离子反应第二课时 (2)ppt课件
合集下载
离子反应第二课时 ppt课件

离子反应第二课时
离子方程式的书写步骤:写、拆、删、查
(1)写:写出正确的化学方程式。
BaCl2 + Na2SO4
BaSO4↓+ 2NaCl
(2)拆:把易溶于水、易电离的物质写成离子形式, 把难溶的物质、气体和水等仍写成化学式。
Ba2++2Cl-+2Na++SO42-
BaSO4↓+2Na++2Cl-
1、离子反应 ——有离子参加的反应
实验
1.向盛有2mlNa2SO4溶液的 试管里加入2ml稀KCl溶液
2.向盛有2mlNa2SO4溶液的 试管里加入2mlBaCl2溶液
现象
没有明显变化 产生白色沉淀
离子反应第二课时
实验一
+ Na2SO4
KCl
+ 2Na+ SO42-
K+ Cl-
实验二
+ Na2SO4
• “太阳当空照,花儿对我笑,小鸟说早中, 蜀军由于误饮哑泉水、个个不能言语, 生命危在旦夕,巧遇老叟,指点迷津— —饮用万安溪安乐泉水、终于转危为安, 渡过难关,哑泉水为何能致哑,万安溪 安乐泉水又是什么灵丹妙药呢?
离子反应第二课时
二.离子反应及其发生的条件
离子反应第二课时
离子反应第二课时
第二章 化学物质及其变化 第二节 离子反应
第二课时 离子反应发生的条件
离子反应第二课时
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
[探究]
反应
离子方程式的书写步骤:写、拆、删、查
(1)写:写出正确的化学方程式。
BaCl2 + Na2SO4
BaSO4↓+ 2NaCl
(2)拆:把易溶于水、易电离的物质写成离子形式, 把难溶的物质、气体和水等仍写成化学式。
Ba2++2Cl-+2Na++SO42-
BaSO4↓+2Na++2Cl-
1、离子反应 ——有离子参加的反应
实验
1.向盛有2mlNa2SO4溶液的 试管里加入2ml稀KCl溶液
2.向盛有2mlNa2SO4溶液的 试管里加入2mlBaCl2溶液
现象
没有明显变化 产生白色沉淀
离子反应第二课时
实验一
+ Na2SO4
KCl
+ 2Na+ SO42-
K+ Cl-
实验二
+ Na2SO4
• “太阳当空照,花儿对我笑,小鸟说早中, 蜀军由于误饮哑泉水、个个不能言语, 生命危在旦夕,巧遇老叟,指点迷津— —饮用万安溪安乐泉水、终于转危为安, 渡过难关,哑泉水为何能致哑,万安溪 安乐泉水又是什么灵丹妙药呢?
离子反应第二课时
二.离子反应及其发生的条件
离子反应第二课时
离子反应第二课时
第二章 化学物质及其变化 第二节 离子反应
第二课时 离子反应发生的条件
离子反应第二课时
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
[探究]
反应
第二章化学物质及其变化第二节离子反应(第二课时)课件-河南省三门峡市第一高级中学高中化学必修一

H++OH-=H2O?
▪ 1.Cu(OH)2+HCl
Cu(OH)2+2H+=Cu2++2H2O
▪ 2.CH3COOH+NaOH
CH3COOH+OH-=CH3COO-+H2O
▪ 3.HCl+NH3.H2O
H++NH3.H2O=NH4++H2O
LOGO
讨论总结
1、 H+ + OH- = H2O
表示强酸和强碱反应生成可溶性盐的一类反应。
LOGO
3.(删): 删去方程式两边形式相同的离子:
2Ag++2NO3-+Cu2++2Cl- = 2AgCl↓+Cu2++2NO3-
4.(查): 整理方程式并检查两边各元素 的原子个数和电荷总数是否相等:
2Ag+ + 2Cl- = 2AgCl↓
Ag+ + Cl- = AgCl↓
LOGO
4、离子反应方程式书写规则
OH-+H+=H2O
பைடு நூலகம்
LOGO
练习:完成下列反应的离子方程式。
1、盐酸与氢氧化钠溶液反应。 2、硝酸与氢氧化钠溶液反应。 3、硫酸与氢氧化钡溶液反应。 4、盐酸与硝酸银溶液反应。 5、氯化钠与硝酸银溶液反应。 6、氢氧化钡与硫酸钠溶液反应。 7、氢氧化钡与硫酸铜溶液反应。
LOGO
思考
下列酸碱中和反应的离子方程式都可以写成
如何正确书写离子方程式?
LOGO
1、(写): 正确写出化学方程式:
例:2AgNO3 + CuCl2 = 2AgCl↓+ Cu(NO3)2 2.(拆): 把易溶于水、易电离的物质写成离 子形式,难溶或难电离的物质以及气体等仍 用化学式表示。
▪ 1.Cu(OH)2+HCl
Cu(OH)2+2H+=Cu2++2H2O
▪ 2.CH3COOH+NaOH
CH3COOH+OH-=CH3COO-+H2O
▪ 3.HCl+NH3.H2O
H++NH3.H2O=NH4++H2O
LOGO
讨论总结
1、 H+ + OH- = H2O
表示强酸和强碱反应生成可溶性盐的一类反应。
LOGO
3.(删): 删去方程式两边形式相同的离子:
2Ag++2NO3-+Cu2++2Cl- = 2AgCl↓+Cu2++2NO3-
4.(查): 整理方程式并检查两边各元素 的原子个数和电荷总数是否相等:
2Ag+ + 2Cl- = 2AgCl↓
Ag+ + Cl- = AgCl↓
LOGO
4、离子反应方程式书写规则
OH-+H+=H2O
பைடு நூலகம்
LOGO
练习:完成下列反应的离子方程式。
1、盐酸与氢氧化钠溶液反应。 2、硝酸与氢氧化钠溶液反应。 3、硫酸与氢氧化钡溶液反应。 4、盐酸与硝酸银溶液反应。 5、氯化钠与硝酸银溶液反应。 6、氢氧化钡与硫酸钠溶液反应。 7、氢氧化钡与硫酸铜溶液反应。
LOGO
思考
下列酸碱中和反应的离子方程式都可以写成
如何正确书写离子方程式?
LOGO
1、(写): 正确写出化学方程式:
例:2AgNO3 + CuCl2 = 2AgCl↓+ Cu(NO3)2 2.(拆): 把易溶于水、易电离的物质写成离 子形式,难溶或难电离的物质以及气体等仍 用化学式表示。
离子反应及离子方程式ppt课件

(2)NaOH、KOH、Ba(OH)2 NaOH == Na+ + OH-
HNO3 == H+ + NO3-
Ca(OH)2 == Ca2+ + 2OH-
H2SO4 == 2H+ + SO42-
Ba(OH)2 == Ba2+ + 2OH-
(3)Na2SO4、 Fe2(SO4)3、 NH4C1
Na2SO4 == 2Na+ + SO42- ▲酸:电离时生成的阳离子全部是H+的化合物 Fe2(SO4)3 == 2Fe3+ + 3SO42- ▲碱:电离时生成的阴离子全部是OH-的化合物
Na
Na
+
+
Na NO3-
+
HNO3 NaOH NaNO3
+ H+ NO3Na++ OH+ Na+ NO3-
+ H+ OH- H2O
H+
SO42-
H+
H+
SO42-
H+
O- OH-
Na
+ Na +
+
OH-
Na+
Na
+
Na
+
Na
+
Na
+
SO42-
H2SO4 NaOH Na2SO4
+ 2H+ SO42Na++ OH+ 2Na+ SO42-
NH4C1 == NH4+ + C1-
▲盐:电离时能生成金属离子和酸根阴离子的化合物。
包括铵根离子
1.下列电离方程式中,正确的是( )
D
高一【化学(人教版)】离子反应(第二课时)-课件-(含实验视频)

自由移动的 Ba2+和Cl-
蓝色透明 液体
白色沉淀
自由移动 的
Cu2+和Cl-
证据
宏观现象 解释 微观探析
初中语文
问题2 CuSO4溶液和BaCl2溶液混合有什么变化?
化学用语
CuSO4溶液 混合前 CuSO4 = Cu2+ + SO42-
BaCl2溶液 BaCl2 = Ba2+ + 2Cl-
混合后
蓝色透明 液体
无色透明 液体
自由移动的 Cu2+和 SO42-
自由移动的 Ba2+和Cl-
蓝色透明 液体
白色沉淀
自由移动 的
Cu2+和Cl-
初中语文
初中语文
CuSO4 溶液
BaCl2 溶液
混合前
混合后
宏观现象 微观粒子 宏观现象 微观粒子
蓝色透明 液体
无色透明 液体
自由移动的 Cu2+和 SO42-
初中语文
A同学
向Ba(OH)2溶液中加入几滴酚酞溶液,然
后向Ba(OH)2溶液中滴加稀硫酸,观察现象。
混合前两种 溶液中的离子
稀硫酸:H+和 SO42Ba(OH)2溶液:Ba2+和OH-
混合时溶液中 离子的变化
Ba2+和 SO42- 反应生成 BaSO4沉淀 H+和OH-反应生成水
初中语文
初中语文
问题3 CuSO4溶液和BaCl2溶液反应实质是什么?
CuSO4 + BaCl2
Cu2+ SO42-
Ba2+ 2Cl-
CuCl2 + BaSO4↓
Cu2+ 2Cl-
蓝色透明 液体
白色沉淀
自由移动 的
Cu2+和Cl-
证据
宏观现象 解释 微观探析
初中语文
问题2 CuSO4溶液和BaCl2溶液混合有什么变化?
化学用语
CuSO4溶液 混合前 CuSO4 = Cu2+ + SO42-
BaCl2溶液 BaCl2 = Ba2+ + 2Cl-
混合后
蓝色透明 液体
无色透明 液体
自由移动的 Cu2+和 SO42-
自由移动的 Ba2+和Cl-
蓝色透明 液体
白色沉淀
自由移动 的
Cu2+和Cl-
初中语文
初中语文
CuSO4 溶液
BaCl2 溶液
混合前
混合后
宏观现象 微观粒子 宏观现象 微观粒子
蓝色透明 液体
无色透明 液体
自由移动的 Cu2+和 SO42-
初中语文
A同学
向Ba(OH)2溶液中加入几滴酚酞溶液,然
后向Ba(OH)2溶液中滴加稀硫酸,观察现象。
混合前两种 溶液中的离子
稀硫酸:H+和 SO42Ba(OH)2溶液:Ba2+和OH-
混合时溶液中 离子的变化
Ba2+和 SO42- 反应生成 BaSO4沉淀 H+和OH-反应生成水
初中语文
初中语文
问题3 CuSO4溶液和BaCl2溶液反应实质是什么?
CuSO4 + BaCl2
Cu2+ SO42-
Ba2+ 2Cl-
CuCl2 + BaSO4↓
Cu2+ 2Cl-
第二节《离子反应(第二课时)》PPT课件

13
2、附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有色离子。
有色离子: MnO4- (紫红色)、Fe3+ (黄色)、 Fe2+ (浅绿色)、 Cu2+(蓝色)
⑵强碱性溶液中肯定不存在与OH-反应的离子。
隐含:PH 〉7,能使酚酞试液变红、能使石蕊变蓝
大量OH-
⑶强酸性溶液中肯定不存在与H+反应的离子。 隐含:PH 〈 7 ,能使石蕊变红,存在大量H+
C、铝和硝酸铜溶液反应
Al+Cu2+=Al3++Cu
D、碳酸钠和稀硫酸反应
CO32-+2H+=CO2↑+H2O
11
三、离子共存问题:
原则:同一溶液中若离子间符合下列任意一个条件就 会发生离子反应,离子之间便不能在溶液中大量共存。
1、不能大量共存的情况
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等
⑵生成气体或挥发性物质:
如:H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3NH4+与OH-
12
⑶生成难电离(弱电解质)物质:
如:H+与Ac-、CO32-、S2-、SO32-、SiO32-ClO3等生成弱酸;
OH-与NH4+生成的弱碱; H+与OH-生成水
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等) 与还原性离子(如S2-、I-、Fe2+、SO32-等) 不能大量共存。
· (3)生成难电离的物质(弱电解质) :如水、NH3 H2O等。 2
2、附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有色离子。
有色离子: MnO4- (紫红色)、Fe3+ (黄色)、 Fe2+ (浅绿色)、 Cu2+(蓝色)
⑵强碱性溶液中肯定不存在与OH-反应的离子。
隐含:PH 〉7,能使酚酞试液变红、能使石蕊变蓝
大量OH-
⑶强酸性溶液中肯定不存在与H+反应的离子。 隐含:PH 〈 7 ,能使石蕊变红,存在大量H+
C、铝和硝酸铜溶液反应
Al+Cu2+=Al3++Cu
D、碳酸钠和稀硫酸反应
CO32-+2H+=CO2↑+H2O
11
三、离子共存问题:
原则:同一溶液中若离子间符合下列任意一个条件就 会发生离子反应,离子之间便不能在溶液中大量共存。
1、不能大量共存的情况
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等
⑵生成气体或挥发性物质:
如:H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3NH4+与OH-
12
⑶生成难电离(弱电解质)物质:
如:H+与Ac-、CO32-、S2-、SO32-、SiO32-ClO3等生成弱酸;
OH-与NH4+生成的弱碱; H+与OH-生成水
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等) 与还原性离子(如S2-、I-、Fe2+、SO32-等) 不能大量共存。
· (3)生成难电离的物质(弱电解质) :如水、NH3 H2O等。 2
第二节离子反应要的离子方程式的写法PPT课件
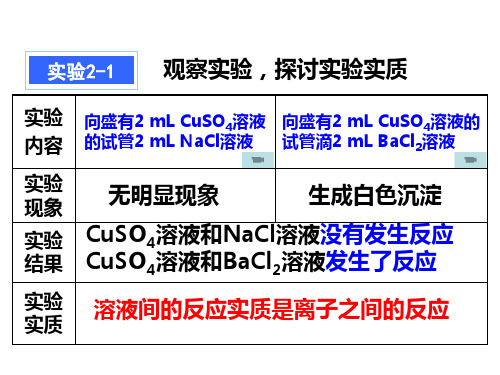
实验2-1 观察实验,探讨实验实质
实验 向盛有2 mL CuSO4溶液 向盛有2 mL CuSO4溶液的 内容 的试管2 mL NaCl溶液 试管滴2 mL BaCl2溶液
实验 现象
无明显现象
生成白色沉淀
实验 CuSO4溶液和NaCl溶液没有发生反应 结果 CuSO4溶液和BaCl2溶液发生了反应
实验 实质
随堂练习
1、写出下列化学方程式和离子方程式
①Na2CO3+HCl ②CuCl2+NaOH
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
深入挖掘:课本34页9
二、离子反应及其发生的条件
1、离子反应的定义 2、离子方程式的书写步骤 3、离子反应发生的条件 4、离子反应的实质
1、课本P34页习题第9题(离子方程式 暂不写)
2、预习课本P31-P32离子方程式及其 书写
复习部分酸、碱、盐的溶解性表及常见的强弱电解质
① HCl + NaOH = NaCl +H2O ② CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaC ③ CuSO4 + Fe = FeSO4 + Cu ④ 2HCl+ CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
溶液间的反应实质是离子之间的反应
实验 向盛有2 mL CuSO4溶液 向盛有2 mL CuSO4溶液的 内容 的试管2 mL NaCl溶液 试管滴2 mL BaCl2溶液
实验 现象
无明显现象
生成白色沉淀
实验 CuSO4溶液和NaCl溶液没有发生反应 结果 CuSO4溶液和BaCl2溶液发生了反应
实验 实质
随堂练习
1、写出下列化学方程式和离子方程式
①Na2CO3+HCl ②CuCl2+NaOH
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
深入挖掘:课本34页9
二、离子反应及其发生的条件
1、离子反应的定义 2、离子方程式的书写步骤 3、离子反应发生的条件 4、离子反应的实质
1、课本P34页习题第9题(离子方程式 暂不写)
2、预习课本P31-P32离子方程式及其 书写
复习部分酸、碱、盐的溶解性表及常见的强弱电解质
① HCl + NaOH = NaCl +H2O ② CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaC ③ CuSO4 + Fe = FeSO4 + Cu ④ 2HCl+ CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
溶液间的反应实质是离子之间的反应
离子共存ppt课件

确定除杂试剂的步骤:
(1)找出杂质离子: Mg2+ 、Ca2+ 、SO42(2)写出配对离子:OH-、CO32- 、Ba2+ (3)从原物质NaCl中找出非杂质离子组成除杂试剂: NaOH溶液、Na2CO3溶液、BaCl₂溶液
离子反应的应用
(二)除杂问题
问题2、整个过程用到的除杂试剂包括NaOH溶液、Na2CO3溶液、BaCl2溶液和
稀盐酸,则各试剂的添加顺序是怎样的? (所加除杂试剂均过量)
NaCl
过量 滤渣:Mg(OH)2 BaCl2+Na2SO4=BaSO4↓+2NaCl
CaCl2 NaOH溶液 Na2SO4 ①过滤 MgCl2
滤液:
NaCl 过量 CaCl2 BaCl2 溶液 Na2SO4 ②过滤 NaOH
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
“透明”也可“有色”
随堂测试
1.在PH=1的无色溶液中可以大量共存的离子组为( B )
A.Na+、Cl- 、OH- 、 A13+ C.K+ 、 MnO4- 、Na+、SO42-
B. NH4+ 、Mg2+ 、NO3- 、ClD. SO32-、K+、H+ 、Cl-
2.下列各组离子中,在碱性溶液中能大量共存,并且溶液为无色透明的是( B )
Ba2+ + SO42- == BaSO4↓
关键1:使杂质离子变成沉淀、水或者气体 关键2:不引入其它无关离子
离子反应的应用(三)物质鉴别
H+(溶液中): ①紫色石蕊试液、pH试纸;②加入铁粉,固体溶解,有气泡产生,溶液变为
浅绿色;③加入碳酸钠或碳酸钙,产生能使澄清石灰水变浑浊的气体。
(1)找出杂质离子: Mg2+ 、Ca2+ 、SO42(2)写出配对离子:OH-、CO32- 、Ba2+ (3)从原物质NaCl中找出非杂质离子组成除杂试剂: NaOH溶液、Na2CO3溶液、BaCl₂溶液
离子反应的应用
(二)除杂问题
问题2、整个过程用到的除杂试剂包括NaOH溶液、Na2CO3溶液、BaCl2溶液和
稀盐酸,则各试剂的添加顺序是怎样的? (所加除杂试剂均过量)
NaCl
过量 滤渣:Mg(OH)2 BaCl2+Na2SO4=BaSO4↓+2NaCl
CaCl2 NaOH溶液 Na2SO4 ①过滤 MgCl2
滤液:
NaCl 过量 CaCl2 BaCl2 溶液 Na2SO4 ②过滤 NaOH
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
“透明”也可“有色”
随堂测试
1.在PH=1的无色溶液中可以大量共存的离子组为( B )
A.Na+、Cl- 、OH- 、 A13+ C.K+ 、 MnO4- 、Na+、SO42-
B. NH4+ 、Mg2+ 、NO3- 、ClD. SO32-、K+、H+ 、Cl-
2.下列各组离子中,在碱性溶液中能大量共存,并且溶液为无色透明的是( B )
Ba2+ + SO42- == BaSO4↓
关键1:使杂质离子变成沉淀、水或者气体 关键2:不引入其它无关离子
离子反应的应用(三)物质鉴别
H+(溶液中): ①紫色石蕊试液、pH试纸;②加入铁粉,固体溶解,有气泡产生,溶液变为
浅绿色;③加入碳酸钠或碳酸钙,产生能使澄清石灰水变浑浊的气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.写出化学反应方程式
CuSO4+BaCl2==CuCl2+BaSO4↓
2.把易溶于水且易电离的物质拆成离子形式
Cu2++SO42++Ba2++2Cl-==Cu2++2Cl-+BaSO4↓
3.删去方程式两边不参加反应的离子
C\u2++SO42++Ba2++2\Cl-==\Cu2++2\Cl-+BaSO4↓
(4)查—— 3H Al (OH )3 Al 3 3H 2O 正确
15
注意:
⑴凡在非溶液中进行的反应一般不能写离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热 2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O
(2)对于易电离的微溶物:
澄清状态: 写离子符号
4.整理方程式并检查两边各元素的原子个数 和电荷总数是否相等
Ba2++SO42+==BaSO4↓
11
小结:离子方程式的书写步骤
1.“写”——写化学方程式 2.“拆”——把易溶于水且易电离的物质写成离子形式.
3.“删”——删去两边没有参加反应的离子
4.“查”——检查方程式两边各元素种类、原子个数 和电荷总数是否守恒
12
要改写成离子符号的物质:
强酸:H2SO4、HCl、HNO3等; 强碱:NaOH、KOH、Ba(OH)2等; 可溶性的盐:钾、钠、铵盐;硝酸盐等。
13
需要保留化学式的物质:
单质 氧化物
气体:CO2 弱电解质:
NH3 H2… 弱酸:HF、H2S、HClO、 H弱2碱SO:3等NH3·H2O等
H2O
反应物
易电离的
浑浊状态: 写化学式
微溶物
生成物:写化学式
16
(3)弱酸的酸式盐的酸根离子不能拆开写。 例如:NaHCO3 == Na++HCO3-
常见酸式根中,只有硫酸氢根能够拆 HSO4- == H+ + SO42-
17
课后习题
课本 P34 2、6、9 练习册,P25 同步检测2
题1、2、3、4、8
难溶性酸碱盐:AgCl 、 Fe(OH)3 、 H2SiO3 14
盐酸与氢氧化铝的反应
(1)写—— 3HCl Al (OH )3 AlCl3 3H 2O
(2)拆—— 3H 3Cl Al (OH )3 Al 3 3Cl 3H 2O
(3)删—— 3H Al (OH )3 Al 3 3H 2O
CuSO4==Cu2++SO42NaCl== Na++Cl-
BaCl2== Ba 2++2Cl-
3
4
实验
现象
原因分析
1.向盛有2mlCuSO4 溶液的试管中加入
1.溶液颜色变浅,但
2mlNaCl溶液。 依然为蓝色
1.产生白色沉淀
2.向盛有2mlCuSO4 2.上层溶液为蓝色
溶液的试管中加入 2mlBaCl2溶液。
1
旧课回顾
强酸:例,HCl、HNO3、H2SO4等
混合物
物质
单质
强电解质
强碱:例,KOH、NaOH、Ca(OH)2、 Ba(OH)2等
纯净物
电解质
多数盐:例,NaCl、NaNO3、BaSO4等 弱酸:例,H3PO4、 CH3COOH
化合物
弱电解质
H2CO3等
弱碱:例,NH3•H2O等
水
非电解质
2
请写出下列物质在水溶液中的电离方 程式:CuSO4、NaCl、 BaCl2
5
6
7
实验
现象
Hale Waihona Puke 原因分析1.向盛有 2mlCuSO4溶液的 试管中加入 2mlNaCl溶液。
1.溶液颜色变浅, 但依然为蓝色
混合前后Na+、 SO42-、Cu2+、Cl- 四 种离子均没有发生变 化
2.向盛有 2mlCuSO4溶液的 试管中加入 2mlBaCl2溶液。
1.产生白色沉淀 2.溶液仍为蓝色
18
混合后SO42-与Ba2+ 结合为难溶的BaSO4, 而Cu2+和Cl-依然大 量存在于溶液中
8
离子反应:离子之间的反应 离子方程式:用实际参加反应的离子符号来
表示反应的式子 。 CuSO4与BaCl2的反应的实质是 Ba2++SO42-=BaSO4↓
9
• 怎样正确书写离子方程式?
10
以CuSO4溶液和BaCl2溶液反应为例
