32_水的电离和溶液的PH(20201126050550)
水的电离与溶液的酸碱性

注意:
(1)水的离子积只随温度的改变而改变。 (2)Kw 不仅适用于纯水,也适用于酸碱 盐的稀溶液。 KW =c(H+)·c (OH-)
H2O
H+ + OH-
常温下对纯水进行下列操作:
条件
酸碱性
水的电离平 衡移动方向
c(H+)
c(OH-)
c(H+)c(OH-)浓 度大小关系
Kw
加热
中性
正向 增大 增大 c(H+)=c(OH-) 增大
水的电离和溶液的酸碱性
一、水的电离
H2O + H2O
简写为:H2O
H3O+ + OH-
水合氢离子
H+ + OH-
(水电离出的H+、OH-浓度相等)
水是极弱的电解质
25℃ 时,1L水中只 有10-7m生ol电H2离O分子发
1、水的离子积常数
H2O
H+ + OH-
c(H+)×c(OH-)
K 电离= c(H2O)
K .c(H2O) = c ( H+) .c( OH-) Kw = c ( H+) .c( OH-)
其中常数K与常数c(H2O)的积记为 Kw,称为水的离子积常数,简称水的为 离子积。
常温下(25℃)时, 水电离出来的KW =c(H+)·c(OH-) =1× 10-14
年,这给
【思考与交流】
1.酸性溶液中是否存在OH-? 碱性溶液中是否存在H+?为什么?
2.溶液的酸碱性是由什么决定的?
3.溶液中的c(H+)与c(OH-)怎样换算?
溶液中的c(H+) 和c(OH-)
《水的电离和溶液的 pH》 讲义

《水的电离和溶液的 pH》讲义一、水的电离水是一种极弱的电解质,能发生微弱的电离。
我们可以用一个简单的式子来表示水的电离过程:H₂O ⇌ H⁺+OH⁻。
在一定温度下,水的电离达到平衡状态时,电离出的氢离子浓度和氢氧根离子浓度的乘积是一个常数,这个常数被称为水的离子积常数,通常用 Kw 表示。
例如,在 25℃时,Kw = 10×10⁻¹⁴。
这意味着在 25℃的纯水中,氢离子浓度和氢氧根离子浓度均为 10×10⁻⁷ mol/L 。
需要注意的是,水的离子积常数 Kw 只与温度有关,温度升高,Kw 增大。
比如,在 100℃时,Kw = 10×10⁻¹²。
影响水的电离平衡的因素主要有温度、外加酸或碱等。
升高温度会促进水的电离,因为电离过程是吸热的。
而外加酸或碱会抑制水的电离。
加入酸时,酸会电离出大量的氢离子,使溶液中的氢离子浓度增大,从而抑制水的电离;加入碱时,碱会电离出大量的氢氧根离子,使溶液中的氢氧根离子浓度增大,同样抑制水的电离。
二、溶液的 pH为了方便表示溶液的酸碱性,我们引入了 pH 的概念。
溶液的 pH 是指氢离子浓度的负对数,即 pH = lgH⁺。
例如,如果某溶液中氢离子浓度为 10×10⁻⁵ mol/L ,那么该溶液的pH = lg(10×10⁻⁵) = 5 。
同样,如果知道了溶液的 pH ,也可以计算出氢离子浓度。
比如,pH 为 3 的溶液,氢离子浓度为 10×10⁻³ mol/L 。
在常温下(25℃),溶液的酸碱性与 pH 的关系如下:pH < 7 时,溶液呈酸性;pH = 7 时,溶液呈中性;pH > 7 时,溶液呈碱性。
但需要注意的是,温度变化时,这个标准会有所不同。
比如在100℃时,pH = 6 时溶液呈中性。
对于强酸溶液,若其物质的量浓度为 c(mol/L),则氢离子浓度为c(mol/L),pH = lgc 。
水的电离和溶液的酸碱性 课件

③两强碱稀溶液混合后的pH
c→ c混 (OH-) → c混 (H+) → pH
例:pH=12和pH=9的两种NaOH溶液等体积混合,求 混合溶液的pH值。
解: c混 (H+) =
≈
1×10-12 + 1×10-9
2
1 2
×10-9
mol/L
mol/L
pH=-lg
10-9 2
=9+lg2 =9.3
④强酸与强碱混合液的pH
• 完全中和时,pH值不一定为7 • 强酸和弱碱完全中和反应时溶液显酸性 • 强碱和弱酸完全中和反应时溶液显碱性
例题1:用0.1032mol/L的HCl溶液滴定25.00mL未知浓 度的NaOH溶液,滴定完成时,用去HCl溶液 27.84mL。通过中和滴定测得NaOH溶液的物质的量 浓度是多少?
解: NaOH + c (NaOH)
3、影响水电离的因素
不同温度下水的离子积常数
t/℃
0
10 20 25 40 50 90 100
KW/10-14 0.134
学科网
0.292 0.681
1.01 2.92
5.47 38.0 55.0
(1)升高温度,促进水的电离,KW增大。 在室温下,Kw值为1×Байду номын сангаас0-14 通常100 ℃ 时,KW=1×10-12
9×10-4mol 0.2L
=4.5×10-3 mol/L
pH=-lg(4.5×10-3 ) =3-lg4.5
例3:pH=3盐酸和pH=13的NaOH溶液等体积混合,求混 合后溶液的pH值。 在1L盐酸中: n (H+) =1×10-3 mol
在1L NaOH溶液中:
n (OH-) =1×10-1mol
水的电离及溶液的pH
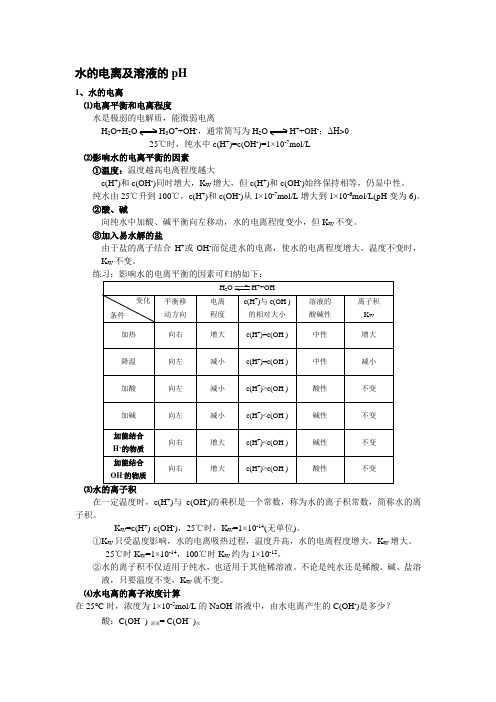
水的电离及溶液的pH1、水的电离⑴电离平衡和电离程度 水是极弱的电解质,能微弱电离H 2O+H 2O H 3O ++OH -,通常简写为H 2O H ++OH -;ΔH >025℃时,纯水中c(H +)=c(OH -)=1×10-7mol/L⑵影响水的电离平衡的因素①温度:温度越高电离程度越大c(H +)和c(OH -)同时增大,K W 增大,但c(H +)和c(OH -)始终保持相等,仍显中性。
纯水由25℃升到100℃,c(H +)和c(OH -)从1×10-7mol/L 增大到1×10-6mol/L(pH 变为6)。
②酸、碱向纯水中加酸、碱平衡向左移动,水的电离程度变小,但K W 不变。
③加入易水解的盐由于盐的离子结合H +或OH -而促进水的电离,使水的电离程度增大。
温度不变时,K W 不变。
练习:影响水的电离平衡的因素可归纳如下:H 2O H ++OH -平衡移 动方向 电离 程度 c(H +)与c(OH -)的相对大小 溶液的 酸碱性 离子积 K W 加热向右增大c(H +)=c(OH -) 中性 增大 降温 向左 减小c(H +)=c(OH -) 中性 减小 加酸 向左 减小c(H +)>c(OH -) 酸性不变加碱 向左 减小 c(H +)<c(OH -) 碱性 不变 加能结合 H +的物质 向右 增大c(H +)<c(OH -) 碱性 不变 加能结合 OH -的物质向右 增大c(H +)>c(OH -)酸性不变⑶水的离子积在一定温度时,c(H +)与c(OH -)的乘积是一个常数,称为水的离子积常数,简称水的离子积。
K W =c(H +)·c(OH -),25℃时,K W =1×10-14(无单位)。
①K W 只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K W 增大。
25℃时K W =1×10-14,100℃时K W 约为1×10-12。
水的电离和溶液的酸碱性 ppt课件

B 9 ×10-9
C 1×10-8
D 1×10-8
☆无论在什么样的水溶液中,
c (H+)水= c(OH-) 水
水的电离和溶液的酸碱性
11
计算题:
(1.)在0.1mol.L-1的HCl溶液中, c(OH-)= ? , c(H+)=? ,由水电离出的 c(OH-)水=? , c(H+)水=?
(2.)在0.1mol.L-1的NaOH溶液中, c(OH-)= ? , c(H+)=? ,由水电离出的 c(OH-)水=? , c(H+)水=?
说明:在没有特别说明的时候,水的
离子积均指的 是25℃时的数值
水的电离和溶液的酸碱性
12
溶液的酸碱性:
*实质:溶液中c(OH-),c(H+)的相对大
小
*依据:c (H+)= c(OH-) 溶液显中性 c (H+)> c(OH-) 溶液显酸性 c (H+)< c(OH-) 溶液显碱性
水的电离和溶液的酸碱性
13
在25℃时溶液的酸碱性
*c (H+)= c(OH-) =10-7mol-1溶液显中 性 * c (H+)> c(OH-)且 c (H+)> 10-7mol-1 溶液显酸性 *c(OH-) > c (H+)且c (OH-)>10-7mol-1 溶液显碱性
水的电离和溶液的酸碱性
14
练习题:
1.在下列溶液中,一定是酸溶液的 为
A 含有H+的溶液
B 常温下KW =1×10-14的溶液
C c (H+)> c(OH-)的溶液
水的电离和溶液的酸碱性
水的电离和溶液的PH ppt课件

①溶液呈酸性: c(H+)>10-7 ,pH<7 ②溶液呈中性: c(H+)= 10-7 ,pH= 7 ③溶液呈碱性: c(H+)<10-7 ,pH>7
①pH越小,溶液酸性越强;pH越大,溶液碱性越强。(pH的范围通常是 0~14) ②当c(H+)或c(OH-)<1 mol/L时用pH表示酸碱性比较方便。 ③当c(H+)或c(OH-)≧1 mol/L时直接用它们的浓度表示酸碱性。
常温下,浓度为0.01 mol·L-1的NaOH溶液中,由水电离的c(H+)和c(OH-)各是多少?
NaOH === Na+ + OH(1) c(H+) c总(H+) = c水(H+)
(2) c(OH-) c总(OH-)= c碱(OH-) + c水(OH-) ≈ c碱(OH-) = 0.01 mol·L-1
Kw的应用 总结归纳 (1)酸溶液中Kw=c酸(H+)·c水(OH-) (忽略水电离出的H+的浓度)。 (2)碱溶液中Kw=c水(H+)·c碱(OH-) (忽略水电离出的OH-的浓度)。 (3)由水电离出的c(H+)与水电离出的c(OH-)一定相等。
溶液的酸碱性与PH
如何判断溶液酸碱性?
溶液的酸碱性 思考与讨论 根据常温时水的电离平衡,运用平衡移动原理分析下列问题。
作物 水稻 玉米 棉花 大豆 小麦
pH 5.5~7.0 6.5~7.5 6.0~6.8 6.5~7.5 6.2~7.5
作物 洋葱 西瓜 柑橘 茶树 水仙花
pH 6.0~7.0 6.0~7.0 5.0~7.0 5.0~5.5 6.0~6.5
PH的测试和调控的意义
4.在环保领域,酸性或碱性废水的处 理常常利用中和反应,在中和处理的 过程中可用pH自动测定仪进行监测和 控制。
3.2.1水的电离和溶液的pH课件高二上学期化学人教版选择性必修1

在 H2O H+ + OH —平衡中,加入
( 酸或强酸的酸式盐如NaHSO4
),
增大c(H+),则平衡向 左 移动,水的电离
程度 减小 ,水的电离被 抑制 ,由于水的电离
平衡仍然存在,温度不改变,Kw 不变 ,则 c(OH —)必然会 减小 。
c(H+) > c(OH —),溶液显 酸 性。 说明:
就是任何水溶液中都是H+、OH-共存的25℃, 任何水溶液中都存在Kw=c(H+) . c(OH-) =10-14
Kw适用于一定温度下任何稀的电解质溶液
平衡是 否移动
c(H+)
c(OH-)
c(H+)与c(OH-) 大小
Kw
NaOH 抑制 减小 增大 c(H+)<c(OH-) 不变
HCl 抑制 增大 减小 c(H+)>c(OH-) 不变
练习5(25℃) :
1、0.1 mol/L的NaOH溶液中,c(OH—) = 0.1 mol/L ,c(H+) = 1×10—13 mol/L; 由水电离出的H+和OH—浓度c(H+)水 = 1×10—13 mol/L,c(OH—)水= 1×10—13 mo。l/L
2、的H2SO4溶液中,c(H+)
解: C(H+)= C(HCl)=1×10-3 mol/L 由Kw = C(H+)·C(OH-),得
C(OH-)=
Kw C(H+)
=
1×10-14 1×10-3 mol/l
= 1×10-11 mol/l
(2)0.05mol/LBa(OH)2溶液 解:C(0H-)= 2C[Ba(OH)2 mol/L
水的电离和溶液的酸碱性 课件

对水电离 平衡的影
响
c(H+) mol/L
c(OH-) mol/L
c(H+)与c(OH-) 比较
溶液 酸碱性
纯水
无
=10-7 =10-7 c(H+)=c(OH-) 中性
HCl
左移 >10-7 <10-7 c(H+)>c(OH-) 酸性
NaOH
左移 <10-7 >10-7 c(H+)<c(OH-) 碱性
增大 增大 c(H+)=c(OH-) 增大 增大 减小 c(H+)>c(OH-) 不变 减小 增大 c(H+)<c(OH-) 不变
(2)加入酸或碱,抑制水的电离,Kw不变。
水的电离
水的离子积: KW = c(OH -)·c(H+) ( 25℃时,KW = 1.0 ×10 -14 )
温度: T ↑, KW ↑ 影响因素 酸: 抑制水的电离, KW不变
如果温度变化Kw会如何变化?为什么?
温度 0℃
20℃
25℃
50℃
100℃
Kw 1.14×10-15 6.81×10-15 1×10-14 5.47×10-14 1×10-12
2. 影响水的电离平衡的因素
H2O
H+ + OH- 水的电离吸热
升高温度: c(H+)=c(OH-)
平衡向 右 移动, c(H+ )增大 ,c(OH-)增大 , Kw增大
溶液的酸碱性由 溶液中H+、OH-浓度相对大小决定
常温25℃ 酸性:c(H+) >c(OH-) c(H+)>10-7mol/L
水的电离和溶液的酸碱性ppt课件

K电离 =
c(H+) ·c(OH-)
水的离子积
Kw =
室温下 1×10-14
注:c(H2O)=
1000 g 18 g·mol-1
1L
影响水的电离平衡的因素 分析表格中的数据,有何规律,并解释之。
t/℃
0
10
20
25
40
50
90
100
Kw/×10-14
0.134
0.292
0.681
1.01
2.92
5.47
碱性! c(H+) = 1×10—7mol/L、 c(OH-) = 1×10—5mol/L, C(OH-) > c(H+)
不能用c(H+) 等于多少来判断溶液酸、碱性,只 能通过c(H+) 、C(OH-) 两者相对大小比较
pH值测定方法
定性测定:酸碱指示剂法(书P51阅读)
定量测定:pH试纸法
精
密
常温下
溶液的酸碱性
c(H+) 和 c(OH-) 的关系
酸性 中性 碱性
c(H+) > c(OH-) c(H+) = c(OH-) c(H+) < c(OH-)
pH=7的溶液一定是中性溶液吗?(以100℃ 为例) 答:不一定,只有在常温下才显中性。 100℃时显碱性
pH <7 =7 >7
c(H+)与pH、溶液酸碱性的关系: 常温下
38.0w=1×10-14,100℃时Kw=1×10-12。Kw在一定温度下是个常数。
水的电离是一个吸热过程。 升高温度,促进水的电离。
影响水的电离平衡的因素
H2O
H+ +OH-
讨论:
水的电离和溶液的PH.ppt

➢溶液的酸碱性---正误判断 1、如果C(H+)不等于C(OH-)则溶液一定呈现酸碱性。 2、在水中加酸会抑制水的电离,电离度减小。 3、如果C(H+)/C(OH-)的值越大则酸性越强。 4、任何水溶液中都有C(H+)和C(OH-)。 5、C(H+)等于10-6mol/L的溶液一定呈现酸性。 6、电离度越大的酸溶液则酸性越强。 7、对水升高温度电离度增大,酸性增强。
PH 0
100 C(H+)
1
10-1
2
10-2
溶
3
10-3
酸
4
10-4
液 的
pH 值
性
5
10-5
增 碱强 性 增
6 7 8 9 10 11
10-6 10-7 10-8 10-9 10-10 10-11
强 12
10-12
13
10-13
14
10-14
➢溶液的pH值--正误判断 1、一定条件下 pH值越大,溶液的酸性越强。 2、用pH值表示任何溶液的酸碱性都很方便。 3、强酸溶液的pH值一定大。 4、pH值等于6是一个弱酸体系。 5、pH值有可能等于负值。 6、pH值相同的强酸和弱酸中C(H+)相同摩尔浓度相同。
D、10:1
例5、常温下,某溶液中由水电离的c(H+)=1×10-13
mol/L,该溶液可能是( B )
①二氧化硫水溶液 ②氯化钠水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
水的电离和溶液的酸碱性 课件

• 1.溶液的酸碱性与c(H+)和c(OH-)的关系 • 溶 液 的 酸 碱 性 取 决 于 c(H + ) 和 c(OH - )
的 相对大小 。
• (1)酸性溶液:c(H+) > c(OH-) • (2)中性溶液:c(H+) = c(OH-) • (3)碱性溶液:c(H+) < c(OH-)
c(H+)与 c(OH-)的相
对大小
溶液 的pH
酸性
c(H+) >c(OH-)
<7
碱性
c(H+) <c(OH-)
>7
中性
c(H+)= c(OH-)
=7
常温下
cH+ cOH- mol·L-1 mol·L-1 KW
备注
>10-7 <10-7 =10-7
<10-7 >10-7 10-7
pH越
小,酸
1× 10-14
• 2.溶液酸碱性与pH
• (1)pH
• ①定义:用 c(H+)的负对数
表示溶液酸碱性的强弱。
• ②表达式:pH= -lgc(H+)
。
• ③意义:pH越大,溶液碱性越 强 ,每增大1个单位,
c(OH-)变为原来的 倍;10pH越小,酸性越 , 每减强小1个单位,c(H+)变为原来的 倍。 10
• ④适用范围:1×10-14 mol/L≤c(H+)≤1×100 mol/L 的溶液。
水的电离、溶液酸碱性与pH
• 1.水的电离
• 水是一种极弱的电解质。电离方程式为:
H2O+H2O H3O++OH- ,也可简写为:H2O
水的电离与溶液的酸碱性

水的电离和溶液的Ph一、水的电离1.电离方程式 :H2O OH - + H + 或 H 3O OH - + H 3O+ 任何情况下水电离的H +和OH -浓度都相等2.影响水的电离因素:温度、外加酸碱、易水解的盐。
3.水的离子积 25℃时,Kw = C (H +)×C (OH —) =10-7×10-7=10-14注意:1、Kw 只与温度有关,;2、适用范围水和所有水溶液例如100℃,1LH 2O 有10-6mol 电离,此时水的离子积常数为Kw=10-12二、溶液的pH1. 溶液的酸碱性,取决于溶液中C (H+) 、 C (OH —) 的相对大小:溶液酸碱性 C (H +)与c(OH —)关系任意温度 室温(mol/L ) pH 值(室温)酸性 C (H +)>c(OH —) C (H +)> 1×10—7 <7中性 C (H +)=c(OH —) C (H +)=c(OH —)=1×10—7 =7碱性 C (H +)<c(OH —) C (H +)< 1×10—7 >72、pH 的计算: pH=-lgc(H +) C (H+)=10-ph pH 值的大小取决于溶液中的 大小, pH+ pOH =14 pOH=-lgKw -pH=pKw -pH ,三、溶液的pH 测定方法:(指示剂法、pH 试纸法)1、指示剂法:定性测定溶液的酸碱性2、pH 试纸(定量测定)(1)、成分:含有多种指示剂(2)颜色:淡黄色(3)操作:用玻璃棒蘸取待测液,抹到试纸上,半分钟之内与标准比色卡对照。
四、有关pH 的计算1、单一强酸强碱溶液的ph :(1)强酸溶液,如HnA ,浓度为Cmol/L ,则c(H +)= ,ph= 。
(2)强碱溶液,如B(OH)n 浓度为Cmol/L 则c(H +)= ,ph= 。
Kw方法总结:C 酸—c(H +)—ph ;C 碱—c(OH —)——c(H +)—ph 。
(高中化学58个精讲)32水的电离和溶液的PH.docx

高中化学58个考点精讲32、水的电离和溶液的PH1.复习重点1.通过对水的电离、离子积、pH定义等重要知识和方法迁移应用的练习,提高认知能力;2.灵活解答水的电离平衡的相关问题;3.学握混合溶液pH计算的方法,并能运用数学工具解决一些有关pH计算的综合问题4.培养学习过程中探究、总结的习惯。
2.难点聚焦(一)溶液的酸碱性及pH的值溶液呈的酸碱性何性,取决于溶液中[H1]. [0H ]的相对大小:pH值的大小取决于溶液中的[H]大+], pOH=—lgKw=pKw溶液酸碱性[疋]与[OH ]关系任意湿度室温(mol/L)pH值(室温)酸性[H f]>[OH-]田[>1X10—7<7屮性[H*]=[OH ][H+]=[OH"]=1 X 10~7=7碱性[H+]<[OH ][H+]>1X 与10一7>7(1)酸性越强,pH值越小,碱性越强,pH值越人,pH值减小一个单位,[H+]就增大到原來的10倍,pH值减小n个单位,[H]的增人到原来的1011倍.(2)任意水溶液中[H〕H0,但pH nJ为0,此R'J [H'plmol/L, 一般[H‘]> lmol/L 时,pH<0,故直接用[Hj表示.(3)判断溶液呈中性的依据为:[H°F[OIT]或pH=pOH=lpKw只有当室温时,Kw=lX10-14r[H']=[OH_]=10_7mol/L溶液呈屮性JlpH=pOH=£ pKw=7分析原因:H2O亍』H++OH—Q由于水的电离是吸热的,湿度越高,电离程度越人,kw越大.中性:pH=pOH=-pKwT/f Kw/f pH+pOH\T \ f Kw\ f pH=pOH /如:100°C, KW=1X1O~12\ pKw=12.中性时Ph=f pKw=6<7.图示:不同湿度(TAT?)时溶液d'rH+l与[OHT], pH与pOH关系图一想一想:图一与图二有哪些不同?为何不同?图二提示:(①形状 ②T ]、T2相对位置)③ 简平分钱划分的两个区域酸碱性不同。
水的电离和溶液的pH

水的电离和溶液的pH水,这个地球上最常见也最神秘的物质,在化学的世界里有着诸多奇妙的性质。
其中,水的电离以及由此引出的溶液 pH 的概念,对于理解化学反应和物质的性质至关重要。
首先,咱们来聊聊水的电离。
水,虽然看起来安静平和,但在微观层面,它可是个热闹的“小世界”。
水分子(H₂O)会发生微弱的电离,产生氢离子(H⁺)和氢氧根离子(OH⁻)。
这个电离过程可以用一个简单的方程式来表示:H₂O ⇌ H⁺+ OH⁻。
可别小看这个小小的等式,它背后隐藏着许多化学的奥秘。
水的电离是一个动态平衡的过程。
在一定的温度下,水分子电离出的氢离子和氢氧根离子的浓度乘积是一个定值。
比如说,在常温(25℃)时,这个定值就是 10⁻¹⁴ mol²/L²。
这意味着,如果氢离子浓度增加了,氢氧根离子的浓度就会相应地减少,以保持这个乘积不变。
那这个电离平衡会受到哪些因素的影响呢?温度就是一个关键因素。
一般来说,温度升高,水的电离程度会增大,也就是电离出的氢离子和氢氧根离子的浓度都会增加。
这就好像给这个“小世界”加热,让分子们变得更加活跃,更容易发生电离。
接下来,咱们再说说溶液的 pH 。
pH 这个概念,简单来说,就是用来衡量溶液酸碱性强弱的一个指标。
它的定义是:pH = lgH⁺,其中H⁺表示氢离子的浓度。
如果溶液中的氢离子浓度较大,pH 值就较小,溶液呈酸性;反之,如果氢离子浓度较小,pH 值就较大,溶液呈碱性。
当 pH = 7 时,溶液呈中性。
举个例子,假如某种溶液中氢离子浓度为 10⁻⁵ mol/L,那么它的pH 就是 5,这种溶液就是酸性的。
而如果氢离子浓度为 10⁻⁹ mol/L,pH 就是 9,溶液就是碱性的。
pH 在生活和科学研究中都有着广泛的应用。
比如在农业生产中,土壤的 pH 对于农作物的生长至关重要。
不同的农作物对土壤 pH 的要求不同,农民们需要了解土壤的 pH 情况,以便选择合适的肥料和种植方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学58个考点精讲32、水的电离和溶液的PH1.复习重点1 •通过对水的电离、离子积、pH定义等重要知识和方法迁移应用的练习,提高认知能力;2 •灵活解答水的电离平衡的相关问题;3 .掌握混合溶液pH计算的方法,并能运用数学工具解决一些有关pH计算的综合问题4 •培养学习过程中探究、总结的习惯。
2.难点聚焦(一)溶液的酸碱性及pH的值溶液呈的酸碱性何性,取决于溶液中[H+]、[0H —]的相对大小:pH值的大小取决于溶液中的[H+]大小+溶液酸碱性[H +]与[OH —]关系任意湿度室温(mol/L )pH值(室温)酸性[H+] > [OH —]+ —7[H ] > 1X 10V 7中性[H +]=[OH —][H+]=[OH —]=1 X 10—7=7碱性[H+] v [OH —][H+] > 1X与10—7> 7(1)酸性越强,pH值越小,碱性越强,pH值越大,pH值减小一个单位,[H+]就增大到原来的10倍,pH值减小n个单位,[H+]的增大到原来的10n倍•(2)任意水溶液中[H+]工0,但pH可为0,此时[H+]=1mol/L,—般[H+]> 1mol/L时,pH v 0,故直接用[H+]表示.1(3)判断溶液呈中性的依据为:[H0]= [OH —]或pH=pOH= — pKw2只有当室温时,Kw=1 X 10—14+ ——7「[H ]=[OH ]=10 mol/L 溶液呈中性y1pH=pOH= pKw=72分析原因:H2O严』H ++OH —Q由于水的电离是吸热的,湿度越高,电离程度越大,kw越大.1中性:pH=pOH= pKw2T — Kw — pH+pOH \T'T Kw \T pH=pOH /如:100 C, KW=X 10—12.. pKw=12.1 中性时Ph= —pKw=6 v 7.2图示:不同湿度(T1>T2)时溶液中[H+]与[OH —], pH与pOH关系[OH-] Jl碱性区中性pOHi酸性区中性酸性区T2 T1碱性区■[H +T2pH图一想一想:图一与图二有哪些不同?为何不同?提示:(①形状②「、T2相对位置)③简平分钱划分的两个区域酸碱性不同。
建议以关系或考虑,并注意湿度不同时Kw的影响。
)图二[H +]、[OH —]=Kw,和pH+pOH=pKw 两个(4)溶液pH的测定方法:①酸碱指示剂②pH试纸③pH计其中①只传判定pH范围② pH试纸也只能确定在某个值左右(对照标准比色卡),无法精确到小数点后1倍。
另外使用时不能预先润湿试纸。
否则相当于又稀释了待测液,测定结果误差大。
③pH计测定较精确(二)酸碱溶液的稀释前后pH值的变化。
由于强酸或强碱在水中完全电离,加水稀释后不会有溶质进一步电离,故仅仅是体积增大的因素导致酸溶液中的[H+]或碱溶液中的[OH —]减小.弱酸或弱碱由于在水中不完全电离,加水稀释同时,能促使其分子进一步电离,故导致相应[H+]或[OH —]减小的幅度降低。
例如①等物质的量浓度的盐酸和醋酸,氢氧化钠和氨水分别加水稀释。
溶液的pH值变化,图示如下: PH7HAC"_乙HCl1加水pH,卜NaOH7NHHO…二二—-------------------- —加水②若把上述问题,换成等pH值,图示又怎样呢?pHi pH.NHHOHClNaOHHACHiO强酸弱酸稀释强、弱碱稀释pH=b Ph (NaOH )=b — n > 7 pH (NH3 • H2C) > b—n> 7△ pH (NaOH) =n△ P H(NH3 • H2O) Vn△ pH (NaOH) >△ pH (NH3 • H2O)① 酸无论怎样稀释,不可能成为碱性;若无限稀释,则 ② 碱无论怎样稀释,不可能成为酸性;若无限稀释,则③ 当起始强酸、弱酸的 pH 相同,稀释后为达仍相同,则稀释倍数一定是弱酸大小强酸(强 碱、弱碱类同)(三)有关pH 的计算1 •溶液简单混合(不发生反应,忽略混合时体积变化)厂强酸:pH=pH 小+0.3 若等体积混合,且△ pH > 2 V.强碱:pH=pH 大一0.3若不等体积混合,物质的量浓度「强酸[H ]总=-------- 匸y +V 2分别为M 1、M 2体积分别为 I 强碱[OH —]总=M “ * MV i +V 2V" V 2的一元强酸或强碱注意:强酸直接由[H +]总求pH 值 强碱由[OH —]总求pOH ,后再求pH 值.2 •强酸和强碱混合(发生中和反应,忽略体积变化)可能情况有三种: ① 若酸和碱恰好中和•即nH +=nOH —, pH=7.② 若酸过量,求出过量的[H +],再求pH 值.③ 若碱过量,求出过量的[OH —],求出pOH 后求pH 值.特例:若强酸与强碱等体积混合① 若pH 酸+pH 碱=14,则完全中和 pH=7. ② 若pH 酸+pH 碱〉14,则碱过量pH 衣pH 碱一0.3 ③ 若pH 酸+pH 碱V 14,则酸过量 pH 疋pH 酸+0.3 讨论:pH=a 的HCI 溶液和pH=b 的NaOH 溶液按体积比 V 1 : V ?混合.当混合液分别呈中性、 酸性、 碱性时,且V 1 : V 2=10n 时,a+b 分别为多少? 分析①呈中性:即pH=7. + —nH =nOH、,. 稀释到10n 倍 匚 刖----------------- 后pH=a pH (Hci )=a+n v 7PH (HAC )v a+n v 7 △ P H (HCI )=n△ P H(HAC )vn△pH (HCl)>△pH (HAC)pH 只能无限接近7且小于7. pH 只能无限接近7且大于7—a 、# —(14—b)10 • V I=10-V2—14+a+bV i : V2=10n a+b—1410 =10n=a+b —14 a+b=14+n②若呈酸性•即pH V 7nH+>nOH—10 • V1> 10 • V2—14+a+bV1 : V2> 10n A r\ — 14+ a+b10 > 10③若呈碱性,即pH > 7,同理可知3•关于酸、碱混合时的定性判断(常温)酸与碱混合时发生中和反应,但不一定恰好完呈中和。
即使恰好完全中和,也不一定溶液呈中性,由生成的盐能否水解及水解情况而定,另外酸碱的强弱不同,提供反应物的量不同也影响着反应后溶液的性质。
一般酸或碱过量化生成的盐水解对溶液的酸碱性影响大。
F面把常见的几种情况分列出来①等物质的量浓度的一元弱酸一元强碱溶液等体积混合溶液pH >7 (由生成的强碱弱酸盐水解决定)②等物质的量浓度的一元强酸与一元弱碱溶液等体积混合后溶液pH V 7(由生成的强酸弱碱盐水解决定)③等物质的量浓度的一元强酸与强碱溶液等体积混合后溶液pH=7 (因生成强酸强碱盐不水解)想一想:若酸或碱之一是多元,情况又怎样?④当pH=pOH的强酸与强碱溶液以等体积混合后pH=7 (与酸、碱的几元性无尖)⑤当pH=3的某一元酸溶液与pH=11的一元强碱以等体积混合后pH < 7。
(考虑酸有强弱之分,若分弱酸,制反应后酸过量)⑥当pH=3的某一元强酸pH=11的一元碱溶液的以等体积混合后pH > 7 (同理⑤,弱碱过量)⑦将pH=3的酸溶液和pH=11的碱溶液以等体积混合后溶液pH=无法确定.再想一想:⑤⑥⑦与酸、碱的几元性有无关系?3•精讲知识点一:水的电离【例1】(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 —NH4++NH2据此判断以下叙述中错误的是( )A •液氨中含有NH3、NH4+、NH2-等微粒—B .一定温度下液氨中C(NH 4 ) • C(NH 2 )是一个常数C .液氨的电离达到平衡时C(NH 3) = C(NH 4+) = C(NH 2-)+ -D .只要不加入其他物质,液氨中C(NH 4 ) = C(NH 2 )(2)完成下列反应方程式①在液氨中投入一小块金属钠,放出气体_______________________________________②NaNH 2溶于水的反应---------------------------------------------③类似于"H+OH =H20"的反应--------------------------------------解析:此题要求掌握水自偶的实质(水分子电离产生的日+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生『和NH2—,H+与NH3结合生成NH4+,液氨电离产生等量的NH2—与NH4+,—定温度下离子浓度乘积为一常数;NH4+类似于H +, NH2—类似于OH —。
具备上述知识后,就可顺利完成解题。
答案:(1) C(2)® 2Na+2NH3=H2f +2NNH2②NaNH2+H2O=NaOH+NH 31或NH2 —+H2O=OH —+NH 3 T③NH2—+NH4+ =2NH 31或NH4CI+NaNH 2=2NH 3? +NaCl知识点二:水的离子积【例2】某温度下纯水中C(H +)= 2X 10-7 mol/L,则此时溶液中的C(OH)= _______________ 。
若温度不变,滴入稀盐酸使C(H+) = 5X 10-6 mol/L,则此时溶液中的C(OH-)=解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH -)。
根据纯水中C(H+)与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH-)。
答案:纯水中C(OH-) = C(H+) = 2 X 10-7 mol/L+ - -7-7 -14Kw = C(H ) • C(OH ) = 2 X 10 X 2X 10 = 4 X 10-+ -14 - 6 - 9稀盐酸中C(OH ) = Kw / C(H ) = (4 X 10 ) / (5 X 10 ) = 8 X 10 mol/L【例3】.难溶化合物的饱和溶液存在着溶解平衡,例如:+ —+ 2 —AgCl(s) 一Ag +Cl ,Ag2CrO4(s) ——2Ag +CrO4,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
, + - -10已知:Ksp(AgCI)=[Ag ][Cl ]=1.8 X 10+ 2 2- -12Ksp(Ag 2CrO4)=[Ag ] [CrO 4 ]=1.9 X 10现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:(1) Cl-和CrO42-中哪种先沉淀?⑵当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)解析:(1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。
