原子吸收光谱概述
原子吸收光谱

8
第三阶段 电热原子吸收光谱仪器的产生 1959年,苏联里沃夫发表了电热原子化技术的第一篇论 文。电热原子吸收光谱法的绝对灵敏度可达到10-12-10-14g, 使原子吸收光谱法向前发展了一步。近年来,塞曼效应和自 吸效应扣除背景技术的发展,使在很高的的背景下亦可顺利 地实现原子吸收测定。
(3) 压力变宽(Pressure effect) 又称为碰撞(Collisional broadening)变宽。它是由于碰撞使激发 态寿命变短所致。外加压力越大,浓度越大,变宽越显著。可分为
a) Lorentz 变宽:待测原子与其它原子之间的碰撞。变宽在10-3nm。
劳伦兹变宽用Δν表示,可表达为 :
单色光谱线很窄才有明显吸收! 若 103 nm 则 I / I 0 1, A 0 无法分析
23
对于分子的紫外-可见吸收光谱的测量,入射光是由单 色器色散的光束中用狭缝截取一段波长宽度为0.xnm至1.xnm 的光,这样宽度的光对于宽度为几十nm甚至上百nm的分子带 状光谱来说,是近乎单色了,它们对吸收的测量几乎没有影 响,当然入射光的单色性更差时,就会引起吸收定律的偏离。 而对于原子吸收光谱是宽度很窄的线状光谱来说,如果 还是采用类似分子吸收的方法测量,入射光的波长宽度将比 吸收光的宽度大得许多,原子吸收的光能量只作入射光总能 量的极小部分。这样测量误差所引起的对分析结果影响就很 大。这种关系如下图所示。
33
若吸收线轮廓单纯取决于多普勒变宽,则:
原子吸收

原子吸收光谱原子吸收光谱(Atomic Absorption Spectroscopy,AAS),即原子吸收光谱法,是基于气态的基态原子外层电子对紫外光和可见光范围的相对应原子共振辐射线的吸收强度来定量被测元素含量为基础的分析方法,是一种测量特定气态原子对光辐射的吸收的方法。
此法是20世纪50年代中期出现并在以后逐渐发展起来的一种新型的仪器分析方法,它在地质、冶金、机械、化工、农业、食品、轻工、生物医药、环境保护、材料科学等各个领域有广泛的应用。
该法主要适用样品中微量及痕量组分分析。
查看精彩图册目录基本原理原子吸收光谱分析谱线轮廓发展历史特点灵敏度高精密度好选择性好,方法简便准确度高,分析速度快应用广泛原子吸收光谱分析的基本原理原子吸收光谱的产生原子吸收光谱的谱线轮廓原子吸收光谱的测量原子吸收分光光度计的组成光源原子化器分光器检测系统干扰及其消除方法物理干扰化学干扰电离干扰光谱干扰分子吸收干扰原子吸收光谱应用近年研究展望展开基本原理原子吸收光谱分析谱线轮廓发展历史特点灵敏度高精密度好选择性好,方法简便准确度高,分析速度快应用广泛原子吸收光谱分析的基本原理原子吸收光谱的产生原子吸收光谱的谱线轮廓原子吸收光谱的测量原子吸收分光光度计的组成光源原子化器分光器检测系统干扰及其消除方法物理干扰化学干扰电离干扰光谱干扰分子吸收干扰原子吸收光谱应用近年研究展望展开编辑本段基本原理原子吸收光谱原理图每一种元素的原子不仅可以发射一系列特征谱线,也可以吸收与发射线波长相同的特征谱线。
当光源发射的某一特征波长的光通过原子蒸气时,即入射辐射的频率等于原子中的电子由基态跃迁到较高能态(一般情况下都是第一激发态)所需要的能量频率时,原子中的外层电子将选择性地吸收其同种元素所发射的特征谱线,使入射光减弱。
特征谱线因吸收而减弱的程度称吸光度A,与被测元素的含量成正比:式中K为常数;C为试样浓度;I0v为原始光源强度;Iv为吸收后特征谱线的强度。
原子吸收光谱法
15:35
(2)谱线的热变宽 又称多普勒( Doppler )变宽,它是由于原子在空间 作热运动而引起的。
从物理学原理可知,从一个运动的原子发出的光,如果运动方 向离开观察者,则在观察者看来,其频率要比静止原子所发出 的光频率低,反之,如果原子向着观察者运动,则其频率要比 静止原子发出的光的频率高,这就是多普勒效应。 原子吸收分析法中,气体中的原子是处于无规则热运动中,有 的向着检测器方向运动,使光能增大,波长变短一点。有的背 向检测器运动,光能减弱,波长变长一点,一长一短,使谱线 变宽。这种频率分布和气体中原子的热运动的速度分布相符。
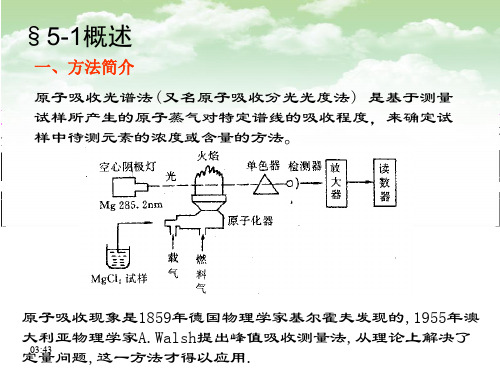
§5-1概述
一、方法简介 原子吸收光谱法 (又名原子吸收分光光度法 ) 是基于测量 试样所产生的原子蒸气对特定谱线的吸收程度,来确定试 样中待测元素的浓度或含量的方法。
原子吸收现象是1859年德国物理学家基尔霍夫发现的,1955年澳 大利亚物理学家A.Walsh提出峰值吸收测量法,从理论上解决了 15:35 定量问题,这一方法才得以应用.
1.14 10 4
从以上计算可以看出,与基态原子数相比,激发态原子数可忽 略不计。
即 N0≈N总
由此我们可以得到结论: (1)基态原子数等于总原子数。
15:35 ( 2)原子吸收法受温度影响不大。
二、吸收轮廓及变宽原因 1.吸收轮廓 从能级跃迁的观点看,吸收线与发射线应是一条严格的几何线, 但实际上是有一定宽度的。我们把吸收线或发射线的强度按频 率的分布叫谱线轮廓。如图5-2所示。 图中最大吸收对应的 频率 ν 0 称为峰值吸收
15:35
§5-2 原子吸收法的基本原理 一、基态原子数与火焰温度的关系 根据热力学原理,在一定温度下达到热力学平衡状态时,基态 和激发态的原子数之比与热力学温度的关系,可以用玻尔茨曼公 式描述: E j E0
原子吸收光谱法概述

原子吸收光谱法概述原子吸收光谱法(atomic absorption spectroscopy,AAS)是一种常用的分析方法,用于定量测定金属元素、半金属和非金属元素等。
该方法基于原子对特定波长的光的选择性吸收,通过测量被样品中金属元素吸收的光线强度来确定元素的浓度。
原子吸收光谱法是一种离子分析方法,用于测定微量金属和非金属元素。
它适用于溶液、固体和气体的分析,可以检测多达80个元素。
原子吸收光谱法的工作原理基于原子吸收谱线的三个基本法则:贝尔-朗伯定律、吉布斯-德瓦尔塔关系和弗朗茨-哈仑定律。
贝尔-朗伯定律指出,吸光度与浓度成正比。
在原子吸收光谱法中,通过测量被吸收光线的强度,可以得到样品中金属元素的浓度。
据此可以推导出吸收光谱法的工作公式:A = εbc,其中A是吸光度,ε是摩尔吸光系数,b是光程长度,c是溶液中金属元素的浓度。
吉布斯-德瓦尔塔关系描述了原子吸收光谱法中吸收光线的发生与元素浓度之间的关系。
该关系表明,吸光度与能级的数目和吸收线的相对强度有关。
这也使得原子吸收光谱法可以通过选择性吸收来定量分析混合溶液中的多个金属元素。
弗朗茨-哈仑定律描述了原子吸收光谱法中吸收光线强度与样品中金属原子浓度之间的关系。
该定律指出,吸收光线强度与样品中金属原子浓度呈线性关系。
通过绘制标准曲线,可以根据样品吸收光线强度来确定溶液中金属元素的浓度。
原子吸收光谱法的操作步骤一般包括样品的前处理、光源选择、样品的进样与蒸发、选择性吸收和测量。
样品前处理的目的是将待测物质从样品中分离出来,通常采用酸溶解、氧化还原等化学方法。
光源通常选择适合吸收元素的谱线,常见的光源有灯丝、火焰和电弧等。
样品进样与蒸发一般通过雾化和干燥来完成。
选择性吸收是通过选择特定波长的光线,使其被样品中的金属元素吸收,并测定被吸收光线的强度。
测量可以使用光电二极管或光度计等设备。
原子吸收光谱法具有灵敏度高、选择性强、准确度高等特点。
它广泛应用于环境监测、药物分析、食品安全等领域,常用于测定土壤、水体、生物样品中的重金属元素浓度。
原子吸收光谱,红外光谱之间异同点

原子吸收光谱和红外光谱是化学分析领域中常见的分析方法,它们在原子和分子结构的解析和鉴定中具有重要作用。
虽然二者都是用于分析样品成分和结构的光谱技术,但它们在原理和应用上有着明显的异同点。
一、原子吸收光谱1.原子吸收光谱的基本原理原子吸收光谱是利用原子对特定波长的光进行吸收而产生的,通过分析光的衰减程度来测定样品中不同元素的含量。
当原子吸收特定波长的光后,电子从基态跃迁至激发态,从而产生吸收峰。
这一原理被广泛应用于分析金属元素和其他原子的定量测定。
2.原子吸收光谱与光谱仪的关系原子吸收光谱仪是用于测定原子吸收光谱的分析仪器,它包括光源、样品室、光路等部分。
通过光源发出特定波长的光线,样品中的原子吸收部分光线,剩余的光线经光路到达检测器,从而实现对样品中不同元素含量的测定。
3.原子吸收光谱的应用原子吸收光谱在环境监测、食品安全和医药等领域都有着广泛的应用。
利用原子吸收光谱可以对水体中的重金属离子进行快速测定,保障水质安全;在医药领域,原子吸收光谱可以用于药品成分的分析和检测。
二、红外光谱1.红外光谱的基本原理红外光谱是利用物质吸收、透射和反射红外光的特性来分析物质结构的一种技术。
物质中的分子在吸收红外光后会发生振动和转动,产生特征的红外光谱图谱。
通过分析这些谱图可以确定物质的结构和成分。
2.红外光谱仪的组成及原理红外光谱仪包括光源、样品室、光路和检测器等组成部分。
当红外光穿过样品时,被吸收的波长和强度会发生改变,检测器可以通过测量这些改变来分析样品的成分和结构。
3.红外光谱的应用红外光谱在化学、材料和生物领域都有着广泛的应用。
红外光谱可以用于药品成分的鉴定和质量控制;在材料领域,红外光谱可以帮助分析材料的组成和结构。
对比原子吸收光谱和红外光谱,可以发现它们在分析原子和分子结构上有着明显的异同点。
原子吸收光谱主要用于分析元素的含量和测定,对于金属元素和其他原子有着较广泛的应用;而红外光谱主要用于分析化合物的结构和成分,可以辅助分析有机化合物和聚合物的结构。
原子吸收光谱法(AAS)

局限性:测不同的元素需不同的元 素灯,不能同时测多元素,难熔元 素、非金属元素测定困难。
原子吸收光谱法基本原理
1.原子的能级与跃迁
基态第一激发态,吸收一定频率的辐射能量。 产生共振吸收线(简称共振线) 吸收光谱 激发态基态,发射出一定频率的辐射。 产生共振吸收线(也简称共振线) 发射光谱
原子吸收光谱法基本原理
A kc
原子吸收分光度计
原子吸收分光度计
原子吸收分光度计
光源
原子化器
单色器
检测系统
思考:光学系统(单色器)为什么在原子化器和检 测系统之间?
光 源
提供待测元素的特征光谱。获得较高的 灵敏度和准确度。 光源应满足如下要求; (1)能发射待测元素的共振线; (2)能发射锐线; (3)辐射光强度大,稳定性好。
2.元素的特征谱线
(1)各种元素的原子结构和外层电子排布不同 基态第一激发态:
跃迁吸收能量不同——具有特征性。
(2)各种元素的基态第一激发态
最易发生,吸收最强,最灵敏线。特征谱线。
(3)利用原子蒸气对特征谱线的吸收可以进行定量分析
原子吸收光谱法基本原理
从光源发射出具有待测元素特征 谱线的光,通过试样蒸气时,被蒸气 中待测元素的基态原子所吸收,吸收 的程度与被测元素的含量成正比。故 可根据测得的吸光度,求得试样中被 测元素的含量。
将待测试样在专门的氢化物生成器中产生氢
化物,送入原子化器中检测。
单色器
•作用:将待测元素的吸收线与邻近线分开
•组件:色散元件 ( 棱镜、光栅 ) ,凹凸镜、 狭缝等
检测系统
•作用: 将待测元素光信号转换为电信号, 经放大数据处理显示结果。 •组件: 检测器、放大器、对数变换器、显 示记录装置。
(完整word版)原子吸收光谱分析解读

原子吸收光谱分析4。
2.1 概述4。
2。
1。
1 基本概念1)原子光谱根据原子外层电子跃迁所产生的光谱进行分析的方法,称为原子光谱法,包括原子发射光谱法、原子吸收光谱法和原子荧光光谱法。
本章重点介绍应用广泛的原子吸收光谱法。
2)原子吸收光谱原子吸收光谱法,又称原子吸收分光光度法或简称原子吸收法,它是基于测量试样所产生的原子蒸气中基态原子对其特征谱线的吸收,从而定量测定化学元素的方法.4。
2.1。
2 仪器结构和过程图4-21 原子吸收示意图如上图,含Pb溶液将经过预处理-喷射成雾状进人燃烧火焰中,Pb化合物雾滴在火焰温度下,挥发并离解成Pb原子蒸气。
用Pb空心阴极灯作光源,产生Pb的特征谱线,通过Pb原子蒸气时,由于蒸气中基态Pb原子的吸收,Pb的特征谱线强度减弱,通过单色器和检测器测得其减弱程度,即可计算出溶液中Pb的含量。
4。
2。
1。
3 方法特点灵敏度高,10—9g/ml-10—12g/ml。
选择性好,准确度高。
单一元素特征谱线测定,多数情况无干扰。
测量范围广.测定70多种元素。
操作简便,分析速度快。
4。
2.2 原子吸收法基本原理 4。
2。
2.1 共振线和吸收线 1) 基本概念➢ 共振线电子从基态跃迁到能量最低的激发态(称为第一激发态),为共振跃迁,所产生的谱线称为共振吸收线(简称共振线).当电子从第一激发态跃回基态时,则发射出同样频率的谱线,称为共振发射线(也简称共振线)。
对大多数元素来说,共振线是指元素所有谱线中最灵敏的线。
➢ 特征谱线各种元素的原子结构和外层电子排布不同.不同元素的原子从基态激发至第一激发态(或由第一激发态跃回基态)时,吸收(或发射)的能量不同,因此各种元素的共振线不同而有其特征性,这种共振线称为元素的特征谱线。
2) 朗伯原理图4-22 原子吸收法的朗伯定律示意图原理公式:b K e I I νν-=0νK :吸收系数;ν:频率。
吸收线图4-23 吸收线轮廓图 图4—24 吸收线半宽度比较上述两个图,注意图的纵坐标参量的不同。
原子吸收光谱详解

τ-激发态原子的寿命;τ 越小,宽度越宽。ΔvN约相当于10-5
nm 数量级。 2. 多普勒宽度ΔνD
由于原子在空间作无规则热运动所导致的,故又称为热 变宽。 当处于热力学平衡时, Doppler变宽可用下式表示:
VD 7.162107 V0
T M
3
原子吸收光谱分析的基本原理
A
B
E3
E2
A 产生吸收光谱 B 产生发射光谱
பைடு நூலகம்
E0 基态能级
E1
E1 第一激发态能级
E2 第二激发态能级
E3 第三激发态能级
E0
1.共振发射线: 电子从基态跃迁到能量最低的激发态时要吸收一
定频 率的光,它再跃迁回基态时,则发射出同样频率的光(谱线),
这种谱线称为共振发射线 。
Iv=I0 e-KvL
Kv 吸收系数
以Kv与 作图: 表征吸收线轮廓(峰)的参数:
中心频率0 (峰值频率) :最大吸收系数对应的频率; 半 宽 度:Δ。
6
原子吸收光谱分析的基本原理
谱线变宽
1. 自然宽度ΔvN 在无外界影响下,谱线仍有一定宽度,这种宽度称为自
然宽度。 根据量子力学的Heisenberg测不准原理,能级的能量有
-K L
0
0
A
1 lg e-K L
lg eK0L
0.434K0L
Ni/N0=gi/g0e-(Ei-E0)/kT
式中, g0 , gi分别为基态和激发态统计权重。
对共振线(E0=0),有
Ni/N0=gi/g0e-Ei/KT
当 T< 3000K 时,Ni/N0都很小,不超过1% ,故
原子吸收光谱法的基本原理

原子吸收光谱法的基本原理
原子吸收光谱法是一种常用的分析技术,其基本原理是利用原子或分子在特定能级间的电子跃迁现象来进行分析。
该法通过测量样品溶液或气体对特定波长的光的吸收情况,从而确定样品中所含元素的种类和浓度。
原子吸收光谱法的基本步骤包括:
1. 光源选择和光束整形:选择恰当的光源,常用的有希望灯和氢/氘灯。
同时,需要通过光束整形系统将光束调节为单色、平行和集中的形式。
2. 样品制备:根据分析目的,在适当的条件下,将待测溶液或气体样品制备成符合测量要求的状态。
例如,对溶液样品进行稀释、过滤或加热等处理。
3. 选择合适的吸收线:根据待测元素的特性,选择合适的吸收波长。
一般情况下,选择元素的共振线可以提高分析的灵敏度和选择性。
4. 光路调节:通过调节光路,使得入射光能够通过样品,并与样品中的原子或分子发生相互作用。
5. 光强测量:使用光电二极管、光电倍增管或光谱仪等光学探测器,测量出透射光强或吸收光强。
6. 基准校正:将测量得到的光强数据与基准样品进行比较,进
行校正。
7. 数据分析:根据样品中吸收光强的变化情况,推导出样品中待测元素的浓度,常用的数据分析方法有比对法、标准曲线法和内标法等。
原子吸收光谱法广泛应用于环境、农业、化学、医药等领域。
其优点包括简单、灵敏且不受干扰,但也存在测量范围窄、矩阵效应和仪器复杂等缺点。
因此,在实际应用中需要根据具体情况选择合适的分析方法和仪器。
原子吸收光谱

都属吸收光谱,遵守LB定律。
不同点:
吸光物质状态不同(分光光度法:溶液中的分
子或离子;AAS:气态的基态原子);
分子吸收为宽带吸收,而原子吸收为锐线吸收 。
特点
优点:
检出限低,10-10~10-14 g 准确度高 选择性好,谱线简单,因谱线重叠引起的光 谱干扰较小,即抗干扰能力强。一般情况下共 存元素不干扰 价廉
积分吸收的限制(2)
单色器的光谱通带 检测器的灵敏度
如果我们测量∫Kvdυ , 就可求出原子浓度N,但是 谱线宽度为10-2Å左右。需要用高分辨率的分光仪 器,高灵敏度的检测器这是目前难以达到的。这 就是早在100多年前就已发现原子吸收的现象, 但一直难以使用于分析科学的原因。
解决积分的困难
峰值吸收
吸收光谱的测量
积分吸收
积分吸收与蒸汽中吸收辐射的原子数N0成正比
积分吸收的限制
在5000Å的波长,要积分半宽度为0.01Å的谱 线,至少要取10点,每点为0.001Å。根据分辨 率公式,可以计算光栅所需的分辨率R 和光栅 常数d。
平面衍射光栅分辨率R
R kN
式中: 是相邻两谱线的平均波长; 是相邻两谱线的波长差; k 是光谱的级次; N 是光栅的刻线数。
温
灰化保 持温度 与时间 灰化 升温 斜率
原子 化升 温斜 率
干燥 升温 斜率
高 温 除 残 程 序 时间
干燥程序
灰化程序
原子化程序
石墨炉原子化器特点
优点:
具有较高的可控温度。 ~3400oC 原子蒸气在光程中的滞留时间长。10-1~10-2s 样品消耗量少。 抗干扰能力强----灰化分离。 灵敏度高。10-6~10-9
原子吸收光谱

0
I 0 e -K Ld
采用锐线光源进 行测量 , 则 Δνe<Δνa ,由图可见,在辐射线宽度范围内, Kν 可近似认为不变,并近似等于峰值时的 吸收系数K0。
11
A lg
e
e
0
I 0 d
0
I 0 e -K Ld
A lg
1 e - K L
lge K 0 L 0.434K 0 L
谱线变宽
1. 自然宽度ΔvN 在无外界影响下,谱线仍有一定宽度,这种宽度称为自 然宽度。 根据量子力学的Heisenberg测不准原理,能级的能量有 不确定性,ΔE由下式估算: Δ E = h/(2πτ ) τ -激发态原子的寿命;τ 越小,宽度越宽。ΔvN约相当于10-5 nm 数量级。 2. 多普勒宽度ΔνD 由于原子在空间作无规则热运动所导致的,故又称为热 变宽。 当处于热力学平衡时, Doppler变宽可用下式表示:
在原子吸收中,谱线变宽主要受多普勒效应影响,则:
2 π ln 2 e 2 K0 N0 f D mc
2 π ln2 e 2 A 0.434 N 0 fL kLN0 D mc
在实验条件一定的情况下,被测元素的浓度c 与原子蒸气中基态原子的总数保持一定的比例 关系: N0 = a c 所以在实验条件一定,各有关参数都是常数的 情况下,吸光度为: A=Kc 上式就是原子吸收分光光度分析的理论基础
第七章 原子吸收和原子荧光光谱法
Atomic Absorption Spectrometry, AAS & Atomic Fluorescent Spectrometry, AFS
1
第一节 原子吸收光谱分析概述
定义:原子吸收光谱法是一种基于在蒸气状态被测元素原子 对其共振辐射吸收进行定量分析的方法。 1802年,英国科学家 W. H. Wollaston在研究太阳连续光谱时, 发现太阳光谱的暗线。
原子吸收光谱分析概述及其优缺点

1原子吸收光谱分析AAS(atomic absorption spectroscopy)概述来源:分析行业原子吸收光谱分析法(AAS)是一种测量特定气态原子对光辐射的吸收的方法。
原子吸收分光光度法和我们以前在分析化学中学过的吸光光度法有很多的相似之处。
这里将通过对比的方式,在简单的复习一般吸光光度法的基础上引入原子吸收分光光度法的概念。
1.1 原子吸收光谱研究的历史人们对光吸收现象的研究始于18世纪初叶。
光吸收现象是指光辐射在通过晶体或液体介质后,其辐射的强度和方式会发生变化的现象。
通过研究这种光辐射吸收现象,人们注意到:原始的光辐射在经过吸收介质后,能量可以分为三个部分:(1)散射的,(2)被吸收的,(3)发射的辐射。
根据粒子从基态到激发态对辐射的吸收原理可以建立各种吸收光谱法,如分子、原子吸收光谱分析;相反,根据粒子从激发态到基态的光能辐射可以建立各种荧光发射光谱分析,只是在测量方向上和光路垂直。
原子吸收光谱法发展经历了这样的几个发展阶段:1.1.1 对原子吸收现象的初步认识因为太阳光是最普通的光源,所以光谱学和吸收光谱法的历史,与对太阳光的观察是紧密相联的。
文献中有记载最早的对原子吸收光谱现象的发现是在1802年,伍朗斯顿(W.H.Wollasto n)在研究太阳连续光谱时,曾指出在太阳连续光谱中存在着许多条的暗线。
几年以后,弗兰霍夫(Fraunhofer)在研究太阳连续光谱时,又独立地再次观察到了这些暗线,并详细地研究了这种现象,所以人们称这些暗线为弗兰霍夫线,但在当时还没有人能阐明产生这种暗线的原因。
1832年,研究其它现象的英国人布鲁斯特(D. Brewster) 首先对弗兰霍夫线产生的原因作了基本上是正确的解释。
在对白光通过一氧化氮时的谱线吸收现象进行了观察后,他认为弗兰霍夫线是由于太阳外围大气圈中比光源温度低的气体吸收了从光源发出的光的缘故。
然而真正对这种吸收现象作出确切解释的还是本生(R. Bu nsen)和克希荷夫(G. Kirchhoff)。
原子吸收光谱法(共73张课件)

比尔定律:
▪ 分析中,待测元素的浓度与其吸收辐射的原子总数成正 比。在一定浓度范围和一定火焰宽度L下:
▪ 可以通过测吸光度可求得待测元素的含量。
▪ 原子吸收分光光度A分析k'的c定量基础。待测元素浓度
2024/8/30
27
§4-3 原子吸收分光光度计
一、基本构造
光源
原子化系统
分光系统
检测系统 显示装置
表
处吸收轮廓上两点间的距离
征
(即两点间的频率差)。
▪ 数量级为10-3 -10-2 nm (发射线10-4 -10-3 nm )。
图4.2 原子吸收光谱轮廓图
2024/8/30
12
谱线变宽: 自然宽度 :N
▪ 无外界影响下,谱线仍有一定宽度—自然宽度。
▪ 与原子发生能级间跃迁时激发态原子的平均寿命有关。
2024/8/30
图4.3 峰值吸收测量示意图
21
应用原理: ▪ 光源:
2024/8/30
A lg I0 I
I0
e
0
I0d
I
e
0
Id
I I0eKL
I e 0
I0eKLd
Alg
e
0
I0 d
I e d e
K L
0 0
则:
在满足瓦尔西方法的测量条件时,在积分界限
内 吸可 收以 系认 数为。为常数,并合K理 地使之等于峰值
5%,测定灵敏度极差。
噪音低;
用该元素的锐线光源发射出特征辐射。 特点: 原子吸收分析的主要特点是测定灵敏度高,特效
发射的谱线稳定性好、强度高且宽度窄。
共振线在外光路损失小。
试样在原子化器中被蒸发,解离为气态基态原子。 共Ok振! L线et(’s特Ha征ve谱a线B)re是ak元. 素所有谱线中最容易发生、最灵敏的线,又具有元素的特征,所以分析中用该谱线作为分析线。
第十章 原子吸收光谱法

二、原子化系统
作用是将试样中待测元素转变成原子蒸气。 1.火焰原子化法 (1)雾化器:作用是将试样溶液雾化。当助
燃气高速通过时,在毛细管外壁与喷嘴口构 成的环形间隙中,形成负压区,将试样溶液 吸入,并被高速气流分散成气溶胶,在出口 与撞击球碰撞,进一步分散成微米级的细雾。 (2)混合室:作用是将未被细微化的较大雾 滴在混合室内凝结为液珠,沿室壁流入泄漏 管排走;并让气溶胶在室内与燃气充分混匀。
第十章 原子吸收光谱法
§10-1 §10-2 §10-3 §10-4 §10-5 §10-6
试题
概述 原子吸收法的基本原理 原子吸收分光光度计 定量分析方法 干扰及其抑制方法 灵敏度与检出限
1
§10-1 概述
一、 原子吸收光谱法
原子吸收光谱是利用待测元素的原子蒸 气中基态原子对特征电磁辐射(共振线)的吸 收来测定的。
式中ν0为谱线中心频率;M 为吸光原子的相对 原子质量;T 为绝对温度。 ΔνD约10-3数量
级,是谱线变宽的主要原因。 3.碰撞变宽(压力变宽) 由于原子相互碰撞使能量发生轻微变化。
劳伦兹变宽ΔνL :待测原子和其他原子碰撞引
起的谱线变宽。
ΔνL约10-3数量级,是碰撞变宽的主要因素。
10
赫鲁兹马克变宽ΔνH :同种原子碰撞引起的
29
二、标准加入法
取若干份体积相同的试液(cX),依次按比 例加入不同量的待测物的标准溶液(cO), 定容后浓度依次为:cX、cX+cO、cX+2cO、 cX+3cO、cX+4cO,分别测得吸光度为:A0、 A1、A2、A3、A4。以A对浓度c做图得一直 线,图中cX点即待测溶液浓度。
30
注意: 1.本法只能消除基体效应带来的干扰,不能消
简述原子吸收光谱法的基本原理,并从原理

简述原子吸收光谱法的基本原理,并从原理
入手探讨其应用和限制。
原子吸收光谱法是一种用于分析和鉴定物质中含有的金属元素的方法。
其基本原理是在样品中的金属元素通过光束中的某一特定波长的光被激发到高能态,然后会通过吸收光束中特定波长的光而返回到基态。
测量吸收光的强度或峰值的变化,可以得到金属元素的含量信息。
原子吸收光谱法的应用非常广泛。
它在环境监测、食品安全、药物分析、化工生产等领域均有重要应用。
其优势在于其高灵敏度和较高的选择性,可以检测到极小量的金属元素,并且对其他干扰物质的响应较小。
原子吸收光谱法也有一些限制。
首先,它只能检测金属元素,无法检测非金属元素。
其次,由于原子吸收光谱法需要满足特定的能级差条件,所以只有特定波长的光才能被吸收,这限制了其应用范围。
此外,原子吸收光谱法在样品制备过程中易受到干扰,需要仔细控制样品的溶解过程和干扰物的消除,以保证准确性和精确性。
综上所述,原子吸收光谱法通过检测金属元素的吸收光强度变化来分析和鉴定样品中金属元素的含量。
虽然具有灵敏度高、选择性强等优点,但其应用受到波长选择、样品制备等因素的限制。
原子吸收光谱法提纲重点笔记

子吸收光谱法提纲重点笔记基本原理1.原子吸收光谱(Atomic Absorption Spectroscopy, AAS),又称原子分光光度法,利用气态原子可以吸收一定波长的光辐射,利用电热能使原子中外层的电子从基态跃迁到激发态的现象而建立的。
能够进行定性、半定量、定量分析。
2.光线范围:紫外光和可见光3.测定方法:标准曲线法、标准加入法4.特征谱线因吸收而减弱的程度称吸光度A,在线性范围内与被测元素的含量成正比:A=KC式中K为常数;C为试样浓度;K包含了所有的常数。
此式就是原子吸收光谱法进行定量分析的理论基础5.原子吸收光谱线并不是严格几何意义上的线,而是占据着有限的相当窄的频率或波长范围,即有一定的宽度。
原子吸收光谱的轮廓以原子吸收谱线的中心波长和半宽度来表征。
中心波长由原子能级决定。
6.影响原子吸收谱线轮廓的两个主要因素:1、多普勒变宽。
多普勒宽度是由于原子热运动引起的。
从一个运动着的原子发出的光,如果运动方向离开观测者,则在观测者看来,其频率较静止原子所发的光的频率低,红移;反之,如原子向着观测者运动,则其频率较静止原子发出的光的频率为高,紫移。
这就是多普勒效应。
原子吸收分析中,对于火焰和石墨炉原子吸收池,气态原子处于无序热运动中,相对于检测器而言,各发光原子有着不同的运动分量,即使每个原子发出的光是频率相同的单色光,但检测器所接受的光则是频率略有不同的光,于是引起谱线的变宽。
2、碰撞变宽。
谱线宽度仅与激发态原子的平均寿命有关,平均寿命越长,则谱线宽度越窄。
原子之间相互碰撞导致激发态原子平均寿命缩短,引起谱线变宽。
碰撞变宽分为两种。
赫鲁兹马克变宽:指被测元素激发态原子与基态原子相互碰撞引起的变宽,称为共振变宽,又称压力变宽。
当蒸气压力达到0.1mmHg时,共振变宽效应则明显地表现出来。
洛伦茨变宽:指被测元素原子与其它元素的原子相互碰撞引起的变宽,称为洛伦茨变宽。
洛伦茨变宽随原子区内原子蒸气压力增大和温度升高而增大。
原子吸收光谱分析法知识详解

原子吸收光谱分析法知识详解原子吸收光谱分析法是实验室元素分析最常用的方法之一。
原子吸收光谱分析(又称原子吸收分光光度分析)是基于从光源辐射出待测元素的特征光波,通过样品的蒸汽时,被蒸汽中待测元素的基态原子所吸收,由辐射光波强度减弱的程度,可以求出样品中待测元素的含量。
一、原子吸收光谱的理论基础1、原子吸收光谱的产生在原子中,电子按一定的轨道环绕原子核旋转,各个电子的运动状态是由4个量子数来描述。
不同量子数的电子,具有不同的能量,原子的能量为其所含电子能量的总和。
原子处于完全游离状态时,具有最低的能量,称为基态。
在热能、电能或光能的作用下,基态原子吸收了能量,最外层的电子产生跃迁,从低能态跃迁到较高能态,它就成为激发态原子。
激发态原于很不稳定,当它回到基态时,这些能量以热或光的形式辐射出来,成为发射光谱。
其辐射能量大小,用下列公式示:ΔE=Eq-E0=hv=hc/λ式中:H:普朗克常数,其数值为:6.626*10-23J·S;C:光速(3*105km/s);V、入:分别为发射光的频率和波长;E0、E q:分别代表基态和激发态原子的能量,它们与原子的结构有关。
由于不同元素的原子结构不同,所以一种元素的原子只能发射由其已与Eq决定的特定频率的光。
这样,每一种元素都有其特征的光谱线。
即使同一种元素的原子,它们的Eq也可以不同,也能产生不同的谱线。
原子吸收光谱是源于发射光谱的逆过程。
基态原子只能吸收频率为:υ=(Eq-E0)/h的光,跃迁到高能态Eq。
因此,原子吸收光谱的谱线也取决于元素的原子结构,每一种元素有其特征的吸收光谱线。
原子的电子从基态激发到最接近于基态的激发态,称为共振激发。
当电子从共振激发态跃迁回基态时,称为共振跃迁。
这种振跃迁所发射的谱线称为共振发射线,与此过程相反的谱线称为共振吸收线。
元素的共振吸收线一般有好多条,其测定灵敏度也不同。
在测定时,一般选用灵敏线,但当被测元素含量较高时,也可采用次灵敏线(有些元素有好几条线,有的只有一条,次灵敏线能量太低不能使用)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子吸收光谱概述摘要:原子吸收光谱法是一种新型的仪器分析方法,它应用比较广泛。
本文综述了原子吸收光谱法的历史、测定、特点、进展及其在各个领域中的应用。
关键词:原子吸收;光谱法;原子化;应用1.原子吸收光谱的发展历史原子吸收光谱法自1955年作为一种分析方法问世以来,先后经历了初始的序幕期、爆发性的成长期、相对的稳定期和智能化飞跃期这4个不同的发展时期,由此原子吸收光谱法得以迅速的发展与普及,如今已成为一种倍受人们青睐的定量分析方法。
1.1第一阶段原子吸收现象的发现与科学解释早在1802年,伍朗斯顿(W.H.Wollaston)在研究太阳连续光谱时,就发现了太阳连续光谱中出现的暗线。
1817年,弗劳霍费(J.Fraunhofer)在研究太阳连续光谱时,再次发现了这些暗线,由于当时尚不了解产生这些暗线的原因,于是就将这些暗线称为弗劳霍费线。
1859年,克希荷夫(G.Kirchhoff)与本生(R.Bunson)在研究碱金属和碱土金属的火焰光谱时,发现钠蒸气发出的光通过温度较低的钠蒸气时,会引起钠光的吸收,并且根据钠发射线与暗线在光谱中位置相同这一事实,断定太阳连续光谱中的暗线,正是太阳外围大气圈中的钠原子对太阳光谱中的钠辐射吸收的结果。
1.2第二阶段原子吸收光谱仪器的产生原子吸收光谱作为一种实用的分析方法是从1955年开始的。
这一年澳大利亚的瓦尔西(A.Walsh)发表了他的著名论文'原子吸收光谱在化学分析中的应用'奠定了原子吸收光谱法的基础。
50年代末和60年代初,Hilger, Varian Techtron及Perkin-Elmer公司先后推出了原子吸收光谱商品仪器,发展了瓦尔西的设计思想。
到了60年代中期,原子吸收光谱开始进入迅速发展的时期。
1.3第三阶段电热原子吸收光谱仪器的产生1959年,苏联里沃夫发表了电热原子化技术的第一篇论文。
电热原子吸收光谱法的绝对灵敏度可达到10-12-10-14g,使原子吸收光谱法向前发展了一步。
近年来,塞曼效应和自吸效应扣除背景技术的发展,使在很高的的背景下亦可顺利地实现原子吸收测定。
基体改进技术的应用、平台及探针技术的应用以及在此基础上发展起来的稳定温度平台石墨炉技术(STPF)的应用,可以对许多复杂组成的试样有效地实现原子吸收测定。
1.4第四阶段原子吸收分析仪器的发展随着原子吸收技术的发展,推动了原子吸收仪器的不断更新和发展,而其它科学技术进步,为原子吸收仪器的不断更新和发展提供了技术和物质基础。
近年来,使用连续光源和中阶梯光栅,结合使用光导摄象管、二极管阵列多元素分析检测器,设计出了微机控制的原子吸收分光光度计,为解决多元素同时测定开辟了新的前景。
微机控制的原子吸收光谱系统简化了仪器结构,提高了仪器的自动化程度,改善了测定准确度,使原子吸收光谱法的面貌发生了重大的变化。
联用技术(色谱-原子吸收联用、流动注射-原子吸收联用)日益受到人们的重视。
色谱-原子吸收联用,不仅在解决元素的化学形态分析方面,而且在测定有机化合物的复杂混合物方面,都有着重要的用途2.原子吸收光谱的分类刘洪涛等人[1] 在激光剥离2单激光二极管原子吸收光谱法(LA-DLAAS) 的基础上[2,3], 利用两个激光二极管(DL)作双光束光源测定了铀贫矿中235U/238U 同位素比。
双光束光源能消除信号波动对测量重现性影响, 改善LA-DLAAS 的精密度和准确度。
Nd : YAG 激光器用于剥离样品作原子化器, 两个DL 激光束以约4°交叉角穿过样品焰, 吸收信号由光电二极管检测。
检测限为18μg·g - 1 ; 精密度和准确度分别为5 %和2 %。
2.1火焰原子吸收( FAAS)Granado 等人[4]用大体积液体膜预富集, 用FAAS 测定了海水及天然水中的镉。
富集因子为17.9 , 检出限为01006μg·L - 1 ; RSD 为215 % , 回收率为101 %。
样品用缓冲液调为pH 7.8 , 取286 mL 置于大烧杯中。
16 mL 的富集液为0106mol·L - 1的硝酸, 置于较矮的小烧杯中。
将小烧杯同心地放在大烧杯中。
再将74 mL 含0184 g·L - 1络合剂2-APBH 的甲苯溶液倒入大烧杯, 液面没过小烧杯, 在样品溶液和预富集溶液的顶端形成一层液体膜。
将此装置放在磁搅拌器上搅拌, 30 ℃的恒温室平衡4.5 h。
富集原理是: 样品溶液中的Cd 离子, 通过与液体膜中的2-APBH 反应, 进入液体膜生成螯合物, 该中性螯合物在pH 梯度力的作用下, 又由液体膜转移到预富集溶液。
从大体积的样品溶液转送到小体积的富集溶液的过程, 就是富集过程。
Yebra 等人[5] 用微型分离柱富集, FI-AAS 检测, 分析海水中的Cd ; 微柱中填装Chelite P螯合树脂。
微型柱可在野外直接输入海水预富集Cd , 不需要调pH 值, 然后在实验室的FI-AAS 上洗脱、测量; Cd 的检出限为2.7 ng·L - 1 ; 富集因子大于1500 ; 无基体干扰。
Silva 等人[6]使用在线富集FI-FAAS 分析了水和生物样品中的痕量Cu(Ⅱ) 和Cd(Ⅱ) , 微型分离柱中填充物为被Nb2O5改进的硅胶(Nb2O5-SiO2 ) , 硝酸反向洗脱; 无基体干扰; 富集因子分别为34.2 和33.0 ; 检出限为0.4 和0.1μg·L- 1 ; 测量精度为1.8 %和1.6 %。
Long 等人[7]用聚四氟乙烯作微型分离柱的填充物, 二乙基二硫代磷酸盐(DDPA) 作螯合剂, ET-AAS 作检测器, 测量了生物及水样品中的痕量Cd , 富集因子为20.8 ; 检出限为5.5μg·L - 1 ; RSD 为1.0 % 。
Anthemidis等人[8] 用在线的流动注射( FI)-液液萃取(LLE)-FAAS 测量了水样中的超痕量Cd。
用APDC 作络合剂, 用异丁基甲基酮( IBMK) 在线萃取使络合物进入有机相, 所设计的重力相分离器可用于在线分离, 富集因子155 ; 检出限0.02 μg·L - 1 ; RSD 为3.2 %。
2.2 石墨炉原子吸收( GF-AAS)冯尚彩[9] 用HNO3-K2HPO4为基体改进剂提高镉的灰化温度, GF-AAS 法直接测定血清中痕量镉; 原子化温度为1700 ℃。
在0~5μg·L - 1范围呈良好的线性关系, 加标回收率为97.8 %~102.5 %。
Hernández 等人[10]用GF-AAS 测量了尿样中的微量镉, 尿样与4 %的硝酸1∶1 混匀后, 取10μL直接转移到横向加热的110 ℃的石墨炉内。
本方法的特点是利用镉的低热稳定性, 仅用进样溶液中的硝酸作改进剂, 没有热分解过程, 仅通过镉的低温、快速原子化过程使镉与基体组分分离, 整个程序仅42 s , 其中在300 ℃下干燥的总时间为30 s , 1 200 ℃下原子化的总时间仅4 s。
测量的检出限为0.06 mg·L - 1 , RSD 约5 % , 回收率约91 %~103 %。
2.3 氢化物发生原子吸收( HG-AAS)刘艺力[11]用流动注射HG-AAS 测定了食品中的痕量汞。
样品用微波消解(MD) , 0.5 %硼氰化钾作氢化物发生还原剂, 硫酸为载液。
检出限0.2 μg·L - 1 , RSD 为1.7 %~3.2 % , 加标回收率在96.6 %~100.2 %之间。
北京翰时制作所的流动注射氢化物发生器使测量具有自动定量地进液进样, 试剂用量少, 稳流等特点。
文献[12]报道氨基硼烷和三价的氰基三硼氢化物可以用来取代NaBH4作氢化物发生器的还原剂, 还可以消除Fe (Ⅲ) , Ni (Ⅱ) , Co (Ⅱ) 和Cu (Ⅱ)离子的干扰。
文献[13]报道NaBH4可以将Au 转变成气态物质后捕集在石墨炉内。
文献[14]报道Au 的汽态可能是通过多种反应形成的。
Feng 等人[15] 报道NaBH4能使Cd 从溶液中以原子或分子的形态汽化。
2.4 其它原子吸收金属器皿原子化法,针对挥发元素,操作方便,易于掌握,但抗干扰能力差,测定误差较大,耗气量较大; 粉末燃烧法,测定Hg、Bi 等元素时,此法灵敏度高于普通火焰法; 溅射原子化法,适用于易生成难溶化合物的元素和放射性元素;电极放电原子化法,适用于难熔氧化物的金属Al 、Ti 、Mo 、W的测定;等离子体原子化法,适用于难熔金属Al 、Y、Ti 、V、Nb、Re ;激光原子化法,适用于任何形式的固体材料,比如测定石墨中的Ca 、Ag、Cu、Li ;闪光原子化法,是一种用高温炉和高频感应加热炉的方法。
3.原子吸收光谱法的特点及其测试方法3.1原子吸收光谱法的特点原子吸收光谱法,选择性强,因其原子吸收的谱线仅发生在主线系,且谱线很窄,所以光谱干扰小、选择性强、测定快速简便、灵敏度高,在常规分析中大多元素能达到10 - 6 级,若采用萃取法、离子交换法或其它富集方法还可进行10 - 9级的测定。
分析范围广,目前可测定元素多达73 种,既可测定低含量或主量元素,又可测定微量、痕量、甚至超痕量元素;既可测定金属类金属元素,又可间接测定某些非金属元素和有机物;既可测定液态样品,又可测定气态或某些固态样品。
抗干扰能力强,原子吸收光谱法谱线的强度受温度影响较小,且无需测定相对背景的信号强度,不必激发,故化学干扰也少很多。
精密度高,常规低含量测定时, 精密度为1 %~3 % ,若采用自动进样技术或高精度测量方法,其相对偏差小于1 %。
当然原子吸收光谱法也有其局限性,它不能对多元素同时分析,对难溶元素的测定灵敏度也不十分令人满意,对共振谱线处于真空紫外区的元素,如P、S 等还无法测定。
另外,标准工作曲线的线性范围窄,给实际工作带来不便,对于某些复杂样品的分析,还需要进一步消除干扰。
3. 2 样品预处理样品预处理的恰当与否直接决定了测量的灵敏度,它主要包括样品的溶解,分离及富集两步。
对于液体样品的溶解,无机样可直接用水稀释至合适的浓度范围,有机样可用甲基异丁酮或石油醚稀释降低其粘度;对于固体样品通常采用酸溶法,极少的情况也用碱溶法,但其溶速较慢,且常会引入无机离子污染。
样品的分离与富集主要分为萃取法、螯合萃取、离子缔合物萃取和离子交换法[16-18]。
另外,值得一提的是,目前在环境、生物、食品研究中广泛应用的预处理方法有:干法灰化、常压湿法消化[19]、微波消解[20]和脉冲悬浮法[21-23] ,其中微波消解技术方便快捷、节约试剂、污染少、样品溶解完全,故最为常用。
