第三章红外吸收光谱
波谱分析 第三章 03红外谱图解析

C= C : 16பைடு நூலகம்0~1450 cm-1区域吸收峰的强弱及个数与分子结 构有关,是判断苯环存在的主要依据。 有2-4个峰,峰数取决于取代基对苯环对称性破坏的程度
苯 甲苯 取代基与苯环共轭时 烷基存在时 1600 cm-1 无吸收 1500 、 1600 cm-1 有吸收 1580 cm-1 处出现强吸收 1450 cm-1 有吸收
烷烃
表3-4, (CH2)n结构 中亚甲基面内摇 摆振动
CH3 –CH – CH2 –CH – CH3 CH3
1168 1386 1468 1367
CH3
2,4 - 二甲基戊烷
78
2.烯烃
基团 = CH中C-H C=C骨架
3080 2975 1680~1620
1000~800 (面外摇摆)
(1) = CH >3000 cm-1为不饱和碳上质子振动吸收,是与饱 和碳上质子的重要区别。 (2) C=C的 位置及强度 与烯碳的取代情况及分子对称性 密切相关。 末端烯烃 C=C吸收最强,双键移向碳链中心时结构对称 性增强, C=C带减弱。顺式较反式强。 共轭双键中由于双键的相互作用出现两个 C=C (1650、1600 cm-1 )。 46
饱和环醚: 在 1260~780 cm-1 范围出现两条或两条以上的吸收带。 环张力增加as波数降低, s波数升高。 O 1071 913 O 983 1028
(3) CH(面外)最有用。 特点是: 不同类型的烯烃,有其独特的波数,且比较固定,不受 取代基的变化而发生很大的变化。 吸收强度特别强。 根据烯氢被取代的个数、取代位置及顺反异构的不同, 出峰的个数、位置及强度不同。
烯烃类型 R1CH=CH2 R1R2CH=CH2 R1CH=CHR2 (顺) R1CH=CHR2 (反) R1R2CH=CHR3 面外弯曲振动位置/cm-1 995 ~985, 910 ~905 895 ~ 885 730 ~ 650 980 ~ 965 840 ~ 790
第三章 红外吸收光谱分析-1

波长和波数
红外区光谱用波长和波数( 红外区光谱用波长和波数(wave number) 波长和波数 ) 来表征 ; 波长多用m做单位; 做单位; 波长多用 做单位 波数: 表示, 波数:以σ表示,定义为波长的倒数,单位 表示 定义为波长的倒数, cm-1,其物理意义是每厘米长光波中波的数 目. σ=1/λ(cm)=104/λ(m)=υ/c 用波数表示频率的好处是比用频率要方便, 用波数表示频率的好处是比用频率要方便,且 数值小. 数值小. 一般用透光率 波数曲线或透光度-波长曲线 透光率-波数曲线 波长曲线来 一般用透光率 波数曲线或透光度 波长曲线来 描述红外吸收光谱. 描述红外吸收光谱.
第三章 红外吸收光谱分析
3.2 基本原理 3.2.1 产生红外吸收的条件
产生红外吸收的条件
1) 辐射光子具有的能量与发生振动 跃迁所需的跃迁能量相等. 跃迁所需的跃迁能量相等. 2)辐射与物质之间有耦合作用. )辐射与物质之间有耦合作用.
条件一: 条件一:辐射光子的能量应与振动跃 迁所需能量相等
红外光谱的特点-1 红外光谱的特点
紫外,可见吸收光谱常用于研究不饱和 紫外,可见吸收光谱常用于研究不饱和 有机物, 有机物,特别是具有共轭体系的有机化 合物; 红外光谱法主要研究在振动中 合物;而红外光谱法主要研究在振动中 伴随有偶极矩变化的化合物. 伴随有偶极矩变化的化合物. 因此,除了单原子和同核分子如Ne, , 因此,除了单原子和同核分子如 ,He, O2,H2等之外,几乎所有的有机化合物 等之外, 在红外光谱区均有吸收. 在红外光谱区均有吸收. 一般只要结构上不同, 一般只要结构上不同,就会有不同的红 外光谱图. 外光谱图.
红外光谱的特点-2 红外光谱的特点
红外谱图吸收带的位置与吸收谱带的强 红外谱图吸收带的位置与吸收谱带的强 度反映了分子结构上的特点, 度反映了分子结构上的特点,可以用来 定基团,定结构; 定基团,定结构; 谱带的强度与分子组成以及含量有关 与分子组成以及含量有关, 谱带的强度与分子组成以及含量有关, 可以用来进行定量分析及纯度的检查; 可以用来进行定量分析及纯度的检查; 红外光谱分析特征性强,气体, 红外光谱分析特征性强,气体,液体和 固体样品均可以测定,并且具有用量少, 固体样品均可以测定,并且具有用量少, 分析速度快和不破坏样品等特点. 分析速度快和不破坏样品等特点.
第三章红外光谱IR
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
C-H面外弯曲振动吸收峰位置(cm-1) 670
770-730,710-690 770-735
810-750,710-690 833-810
780-760,745-705 885-870,825-805 865-810,730-675
810-800 850-840 870-855
870
各类取代苯的倍频吸收和面外弯曲振动吸收
有机波谱解析-第三章_红外光谱

由于红外光谱吸收强度受狭缝宽度、温度和溶剂等因素影 响,故不易精确测定,在实际分析中,只是通过与羰基等强吸 收峰对比来定性研究。
谱带强度与振动时偶极矩变化有关,偶极矩变化愈 基团极性 大,谱带强度愈大;偶极矩不发生变化,谱带强度为0, 即为红外非活性。 电子效应
红外吸收强度 偶极距变化幅度 振动偶合
伸缩振动(
as
)两种形式。
弯曲振动:原子垂直于化学键方向的运动。又可以分
它们还可以细分为摇摆、卷曲等振动形式。
为面内弯曲振动()和面外弯曲振动( )两种形式,
+和-表示垂直于纸面方向的前后振动。
亚甲基的振动形式
三、分子振动与红外吸收峰的关系
理论上具有特定频率的每一种振动都能吸收相应 频率的红外光,在光谱图对应位臵上出现一个吸收 峰。实际上,因种种原因分子振动的数目与谱图中
纵坐标为: 百分透过率(%) 横坐标为: 波长(µ m)或波 数(cm-1)。
环戊烷
也可用文字形式表示为:2955cm-1(s)为CH2的反对称伸缩振动 (υasCH2),2870cm-1(m)为CH2的对称伸缩振动(υsCH2) 1458cm-1(m) 为CH2的面内弯曲振动(δ面内CH2),895cm-1(m)为CH2的面外弯曲振动 (面外CH2)
诱导效应大于共轭效应, C=O 蓝移至 1735 cm-1
三、空间效应
(1)空间位阻 破坏共轭体系的共平面性,使共
轭效应减弱,双键的振动频率蓝移(增大)。
CH(CH3)2 O O O
CH3 CH3
CH3 CH(CH3)2
CH3
1663cm-1
1686cm-1
1693cm-1
(2)环的张力:环的大小影响环上有关基 团的频率。
第三章 红外光谱法--本科生

1. 红外辐射光的频率与分子振动的频率相 当,才能满足分子振动能级跃迁所需的能 量,而产生吸收光谱。 2. 必须是能引起分子偶极矩变化的振动才能 产生红外吸收光谱。
4 吸收谱带的强度
红外光谱的吸收带强度即可用于定量分析,也是 化合物定性分析的重要依据。 基态分子中的很小一部分,吸收某种频率的红外 光,产生振动的能级跃迁而处于激发态。激发态分子 通过与周围基态分子的碰撞等原因,损失能量而回到 基态,它们之间形成动态平衡。跃迁过程中激发态分 子占总分子的百分数,称为跃迁几率,谱带的强度即 跃迁几率的量度。跃迁几率与振动过程中偶极矩的变 化(△μ)有关,△μ越大,跃迁几率越大,谱带强度 越强。
特征区(官能团区)分为三个区域:
(2)2500~1900 为叁键和累积双键区。 主要包括-CC、 -CN等等叁键的伸缩振动,以及-C =C=C、C=C=O等累积双键的不对称性伸缩振动。 对于炔烃类化合物,可以分成R-CCH和R-C C-R两种类型, RCCH的伸缩振动出现在2100~2140 cm-1附近; R-C C-R出现在 2190~2260 cm-1附近;-C N基的 伸缩振动在非共轭的情况下出现在 2240~2260 cm-1附近。当与不饱和键或芳香核共轭时,该峰位移到 2220~2230 cm-1附近。
k /N.cm
7.7 6.4
折合质量μ :μ ↓,(v)↑,红外吸收信号将出现在 高波数区。
v
振 σ
1 k 2 c
吸收峰的峰位:化学键的力常数k越大,原子的折 合质量越小,振动频率越大,吸收峰将出现在高波数 区(短波长区);反之,出现在低波数区(高波长区)
v
v
ቤተ መጻሕፍቲ ባይዱ
结论:
产生红外光谱的必要条件是:
红外吸收光谱

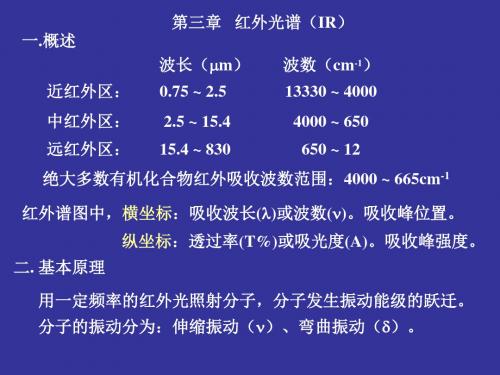
第三章红外吸收光谱(Infrared Absorption Spectroscopy)3.1 概述红外光谱又称为分子振动光谱或分子振转光谱1、特点:特征性强,适应范围广。
有机、无机、高分子化合物;固态、液态、气态样品都可以进行测定红外分为三个区域,近红外区(0.76μm~2.5μm,12820~4000cm-1)、中红外区(2.5μm~25μm, 4000~400cm-1)和远红外区(25μm~1000μm, 400~33cm-1)。
绝大多数有机化合物的基团震动频率处于中红外区。
2、表示方法:红外光谱多用透光率T%为纵坐标,表示吸收强度,以波数ζ(cm-1)为横坐标,表示吸收峰的位置。
也有用吸光度A为纵坐标,出反峰。
波数是频率的一种表示方法(每厘米长的光波中的波的数目)ζ(cm-1)=波数(cm-1)=1/波长(λcm)=104/波长(μm)=1/λ(cm);ζ·λ=1cm 3、红外光谱产生的基本条件1)E红外光=△E分子振动或υ红外光=υ分子振动2)分子振动时其偶极矩(μ)必须发生变化,即△μ≠0,μ=δr3.2 红外光谱与分子结构的关系3.2.1分子的振动形式*基频:分为两大类:伸缩振动和弯曲(变型)振动。
用υs表示对称伸缩,用υas 表示不对称伸缩,δ表示面内弯曲振动,γ表示面外弯曲振动。
以亚甲基为例:此外,还有一些其它的振动吸收峰存在:*倍频:由振动能级基态跃迁到第二,第三激发态时所产生的,不是整数倍。
*组合频:一种频率红外光,同时被两个振动所吸收。
倍频和组合频统称为泛频,在谱图中均显示为弱峰。
*振动偶合:当相同的两个基团相邻,且振动频率相近时,会发生振动偶合裂分,成为两个峰。
*费米共振:基频与泛频之间发生的振动偶合。
当泛频峰与某基峰相近时,发生相互作用,使原来很弱的泛频吸收峰增强。
图3-12费米共振和倍频。
3.2.2 红外光谱的分区(1)基团结构与振动频率的关系表3-1 基团振动频率与化学键力常数的关系(化学键种类)基团化学键力常数(K/N·cm-1) 键长(Â)振动频率(cm-1)C—C(三键)12~18 1.27 2262~2100C—C(双键)8~12 1.40 1600~1800C—C(单键)4~6 1.54 1000~1300(弱)表3—2基团振动频率与原子折合质量的关系(原子种类)基团折合质量键长(Â)振动频率cm-1C—H 0.9 1.12 2800~3100C—C 6 1.54 约1000C—Cl 7.3 1.77 约625C—I 8.9 2.31 约5000—H N—H 0.971.0336003300-3500(2)基团频率区的划分(表3-3)前三个区域(氢键区、叁键及累积双键区、双键区,即4000——1500 cm-1)称为特征频率区,小于1500 cm-1的区域称为指纹区(单键区,有些文献中以1350 cm-1作为二者的界限)。
第三章-红外吸收光谱分析

第三章红外吸收光谱分析3.1概述3.1.1红外吸收光谱的基本原理红外吸收光谱法又称为分子振动转动光谱,属于分子光谱的范畴,是有机物结构分析的重要方法之一。
当一定频率的红外光照射分子时,若分子中某个基团的振动频率和红外辐射的频率一致,两者产生共振,光的能量通过分子偶极矩的变化传递给分子,该基团就吸收了这个频率的红外光,产生振动能级跃迁;如果红外辐射的频率和分子中各基团的振动能级不一致,该频率的红外光将不被吸收。
如果用频率连续变化的红外光照射某试样,分子将吸收某些频率的辐射,引起对应区域辐射强度的减弱,用仪器以吸收曲线的形式记录下来,就得到该试样的红外吸收光谱,稀溶液谱带的吸光度遵守Lambert-Beer定律。
图3-1为正辛烷的红外吸收光谱。
红外谱图中的纵坐标为吸收强度,通常用透过率或吸光度表示,横坐标以波数或波长表示,两者互为倒数。
图中的各个吸收谱带表示相应基团的振动频率。
各种化合物分子结构不同,分子中各个基团的振动频率不同。
其红外吸收光谱也不同,利用这一特性,可进行有机化合物的结构分析、定性鉴定和定量分析。
图3-1 正辛烷的红外光谱图几乎所有的有机和无机化合物在红外光谱区均有吸收。
除光学异构体,某些高分子量的高聚物以及一些同系物外,结构不同的两个化合物,它们的红外光谱一定不会相同。
吸收谱带出现的频率位置是由分子振动能级决定,可以用经典力学(牛顿力学)的简正振动理论来说明。
吸收谱带的强度则主要取决于振动过程中偶极矩的变化和能级跃迁的概率。
也就是说,红外光谱中,吸收谱带的位置、形状和强度反映了分子结构的特点,而吸收谱带的吸收强度和分子组成或官能团的含量有关。
因此,红外吸收光谱在化学领域中的应用,大体上可分为两个方面,即分子结构的基础研究和用于化学组成的分析。
首先,红外光谱可以研究分子的结构和化学键。
利用红外光谱法测定分子的键长和键角,以此推断出分子的立体构型;利用红外光谱法测定分子的力常数和分子对称性等,根据所得的力常数就可以知道化学键的强弱;由简正频率来计算热力学函数等等。
第三章红外吸收光谱

CH3, CH2
酯C=O CH2,CH3 CH3 酯得特征 酯得特征
3)官能团
CH2
CH3
4)可能得结构
C=O
C-O
νas(C-O-C)
1180cm-1
5)确定结构
O
1240cm-1
O C CH3
1160cm-1
例3、某化合物分子式C8H8,试根据如下红外光 谱图,推测其结构。
例3解:
1)不饱和度 分子式: C8H8,
(CH2)n
gC-H(oop)
1-己烯和1-己炔
g=CH2 (面外) (CH2)n
例2:烷烃(另一种形式得IR谱)
例3:烯烃
例4:炔烃
例5:苯环上得取代
例6:芳香族化合物
例7:醇类化合物
例8:酚类化合物
例9:醚类化合物
例10:羰基化合物-醛类
例11:羰基化合物-酮类
例12:羧酸类化合物
结构验证 其不饱和度与计算结果相符;并与标准谱图对照证明结构正确。
例5、化合物C4H8O,根据如下IR谱图确定结构, 并说明依据。
O
CCC
例5解:
1)不饱和度 分子式: C4H8O,
2)峰归属
U=1-8/2+4=1
波数(cm-1 )
归属
结构信息
3336 3078 2919,2866 1622 1450 1036
例13:酯类化合物
例14:酸酐类化合物
例15:酰卤类化合物
例16:酰胺类化合物
H 3 C C
例17:胺类化合物
例18:腈类化合物
O
O
O
H C O CH2CH2CH 3 H3C C O C H2CH3 H3CH 2C C O C H3
第三章-红外吸收光谱分析-1

由于分子非谐振性质,各倍频峰并非正好是基频峰的 整数倍,而是略小一些。
HCl的基频峰和倍频峰
基频峰(V0→1) 二倍频峰( V0→2 ) 三倍频峰( V0→3 ) 四倍频峰( V0→4 ) 五倍频峰( 0→5 )
折合质量μ的影响
对于相同化学键的基团,波数与折合 质量μ平方根成反比。例如C-C、C-O、 C-N键的力常数相近,但折合质量不同。
μ : C-C < C-N < C-O 1430 cm-1 1330 cm-1 1280 cm-1
第三章 红外吸收光谱分析
3.2 基本原理 3.2.3 多原子分子振动
在红外吸收光谱上除基频峰外,还有振动能级由基 态( V =0)跃迁至第二激发态( V =2)、第三激 发态( V =3),所产生的吸收峰称为倍频峰。
除此之外,还有合频峰(1+2,21+2,),差 频峰( 1-2,21-2, )等,这些峰多数很弱, 一般不容易辨认。
倍频峰、合频峰和差频峰统称为泛频峰。
通过试样后的红外光在一些波数范围减弱,在 另一些波数范围内仍然较强,用仪器记录该试 样的红外吸收光谱,进行样品的定性和定量分 析。
第三章 红外吸收光谱分析
3.2 基本原理 3.2.2 双原子分子的振动
红外光谱是由于分子振动能级的跃迁(同时伴有转动能级跃迁) 而产生,即分子中的原子以平衡位置为中心作周期性振动,其振 幅非常小。这种分子的振动通常想象为一根弹簧联接的两个小球 体系,称为谐振子模型。这是最简单的双原子分子情况,如下图 所示。
EL=hL 产生红外吸收光谱的第一条件为:
EL =△Ev hL = △Vh 即 L= △V
第三章 红外吸收光谱法

3)远红外区: 400~25cm-1(25~1000 m),主要用 于研究分子的转动光谱以及重原子成键的振动等。
2
红外吸收光谱图的表示方法
横坐标为波数(σ/cm-1),纵坐标为透射比(T%) 吸收峰为倒峰。
3
3.2 红外吸收光谱的基本原理
1 产生红外吸收的条件
(1)红外辐射的能量等于分子振动能级跃迁所需要的能量。 ΔEν=Eν2- Eν1=hνa νa:红外光频率。
26
例
100 90 80
化合物的分子式为C6H14,IR光谱图如下如下,试推断其可 能的分子结构结构。
70 60 50 40 30 20 10 0 4000
饱和-CH3、CH2 对称与反对称 伸缩振动
CH3 H3C C H2 CH C H2 CH3
亚 甲 基 弯 曲 振 动
Transmittance %
RC CR’ (2190 2260 cm-1 ) R=R’ 时,无红外活性
(2)RC N (2100 2140 cm-1 ) 非共轭 2240 2260 cm-1 共轭 2220 2230 cm-1
(3)累积双键O=C=O
2349 cm-1
667cm-1
21
3. 双键伸缩振动区( 2000 1500 cm-1 )
羧酸的C=O
1820~1750 cm-1 ,
氢键,二分子缔合体;
23
(2)C=C,C=N和N=O 1680-1500 cm-1 RC=CR’ 1620 1680 cm-1 强度弱, R=R’(对称)时,无红外活性。 (3)单核芳烃 的C=C键伸缩振动(1600和1500 cm-1 )
习题6
24
σ = 22 π cc
第3章红外光谱法

Rayleigh散射:
激发虚态
弹性碰撞;无能
E1 + h0
h(0 - )
量交换,仅改变方向
Raman散射:
h0
非弹性碰撞;方
向改变且有能量交换 E1
E0 + h0
h0 h0 V=1
h0 +
E0
V=0
Rayleigh散射
Raman散射
h
E0基态, E1振动激发态; E0 + h0 , E1 + h0 激发虚态;
发生振动能级跃迁需要能量的大小取决于键两端原子 的折合质量和键的力常数,即取决于分子的结构特征。
14.06.2019
分析化学研究所
第8页
分子中基团的基本振动形式
1.两类基本振动形式
伸缩振动
弯曲振动
亚甲基
14.06.2019
亚甲基
分析化学研究所
第9页
伸缩振动
甲基的振动形式
弯曲振动
对称 υ s(CH3) 2870 ㎝-1
频峰
14.06.2019
分析化学研究所
第13页
官能团区和指纹区
• 官能团区 4000~1300cm-1是基团伸缩振动出现的区域,对鉴定 基团很有价值
• 指纹区 1300~600cm-1是单键振动和因变形振动产生的复杂光 谱区,当分子结构稍有不同时,该区的吸收就有细微 的差异,对于区别结构类似的化合物很有帮助。
共轭效应:使共轭体系中的电子云密度平均化,使双键略有伸 长,因此,双键的吸收频率向低波数方向位移。
中介效应:当含有孤对电子的原子(如:O, N, S等)与具有多 重键的原子相连时,也可起类似的共轭作用,使吸收频率向低 波数方向位移。
第三章 红外吸收光谱完整版本ppt课件

解析完后,进行验证,不饱和度与计 算值是否相符,性质与文献值是否一致, 与标准图谱进行验证
谱图对照应注意:所用的仪器在分辨 率和精确度一致;测定的条件一致;杂质 引进的吸收带应仅可能避免。
.
三、红外光谱解析实例C8H16
例一:未知物分子式为C8H16,其红外图谱如 下图所示,试推其结构。
.
解:由其分子式可计算出该化合物不饱和度为1, 即该化合物具有一个烯基或一个环。
C C 2100
H 763 ,694(双峰)
CO 1638 C(C 芳环)1597 ,1495 ,1445
.
➢
解:
U
2
29
1
7
7
可能含有苯环
2
1638cm1强吸收 为 CO 3270cm1有吸收 NH 1132353123003300ccccmmmm( ( 1111吸强 强收) ) C N含 含NHCCCH 13023608ccmm11 为CH H 1597 ,1495 和 1445cm(1 三峰) 为 C(C 芳环) 763 和 694cm(1 双峰) 为 H(单取代)
❖ 3387、3366 cm-1 :NH2的伸缩振动; ❖ 1624 cm-1 : NH2弯曲振动; ❖ 1274 cm-1 :C-N伸缩振动;
❖综合上述信息及分子式,可知该化合物为:
邻苯二胺
.
图谱解析实例 例1 某化合物,测得分子式为C8H8O,其红外
光谱如下图所示,试推测其结构式。
C8H8O红外光谱图
1查找基团时先否定以逐步缩小范围2在解析特征吸收峰时要注意其它基团吸收峰的干扰3350和1640cm1处出现的吸收峰可能为样品中水的吸收3吸收峰往往不可能全部解析特别是指纹区4掌握主要基团的特征吸收
【2024版】第三章-红外吸收光谱分析-4

附图A1 固载氯烷基硅氧烷原料硅胶在常温时测 定的IR谱图
附图A2 固载氯烷基硅氧烷的硅胶中间体在常温 时测定的IR谱图
附图A3 氯烷基硅氧烷做偶联剂研制的杀菌剂产 品在常温时测定的IR谱图
附图A4 固载氯烷基硅氧烷原料硅胶在200℃时测 定的IR谱图
附图A6 固载氯烷基硅氧烷的硅胶中间体在 200℃时测定的IR谱图
MeO
MeO Si O SiCH 2CH2CH2Cl + MeOH
MeO
以硅胶为载体通过γ-氯丙基三甲氧基硅烷固载 季铵盐制备水不溶性杀菌剂
CH 3
Si
CH2Cl + N CnH2n+1
Si
CH 2
CH 3
叔胺可以是 N,N-二甲基-n 烷基胺,n 为 12-18。
CH 3 N + CnH2n+1Cl-
入封闭液体池中,液层厚度一般为 0.01~1mm。
液体和溶液试样
液体和溶液试样
(2)液膜法 ➢ 沸点较高的试样,直接滴在两片盐片之间,形成液膜。 ➢ 一些固体也可以溶液的形式进行测定。 ➢ 常用的红外光谱溶剂应在所测光谱区内本身没有强烈的
吸收,不侵蚀盐窗,对试样没有强烈的溶剂化效应等。 如CS2(1350-600cm-1)和CCl4(4000-1350 cm-1) 等。
(3)试样的浓度和测试厚度应选择适当,以使光谱图中 的大多数吸收峰的透射比处于20%~80%范围内。
制样的方法
1 .气体样品 气态样品可在玻璃气槽内进行测定,它
的两端粘有红外透光的NaCl或KBr窗片。先 将气槽抽真空,再将试样注入。
气体样品
液体和溶液试样
(1)液体池法 沸点较低,挥发性较大的试样,可注
红外光谱法

指纹区:波数在1330~667cm-1(波长7.5~15μm) 的区域称为指纹区。 在该区域中各种官能团的特征频率缺乏鲜明的特征性。 在指纹区包括有单键的伸缩振动及变形振动所产生的复 杂光谱。当分子结构稍有不同时,该区的吸收就有细微 的差异,而且峰带非常密集,犹如人的指纹,故称指纹 区。因此,可以利用分子结构上的微小变化所引起的指 纹区内光谱的明显变化来确定有机化合物的结构。
2、特征峰与相关峰
红外吸收光谱具有极强的特征性。在含有许多原子基团 的复杂分子中,这种特征性与各类型化学键振动的特征相 关联。组成分子的各种原子基团都有自己的特征红外吸收 的频率范围和吸收峰,称这些能用于鉴定原子基团存在并 有较高强度的吸收峰为特征峰,其相应的频率称为特征频 率或基团频率。 对于一个基团来说,除了有特征峰之外,还有一些其它 振动形式的吸收峰。将这些相互依存及可相互佐证的吸收 峰称为相关峰。 在实际分析中,由于样品中含有多种原子基团,并相互 影响,给分析带来一定的难度。此时用一组相关峰鉴别其 团的存在显得尤为重要。
带强度较弱。
2、偶极矩的影响 由量子力学得出,吸收系数与偶极矩变化量(Δμ)的平 方成正比,即ε(Δμ)2。而Δμ又与分子或基团的偶极矩、 分子的对称性及振动形式等有关。
§2.3 化合物基团频率及特征吸收峰
一、红外吸收光谱中的常用术语
1、基频峰与泛频峰
基频峰:其分子的振动能级从基态(V0)跃迁到第一激发态(V1) 跃迁几率大,故强度也大。 泛频峰 倍频峰: 从基态跃迁至第二、第三激发态时所产 生的吸收峰。由于振动能级间隔不等距, 所以倍频不是基频的整数倍。 组频峰:一种频率红外光,同时被两个振动所吸 收即光的能量由于两种振动能级跃迁。 泛频峰:因不符合跃迁选律,发生的几率很小,显示为弱峰。
红外吸收光谱分析

吸收峰位置σ(cm-1) 1429 1667 2222
2920
§4 分子振动的形式
多原子中基团的振动形式极为复杂,振动形式的总 数可如下计算
非直线型分形 子式 的 3原 = 总子 振 6数 动 直线型分子式 的3= 总 原振 子 5动 数形
非直线型分子以水分子为例
直线型分子以CO2为例
二、多原子分子的振动
合物
位置
1715 1805
1735 ~1740
1740 ~1770
~1680
1775
~1700
1710
1750
1750~ 1800
羧酸、酰卤、酸酐、 酰亚胺
羧酸与羧酸盐: 2700~3300、双峰 (1550~ 1620)+(1330~1420)
酰卤:
向高频移动
RCOF:1850 RCOCl:1795
900~600cm-1
应用:
1 (CH2)n:n≥4,722;n减小,吸收峰红移; 2 烯烃
RCH=CH2 890(较强)
RHC=CHR
顺式
反式
690(弱)
970(强)
CH3
3 C C H 3 :(1370~1380)+(1380~1385)双峰
4 苯环取代情况 苯环:1600、1580、1500cm-1处、两 到三个峰
当C=C与C=O共轭时,吸收强度较低; 苯环取代情况主要看700~900(强)和
1660~2000cm-1(弱) 单取代:~710和~750双强峰 四个相邻氢:770~735强峰 三个相邻氢:810~750强峰 两个相邻氢:860~800强峰 单独的氢 :900~800弱峰
C=N:1630~1690,强度不定 硝基化合物:~1350 与 ~1560 两强峰 C-O键(1070~1150,强)判断醚、醇、
仪器分析教程第3章 红外光谱

一. 基本振动的类型 伸缩振动和弯曲振动。
1. 伸缩振动(Stretching Vibration)
用 v 表示。 特点:成键原子沿键轴方向伸缩,键长发生周 期性的变化,其键角不变。 当分子中原子数 >=3 时,可产生对称伸缩振动
键或官能团的吸收频率,这种现象叫诱导效应。
诱导效应的影响沿着分子中的化学键而传递,
与分子的几何形状无关。
羰基碳上的 电负性基团使羰基伸缩振动吸收峰
向高频方向移动(蓝移)。
O R-C-R O R-C-Cl O F-C-F O CH3-C-O-CH=CH2 为什么 ? vC=O 1770cm-1 1928cm-1 1800cm-1 1715cm-1 O R-C-H O R-C-F O R-C-NH2 1680cm-1 O CH3-C-O-CH2CH3 1734cm-1 1920cm-1 1730cm -1
例:水分子(非线性分子)。 振动自由度数 = 3 × 3 - 6 = 3
3600~3000cm-1
1647cm-1
990~400cm-1
例:
CO2分子(线性分子)。 振动自由度= 3×3-5 = 4
2349 cm-1
667 cm-1
3.1.3 红外吸收峰强度
intensity of Infrared absorption band (一)红外吸收峰强度的表示方法
O R- C
H- NH C- R O
1690 cm-1 3500 cm-1 1650 cm-1
HN- H
游离:
vC=O vN-H
第三章 红外吸收光谱分析-3

外部因素
外部因素主要指测定时物质的状态以及溶剂效应等因
素。 同一物质的不同状态,由于分子间相互作用力不同, 所得到光谱往往不同。 分子在气态时,其相互作用力很弱,此时可以观察到 伴随振动光谱的转动精细结构。 液态和固态分子间作用力较强,在有极性基团存在时, 可能发生分子间的缔合或形成氢键,导致特征吸收带 频率、强度和形状有较大的改变。 例如,丙酮在气态时的C-H为1742 cm-1 ,而在液态时 为1718 cm-1 。
C=O :→降低
注意:有时在化合物中,I效应与M效应同时存在,如果二者方 向不一致,这时应考虑哪个效应起主导作用。例如,饱和酯的 C=O为1735cm-1,比酮(1715cm-1)高,就是由于I效应大于M效应, 二者的净效应使得电子云密度由氧移向双键中间,使键力常数增 加的缘故。
当含有孤对电子的原子(O、S、N等)与具有多重键
游离羧酸的co键频率出现在1760cm1左右在固体或液体中由于羧酸形成二聚体co键频率出现在1700cm1当两个振动频率相同或相近的基团相邻具有一公共原子时由于一个键的振动通过公共原子使另一个键的长度发生改变产生一个微扰从而形成了强烈的振动相互作用
第三章 红外吸收光谱分析
3.3 基团频率和特征吸收峰
利用指纹区中苯环的C-H面外变形振动吸收峰 和2000~ 1667cm-1区域苯的倍频或组合频吸收 峰,可以共同配合确定苯环的取代类型。下图为不 同的苯环取代类型在2000~ 1667cm-1和 900~600cm-1区域的光谱。
指纹区
变形振动- 亚甲基
指纹区
变形振动 - 甲基
对称δ s(CH3)1380㎝-1
共轭效应- C效应
共轭效应使共轭体系中的电子云密度平 均化。 双键略有伸长,单键略有缩短,即双键 电子云密度降低,化学键力常数变小, 伸缩振动频率向低频方向移动。 共轭效应常引起C=O双键的双键性降低, 伸缩振动频率向低波数位移。
第三章红外光谱分析法(波普分析)

第三章红外光谱分析法紫外-可见吸收光谱常用于研究具有共轭体系的有机化合物,而红外吸收谱则主要研究在振动中伴随偶极矩变化的化合物。
通常红外吸收带的波长位置与吸收谱带的强度,反映了分子结构上的特点,可用以鉴定未知物结构组成或确定其化学基团。
由于红外光谱分析特征性强,对气体、液体、固体均可分析,是鉴定有机化合物的最常用的方法之一。
常用的范围是400 - 4000cm-1。
一、红外吸收光谱的基本原理红外吸收光谱产生应满足两个条件:(1)辐射应具有能满足物质产生振动跃迁所需的能量;(2)辐射与物质间有相互偶合作用。
分子在振动过程中必须有瞬间偶极矩的改变。
对称分子:没有偶极矩,辐射不能引起共振,无红外活性。
如:N2、O2、Cl2 等。
非对称分子:有偶极矩,红外活性。
分子的振动可近似看为一些用弹簧连接的小球的运动。
分子的振动能级(量子化): E振=(V+1/2)hnV:化学键的振动频率;n:振动量子数。
任意两个相邻的能级间的能量差为:K化学键的力常数,与键能和键长有关, m为双原子的折合质量 m =m1m2/(m1+m2)发生振动能级跃迁需要能量的大小取决于键两端原子的折合质量和键的力常数,即取决于分子的结构特征。
多原子分子的振动多原子分子的振动较双原子分子振动复杂得多。
其振动的基本类型有伸缩振动(ν)和弯曲振动(δ)两大类。
伸缩振动是指原子沿键轴方向伸缩,使键长发生周期性变化的振动。
由于振动偶合作用,3个原子以上的基团还可分为对称伸缩振动和不对称伸缩振动,表示为ν对称和ν不对称。
弯曲振动又叫变形或变角振动,指基团键角发生周期性变化的振动。
弯曲振动的力常数较小,因此常出现在低频区。
红外吸收峰的强度主要取决于吸收过程中偶极矩的变化。
变化越大,吸收越强。
通常两个原子的电负性相差越大,吸收越强。
如C=O吸收峰是大多数红外谱图中吸收最强的峰。
二、基团频率与特征吸收峰组成分子的各个基团均有其特定的红外吸收区域。
根据化学健的性质,可将其分为四个区:4000 - 2500 cm-1 氢键区;2500 - 2000 cm-1 参键区;2000 - 1500 cm-1 双键区;1500 - 1000 cm-1 单键区。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红外光谱的最大特点是具有特征性,谱图上
的每个吸收峰代表了分子中某个基团的特定 振动形式。 定性分析 定量分析
一、定性分析
已知物的鉴定
未知物的鉴定
谱图库搜索、比对算法 谱图解析
首先应了解样品的来源、用途、制备方法、分离方法、理化性质、元素 组成及其它光谱分析数据如UV、NMR、MS等有助于对样品结构信息的
104 (cm ) ( m)
1
波长(µ m) 波数(cm-1)
0.75-2.5 2.5-25 13158-4000 4000-400
能级跃迁类型
OH、NH、CH键的倍 频吸收
分子振动/伴随转动
远红外区
25-300
400-10
分子转动
5
近红外光区(0.75 ~ 2.5µ m) 主要是由低能电子跃迁、含氢原子团(如O—H、N—H、C—H)伸缩振动的倍 频吸收等产生的。该区的光谱可用来研究稀土和其它过渡金属离子的化合物, 并适用于水、醇、某些高分子化合物以及含氢原子团化合物的定量分析。 中红外光区(2.5 ~ 25µm ) 绝大多数有机化合物和无机离子的基频吸收带出现在该光区。由于基频振 动是红外光谱中吸收最强的振动,所以该区最适于进行红外光谱的定性和定量 分析。同时,由于中红外光谱仪最为成熟、简单,而且目前已积累了该区大量 的数据资料,因此它是应用极为广泛的光谱区。通常,中红外光谱法又简称为 红外光谱法。 远红外光区 (25 ~ 1000µm ) 该区的吸收带主要是由气体分子中的纯转动跃迁、振动-转动跃迁、液体和 固体中重原子的伸缩振动、某些变角振动、骨架振动以及晶体中的晶格振动所 引起的。 由于低频骨架振动能很灵敏地反映出结构变化,所以对异构体的研究 特别方便。此外,还能用于金属有机化合物(包括络合物)、氢键、吸附现象 的研究。但由于该光区能量弱,除非其它波长区间内没有合适的分析谱带,一 般不在此范围内进行分析。 红外吸收光谱一般用T~曲线或T~ 波数曲线表示。纵坐标为百分透射比T%, 因而吸收峰向下,向上则为谷;横坐标是波长(单位为µ m ),或波数(单位 为cm-1)。
09:25:07
—CH3 —CH2— —C—H
2960 cm-1 2870 cm-1 2930 cm-1 2850 2890 cm-1 cm-1
反对称伸缩振动 对称伸缩振动 对称伸缩振动 弱吸收
反对称伸缩振动
3000 cm-1 以 下
(3)不饱和碳原子上的=C—H( C—H )
苯环上的C—H =C—H C—H 3030 cm-1 3010 2260 cm-1 3300 cm-1
常见的有机化合物基团频率出现的范围:4000 670 cm-1 依据基团的振动形式,分为四个区: (1)4000 2500 cm-1 X—H伸缩振动区(X=O,N,C,S) (2)2500 1900 cm-1 三键,累积双键伸缩振动区
(3)1900 1200 cm-1 双键伸缩振动区 (4)1200 670 cm-1 X—Y伸缩, X—H变形振动区
振动中分子偶极矩变化越小,谱带强度也就越弱。一般地,极性较强的基团(如C=0,
C-X等)振动,吸收强度较大;极性较弱的基团(如C=C、C-C、N=N等)振动,吸
和很弱(vw)等表示。按摩尔吸光系数的大小划分吸收峰的强弱等级,具体如下: >100 非常强峰(vs)
收较弱。红外光谱的吸收强度一般定性地用很强(vs)、强(s)、中(m)、弱(w)
一般将振动形式分成两类:伸缩振动和变形振动。
a. 伸缩振动(νs νas )
原子沿键轴方向伸缩,键长发生变化而键角不变的振动称为伸缩振动。它又分 为对称伸缩振动(νs )和不对称伸缩振动(νas ) 。
b. 变形振动(又称弯曲振动或变角振动,用符号δ 表示)
基团键角发生周期变化而键长不变的振动称为变形振动。变形振动又分为 面内变形振动和面内变形振动。
c.
基本振动的理论数
简正振动的数目称为振动自由度,每个振动自由度相当于红外光 谱图上一个基频吸收带。
水分子
所示:
独立的振动数: 非直线型分子: 3n-5 直线型分子: 3n-6
水分子是非线型分子,振动自由度:3×3-6=3个振动形式,分别为不对称伸缩振 动、对称伸缩振动和变形振动。这三种振动皆有偶极矩的变化是红外活性的。 如图
指纹区(1350 650 cm-1 ) ,较复杂。 C-H,N-H的变形振动; C-O,C-X的伸缩振动; C-C骨架振动等。精细结构的区分。 顺、反结构区分;
基团吸收带数据
特 征 吸 收 带 ( 伸 缩 振 动 ) 指 纹 吸 收 带 含 氢 化 学 键 伸 缩 振 动 变 形 振 动 活 泼 氢 不 饱 和 氢 饱 和 氢 三 键 双 键
09:25:07
五、分子结构与吸收峰
1. X—H伸缩振动区(4000 cm-1 )
(1)—O—H 3650 3200 cm-1 确定
2500
醇、酚、酸
在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐,强吸收;当浓度较大时,发 生缔合作用,峰形较宽。 注意区分
—NH伸缩振动:
3500 3100 cm-1
归属和辨认。
二、定量分析
Lambert-Beer定律 定量时吸光度的测定常 用基线法。如图所示,图 中I与I0之比就是透射比。
基线的画法
三、红外光谱与有机化合物结构—谱图解析
红外光谱图: 纵坐标为吸收强度, 和波数1/λ 单位:cm-1 可以用峰数,峰位,峰形, 峰强来描述。
应用:有机化合物的结构解析。 定性:基团的特征吸收频率; 定量:特征峰的强度;
分子中基团的振动和转动能级跃迁产生:振-转光谱 辐射→分子振动能级跃迁→红外光谱→官能团→分子结构
一、红外光区的划分
红外光区分成三个区:近红外区、中红外区、远红外区。 其中中红外区是研究和应用最多的区域,一般说的红外光谱 就是指中红外区的红外光谱.
■红外光区的划分如下表:
区域名称
近红外区 中红外区 泛频区 基本振动区 分子转动区
电子能级
振动能级
转动能级
分子能级示意图
分子振动方式
用经典力学方法把双原子分子的振动形式用两个刚性小球的弹簧振动来模拟,如 下图所示:
Байду номын сангаас
δ
双原子分子振动示意图
δ
影响基本振动频率的直接因素是相对原子质量和化学键的力常数。
2)多原子分子的振动和转动
对于多原子分子,由于一个原子可能同时与几个其它原子形成化学 键,它们的振动相互牵连,不易直观地加以解释,但可以把它的振动分 解为许多简单的基本振动,即简正振动。
亚甲基:
变形振动 亚甲基
伸缩振动 甲基:
对称 υ s(CH3) 2870 ㎝-1
不对称 υ as(CH3) 2960㎝-1
变形振动
甲基
对称δ s(CH3)1380㎝-1
不对称δ
as(CH3)1460㎝
-1
产生红外吸收的分子称为红外活性分子,如CO2分 子;反之为非红外活性分子,如O2分子。
14
1.峰位
第三章 红外吸收光谱
化
学 与 材 料 工 程 学 院 刘 昭 第
当样品受到频率连续变化的红外光照射时,
分子吸收某些频率的辐射,并由其振动运动 或转动运动引起偶极矩的净变化,产生的分 子振动和转动能级从基态到激发态的跃迁, 从而形成的分子吸收光谱称为红外光谱。又 称为分子振动转动光谱。
概述
例: 2800 3000 cm-1 —CH3 特征峰; 1600 1850 cm-1 —C=O 特征峰; 基团所处化学环境不同,特征峰出现位置变化:
—CH2—CO—CH2—
—CH2—CO—O— —CH2—CO—NH—
1715 cm-1
1735 cm-1 1680 cm-1
酮
酯 酰胺
09:25:07
C2H4O
O
-1 1 7 3 0 cm
-1 1 1 6 5 cm
H H H
C
H
-1 2 7 2 0 cm
C
(CH3)1460 cm-1,1375 cm-1。 (CH3)2930 cm-1,2850cm-1。
四、基团频率和特征吸收峰
与一定结构单元相联系的、在一定范围内出现的化学键振动频率——基团特征频率 (特征峰); 基团频率在4000 cm-1 ~ 1300 cm-1 之间,这一区域称为基团频率区、官能团区或特征 区。区内的峰是由伸缩振动产生的吸收带,比较稀疏,容易辨认,常用于鉴定官能团。 在1800 cm-1 (1300 cm-1 )~600 cm-1 区域内,除单键的伸缩振动外,还有因变形振动 产生的谱带。这种振动与整个分子的结构有关。当分子结构稍有不同时,该区的吸收就有 细微的差异,并显示出分子特征。这种情况就像人的指纹一样,因此称为指纹区。指纹区 对于指认结构类似的化合物很有帮助,而且可以作为化合物存在某种基团的旁证。
3000 cm-1 以上
2. 叁键(C C)伸缩振动区
(2500
RC CR’
1900 cm-1 )
2140 cm-1 )
2260 cm-1 ) (2190
在该区域出现的峰较少; (1)RC CH (2100 R=R’ 时,无红外活性 (2)RC N (2100 非共轭
2140 cm-1 )
(2)单核芳烃 的C=C键伸缩振动(1626 1650 cm-1 )
苯衍生物的C=C
苯衍生物在 1650 2000 cm-1 出现 C-H和C=C键的面内变形振动的 泛频吸收(强度弱),可用来判断取代基位置。 2000 1600
(3)C=O (1850 1600 cm-1 ) 碳氧双键的特征峰,强度大,峰尖锐。
O-H N-H P-H S-H C-H Ar-H =C-H -CH3 CH2 -CH C C N C R2C=O RHC=O C=C C-O C-N C-C C-C-C C-N-O H-C=C-H R-Ar-H H-C-H 3630 3350 2400 2570 3330 3060 3020 2960,2870 2926,2853 2890 2050 2240 1715 1725 1650 1100 1000 900 <500 500 960(反) 650-900 1450
