艾曲波帕杂质
艾曲波帕注意事项及副作用

艾曲波帕注意事项及副作用艾曲波帕是一种用于治疗高血压、心律失常和冠心病的药物。
它属于一类叫做钙离子拮抗剂的药物。
以下是关于艾曲波帕的注意事项及副作用的详细解释。
注意事项:1. 用药前应告知医生自己的过敏史,尤其是对钙离子拮抗剂类药物有无过敏反应。
2. 在开始使用艾曲波帕之前,请告知医生目前正在使用的所有药物,包括处方药、非处方药和补品。
3. 在使用艾曲波帕期间,避免饮用含有葡萄柚的饮料,因为葡萄柚会干扰药物的清除,增加药物在体内的浓度。
4. 禁止饮酒,因为酒精会增加艾曲波帕的镇静作用。
5. 如果您有心脏病史或其他相关疾病,应定期接受医生的心电图和血压监测。
6. 在使用艾曲波帕期间,应避免从躺卧或坐起的位置突然站立,以防止低血压引起的头晕和晕厥。
7. 在使用药物期间,如果您感到心悸、心跳加快、呼吸急促、胸闷或胸痛等不适,应立即就医。
副作用:1. 最常见的副作用是头晕和疲乏感,这些症状往往会在用药的早期发生,随着身体适应药物而减轻。
2. 另一个常见的副作用是便秘,可以通过增加饮水和摄入高纤维食物来缓解。
3. 艾曲波帕还可能导致低血压,可能会引起头晕、虚弱或晕厥,特别是在用药的初始阶段。
所以起床时要慢慢站起来,以避免突然的血压下降。
4. 艾曲波帕有一定的心脏功能抑制作用,可能会导致心悸、心动过速等心脏相关症状。
5. 一些患者还可能出现消化不良的副作用,如恶心、呕吐和腹泻。
6. 偶尔会出现头痛、失眠、抑郁、记忆力减退等中枢神经系统相关的副作用。
7. 虽然不常见,但有些人可能对药物产生过敏反应,如皮疹、瘙痒、呼吸困难等。
如出现这些症状应立即就医。
需要注意的是,艾曲波帕具体的注意事项和副作用可能因个体差异而略有不同。
因此,在使用前最好咨询医生,遵循医生的建议,并定期进行复查。
如果出现严重的副作用或不适,请及时就医并停止使用该药物。
比索洛尔杂质研究总结

10mg 25mg 50mg 100mg 其他
项目研发 注册申报
17 比索洛尔杂质 1
Bisoprolol Impurity 1
1797024-50-0
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
18 比索洛尔杂质 2
Bisoprolol Impurity 2
177034-57-0
项目研发 注册申报
比索洛尔 EP 杂质 11
N
Bisoprolol EP Impurity N
1346601-75-9
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
比索洛尔 EP 杂质 12
Q
Bisoprolol EP Impurity Q
1346604-00-9
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
富马酸比索洛尔 7
EP 杂质 F
Bisoprolol EP Impurity F
Hemifumarate
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
比索洛尔 EP 杂质 8
G
Bisoprolol EP Impurity G
1215342-36-1
10mg 25mg 50mg 100mg 其他
①阿立哌唑杂质 ②西地那非杂质 ③阿比特龙杂质 ④醋丁洛尔杂质 ⑤醋氯芬酸杂质 q:300⑥阿呋唑嗪杂质 ⑦氨氯地平杂质 ⑧阿莫西林杂质 ⑨倍他米松杂质 ⑩比卡鲁胺杂质 -8058⑪氨溴索杂质 ⑫苯达莫司汀杂质 ⑬阿托伐他汀杂质 ⑭胺碘酮杂质 ⑮比索洛尔杂质 -303 ......更多项目品种持续更新 代理:CP/EP/USP/TRC/TLC/MC/LGC/RHINO 等品牌
艾曲波帕产品幻灯

注意事项
1. 艾曲波帕(Eltrombopag)和其它药物、食物或多价阳离子(如,铁、钙、铝、镁、硒,和锌)添加 剂间允许间隔4小时
2. 为减低出血风险调整每天剂量至达到和维持血小板计数≥50 × 109/L 3. 每天最大剂量建议不超过75 mg 4. 如最大剂量后4周血小板计数不增加中断艾曲波帕(Eltrombopag) 5. 重要肝功能检验异常或血小板计数反应过量也中断艾曲波帕(Eltrombopag)
艾曲波帕
石文质
本文仅供参考
艾曲波帕是什么药?
【药品名称】
化学结构式:
【通用名称】 艾曲泊帕乙醇胺片 【商品名称】 瑞弗兰 Revolade 【英文名称】 Eltrombopag Olamine Tablets 【汉语拼音】 Ai Qu Bo Pa Yi Chun An Pian
【成份】
活性成份:艾曲泊帕乙醇胺。 化学名称:3'-{(2Z)-2-[1-(3,4-二甲苯基)-3-甲基-5-氧1,5-二氢-4H-吡唑-4-亚基]肼基}-2'-羟基-3-二苯羧酸- 2-氨基 乙醇(1:2) 25mg:本品为白色薄膜衣片,除去包衣后显红色至棕色。 50mg:本品为棕色薄膜衣片,除去包衣后显红色至棕色。
慢性ITP患者的不良反应:恶心、腹泻、呕吐、上呼吸道感染、口咽痛、咽 炎、流感、感觉异常、皮疹、肌痛、背痛。 慢性丙型肝炎伴血小板减少症患者的不良反应:贫血、发热、疲劳、头痛、 恶心、腹泻、食欲缺乏、流感样症状等。 严重不良反应:肝毒性、肝脏失代偿、骨髓网硬蛋白形成、骨髓纤维化、血 栓形成、白内障。
2、肌痛,背痛等疼痛 对于疼痛难耐的情况,按照世界卫生组织制定的三阶梯疼痛的药物治疗方案可供参考: 1)一般疼痛常用阿司匹林、消炎痛、布洛芬,芬必得、扶他林等。 2)中度持续疼痛或疼痛加重,主要用药可卡因、双氢可待因、曲马多、布桂嗪等。 3)强烈持续疼痛,主要用药有吗啡、杜冷丁、芬太尼等。 3、皮疹
阿莫西林EP药典相关杂质
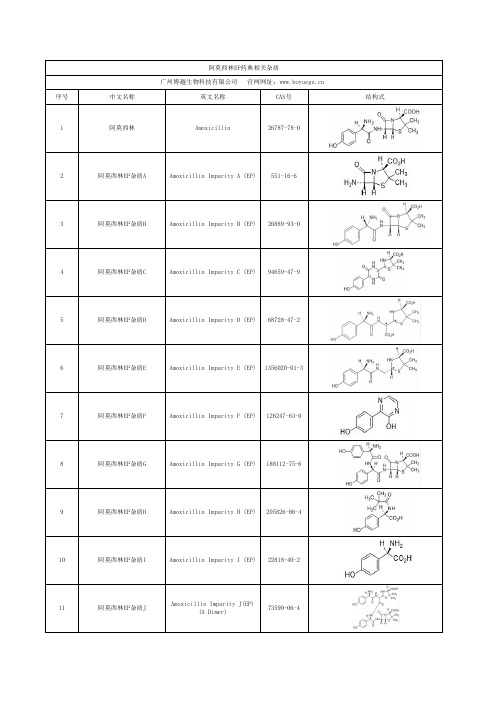
14
阿莫西林杂质M(EP)
N/A
(A Trimer)
15
阿莫西林EP杂质O
Amoxicillin Impurity O(EP)
N/A
16
阿莫西林EP杂质P
Amoxicillin Impurity P(EP)
N/A
17
阿莫西林EP杂质Q
Amoxicillin Impurity Q(EP)
N/A
Amoxicillin Impurity U(EP),
序号 1
中文名称
阿莫西林EP药典相关杂质
广州博越生物科技有限公司 官网网址:
英文名称
CAS号
阿莫西林
Amoxicillin
26787-78-0
结构式
2
阿莫西林EP杂质A
Amoxicillin Impurity A (EP) 551-16-6
3
阿莫西林EP杂质B
Amoxicillin Impurity B (EP) 26889-93-0
Amoxicillin Impurity F (EP) 126247-63-0
8
阿莫西林EP杂质G
Amoxicillin Impurity G (EP) 188112-75-6
9
阿莫西林EP杂质H
Amoxicillin Impurity H (EP) 205826-86-4
10
阿莫西林EP杂质I
Amoxicillin Impurity I (EP) 22818-40-2
Amoxicillin Impurity J(EP)
11
阿莫西林EP杂质J
(A Dimer)
73590-06-4
伊屈泼帕(艾曲波帕)杂质列表集

中文名称
英文名称
CAS
伊屈泼帕(艾曲波 Eltrombopag Olamine 496775-62-3
帕)乙醇胺
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
伊屈泼帕(艾曲波 Eltrombopag Impurity 2
N/A
帕)杂质27
27
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
伊屈泼帕(艾曲波 Eltrombopag Impurity
277299-70-4
帕)杂质35
35
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
伊屈泼帕(艾曲波 Eltrombopag Impurity
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
伊屈泼帕(艾曲波 Eltrombopag Impurity
N/A
帕)杂质13
13
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
伊屈泼帕(艾曲波 Eltrombopag Impurity
N/A
帕)杂质2
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
伊屈泼ቤተ መጻሕፍቲ ባይዱ(艾曲波
Eltrombopag Impurity 3
N/A
帕)杂质3
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
伊屈泼帕(艾曲波 Eltrombopag Impurity 4 15969-09-2 帕)杂质4
艾曲波帕杂质全套对照品

项目报批 纯度高于98%源自艾曲波帕杂质6 Eltrombopag Impurity 6
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
唐 1814- 扬信医药 代理各品种杂质对照品:舒更葡糖钠杂质,达托霉素杂质,依维莫司杂质,他克莫司杂质,阿奇霉素杂质,克拉
志 -064- 维酸钾杂质,红霉素杂质,克拉霉素杂质,林可霉素杂质,罗红霉素杂质,克林霉素杂质,恩曲他滨杂质,艾地那非;
艾曲波帕杂质全套对照品
中文名称
英文名称
CAS
艾曲波帕杂质2 Eltrombopag Impurity 2
N/A
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
艾曲波帕杂质3 Eltrombopag Impurity 3
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
艾曲波帕杂质4 Eltrombopag Impurity 4 15969-09-2
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
艾曲波帕杂质5 Eltrombopag Impurity 5 893736-72-6
10mg 25mg 50mg 100mg 更大规格请咨询
康
-3157 瑞卢戈利杂质,艾康氟康唑杂质等;并提供COA、NMR、HPLC、MS等结构确证图谱;详情请点 用户名 ,谢谢!
扬信医药专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/ STD 等品牌。
恒瑞医药:海曲泊帕获批上市,创新药梯队持续完善

恒瑞医药:海曲泊帕获批上市,创新药梯队持续完善
海曲泊帕获批上市,进入创新药品种丰富期:公司公告,创新药海曲泊帕乙醇胺获得《药品注册证书》,适应症为:(1)用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者;(2)附条件批准治疗免疫抑制治疗疗效不佳的重型再生障碍性贫血成人患者。
海曲泊帕销售峰值有望达到10亿元级别:海曲泊帕乙醇胺片是一种口服非肽类血小板生成素受体(TPO-R)激动剂,可激活TPO-R介导的STAT和MAPK 信号转导通路,促进血小板生成。
同类产品中已经有艾曲泊帕乙醇胺和Avatrombopag在国内上市,2020年艾曲泊帕乙醇胺片全球销售额约为17.38亿美元,国内样本医院销售额7029万元。
艾曲泊帕最常见的严重不良反应是出血,此外易引起肝脏毒性、肝脏损伤和骨髓纤维化。
与艾曲泊帕相比,海曲泊帕进行了一系列结构修饰,临床价值有望更优。
测算后认为海曲泊帕上市后销售峰值有望达到10亿元级别。
公司进入创新药品种快速丰富期:除海曲泊帕外,公司未来数年内有望有多个创新药上市,包括瑞格列汀、恒格列净和SHR6390等进入NDA阶段;SHR-1316、SHR3680、法米替尼、SHR-1701、SHR4640、SHR0302、SHR-1314和SHR-1209等进入临床III期阶段,公司创新药品种将快速丰富,能够有效抵消集采带来的仿制药收入下滑的不利影响。
中长期来看,公司国内创新药研发管线丰富,龙头地位稳固,持续受益于中国创新药市场扩容。
同时通过打造适应全球化布局的创新研发体系,未来若海外创新药取得突破,收入和利润体量天花板有望大幅提升。
安非他酮杂质汇总
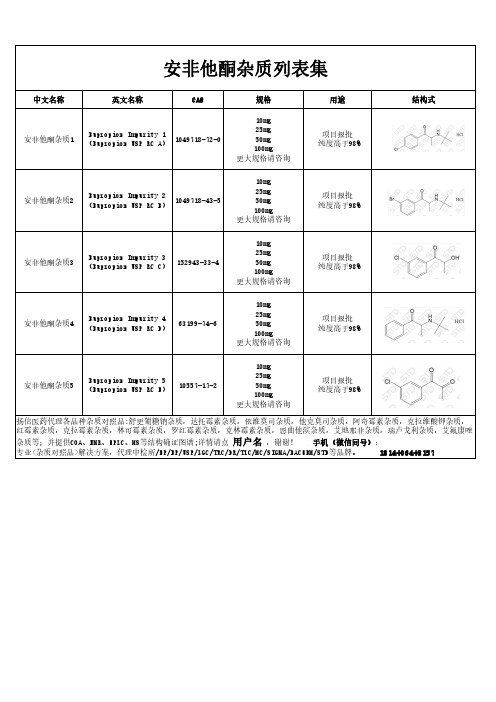
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
安非他酮杂质3 Bupropion Impurity 3 152943-33-4 (Bupropion USP RC C)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
Bupropion Impurity 4 安非他酮杂质4 (Bupropion USP RC D) 63199-74-6
10mg 25mg 50mg 100mImpurity 5
安非他酮杂质5
10557-17-2
(Bupropion USP RC E)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
扬信医药代理各品种杂质对照品:舒更葡糖钠杂质,达托霉素杂质,依维莫司杂质,他克莫司杂质,阿奇霉素杂质,克拉维酸钾杂质, 红霉素杂质,克拉霉素杂质,林可霉素杂质,罗红霉素杂质,克林霉素杂质,恩曲他滨杂质,艾地那非杂质,瑞卢戈利杂质,艾氟康唑
杂质等;并提供COA、NMR、HPLC、MS等结构确证图谱;详情请点 用户名 ,谢谢! 手机(微信同号):
专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌。 1814+064+3157
安非他酮杂质列表集
中文名称
英文名称
CAS
规格
Bupropion Impurity 1
安非他酮杂质1
1049718-72-0
(Bupropion USP RC A)
10mg 25mg 50mg 100mg 更大规格请咨询
高效液相色谱法测定烯丙雌醇片的有关物质

高效液相色谱法测定烯丙雌醇片的有关物质
贾飞;汪卫军
【期刊名称】《中国药业》
【年(卷),期】2009(018)015
【摘要】目的建立烯丙雌醇片的有关物质检查方法 .方法采用高效液相色谱(HPLC)法,色谱柱为Diamonsil C18柱(150 mm×4.6mm,5 μm),流动相为乙腈-水(95:5),检测波长为210 nm,流速为1.5mL/min.结果烯丙雌醇与强制破坏产生的降解产物的杂质峰分离良好,最低检出量为0.81 ng.结论 HPLC法准确、灵敏、专属性强,可用于烯丙雌醇的有关物质检查.
【总页数】2页(P30-31)
【作者】贾飞;汪卫军
【作者单位】浙江省食品药品检验所,浙江,杭州,310004;浙江仙琚制药技术开发有限公司,浙江,杭州,310005
【正文语种】中文
【中图分类】R927.11;R977.1+2
【相关文献】
1.高效液相色谱法测定西咪替丁片的含量及有关物质 [J], 沈丽平
2.高效液相色谱法测定他达拉非片的有关物质 [J], 石笑弋;刘轶
3.高效液相色谱法测定烯丙雌醇片的含量 [J], 成霄;贾飞
4.梯度洗脱高效液相色谱法测定辛伐他汀片的有关物质 [J], 陈霞;罗媛
5.高效液相色谱法测定艾曲波帕片有关物质及含量 [J], 胡蝶
因版权原因,仅展示原文概要,查看原文内容请购买。
艾曲波帕_eltrombopagolamine_

第19卷 第3期2009年6月 总89期中国药物化学杂志C hine se Journa l o f M ed ici na l Che m istryV o l 19 N o 3 p .161Jun 2009Su m 89文章编号:1005-0108(2009)03-0237-01新药信息艾曲波帕(eltrombopag olam ine)英国葛兰素史克公司开发的造血新药艾曲波帕(e-l tro m bopag o la m i ne ,商品名为P rom acta)于2008年11月获得FDA 批准在美国上市,用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后慢性特发性血小板减少性紫癜(I TP )患者的血小板减少[1]。
艾曲波帕的中文化学名称:3 -{(2Z )-2-[1-(3,4-二甲苯基)-3-甲基-5-氧代-1,5-二氢-4H -吡唑-4-亚基]肼基}-2 -羟基-3-联苯基甲酸-2-氨基乙醇盐(1 2);英文化学名称:3 -{(2Z )-2-[1-(3,4-d i m ethy l pheny l )-3-m ethy -l 5-oxo -1,5-di hydro -4H -pyrazo-l 4-y li dene]hydrazi no}-2 -hydroxy -3-biphenylcarboxy-l ic ac i d-2-am inoe t hano l(1 2);分子式:C 25H 22N 4O 4;相对分子质量:564 65;CAS 登记号:496775-61-2。
文献[2-3]报道艾曲波帕的合成路线是以2-溴苯酚为原料,经硝化得2-溴-6-硝基苯酚,经甲基化保护酚羟基,再与4-溴苯硼酸发生偶联反应后脱甲基得到2 -羟基-3 -硝基联苯-4-甲酸,经氢气还原得3 -氨基-2 -羟基联苯基-4-甲酸,再与1-(3,4-二甲苯基)-3-甲基-1H-吡唑-5(4H )-酮反应得到艾曲波帕。
一种艾塞那肽杂质含量的分析方法[发明专利]
![一种艾塞那肽杂质含量的分析方法[发明专利]](https://img.taocdn.com/s3/m/32bdff1b4693daef5ef73dfa.png)
专利名称:一种艾塞那肽杂质含量的分析方法专利类型:发明专利
发明人:代连花,赵慧英,张磊,张林
申请号:CN201710558482.6
申请日:20170711
公开号:CN109239242A
公开日:
20190118
专利内容由知识产权出版社提供
摘要:本发明公开了一种艾塞那肽杂质含量的分析方法,属于药物分析技术领域。
本发明将艾塞那肽及三个特定杂质采用胰蛋白酶酶切,酶切后样品分别采用两种色谱方法进行分离,以外标法计算测定艾塞那肽中杂质[D‑His]‑艾塞那肽、杂质[Double Pro]‑艾塞那肽及杂质[Des‑Gly]‑艾塞那肽含量。
本发明的方法便捷、有效、精准度高,能够有效分离杂质并准确定量。
申请人:齐鲁制药有限公司
地址:250100 山东省济南市高新区新泺大街317号
国籍:CN
更多信息请下载全文后查看。
高效液相色谱法测定艾曲波帕片有关物质及含量

2019年第15期广东化工第46卷总第401期·195·高效液相色谱法测定艾曲波帕片有关物质及含量胡蝶(安徽中医药大学第二附属医院药学部,安徽合肥230001)Determination of Related Substances and Content of Atratropine Tablets by HPLCHu Die(Second Affiliated Hospital of Anhui University of Traditional Chinese Medicine,Hefei230001,China)Abstract:Objective To establish a high performance liquid chromatography method for the determination of related substances and contents of atratropine tablets.Methods Welch C8column was used;0.02mol/L dipotassium hydrogen phosphate buffer solution(pH adjusted to6.5with phosphoric acid)was used as mobile phase A,acetonitrile was mobile phase B;detection wavelength was210nm,column temperature:30℃;flow rate1.0mL/min.Results The concentration of ezeppa has a good linear relationship in the range of90.0~210.0μg/mL,r is0.9998,the average recovery is99.0%,and the RSD is0.5%.Conclusions The method is simple,accurate,reproducible and specific.It can be used for the detection and determination of related substances in Atratropine tablets.Keywords:atratropin;related substances;content determination;HPLC艾曲波帕是一种口服血小板生成素受体激动剂(TPO-RA),通过诱导来自骨髓干细胞的巨核细胞刺激和分化来增加血小板的产生。
《艾曲泊帕乙醇胺片生物等效性研究技术指导原则(2023版)》

2023年8月一、概述 (1)二、人体生物等效性研究设计 (1)(一)研究类型 (1)(二)受试人群 (2)(三)给药剂量 (2)(四)给药方法 (2)(五)血样采集 (2)(六)检测物质 (2)(七)生物等效性评价 (2)(八)其他 (2)三、人体生物等效性研究豁免 (3)四、参考文献 (3)一、概述艾曲泊帕乙醇胺(Eltrombopag Olamine)为小分子血小板生成素(TPO)受体激动剂,艾曲泊帕乙醇胺片临床获批用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的成人和12岁及以上儿童慢性免疫性(特发性)血小板减少症(ITP)患者,使血小板计数升高并减少或防止出血。
本品仅用于因血小板减少和临床条件导致出血风险增加的ITP患者。
本品应在以下产品使用前间隔至少2小时或使用后间隔至少4小时服用,包括抗酸药、富含钙(≥50mg钙)的食物(如乳制品、豆制品(不包括豆奶)、海产品、芝麻、脱水蔬菜等,具体可参考《中国食物成分表》)、或含有多价阳离子(如铝、钙、铁、镁、硒和锌)的矿物质补充剂。
艾曲泊帕乙醇胺片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》等相关指导原则。
二、人体生物等效性研究设计(一)研究类型采用两制剂、两周期、两序列交叉设计,进行空腹和餐后条件下单次给药的人体生物等效性研究。
也可考虑采用平行试验设计。
(二)受试人群健康受试者。
(三)给药剂量建议采用申报的最高规格单片服用。
(四)给药方法口服给药。
(五)血样采集合理设计样品采集时间,使其包含吸收、分布及消除相。
(六)检测物质血浆中的艾曲泊帕。
(七)生物等效性评价以艾曲泊帕的C max、AUC0-t、AUC0-∞作为生物等效性评价指标。
生物等效性接受标准为受试制剂与参比制剂的C max、AUC0-t和AUC0-∞的几何均值比的90%置信区间在80.00%~125.00%范围内。
艾曲波帕片中溶出度方法研究

泊帕片是首个获准治疗成人慢性ITP患者的口服非 肽类TPO受体激动剂,临床前和临床研究显示刺激 本品可升高血小板的骨髓巨核细胞的增生和分化*
本研究参照2015版中国药典,对艾曲波帕片溶出度 方法进行研究,所建立的方法准确、可靠,适用于艾曲
波帕片的溶出度的测定*
1仪器与试药
1.1仪器UV-2450型紫外分光光度仪(日本岛津
公司);RC12A溶出液(黄海药业有限公司);
YP502 -S电子天平(上海精密仪器有限公司)*
1-2试药及试剂艾曲泊帕乙醇胺工作对照品(公
司自制,批号WS0505 - 05 - 01,纯度99- 5% );原研 片(GlaxoSmithKline,批号13008 );艾曲波帕原料(公
司自制,批号:WS0505 -05 -01, WS0505 - 10 -01,
浓度成正比,线性关系良好,回收率平均值在99.3% ~100.1%,RSD在0.15% -1.66%之间。结论建立的溶
出度测定方法具有良好的准确度,可用于测定艾曲波帕片的溶出度。
:关键词]艾曲波帕片;溶出度;紫外分光光度法
[中图分类号]R944. 4 [文章编号]1672-7193 (2020)02-0169-04
2.285
4.571
5.713
9.141
0.139
0.259
0.322
0.512
E=0. 0549C+0. 0094
9 = 0.9998
11.426 0.628
测定上述各稀释液的吸光度,结果见表1*结果表明
本方法在 2- 285mg - mL _1 - 15- 997mg - mL _1 (以艾
曲泊帕计)浓度范围内,艾曲泊帕吸光度与浓度成正
艾曲波帕乙醇胺质量标准

艾曲波帕乙醇胺质量标准一、背景与意义艾曲波帕乙醇胺是一种重要的药物分子,具有改善血小板减少症状、促进凝血等功能,被广泛应用于临床治疗。
由于其对于治疗多种疾病具有不可替代的作用,因此制定严格的质量标准对于保障临床安全、有效用药以及产品的稳定性具有重要意义。
二、化学名称与结构化学名称:4-[5-(2-甲基-1H-吲哚-3-基)戊基]-2-咪唑啉-2-醇结构式:C12H16N4O分子式:240.28三、物理性质艾曲波帕乙醇胺为白色至类白色结晶性粉末,无臭。
其可溶于甲醇、乙醇、DMSO等有机溶剂,不溶于水。
四、鉴别试验1.光谱分析:采用红外光谱(IR)、紫外光谱(UV)和核磁共振(NMR)等方法对艾曲波帕乙醇胺进行结构确证。
2.色谱法:通过高效液相色谱法(HPLC)或气相色谱法(GC)等方法分离纯化样品,根据色谱图中的峰形及保留时间进行鉴别。
五、含量测定采用高效液相色谱法(HPLC)或紫外-可见光光谱法进行含量测定。
以峰面积或吸光度为响应值,通过标准曲线法计算样品含量。
六、杂质限量与纯度要求1.杂质限量:艾曲波帕乙醇胺中可能存在的杂质包括起始原料、中间体等。
根据相关法规和标准,设定杂质限值。
2.纯度要求:艾曲波帕乙醇胺应符合药典对于纯度的要求,如单一杂质不得超过0.5%,总杂质不得超过1.0%。
七、生产工艺与质量控制要点1.生产工艺:艾曲波帕乙醇胺的生产工艺应符合相关法规和标准,包括原料的选择、反应条件、分离纯化等环节。
2.质量控制要点:在生产过程中应严格控制关键质量属性,如原料质量、中间体质量、产品收率等,以确保产品质量稳定。
八、包装、存储与运输要求1.包装:艾曲波帕乙醇胺的包装应符合相关法规和标准,采用适当的材料和容器进行密封包装。
包装标签上应注明品名、规格、批号、生产日期等信息。
2.存储:艾曲波帕乙醇胺应存放在阴凉干燥、通风良好的库房中,避免阳光直射和高温。
同时应定期检查产品的质量稳定性。
3.运输:艾曲波帕乙醇胺在运输过程中应防止受潮、雨淋和污染。
血小板受体激动剂艾曲波帕二乙醇胺的结构和热稳定性分析

第40卷,第10期 光谱学与光谱分析Vol.40,No.10,pp289-2902 0 2 0年1 0月 Spectroscopy and Spectral Analysis October,2020 血小板受体激动剂艾曲波帕二乙醇胺的结构和热稳定性分析马雨璇,戴苏云,王 娜,王 冰,李 钢*南京师范大学分析测试中心,江苏南京 210023摘 要 艾曲波帕二乙醇胺是一种非肽类、小分子的促血小板生成素受体激动剂,已被批准用于治疗肝炎、肝硬化和免疫性血小板减少性紫癜[1-2]。
通过元素分析(EA)、质谱(MS)、核磁共振波谱(NMR)、扫描电子显微分析(SEM)、傅里叶变换红外光谱(FTIR)、差示扫描量热法(DSC)和X射线粉末衍射法(PXRD)等手段对其结构进行表征。
采用X射线粉末衍射原位升温附件与热重-差热联用仪(TG-DTA)对其晶型I进行热稳定性研究。
EA,MS和NMR的检测结果与艾曲波帕二乙醇胺分子结构一致。
扫描电镜表明其微观形貌呈粒子状和片层状且具有较干净的表面。
DSC曲线显示在133.3℃开始出现脱溶峰。
PXRD图谱显示在2θ=5.59°,7.35°,8.16°,11.26°,13.81°,17.02°,22.81°,26.55°处有可用来定性鉴别的特征峰。
艾曲波帕二乙醇胺晶型I在程序升温条件下于167.8~193.5℃和193.5~226.9℃出现两个阶段的失重并伴随着晶型结构的改变。
以上的分析结果为我国仿制药的生产和鉴定提供了较为全面的参考。
关键词 艾曲波帕二乙醇胺晶型Ⅰ;定性分析;X射线粉末衍射;热分析文献标识码:A 文章编号:1000-0593(2020)10-0289-02 收稿日期:2020-03-30,修订日期:2020-07-10 *通讯联系人 元素分析(EA)测得样品中C:57.90%;H:6.83%;N:14.83%,检测结果与样品艾曲波帕二乙醇胺(图1)的分子式相符(C25H22N4O4·2C2H7NO);质谱分析(MS)测得样品的最高质量峰m/z为443.20,为艾曲波帕二乙醇胺样品失去二乙醇胺后的(M+1)峰,与艾曲波帕C25H22N4O4分子量442一致;核磁共振波谱(NMR)的数据如下:1 H NMR(DM-SO-d),δ(ppm):8.21(S,1H),7.89(S,2H),7.82~7.78(T,8H),7.65~7.63(M,4H),7.39~7.37(M,4H),7.06~7.04(M,4H),3.59(T,4H),2.85(T,3H),2.39~2.19(M,6H),13 C NMR(DMSO-d),δ(ppm):170.72,162.15,149.36,139.52,138.64,137.79,137.48,135.83,130.45,130.04,129.28,128.85,127.13,126.47,125.97,119.5,118.57,114.90,58,41.48,19.74,18.76,17.05,与中国专利102448942一致。
艾曲波帕治疗再生障碍性贫血致色素沉着1例报道

艾曲波帕治疗再生障碍性贫血致色素沉着1例报道
田曼雯;陈玲珍;张泳民;艾菁;陈俊腾;甘金莹
【期刊名称】《实用老年医学》
【年(卷),期】2022(36)10
【摘要】再生障碍性贫血(aplastic anemia,AA)是一种危及生命的骨髓衰竭症。
血小板生成素(thrombopoietin,TPO)是一种重要的造血调节因子,血小板生成素受体(thrombopoietin receptor,TPO-R)在造血干细胞上表达。
艾曲波帕(eltrombopag)作为一种口服小分子、非肽类的血小板生成素受体激动剂(TPO-RA),可与TPO-R的跨膜结构域结合,激活下游的JAK/STAT和丝裂原活化蛋白激酶(MAPK)信号通路,促进巨核细胞增殖及分化,最初用于刺激免疫性血小板减少性紫癜(immune thrombocytopenic purpura,ITP)病人的PLT生成。
【总页数】2页(P1075-1076)
【作者】田曼雯;陈玲珍;张泳民;艾菁;陈俊腾;甘金莹
【作者单位】广州医科大学附属市八医院血液内科
【正文语种】中文
【中图分类】R556.5
【相关文献】
1.艾曲波帕在重型再生障碍性贫血治疗中的应用进展
2.艾曲波帕治疗激素治疗无效或激素依赖性儿童免疫性血小板减少症疗效观察
3.艾曲波帕治疗实体瘤化疗后继发再生障碍性贫血的临床研究
4.艾曲波帕与大剂量人免疫球蛋白联合激素治疗儿
童慢性免疫性血小板减少性紫癜的疗效对比5.艾曲波帕联合激素治疗成人原发免疫性血小板减少症有效性及安全性分析
因版权原因,仅展示原文概要,查看原文内容请购买。
