检验原始记录填写
药品检验原始记录的书写

药品检验原始记录的书写药品检验原始记录的书写药品检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料,具有科学性、规范性和可追溯性。
规范检验记录是保证再现实验过程,提高检验工作质量,实现实验室质量方针和质量目标的有效方法,从而提高实验室的核心竞争力,更好地发挥技术支撑和服务社会的功能。
为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,标准正确,数据准确,内容完整、齐全,书写清晰、整洁。
1.3检验依据按国家(中国药典)、部、局颁标准等成册标准检验的,应在检验原始记录中写明标准名称、版本和页数;按单篇标准检验的,应在检验原始记录中写明标准名称并将标准复印件附于检验原始记录最后面;按委托人提供检验资料或有关文献检验的,应在检验原始记录中写明标准名称并将有关资料附于检验原始记录最后面(注册检验资料除外)。
1.4检验过程可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如完全按照检验依据中所载方法,可简略扼要叙述),实验条件(如实验温湿度,仪器名称型号和编号),实验结果(不要照抄标准,而应简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算)和结果判断等均应及时、完整地记录,严禁事后补记或转抄。
如发现记录有误,可用单线划去并保持原有的字迹可辨,不得擦抹涂改,并在修改处签名。
实验结果无论成败(包括必要的复试),均应详细记录。
对废弃的数据或失败的试验,应及时分析原因,并在原始记录上注明。
实验数据有效数位的保留原则上与标准规定的有效数位一致。
1.5检验中使用的标准品或对照品,应记录其来源、批号和对照液的处理过程;用于含量(或效价)测定的,还应注明其含量(或效价)和干燥失重(或水分)(如有含量或水分)。
每个检验项目均应写明标准中规定的限度或范围,根据检验结果做出单项结论(符合规定或不符合规定)。
混凝土施工检验批原始记录填写范例

混凝土施工检验批原始记录填写范例一、项目基本信息项目名称:XX工程施工单位:XX建筑有限公司施工日期:20XX年X月X日二、施工地点地点:XX省XX市XX区XX街道XX号三、检验批信息检验批编号:XX-202X-XXX检验批名称:混凝土施工检验批四、检验批成员检验员:XXX监理员:XXX施工队长:XXX技术负责人:XXX五、检验项目及结果1. 混凝土配合比检验检验项目:混凝土配合比检验结果:符合设计要求,配合比为X:X:X2. 骨料检验检验项目:骨料检验结果:骨料符合规范要求,无明显杂质3. 水泥检验检验项目:水泥检验结果:水泥符合规范要求,标号为XXX4. 砂浆检验检验项目:砂浆检验结果:砂浆符合规范要求,强度达到X MPa5. 混凝土坍落度检验检验项目:混凝土坍落度检验结果:坍落度为X cm,符合设计要求6. 混凝土抗压强度检验检验项目:混凝土抗压强度检验结果:经28天养护,抗压强度达到X MPa,符合设计要求7. 混凝土开裂检验检验项目:混凝土开裂情况检验结果:混凝土无明显开裂,符合规范要求六、施工注意事项1. 混凝土搅拌过程中,应保持搅拌机清洁,避免杂质混入。
2. 施工现场应保持整洁,防止污染混凝土。
3. 混凝土浇筑前,应进行湿润处理,避免过早脱水。
4. 浇筑混凝土时,应采取适当措施防止坍落度过大或过小。
七、总结与签名本次混凝土施工检验批记录完整、准确,符合设计要求和规范要求。
经检验,混凝土质量达到要求,可进行下一步施工工序。
检验原始记录,台帐和检验报告的填写、编制、审核制度

检验原始记录、台账和检验报告的填写、编制、审核制度1. 引言本文档旨在规范检验原始记录、台账和检验报告的填写、编制、审核制度,确保检验工作的准确性、可靠性和规范性。
本制度适用于所有涉及检验工作的部门和人员。
2. 检验原始记录的填写制度2.1 原始记录的定义原始记录是指检验过程中所产生的实际数据、观察记录、操作记录等信息的记录。
原始记录应真实、准确、完整地反映检验过程和结果,并需要在检验完成后立即填写。
2.2 原始记录的填写要求•应使用规定的填写表格或模板进行记录,确保格式统一、便于阅读和理解。
•检验人员应及时填写原始记录,记录内容要详细、具体、清晰,不能有模糊或含糊不清的表述。
•对于涉及测量、测试等数据的记录,应包括测量设备的标识、测量方法、测量结果等信息。
•对于观察记录,应描述所观察到的现象、特征等信息,并可以配合相应的照片、示意图等进行说明。
•原始记录应由检验人员本人填写,禁止代填、抄录或修改他人的记录。
2.3 原始记录的保管和归档•原始记录应妥善保管,确保其完整性和可追溯性。
原始记录应存放在指定的文件柜或电子系统中,并设置访问权限。
•原始记录应按照一定的分类和编号规则进行归档,便于查阅和管理。
•原始记录的归档期限应根据相关法律法规、标准和公司规定进行规定,并按时执行。
3. 检验台账的编制制度3.1 台账的定义检验台账是对进行检验的样品、项目、设备等进行记录和管理的文件。
台账应用于对检验过程中的样品流转、项目进度、设备维护等进行跟踪和监控。
3.2 台账的编制要求•台账应由专人进行编制,确保信息的准确性和时效性。
•台账内容应包括样品编号、样品名称、所属项目、检验进度、检验结果等信息,可以根据需要进行补充。
•台账应定期进行更新,及时记录检验进展和结果,以便于管理人员和相关人员查阅。
•台账应保密,只能由授权的人员查阅和使用,禁止随意传递、抄录或修改。
3.3 台账的保管和归档•台账应妥善保管,确保其完整性和可追溯性。
新规范检验批容量及原始记录填写要点最终
地下卷材防水
M2
卷材的铺贴面积
每100 M2一个点,不少于3个处
砌体工程
M3
1.不超过250M3 2.一层为一个检验批、填充墙可多个、 3.材料类型及同类型材强度等级相同
检验批:多层每层1批高层三层1批,检验批含量不大于250 M3.
每个检验批不少于5处
《砌体结构工程施工质量验收规范》GB50203-2011
项目一:检验批的划分
*
第*页
项目一:检验批的划分
*
第*页
10、混凝土施工检验批: 检验批容量:m³。可根据与施工方式相一致且便于控制施工质量的原则,按工作班、楼层结构、施工缝或施工段划分为若干检验批;
项目一:检验批的划分
*
第*页
11、现浇结构外观及尺寸偏差检验批: 检验批容量:同钢筋安装。可根据与施工方式相一致且便于控制施工质量的原则,按工作班、楼层结构、施工缝或施工段划分为若干检验批;
楼地面垫层
间(M2)
1.多层每层1批高层三层1批 2.走廊、过道10延长米为一间、工业厂房按跨计
检验批:多层每层1批高层三层1批,检验批含量不大于1000 M2.
每个检验批不少于3间 防水要求的不少于4间
项目一:检验批的划分
*
第*页
装修检验批划分
3)有防水要求的建筑地面子分部工程的分项工程施工质量每检验批抽查数量应按其房间总数随机检验不应少于4间,不足4间,应全数检查。 (2)《建筑装饰装修工程施工质量验收规范》GB 50210-2001中规定如下: 4.1.5 抹灰工程的各分项工程的检验批应按下列规定划分: 相同材料、工艺和施工条什的室外抹灰工程每500~1000应划分为一个检验批,不足500也应划分为一个检验批。 相同材料、工艺和施工条什的室内抹灰工程每50个自然间(大面积房间和走廊按抹灰面积30为一间)应划分为一个检验批,不足50间也应划分为一个检验批。 5.1.5 门窗工程的各分项工程的检验批应按下列规定划分: 同一品种、类型和规格的木门窗、金属门窗、塑料门窗及门窗玻璃每100樘应划分为一个检验批,不足100樘也应划分为一个检验批。 同一品种、类型和规格的特种门每50樘应划分为一个检验批,不足50樘也应划分为一个检验批。
检验原始记录书写要求

第一百六十二条 每批药品应当有批记录,包括批生产记录、批包装 记录、批检验记录和药品放行审核记录等与本批产品有关的记录。批 记录应当由质量管理部门负责管理,至少保存至药品有效期后一年。
质量标准、工艺规程、操作规程、稳定性考察、确认、验证、变更 等其他重要文件应当长期保存。
第一百六十三条 如使用电子数据处理系统、照相技术或其他可靠方 式记录数据资料,应当有所用系统的操作规程;记录的准确性应当经 过核对。
灰分)
渣与坩埚的恒重值,计算与结果。(限度规定为≤0.1%时,
结果符合规定,报告“小于0.1%”或“0.1%”)
项目
记录内容
重金属(或铁盐) 采ቤተ መጻሕፍቲ ባይዱ的方法,供试液的制备,标准溶液的浓度和用量,比较结果。
砷盐(或硫化物) 采用的方法,供试液的制备,标准溶液的浓度和用量,比较结果。
异常毒性
小鼠的品系、体重和性别,供试品溶液的配制及其浓度,给药途 径及其剂量,静脉给药时的注射速度,即时反应,小鼠在48小时 内的死亡数,结果判断。
3 中药材:描述药材的形状、大小、色泽、表面、质地、断面、气 味等(附录ⅡB 药材鉴定通则)
4 中成药:描述制剂的色泽、外形,或内容物的色泽、外形,气、 味
项目 溶解度 相对密度
记录内容
天平型号、供试品的称量、溶剂及其用量、测定温度、溶 解情况。
采用的方法:比重瓶法或韦氏比重秤法比重瓶法:比重瓶类 型、天平型号、测定温度、室温、各项称量数据,计算公 式、结果。 韦式比重称法:韦式比重称型号、测定温度、室温、读取 数值(非20℃相对密度为1的比重称)
热原
饲养室及实验室温度,家兔的体重与性别,每一家兔正常体温的 测定值与计算值,供试品溶液的配制(包括稀释过程和所用的溶 剂)与浓度,每1kg体重的给药剂量及每一家兔的注射量,注射后 3小时内每隔30分钟的体温测定值,计算每一家兔的升温值,结 果判断。
产品检验原始记录

产品检验原始记录日期:XXXX年XX月XX日检验员:XXX一、产品基本信息产品名称:XXXXX生产日期:XXXX年XX月XX日生产批次:XXXXX生产线号:XXXXX包装规格:XXXXX二、检验项目和要求序号检验项目检验要求1外观检查外包装应完好无损,内包装应清洁无异味;产品表面应无明显划痕、锈蚀等瑕疵。
2规格尺寸产品尺寸应符合标准规定。
3功能性能产品应具备正常的功能性能,能够满足使用要求。
4安全性能产品应符合相关的安全标准,无伤害人体的物质和设计缺陷。
三、检验步骤和结果1.外观检查-检查外包装:外包装完好无损,无破损,符合要求。
-检查内包装:内包装清洁无异味,符合要求。
-检查产品表面:产品表面无明显划痕、锈蚀等瑕疵,符合要求。
2.规格尺寸-使用测量工具对产品进行测量。
-比较测量结果与标准规定,确认产品尺寸是否符合要求。
3.功能性能-连接电源,进行基本功能测试。
-检查产品是否能够正常工作,是否满足预期的功能要求。
4.安全性能-检查产品是否符合相关的安全标准,如防火性能、电气安全等。
-检查产品是否存在可能伤害人体的物质和设计缺陷。
四、检验结论根据对产品的检验结果进行综合评估1.外观检查:合格2.规格尺寸:合格3.功能性能:合格4.安全性能:合格五、总结与建议经过本次产品检验,产品符合相关的质量标准和要求,具备正常的外观、规格、功能和安全性能。
建议在生产过程中继续保持良好的品质控制,确保产品的稳定性和一致性。
六、备注七、检验员签名:。
检验原始记录填写

检验原始记录填写在科学研究中,原始记录是非常重要的一环。
它们是研究过程中所得到的数据和观察结果的准确记录,并且是其他研究人员和审核机构评估研究结果真实性和可靠性的依据。
因此,正确填写和检验原始记录是科学研究的基石。
首先,原始记录需要包括全面的实验步骤描述。
这包括实验的具体操作过程,所使用的仪器设备、试剂和材料的名称、型号和批号等信息。
完整详细的描述可以帮助其他研究人员或审核机构能够复现实验结果,并且可以排除实验操作上的误差。
其次,原始记录需要准确地记录实验结果。
这包括实验所得到的数值数据、观察到的现象或变化,以及实验过程中出现的异常情况。
数值数据需要以适当的单位进行记录,并保证记录的精确性和准确性。
观察结果需要具体清晰地描述,避免模糊、歧义或主观性的表述。
记录异常情况可以帮助分析实验结果时发现不一致或异常的原因,并且提供必要的解释和说明。
此外,原始记录还需要包括实验环境条件的记录。
例如,实验室温度、湿度,以及其他可能对实验结果产生影响的环境因素。
这些环境条件的记录可以帮助其他研究人员或审核机构评估实验结果的可靠性,并且了解实验过程中可能存在的潜在偏差。
在填写原始记录时,需要注意以下几个方面来保证其准确性和可靠性。
首先,必须确保记录是实时进行的,不允许事后编造或回忆填写。
其次,必须使用清晰、易读的文字和符号,避免模糊或不具体的表述。
再次,必须使用不可改动的记录媒介,如纸质笔记本或电子文档,并且每一页都需要有日期和签名等标识。
最后,必须保护好原始记录的隐私和机密性,只能向涉及的研究人员或审核机构提供,避免泄露和滥用。
在检验原始记录时,可以采取以下几个步骤来确保其准确性和可靠性。
首先,需要进行内部审查,由实验人员或研究团队内部的其他成员来进行检查。
他们需要仔细查看记录的完整性、准确性和连贯性,并提出改进建议和疑问。
其次,可以进行外部审查,由其他独立的专家或审核机构来进行检查。
他们可以对原始记录进行全面评估,发现其中可能存在的问题或疏漏。
检验原始记录【范本模板】
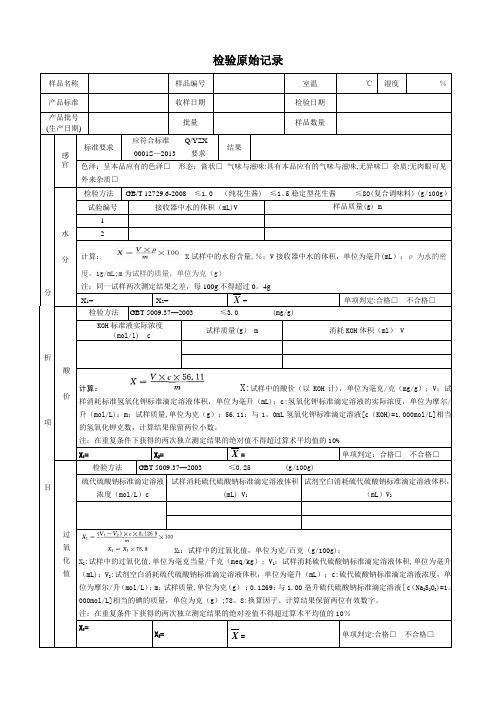
样品名称样品编号室温℃湿度%产品标准收样日期检验日期产品批号(生产日期)批量样品数量分析项目感官标准要求应符合标准Q/YZX0001S—2013 要求结果色泽:呈本品应有的色泽□形态:膏状□气味与滋味:具有本品应有的气味与滋味,无异味□杂质:无肉眼可见外来杂质□水分检验方法GB/T 12729.6-2008 ≤1.0 (纯花生酱) ≤1。
5稳定型花生酱≤80(复合调味料) (g/100g)试验编号接收器中水的体积(mL)V 样品质量(g) m12计算: X试样中的水份含量,%;V接收器中水的体积,单位为毫升(mL);ρ为水的密度,1g/mL;m为试样的质量,单位为克(g)注:同一试样两次测定结果之差,每100g不得超过0。
4gX1= X2= X= 单项判定:合格□不合格□酸价检验方法GBT 5009.37—2003 ≤3.0 (mg/g)KOH标准液实际浓度(mol/l) c试样质量(g) m 消耗KOH体积(ml) V计算:X:试样中的酸价(以KOH计),单位为毫克/克(mg/g);V:试样消耗标准氢氧化钾标准滴定溶液体积,单位为毫升(mL);c:氢氧化钾标准滴定溶液的实际浓度,单位为摩尔/升(mol/L);m:试样质量,单位为克(g);56.11:与1。
0mL氢氧化钾标准滴定溶液[c(KOH)=1.000mol/L]相当的氢氧化钾克数,计算结果保留两位小数。
注:在重复条件下获得的两次独立测定结果的绝对值不得超过算术平均值的10%X1= X2= X= 单项判定:合格□不合格□过氧化值检验方法GBT 5009.37—2003 ≤0.25 (g/100g)硫代硫酸钠标准滴定溶液浓度(mol/L)c试样消耗硫代硫酸钠标准滴定溶液体积(mL) V1试剂空白消耗硫代硫酸钠标准滴定溶液体积,(mL)V2X1:试样中的过氧化值,单位为克/百克(g/100g);X2:试样中的过氧化值,单位为毫克当量/千克(meq/kg);V1:试样消耗硫代硫酸钠标准滴定溶液体积,单位为毫升(mL);V2:试剂空白消耗硫代硫酸钠标准滴定溶液体积,单位为毫升(mL);c:硫代硫酸钠标准滴定溶液浓度,单位为摩尔/升(mol/L);m:试样质量,单位为克(g);0.1269:与1.00亳升硫代硫酸钠标准滴定溶液[c(Na2S2O3)=1。
(医疗药品管理)药品检验原始记录书写范例最全版

(医疗药品管理)药品检验原始记录书写范例
2.2.5气(液)相色谱:如为引用检查或含量测定项下所得的色谱数据,记录可以简略;但应注明检查或含量测定项记录的页码。
同2.6.4气相色谱法和2.6.5高效液相色谱法项下的记录要求。
2.2.6紫外-可见吸收光谱:同2.1.7吸收系数项下的记录要求。
2.2.7红外吸收光谱:记录仪器型号,环境温度与湿度,供试品的预处理和试样的制备方法,对照图谱的来源(或对照品的图谱),并附供试品的红外光吸收图谱。
如常规操作红外图谱与对照图谱不一致时,需详细记录供试品的特殊处理过程。
例:
红外光谱:检验日期:2005.08.05t:28℃RH:65%
按《中国药典》2005年版二部(附录ⅣC)方法检验
仪器型号:AE-240型电子天平(№008)
Avatar330型智能型傅立叶变换红外光谱仪(№074)
供试品(醋酸泼尼松)的制备(压片法):取供试品0.03~0.2mg,置玛瑙研钵中,加入干燥的溴化钾细粉15~20mg,充分研磨混匀,依法压片。
测定:取制成的供试片,目视检查均匀无明显颗粒。
将供试片置于仪器的样品光路中,扣除用同法制成的空白溴化钾片的背景,录制光谱图。
(红外吸收图谱附后见页)。
现场验收检查原始记录填写规范

共
1
页
第
1
页
单位(子单位)
工程名称
杭政储出【2011】37号地块商业办公用房项目兼容公交用地项目
检验批名称
钢筋连接检验批质量验收记录
检验批编号
005
编号
验收项目
验收部位
验收情况记录
备注
1
纵向钢筋的连接
(1~7)×(H~X)轴第一道支撑及围檩
全数检查,钢筋采用直螺纹套筒连接及焊接连接,接头率为50%,符合设计要求。
4
焊接连接的外观质量
(1~7)×(H~X)轴第一道支撑及围檩
焊接连接:外观满足要求
监理校核:
检查:
记录:
验收日期:
年 月ቤተ መጻሕፍቲ ባይዱ日
共计接头数量约为200个,接头位置正确,符合设计和规范要求。
2
机械连接和焊接接头百分率
(1~7)×(H~X)轴第一道支撑及围檩
全数检查直螺纹套筒及焊接接头,连接接头率为50%,符合设计要求。
3
机械连接的外观质量
(1~7)×(H~X)轴第一道支撑及围檩
全数检查,接头百分率为50%,符合设计要求。Φ16搭接长度为75cm,符合设计和规范要求。
2
机械连接的力学性能
(1~7)×(H~X)轴第一道支撑及围檩
现场随机截取试件一组进行接头力学试验。结果合格。试验报告编号:Z23
3
焊接连接的力学性能
(1~7)×(H~X)轴第一道支撑及围檩
现场随机截取试件一组进行接头力学试验。结果合格。试验报告编号:Z15
1
接头位置和数量
(1~7)×(H~X)轴第一道支撑及围檩
药品检验原始记录书写范例

药品检验原始记录书写范例药品检验原始记录书写范例药品检验是保证药品质量的重要手段,而药品检验原始记录是整个检验过程中重要的一环,对药品的质量控制起着至关重要的作用。
药品检验原始记录必须规范、准确地记录检验结果和检验过程,本文将给出药品检验原始记录书写的范例,以供参考。
1. 各项基本信息的书写药品检验记录中各项基本信息的填写要准确无误,包括药品名称、检验日期、制造厂家、批号、规格、批量、样品编号等。
对于样品批量和批号,即使是重复检验,也必须保持一致。
2. 检验方式当前,药品检验中主要采用荧光分析、气相色谱、液相色谱等方法。
在记录时,需要详细描述采用的检验方法,并注明方法文献的名称、版本和出版日期等信息。
3. 检验设备及工艺药品检验过程中,不同的设备和工艺会对检验结果起着不同的影响,在记录时,必须精准描述检验设备及工艺,如仪器型号、检验温度、检测条件、操作流程等信息。
4. 质量控制进行药品检验时,必须采取质量控制措施,以保证检验结果的精准和准确性。
在记录时,应该详细描述质量控制措施,如内部标准品的采用、浓度的计算及稀释、样品加标、纯化、净化等过程记录。
5. 检验结果药品检验原始记录中检验结果的书写要准确明确,包括结果计算和评价,不合格样品的处理等内容。
对于结果计算,应该详细描述计算过程、计算式的来源和计算结果的含义,对于不同的检验项目,结果评价标准有所不同,必须在记录中明确说明。
6. 仪器及设备校准记录药品检验过程中,仪器及设备的准确性对于检验结果的准确性起着关键作用,因此,周密的校准记录非常重要。
在记录仪器及设备校准时,应该写明校准标准品的来源、浓度以及校准时的操作流程和结果。
7. 附加信息药品检验原始记录中,有些信息不属于必要信息,但是包含这些信息能够使检验结果更可靠、实用。
如样品的来源、样品的保存条件、样品采集时间等。
总的来说,药品检验原始记录的书写要准确、规范,必须包含所有必备信息,同时,需要增加一些附加信息以便于后续分析和判断。
检验原始记录填写

1.2检验项目的记录
1.4 折光率:记录仪器型号,温度,校正用物,3次测定 值,取平均值报告。 1.5 熔点:记录采用第×法,仪器型号或标准温度计的编 号及其校正值,除硅油外的传温液名称,升温速度;供试 品的干燥条件,初熔及全熔时的温度(估计读数到0.1℃), 熔融时是否有同时分解或异常的情况等。每一供试品应至 少测定2次,取其平均值,并加温度计的校正值;遇有异 常结果时,可选用正常的同一药品再次进行测定,记录其 结果并进行比较,再得出单项结论。(如用仪器自动读书 的情况,根据仪器操作规程正确记录数据)
1.2检验项目的记录
4.5高效液相色谱法:记录仪器型号,检测波长,色谱柱与 柱温,流动相与流速,内标溶液,供试品与对照品的称量 (平行试验各2份)和溶液的配制过程,进样量,测定数据, 计算式与结果;并附色谱图。如标准中规定有系统适用性试 验者,应记录该试验的数据(如理论板数,分离度,校正因 子的相对标准偏差等)。 4.6氨基酸分析:除应记录高效液相色谱法的内容外,尚应 记录梯度洗脱的情况。
1.2检验项目的记录
3.11 微生物限度:记录供试液的制备方法(含预处理方法)后, 再分别记录:(1)细菌数记录各培养皿中各稀释度的菌落数, 空白对照平皿中有无细菌生长,计算,结果判断;(2)霉菌数 和酵母菌数分别记录霉菌及酵母菌在各培养皿中各稀释度的菌 落数、空白对照平皿中有无霉菌或酵母菌生长,计算,结果判 断;(3)控制菌记录供试液与阳性对照菌增菌培养的条件及结 果,分离培养时所用的培养基、培养条件和培养结果(菌落形 态),纯培养所用的培养基和革兰氏染色镜检结果,生化试验 的项目名称及结果,结果判断;必要时,应记录疑似菌进一步 鉴定的详细条件和结果。
效数字取舍和结论。
1.2检验项目的记录
药物检验原始记录的格式大全

一、化学鉴别法药品检验原始记录检品名称:检验日期:批号:规格:【鉴别】/结果:□呈正反应□不呈正反应结论:□符合规定□不符合规定检验者: 复核者: 第页二、TLC鉴别法药品检验原始记录检品名称:检验日期:批号:规格:[鉴别]供试品溶液的制备:对照品(或对照药材、对照提取物)溶液的制备:对照物质来源:□均为中国药品生物制品检定所提供□其他:No:薄层色谱条件与结果详见附图()。
结论:□符合规定□不符合规定(规定:在供试品色谱中,在与对照品(或对照药材、对照提取物)色谱相应位置上,显相同颜色的斑点。
)检验者: 复核者: 第页三、TLC图薄层色谱检验记录图号:检品名称:检品编号: 检验日期:天气:室温:湿度:薄层板:展开温度:展开剂:显色剂及检视方法:点样量( l):点样顺序: 1 2结论:检验者: 复核者: 第页四、 相对密度药品检验原始记录检品名称: 检品编号: 检验日期: 规格: 批号 室温: 湿度: 相对密度(比重瓶法)照相对密度测定法(中国药典2010年版A V I AV II 二部附录一部附录)测定。
测定方法: □比重瓶法 □韦氏比重称法 (规定测定温度为20℃)。
天平: 实验温度: 空瓶重(W 1): 瓶+供试品重(W 2): 供试品重(W 2-W 1): 瓶+水重(W 3): 水重(W 3-W 1):结果计算:计算公式:相对密度 = 水重量供试品重量结论: (规定 ) 检验者: 复核者: 第 页五、PH值测定法药品检验原始记录检品名称:检品编号: 检验日期:批号:规格:温度:湿度:pH值照pH值测定法(《中国药典》2010年版一部附录VII G)测定。
仪器:校正仪器用标准缓冲液:邻苯二甲酸氢钾标准缓冲液(pH4.00)磷酸盐标准缓冲液(pH6.86)其它:供试品溶液的制备:pH值测定结果:结论:□符合规定□不符合规定(规定: ) 检验者: 复核者: 第页六、重量差异检查之一药品检验原始记录检品名称:检验日期:批号:规格:重量差异按《中国药典》2010年版一部附录I D片剂项下检查法取供试品20片,分别精密称定每片的重量。
如何完整准确填写原始记录?

如何完整准确填写原始记录?在样品记录中应具体包含全部的样品信息,在检测记录中可只记录样品名称和试验室样品唯一性编号,以及样品到达试验室后的处置记录。
三、依据的检测方法的填写在不引起混淆的状况下,可只记录方法的标准及发布年号或依据的文件名称、编号及发布年号。
假如要记录试验室标准操作规程,此时可只记录名称、文件编号及版本号。
当依据的文件中规定有多个方法时,应精确记录方法名称或章条号,确保方法依据的唯一性。
四、仪器设备及标准物质填写1、记录主要的直接出具数据的关键设备,假如试验室认为其他设备也很重要,也应记录。
通常,应记录使用的仪器设备名称、仪器设备的唯一性编号,必要时还应记录量值溯源信息;2、记录所使用的标准物质及质控物质的名称、有证标准物质的编号及其有效期,标准溶液的标准值及有效期,必要时还要记录储备液的有效期、使用液的有效期。
五、重要配件试剂药品和工具填写必要时,应记录检测中使用的重要配件(如色谱柱及其规格型号)、对检测结果有直接影响的重要试剂药品和工具等。
检测记录设计人员应对这些内容进行识别,确保不会漏记,必要时可与有关人员争论确定。
六、环境条件填写检测方法对环境条件有要求,试验室要记录检测当时的环境条件。
记录环境条件的目的是为了证明检测当时的环境条件满意方法标准的要求。
因此,检测人员在检测开头前,应经过对环境条件满意方法要求的推断,确认满意要求之后记录。
七、检测过程记录1、通常,检测依据的方法文件中对过程有具体的规定,试验室应用简略的、规律严密的文字记录实际检测操作过程,用以证明检测过程满意依据文件的要求。
示例:某方法文本要求样品在烘箱中(105+5)℃条件下烘干2h。
试验室应记录烘干开头时间、烘干结束时间、开头的温度、中间温度、烘干结束温度5个数据,用以证明烘干过程满意方法要求。
2、设计过程记录表单时,可将文字描述部分固定,留出数字空白处,检测人员在记录时,只需填写数据即可。
通常,至少在一段时间内,仪器设置的条件记录不会转变,这些记录可固定。
检验批原始记录填写范例

检验批原始记录填写范例一、记录表格的基本信息在填写检验批原始记录之前,首先需要填写记录表格的基本信息,包括产品名称、生产日期、检验批号、检验日期等。
这些基本信息能够帮助我们准确标识每个检验批的信息,方便后续的追溯和管理。
二、检验项目的填写在记录表格中,需要列出每个检验项目的名称和要求。
检验项目可以根据产品的特点和生产过程的要求进行选择,常见的检验项目包括外观质量、尺寸精度、物理性能等。
对于每个检验项目,需要填写相应的要求,例如外观质量可以要求产品表面无划痕、无凹陷等。
三、检验结果的填写在填写检验结果时,需要根据实际的检验情况填写合格或不合格。
如果检验项目符合要求,则填写合格,否则填写不合格。
对于不合格的检验项目,还需要填写具体的不合格情况和处理措施,例如是否需要返工或报废等。
四、检验记录的签字确认为了确保检验记录的真实性和可靠性,每个检验批的记录都需要进行签字确认。
在填写检验记录之后,相关负责人员需要在记录表格上签字确认,并注明签字日期。
这样可以确保检验记录的责任人和时间,方便后续的追溯和审核。
五、检验记录的保存填写完成的检验批原始记录需要及时保存,以备后续的查阅和分析。
通常情况下,检验记录会按照一定的时间周期进行归档,例如每月或每季度进行一次归档。
这样可以方便管理人员快速查找相关的检验记录,进行统计和分析。
六、检验批原始记录的用途检验批原始记录的填写范例不仅仅是为了满足管理要求,更重要的是为了确保产品的质量和安全。
通过记录每个检验批的检验结果,可以及时发现生产过程中的问题和不足,进而采取相应的措施进行改进。
同时,检验批原始记录还可以作为生产过程中的重要参考,为后续的质量管理和产品追溯提供依据。
通过以上的范例内容,希望读者能够了解到检验批原始记录的填写要点和基本流程。
只有做好检验批原始记录的填写工作,才能够确保产品质量的稳定和可靠,提升企业的竞争力和口碑。
最后,希望读者能够在实际工作中灵活运用这些知识,做好产品质量的管理和控制。
检验原始记录

生产日期: _____________________ 抽样时间: _____________________ 脂肪透明或呈乳白色。
腊肉制品检验原始记录
样品名称: ________________________ 生产日期: ______________________________ 样品批量: ________________________ 抽样时间: ______________________________
1、感官:□符合□不符合 色泽:色泽鲜明,肌肉呈现红色,脂肪透明或呈乳白色。
□符合□不符合 滋味与气味:具有本品固有的滋味及气味 □符合□不符合 组织形态:质紧密而坚实,切面平整。
□符合□不符合
腊肉制品检验原始记录
样品名称: _______________________
样品批量:
5、感官:□符合□不符合
色泽:色泽鲜明,肌肉呈现红色,
□
符合□不符合
滋味与气味:具有本品固有的滋味及气味 组□符合□不符合
□符合□不符合
检验:___________________ 检验日期:
检验:___________________ 检验日期: ______________________________________。
检验原始记录
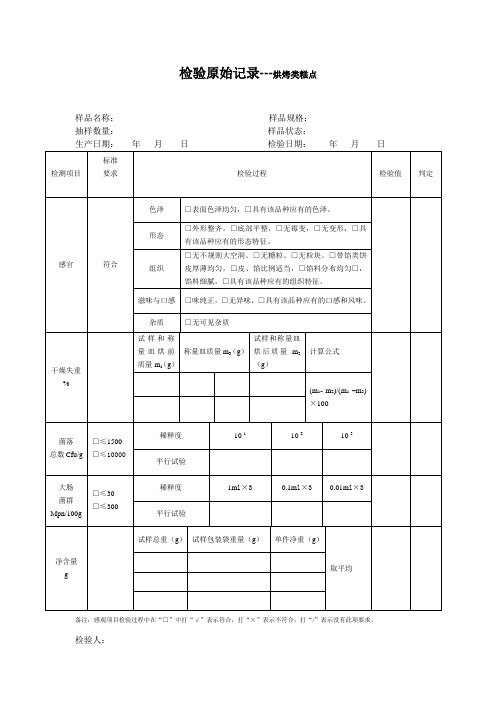
□≤30
□≤300
稀释度
1ml×3
0.1ml×3
0.01ml×3
平行试验
净含量
g
试样总重(g)
试样包装袋重量(g)
单件净重(g)
取平均
备注:感观项目检验过程中在“□”中打“√”表示符合,打“×”表示不符合,打“/”表示没有此项要求。
检验人:
检验原始记录---油炸类糕点
样品名称:样品规格:
菌群Mpn/100g
□≤30
□≤300
稀释度
1ml×3
0.1ml×3
0.01ml×3
平行试验
净含量
g
试样总重(g)
试样包装袋重量(g)
单件净重(g)
取平均
备注:感观项目检验过程中在“□”中打“√”表示符合,打“×”表示不符合,打“/”表示没有此项要求。
检验人:
检验原始记录---面包
样品名称:样品规格:
滋味与口感
□味纯正,□无异味,□具有该品种应有的口感和风味。
杂质
□无可见杂质
干燥失重
%
试样和称量皿烘前质量m1(g)
称量皿质量m3(g)
试样和称量皿烘后质量m2(g)
计算公式
(m1- m2)/(m1–m3)×100
菌落
总数Cfu/g
□≤1500
□≤10000
稀释度
10-1
10-2
10-3
平行试验
大肠
抽样数量:样品状态
生产日期:年月日检验日期:年月日
检测项目
标准
要求
检验过程
检验值
判定
感官
符合
色泽
□表面色泽均匀,□具有该品种应有的色泽特征。
检验批原始记录的填写要求

检验批原始记录的填写要求《说说检验批原始记录的那些事儿》嘿,朋友们!今天咱来聊聊这检验批原始记录的填写要求。
这可真是个有点门道又得讲究的事儿呢!咱先说说为啥要重视这玩意儿吧。
就好比你搭积木,要是底层没搭稳,那上面就算堆得再漂亮,一推就倒啦。
这检验批原始记录就像是建筑的基石,它得扎实可靠,才能让后面的工作顺顺利利的呀。
要说这填写要求,那可得仔细着点儿。
就像你出门前穿衣服,不能这儿扣错扣子,那儿鞋带没系好。
每个细节都得照顾到。
首先呢,字迹得清楚,别写得龙飞凤舞跟医生开的处方似的,回头自己都认不出来可就麻烦啦。
还有啊,数据得准确。
这可不是能随便糊弄的事儿,不是说差不多就行。
那可不行,得精确到小数点后几位,这叫严谨!想象一下,要是你做菜,盐放多放少都无所谓,那做出来的菜能好吃吗?同理呀,这数据要是不准确,后面的工程质量能有保障吗?你说这填写过程中有没有遇到过啥头疼的事儿?嘿嘿,那肯定有啊。
有时候写着写着就走神了,回过神来都不知道自己写到哪儿了。
这时候就得拍拍自己脑袋,清醒清醒,重新集中注意力。
还有,有时候会碰到一些复杂的数据或者情况,那可得绞尽脑汁去想怎么写才能既清楚又准确。
然后呀,就是时间得写对。
这就像你约朋友见面,可不能把时间记错了,不然朋友等半天不见你人影,那多不好呀。
检验批原始记录的时间也是一样重要,得如实记录,不能瞎编乱造。
怎么样,听我这么一说,是不是觉得这检验批原始记录的填写要求还挺有意思的。
虽然有点麻烦,但是只要我们认真对待,按照要求一步一个脚印地来,就肯定能把它填好。
这样,咱的工程质量才有保障,大家心里也踏实呀。
总之呢,对待这检验批原始记录可不能马虎,要像对待宝贝一样精心呵护。
只有这样,我们才能在工程这条大道上稳稳地走下去,做出高质量的好活儿来!让我们一起加油吧,把这检验批原始记录填写得杠杠的!。
检验原始记录填写

环境湿度
记录检验时的环境湿度,确保符合检 验方法的湿度要求。
环境清洁度
描述检验环境的清洁程度,确保样品 不受污染。
环境安全措施
说明检验环境中采取的安全措施,如 通风、fire extinguisher等。
检验过程
样品处理
详细描述样品的处理过程,如前处理、破碎、 溶解等。
操作步骤
按照检验方法的要求,详细记录每一步的操 作过程。
检验原始记录的法规要求
符合国家法律法规和相关标准的要求 ,确保检验原始记录的合法性和规范 性。
遵循行业主管部门和认证机构的指导 文件,确保检验原始记录满足相关要 求和标准。
检验原始记录的填写原则
• 实时记录:在检测或校准活动进行过程中,应实时、准确地记录原始数据和信息,避免事后补记或篡改。 • 客观真实:检验原始记录应客观真实地反映检测或校准过程,不夸大、不修饰,确保数据的可靠性和准确性。 • 规范整洁:检验原始记录的填写应规范、整洁,易于阅读和识别,避免因字迹潦草或涂改导致信息混淆或无法
表格中的数据应按照一定的顺序排列,如按照时间顺序或按照项目 分类等。
表格填写完整
表格中的每一项都应填写完整,不得遗漏或忽略任何重要信息。
图示绘制规范
图示清晰易懂
图示应清晰易懂,能够直观地表达检验结果和数据变 化趋势。
图示准确
图示中的数据和标注应准确无误,不得有任何错误或 偏差。
图示规范统一
图示的绘制应遵循统一的标准和规范,确保图示的可 读性和可比性。
理化检验原始记录填写示例
检验项目:水分含量 检验方法:干燥法
样品名称:粮食
理化检验原始记录填写示例
01
样品编号:789012
02
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.性状:应根据检验中观察到的情况如实描述药品
的外观,不可照抄标准上的规定。如标准规定其外
观为“白色或类白色的结晶或结晶性粉末”,可依
观察结果记录为“白色结晶性粉末”。标准中的臭
味和引湿性(或风化性)等,一般可不予记录,但遇
异常时,应详细描述。
1.1溶解度:应详细记录供试品的称量、溶剂及其用
量、温度和溶解时的情况等。
效数字取舍和结论。
.
10
1.2检验项目的记录
检验项目的记录:先写明检验项目名称。项目名称 应规范,不得采用习语。可依实验的先后依次记录 各检验项目,最后应对该项目的检验结果给予明确 的结论。除满足上述要求外,所有检验项目的记录 内容,实验人员应如实填写详细记录实验现象和数 据。
.
11
1.2检验项目的记录
规程中所载的检验方法检验,并全部记录),如有特殊要求的
检验,根据要求记录实验条件(如实验温度、压力等),观察
到的现象(不要照抄标准,而应是简要记录检验过程中观察到
的真实情况,遇有反常的现象,则应详细记录,以便后期作为
参考和查阅的依据)。
.
7
1.1基本要求
5.2实验数据,计算(注意有效数字和数值的修约及其运算)和 结果判断等;均应及时完整地记录,严禁事后补记或传抄。如 发现记录有误,可用单线划去并保持原有的字迹可辨,不得擦 抹涂改,并应在修订处签名或盖章,以示负责。检验或试验结 果,无论成败(包括必要的复试),均应详细记录、保存。对 废弃的数据和失败的实验。应及时分析其可能的原因,并在原 始记录上注明。
.
4
1.1基本要求
3.检验过程中应及时记录所用仪器型号、仪器编 号,所用试液、试剂的名称、批号。且不得空页 或空项,空页、空项不需填写时用横线划掉。检 验中使用的标准品或对照品,应记录其来源、批 号和使用前的处理;用于含量(或效价)测定的, 应注明其含量(或效价)和干燥失重(或水分)。
.
5
1.1基本要求
.
8
1.1基本要求
6.同品种多批号检品连续进行检验时,如紫外分光光度法进行 含量测定中,使用同一对照品(标准品),其对照溶液的制备 (前处理、称量、稀释过程)及吸收度值、标准曲线等;如高 效液相色谱法用以进行药品的含量检验中,对照溶液的配制及 其图谱等,凡属上述情况之一者,均可只详细记录一个批号的 情况,并在其余批号上以同样的情况体现。
.
31
2.药品检验报告单的表头栏目及其填写说明
1.报告单编号方法:
1.1检验报告单编号为产品或物料代码加7位年月流水号,年月为报告单出具的
.
12
1.2检验项目的记录
1.2相对密度:进行此项检查,应记录采用的方法 (比重瓶法或韦氏比重瓶法)、测时的温度、测定 值、计算公式及结果。 1.3比旋度:记录仪器型号,测定时的温度,供试品 的称样量及其干燥失重或水分,供试液的配制,旋 光管的长度,零点(试仪器的检验特点而定)和供试 液旋光度的测定值各3次的读数,取其平均值,计算 比旋度等。
操作方法,干燥或灼烧的温度,滤器(或坩埚)的恒重值,
沉淀物或残渣的恒重值,计算式与结果。
.
26
1.2检验项目的记录
4.3紫外分光光度法:记录仪器型号,检查溶剂是否符合要 求的数据,吸收池的配对情况,供试品与对照品的称量(平 行试验各2份)其及溶解和稀释情况,核对供试品溶液的最 大吸收峰波长是否正确,狭缝宽度,测定波长及其吸收度 值(或附仪器自动打印记录),计算式及结果。必要时应记 录仪器的波长校正情况。
.
25
1.2检验项目的记录
4.1容量分析:记录供试品的称量(平行试验2份),简要
的操作过程,指示剂的名称,滴定液的名称及其浓度
(mol/L),消耗滴定液的毫升数,空白试验的数据,计算
式与结果。电位滴定法应记录采用的电极;非水滴定要记
录室温;所用的滴定管与移液管均应记录其校正值。
4.2重量分析:记录供试品的称量(平行试验2份),简要的
.
18
1.2检验项目的记录
3.检查:一般检查项目,只取一份供试品依法进行检查。检查 结果为不符合规定或边缘产品时,按《实验室数据调查管理》 进行调查。规定以一次检查结果为准的项目,不得复试。 3.1薄层色谱(或纸色谱):记录室温及湿度,薄层板所用的吸附 剂(或层析纸的预处理),供试品的预处理,供试液与对照液的 配制及其点样量,展开剂、展开距离、显色剂,色谱示意图; 必要时,计算出Rf值。
.
21
1.2检验项目的记录
3.7水份(费休氏法):记录实验室的湿度,供试品的称量(平行 试验3份),消耗费休氏试液的毫升数,费休氏试液标定的原始 数据(平行试验3份),计算式与结果,以平均值报告。
3.8炽灼残渣、灰分:应记录坩锅恒重量,取样量,炽灼温度, 炽灼后残渣与坩锅的恒重量,结果计算。
.
22
.
20
1.2检验项目的记录
3.5氯化物、硫酸盐、铁盐、重金属、砷盐等:记录采用的方法, 标准溶液的浓度和用量,供试品溶液的制备,比较结果。必要 时应记录供试品溶液的前处理方法。 3.6干燥失重:可只做一份;必要时应同时作两份,取平均值。 记录分析天平的型号,干燥条件(包括温度、真空度、干燥剂名 称、干燥时间等),各次称量(失重为1%以上者应作平行试验2份) 及恒重数据(包括空称量瓶重及其恒重值,取样量,干燥后的恒 重值)及计算等。
4.检验记录中,应首先记录样品的名称、批号、 送检时间等相关样品信息,写明检验的依据。凡 按中国药典、地方药品标准或国外药典检验者, 应列出标准名称,版本和页数;凡按公司内控质 量标准检验,应列出标准名称或其编号。
.
6
1.1基本要求
5.
5.1检验过程中,可按检验顺序依次记录各检验项目,内容包括:
项目名称、检验日期,操作方法(应完全按照该品种检验操作
.
13
1.2检验项目的记录
1.4 折光率:记录仪器型号,温度,校正用物,3次测 定值,取平均值报告。 1.5 熔点:记录采用第×法,仪器型号或标准温度计 的编号及其校正值,除硅油外的传温液名称,升温速 度;供试品的干燥条件,初熔及全熔时的温度(估计读 数到0.1℃),熔融时是否有同时分解或异常的情况等。 每一供试品应至少测定2次,取其平均值,并加温度计 的校正值;遇有异常结果时,可选用正常的同一药品 再次进行测定,记录其结果. 并进行比较,再得出单项 14
.
27
1.2检验项目的记录
4.4气相色谱法:记录仪器型号,检测器及其灵敏度,色谱 柱长与内径,柱填料与固定相,载气和流速,柱温,进样 口与检测器的温度,内标溶液,供试品的预处理,供试品 与对照品的称量(平行试验各2份)和配制过程,进样量,测 定数据,计算式与结果;并附色谱图。标准中如规定有系 统适用性试验者,应记录该试验的数据(如理论板数,分离 度,校正因子的相对标准偏差等)。
检验原始记录填写、报告编写与保存
化验室
.
1
1 原始记录的填写 报告的编写 2
3 保存
.
目 录
2
原始记录的填写
.
3
1.1基本要求
1.药品检验原始记录必须原始、真实、完整清晰,易读,不 易擦除。原始记录应使用蓝黑墨水的钢笔或碳素笔书写。凡 用微机打印的原始数据及图谱应签注操作者姓名、日期。
2.检验人员在检验前应仔细核对检品标签信息与请验单内容 是否相符,并逐一记录规格、批号等原始记录中的必要信息。 出现检品标签信息与请验单内容不符时应及时和送样人员沟 通。
.
9
1.1基本要求
7.每个检验项目均写明标准中规定的限度或范围,根据检验结
果作出单项结论(呈正反应或不呈正反应,符合规定或不符合
规定),并签署检验者的姓名。
8记录整理
各检验项目的最终检验结果的有效数位按《有效数字和数值的
修约及运算标准操作规程》处理。
9.记录复核:复核人复核检品信息、文字书写、数据计算、有
.
28
1.2检验项目的记录
4.5高效液相色谱法:记录仪器型号,检测波长,色谱柱与 柱温,流动相与流速,内标溶液,供试品与对照品的称量 (平行试验各2份)和溶液的配制过程,进样量,测定数据, 计算式与结果;并附色谱图。如标准中规定有系统适用性试 验者,应记录该试验的数据(如理论板数,分离度,校正因 子的相对标准偏差等)。 4.6氨基酸分析:除应记录高效液相色谱法的内容外,尚应 记录梯度洗脱的情况。
1.2检验项目的记录
1.6 吸收系数:记录仪器型号与狭缝宽度,供试品的
称量(平行试验2份)及其干燥失重或水分,溶剂名称与
检查结果,供试液的溶解稀释过程,测定波长(必要时
应附波长校正和空白吸收度)与吸收度值(或附仪器自
动打印记录),以及计算式与结果等。(或根据仪器的
自身特点进行相关的数据记录)
.
15
.
29
报告的编写
01 药品检验报告的定义 02 药品检验报告单的表
和规范名称
头栏目及其填写说明
03 药品检验报告中检验 项目的编排与格式
药品检验报告书中各 04 项检测项目的书写要
求
05 检验报告书的结论
06 检验报告的签名
.
30
1.药品检验报告的定义和规范名称
1.“××××检验报告”系指本公司出具对某一药品检 验结果的正式凭证。 2“检验报告连同检验记录”系指本公司内部留存的上 述正
3.11 微生物限度:记录供试液的制备方法(含预处理方法)后,
再分别记录:(1)细菌数记录各培养皿中各稀释度的菌落数,空
白对照平皿中有无细菌生长,计算,结果判断;(2)霉菌数和酵
母菌数分别记录霉菌及酵母菌在各培养皿中各稀释度的菌落数、
空白对照平皿中有无霉菌或酵母菌生长,计算,结果判断;(3)
控制菌记录供试液与阳性对照菌增菌培养的条件及结果,分离
