第03章 酶
生化理论课_第03章酶

物之间的非共价键相互作用(假说)。
3
Peter B. Moore 1940-
1981,Cech,I 型内含子是自我剪接的。 RNA也可以是高效的生物催化剂(核酶)。
辅基 (proБайду номын сангаасthetic group): 与酶蛋白结合紧密,不能用透析或超 滤的方法除去。
9
金属离子作为辅助因子
➢ 金属酶(metalloenzyme) 金属离子与酶结合紧密,提取过程中不 易丢失。
➢金属激活酶(metal-activated enzyme) 金属离子为酶的活性所必需,但与酶的结 合不甚紧密。
1994,Joyce,人工合成的单链DNA具有催化活性 (脱氧核酶)。
2000,Moore,核糖体是核酶。 蛋白质合成的最关键步骤(肽键形成)是由 RNA催化的。
4
本章的主要内容
酶的分子结构与功能 酶促反应的特点与机制 酶促反应动力学 酶的调节 酶的命名与分类 酶与医学
5
第一节 酶的分子结构与功能
10
辅助因子的作用
辅助因子决定反应的种类与性质 酶蛋白决定反应的特异性
➢ 金属离子 稳定酶的构象(少见) 参与催化反应,传递电子(超酸催化剂) 在酶与底物间起桥梁作用(配位键) 中和阴离子,降低反应中的静电斥力
➢小分子有机化合物 在反应中起运载体的作用,传递电子、质子或
其它基团。
11
小分子有机化合物作为辅助因子
物质,称为辅酶 (coenzyme)。
医学生物化学 第03章 酶 习题

1. 下列有关辅酶与辅基的论述,错误的是: ( D ) 下列有关辅酶与辅基的论述,错误的是: A. 辅酶与辅基都是酶的辅助因子 B. 辅酶以非共价键与酶蛋白疏松结合 C. 辅基以共价键与酶蛋白牢固结合 D. 不论辅酶或辅基都可以用透析或超滤的方法除去 E. 辅酶和辅基的差别在于它们与酶蛋白结合的紧密程度与反应方式不同。 辅酶和辅基的差别在于它们与酶蛋白结合的紧密程度与反应方式不同。 2.关于全酶,正确的说法是: ( E ) 关于全酶, 关于全酶 正确的说法是: A. 辅酶与酶蛋白结合牢固 B.。 辅基与酶蛋白结合疏松 C. 用超滤的方法将辅酶除去后,该酶仍具有活性 用超滤的方法将辅酶除去后, D. 决定专一性的部分是辅助因子 E. 决定专一性的部分是酶蛋白 3. 关于酶活性中心的叙述,下列哪项是正确的: ( B ) 关于酶活性中心的叙述,下列哪项是正确的: A . 酶的必需基团全部位于活性中心 B. 所有的酶都具有活性中心 C. 在活性中心内只有带电氨基酸残基才参与酶的催化作用 D. 活性中心中的必需基团只有两种 E . 构成活性中心的各种基团在一级结构上都互相靠近
填空题 核酶 1. 具有特异催化活性的核糖核酸称为_________ 。 具有特异催化活性的核糖核酸称为_________ 必需基团 2. 酶分子中与其发挥催化活性密切相关的基团称为_________ 。 酶分子中与其发挥催化活性密切相关的基团称为_________ 降低活化能 3. 酶加速化学反应的机理是酶能__________________。 酶加速化学反应的机理是酶能__________________。 4. 解释酶促反应的反应速度与底物浓度关系的最合理的学说是 中间产物学说 ________________。 ________________。 4:5 : 5. 当[S]=4Km时,酶促反应V与Vmax之比为___________。 [S]=4Km时 酶促反应V Vmax之比为 之比为___________。 6. 当底物浓度大大超过酶浓度时,酶促反应速度与酶浓度关系 当底物浓度大大超过酶浓度时, 正比 _________。 呈_________。
酶的结构与功能

酶的活性中心
02 The active center of an enzyme
酶
的
活
第Ⅰ类
性
酶活性中心 内的必需基团
有两类
一类是结合基团,其
中
作用是与底物相结合,
心
内
外
第Ⅱ类
的
另一类是催化基团,其 作用是催化底物发生化
必
须 学反应并将其转变成产
物。
基
因
一些必需基
团虽然不直接参 加活性中心的组 成,却为维持酶 活性中心应有的 空间构象所必需, 这些基团称为酶 活性中心外必需 基团。
02 酶的活性中心 The active center of an enzyme
必需基因
(1)各种研究证明,酶分子中只有少数氨基酸残基侧链上的基因参与底物结合及催化作用。 这些与酶活性密切
相关的基因成为酶的必需基因。
(2)常见的必需基因有丝氨酸残基的羟基、半胱氨酸残基的基、组氨酸残点基击的请咪替换唑文基字、内酸容 性氨基酸残基的
请替换文字内容,添加相关标题,修
非a-羧基等。
改文字内容,也可以直接复制你的内 容到此。
组成多肽的氨基酸在 相互结合时,由于其 部分基团参与了肽键 的形成而失去一分子 水,因此把多肽中的 氨基酸单位称为氨基 酸残基。
组氨酸是一种α-氨基酸, 化学sC6H9N3O2,分 子量为155,是一种人 类必需的氨基酸,主要 是儿童。
酶活性中心 外的必需基团
2021 THANK YOU
感谢聆听,批评指导
汇报人:xxx
02 酶的活性中心 The active center of an enzyme
酶的活 性中心
酶分子中必需基团比较 集中,具有特定的空间构象, 能与底物特异地结合并催化底 物转变为产物的区域称为酶的 活性中心。
03 酶与辅酶汇总

第三章酶学与维生素一、名词解释:1. 辅酶/辅基;2. 酶活力;3. 酶的活性中心;4. K m值(米氏常数);5. 激活剂/抑制剂;6. 不可逆抑制/可逆抑制;7. 单体酶/寡聚酶/多酶复合体;8. 同工酶;.9. 别构酶;10. 酶原激活11. 诱导契合;二、填空:1.酶是___________产生的,具有催化活性的______________ 。
2.与酶催化的高效率有关的因素有___________ 、________ 、________ 、____________、________等。
3.丙二酸和戊二酸都是琥珀酸脱氢酶的______________ 抑制剂。
4.变构酶以V 对[S]作图时,表现出____________ 型曲线,而非__________ 曲线。
它是___________ 酶。
5.全酶由__________ 和____________ 组成,在催化反应时,二者所起的作用不同,其中_____________决定酶的专一性和高效率,_____________ 起传递电子、原子或化学基团的作用。
6.辅助因子包括___________ 和________ 等。
其中_________ 与酶蛋白结合紧密,________ 与酶蛋白结合疏松,可以用____________ 除去。
7.T.R.Cech 和S.Alman 因各自发现了____________ 而共同获得1989年的诺贝尔奖(化学奖)。
8.根据国际系统分类法,所有的酶按所催化的化学反应的性质可分为六类___________ 、___________ 、__________ 、____________ 、_________ 和_____________。
9.根据酶的专一性程度不同,酶的专一性可以分为________________ 和____________ 。
10.酶的活性中心包括_________ 和____________ 两个功能部位,其中__________ 直接与底物结合,决定酶的专一性,___________ 是发生化学变化的部位,决定催化反应的能力。
第03章酶催化作用机制

V
Vmax
[S]
随着底物浓度的增高 反应速度不再成正比例加速。
V
Vmax
[S]
当底物浓度高达一定程度 反应速度不再增加,达最大速度,说明酶已 经被底物所饱和。
1. 米氏方程
第 三 章 酶 催 化 作 用 机 制
1913年,米彻利斯(Michaelis)和曼吞 (Menton)在前人研究的基础上,推导出 著名的米氏方程: v——反应速度; S——底物浓度; v m —— 最大反应速度; K m —— 米氏常数,为 酶催化反应速度等于最大反应速度一半时 的底物浓度。
(一)酶的刚性与“琐和钥匙”学说
第 三 章 酶 催 化 作 用 机 制
1890年,德 国化学家费舍 尔(Fisher) 提出了著名的 “琐和钥匙” 此学说认为:酶与底物都是刚性的,二者 学说。 结构间天然存在互补的关系,就像锁和钥
匙一样。此学说较好的解释了酶对底物选 择的专一性,但不能解释酶能够高效催化 反应的原因。
中间产物学说
中间产物
第 三 章 酶 催 化 作 用 机 制
酶促反应速度与底物浓度的关系,可以用 中间产物学说加以解释。 酶促反应模式——中间产物学说
E+S
k1 k2
ES
k3
E+P
推导过程
米-曼氏方程式推导基于两个假设:
第 三 章 酶 催 化 作 用 机 制
E与S形成ES复合物的反应是快速平衡反应,
Dixon plot
Cornish-Bowden plot
酶的转换数
定义 — 当酶被底物充分饱和时,单位时间内 (每秒钟)每个酶分子催化底物转变 为产物的分子数(微摩尔数)。 意义 — 可用来比较每单位酶的催化能力。
生物化学03第三章 酶

三、 酶的命名与分类
(一)酶的命名
1.习惯命名法——推荐名称
通常以酶催化的底物、反应的性质以及酶的来源命名。 (1) 依据酶所催化的底物命名,如淀粉酶等。 (2) 依据催化反应类型命名,如脱氢酶、转氨酶等。 (3) 综合上述两项原则命名,如乳酸脱氢酶等。 2. 系统命名法——系统名称 规定各种酶名称要明确标示酶的底物与反应类型,如 果一种酶催化两个底物,应在酶系统名称中同时写入 两种底物的名称,用“:”把它们分开,如果底物之 一是水,则水可省略不写。
底物
反应总能量改变
产物 应 过 程
酶促反应活化能的改变
反
一、酶的活性中心(active center)
(一)什么是活性中心(活性部位)
指在整个酶分子中,只有一小部分区域 的aa残基参与对底物的结合和催化作用,这
些特异的aa残基比较集中的区域称为酶的活
性中心或称活性部位。
(二)酶活性中心的组成
结合部位:酶分子中与结合底物有关的部位。
1. 结合酶的酶蛋白与辅助因子协同作用才能发挥 催化作用。
酶蛋白
(无催化活性)
+ 辅助因子
(无催化活性)
全酶
(有催化活性)
2.全酶各部分在催化反应中的作用
(1)酶蛋白决定反应的特异性。 (2)辅助因子决定反应的种类与性质。
3.辅酶:属于有机分子类型的辅因子;辅酶又可
分为一般的辅酶和辅基两类(按其与酶蛋白结合
酶的调节部位可以与某些化合物可逆地非共价结 合,使酶发生结构的改变,进而改变酶的催化活性, 这种酶活性的调节方式称~。
别构酶:多为寡聚酶
正效应物(别构激活剂) 负效应物(别构抑制剂)
效应物(别构效应剂) (多为小分子化合物)
高中生物第一册 第03章 细胞的基本结构(A卷)(含答案)

第三章细胞的基本结构A卷一、单项选择题(本大题共15小题,每小题4分,共60分)1.细胞膜对物质进出的控制作用主要体现在哪些方面()①细胞需要的营养物质可以从外界进入细胞②细胞产生的代谢废物可以排出细胞③细胞内核酸等重要的成分不会流出细胞④环境中一切有害物质都不能通过细胞膜进入细胞A.①②③B.①②④C.②③④D.①③④【答案】A【解析】细胞膜控制物质进出细胞的作用是相对的,环境中的有害物质也可能进入细胞,如重金属离子、病毒、病菌等。
2.功能越复杂的细胞膜,其蛋白质种类和数量越多,下列除哪项外,均属于正常机体细胞膜上的蛋白质()A.具有信息转换功能的受体蛋白B.具有催化作用的蛋白质C.具有识别功能的糖蛋白D.具有运输功能的载体蛋白【答案】B【解析】细胞膜上行使多种功能的成分是蛋白质,功能越复杂的细胞膜,其蛋白质种类和数量越多。
细胞膜上的蛋白质具有识别、信息交流以及运输物质进出细胞的功能。
起催化作用的蛋白质是酶,而不是膜蛋白。
3.如图为细胞间进行信息交流的一种方式,下列有关叙述错误的是()A.图中b表示细胞膜上的载体B.图中乙表示靶细胞C.图中a表示信号分子(如激素)D.图中反映了细胞膜具有细胞间信息交流的功能【答案】A【解析】图示为细胞间进行信息交流的间接传递方式。
图中甲表示发出信号的细胞,乙表示靶细胞,b 表示细胞膜上的受体。
4.下列有关生物膜的叙述,正确的是()A.人体淋巴细胞膜的主要成分是多糖与脂质B.细胞膜具有一定的流动性,是选择透过性的基础C.流动镶嵌模型认为生物膜是蛋白质—脂质—蛋白质三层结构D.细胞完成分化后,其细胞膜的通透性稳定不变【答案】B【解析】细胞膜的主要成分是脂质和蛋白质。
流动镶嵌模型认为生物膜以磷脂双分子层形成基本支架,蛋白质镶在表面,部分或全部嵌入、贯穿于磷脂双分子层中,磷脂分子和大部分蛋白质是运动的。
细胞膜是一种选择透过性膜,其通透性大小与许多因素(如温度等)有关,并不是稳定不变的。
第03章.酶-2009级临床医学本科PPT课件
酶的生物学意义:
酶在机体中十分温和条件下的高效率催化 作用,并在多种因素的影响下对代谢发挥着巧 妙的调节作用,使得生物体内的物质代谢有条 不紊地进行 。
2010.09
基因工程研究所 肖维威
酶与医学关系密切
(一) 酶与疾病的发生 (二) 酶与疾病的诊断 (三) 酶与疾病的治疗
2010.09
基因工程研究所 肖维威
酸性磷酸酶 前列腺 红细胞
谷丙转氨酶 肝 心 骨骼肌
谷草转氨酶滑肌
乳酸脱氢酶 心 肝 骨骼肌 红细胞
血小板 淋巴结
胆碱脂酶 肝
主要临床应用 胰腺疾患 骨病、肝胆疾患 前列腺癌、骨病 肝实质疾患 心肌梗塞 肝实质疾患 肌肉病 心肌梗塞、肌肉病 心肌梗塞 溶血肝实质疾患
有机磷中毒 肝实质疾患
2010.09
基因工程研究所 肖维威
(三)酶与疾病的治疗
替代治疗:消化不良--胃酶、胰酶 抗菌治疗:磺胺药 对症治疗:预防血栓形成--尿激酶、链激酶、纤溶酶 抗癌治疗:MTX抑制FH2还原酶
2010.09
基因工程研究所 肖维威
1 2 3 4 5
2010.09
本章内容
什么是酶 ?
催化作用 存在于生物体内 蛋白质或核酸
酶是生物体内一类具有催化活性的生物大分 子,包括蛋白质和核酸。
2010.09
核酶
脱氧核 酶
基因工程研究所 肖维威
酶催化进行的化学反应:酶促反应
S(substrate)
底物
E(enzyme)
酶
P(product)
产物
2010.09
基因工程研究所 肖维威
全酶
(无催化活性) (无催化活性) (有催化活性)
对于结合酶来说,单独酶蛋白或辅助因子 没有催化活性,只有全酶才有催化作用。
2017-03第三章 酶的命名和分类

2. 转移酶类 2.1 转一碳基团的酶 2.2 转醛基和酮基的酶 2.3 转酰基的酶 2.4 转糖苷的酶 2.5 转甲基以外的烷基及芳香基 2.6 含N基团转移酶 2.7 含磷酸基团转移酶 2.8 含硫基团转移酶
3. 水解酶类 3.1 作用于酯键 3.2 作用于糖苷键 3.3 作用于醚键 3.4 作用于肽键 3.5 作用于肽键以外的C-N键 3.6 作用于酸酐键 3.7 作用于-C-C-键 3.8 作用于卤化物 3.9 作用于P-N键 3.10 作用于S-N键 3.11 作用于C-P键
如EC 3.1.3.1代表 Enzyme Commission
第三大类酶- 水解酶类; 第三大类中的第一亚类:作用于酯键的酶 该亚类中的第三次亚类:磷酸单酯 该次亚类中的第一号酶:碱性磷酸酶
第二节:六大类酶的催化反应性质:
氧化还原酶类:Oxido-reductases [O] 催化氧化还原反应
AH2 + B
[H]
A + BH2
其中:AH 2为还原剂,起氧化反应,被B氧 化,B为氧化剂,起还原反应,被AH2还原 例如:乳酸脱氢酶(EC. 1.1.1.27) L-乳酸:NAD+氧化反应酶
CH3 OHCH COOH + NAD+ CH3 C
O
+
NADH + H+
COOH
转移酶类:Transferases 催化功能基团的转移反应
第二章 酶的命名和分类
第一节 酶的命名原则: 一、习惯命名法: 1. 依底物命名: 如淀粉酶、蛋白酶 2. 依反应性质命名: 转氨酶、水解酶 3. 依底物及反应性质命名: 琥珀酸脱氢酶 4. 附加其它条件性质: 胃蛋白酶、胰蛋白酶; 碱性磷酸酶、 酸性磷酸酶
查锡良《生物化学与分子生物学》(第8版)笔记和考研真题详解

第五章维生素与无机盐
5.1复习笔记 5.2考研真题详解
第六章糖代谢 第七章脂质代谢
第八章生物氧化 第九章氨基酸代谢
第十一章非营养物 质代谢
第十章核苷酸代谢
第十二章物质代谢 的整合与调节
第六章糖代谢
6.1复习笔记 6.2考研真题详解
第七章脂质代谢
7.1复习笔记 7.2考研真题详解
第八章生物氧化
8.1复习笔记 8.2考研真题详解
第九章氨基酸代谢
9.1复习笔记 9.2考研真题详解
第十章核苷酸代谢
10.1复习笔记 10.2考研真题详解
第十一章非营养物质代谢
11.1复习笔记 11.2考研真题详解
第十二章物质代谢的整合与调节
12.1复习笔记 12.2考研真题详解
第十四章 DNA的生 物合成
查锡良《生物化学与分子生物 学》(第8版)笔记和考研真题
详解
读书笔记模板
01 思维导图
03 目录分析 05 读书笔记
目录
02 内容摘要 04 作者介绍 06 精彩摘录
思维导图
本书关键字分析思维导图
知识
技术
分子生物 学
精华
分子
复习
代谢
笔记
真题
教材 复习
生物
第版
笔记
结构
真题
功能
基因
物质
内容摘要
内容摘要
第十三章真核基因 与基因组
第十五章 DNA损伤 与修复
第十六章 RNA的生 物合成
第十七章蛋白质的生 物合成
第十八章基因表达调 控
第十九章细胞信号转 导的分子机制
第十三章真核基因与基因组
生化反应工程试题库

试题库结构章节 试题分布名词解释 数学表达式 简答题图形题推导题判断题 计算题合计第一章 0 0 9 0 0 0 0 9 第二章 0 0 11 0 0 0 2 13 第三章 1 3 9 3 11 4 2 33 第四章 1 11 6 7 1 11 14 51 第五章 3 1 7 8 2 0 13 34 第六章 6 0 6 2 0 0 0 14 第七章 2 2 2 2 0 0 13 21 第八章 0 0 36 0 0 0 2 38 合计 13 17 86 22 14 15 46 213一、名词解释[03章酶促反应动力学]酶的固定化技术:[04章微生物反应动力学]有效电子转移:[05章微生物反应器操作]流加式操作:连续式操作:分批式操作:[06章生物反应器中的传质过程]粘度:牛顿型流体:非牛顿型流体塑性流体假塑性流体胀塑性流体[07章生物反应器]返混:停留时间:二、写出下列动力学变量(参数)的数学表达式[03章酶促反应动力学]1. Da准数:2. 外扩散效率因子:3. 内扩散效率因子:[04章微生物反应动力学]1. 菌体得率:2. 产物得率:3. 菌体得率常数:4. 产物得率常数:5. 生长比速:6. 产物生成比速:7. 基质消耗比速:8. 生长速率:9. 产物生成速率:10. 基质消耗速率:11. 呼吸商:[05章微生物反应器操作]1. 稀释率:[07章生物反应器]1. 停留时间:2. 转化率:三、简答题:[01章绪论]1.什么是生物反应工程、生化工程和生物技术?2.生物反应工程研究的主要内容是什么?3.生物反应工程的研究方法有哪些?4.解释生物反应工程在生物技术中的作用。
5. 为什么说代谢工程是建立在生化反应工程与分子生物学基础之上的?6. 何为系统生物学?7. 简述生化反应工程的发展史。
8. 如何理解加强“工程思维能力”的重要性。
9. 为什么在当今分子生物学渗入到各生物学科领域的同时,工程思维也成为当今从事生物工程工作人员共同关注的话题?[02章生物反应工程的生物学与工程学基础]1. 试说明以下每组两个术语之间的不同之处。
03 第三章 酶的发酵生产1思维导图
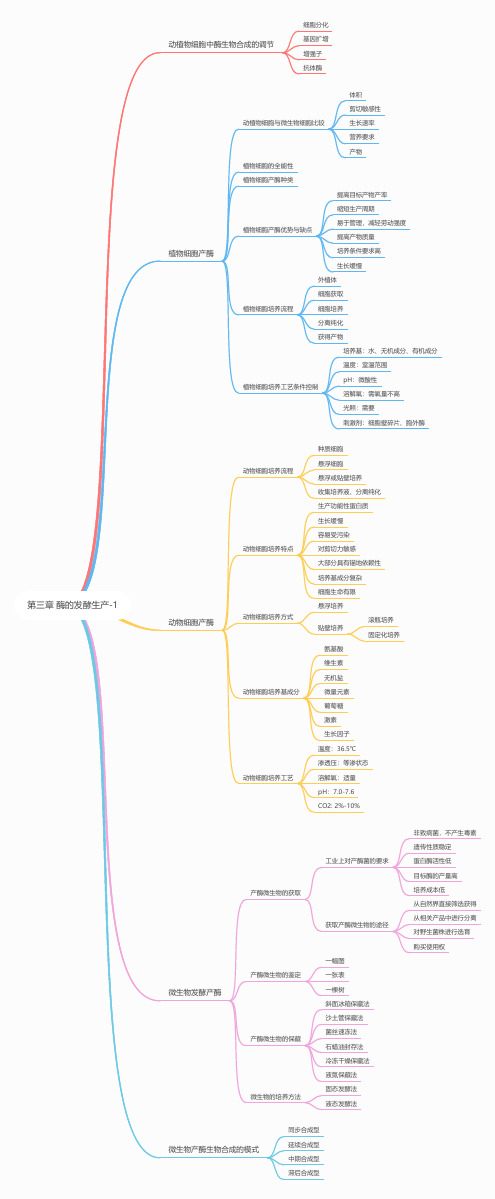
第三章 酶的发酵生产-1微生物发酵产酶动植物细胞与微生物细胞比较体积剪切敏感性生长速率营养要求产物动植物细胞中酶生物合成的调节细胞分化基因扩增增强子抗体酶植物细胞的全能性植物细胞产酶种类植物细胞产酶优势与缺点提高目标产物产率缩短生产周期易于管理,减轻劳动强度提高产物质量培养条件要求高生长缓慢植物细胞培养流程外植体细胞获取细胞培养分离纯化获得产物植物细胞培养工艺条件控制培养基:水、无机成分、有机成分温度:室温范围pH:微酸性溶解氧:需氧量不高光照:需要刺激剂:细胞壁碎片、胞外酶动物细胞产酶动物细胞培养流程种质细胞悬浮细胞悬浮或贴壁培养收集培养液、分离纯化动物细胞培养特点生产功能性蛋白质生长缓慢容易受污染对剪切力敏感大部分具有锚地依赖性培养基成分复杂细胞生命有限动物细胞培养方式悬浮培养贴壁培养动物细胞培养基成分氨基酸维生素无机盐微量元素葡萄糖激素生长因子动物细胞培养工艺温度:36.5℃渗透压:等渗状态溶解氧:适量pH:7.0-7.6CO2: 2%-10%产酶微生物的获取工业上对产酶菌的要求非致病菌,不产生毒素遗传性质稳定蛋白酶活性低目标酶的产量高培养成本低获取产酶微生物的途径从自然界直接筛选获得从相关产品中进行分离对野生菌株进行选育购买使用权产酶微生物的保藏斜面冰箱保藏法沙土管保藏法菌丝速冻法石蜡油封存法冷冻干燥保藏法液氮保藏法微生物的培养方法固态发酵法液态发酵法滚瓶培养固定化培养产酶微生物的鉴定一幅图一张表一棵树植物细胞产酶微生物产酶生物合成的模式同步合成型延续合成型中期合成型滞后合成型。
第03章 物理图绘制

大分子DNA的分离技术
脉冲交变电场电泳
均 一 脉 冲 电 场 电 泳
采用大分子DNA技术绘制 E.coli基因组物理图
大肠杆菌基因组物理图绘制
大 肠 杆 菌 基 因 组 遗 传 图
大肠 杆菌 基因 组 遗传 图 与 物理 图 整合
克隆作图---大分子DNA的克隆
根据克隆的DNA片段之间的重 叠顺序构建叠连群(Contig), 绘 制物理连锁图。
辐射杂种连锁分析
人类21号染色体辐射杂种图
一段人类染色体DNA的辐射杂种图
染色体 物理长度(Mb)cM/cR
人 类 基 因 组 辐 射 杂 种 图 距
————————————————————————————————
kb/cR 197 225 233 256 272 243 229 271 305 253 270 234 179 208 203 201 147 172 110 191 151 185 231 208
1) 2) 3) 4) 5) 目标基因组大分子DNA的制备 载体制备 载体和插入DNA的连接 转化 转化子鉴定
目标基因组大分子DNA的制备
1) 动物细胞: 样品洗涤→低溶点琼脂糖包埋→蛋白酶 消化→洗涤→限制酶部分酶解 2) 植物细胞: 样品(叶片)→洗涤吸干水分→液氮冷冻 →碾碎→离心收集细胞核→低融点琼脂 糖包埋→蛋白酶消化→洗涤→限制酶部 分酶解
酶的命名和分类

酶的催化作用特性
酶促反应遵循米氏动力学方程
酶分子的结构 酶与底物分子之间的相互作用 酶与底物分子之间的定向效应 酶与反应过渡态的结合作用 酶与底物的手性选择性结合作用
01
返回
02
与酶催化特性有关的因素
(一)酶分子的结构
酶的活性中心 结合部位:专一性 空间形状和氨基酸残基组成上,利于酶-底物复合物的形成。 催化部位:高效性 与结合部位重叠或非常靠近; 含有多种具有活性侧链的氨基酸残基; 有的含有辅酶或金属离子; 激活底物或降低过渡态活化能。
01
返回
02
影响酶作用的因素
1) 温度对酶作用的影响
酶的最适温度(optimum temperature, Tm) 在一定范围内,反应速度达到最大时的温度称为酶的最适温度(optimum temperature, Tm)。 最适温度不是酶的特征物理常数。
返回
01
02
pH对酶作用的影响
辅酶和辅基的作用特点
(一)辅酶和辅基
(一)辅酶和辅基
辅酶和维生素 大多数辅酶或辅基的前体是维生素,主要是水溶性B族维生素。
”
返回
(二)酶分子中的金属离子
金属酶(mentalloenzymes),如SOD 1) 酶蛋白与金属离子结合紧密 2)过渡金属离子:如Fe2+/Fe3+,Cu2+/Cu+, Zn2+,Mn2+等 3)通过配位健与氨基酸残基侧链基团相连 或作为酶的辅助因子 金属激活酶(metal-actived enzymes) 1)结合较松散 2)碱金属离子或碱土金属离子,如K+,Na+,Mg2+,Ca2+等
返回
4.5 酶的抑制剂与药物分子设计
第03章:补体系统

C4 ---→ C4a + C4b ↑ ↓
2. 活化阶段:C1s作用于后续成分, 至形成C3转化酶和C5转化酶。
C1s
↓ C2 --→
--→ C4b2b(C3转化酶)→ C4b2b3b(C5转化酶) ↓ ↑ ↑ C2b + C2a C3 -----→ C3b + C3a
• 3.膜攻击阶段 * C5转化酶 →裂解C5
C5
C5b + C6 C7 C8 C9
识别阶段 活化阶段
攻膜阶段
C56789——MAC
补体激活的经典途径
(二)MBL(mannan-binding lectin)途径
•
该途径与经典途径的过程基本类似,但激活物质 (MBL)不同; MASP与活化的 C1q具有同样生物学活性,可水解 C4和 C2分子,继而形成 C3转化酶,其后的反应过 程与经典途径相同。
→系列的连接反应
→形成C5b-C9膜攻击复合物
(membrane attack complex,MAC)
→损伤靶细胞膜→细胞崩解 C4b2b3b C5a + C5b C5 、
C6、C7、C8、C9 C5b6789(MAC)
免疫复合物 C1 C1
C2
C2b
C4b2b
C4 C4b C3 C3b C4b2b3b
膜攻击阶段
胞浆
(a)
(b)
(c)
(d)
三、补体活化的调控
(一) 补体的自身调控
补体激活过程中产生的某些中间产物极不 稳定,成为级联反应的重要自限因素。
(二) 补体调节因子的作用
1.C1抑制物(C1 inhibitor, C1INH) 与活化的C1q、C1r结合成稳定的复合物,灭活 C1r、C1s。
生物化学基础第03章 酶学习题

E.哇巴因是Na+-K+-ATP酶的竞争性抑制剂
4.对NAD+的正确描述是:
√A. NADH与NAD+通过氧化还原反应相互转换
B. NAD+称尼克酰胺腺嘌呤二核苷酸磷酸 C. NADH与NAD+均含有维生素PP,都作为脱
氢酶的辅基 D. NAD+在波长340nm处有吸收峰,利用此特
性构成酶偶联测定法
第三章练习题
• 从备选答案中选择正确答案,并说明你 否定其他备选答案的理由: 1.关于生物催化剂的正确叙述: A.蛋白质就是生物催化剂
√B.有特异催化作用的RNA也称为核酶
C.生物催化剂的化学本质都是蛋白质 D.生物催化剂在生物体外无活性
√E.生物催化剂降低化学反应活化能
2.关于酶的错误叙述是:
√ A.酶有高度特异性所有酶只作用于一种底物 √ B.蛋白酶也称为酶蛋白ቤተ መጻሕፍቲ ባይዱ
• 1 BE • 2 ABDE • 3 BCD • 4 AE • 5 ABCDE
END
√E. 含有NAD+或NADP+的酶属于结合酶
5.酶与疾病有密切的关系,例如:
√A.急性肝炎血清丙氨酸氨基转移酶(ALT)活
性升高
√B.有机磷农药抑制胆碱酯酶引起有机磷农药
中毒
√C.急性胰腺炎血清和尿中淀粉酶活性升高 √D.肝功能严重障碍,血中凝血酶原含量可减少 √E.缺乏酪氨酸酶引起白化病
练习题答案
C.酶的无活性前体称为酶原
√ D.分子结构与催化功能相同的酶互称为同工
酶
√ E.酶活性中心外的化学基团与酶活性无关
3.有关酶促反应动力学的问题的 正确描述是:
A.要求反应速度达到50%vmax,[S]应为 2 Km
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(四)酶的不稳定性 酶的化学本质是蛋白质,酶促反应要在一定的 温度和pH条件下进行。凡强烈的理化因素都可能使
酶蛋白变性而丧失活性。
第三节 酶促反应的机制
The Mechanism of Catalytic Reaction of Enzyme
一、酶-底物复合物的形成和诱导契合学说
(一)酶-底物复合物的形成 大量的资料证明,在酶促反应中,酶(E)总是先
活化,从而加速反应的进行。
活化能:即底物分子从常态转变到活化态所需的最低 能量,只有达到活化态的分子才能发生化学反应。
自 由 能
非催化反应活化能
一般催化剂 反应的活化能
酶促反应 活化能
初 态 全部自由能的变化 终 态
反
应
进
程
酶催化反应的自由能变化
催化过程和非催化过程的能量变化
1. G非≠>G催≠> G酶≠; 2. ⊿ G非o = ⊿ G催o= ⊿ G酶o; 3. 催化反应并不改变化学反应历程,仅仅是加快
2.相对专一性:催化一类化合物(或同种化学键) →一定的P。 对S不太严格的选择性。例如:脂肪酶。 3.立体异构体专一性:催化立体异构体中的一种S →一定的P。 例如:延胡索酸酶。
(三)酶活性的可调节性
酶所具有的催化能力的大小叫酶活性或酶活力。 酶活性受多种因素调节,例如别构调节、共价修
饰调节、正反馈与负反馈调节、酶原激活及激素调
二、维生素与辅酶
维生素(vitamin,Vit.)是一类维持细胞正常功能所必
需的小分子有机化合物, 动物体内不能合成或合成不
足,必须由食物小量供应。
维生素分脂溶性和水溶性两大类。 脂溶性有维生素 A、D、E、K,各有重要的生理功能。水溶性维生素中, 除维生素C外,总称为B族维生素。几乎所有的B族维生 素均参与辅酶组成,因此也是许多酶发挥其催化活性所
些酸性或碱性基团对许多有机反应都是有力的催化剂。
四、表面效应
该机制认为: 底物受酶催化的反应,常常发生在酶分子内部的 疏水区域,因为疏水环境可避开水分子的多重干扰: 有利于底物和酶的靠近接触;有利于酶的功能基团 对底物的快速催化。
第四节 酶促反应的动力学
Kinetics of Catalytic Reaction of Enzyme
与底物(S)形成不稳定的中间产物(ES),然后再
分解成酶(E)和产物(P)。此即中间产物学说:
E+S
所需活化能很低
(中间产物)
ES
E+P
ES的形成可使S的活化能大大降低,从而使反应加速。
(2h止)
实验证明: 1. P的生成速度 v 只与ES 的浓度成正比,而与游
离的E或S无关。(根据反应速度定律:pA+qB→nC
(二)米-曼氏方程式
Michaelis和Menten根据上述理论和反应式,从平衡法
推导出下列公式,即米-曼氏方程式:
= V K
Vmax[S]
m+
[S]
[S]:底物浓度 ;V:不同[S]时的反应速度 ;Vmax:最大反应速度 ;
Km:米氏常数 (Michaelis constant) 。 【 推导此式时,没有考虑逆反应 E+ P→ES。而要忽略此反 应,必须[P]趋近于零,因此米-曼氏方程式仅适用于测量反应 的初速度,也即在反应开始, [P]很低时。通常把底物浓度变化在 5%以内的速度作为初速度。】
1/V
斜率=
Km 1/V= V 1/[S] + 1/Vmax max
Km Vmax
1 / Vmax ﹣1 / Km
截距
1/ [S]
1.作图:1 / V对1/ [S]作图。 2.应用:求Km和Vmax ;研 究抑制剂作用。 3.缺点:实验点过分集中 于直线左端,作图不易 十分准确。
2. Hanes-Woolf作图法 在林-贝氏方程基础上,两边同乘以[S],得到
+mD, 反应速度 v﹦k﹝A﹞p ·﹝B﹞q,k为速度常 数) 2. 光谱分析:各物质具有特异的光吸收值。 3. 已获得ES的结晶以及对它的X射线衍射分析结果。
(二)诱导契合学说 目前了解,当酶与底物接近时,酶受底物分子的 诱导,其构象发生了有利于和底物结合的变化,酶与 底物在此基础上互相契合进行反应。此即诱导契合学
[S]/V
斜率=
1 Vmax
[S]/V=Km/Vmax + [S]/Vmax 以[S]/V对[S]作图,求出Km和Vmax。
- Km Km/Vm [S]
二、酶浓度对反应速度的影响
当[S]>> [E], 酶可
被底物完全饱和,反应速度
V与[E]成正比。 关系式:V = k2 [E]
V
[在临床检验中常用此高浓度 0 [E] 底物测定血清酶活性。但有时 当[S]>>[E]时,Vmax = k2 [E] 由于底物溶解度或成本等原因, 酶浓度对反应速度的影响 所用[S]只是略大于Km.]
酶动力学概念
1. 酶动力学是对酶促反应速度及其影响因素进行 定量研究的科学。 2. 影响因素包括: [S] 、 [E] 、温度、 pH 、激活剂、 抑制剂等。 3. 如何研究:只改变待观察的因素,其他条件恒定。 4. 研究前提:⑴ 单底物、单产物;⑵ 速度的表示: 单位时间内 S的减少量或P的增加量;⑶ 反应速度采 用初速度:不超过 5%的S →P时的速度;⑷ [S] >> [E] 。
四、多酶复合物及多功能酶
1. 单体酶—分子结构中只有一条多肽链的酶。
2. 寡聚酶—由多个相同或不同的亚基组成的酶。
3. 多酶复合物或多酶体系—催化不同反应,但功能相
关、彼此嵌合在一起的酶。如丙酮酸脱氢酶复合体。
4. 多功能酶—在一条酶蛋白多肽链上有多个活性中心, 能完成多种催化功能。如脂肪酸合成酶有七种酶活 性中心,协同作用,有利于脂肪酸快速有序的合成。 (1h止)
一、底物浓度对反应速度的影响
(一)底物浓度曲线 在[E]、温度、 pH恒定的条 件下,对大多数酶来说,底物浓度对反应速度的影响 呈矩形双曲线关系。 V Vmax c b a 当[S]很低时, [S] 酶未被饱和,速度v取决于中间产物[ES]的多少, 此时v与[S]成正比;为一级反应(a 段,即S →P的反 应)。
三、pH对反应速度的影响
1. 原理:pH 可影响酶和底物的解离以及两者的结合, 但往往只有一种解离状态最适宜于它们互相结合, 并发生催化作用。此时酶的活性最高。 2. 最适pH定义: 酶催化活性最大时的环境 pH, 称为 最适pH。 最适pH不是E的特征性常数,它受缓冲液种类、 浓度、[S]及E纯度的影响。
反应速度。
注:G非≠ 、 G催≠等表示活化能, ⊿ G非o 、 ⊿ G催o等 表示自由能变化。
(二)高度特异性 酶对所催化的底物有选择性以及能使底物生成确 定结构的产物,此称为酶的特异性或专一性。
根据酶对底物的选择程度不同,酶的特异性分以
下3种类型:
1.绝对专一性:催化一种 S →一定的P, 对S有严格选择性。 例如:脲酶。
说。不少物理化学实验结果支持这一假设,证明了酶
与底物结合时,确有显著的构象改变。
二、邻近效应及定向排列
酶可将它的底物结合于它的活性部位,彼此靠近, 并有一定的取向,从而大大增加ES复合物进入过渡态 的几率。
不利的定向 不利的趋近
不利的定向 有利的趋近
有利的定向 有利的趋近
三、酸碱催化
酶的活性中心含有特殊氨基酸残基的R基团,这 些基团可以是质子供体或质子受体。 在水溶液中这
基伸入,通过疏水作用相结合。而胰蛋白酶分子在活
性Ser附近有一凹陷,其中有带负电荷的Asp侧链,很
容易与蛋白质中带正电荷的碱性氨基酸侧链形成盐键 而结合成中间产物。故这两种蛋白酶具有不同的专一
性(看下图)。
3. 酶的活性中心和整个酶分子是不可分的。酶的其 他部分对于酶的催化功能、调节功能以及维持空间结 构等方面均有重要作用。
必要的组成部分。
B族维生素参与组成的辅酶及其作用见下表:
三、酶的活性中心
(一)必需基团 酶分子中与催化活性密切相关的基团。
(二)酶活性中心的概念
1.定义:酶分子中的必需基团在空间上彼此靠近, 形成能与底物结合并将底物转变成产物的空间结构 区域。 [ 活性中心往往位于酶分子表面,或凹陷处,或 裂隙处,也可通过凹陷或裂隙深入到酶分子内部的 疏水区域。]
(4)同一种 E对于不同 S有不同的Km值。
2. 最大反应速度 Vmax: (1)定义:当酶完全被底物饱和时的反应速度,与[E]成正 比。
表达式:V max = k2 [E] (2)如果酶的总浓度已知,可从 Vmax计算动力 学常数 k2 ,即酶的转换数(每秒钟每个酶分子转换底
物的分子数)。 k2值越大,表示酶的催化效率越高,
(3h止)
(三)米氏方程动力学常数的意义
1. 米氏常数( Km)的意义
( 1 ) 米 氏 常 数 Km 即 是 V=1/2Vmax 时 的 [S] 。 单 位 是 mol/L或mmol/L 。
(2)Km值是E的特征性常数;只与E性质有关,而与 [E]无关。 (3) Km可近似表示 E对S的亲和力; 反比关系。
L72h版
第三章
酶
Enzyme
酶(Enzyme,E) 是由活细胞产生的具有高效催化
作用的蛋白质。
对于生化反应:A+B↔C+D, A与B为作用物,现 常称为底物(S),C与D为生成物,现常称为产物 (P), 酶所催化的反应叫酶促反应 。S即substrate ,
P即product。
第一节 酶的分子结构
2. 活性中心内的必需基团: 结合基团 (binding group) 与S结合 催化基团 (catalytic group) 催化S转变成P
