过氧化氢标准曲线
植物组织过氧化氢含量的测定

植物组织过氧化氢含量的测定Company number:【0089WT-8898YT-W8CCB-BUUT-202108】配制100ml 、100umol/L 的过氧化氢溶液需要多少30%的过氧化氢原液请写出计算过程。
答:首先计算其摩尔浓度:若30%为其质量百分数双氧水30%浓度的试剂(上海国药集团出品),室温时实测密度为:1,122g/L,所以,1L 30%含量的双氧水中过氧化氢含量为:1122g/L ×1L×30%=337g又H2O2的分子量为,那么1L 30%含量的双氧水中过氧化氢浓度为:337/= mol/L.100ml×10-3×100umol/L×10-6=mol/L×VV=10-6L=1 ul若30%为体积分数100% H2O2密度是1,440 g/L, 30 ml H2O2的质量为1440 g/L ×30ml×10-3=,30%含量的双氧水中过氧化氢浓度为:= mol/L.100ml×10-3×100umol/L×10-6=mol/L×VV=×10-7L= ul植物组织中过氧化氢含量测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
【仪器和用具】研钵;移液管×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
双氧水中过氧化氢含量的检测方案

双氧水中过氧化氢含量的检测方案双氧水是一种常用的强氧化剂,主要用于漂白、消毒、清洁等方面。
过氧化氢(H2O2)是双氧水的主要成分之一,因此,对双氧水中过氧化氢含量进行准确的检测很重要。
以下是一个针对双氧水中过氧化氢含量的检测方案:1.理论基础过氧化氢可以通过分光光度法、电化学法、滴定法等方法进行检测。
其中,分光光度法是一种简便快捷的分析方法,通过测量溶液中吸收或发射的光谱信号来间接推算出过氧化氢的浓度。
2.实验步骤(1)样品准备:将双氧水样品取1mL,加入50mL容量瓶中。
(2)标准曲线制备:取一系列不同浓度的过氧化氢标准溶液,如0.1 mol/L、0.05 mol/L、0.01 mol/L等,每个浓度制备10 mL。
对每个标准溶液,其吸光度与过氧化氢的浓度之间应有一线性关系。
通过测量各个标准溶液的吸光度,制作过氧化氢的标准曲线。
(3)测试样品的吸光度:将样品中的双氧水用试剂盒中给定的试剂反应生成一种有颜色的产物,通过分光光度计测量该产物的吸光度。
根据标准曲线,可以找到吸光度对应的过氧化氢浓度。
(4)计算样品中过氧化氢的含量:根据吸光度与过氧化氢浓度之间的线性关系,计算样品中过氧化氢的含量。
3.实验注意事项(1)实验过程中要注意操作的准确性和稳定性,避免误差的产生。
(2)每个操作步骤都需要严格按照实验方法进行,确保实验结果的准确性。
(3)实验室环境要保持干燥、洁净,以防止样品受到外界污染。
(4)实验中用到的仪器和试剂要经过充分的检查和清洁,以确保实验结果的准确性。
(5)实验中应当注意自身的安全,避免吸入或接触到有害物质。
总结:通过分光光度法检测双氧水中过氧化氢的含量是一种简便可行的方法。
该方法通过测量吸光度来间接推算出过氧化氢的浓度。
在实验中要注意操作的准确性和稳定性,确保实验结果的准确性。
同时,实验室要保持干燥、洁净的环境,确保样品不受外界污染。
实验过程中要注意自身的安全意识,避免吸入或接触到有害物质。
实验40--植物组织中过氧化氢含量及过氧化氢酶活性测定

实验40--植物组织中过氧化氢含量及过氧化氢酶活性测定实验40 植物组织中过氧化氢含量及过氧化氢酶活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min 下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(完整word版)过氧化氢的测定

Fenton体系下过氧化氢的测定一、反应体系中双氧水测定方法的建立体系中双氧水的测定主要采用高锰酸钾法和碘量法,碘量法检出限较高、操作繁琐,高锰酸钾法是较常规的分析方法,操作简单且准确性高,但在Fenton氧化体系中,由于可被高锰酸钾氧化的亚铁离子和有机物的存在,测定结果往往偏高。
因此,本实验采用了已有报道的钛盐光度法测定Fenton体系氧化过程中的过氧化氢含量。
钛盐光度法测定过氧化氢的原理是过氧化氢与钛离子在酸性溶液中形成稳定橙色络合物—过钛酸(pertitanic acid),此络合物颜色的深浅与样品中过氧化氢的含量成正比。
姜成春等在蒸馏水体系、含有机物体系及Fenton高级氧化体系中,对高锰酸钾法、碘量法和钛盐光度法测定过氧化氢的结果进行对比分析,得出可见钛盐光度法测定过氧化氢具有较高的灵敏度,而且检测限较低,有利于低浓度过氧化氢的测定,避免了氧化还原法测定低浓度过氧化氢通过终点颜色判断所带来的误差。
二、钛盐光度法测定过氧化氢方法的建立:仪器及实验药品:1、DR2800;哈希管;2、药品:100mg/l过氧化氢;3mol/l硫酸溶液;0.05mol/l草酸钛钾溶液;三、测定波长为400nm四、标准曲线的测定:分别取已配置好的双氧水标准溶液(100mg/L)已用高锰酸钾法标定,取0.2,0.4,0.6,0.8,1.0,1.2ml于哈希管中,分别加入0.5ml 的3.0mol/l硫酸溶液和0.05mol/l草酸钛钾溶液,再加入适量纯水至5ml。
放置10min,在400nm波长下,以试剂空白作参比,测定其吸光度。
Fenton氧化体系中双氧水的测定:将反应结束后的一定量的待测溶液加入哈希管中,分别加入0.5ml的3.0mol/L硫酸溶液和0.05mol /L草酸钛钾溶液,定量至5ml并摇匀后放置10min,在400nm波长下,以试剂空白作参比,测定其吸光度。
根据所测吸光度于标准曲线上查的双氧水的含量。
过氧化氢含量的测定

过氧化氢含量的测定:双氧水(过氧化氢,化学式H2O2),是一种重要的无机化工产品,也是工业领域重要的氧化剂、漂白剂、消毒剂和脱氯剂。
在纺织、造纸、化工、轻工、医药、电子、食品、环保等领域应用广泛。
目前我国双氧水产品分工业级、试剂级、医药级和电子级,浓度有27.5%,35%,50%,70%等多种规格。
过氧化氢含量的测定H2O2在化学工业、医药工业、印染工业和食品行业等领域有着广泛的应用,可作为氧化剂、消毒剂、漂白剂等使用。
但H2O2在使用的过程中会产生一些羟基自由基,具有很强的氧化性,对人体有一定危害。
近年来,H2O2在环境中也普遍存在,因此对H2O2的检测具有重要的意义。
检测H2O2的方法主要有:分光光度法、滴定法、电化学法、色谱法、化学发光法、共振散射光谱法、荧光光度法、原子吸收光谱法等。
荧光光度法测定过氧化氢(一)实验部分1、仪器和试剂Cary Eclipse型荧光分光光度计。
H2O2储备溶液:取2mL30%H2O2稀释至500mL,用KMnO4法标定得准确浓度为4.06×10-2mol/L;H2O2工作溶液:1.624×10-4mol/L(临用前用储备溶液稀释);NaOH溶液:1mol/L;邻苯二胺:2×10-3mol/L;四羧基铁酞菁(FeC4Pc)0.0186g用3.5mL 0.2mol/L NaOH溶液溶解,用水定容至250mL,得到浓度为1.0×10-4mol/L。
所用试剂均为分析纯,实验用水均为二次去离子水。
2、实验方法在2支5mL刻度试管中,分别加入0.2mL NaOH,0.1mL FeC4Pc,0.4mL OPDA,其中1支管中加入一定量的H2O2工作液,用水稀释至5mL,摇匀,静置80min。
然后在荧光光度计上用1cm 石英比色皿,设置电压为700V,狭缝宽度为10nm,激发波长为423nm,发射波长为577nm,分别测定加有H2O2的溶液的荧光值F和不加H2O2的试剂空白的荧光值F0,计算△F=F-F0。
实验40--植物组织中过氧化氢含量及过氧化氢酶活性测定
实验40 植物组织中过氧化氢含量及过氧化氢酶活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O2 57μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol 硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
实验植物组织中过氧化氢含量及过氧化氢酶活性测定

实验40 植物组织中过氧化氢含量及过氧化氢酶活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性及植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】H2O2及硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅及H2O2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O2 57μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料及提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol 硫酸5ml,待完全溶解后,及标准曲线同样的方法定容并比色。
工作场所空气有毒物质测定 氧化物(过氧化氢)

工作场所空气有毒物质测定氧化物(过氧化氢)(本方法引用国标:GBZ/T160.32-2004)1.范围本标准规定了监测工作场所空气中氧化物浓度的方法。
本标准适用于工作场所空气中氧化物浓度的测定。
2.规范性引用文件GBZ 159 工作场所空气中有害物质监测的采样规范3.原理过氧化氢的四氯化钛分光光度法空气中的过氧化氢用含钛吸收液吸收,反应生成黄色化合物,在410nm波长下测量吸光度,进行定量。
4.仪器4.1大型气泡吸收管。
4.2空气采样器,0~3L/min。
4.3刻度试管,10ml。
4.4分光光度计。
5.试剂实验用水为蒸馏水。
5.1硫酸,ρ20=1.84g/ml。
5.2盐酸,ρ20=1.18g/ml。
5.3盐酸溶液:100ml盐酸加入到900ml水中。
5.4钛试剂:在50ml容量瓶中,加入10ml盐酸溶液,称量后,加入约10g四氯化钛(含量为99%),再称量,用盐酸溶液稀释至刻度。
由两次称量之差计算钛的含量;再用盐酸溶液稀释成1ml含50mg钛的溶液。
5.5吸收液:取20ml钛试剂,加入400ml盐酸溶液,用水稀释至1000ml,此溶液1ml 含1mg钛。
5.6标准溶液:取10ml浓过氧化氢用水稀释至150ml。
取出2.5ml此液于250ml锥形瓶中,加20ml硫酸溶液(1mol/L),用高锰酸钾溶液(0.2mol/L)滴定。
根据高锰酸钾溶液的用量计算出过氧化氢的浓度。
然后用刚煮沸放冷的水稀释成100μg/ml过氧化氢标准溶液。
或用国家认可的标准溶液配制。
6.样品的采集、运输和保存现场采样按照GBZ 159执行。
在采样点,用1只装有10.0ml吸收液的大型气泡吸收管,以1L/min流量采集空气样品,直到吸收液呈现淡黄色为止。
采样后,封闭试管进出气口,立即置清洁的容器内运输和保存。
样品应在12h内测定。
7.分析步骤7.1对照试验:将装有10.0ml吸收液的大型气泡吸收管带至采样点,除不连接空气采样器采集空气样品外,其余操作同样品,作为样品的空白对照。
abts vc标准曲线

abts vc标准曲线ABTS VC标准曲线。
ABTS VC标准曲线是一种常用的生物化学实验方法,用于测定抗氧化活性。
ABTS(2,2'-联氨基双(3-乙基苯并噻唑啉-6-磺酸))是一种常用的抗氧化剂,其氧化还原反应可以用来评估样品中的抗氧化活性。
本文将介绍ABTS VC标准曲线的制备方法和测定步骤。
首先,准备ABTS溶液。
将ABTS粉末称取至适量,加入适量的PBS缓冲液(pH=7.4),摇匀使其充分溶解,直至溶液呈现深绿色。
然后将该溶液在室温下保存,避免光照。
其次,制备过氧化氢溶液。
将过氧化氢溶液稀释至一定浓度,用于后续的实验操作。
过氧化氢是一种常用的氧化剂,可以用来促进ABTS的氧化反应。
然后,进行标准曲线的制备。
取适量的ABTS溶液,加入适量的过氧化氢溶液,使其充分反应。
随后,通过分光光度计测定不同反应时间点的吸光度值,绘制出ABTS VC标准曲线。
标准曲线的斜率和截距可以用来计算样品的抗氧化活性。
最后,进行样品的测定。
将待测样品加入ABTS溶液中,使其充分反应。
然后通过分光光度计测定样品的吸光度值,并利用标准曲线计算出样品的抗氧化活性。
通过这一方法,可以快速、准确地评估样品中的抗氧化活性,为后续的生物化学研究提供重要参考。
总之,ABTS VC标准曲线是一种常用的抗氧化活性测定方法,具有操作简便、结果可靠的特点。
通过制备标准曲线和测定样品,可以有效地评估样品中的抗氧化活性,为生物化学研究提供重要参考。
希望本文能够为相关研究工作提供一定的帮助,促进科学研究的进展。
分光光度法测定过氧化氢的含量

分光光度法测定过氧化氢的含量分光光度法是一种常用的分析方法,适用于测定物质的浓度和含量。
下面将详细介绍分光光度法测定过氧化氢(H2O2)含量的原理、操作步骤和实验注意事项。
一、原理分光光度法是基于物质吸收光的特性进行分析的方法。
过氧化氢是一种具有吸收紫外光的物质,其吸收光的强度与其浓度成正比。
通过测定过氧化氢溶液对特定波长光的吸收,可以确定溶液中过氧化氢的浓度。
二、操作步骤1. 样品制备:将待测过氧化氢样品稀释至适宜的浓度范围,使其能够在仪器的工作范围内进行测定。
2. 仪器准备:打开分光光度计,选择合适的波长进行测定。
使用纯水进行零点校准,确保仪器的准确度。
3. 测量过程:将样品溶液倒入比色皿中,将比色皿放入分光光度计的样品槽中。
调节分光光度计的波长为过氧化氢吸收光的波长,记录下吸光度值。
4. 绘制标准曲线:准备一系列已知浓度的过氧化氢标准溶液,分别进行测量并记录吸光度值。
根据浓度和吸光度值的关系,绘制标准曲线。
5. 测定样品浓度:根据样品的吸光度值,使用标准曲线计算出样品中过氧化氢的浓度。
三、实验注意事项1. 样品的制备要遵循适当的稀释比例,以确保测量结果在仪器的工作范围内。
2. 选择合适的波长进行测定,确保过氧化氢吸收光能够被光度计准确测量。
3. 在进行测量之前,要对仪器进行零点校准,确保测量结果的准确性。
4. 标准曲线的制备要同时测量多个已知浓度的标准溶液,以提高曲线的准确度。
5. 每个样品的测量要进行多次重复,取平均值,以提高测量结果的可靠性。
6. 实验过程中要注意安全,避免接触过氧化氢溶液对皮肤和眼睛造成损伤。
分光光度法测定过氧化氢含量是一种简单、快速且准确的测定方法。
通过合理的实验设计和严格的操作,可以得到可靠的结果,并可以应用于实际生产和科研中。
LT-1食品级过氧化氢

编制说明食品级过氧化氢广泛用于食品的漂白、消毒、保鲜、防腐以及食品包装物的消毒杀菌。
本公司生产的食品级过氧化氢已达到国内外同行业的先进水平,具有无色、无味、稳定度高和杂质低的特点。
根据《中华人民共和国标准法》的规定,特制订本企业标准,作为组织产品和进行产品检验的依据。
标准中技术内容主要是依照国外的相关标准及国内同行业标准的先进指标,同时又结合本企业的特点和食品级双氧水的特殊要求而确定的。
本标准由**化工有限公司提出并负责起草本标准起草负责人:**LT—1食品级过氧化氢1、范围本标准规定了LT—1食品级过氧化氢的技术要求、试验方法、检验规测以及标志、标签、包装、运输和贮存。
本标准适用于食品级过氧化氢(俗名双氧水)2、引用标准下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。
GB191—2000 包装储运图示标志(eqv ISO780:1997)GB/T601—2002 化学试剂标准滴定溶液的制备GB/T602—2002 化学试剂杂质测定用标准溶液的制备GB/T603—2002 化学试剂试验方法中所用制剂及制品的制备GB/T1250—1989 极限数值的表示方法和判定方法GB/T6678—1986 化工产品采样总则GB/T6680—1986 液体化工产品采样通则GB/T6682—1992 分析实验室用水规格和试验方法(neq ISO3696:1987)GB13690—1992 常用危险化学品的分类及标志GB15603—1995 常用化学危险品贮存通则3、技术要求3.1 外观:无色透明液体4、试验方法本标准所用试剂和水在没有注明其他要求时,均指分析纯试剂和GB/T6682中规定的三级水。
试验中所用标准滴定溶液、杂质标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T601、GB/T602、GB/T603之规定制备。
安全提示:标准所用盐酸、硝酸、硫酸及过氧化氢等化学品具有腐蚀性,使用者应小心操作避免溅到皮肤上。
过氧化氢含量测定
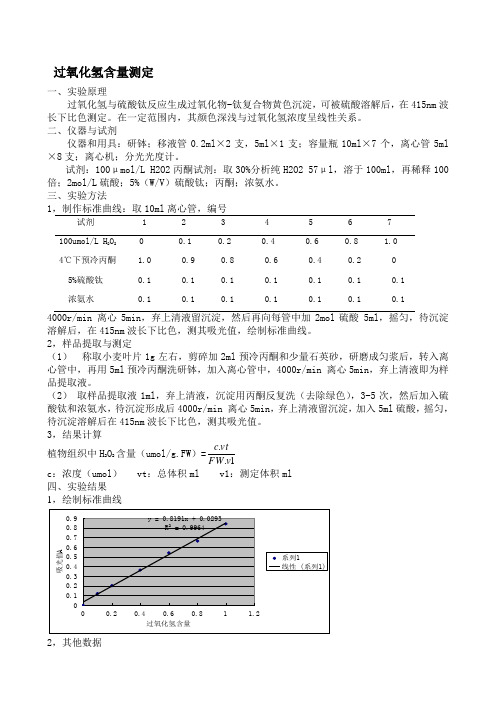
过氧化氢含量测定一、实验原理过氧化氢与硫酸钛反应生成过氧化物-钛复合物黄色沉淀,可被硫酸溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与过氧化氢浓度呈线性关系。
二、仪器与试剂仪器和用具:研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml ×8支;离心机;分光光度计。
试剂:100μmol/L H2O2丙酮试剂:取30%分析纯H2O2 57μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
三、实验方法1,制作标准曲线:取10ml离心管,编号试剂 1 2 3 4 5 6 7 100umol/L H2O2 0 0.1 0.2 0.4 0.6 0.8 1.04℃下预冷丙酮 1.0 0.9 0.8 0.6 0.4 0.2 0 5%硫酸钛 0.1 0.1 0.1 0.1 0.1 0.1 0.1浓氨水 0.1 0.1 0.1 0.1 0.1 0.1 0.14000r/min 离心5min,弃上清液留沉淀,然后再向每管中加2mol硫酸 5ml,摇匀,待沉淀溶解后,在415nm波长下比色,测其吸光值,绘制标准曲线。
2,样品提取与测定(1)称取小麦叶片1g左右,剪碎加2ml预冷丙酮和少量石英砂,研磨成匀浆后,转入离心管中,再用5ml预冷丙酮洗研钵,加入离心管中,4000r/min 离心5min,弃上清液即为样品提取液。
(2)取样品提取液1ml,弃上清液,沉淀用丙酮反复洗(去除绿色),3-5次,然后加入硫酸钛和浓氨水,待沉淀形成后4000r/min 离心5min,弃上清液留沉淀,加入5ml硫酸,摇匀,待沉淀溶解后在415nm波长下比色,测其吸光值。
3,结果计算植物组织中H2O2含量(umol/g.FW)=1..vFWvtcc:浓度(umol) vt:总体积ml v1:测定体积ml 四、实验结果1,绘制标准曲线2,其他数据FW=1.008g vt=7ml A(样品)=1.472 3,计算结果植物组织中H2O2含量(umol/g.FW)=1..vFWvtc=12.2314五、实验分析1,本次试验在研磨小麦叶片时,由于丙酮易挥发,所以研磨不充分,而且冲洗研钵时也不完全,导致样品的损失。
叶绿素测定以及标准曲线绘制,还有过氧化酶测定

过氧化物酶活性的测定仪器药品721型分光光度计、离心机、秒表、天平、研钵、磁力搅拌器、20mmol/LKH2PO4、愈创木酚、30%过氧化氢、100mmol/L磷酸缓冲液(PH6.0)反应混合液:100mmol/L磷酸缓冲液50ml与烧杯中,加入愈创木酚28ul,于磁力搅拌器上加热搅拌,直至溶解,带溶液冷却后,加入30%过氧化氢19ul,混和均匀,保存于冰箱中。
操作步骤1.称取植物材料1g,加20mmol/LKH2PO45ml,于研钵中研磨成匀浆,以4000r/min离心15分钟,倾出上清夜保存在冷处,残渣在用KH2PO4溶液提取一次,合并两次上清夜,处于冷处备用。
2.取光径1cm比色杯2只,于1只中加入反应混合液3ml,KH2PO41ml,作为校零对照,另1只中加入反应混合液3ml,上述酶液1ml,立即开启秒表记录时间,于分光光度计上测量吸光度值,每隔1分钟读数一次,读数于波长470nm下进行。
3.以每分钟吸光度变化值表示酶活性大小,即以ΔA470/min.mg 鲜重表示之。
4.植物样品中过氧化物酶活性的测定:采用粗天平称取剪碎、混匀的植株叶片1g,于研钵中加入少许蒸馏水及约0.2gCaCO3,研磨成匀浆状.转移全部匀浆至100mL容量瓶中并补充体积至刻度,摇匀.取25mL悬浮液注入50mL量瓶中,用10%硝酸钙溶液稀释至刻度,摇匀,在定期摇动下浸泡30-40min.经过滤后,采用愈创木酚法测定过氧化物酶活性[4].叶面积测量法单叶表面积的估算采用坐标纸描绘法,即先随意挑取48片叶描绘在坐标纸上,计算出面积,然后以长(a)×宽(b)为变量,叶面积为依变量进行线性回归,方程式为:y=0.87ab-0.21 r2=0.98。
单叶面积依此公式将叶长、叶宽换算而得。
特殊叶面积为单叶面积与单叶重量的比值。
单株总叶面积为叶重和特殊叶面积的乘积。
叶面积率为单株总叶面积与植株总重的比值。
根形态测定法1)菜豆试验.采用分层式磷控释砂培试验。
植物组织中过氧化氢含量的测定

植物组织中过氧化氢含量的测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
因此,植物组织中H2O2含量与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量。
一、实验原理H2O2与硫酸钛生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在410nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
TiSO4(TiO2)+H2O2 [TiO(H2O2)]2 (桔黄色沉淀)二、实验材料与设备1)仪器和用具研钵;移液管0.2ml×2支,5ml×1支;离心管5ml×8支;离心机;分光光度计。
2)材料和试剂小麦叶片;100μmol/L H2O2丙酮试剂;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
三、实验步骤1)制作标准曲线:取10ml离心管7支,顺序编号,并按表1加入试剂。
表1测定H2O2浓度标准曲线配置表离心管号试剂(ml)1234567 100μmol/L H2O200.10.20.40.60.8 1.0 4℃下预冷丙酮 1.00.90.80.60.40.20 5%硫酸钛0.10.10.10.10.10.10.1浓氨水0.20.20.20.20.20.20.2离心5000r/min 离心5min,弃去上清夜,留沉淀2mol 硫酸 5.0 5.0 5.0 5.0 5.0 5.0 5.0待沉淀完全溶解后,将其小心倒入分光光度计的比色皿中,在410nm波长下比色,记录数据,做出H2O2浓度标准曲线(图1)。
图1 标准曲线(由于R²=0.9999,可得出线性特别好)注:1、横轴为H2O2的每毫升微摩数,纵轴为A=410nm下的分光度;2、由于实验当天未作出标准曲线。
图1中的标准曲线数据为老师做出来给的。
但标准曲线要用的数据是标准方程的斜率,因此无论过氧化氢的浓度是升高或是降低,均不影响实验结果。
