western蛋白提取步骤
Westernblot实验操作步骤

Western blot实验步骤一、制备蛋白样品(单层贴壁细胞总蛋白提取)1.倒掉细胞培养液,加3ml预冷的PBS洗涤细胞,重复两次,弃掉PBS后将细胞培养瓶置于冰上。
2.裂解液RIPA(强)1ml +PMSF10ul(100:1),两者混匀后加入培养瓶中裂解细胞,冰上裂解30min,为使细胞充分裂解,培养瓶要经常来回摇动。
3.裂解完后,用细胞刮将细胞刮于一侧(动作要快),转移至ep管中.4.4度,12000rpm,离心5min.离心后取上清至新的ep管中,用于后续实验(-80保存)常用蛋白收样:倒掉细胞培养基后,预冷PBS洗涤细胞2次,弃去,再加入1ml PBS,用细胞刮轻轻刮取细胞,转移至1.5ml ep管中,12000rpm,离心5min,尽量吸净上清,沉淀于-80保存,用于后续实验。
融化蛋白样品,加入RIPA+PMSF细胞裂解液(200ul/ep管),充分混匀,冰上裂解20min,4度离心,5min ,12000rpm,小心吸取上清至新的ep管中。
二、蛋白浓度测定(BCA法)BCA(碧云天)蛋白浓度测定试剂盒灵敏度高,检测浓度下限达到25ug/ml,最小检测蛋白量达到0.5ug,待测样品体积为1-20ul。
在50-2000ug/ml浓度范围内有较好的线性关系。
标准蛋白BSA浓度:5mg/ml (-20保存) ,完全溶解蛋白标准品,取10ul稀释至100ul,使终浓度为0.5mg/ml(ug/ul)。
蛋白样品在什么溶液中,标准品也宜用什么溶液稀释。
但为了简便起见,也可以用0.9%NaCl或PBS稀释标准品。
1. 配置BCA工作液A液: B液= 50 : 1 ,混匀 A液+B液=200ul (每个样本)样本数量: 7个标准品 + N 个待测蛋白样本2. 先将每孔加入200ul BCA工作液,再加入蛋白样本。
(96孔板),总体积为10ul.待测蛋白样本先10倍稀释。
3.37度,温箱中孵育30min。
WB实验步骤详解

WB实验步骤详解Western blotting(简称WB)是一种常用的蛋白质检测技术,通过将蛋白质分离、转移和检测,可以用来确定特定蛋白质的存在和表达水平。
本文将详细介绍WB实验的步骤,以帮助读者了解该技术的操作流程。
1. 细胞培养和蛋白提取。
首先,需要培养细胞并收集细胞样本。
将细胞样本离心,去除培养基,然后用PBS洗涤细胞。
接下来,加入细胞裂解液并振荡离心,收集上清液,即为蛋白提取物。
2. 蛋白质浓度测定。
使用BCA或Bradford方法测定蛋白提取物的浓度,以确保后续实验中使用的蛋白质量一致。
3. SDS-PAGE凝胶电泳。
将蛋白提取物加入蛋白负载缓冲液,然后加入SDS-PAGE凝胶槽中。
进行电泳分离蛋白质,根据蛋白质大小和电荷不同,蛋白质会在凝胶中形成不同的条带。
4. 蛋白质转印。
将SDS-PAGE凝胶中的蛋白质转移到膜上,通常使用半湿式或全湿式转印。
将蛋白质从凝胶转移到膜上,使得蛋白质可以与抗体结合。
5. 阻塞。
将膜放入含有蛋白质的溶液中,如5%脱脂奶粉或蛋白质阻塞缓冲液中,阻塞非特异性结合位点。
6. 一抗孵育。
加入第一抗体,孵育过夜。
第一抗体与目标蛋白结合,形成抗原-抗体复合物。
7. 洗涤。
用TBST或PBS洗膜,去除未结合的抗体。
8. 二抗孵育。
加入HRP标记的二抗,孵育1小时。
二抗与第一抗体结合,形成复合物。
9. 洗涤。
用TBST或PBS洗膜,去除未结合的二抗。
10. 显色。
加入ECL显色液,使得膜上的蛋白质产生发光反应。
将膜放入暗室中,用X光片曝光,然后用显影液显影。
11. 图像获取和分析。
将X光片放入X光片扫描仪中,获取蛋白质条带的图像。
使用图像分析软件,如ImageJ,分析蛋白质的相对表达水平。
以上就是WB实验的详细步骤,每一步都至关重要,需要严格按照操作规程进行。
希望本文能够帮助读者更好地理解WB实验的操作流程,并在实验中取得准确、可靠的结果。
western蛋白提取步骤

western蛋白提取步骤•相关推荐western蛋白提取步骤蛋白提取方法一、对于培养细胞样品:1. 融解Western及IP细胞裂解液,混匀。
取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
2. 对于贴壁细胞:去除培养液,用PBS、生理盐水或无血清培养液洗一遍(如果血清中的蛋白没有干扰,可以不洗)。
按照6孔板每孔加入100-200微升(6cm培养皿200-300ul)裂解液的比例加入裂解液。
用枪吹打数下,使裂解液和细胞充分接触。
通常裂解液接触细胞1-2 秒后,细胞就会被裂解。
对于悬浮细胞:离心收集细胞,用手指把细胞用力弹散。
按照6孔板每孔细胞加入100-200微升裂解液的比例加入裂解液。
再用手指轻弹以充分裂解细胞。
充分裂解后应没有明显的细胞沉淀。
如果细胞量较多,必需分装成50-100万细胞/管,然后再裂解。
大团的细胞较难裂解充分,而少量的细胞由于裂解液容易和细胞充分接触,相对比较容易裂解充分。
3. 在冰上充分裂解20-30min后,10000-14000g离心3-5分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。
裂解液用量说明:通常6孔板每孔细胞加入100微升裂解液已经足够,但如果细胞密度非常高可以适当加大裂解液的用量到150微升或200微升。
二、对于组织样品:1. 把组织剪切成细小的碎片。
2. 融解Western及IP细胞裂解液,混匀。
取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的`最终浓度为1mM。
3. 按照每20毫克组织加入100-200微升裂解液的比例加入裂解液。
(如果裂解不充分可以适当添加更多的裂解液,如果需要高浓度的蛋白样品,可以适当减少裂解液的用量。
)4. 用玻璃匀浆器匀浆,直至充分裂解。
5. 充分裂解后,10000-14000g离心3-5分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。
western膜蛋白的提取

western膜蛋白的提取分离膜蛋白的方法有两种:1先分离膜,然后提取;2用特殊的去污剂选择性的分离。
第二种方法简单,可靠,但有时含有其他蛋白。
原理:4度时所有的蛋白质原则上都溶于TritonX114水溶液,但在37度时,此溶液分为水相和去污相;此时亲水性蛋白溶于水相,疏水的膜蛋白溶于去污剂相中。
方案1)放射性标记受试细胞2)将标记的细胞放在冰上3)去除上清,用pH7。
4的冷磷酸盐缓冲液洗涤单层细胞两次4)加入1ml2%TritonX溶液冰浴15min5)刮下单层细胞,4度下10 000g 5min离心6)溶液37度水浴10min以分离水相和去污剂相,然后37度下2 000g离心5min7)收集水相留作分析8)用500ul冰冷的buffer C溶解去污剂相沉淀,冰浴2min后加温,在按步骤6再次离心9)按步骤8再次抽提去污剂相,用buffer C将洗涤后的去污剂相稀释到初始体积10)用等量的buffer A分别稀释水相与去污相,并进行免疫沉淀实验试剂:1)2%tritonX114:2%TritonX114、50mmol/L Tris HCl(pH7。
5)、蛋白酶抑制剂2)缓冲液A(含0。
5mol/LNaCl的RIPA buffer)3)buffer C10mmol/L Tris HCl(pH7.5)150mmol/L NaCl5mmol/L EDTA(PH7.5)这是我在nwfsc上求助膜蛋白提取时别人发给我的email,其实膜蛋白的提取的方法依据膜蛋白的不同类型方法也不一样。
是组织还是细胞,细胞膜膜结合蛋白还是细胞器结构膜蛋白,如果是细胞的话建议你买个膜蛋白抽提试剂盒吧。
I'll give you these protocols that I use. The first is for isolation of mitochondria from liver and the other is for the isolation of membrane proteins. Both of these are specific to my needs and you will want to optimise them for your own needs. For the isolation of membrane proteins you will need to find references for your specific protein. The buffers and conditions that I use will not be suitable for all proteins.Isolation of mitochondria (adapted from O'Gorman et al. FEBS Lett. 414 (1997) 253-257) Isolation buffer: Mannitol 200mM Sucrose 70mMHEPES 2mMEDTA 0.5mMBSA 0.5mM pH 7.4Wash buffer: Mannitol 200mMSucrose 70mMHEPES 2mM pH 7All experimental work is carried out at 4degC and in the presence of 500uM PMSF. (the PMSF can be substituted for AEBSF but one or the other must be used)Liver is removed from Wistar rat and placed in cold isolation buffer. the liver is cut up into 4x2g pieces. Each piece is placed in1ml isolation buffer and chopped up with scissors to form a mince. This mince is placed in a Potter tissue grinder and 2ml more isolation buffer is added. The mince is homogenised with four passes of the grinder and more isolation buffer is added until the total volume is 10ml. The homogenate is put into a centrifugetube and 10ml more isolation buffer is added to give a 10% homogenate (2g of tissue in 20ml of buffer). Repeat this process with the other pieces of tissue.Differential centrifugation is used to isolate mitochondria.Centrifuge at 560g for 15min. This will give a pellet of large cell debris and nucleus (I discard this pellet)Centrifuge the supernatant from the first spin at 7000g for 15min. This gives a pellet of mitochondria. The supernatant will contain microsomes and cytosol (the microsomes can be separated by centrifuging at 21,000g for 40 min)Resuspend the pellet you want in 10ml of washing buffer and then centrifuge again at the speed required. Repeat this step until the pellet has been washed 3 times.Now you have a cellular pellet you can start to isolate your protein from it.With this protocol the most important thing to do is remember the AEBSF or PMSF. If you do not add it your protein may become degraded before you can isolate it.Isolation of membrane bound protein (adapted from Zwizinski and Schmidt Arch. Biochem Biophys 294 (1992) 178-183 and Belzacq et al. Oncogene 20 (2001) 7579-7587) The protocol will really depend on the properties of the protein that you want to isolate. Basically I use a lysis buffer like this:KH2PO4 40mMKCl 40mMEDTA 2mMTriton X-100 6%Basic protocolMix cellular pellet with 4ml of lysis buffer. Briefly vortex and mix for 30 min at 4degC. Place solution in tubes and centrifuge at 30,000g for 60min. This will separate the lysed membrane fromthe proteins that are soluble in a 6% Triton soln. Check to see what your protein is soluble in. It may be that you need to alter the buffer.I'm sorry that I can't add more to this protocol as the rest is specific to VDAC and is quite good at removing all other membrane proteins.Well I hope that this helps you and I apologise for not having replied sooner.1、因为我接下去是做western 的,所以只要膜蛋白在里面就可以了,这样是不是只要提取总的蛋白就够了,还是应该纯度高一些,提了总的蛋白之后再提取膜蛋白,这样会不会损失很大啊。
wb蛋白提取步骤

wb蛋白提取步骤WB蛋白提取步骤引言:WB蛋白提取是一种常用的实验技术,用于研究蛋白质的表达及其相互作用。
本文将详细介绍WB蛋白提取的步骤,包括细胞裂解、蛋白质提取、浓缩和检测等关键步骤。
一、细胞裂解细胞裂解是WB蛋白提取的第一步,旨在破坏细胞膜、细胞核膜以及其他细胞组分,释放出目标蛋白质。
常用的细胞裂解方法有机械法、化学法和生物学方法等。
其中,最常用的方法是使用细胞裂解缓冲液,通过冷冻-解冻或超声波等方式破坏细胞结构。
二、蛋白质提取蛋白质提取是WB蛋白提取的关键步骤之一。
在细胞裂解后,目标蛋白质以及其他细胞组分被释放到裂解液中。
为了提取目标蛋白质,需要将裂解液进行离心,分离出上清液。
上清液中含有目标蛋白质,可以用于后续的蛋白质浓缩和检测。
三、蛋白质浓缩蛋白质浓缩是WB蛋白提取的重要步骤之一,旨在提高目标蛋白质的浓度,便于后续的蛋白质检测。
常用的蛋白质浓缩方法有醋酸沉淀法、酒精沉淀法和尿素沉淀法等。
在浓缩过程中需要注意控制温度和pH值,以避免蛋白质的降解和聚集。
四、蛋白质检测蛋白质检测是WB蛋白提取的最后一步,用于确定提取的蛋白质是否含有目标蛋白以及其相对丰度。
常用的蛋白质检测方法有SDS-PAGE和免疫印迹等。
其中,SDS-PAGE是一种分离蛋白质的电泳方法,可以根据蛋白质的分子量将其分离成不同的条带;免疫印迹则是通过特异性抗体与目标蛋白质结合,然后使用酶标记的二抗进行检测。
总结:WB蛋白提取是一种重要的实验技术,用于研究蛋白质的表达及其相互作用。
其步骤包括细胞裂解、蛋白质提取、蛋白质浓缩和蛋白质检测等。
通过合理选择和操作这些步骤,可以获得高质量的蛋白提取物,为后续的蛋白质研究提供可靠的基础。
参考文献:[1] Bustin SA, Benes V, Garson JA, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem. 2009;55(4):611-622.[2] Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A.1979;76(9):4350-4354.[3] Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, 1989.。
Western Blotting操作步骤及说明

Western Blot操作方法及步骤1).蛋白质提取Extraction buffer组成:蔗糖0.7 MTris/HCl0.5 MEDTA 50 mMKCl0.1 M配制成母液pH 9.4巯基乙醇2%蛋白酶抑制剂25×取100-200 mg植物叶片,用液氮速冻后用研磨仪打碎(若量比较大可用液氮研磨,分装到多管中),加入500 µl 提取缓冲液,涡旋;完全混匀后加入500 µl 苯酚(分层,取下层酚层), 涡旋;在3000 g 的转速下离心10 min, 4 °C拿两只新的EP管,各取200 µl 离心后的上清液;向两只EP管中各加入1 ml 0.1M NH4Ac(用甲醇溶解配制);在-20°C下沉淀放置至少2 h过夜放置;在13000 rpm转速下离心5 min,4 °C;用0.1 M NH4Ac(用甲醇溶解配制)洗涤,用枪头将蛋白吹散,洗净杂质;在13000 rpm转速下离心5 min,4 °C;取上清后空甩EP管,去除多余的溶液;室温干燥蛋白, 用1% SDS(100ul左右)溶解蛋白。
2). 测定总蛋白浓度。
用BCA蛋白检测试剂盒测定提取物中的蛋白质含量(1)蛋白浓度测定1、考马斯亮蓝G250通过与蛋白质内的氨基和羧基基团间的静电结合作用以及范德华力,考马斯亮蓝与蛋白质形成强但非共价键连接的复合物。
蛋白-染料复合物的形成稳定染料携带的负电荷阴离子,从而产生在膜上或者胶上肉眼可见的蓝色①测定总蛋白浓度步骤:按照BCA试剂盒说明书进行操作1.配制标准曲线的标准样品--胎牛血清蛋白(BSA)浓度BSA原液浓度:5mg/ml②待测样品稀释用Nanophotometer(纳米光度计)初步测一下待测样品的浓度,计算好稀释的体积,使得终浓度在标准曲线区间内。
③加样准备测定标准样品和待测样品各准确吸取20μl溶液于酶标孔中,加入BCA工作液200μl。
WB实验步骤详解

WB实验步骤详解WB实验(Western Blotting)是一种用于检测和鉴定蛋白质的实验技术。
在WB实验中,通常将目标蛋白质从混合蛋白样本中分离出来,然后通过电泳将其分离在聚丙烯酰胺凝胶上,并利用蛋白质转印技术将蛋白质迁移到膜上。
最后,使用特异性抗体进行免疫染色来检测目标蛋白质。
下面是WB实验的详细步骤:1.提取蛋白质:首先,从细胞、组织样本中提取蛋白质。
这个步骤可以使用不同的方法,例如细胞裂解、组织切碎和离心等。
提取的蛋白质可以用于整个WB实验的下一步。
2.蛋白质电泳分离:将提取的蛋白质样本与样品缓冲液混合,然后加载到聚丙烯酰胺凝胶上。
通常使用的凝胶是SDS-(聚丙烯酰胺凝胶电泳),该凝胶根据蛋白质的分子量将其分离开来。
样品加载完毕后,通电进行电泳分离。
较小的蛋白质会迁移到凝胶的上部,较大的蛋白质会停留在凝胶的下部。
3.转印:将电泳分离后的蛋白质转移到膜上。
通常使用的膜是聚偏氟乙烯(PVDF)或硝酸纤维素膜。
在转印之前,通常将凝胶浸泡在转移缓冲液中以增强转印效果。
然后,将凝胶与膜、滤纸层堆叠在一起,将其放置在转印装置中,施加电流进行蛋白质转印。
4.阻断:将转印完成的膜孔洞中的非特异性结合位点进行阻断。
阻断是为了防止以后的抗原-抗体反应受到非特异性结合的干扰。
最常用的阻断剂是1%-5%的非脂牛奶粉或5%-10%的牛血清蛋白。
5.抗体孵育:使用特异性的抗体来检测目标蛋白质。
首先将抗体稀释在主抗体稀释液中,然后将其加到阻断后的膜上进行孵育。
通常在4℃下过夜孵育,使抗体与目标蛋白质结合。
选择合适的抗体对于获得准确的结果非常重要。
6.辅助抗体孵育:将特异性抗体之外的次级抗体添加到膜上,用于识别已结合的主抗体。
这些次级抗体通常与酶(如辣根过氧化物酶)或荧光染料标记进行共轭,以便于标记的抗体的检测。
次级抗体与主抗体结合形成复合物。
7.检测:使用特定的检测方法来显示已结合的抗体。
这些方法可以使用酶标法(如辣根过氧化物酶反应和色素显色)或荧光技术(如荧光染料)。
wb蛋白提取步骤

wb蛋白提取步骤WB蛋白提取步骤引言:WB蛋白提取是一种常用的蛋白质分离和检测方法,广泛应用于生物学研究领域。
本文将介绍WB蛋白提取的步骤,包括细胞裂解、蛋白质浓缩、电泳分离和膜转移等过程。
一、细胞裂解细胞裂解是WB蛋白提取的第一步,主要目的是将细胞膜破坏,释放蛋白质。
细胞裂解的方法有多种,常用的有机械破碎法和化学裂解法。
其中,机械破碎法适用于坚硬的细胞壁,如细菌和酵母菌;而化学裂解法适用于无细胞壁的动物和植物细胞。
二、蛋白质浓缩蛋白质浓缩是为了提高样品中蛋白质的浓度,使其更易于检测。
常用的蛋白质浓缩方法有盐析法、醇沉淀法和凝胶过滤法等。
其中,盐析法是利用蛋白质与盐溶液中的离子相互作用,使蛋白质从溶液中沉淀出来;醇沉淀法则是利用醇与蛋白质的亲和性,使蛋白质在醇溶液中沉淀;凝胶过滤法则是利用蛋白质分子在凝胶中的大小和电荷差异,通过筛选作用将蛋白质从其他物质中分离出来。
三、电泳分离电泳分离是WB蛋白提取的关键步骤,通过电场作用使蛋白质在凝胶上进行分离。
常用的电泳方法有聚丙烯酰胺凝胶电泳和SDS-PAGE电泳。
聚丙烯酰胺凝胶电泳适用于分离较小的蛋白质,其原理是根据蛋白质的分子大小和电荷差异进行分离;而SDS-PAGE电泳则是利用SDS(十二烷基硫酸钠)使蛋白质带负电荷,并根据蛋白质的分子大小进行分离。
四、膜转移膜转移是将电泳分离后的蛋白质转移到膜上,以便进行进一步的检测。
常用的膜转移方法有湿式转移和半干式转移。
湿式转移是将凝胶和膜浸泡在缓冲液中,通过电场使蛋白质从凝胶转移到膜上;而半干式转移则是将凝胶和膜通过滤纸或海绵进行转移,速度更快。
五、膜检测膜检测是WB蛋白提取的最后一步,通过特定的抗体与目标蛋白质结合,并利用染色剂使蛋白质在膜上可见。
常用的膜检测方法有荧光标记法和酶标记法。
荧光标记法是利用荧光标记的抗体与目标蛋白质结合,通过荧光显微镜观察;酶标记法则是利用酶标记的抗体与目标蛋白质结合,通过酶的催化作用产生可见的色素反应。
wb细胞蛋白提取步骤

wb细胞蛋白提取步骤一、背景介绍WB(Western Blot)是一种常用的蛋白质分析方法,通过将蛋白质样品经电泳分离后转移到膜上,再与特异性抗体反应并检测,从而确定目标蛋白的存在与表达水平。
而WB细胞蛋白提取是WB实验的前提,本文将介绍WB细胞蛋白提取的步骤。
二、实验器材准备1. 细胞培养器:细胞培养器是培养细胞的必备设备,可提供适宜的温度、湿度和CO2浓度等环境条件。
2. 细胞离心管:用于离心细胞,分离细胞上清液和细胞沉淀。
3. 细胞裂解液:细胞裂解液是提取细胞蛋白的重要试剂,可选择RIPA缓冲液等。
4. 低温冰箱:用于保存试剂和细胞裂解液等在实验过程中需要低温保存的物品。
5. 离心机:用于离心细胞、沉淀蛋白等。
三、细胞样品准备1. 细胞培养:将需要研究的细胞株在无菌条件下培养至对数生长期。
2. 细胞收集:用PBS等缓冲液洗涤细胞,使细胞悬浮液中不含有培养基或其他杂质。
3. 细胞裂解:将细胞悬浮液加入细胞裂解液中,用震荡器或超声波仪器进行细胞裂解。
四、细胞蛋白提取1. 细胞裂解:将细胞裂解液和细胞悬浮液混合,通过震荡器或超声波仪器进行细胞裂解,破坏细胞膜释放细胞内的蛋白质。
2. 离心:将细胞裂解液离心,分离出细胞碎片和细胞膜等残留物,得到上清液。
3. 蛋白含量测定:使用BCA或Bradford方法等,测定提取的蛋白液中的蛋白质浓度,以便后续实验的样品配比。
4. 储存:将提取的蛋白液分装成适量的小管,存放在低温冰箱中保存,避免蛋白质降解和污染。
五、质检和实验准备1. SDS-PAGE凝胶制备:根据需要分离的蛋白质大小,选择合适的凝胶浓度,制备SDS-PAGE凝胶。
2. SDS-PAGE电泳:将提取的蛋白液按照浓度进行加载,进行电泳分离。
3. 转膜:将电泳分离后的蛋白质转移到PVDF或nitrocellulose膜上,使蛋白质固定在膜上。
4. 阻断:将转膜后的膜放入蛋白质阻断液中,阻断膜上未结合的部分空位。
western原理及主要步骤

western原理及主要步骤Western原理及主要步骤Western原理是一种常用的蛋白质分析方法,通过电泳分离蛋白质并使用特定的抗体进行检测,从而可以定性和定量地分析目标蛋白质的表达水平。
本文将介绍Western原理的基本概念和主要步骤。
一、Western原理的基本概念Western原理是基于免疫学的方法,通过将蛋白质样品进行SDS-PAGE电泳分离,然后将分离的蛋白质迁移到聚丙烯酰胺凝胶(PVDF)或硝酸纤维素膜上。
接下来,膜上的蛋白质与特异性抗体结合,再用次级抗体标记的酶或荧光物质进行检测。
通过观察标记物的产生或荧光信号的强度,可以得出目标蛋白质的表达水平。
二、Western的主要步骤1. 蛋白质样品的制备:首先,需要从细胞或组织中提取蛋白质样品。
常用的方法有细胞裂解、组织匀浆和切片等。
提取的样品需要添加蛋白酶抑制剂以防止蛋白质降解。
2. SDS-PAGE电泳分离:将蛋白质样品与含有SDS和还原剂的样品缓冲液混合,使蛋白质变性并带负电荷。
然后,将混合物注入到聚丙烯酰胺凝胶的孔中,通过电场作用使蛋白质在凝胶中分离。
较小的蛋白质会移动得更快,而较大的蛋白质则移动得更慢。
3. 蛋白质迁移:将分离的蛋白质从凝胶上转移到PVDF或硝酸纤维素膜上。
这一步骤称为蛋白质的迁移或转印。
迁移可以使用湿式或半干式电泳转印系统进行。
4. 阻断和抗体结合:在蛋白质迁移膜上,需要进行阻断以防止非特异性结合。
常用的阻断剂有牛血清蛋白、非脂干奶粉和BSA等。
然后,将特异性抗体与目标蛋白质结合。
5. 检测和显色:使用次级抗体标记的酶或荧光物质,与结合了特异性抗体的蛋白质结合。
常用的次级抗体有HRP(辣根过氧化物酶)和AP(碱性磷酸酶)。
酶标法中,通过添加底物,可以使酶产生产生可见的颜色。
荧光法中,通过激发物质的激发光源,观察蛋白质所产生的荧光信号。
6. 图像分析:使用相应的成像系统记录酶标法的显色结果或荧光法的荧光信号。
实验记录-Western-Blot之蛋白的提取与定量

细胞蛋白的提取与测定一、蛋白提取原理: 蛋白质是一切生命活动的承担者, 为了研究及探索蛋白质的功能、特异性蛋白表达水平、翻译后修饰(甲基化磷酸化等)、蛋白-蛋白或蛋白-核酸之间相互作用的研究, 进一步阐明众多疾病的机制, 同时为疾病治疗提供理论依据, 因此需要提取目的蛋白, 由于蛋白质种类繁多, 结构复杂, 需要通过一些步骤使细胞裂解、杂志去除、蛋白纯化来得到目的蛋白。
贴壁细胞蛋白的提取: (所有操作均在冰上进行)准备相应数量的EP管标记后放放冰上备用裂解液制备: 每1ml蛋白裂解液(RIPA)加入10ul蛋白酶抑制剂(如PMSF保护蛋白, 使其免于被蛋白酶降解), 配好后冰上备用;2.此处以6孔板为例, 吸掉培养基后每孔加入1-2ml冰PBS溶液, 清洗 2-3次, 吸净残余BPS(如果有残留的话有可能使提取的蛋白稀释);3.加入适当体积的裂解液, 让裂解液与细胞充分混匀, 冰上裂解30min;4.裂解完成后, 用细胞刮刀将细胞刮下, 将细胞及裂解液吸入离心管, 放离心机4℃12000rpm 离心30min(离心机提前预冷), 上清即为蛋白溶液, 细胞碎片沉降于底部;5.蛋白提取完成后a.可放置于-20℃保存(长期保存放于-80℃);b.可取出部分进行BCA 定量分析;c.做western blot, 需要对蛋白进行变性处理后储存于-20℃或-80℃的冰箱中保存(根据蛋白变性条件不同有所不同, 例如在100℃的高温下水浴锅煮5-10分钟)。
二、组织中总蛋白的提取:1.将已称重的冷冻组织(约50g)放入预冷好的研钵中, 用研杵快速研磨组织, (有的需要加入液氮), 直至组织被研磨成匀浆(无明显颗粒);2.裂解液制备: 取250ulRIPA裂解液+2.5ul 100mmol/L蛋白酶抑制剂+2.5ul蛋白酶抑制剂复合物Cocktail(多种小分子组成的抑制剂混合物能更好的保护蛋白不被蛋白酶降解);3.取适量研磨的匀浆放入离心管, 加入配好的裂解液, 冰上孵育40min;4.离心: 4℃ 12000rpm 离心15min 保留上清;5.将蛋白溶液防止于-20℃保存(长期保存放于-80℃)。
wb细胞蛋白提取步骤

wb细胞蛋白提取步骤WB细胞蛋白提取步骤引言:WB(Western Blot)是一种常用的蛋白质分析技术,通过该技术可以检测特定蛋白质的存在与表达水平。
而WB细胞蛋白提取是进行WB实验的关键步骤之一,本文将详细介绍WB细胞蛋白提取的步骤。
步骤一:细胞收集需要从培养皿中收集目标细胞。
将细胞培养液倒入50 mL离心管中,离心5分钟(1000 rpm),将上清液去除,留下沉淀的细胞。
步骤二:洗涤细胞将细胞沉淀用无菌PBS洗涤3次,每次洗涤后离心5分钟(1000 rpm),去除上清液。
步骤三:细胞裂解将洗涤后的细胞沉淀加入适量的细胞裂解液(如RIPA缓冲液),并加入蛋白酶抑制剂。
用移液管反复吸取和排放细胞裂解液,使细胞完全裂解。
将细胞裂解液放置在冰上浸泡20分钟,促使细胞内蛋白质释放。
步骤四:离心细胞裂解液将细胞裂解液离心10分钟(12000 rpm),将上清液转移到新的离心管中,以避免沉淀物对后续实验的干扰。
步骤五:测定蛋白浓度采用BCA方法或其他合适的蛋白浓度测定方法,测定细胞裂解液中的蛋白质浓度。
步骤六:蛋白样品制备将细胞裂解液中的蛋白质与蛋白加载缓冲液按照一定比例混合,加入适量的蛋白酶抑制剂,并进行煮沸处理。
煮沸处理的目的是使蛋白质变性,并使其在WB实验中得到更好的分离和检测。
步骤七:SDS-PAGE电泳将蛋白样品加载到SDS-PAGE凝胶中,进行电泳分离。
可以根据需要选择合适的凝胶浓度和电泳条件,以获得最佳的蛋白分离效果。
步骤八:蛋白转膜将电泳分离后的蛋白转移到聚合物膜(如PVDF膜)或硝酸纤维素膜上,可以使用湿法或半湿法转膜方法。
转膜后,可以用荧光素或染色剂对膜进行染色,以观察蛋白质的迁移情况。
步骤九:膜孔堵塞为了防止非特异性结合,需要对转膜后的膜进行堵塞处理。
一般使用5%的脱脂奶粉或3%的BSA等溶液进行堵塞,在室温下搅拌1小时或过夜。
步骤十:一抗孵育将膜与一抗溶液孵育,一抗可以是特异性抗体,用于检测目标蛋白的存在。
wb蛋白提取步骤

wb蛋白提取步骤WB蛋白提取步骤一、引言WB(Western Blot)蛋白提取是一种常用的蛋白质分析方法,通过将样品中的蛋白质分离、定量和检测,可以研究蛋白质的表达水平、功能和相互作用等。
本文将介绍WB蛋白提取的步骤及操作要点。
二、样品准备1. 收集样品:根据研究目的,选择合适的样品进行提取。
样品可以是细胞、组织、血清、培养基等。
2. 样品处理:对于细胞和组织样品,可先用PBS缓冲液洗涤去除残留的培养基或组织液。
对于血清样品,可离心去除悬浮的细胞或血小板。
三、蛋白提取1. 细胞裂解:将细胞沉淀离心后,加入细胞裂解液,使细胞膜破裂释放蛋白质。
可以选择不同的细胞裂解液,如RIPA缓冲液、NP-40缓冲液等。
2. 组织裂解:将组织样品切碎后,加入组织裂解液,将组织细胞破碎并释放蛋白质。
组织裂解液可以选择RIPA缓冲液、Tris-HCl缓冲液等。
3. 蛋白质提取:将裂解液离心,收集上清液,即为蛋白提取物。
可以通过BCA方法或Lowry方法等测定蛋白质的浓度。
四、蛋白质分离与检测1. SDS-PAGE凝胶电泳:将蛋白样品加热变性,然后加载到凝胶孔中,施加电场使蛋白质在凝胶中进行分离。
常用的凝胶浓度为8%~15%。
2. 转膜:将凝胶中的蛋白质转移到膜上,常用的转膜方法有湿式转膜和半干式转膜。
常用的膜材料有PVDF膜和NC膜。
3. 阻断与孵育:将转膜后的膜放入阻断液中进行孵育,阻断非特异性结合位点,避免假阳性结果的产生。
4. 一抗和二抗孵育:将目标蛋白特异性抗体(一抗)孵育于膜上,然后孵育与一抗结合的二抗,二抗中带有标记物,例如辣根过氧化物酶(HRP)等。
5. 显色与成像:使用化学发光法或染色法,使膜上特定蛋白质形成显色带,然后使用成像系统进行成像和分析。
五、结果分析通过观察显色带的位置和强度,可以初步判断蛋白质的表达水平。
根据需要可以进行定量分析,使用专业软件测量带的强度,并与内参蛋白进行比较分析。
六、注意事项1. 样品保存:样品提取后应及时保存,避免蛋白质降解。
Western blot具体实验操作步骤
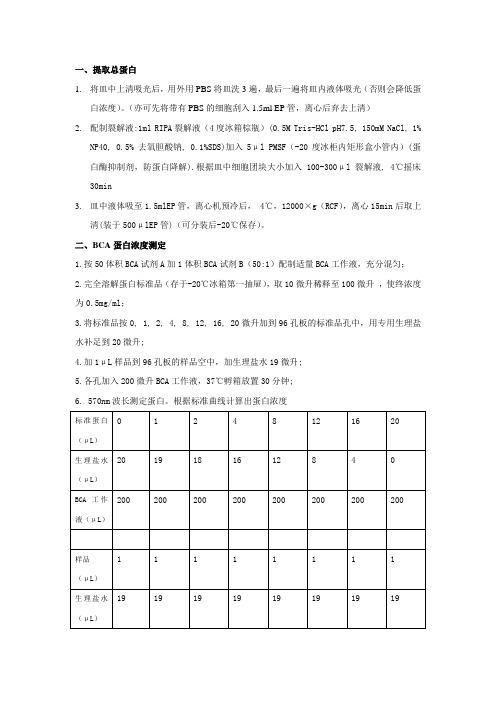
一、提取总蛋白1.将皿中上清吸光后,用外用PBS将皿洗3遍,最后一遍将皿内液体吸光(否则会降低蛋白浓度)。
(亦可先将带有PBS的细胞刮入1.5ml EP管,离心后弃去上清)2.配制裂解液:1ml RIPA裂解液(4度冰箱棕瓶)(0.5M Tris-HCl pH7.5, 150mM NaCl, 1%NP40, 0.5% 去氧胆酸钠, 0.1%SDS)加入5μl PMSF(-20度冰柜内矩形盒小管内)(蛋白酶抑制剂,防蛋白降解).根据皿中细胞团块大小加入100-300μl裂解液, 4℃摇床30min3.皿中液体吸至1.5mlEP管,离心机预冷后, 4℃,12000×g(RCF),离心15min后取上清(装于500μlEP管)(可分装后-20℃保存)。
二、BCA蛋白浓度测定1.按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀;2.完全溶解蛋白标准品(存于-20℃冰箱第一抽屉),取10微升稀释至100微升,使终浓度为0.5mg/ml;3.将标准品按0, 1, 2, 4, 8, 12, 16, 20微升加到96孔板的标准品孔中,用专用生理盐水补足到20微升;4.加1μL样品到96孔板的样品空中,加生理盐水19微升;5.各孔加入200微升BCA工作液,37℃孵箱放置30分钟;6. 570nm波长测定蛋白。
根据标准曲线计算出蛋白浓度EXCEL详细过程:标曲:上一行吸光度,下一行浓度(0,0.5,1,2,4,6,8,10),以此作标曲,标曲相关系数须达两个9,以这次的样品为例,算得两样品浓度分别为4.09和5.26 因为须上样100μg,所以算得须上样的蛋白体积=100/4.09=24.5μL所以上样须补水30-24.5=5.5μL及βme:6×SDS(2:3)为10μL现此样品蛋白体积足够煮10份,即按照245μL蛋白样品+55μL水+100μLβme:SDS(2:3)来配注意:SDS很粘,须涡旋再低速离心,使用枪时须慢吸三、煮蛋白:加样配制: 总体积:40μL(含蛋白液与dH2O混合物30μL+β-meSDS10μL)1.β-巯基乙醇(β-me):6×SDS(2:3)样品缓冲液10μL2.蛋白取量取一组蛋白中,样品蛋白加的体积=蛋白浓度最低的浓度*30μL/每个样品浓度3.剩余的体积即30μL-样品蛋白加的体积,即为各管需补加水的体积4.多加一点防煮时蒸发部分混和后file22-start100℃煮沸5 min。
本实验室Westernblotting实验步骤

1Western blotting 实验步骤 第一步:蛋白质的提取取冻存或新鲜组织黄豆大小200μl 细胞裂解液(用时加DTT 1:100,PMAF 1:100)用玻璃匀浆器捣碎,匀浆---200μl 涮管(注意:组织一定要碎到几乎所有的细胞都破裂)转移至冻存管中几乎所有的细胞都破裂)转移至冻存管中液氮反复冻溶裂解细胞:液氮冷冻---RT 自来水冲洗解冻自来水冲洗解冻3-5次转移至离心管中,4℃高速离心℃高速离心 12000转/分钟分钟80min (60min+30min ) 离两次,每次30min 取上清液,分装,取上清液,分装,--20℃保存备用℃保存备用如果定量检测蛋白质,做Bradford 检测;如果只是定性,此步可省!检测;如果只是定性,此步可省! 《精编分子生物学实验指南》《精编分子生物学实验指南》P332 P332第二步:跑胶将制胶装置洗净装好将制胶装置洗净装好,,配分离胶(随所测蛋白的分子量而变化) 注意:最后加聚合剂TEMED 时一定要边加边摇动配液烧杯,否则会发生局部聚合而使配胶失败用枪将胶沿边缘小心,快速注如板中,体积[3.2 ml]蒸馏水水封蒸馏水水封((加水液封时要很慢,否则胶会被冲变型。
)当水和胶之间有一条折射线时,当水和胶之间有一条折射线时,说明胶已凝了。
说明胶已凝了。
说明胶已凝了。
再等再等3min 使胶充分凝固就可倒去胶上层水并用吸水纸将水吸干。
可倒去胶上层水并用吸水纸将水吸干。
用枪头和滤纸吸净蒸馏水用枪头和滤纸吸净蒸馏水配浓缩胶 (与所测蛋白分子量无关)1ml注胶,插梳子注胶,插梳子RT RT,静置,静置30min自来水冲掉多余的胶自来水冲掉多余的胶装电泳内槽,加电泳Buffer Buffer,拔梳子,拔梳子,拔梳子50μgSample 蛋白蛋白+Sample Buffer +Sample Buffer (6x;6x;微波煮沸微波煮沸3min 3min,冷却,冷却,冷却加样,加样,10-15ul 10-15ul 10-15ul,具体加多少看跑的条带清晰度而定,具体加多少看跑的条带清晰度而定,具体加多少看跑的条带清晰度而定注意:1.1.样品中如果有非蛋白成分会影响电泳效果,应除去。
WesternBlot操作流程

Western Blot操作流程一、蛋白提取准备:1×PBS、吸管、冰盒、细胞裂解液、PMSF(蛋白酶抑制剂)、1.5ml和0.5mlEP管、双蒸水、滤纸、超声仪(用之前、之后及处理不同样本之间均需用双蒸水冲洗,将水用滤纸吸干)、加样枪(200ul和1000ul),Tip头、细胞刮子(使用前、后及不同样本之间,均需用双蒸水冲洗,用滤纸吸干)、封口膜、计时器步骤(所有操作均在冰上进行)1、4℃ 1×PBS洗涤细胞三次后,用力将其内水甩干,将培养瓶倒置于滤纸上,控干约10min。
2、加100ul细胞裂解液,尽可能铺满器皿。
(用加样枪均匀成Z字形走行加样、第一瓶完后即开始计时30min)3、冰上裂解30min(准备细胞刮子;准备EP管,并将其做好标记;准备离心机设置为4℃12000rpm 12min等其降温)4、将细胞刮入1.5ml EP管中(将产物刮至瓶底,用1000ul枪吸出),用手上离心机瞬时离心数秒。
5、用超声波破碎细胞、剪切DNA(超声时间<5S,超声间隔约6S,剪切DNA至溶液不粘稠为止,超声次数约为6~8次;将探头接触到EP管底部,但不要用力,不容易出气泡)6、用封口膜封口7、沸水浴5~10min一般8min(沸水浴时,用1000W火锅即可,不要盖锅盖)8、4℃ 12000rpm 离心 12min,取上清也,根据自己的蛋白用量分装,-20℃或-70℃冻存备用。
二、蛋白浓度测定准备:96孔板、75%酒精棉球、双蒸水(DW)、0.5mlEP管、37℃水浴箱、酶标仪(波长调至570nm)、加样枪、Tip头步骤:1、用酒精棉将96孔板所需孔擦干净,放入37℃温箱,待酒精挥发干净2、空白管加入25ulDW、样品管加入22.5ulDW+2.5ul待测蛋白3、将分析液按A:B=50:1的比例混合,涡旋混匀,瞬时离心4、在各EP管中加入200ul分析液,涡旋混匀,瞬时离心5、37℃水浴30min,使分析液与蛋白样品充分反应6、取100ul各样品加入96孔板中,用酶标仪测蛋白浓度7、所读数值为OD值,按试剂盒所测出的标准曲线计算样品的蛋白浓度(Cpro)8、计算如下项目:OD测、Cpro、Vpro、Mpro、V上样缓冲液(终用法为1×)、V总三、Western blot相关试剂的配制1、1×PBS 1000ml 2000mlNaCl 8.0g 16.0gKCl 0.2g 0.4gNa2HPO4.12H20 3.58g 7.16gKH2PO40.2g 0.4gdddH2O 1000ml 2000ml2、0.5mol/L EDTA(PH=8.0)DdH2O 800ml NaOH约EDTA-Na.2H2O 186.1g 20g 调节PH至8.0,定容至1000ml或称取EDTA 9.3g,加ddH2O 50ml,边搅拌边加NaOH固体(约1g)调PH值至8.03、细胞裂解液0.5mol/L EDTA(PH=8.0) 40ul10% SDS 4ml1mol/L Tris.HCl(PH=6.8) 1ml 混匀定容至20mlddH2O 14.96ml蛋白酶抑制剂(用之前加) 10ul4、30%丙烯酰胺(保存最好不超过两个月)丙烯酰胺(Arcylamide) 29g(神经毒性) 加热至补水至 N,N’-亚甲双丙烯酰胺(bis- Arcylamide) 1g 37℃溶解 100ml 于棕色瓶中保存于室温5、1.5mol/L Tris (PH=8.8) 100mlTris-base 18.15gddH2O 80ml 定容至 100ml浓HCl 约 3ml6、1mol/L Tris(PH=6.8) 100mlTris-base 12.1gddH2O 80ml 定容至 100ml浓HCl 约7~8ml7、10%SDS(w/v) 100ml定容至100ml,室温保存,长期保存或温度很低时若出现沉淀,水浴溶解后可再使用8、10%过硫酸铵(APS)现用现配APS 0.1 g 溶解混匀后4℃保存,ddH2O 1.0ml 保质期为2W左右9、分离胶配方:(不同浓度适用于不同分子量的蛋白),具体各浓度胶的分离范围和配方详见《分子克隆》。
Western blot 之蛋白提取

Western blot 之蛋白提取(protocol)一、蛋白提取准备:冰浴盒、冰、小烧杯、EP管(1.5ml)、小镊子、RIPA裂解液(4℃保存,试剂盒中含PMSF,-20℃保存)、蛋白酶抑制剂(protease inhibitor tablets)、磷酸酶抑制剂(phosphatase Inhibitor cocktail 3)、15ml离心管(裂解液)、移液器、超声粉碎机、低温高速离心机、BCA蛋白定量试剂盒、96孔板、酶标仪、4×蛋白上样缓冲液(分装1ml/管,-20℃保存)、二、蛋白提取操作:1. -80℃取出组织,冰上复温;由冻存管移入1.5mlEP管,并重新编号;(1、2、3、4、5、6分别为sham、3h、12h、24h、3d、7d)2. 加裂解液;a、裂解液配制:(10mlRIPA(4℃)+100ulPMSF(-20℃)+100ul蛋白酶抑制剂(4℃ 10×、1×)+1-2ul磷酸酶抑制剂)注:磷酸酶抑制剂作用是保护已磷酸化蛋白,避免其降解破坏,所以加之有益无害。
b、加入EP管,1mg:10-20ul;(400ul/EP管,不要求精确)3. 匀浆;机械(电动匀浆机);超声粉碎机√附:超声粉碎机操作:a、打开电源;b、确认设置;(默认)c、蒸馏水清洗机头;(每次换样本均要清洗、避免污染、并擦干)d、匀浆;(电源键控制机头启停,装有标本的1.5mlEP管置入小烧杯冰浴中,匀浆过程反复上下活动,充分匀浆组织)4. 冰浴静置30分钟;(再加裂解液600ul至总量1000ul;)5. 预开机制冷,12000rpm,4℃,离心20分钟;离心结束后,取上清至新1.5mlEP管;附:低温高速离心机操作:a、开机;b、设置speed、time、temp,注意ROTOR内外对应;12154(1.5ml或2mlEP管)c、温度降至预设温度后,配平,开始;6. BCA试剂盒蛋白定量a.配制工作液;BCA试剂:CU试剂=50:1(5mlBCA+100ulCU);(标准品数量+样品数量)×200ul;充分混匀,24小时室温稳定;b.各孔加BCA工作液200ul;c、稀释标准品;(0.5mlEP管)①90ulPBS稀释液+10ulBSA标准品(-20℃),至100ul,浓度0.5mg/ml;②加稀释后的标准品至96微孔板标准孔中:20、16、12、 8、 6、 4、 2、 0 ul加PBS补足至20ul:0、 4、 8、12、14、16、18、20 ul实际浓度:0.5、0.4、0.3、0.2、0.15、0.1、0.05、0mg/mld、样品稀释;(0.5mlEP管)(尽可能让样品点落在标准线1/2后),样品量不能少于2ul,否则误差太大。
Western Blotting(半干转) 超级详细步骤

Western Blotting Analysis Guide(半干转)Western blotting (半干转)可分为以下9个步骤:一、蛋白的提取A.总蛋白提取1. 将收集的细胞或组织(约0.1 g)从-80°C冰箱取出,按1:10 (w:v)加入冰浴的蛋白裂解液(RIPA);并加入1/10体积的蛋白酶抑制剂(PMSF)2. 用Dounce 手动匀浆器或电动匀浆器,匀浆细胞或组织(注意:全程冰上操作,每个样品用Dounce 上下抽动相同的次数,电动匀浆器匀浆相同的转速及时间)3. 冰上静置20 min 后,12000 rpm 离心,4 °C,15 min,取上清。
B.核蛋白提取1. 称取100 mg 肝脏冰冻组织置于Dounce 手动匀浆器,加入1 mL 冰浴的核蛋白裂解液A,上下抽动5下(注意:全程冰上操作,不同组织上下抽动需摸条件,匀浆后能看到些许小组织块)2. 将匀浆液倒入1.5 mL 离心管,瞬时离心30 s3. 上清倒入另一1.5 mL 离心管,冰浴5 min4. 3000 rpm 离心,4 °C,10 min,上清倒入另一1.5 mL 离心管收集(此为胞浆蛋白)5. 沉淀加入50 μL 核蛋白裂解液B 吹打,冰浴20 min6. 12000 rpm 离心,4 °C,20 min,将上清吸入0.5 mL 离心管收集(此为核蛋白)。
二、蛋白浓度的测定在碱性条件下,BCA 与蛋白质结合时,蛋白质将Cu2+还原为Cu+,一个Cu+螯合二个BCA 分子,工作试剂由原来的苹果绿形成紫色复合物,最大光吸收强度与蛋白质浓度成正比。
1.BCA标准品和样品的准备:(BCA标准品为5mg/mL)配制1mg/mL的标准品:取10 μL原标准品+ 40 μL PBS缓冲液混匀,浓度为1mg/mL 配制0.25 mg/mL的标准品:取5 μL上述1mg/mL的标准品+ 15 μL PBS缓冲液混匀,浓度为0.25 mg/mL样品用水以1– 5倍稀释,并且将蛋白裂解液用PBS缓冲液按相同的比例稀释作为样品的空白对照(建议样品稀释2倍,不同组织使用不同稀释倍数)。
蛋白质印迹(Western blotting)实验操作步骤

蛋白质印迹/Western blotting实验操作步骤一、总蛋白的提取单层贴壁细胞总蛋白的提取:1)吸除培养液2)每皿细胞加4℃预冷的 PBS。
平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。
重复上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(PBS会降低细胞裂解液的效价和总蛋白的浓度)3)加裂解液于冰上裂解 30 min,为使细胞充分裂解,培养瓶要经常来回摇动(可放置在4℃摇床裂解)。
4)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5mL 离心管中。
(整个操作尽量在冰上进行)5)在EP管中将细胞震碎(10s/次,3次)6)于4℃下 12000rpm 离心 20-30 min。
(离心机提前预冷至4℃)7)将离心后的上清分装转移倒 1.5mL 的离心管中放于-20℃保存。
二、BCA法测蛋白浓度1)将BCA protein assay每孔 A液200μL,B液4μL混合,96孔板每孔加入22.5μLdd水,2.5μL蛋白提取液,200μLA+B混合液2)在烘箱中37℃,90r,孵育30min3)使用酶标仪测出吸光度后,使用公式y=0.9154x-0.118计算出蛋白浓度(浓度需要×10)4)将蛋白配成等浓度等体积(使用配置好的裂解液配),按照4:1加入5X loading buffer然后煮5min(100℃),放入-20℃保存三、SDS-PAGE电泳板子1.5mm,梳子1.5mm1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲洗2)验漏:玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上,加满水验漏3)灌胶:验漏结束后用纸吸干水分,按方法配制下层胶(4mL+4mL+80μLAP),灌胶时,可用 1mL 枪吸取胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加1 mL水,液封后的胶凝的更快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白提取方法
一、对于培养细胞样品:
1. 融解Western及IP细胞裂解液,混匀。
取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
2. 对于贴壁细胞:去除培养液,用PBS、生理盐水或无血清培养液洗一遍(如果血清中的蛋白没有干扰,可以不洗)。
按照6孔板每孔加入100-200微升(6cm培养皿200-300ul)裂解液的比例加入裂解液。
用枪吹打数下,使裂解液和细胞充分接触。
通常裂解液接触细胞1-2 秒后,细胞就会被裂解。
对于悬浮细胞:离心收集细胞,用手指把细胞用力弹散。
按照6孔板每孔细胞加入100-200微升裂解液的比例加入裂解液。
再用手指轻弹以充分裂解细胞。
充分裂解后应没有明显的细胞沉淀。
如果细胞量较多,必需分装成50-100万细胞/管,然后再裂解。
大团的细胞较难裂解充分,而少量的细胞由于裂解液容易和细胞充分接触,相对比较容易裂解充分。
3. 在冰上充分裂解20-30min后,10000-14000g离心3-5分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。
裂解液用量说明:通常6孔板每孔细胞加入100微升裂解液已经足够,但如果细胞密度非常高可以适当加大裂解液的用量到150微升或200微升。
二、对于组织样品:
1. 把组织剪切成细小的碎片。
2. 融解Western及IP细胞裂解液,混匀。
取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
3. 按照每20毫克组织加入100-200微升裂解液的比例加入裂解液。
(如果裂解不充分可以适当添加更多的裂解液,如果需要高
浓度的蛋白样品,可以适当减少裂解液的用量。
)
4. 用玻璃匀浆器匀浆,直至充分裂解。
5. 充分裂解后,10000-14000g离心3-5分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。
6. 如果组织样品本身非常细小,可以适当剪切后直接加入裂解液裂解,通过强烈vortex使样品裂解充分。
然后同样离心取上
(注:文档可能无法思考全面,请浏览后下载,供参考。
可复制、编制,期待
你的好评与关注)。
