温州大学化学专业物理化学(下)期末考试试卷G
温州大学化学专业《物理化学(下)》期末考试试卷G..

温州大学期末考试试卷一、是非题(正确者打‘✓',错误者打‘×’.共10小题,每题1分)1、 质量作用定律是碰撞理论的直接结果。
( )2、 过渡态理论中的“马鞍点”是势能面上的最高点。
( )3、 绝对纯净的液态水可以过冷到0℃以下而不结冰。
( )4、 对于电池:,m 较小的一端是负极。
( )5、 液体在固体表面发生铺展的必要条件是:γs —g γs-l + γl —g ( )6、 光化学反应的量子效率不可能小于1. ( )7、 弯曲液面产生的附加压力的方向总是指向该曲面的曲心。
( )8、 高度分散的CaCO 3的分解压比块状CaCO 3的分解压大。
( )9、 同温度下,小液滴的饱和蒸气压恒大于平面液的饱和蒸气压。
( ) 10、反应级数n 不可能是负数。
( ) 二、选择题(只有一个正确答案,多选得零分。
共30题,每题2分)1、 在电导测量实验中, 应该采用的电源是: ( )①直流电源 ②交流电源③直流电源或交流电源④测固体电导用直流电源, 测溶液电导用交流电源2、 能证明科尔劳乌施经验式 ()的理论是: ( )① 阿仑尼乌斯 (Arrhenius ) 电离理论② 德拜-休克尔 (Debye-Huckel) 离子互吸理论 ③ 布耶伦 (Bjerrum) 的缔合理论④ 德拜-休克尔-昂萨格 (Debye —Huckel-Onsager ) 电导理论3、 法拉弟于1834年根据大量实验事实总结出了著名的法拉弟定律。
它说明的问题是:学院-——-—---—-—--——-—-——-—---———--—-——--—- 班级-——-—-—-------———-—---—-——-——--——- 姓名---—---——--————--—-—-—----——-———-——-— 学号——---—————-—---—--——-—-—-—--—-———--——( )①通过电解池的电流与电势之间的关系②通过电解池的电流与超电势之间的关系③通过电解池的电量与发生电极反应的物质的量之间的关系④电解时电极上析出物质的量与电极面积的关系4、对于理想的水平液面,其值为零的表面物理量是:()①表面能②比表面吉布斯函数③表面张力④附加压力5、有一球形肥皂泡,半径为r,肥皂水溶液的表面张力为γ,则肥皂泡内附加压力等于:()①②③④6、某可逆性电池在以下三种情况下放电:(1)电流趋近于零;(2)有一定大小的工作电流;(3)短路。
温州大学物化期末考试试卷答案

温州大学期末考试试卷答案200 —200 学年第 学期注:一、选择题。
在题后括号内,填上正确答案代号。
(20小题,每题1分,共20分) 1、电解质溶液的电导率随浓度变化的规律为:( 3 )。
(1)随浓度增大而单调地增大; (2)随浓度增大而单调地减小; (3)随浓度增大而先增大后减小; (4)随浓度增大而先减小后增大。
2、相同温度下,下列溶液中摩尔电导率最大的是:( 2 ),最小的是:( 1 )。
(1)1 mol -dm -3 KCl 水溶液; (2)0.001 mol -dm -3 HCl 水溶液; (3)0.001 mol -dm -3 KOH 水溶液; (4)0.001 mol -dm -3 KCl 水溶液。
3、25℃无限稀释的KCl 摩尔电导率为130 S -m 2- mol -1,已知Cl -的迁移数为0.505,在K +离子的摩尔电导率为(单位:S -m 2-mol -1):( 4 )。
(1)130; (2)0.479; (3)65.7; (4)64.35。
4、在25℃无限稀释的水溶液中,离子摩尔电导率最大的是:( 4 )。
(1)La 3+; (2)Mg 2+; (3)NH 4+; (4)H + 。
5、下列电解质溶液:(1)0.01 mol ·kg -1KCl ; (2)0.01 mol ·kg -1CaCl 2;(3)0.01 mol ·kg -1LaCl 3; (4)0.001 mol ·kg -1KCl 。
平均活度因子(系数)最大的是( 4 );最小的是( 3 )。
6、下列电池中哪个电池的电动势与氯离子浓度无关( 3 )。
(1)Zn | ZnCl 2溶液 | Cl 2,Pt ;(2)Zn | ZnCl 2溶液 || KCl 溶液 | AgCi ,Ag ; (3)Ag ,AgCl | KCl 溶液 | Cl 2,Pt ; (4)Pt ,H 2 | HCl 溶液 | Cl 2,Pt 。
大学化学专业《大学物理(下册)》期末考试试卷 附答案

大学化学专业《大学物理(下册)》期末考试试卷附答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、一长为的均匀直棒可绕过其一端且与棒垂直的水平光滑固定轴转动。
抬起另一端使棒向上与水平面呈60°,然后无初转速地将棒释放,已知棒对轴的转动惯量为,则(1) 放手时棒的角加速度为____;(2) 棒转到水平位置时的角加速度为____。
()2、质量为的物体,初速极小,在外力作用下从原点起沿轴正向运动,所受外力方向沿轴正向,大小为。
物体从原点运动到坐标为点的过程中所受外力冲量的大小为_________。
3、设描述微观粒子运动的波函数为,则表示_______________________;须满足的条件是_______________________;其归一化条件是_______________________。
4、在主量子数n=2,自旋磁量子数的量子态中,能够填充的最大电子数是______________。
5、质点在平面内运动,其运动方程为,质点在任意时刻的位置矢量为________;质点在任意时刻的速度矢量为________;加速度矢量为________。
6、真空中有一半径为R均匀带正电的细圆环,其电荷线密度为λ,则电荷在圆心处产生的电场强度的大小为____。
7、设在某一过程P中,系统由状态A变为状态B,如果________________________________________,则过程P为可逆过程;如果_________________________________________则过程P为不可逆过程。
8、四根辐条的金属轮子在均匀磁场中转动,转轴与平行,轮子和辐条都是导体,辐条长为R,轮子转速为n,则轮子中心O与轮边缘b之间的感应电动势为______________,电势最高点是在______________处。
物理化学期末考试题及答案pdf

物理化学期末考试题及答案pdf一、选择题(每题2分,共20分)1. 以下哪种物质的摩尔质量与水(H2O)的摩尔质量相同?A. 氢气(H2)B. 二氧化碳(CO2)C. 氨气(NH3)D. 甲烷(CH4)答案:D2. 根据理想气体定律,当温度和压力保持不变时,气体体积与摩尔数的关系是:A. 成正比B. 成反比C. 无关D. 不确定答案:A3. 以下哪种类型的晶体在熔化时不吸收热量?A. 离子晶体B. 分子晶体C. 金属晶体D. 共价晶体答案:D4. 根据吉布斯自由能变化公式,当ΔG < 0时,反应是否自发进行?A. 是B. 否C. 不确定D. 只在特定条件下自发答案:A5. 以下哪种物质在标准状态下不是气体?A. 氧气(O2)B. 氮气(N2)C. 氦气(He)D. 水(H2O)答案:D6. 以下哪种物质的溶解度随温度升高而降低?A. 氯化钠(NaCl)B. 糖(蔗糖)C. 氢氧化钙(Ca(OH)2)D. 硝酸钾(KNO3)答案:C7. 以下哪种类型的电池是可充电电池?A. 干电池B. 铅酸电池C. 锂电池D. 碱性电池答案:B8. 以下哪种物质的pH值小于7?A. 纯水B. 柠檬水C. 牛奶D. 肥皂水答案:B9. 以下哪种物质的导电性最好?A. 玻璃B. 橡胶C. 铜D. 陶瓷答案:C10. 以下哪种物质的比热容最大?A. 水B. 空气C. 铁D. 铝答案:A二、填空题(每题2分,共20分)11. 阿伏伽德罗常数的近似值是 ________ mol^-1。
答案:6.022 x 10^2312. 物质的量浓度(M)的单位是 ________。
答案:mol/L13. 标准大气压(1 atm)的值是 ________ Pa。
答案:1.01325 x 10^514. 理想气体定律的公式是 ________。
答案:PV = nRT15. 热力学第一定律的公式是 ________。
答案:ΔU = Q - W16. 电化学电池的电动势(E)公式是 ________。
大学化学专业《大学物理(下册)》期末考试试卷B卷 附解析

大学化学专业《大学物理(下册)》期末考试试卷B卷附解析姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、一根无限长直导线通有电流I,在P点处被弯成了一个半径为R的圆,且P点处无交叉和接触,则圆心O处的磁感强度大小为_______________,方向为_________________。
2、一个半径为、面密度为的均匀带电圆盘,以角速度绕过圆心且垂直盘面的轴线旋转;今将其放入磁感应强度为的均匀外磁场中,的方向垂直于轴线。
在距盘心为处取一宽度为的圆环,则该带电圆环相当的电流为________,该电流所受磁力矩的大小为________ ,圆________盘所受合力矩的大小为________。
3、三个容器中装有同种理想气体,分子数密度相同,方均根速率之比为,则压强之比_____________。
4、四根辐条的金属轮子在均匀磁场中转动,转轴与平行,轮子和辐条都是导体,辐条长为R,轮子转速为n,则轮子中心O与轮边缘b之间的感应电动势为______________,电势最高点是在______________处。
5、一个质点的运动方程为(SI),则在由0至4s的时间间隔内,质点的位移大小为___________,在由0到4s的时间间用内质点走过的路程为___________。
6、理想气体向真空作绝热膨胀。
()A.膨胀后,温度不变,压强减小。
B.膨胀后,温度降低,压强减小。
C.膨胀后,温度升高,压强减小。
D.膨胀后,温度不变,压强不变。
7、沿半径为R的圆周运动,运动学方程为 (SI) ,则t时刻质点的法向加速度大小为________;角加速度=________。
8、质点p在一直线上运动,其坐标x与时间t有如下关系:(A为常数) (1) 任意时刻t,质点的加速度a =_______; (2) 质点速度为零的时刻t =__________.9、两个相同的刚性容器,一个盛有氧气,一个盛氦气(均视为刚性分子理想气体)。
温州大学物理化学期末考试卷

温州大学物理化学期末考试试卷一、选择题(只一个正确答案,多选得零分。
共15小题,每题3分)1、 基元反应:B A k2−→−,k A 是与A 的消耗速率相对应的速率常数,则下列微分速率方程式中哪一个是正确的? ( )A.AA Bc k dtdc = B.AA Bc k dtdc 2= C.AA B c k dt dc 21= D.2AA Bc k dtdc =2、 比较一定温度下无限稀薄溶液中H +、Li +、Na +和K +四种离子的电迁移率∞+U 的大小,结果为: ( )A.H +>Li +>Na +>K +B.H+>K +>Na +>Li +C.H +<Li +<Na +<K +D.H +<K +<Na +<Li +3、 能证明科尔劳乌施经验式 ()1(c m m β-Λ=Λ∞)的理论是: ( ) (a ) 阿仑尼乌斯 (Arrhenius) 电离理论(b ) 德拜-休克尔 (Debye-Huckel) 离子互吸理论 (c ) 布耶伦 (Bjerrum) 的离子缔合理论(d ) 德拜-休克尔-昂萨格 (Debye-Hückel -Onsager) 电导理论4、 某可逆电池在以下三种情况下放电:(1)电流趋近于零;(2)有一定大小的工作电流;(3)短路,则在这三种情况下: ( )A.电池电动势的改变B.电池的工作电压(即端电压)不变C.输出的电能相同D.输出的电功率不同5、 在“标准电极电势表”中列出的电极电势θE 都是指25℃时该电极反应中各物质活度均为1时相对于标准氢电极电势之值。
为了精确测定诸电极的θE 值,下列方法(均在25℃下进行)可行的是( )(a ) 精确配制出各电极活性物质的活度为1的溶液组成电池, 测定电池的电动势(b ) 由电解质活度、电解质离子平均活度及与它们相应的浓度之间的关系,求得电解质活度为1时的浓度,以此配制电解质溶液,进行电动势测量(c ) 由实验测定热力学数据(如θm r G ∆), 然后计算θE(d ) 配制浓度不同的一系列电解质溶液, 测出待定电极与标准氢电极组成的电池的一系列电动势E值, 用外推法求出θE6、 在原电池电动势测量中,下列哪一项叙述不正确? ( ) (a ) 用万用表或伏特计直接测定两极间的电势差即可(b ) 工作电池的电动势必须大于标准电池和待测电池的电动势(c ) 使用Weston 电池作标准电池主要是因为它的电动势很稳定,温度系数很小 (d ) 利用电动势法可以测定电解质的离子平均活度因子±γ7、 已知温度为T 时电池反应 -++=+Cl Cu Cl Cu 22212121 (1) 和 -++=+Cl Cu Cl Cu 222 (2)的标准电动势分别为01E 和02E ,则01E 和02E 之间的关系为: ( )A.01E /02E =1/2 B.01E /02E =2 C.01E /02E =1/4 D.01E /02E =18、 在298.15K ,100kPa 下,将金属铅Pb 与醋酸铜Cu(Ac)2溶液的置换反应熵S 的变化为: ( )A.ΔU > 0,ΔS > 0B.ΔU < 0,ΔS < 0C.ΔU > 0,ΔS < 0D.ΔU < 0,ΔS > 09、 已知标准电极电势:V Hg e Hg E 796.0)21(22=→++,V Hg e Hg E 851.0)2(2=→++则反应++=+222Hg Hg Hg 的标准平衡常数θK ln 为: ( )A.4.28B.-28.8C.8.56D.-57.710、反应物A 和B 所组成的体系中存在下列反应H A k−→−12,2/11ARTE H c eA dtdc -=)(2目标产物S B A k−→−+,B A RT E S c c e A dtdc /22-=G B k−→−12,2/33BRTE Gc eA dtdc -= 为有利于S 的生成,下列叙述中正确的是: ( )(a ) 若312,E E E >,则应尽可能选择低温下反应 (b ) 若312,E E E <,则应尽可能选择高温下反应 (c ) 若321E E E >>,则应选择中温下反应(d ) 无法通过控制反应温度来达到目的11、对于单向连续反应:z y x kk−→−−→−21,反应体系中x 、y 、z 的浓度与时间t 的关系如下图所示,请判断1k 与2k 之间的关系。
物理化学下册期末复习试卷和答案

物理化学复习题三[一]单选择题(1) 在实验中,测定溶液的电导实际上是测量溶液的:(a )电流强度 (b )电阻 (c )电动势 (d )电感(2) 满足电池能量可逆条件的要求是:(a )池内通过较大电流 (b )有电流通过电池(c )有限电流通过电 (d )有一无限小的电流通过电池(3) 某电池的电池反应可写成:(1) H 2(g) + 12O 2(g) ─→ H 2O(l) (2) 2H 2(g) + O 2(g) ─→ 2H 2O(l)用 E 1,E 2表示相应反应的电动势,K 1,K 2 表示相应反应的平衡常数,下列各组关系正确的是:(a )E 1= E 2 K 1= K 2 (b )E 1≠ E 2 K 1= K 2(c )E 1= E 2 K 1≠ K 2 (d )E 1≠ E 2 K 1≠ K 2(4) 因正、负离子迁移数不同引起的两溶液界面处的电势差称为:(a )电极电势 (b )接触电势(c )表面电势 (d )液接电势(5) 盐桥的作用是:(a )降低电池的内阻 (b )减小液体接界电势(c )完全消除液体接界电势 (d )提高电池电动势(6) 分别将 CuSO 4、H 2SO 4、HCl 、NaCl 从 0.1 mol dm -3降低到0.01 mol dm -3,则m Λ变化最大的是:(a )CuSO 4 (b )Na 2SO 4 (c )NaCl (d )HCl(7) 在Z n SO 4水溶液中,Z n SO 4的活度a 与离子平均活度α±的关系为:(a )a =a ±(b )a =(a ±)2(c )a =(a ±)4 (d )a =4(a ±)2(8) 下列电池中肯定为不可逆电池的是:(a )Pt |H 2(P 2)|HCl (a )|Cl 2(P 2) |Pt(b )Ag,AgCl(s)|KCl (a )|Hg 2Cl 2(s) |Hg(l)(c )Zn |H 2SO 4(a )|Cu(d )Pb |PbO(s)|N aOH (a )|HgO(s) |H g(l)(9) 在等温、等压下,电池以可逆方式对外作电功的热效应Q R 等于:(a )Q R =∆H (b )Q R =zFT (∂E /∂T )p(c )Q R =zFE (∂E /∂T )p (d )Q R =zEF(10) 291K 时,电池 Pt | H 2(p ∃)|H 2SO 4(m)|O 2(p ∃) | Pt 的E ∃=1.23V, 则 反 应 2 H 2 (g)+O 2(g)→ 2H 2O(l)的标准平衡常数为:(a )1.68⨯1085 (b )4.03⨯1042(c )3.87⨯1043 (d )1.50⨯1083(11) 电极 Pb 2+(a ) | Pb -Hg(a ') 和电极 Pb 2+(a ) | Pb(s) 的电极电势和标准电极电势间的关系为:(a )标准电极电势相同电极电势不同 (b )电极电势相同标准电极电势不同(c )电极电势和标准电极电势均相同 (d )电极电势和标准电极电势均不同(12) 下列物质的水溶液,在一定浓度下其正离子的迁移数(t +)如 A 、B 、C 、D 所列。
大学化学专业《大学物理(下册)》期末考试试卷 附解析

大学化学专业《大学物理(下册)》期末考试试卷附解析姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、一小球沿斜面向上作直线运动,其运动方程为:,则小球运动到最高点的时刻是=_______S。
2、动方程当t=常数时的物理意义是_____________________。
3、如图所示,轴沿水平方向,轴竖直向下,在时刻将质量为的质点由a处静止释放,让它自由下落,则在任意时刻,质点所受的对点的力矩=________ ;在任意时刻,质点对原点的角动量=_____________。
4、一电子以0.99 c的速率运动(电子静止质量为9.11×10-31kg,则电子的总能量是__________J,电子的经典力学的动能与相对论动能之比是_____________。
5、一个质点的运动方程为(SI),则在由0至4s的时间间隔内,质点的位移大小为___________,在由0到4s的时间间用内质点走过的路程为___________。
6、一个半径为、面密度为的均匀带电圆盘,以角速度绕过圆心且垂直盘面的轴线旋转;今将其放入磁感应强度为的均匀外磁场中,的方向垂直于轴线。
在距盘心为处取一宽度为的圆环,则该带电圆环相当的电流为________,该电流所受磁力矩的大小为________ ,圆________盘所受合力矩的大小为________。
7、一维保守力的势能曲线如图所示,则总能量为的粒子的运动范围为________;在________时,粒子的动能最大;________时,粒子的动能最小。
8、气体分子的最可几速率的物理意义是__________________。
9、图示曲线为处于同一温度T时氦(原子量4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
温州大学化学专业《物理化学(下)》期末考试试卷H剖析
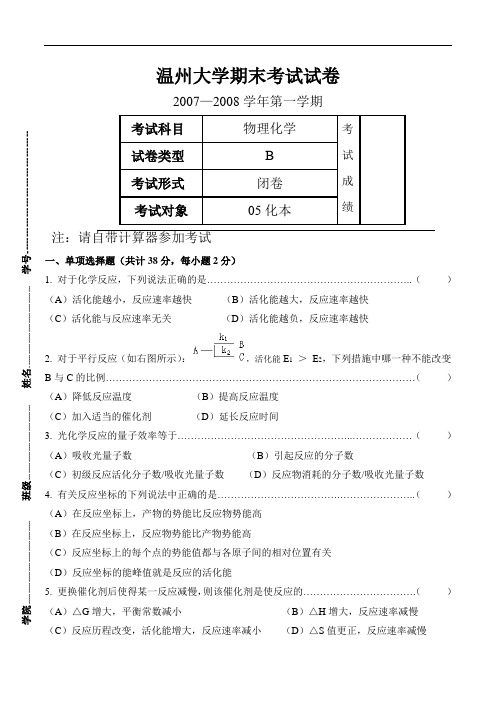
温州大学期末考试试卷 2007—2008学年第一学期考试科目 物理化学 考试成绩 试卷类型 B 考试形式 闭卷 考试对象 05化本 注:请自带计算器参加考试 一、单项选择题(共计38分,每小题2分) 1. 对于化学反应,下列说法正确的是……………………………………………………..( ) (A )活化能越小,反应速率越快 (B )活化能越大,反应速率越快 (C )活化能与反应速率无关 (D )活化能越负,反应速率越快 2. 对于平行反应(如右图所示):,活化能E 1 > E 2,下列措施中哪一种不能改变B 与C 的比例…………………………………………………………………………………( ) (A )降低反应温度 (B )提高反应温度 (C )加入适当的催化剂 (D )延长反应时间 3. 光化学反应的量子效率等于……………………………………………..………………( ) (A )吸收光量子数 (B )引起反应的分子数 (C )初级反应活化分子数/吸收光量子数 (D )反应物消耗的分子数/吸收光量子数 4. 有关反应坐标的下列说法中正确的是……………………………….…………………..( ) (A )在反应坐标上,产物的势能比反应物势能高 (B )在反应坐标上,反应物势能比产物势能高 (C )反应坐标上的每个点的势能值都与各原子间的相对位置有关 (D )反应坐标的能峰值就是反应的活化能 5. 更换催化剂后使得某一反应减慢,则该催化剂是使反应的…………………………….( ) (A )△G 增大,平衡常数减小 (B )△H 增大,反应速率减慢(C )反应历程改变,活化能增大,反应速率减小 (D )△S 值更正,反应速率减慢 学院-------------------------------------- 班级---------------------------------- 姓名------------------------------------- 学号-------------------------------------6. 电解质溶液属于第二类导体导电方式,下列描述的特点中,不正确的是…………..()(A)电阻随温度降低而增加(B)电导随温度升高而增加(C)电导率总是随着溶液浓度增大而增大(D)溶液无限稀释时,摩尔电导率趋于最大值7. 下列对于电解质溶液导电特点的描述中,哪一点是不正确的………………..…….. ()(A)其电阻随温度的升高而增大(B)其电阻随温度的升高而减小(C)其电导的原因是离子的存在(D)当电流通过时在电极上有化学反应发生8. 将反应H+ + OH- = H2O设计成可逆电池,选出下列电池中正确的一个……………..()(A)Pt│H2│H +(aq)║OH -(aq)│O2│Pt (B)Pt│H2│NaOH(aq)│O2│Pt(C)Pt│H2│NaOH(aq)║HCl(aq)│H2│Pt (D)Pt│H2 (P1)│H2O(1)│H2 (P2)│Pt9. 已知φ0(Tl+/Tl)= -0.34V,φ0(Tl 3+/Tl) = 0.72V,则φ0(Tl 3+/Tl+)为……….…………()(A)(0.72×3)+0.34 V (B)0.72×1.5+0.17 V(C)0.72+0.34 V (D)0.72-0.34 V10. 日常使用的锌锰干电池,表示为Zn│NH4Cl(糊状)│MnO2(C),下列反应表示不正确的是…………………………………………………………………….………………………. ()(A)电池反应Zn+2NH4Cl+2MnO2 = Zn(NH3) 2Cl2+2MnOOH(B)负极反应Zn-2e+2NH4Cl = Zn(NH3) 2Cl2+2H2(C)正极反应2MnO2+2H++2e = 2MnOOH(D)正极反应MnO2+4H++2e = Mn+2H2O11. 纯Zn棒插入KCl水溶液中,腐蚀将先在何处发生(如图)……………..…………()(A)A处(B)B处(C)C处(D)D处12. 某溶液中有下列离子Cl -、Br -、F -、NO3-,用AgI固体作吸附剂进行吸附,哪个离子首先被吸附………………………………………………………………………………………()(A)Cl-(B)Br-(C)F-(D)NO3-13. 水在两玻璃板间能形成凹液面,当在两块玻璃板间放一滴水后,与不放水以前比较,拉开(A)更容易(B)更难(C)不变(D)相当14. 表面活性物质在不同情况下,对体系具有提高润湿性及乳化、增溶和起泡等作用,其中与界面张力的降低无直接关系的是……………………………………………………………()(A)提高润湿性(B)乳化(C)加溶(D)起泡15. 有机液体与水形成W/O型还是O/W型乳状液,与乳化剂的HLB值有很大关系,一般是…………………………………………………………………………………………….. ()(A)HLB值大,易形成W/O型(B)HLB值小,易形成O/W型(C)HLB值大,易形成O/W型(D)HLB值小,不易形成W/O型16. 大分子溶液的敏化作用指的是…………………………………….……………………()(A)可以显著提高溶胶的稳定性(B)可以显著减小某一电解质对溶胶的聚沉值(C)直接导致溶胶的聚沉(D)在加入电解质后产生沉淀17. 根据理论,溶胶相对稳定的主要因素是………………………………………………...()(A)胶粒表面存在双电层结构(B)胶粒和分散介质运动时产生ζ电位(C)布朗运动使胶粒很难聚结(D)离子氛重叠时产生的电性斥力占优势18. 胶体分散体系和其它分散体系的主要区别在于…………………….…………………()(A)分散相在普通显微镜下观察不到(B)颗粒不能通过半透膜(C)扩散速度慢(D)胶体粒子大小介于1~100nm19. 用含a mol的AgNO3和b mol KI的溶液制备溶胶,胶团结构为{(AgI)n I(n-q)K}q K;这说明了……………………………………………………………………………………………..()(A)a > b (B)a = b(C)a < b (D)不能确定a、b的关系二、填空题(共计10分,每小题2分)1. 某反应速率常数单位是mol-1·dm3·s-1,则该反应级数为( )2. 某反应在时刻t有两种不同产物,当t → ∞时,其中一种产物浓度趋近于零,而另一种产物浓度趋近于反应物的初浓度(或其倍数),则该反应必然为( )3. 恒温下电解质溶液的浓度增大时,其摩尔电导率( )4. 298K时,在有玻璃电极的电池中,加入pH = 4.00的缓冲溶液,测得电动势为0.1122V;则当电动势为0.2305时,溶液的pH为( )5. 对于(1)电解池的阴极(2)原电池的正极(3)电解池的阳极(4)原电池的负极;由于极化而使电极电势负移的电极是其中的( )1. 有两个都为一级反应的平行反应(如图所示),下列说法中错误的是:……()(A)k= k1 + k2(B)E总= E1 + E2总(C)k1/ k2 = [B] / [C] (D)t1/2 = ln2/( k1 + k2)= k1 - k2(E)k总2. 比较两个电极反应(1)Ag = Ag+ + e;(2)Ag(CN)2- + e = Ag + 2CN -的异同点,下列说法中错误的是:………………………………………………………………….………. ()(A)二者均可称为银电极反应,有相同的电极电位值(B)二电极类型不同,电极电位值也不同(C)电极反应(1)对Ag可逆,(2)对CN -可逆(D)两个电极的值的关系是φ0(Ag+/Ag) = φ0(Ag(CN)2-/Ag) - RT/(nF) ln K a(不稳)(E)两个电极的值的关系是φ0(Ag+/Ag) = φ0(Ag(CN)2-/Ag) - RT/(nF) ln K a(稳)3. 下列反应中活化能为零的是:…………………………………..………………()(A)A· + BC → AB + C· (B)A·+ A·+ M → A2 + M(C)A2+ M → 2A·+ M (D)A2 + B2→ 2AB(E)B·+ B·+ M → B2 + M4. 正丁醇加入水中:…………………………………………………………...……()(A)能增大液体表面张力(B)能显著降低液体表面张力(C)对液体表面张力无影响(D)表现为正吸附(E)表现为负吸附四、计算题(共计35分)1.(本题8分)C14存在于有生命的树木中,C14放射性蜕变的半衰期是5730年,现有一个考古样里仍含72%的C14木质,问考古样的年纪有多大?2.(本题7分)试计算含有0.001mol·dm-3 NaCl和0.003mol·dm-3 Na2SO4的水溶液中Na2SO4的离子平均活度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
温州大学期末考试试卷一、是非题(正确者打‘✓’,错误者打‘×’。
共10小题,每题1分)1、 质量作用定律是碰撞理论的直接结果。
( )2、 过渡态理论中的“马鞍点”是势能面上的最高点。
( )3、 绝对纯净的液态水可以过冷到0℃以下而不结冰。
( )4、 对于电池:Ag m AgNO m AgNO Ag )()(2313,m 较小的一端是负极。
( )5、 液体l 在固体s 表面发生铺展的必要条件是:γs-g ≥γs-l + γl-g ( )6、 光化学反应的量子效率Φ不可能小于1。
( )7、 弯曲液面产生的附加压力的方向总是指向该曲面的曲心。
( )8、 高度分散的CaCO 3的分解压比块状CaCO 3的分解压大。
( )9、 同温度下,小液滴的饱和蒸气压恒大于平面液的饱和蒸气压。
( ) 10、反应级数n 不可能是负数。
( ) 二、选择题(只有一个正确答案,多选得零分。
共30题,每题2分)1、 在电导测量实验中, 应该采用的电源是: ( )①直流电源 ②交流电源③直流电源或交流电源④测固体电导用直流电源, 测溶液电导用交流电源2、 能证明科尔劳乌施经验式 ()1(c m m β-Λ=Λ∞)的理论是:( ) ① 阿仑尼乌斯 (Arrhenius) 电离理论② 德拜-休克尔 (Debye-Huckel) 离子互吸理论 ③ 布耶伦 (Bjerrum) 的缔合理论④ 德拜-休克尔-昂萨格 (Debye-Huckel-Onsager) 电导理论3、 法拉弟于1834年根据大量实验事实总结出了著名的法拉弟定律。
它说明的问题是:学院-------------------------------------- 班级---------------------------------- 姓名------------------------------------- 学号------------------------------------- -----------------------------------------装--------------------------订---------------------------------线---------------------------------------( )① 通过电解池的电流与电势之间的关系 ② 通过电解池的电流与超电势之间的关系③ 通过电解池的电量与发生电极反应的物质的量之间的关系 ④ 电解时电极上析出物质的量与电极面积的关系4、 对于理想的水平液面,其值为零的表面物理量是: ( )①表面能 ②比表面吉布斯函数 ③表面张力 ④附加压力5、 有一球形肥皂泡,半径为r ,肥皂水溶液的表面张力为γ,则肥皂泡内附加压力s p等于: ( )①r p s γ2= ②r p s 2γ= ③r p s γ4=④rp s 4γ= 6、 某可逆性电池在以下三种情况下放电: (1)电流趋近于零;(2)有一定大小的工作电流; (3)短路。
这三种情况下,会导致: ( )①电池电动势的改变 ②电池的工作电压不变 ③所能输出的电能相同 ④所能输出的电功率不同7、 在“标准电极电势表”中列出的电极电势E °都是指25℃时该电极反应中各物质活度均为1时相对于标准氢电极电势之值。
为了精确测定诸电极的E °值,下列方法(均在25℃下进行)可行的是? ( )① 精确配制出各电极活性物质的活度为1的溶液组成电池, 测定电池的电动势 ② 由电解质活度、电解质离子平均活度及与它们相应的浓度之间的关系,求得电解质活度为1时的浓度,以此配制电解质溶液,进行电动势测量 ③ 由实验测定热力学数据(如Δr G °), 然后计算E °④ 配制浓度不同的一系列电解质溶液, 测出待定电极与标准氢电极组成的电池的一系列电动势E 值, 用外推法求出E ° 8、 表面现象在自然界普遍存在,但有些自然现象与表面现象并不密切相关,例如:( ) ①气体在固体上的吸附 ②微小固体在溶剂中溶解 ③微小液滴自动呈球形 ④不同浓度的蔗糖水溶液混合9、 在相同温度下,同一液体被分散成不同曲率半径的分散物系时,将具有不同的饱和蒸汽压。
若以p 平、p 凹和p 凸分别表示平面、凹面和凸面液体上的饱和蒸汽压,则三者的关系为: ( )①p平>p凹>p凸②p凹>p平>p凸③p凸>p平>p凹④p凸>p凹>p平10、为避免暴沸,可在液体中加入多孔性物质沸石,这是因为沸石的小孔中储存有空气可使液体的()①沸点升高②表面张力降低③饱和蒸汽压降低④过热程度大大降低,因为加热时这些气体成为新相种子,使液体绕过了产生微小气泡的困难阶段11、已知温度为300 K时某反应的活化能Ea等于37.4 kJ⋅mol-1,若温度增加1 K,则反应速率常数k增加的百分数约为:()①5% ②90%③11% ④50%12、对于平行反应:下列叙述中哪个是不正确的?()①平行反应的总速率等于各平行反应速率之和②速率方程的微分式和积分式与同级的简单反应的速率方程相似,只是速率系数为各个反应速率系数的和③用合适的催化剂可以改变某一反应的速率,从而提高主反应产物的产量④用改变温度的办法,不能改变产物的相对含量13、对于对峙反应:下列叙述中哪个是不正确的?()①净速率等于正、逆反应速率之差值②达到平衡时,反应净速率不等于零③正、逆速率系数之比等于平衡常数K=k1/k-1④在c~t图上,达到平衡后,反应物和产物的浓度不再随时间而改变14、有一露于空气中的圆球形液膜,若其直径是2×10-3m,比表面吉布斯函数为0.7J·m-2,则它所受的附加压力是: ()①1.4kPa②2.8kPa③5.6kPa④8.4kPa15、有关链反应的特点,以下哪个说法是不正确的?()①链反应的概率因子P 远大于1②链反应一般都有自由原子或自由基参加 ③链反应一开始的速率就很大④直链反应进行过程中,链传递物消耗与生成的速率相等16、 加催化剂能使化学反应的下列哪一项内容发生改变? ( )①反应热 ②平衡常数和平衡转化率③活化能和速率常数 ④反应熵变17、 常见的一些亚稳现象都与表面现象有关,下面的说法正确的是: ( )①过饱和蒸气是由于小液滴的蒸气压小于大液滴的蒸气压所致 ②过热液体形成的原因是新相种子小气泡的附加压力太小 ③饱和溶液陈化,晶粒长大是因为小晶粒溶解度比大晶粒的小 ④人工降雨时在大气中撒入化学物质的主要目的是促进凝结中心形成18、 已知20℃时水-空气的界面张力为0.07275N ·m-1 ,当在20℃和1atm 下可逆地增大水的表面积4cm2 时,物系的ΔG 为: ( )①2.91×10-5J ②2.91×10-1J ③-2.91×10-5J ④-2.91×10-1J19、 一个复杂化学反应可用平衡态近似法处理的条件是: ( )①反应速率快, 迅速达到化学平衡态②包含可逆反应且很快达到平衡, 其后的基元步骤速率慢 ③中间产物浓度小, 第二步反应慢 ④一步反应快, 第二步反应慢20、 下列关于光化学反应哪一项是不正确的? ( )①跟普通热反应一样,反应的活化能来源于分子碰撞②温度对光化学反应速率的影响一般都不大,特殊情况下其温度系数可为负值 ③反应能向0>∆G 的方向进行 ④平衡常数与吸收光的强度有关21、 下列关于过渡态理论的叙述不正确是: ( )① 反应物分子要变成产物,先要经过足够能量的碰撞形成高势能的活化络合物 ② 因为过渡态是处于反应物向产物转化的一个“无返回点”,所以任何情况下都不可能再分解为原始反应物③ 活化络合物以频率ν分解为产物,此速率即为该基元反应的速率④ 活化络合物的键比正常化学键要弱得多,但它仍能象正常分子一样进行平动、转动和有限制的振动。
22、 气体反应的碰撞理论的要点是: ( )① 反应分子可看成刚性球,一经碰撞就能引起反应 ② 反应分子必须互相碰撞且限于一定方向才能引起反应 ③ 反应物分子只要互相迎面碰撞就能引起反应④ 一对反应分子具有足够能量的迎面碰撞才能引起反应23、 微观可逆性原理不适用的反应是: ( )① H 2 + I 2 = 2HI ② Cl· + Cl· = Cl 2③ 蔗糖 + H 2O = C 6H 12O 6(果糖) + C 6H 12O 6(葡萄糖) ④ CH 3COOC 2H 5 + OH - = CH 3COO - + C 2H 5OH 24、 活化能Ea 、临界能(阈能)Ec 和标准活化焓θmr H ≠∆的关系正确的是: ( )①E a > E c > θm r H ≠∆ ②θm r H ≠∆ > E a > E c ③E c > θm r H ≠∆ > E a ④E c > E a > θm r H ≠∆25、 下列光化学反应中,量子产率Φ最大的是哪个? ( )①2HI −→−νh H 2 + I 2 ②3O 2−→−νh 2O 3 ③H 2 + Cl 2−→−νh 2HCl ④H 2S −→−νh H 2 + S(g) 26、 破坏臭氧的反应机理为:NO + O3→NO2 + O2,NO2 + O →NO + O2,其中NO 是:( )①总反应的反应物 ②中间产物 ③催化剂 ④自由基27、 同一体系,表面Gibbs 自由能和表面张力都用γ表示,它们: ( )①物理意义相同,数值相同 ②量纲和单位完全相同 ③物理意义相同,单位不同 ④前者是矢量,后者是标量28、 下列各式中,不属于纯液体表面张力的定义式的是: ( )①p T A G ,⎪⎭⎫⎝⎛∂∂ ②V T A F ,⎪⎭⎫⎝⎛∂∂ ③V S A U ,⎪⎭⎫⎝⎛∂∂ ④pT A H ,⎪⎭⎫⎝⎛∂∂ 29、 表面活性剂是: ( )①能降低溶液表面张力的物质②能增加溶液表面张力的物质③溶入少量就能显著降低溶液表面张力的物质 ④溶入少量就能显著增加溶液表面张力的物质30、 Langmuir 吸附等温式有很多形式,而最常见的是ap ap+=1θ,但它不适用于: ( )①多种分子同时被强吸附 ②单分子层吸附 ③物理吸附 ④化学吸附 三、简答题(共5小题,每题2分)(1) 对于单向连续反应:z y x kk −→−−→−21,试根据下列(a)、(b)、(c)三张图(浓度-时间图)所示情况比较1k 与2k 的大小(在空格处直接填入“=”、“≈”、“>>”、“<<”等最确切的数学符号)。
(2) 当加热一根水平放置的中间装有一段液体的毛细管时,下面(1)、(2)两种情况下液柱将向何方移动?(在图中直接用箭头→表示即可)(1) (2)(3) 用如下实验装置可以验证Laplace 方程r p s γ2=的正确性。
