高中阶段常见酸碱盐溶解性表复习课程
部分酸、碱和盐的溶解性表(室温)

部分酸、碱和盐的溶解性表(室温)
性,“---”表示那种物质不存在或遇到水就分解了。
碱的溶解性
说明:能溶解的碱共有五种,分别是氢氧化钾(KOH)、氢氧化钠(NaOH)、氢氧化钡[Ba(OH)2]、氢氧化钙[Ca(OH)2微溶]、氨水(NH3·H2O又叫一水合氨)。
除此之外的碱都不溶解,像氢氧化铜[Cu(OH)2]是蓝色沉淀,氢氧化铁[Fe(OH)3]是红褐色沉淀,其他的碱都是白色沉淀。
盐的溶解性
说明:
第一句:钾盐、钠盐、铵盐、硝酸盐都易溶于水;
第二句:硫酸盐中除了硫酸钡(BaSO4)难溶,硫酸银(Ag2SO4)和硫酸钙(CaSO4)微溶以外,其他的硫酸盐都易溶于水;第三句:盐酸盐中除了氯化银(AgCl)难溶以外,其他的盐酸盐都易溶于水;
第四句:碳酸盐中除了第一句中的碳酸钾(K2CO3)、碳酸钠(Na2CO3)、碳酸铵[(NH4)2CO3]、碳酸氢铵(NH4HCO3)易溶于水外,还有碳酸镁(MgCO3)微溶,其他的碳酸盐都难溶于水。
常见酸碱盐的溶解性表(20度)+ 反应规律 + 化合价
不
17
Cu2+
不
溶
溶
溶
不
不
不
不
不
18
Hg+
—
溶
不
微
不
不
不
—
不
19
Hg2+
—
溶
溶
溶
不
不
不
—
不
20
Ag+
—
溶
不
微
不Байду номын сангаас
不
不
不
不
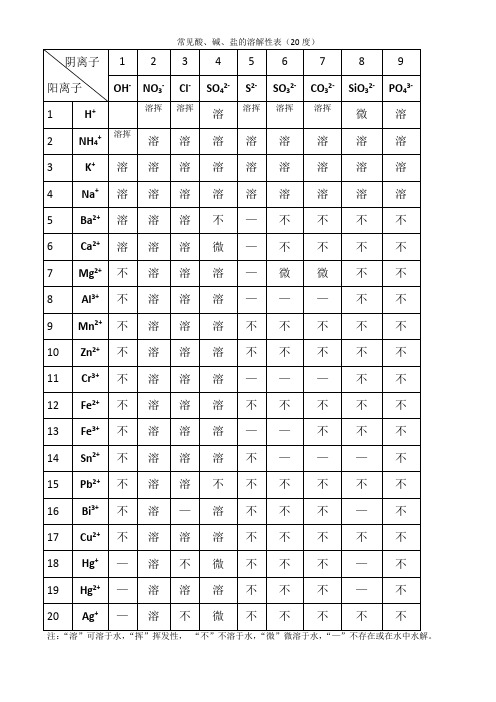
注:“溶”可溶于水,“挥”挥发性,“不”不溶于水,“微”微溶于水,“—”不存在或在水中水解。
常见酸、碱、盐的溶解性表(20度)
阴离子
阳离子
1
2
3
4
5
6
7
8
9
OH-
NO3-
Cl-
SO42-
S2-
SO32-
CO32-
SiO32-
PO43-
1
H+
溶挥
溶挥
溶
溶挥
溶挥
溶挥
微
溶
2
NH4+
溶挥
溶
溶
溶
溶
溶
溶
溶
溶
3
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
4
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
5
Ba2+
溶
溶
溶
不
—
不
不
不
酸碱盐的溶解性表

说明:此为2(rc时的情况。
"溶"表示那种物质可溶于水, "不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,表示那种物质不存在或遇到水就分解了背诵口诀1 •钾钠鞍盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶换不溶硝酸盐遇水影无踪钾钠锁钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:4初中用够了.红褐铁,代表铁盐沉淀为红褐色[fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2•氯化银【不溶酸】,碳酸钙,碳酸换,硫酸顿【不溶酸】,氢氧化铝.氢氧化镁,为白色沉淀。
氢氧化铁〔红褐色〕氢氧化铜〔蓝色〕说明【】内为前一物质的特点2•钾钠镀盐全都溶其他全都不能溶AgCL BaSO4酸也不溶-氧气的性质:4〕单质与氧气的反响:〔化合反响〕1. 镁在空气中燃烧:2Mg + 02点燃2MgO2. 铁在氧气中燃烧:3Fe + 202点燃Fe3O43.铜在空气中受热:2Cu + 02加热2CuO4.铝在空气中燃烧:4A! + 302点燃2AI2O35.氢气中空气中燃烧:2H2 + 02点燃2H2O6•红磷在空气中燃烧〔研究空气组成的实验〕:4P + 502点燃2P2O57. 硫粉在空气中燃烧:S + 02点燃SO28. 碳在氧气中充分燃烧:C+O2点燃CO29. 碳在氧气中不充分燃烧:2C + 02点燃2CO(2)化合物与氧气的反响:10. 一氧化碳在氧气中燃烧:2CO + 02点燃2CO211. 甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 302点燃2CO2 +3H2O⑶氧气的来源:13 •玻义耳研究空气的成分实验2HgO加热Hg+ 02 t14 •加热高猛酸钾:2KMnO4协热K2MnO4 + MnO2 + 02 t〔实验室制氧气原理A15 •过氧化氢在二氧化猛作催化剂条件下分解反响:H2O2MnO22H2O+ 02 t〔实验室制氧气原理2]二自然界中的水:电2H2T+ 02 t17. 生石灰溶于水:CaO + H2O == Ca(OH)218. 二氧化碳可溶于水:H2O + CO2==H2CO319.镁在空气中燃烧:2Mg + 02点燃2MgO 21.氢气复原氧化铜:H2 + CuO加热Cu + H2O 22.镁复原氧化铜:Mg + CuO加热Cu + MgO四、碳和碳的氧化物:⑴碳的化学性质23.碳在氧气中充分燃烧:C + 02点燃CO2 24 .木炭复原氧化铜:C+ 2CuO高温2Cu + CO2t 25.焦炭复原氧化铁:3C+ 2Fe203高温4Fe + 3CO2T⑵煤炉中发生的三个反响:〔几个化合反响〕26 •煤炉的底层:C + 02点燃CO2 27.煤炉的中层:CO2 + C高温2CO 28.煤炉的上部蓝色火焰的产生:2CO + 02点燃2CO2⑶二氧化碳的制法与性质:29 •大理石与稀盐酸反响〔实验室制二氧化碳〕:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 30・碳酸不稳定而分解:H2CO3 == H2O + CO2t 31・二氧化碳可溶于水:H2O +CO2== H2CO332 •高温熾烧石灰石〔工业制二氧化碳〕:CaCO3高温CaO + CO2t 33 •石灰水与二氧化碳反响[鉴别二氧化碳〕:Ca(OH)2 + CO2 === CaCO3 1+ H2O⑵金属单质+盐+氢气 〔詈换反⑷一氧化碳的性质:34 . 一氧化碳复原氧化铜:CO + CuO 加热Cu + CO2 35. 一氧化碳的可燃性:2CO + 02点燃2CO2五燃料及其利用:37.甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O 38 •酒精在空气中燃烧:C2H5OH + 302点燃2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + 02点燃2H2O/u 金属(1)金属与氧气反响:40・镁在空气中燃烧:2Mg + 02点燃2MgO 41・铁在氧气中燃烧:3Fe + 202点燃Fe3O4 42. 铜在空气中受热:2Cu + 02加热2CuO43. 铝在空气中形成氧化膜:4A! + 302 = 2AI2O344. 锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2t 45. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2t 46. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2t 47. 铝和稀硫酸2AI +3H2SO4 = A!2(SO4)3 +3 H2!其它反响:Na2CO3辖幕醫Zn+ 2HC_n n znc_2+ H2T萍幕醫Fe+ 2HC一n n艮一2+H2T棘幕鬣Mg+ 2HC一n h Mgc_2+ H2T・茄君帝聆嬲2A_+ 6HC一nu2A_C一3+ 3 H2T二的翻般网+即〔两蒔〕..................鬓專+器 B 1B^8 - Fe + CCSO4n n FeSO4 +Cu盘〔匕霍+的a ...即+釧川〔总〔2〕糜+的醫喜....... 弱+为 56・ 咕e2O3+6HC一HH2Fec_3+3H257・$203 + 3H2SO4n n+ 3H2O58・ - a c o+ 2HC_Hucuc一2 + H2O59・ ^s s ss -aco+H2SO4n n CUSO4 + H.〔〕嬲+気弱;s ^s7二一(4)另一种酸61. 盐酸和氢氧化钙反响:2HCI + Ca(OH)2 == CaCI2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCI + AI(OH)3 == A/C/3 + 3H2O63. 硫酸和烧碱反响:H2SO4 + 2NaOH == Na2SO4 + 2H2O 64 .大理石与稀盐酸反响:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 65碳酸钠与稀盐酸反响:Na2CO3 + 2HCI = = 2NaC! + H2O+ CO2t 66 •碳酸氢钠与稀盐酸反响:NaHCO3 + HC!== NaC! + H2O + CO2t67.硫酸和氯化坝溶液反响:H2SO4 + BaCI2== BaSO4 !+ 2HC!2、碱的化学性质⑴碱+非金属氧化物 .............. 盐+水68 •苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69 •苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O盐+水74.铁和,铜溶液另一种酸70 •苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71 •消石灰放在空气中变质:Ca(OH)2 + CO2二二CaCO3 I + H2O72.消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 1+ H2O〔3〕碱+盐 ......... 另_种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3l+ 2NaOH 3.盐的化学性质(1)盐〔溶液〕+金属单质・……另一种金属+另一种盐 75碳酸钠与稀盐酸反响:Na2CO3 + 2HCI==2NaCI + H2O + CO2t碳酸氢钠与稀盐酸反响:NaHCO3 + HC/== NaCI + H2O + CO2t⑶盐+碱 ............ 另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3!+ 2NaOH⑷盐+盐两种新盐77•氯化钠溶液和硝酸银溶液:NaCI + AgNO3二二AgClJ +〔2〕碱 +⑵盐+NaNO3 78・硫酸钠和氯化锁:Na2SO4 + BaC/2 == BaSO4l + 2NaC!钾钠硝钱均可溶.盐酸盐不溶AgCI.硫酸盐不溶BaSO4,碳•溶解性口诀一钾钠链盐溶水快,◎硫讎除去坝铅钙。
酸碱盐溶解性表和口诀(精华版)
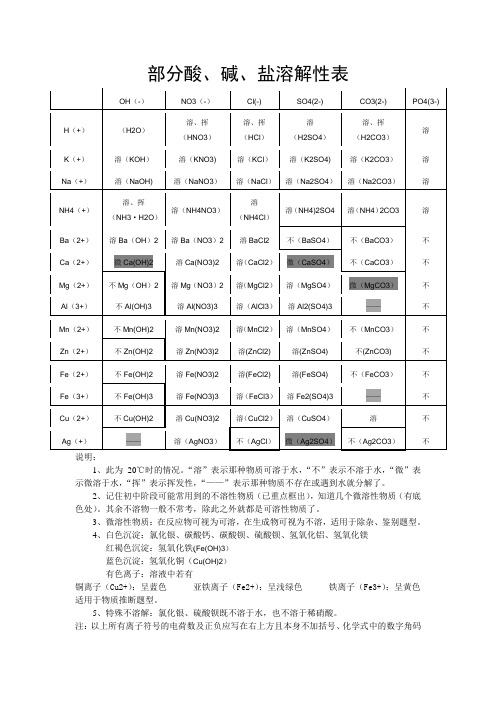
说明:
1、此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
2、记住初中阶段可能常用到的不溶性物质(已重点框出),知道几个微溶性物质(有底色处)。
其余不溶物一般不常考,除此之外就都是可溶性物质了。
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型。
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁
红褐色沉淀:氢氧化铁(Fe(OH)3)
蓝色沉淀:氢氧化铜(Cu(OH)2)
有色离子:溶液中若有
铜离子(Cu2+):呈蓝色亚铁离子(Fe2+):呈浅绿色铁离子(Fe3+):呈黄色适用于物质推断题型。
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
注:以上所有离子符号的电荷数及正负应写在右上方且本身不加括号、化学式中的数字角码
应写在右下方,这里是为了方便打字,请谅解。
部分酸碱盐溶解性背诵口诀
①钾钠铵盐硝酸盐,
完全溶解不困难。
②硫酸盐中钡不溶,
盐酸盐中只银难,
硫酸钡和氯化银,
两种沉淀记心间。
③碳酸盐溶钾钠铵,
碳酸铝铁银碱无。
④硫酸钙银盐微溶,
微溶还有碳酸镁。
⑤碱有钾钠铵钡溶,
氢氧化钙是微溶,
其他全都不能溶。
⑥常见诸酸皆可溶,
记住挥酸盐硝碳。
注:口诀仅供参考,本身并不完全准确,但是能促进记忆。
浙教版科学中考复习:酸碱盐溶解性 (共33张PPT)【完美版】

一.酸、碱、盐的溶解性
• 1.酸:大多数都可溶。 • 2.碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙
可溶于水,其余均为沉淀。 • 3.盐:钾盐、钠盐、铵盐、硝酸盐都可溶。 • (1)氯化物除氯化银不溶于水外,其余多数均易溶于水。 • (2)硫酸盐除硫酸钡不溶于水,硫酸银、硫酸钙微溶于水外,
7
浙教版科学中考复习:酸碱盐溶解性 (共33张PPT)【完美版】
三.特殊离子鉴别
• (2)特征离子关系图
• (3)物质鉴别的原则 • ① 操作简便:能用物理方法鉴别的不用化学方法。能用一种试剂
鉴别的不用多种试剂。 • ② 现象明显:使待检物质的现象对比度较大。 • ③ 防止干扰:鉴别Cl-和SO42-时,只能用BaCl2溶液不能用
浙教版科学中考复习:酸碱盐溶解性 (共33张PPT)【完美版】
11
浙教版科学中考复习:酸碱盐溶解性 (共33张PPT)【完美版】
题模一:酸碱盐的溶解性
• 2.化学与生产、生活、社会息息相关,下列说法错误的是( ) • A.煤的气化、焦化、液化和石油的蒸馏都属于化学变化 • B.透视检测肠胃疾病时可口服钡餐(BaSO4),钡餐不会对人
Cu2+
Fe3+ OHSO42Cl-
CO32-
检验方法 滴入紫色石蕊试液 加入H2SO4 (SO42- 起作用) 加入HCl(Cl- 起作用) 加入NaOH溶液加热(OH- 起作用)
加入NaOH溶液(OH- 起作用)
加入NaOH溶液(OH- 起作用) 滴入酚酞试液
加入Ba(NO3)2溶液和稀硝酸(Ba2+ 起作用)
AgNO3溶液。
浙教版科学中考复习:酸碱盐溶解性 (共33张PPT)【完美版】
酸碱盐的溶解性表口诀高中

酸碱盐的溶解性表口诀高中酸碱盐的溶解性表口诀是学习酸碱盐的基础,在高中物理化学中有着重要的作用。
一般来说,酸碱盐的溶解性会与溶质的性质,溶解介质的性质,溶液的倍量有关。
那么,我们需要记住酸碱盐的溶解性表口诀,以便能够正确地判断某一酸碱盐是否能够溶于某一介质中,更加深入地学习酸碱盐的方面。
在高中物理化学中,酸碱盐的溶解性表口诀是学习酸碱盐的一个重要知识点,可以记住以下口诀:溶于水的有HCl、NaOH、KNO3、NaHCO3,而溶于醇的有HNO3、H2SO4、C2H5OH、NaClO。
下面我们来看看酸碱盐的溶解性表口诀的一些具体内容:一、 HCl、NaOH、KNO3、NaHCO3都能溶于水,其中HCl是一种强酸,NaOH是一种强碱,而KNO3和NaHCO3则都是碱性无机盐。
二、 HNO3、H2SO4、C2H5OH、NaClO都能溶于醇,其中HNO3是一种强酸,H2SO4是一种强碱,而C2H5OH和NaClO则都是碱性无机盐。
三、汞是一种重要的金属,也能够溶于稀硫酸,这是一种强酸,它的溶解度受温度的影响,随着温度的升高,汞的溶解度也会增加。
四、铝能够溶于硫酸铝,硫酸铝是一种弱酸,属于酸性无机盐,它的溶解度也受温度的影响,随着温度的升高,铝的溶解度也会增加。
五、碳酸钠可以溶于水,也可以溶于乙醇,碳酸钠是一种弱碱,属于碱性无机盐,它的溶解度受温度的影响,随着温度的升高,碳酸钠的溶解度也会增加。
六、氯化氢(HCl)可以溶于水,也可以溶于乙醇,它属于强酸,它的溶解度受温度的影响,随着温度的升高,氯化氢的溶解度也会增加。
七、氢氧化钙(Ca(OH)2)可以溶于水,也可以溶于乙醇,它属于强碱,它的溶解度受温度的影响,随着温度的升高,氢氧化钙的溶解度也会增加。
以上就是高中物理化学中酸碱盐的溶解性表口诀的一些具体内容,希望大家能够记住,以便在学习酸碱盐的方面更加深入地理解。
从口诀中我们可以得知,溶解在酸碱盐中是非常重要的,它的溶解性受到溶质的性质,溶解介质的性质,溶液的倍量以及温度等因素的影响。
酸碱盐的溶解性表及记忆口诀

酸碱盐的溶解性表
第一条
酸除硅酸全可溶,碱溶钾钠铵钡钙。
钾钠铵盐硝酸盐,全部溶解不困难。
氯化银和硫酸钡,两种沉淀记心间。
碳酸盐除钾钠铵,其余皆不溶于水。
第二条
钾钠铵盐硝酸盐,全都溶于水中间;
溶碱钾钠钡钙铵,碳酸只溶钾钠铵;
硫酸盐中钡不溶,氯化物中银也难;
常见诸酸皆可溶,记住挥酸盐硝碳。
第三条
碱有钾钠铵钡溶,氢氧化钙是微溶。
碳酸铝铁银碱无,钾钠铵硝盐全溶。
硫酸不溶只有钡,硫酸钙银盐微溶。
微溶还有碳酸镁,盐酸只有银不溶。
注:[特殊不溶解:氯化银、硫酸钡不溶于稀硝酸] 第四条
氯盐只有银不溶,碱镁铝锰锌铁铜。
硫酸钡钙银不溶,碳酸钾钠氢氨溶。
氢氧化钙是微溶,钾钠钡铵碱可溶。
红褐铁,蓝絮铜,其它沉淀呈白色。
酸碱盐溶解性表
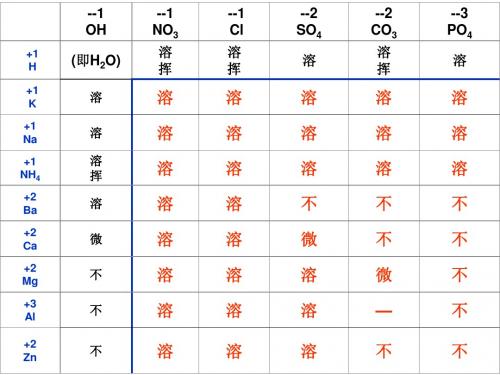
溶 溶 溶 不 微 溶 溶 溶
溶 溶 溶 不 不 微 — 不
溶 溶 溶 不 不 不 不 不
--1 OH
--1 NO3
--1 Cl
--2 SO4
--2 CO3
--3 PO4
+2 Fe +3 Fe +2 Cu +1 Ag +2 Pb
不
不 不
溶
溶 溶
溶
溶 溶
溶
溶 溶
不
— 不
不
不 不
—
不
溶
溶
不
微
微
不
不
不
不
例1:AgNO3、Na2SO4
(B)H2 SO4、NaCl、Na2CO3 (C)Na2SO4、KNO3、Ba(OH)2 (D)BaCl2、NaCl、KOH
(物质共存不反应, 反应不共存.)
解释: A.是银离子与氯离子不能共存 , Ag+ 和 Cl-- 结合 ,得到 AgCl沉淀 B. 是氢离子与碳酸根离子不能共存 , H+ 和 CO32– 结 合得到H2CO3, H2CO3 不稳定分解得到 H2O和CO2 H2 SO4 + Na2CO3 == Na2SO4 + H2O + CO2↑ C. 是硫酸根离子 与 钡离子不能共存 , Ba2+和SO42- 结合, 得到 BaSO4 沉淀
不
说明:“溶”表示那种物质可溶于水, “不”表示不溶于, “微”表示微溶于水,“挥”表示挥发性, “——”表示 那种物质不存在或在遇到水就分解了
3. 酸碱盐的溶解性表-----口决: (1)(钾、钠、铵、硝酸)盐溶 (2) 盐酸盐不溶银(例:AgCl ) (3) 硫酸盐不溶钡和铅 (例:BaSO4 PbSO4 ) (4) 碳酸盐,磷酸盐只溶钾,钠,铵 备注:①Ag2SO4 ,CaSO4 MgCO3 微溶于水; ②AgCl与BaSO4 不仅不溶于水,也不溶于酸
高中化学盐溶解性表及元素周期表
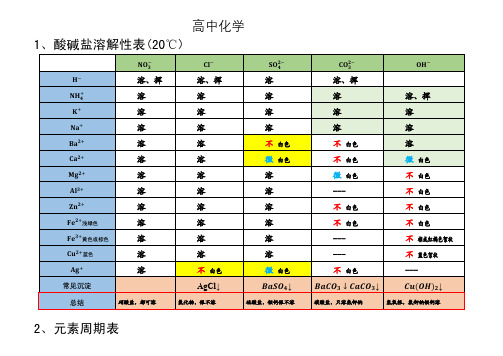
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
记忆酸碱盐溶解性表

胜利第六十二中 李伟
常见的阳离子: K+、 Na+、 H+、 Ag+、 Ca2+、 Mg2+、Ba2+、Zn 2+、 Cu+(亚铜离子)、 Cu2+(铜离子)、 2+ 3+ Fe (亚铁离子)、 Fe (铁离子)、 3+ + Al 、 NH4 常见的阴离子:
2 2OH 、NO3 、Cl 、SO4 、CO3
三个不存在的物质
氢氧化银、 碳酸铝、 碳酸铁
记住八个常见的沉淀物
氯化银、硫酸钡、(不溶于硝酸) 碳酸银、碳酸钡、碳酸钙、 氢氧化镁、 氢氧化铜(蓝)、氢氧化铁(红褐) 写出以上沉淀物质的化学式。
四个微溶物:
Ca(OH)2 (石灰水注明“澄清”的原因); CaSO4(实验室制二氧化碳时不用稀硫酸 的原因); Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银 的原因); MgCO3(碳酸根离子不能用于在溶液中除 去镁离子的原因)
OH-
NO3-
Cl-
SO4 2 -
CO3 2 -
练 习 填 写 溶 解 NH 性
H+ Cu2+ K+ Zn2+ Mg2+ Al3+ Ba2+ Ca2+ Na+
+
ቤተ መጻሕፍቲ ባይዱ---
4 Fe2+
Fe3+ Ag+
-----
酸、碱、盐的溶解性:
酸全溶,碳酸不稳定, 溶碱有五位,钾钠铵钙钡, 硝酸盐全溶, 氯化物不溶氯化银, 硫酸盐不溶硫酸钡, 碳酸盐只溶钾钠铵。
《酸碱盐的复习课》教学设计

《酸碱盐的复习课》教学设计九班级化学《酸碱盐的复习课》的教学设计篇1教学目标1.通过对酸、碱、盐、氧化物概念的复习进一步掌握有关物质分类的知识。
2.通过对酸、碱、盐、氧化物性质的复习进一步掌握各类物质的性质及其相互关系。
3.巩固有关重要反应化学方程式的书写,并在此基础上进一步总结某些化学反应的规律。
学会运用金属活动顺序表判断某些置换反应能否发生;学会运用酸、碱、盐溶解性表判断复分解反应能否发生。
4.运用各类物质的性质及相互关系解决一些具体问题。
教学重点1.物质的分类。
2.各类物质的通性及相互关系。
教学难点综合利用本章知识解决一些具体问题。
课时安排2课时第一课时:总结物质的分类、性质及其相互关系。
第二课时:综合运用本章知识解决具体问题的思路、方法。
教学过程一、物质的分类(提问)请学生小结有关物质的分类(具体见板书设计),并复习有关的概念。
(练习)写出下列物质的化学式,并将其分类。
氢氧化钠、氧化铁、硫化锌、盐酸、硫酸钠、胆矾、氢氧化铜、三氧化硫、生石灰、硝酸、碳酸氢钠、碱式碳酸铜、氢氧化钙、硫酸亚铁。
二、各类物质的性质及其相互关系(提问)请依次说出酸、碱有哪些通性?盐有哪些化学性质?氧化物有哪些化学性质?(老师)可用不同颜色的粉笔板书,用图示法找到物质间的相互联系。
(具体见板书设计)(练习)请学生对每一个具体反应举一个典型的化学反应。
(口述)三、运用金属活动顺序表判断某些置换反应能否发生,正确书写金属跟酸、金属跟盐反应的化学方程式。
(练习)判断下列反应能否发生?写出能发生反应的化学方程式,不能反应的说明理由。
(1)Mg+H2SO4(2)Fe+HCl(3)Ag+H2SO4(稀)(4)Zn+HNO3(5)Zn+CuSO4(6)Ag+ZnSO4(7)Cu+AgCl(8)Cu+Hg(NO3)2(讨论)可进行分组讨论,并小结置换反应能否发生的条件。
(小结)1.金属跟酸:(1)在金属活动性顺序表中,排在氢前的金属可置换出酸中的氢,排在氢以后的金属则不能置换出酸中的氢。
部分酸碱盐的溶解性表说课讲解

部分酸碱盐的溶解性表部分酸碱盐的溶解性表.txt鲜花往往不属于赏花的人,而属于牛粪。
道德常常能弥补智慧的缺陷,然而智慧却永远填补不了道德空白人生有三样东西无法掩盖:咳嗽贫穷和爱,越隐瞒,就越欲盖弥彰。
名称化学式溶解性溶液及沉淀颜色硝酸HNO3 溶、挥无色硝酸铵NH4NO3 溶无色硝酸钾KNO3 溶无色硝酸钠NaNO3 溶无色硝酸钡Ba(NO3)2 溶无色硝酸钙Ca(NO3)2 溶无色硝酸镁Mg(NO3)2 溶无色硝酸铝Al(NO3)3 溶无色硝酸锰Mn(NO3)2 溶无色硝酸锌Zn(NO3)2 溶无色硝酸铁Fe(NO3)3 溶黄色硝酸亚铁Fe(NO3)2 溶浅绿色硝酸铜Cu(NO3)2 溶蓝色硝酸银AgNO3 溶无色氯化氢HCl 溶、挥无色氯化铵NH4Cl 溶无色氯化钾KCL 溶无色氯化钠NaCl 溶无色氯化钡BaCl 溶无色氯化钙CaCl 溶无色氯化镁MgCl2 溶无色氯化铝AlCl3 溶无色氯化锰MnCl2 溶无色氯化锌ZnCl2 溶无色氯化铁FeCl3 溶黄色氯化亚铁FeCl2 溶浅绿色氯化铜CuCl2 溶蓝绿色氯化银AgCl 不白色硫酸H2SO4 溶无色硫酸铵(NH4)2SO4 溶无色硫酸钾K2SO4 溶无色硫酸钠Na2SO4 溶无色硫酸钡BaSO4 不白色硫酸钙CaSO4 微无色、白色硫酸镁MgSO4 溶无色硫酸铝Al2(SO4)3 溶无色硫酸锰MnSO4 溶无色硫酸锌ZnSO4 溶无色硫酸铁Fe2(SO4)3 溶黄色硫酸亚铁FeSO4 溶浅绿色硫酸铜CuSO4 溶蓝色硫酸银Ag2SO4 微无色、白色碳酸H2CO3 溶、挥无色碳酸氨(NH4)2CO3 溶无色碳酸钾K2CO3 溶无色碳酸钠Na2CO3 溶无色碳酸钡BaCO3 不白色碳酸钙CaCO3 不白色碳酸镁MgCO3 微无色、白色碳酸铝/碳酸锰MnCO3 不白色碳酸锌ZnCO3 不白色碳酸铁/碳酸亚铁FeCO3 不白色碳酸铜CuCO3 不蓝色碳酸银Ag2CO3 不白色一水合氨NH3.H2O 溶、挥无色氢氧化钾KOH 溶无色氢氧化钠NaOH 溶无色氢氧化钡Ba(OH)2 溶无色氢氧化钙Ca(OH)2 微无色、白色氢氧化镁Mg(OH)2 不白色氢氧化铝Al(OH)3 不白色氢氧化锰Mn(OH)2 不白色氢氧化锌Zn(OH)2 不白色氢氧化铁Fe(OH)3 不红褐色氢氧化亚铁Fe(OH)2 不白色氢氧化铜Cu(OH)2 不蓝色氢氧化银/。
如何记忆酸碱盐溶解性表

如何记忆酸碱盐溶解性表佛山顺德杏坛中学 杜泳霖在高一化学教学中,我发现大多数的学生对酸、碱、盐在水溶液中发生离子反应的离子方程式的写书较难正确掌握。
但离子反应是高考每年必考的重要考点。
通过对学生练习和作业的检查发现,多数学生没有建立好电解质在溶液中的离子观和符号观:一是常见的离子符号不会写或写错;二是课本附录II 中的部分酸、碱、盐的溶解性表没有能记忆,电离方程式和离子方程式写错率较高,测验结果与老师精心教学的落差较大,即便讲评了还有不少学生感觉到是一团雾水。
为解决学生能理解记忆“酸、碱、盐溶解性表”这一问题,我设计以下教学方案引导学生分析和处理表中所含有信息,最后编出30个字的打游诗来强化记忆,并辅以一组练习加以巩固。
【环节1】引导学生将表中各阴、阳离子对应的化学式填写到相应的方格内。
如NH 4+ 和OH -写成NH 3·H 2O, NH 4+ 和SO 42-写成(NH 4)2SO 4 等。
【环节2】①让学生数一数表中有多少个“溶”字;多少个“不”字;多少个“微”字; 多少个“—”。
②画出树状分类图,并展示和交流。
③老师点评,并列举实例解释表中“溶”、“不”、“微”、“—”含义。
【环节3】学生分组讨论挖掘出表中各物质溶解性的规律,尝试编出便于自己记忆的打游诗。
各小组编得都是比较零散不十分全面,最后是老师把自己编好的打游诗,先用硬笔书法到一张白纸上,放在电子白板投影仪上给全班同学投影展示。
投影出来后,几个班的同学都被老师的精美佳作振奋了。
具体内容如下:课本附录II中部分酸碱盐的溶解性表记忆打游诗:“四微四不存,四六十五不。
”酸铵硝钾钠,氯盐银不溶;碱钾钠钡溶,钙微铝两溶;硫钡钙银微,碳钾钠镁微。
学生抄写到课本完后,集体背诵三遍,课堂气氛活跃,较果较好。
【环节4】编一组练习让学生训练书写电离方程式和离子方程式。
一.酸铵硝钾钠(均溶)写出下列各电解质的电离方程式:1.酸:HCl , HNO3 , H2SO4;2.铵盐:NH4Cl ,(NH4)2SO4;3.硝酸盐:KNO3 , Ba(NO3)2.二.氯盐银不溶写出下列复分解反应的化学方程式和离子方程式1.NaCl溶液+硝酸银:();2.CaCl2溶液+硝酸银:();3.BaCl2溶液+硝酸银:();三.碱钾钠钡溶写出下列各电解质的电离方程式:1. KOH ,2. NaOH ,3. Ba(OH)2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中阶段常见酸碱盐溶解性表
OHˉ
NO3ˉ
Clˉ
SO42ˉ
S2ˉ
SO32ˉ
CO32ˉ
SiO32ˉ
PO43ˉ
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
难
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
—
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
难
—
微
难
难
难
Ca2+
微
溶
溶
微
—
难
难
难
难
Mg2+
难
溶
溶
溶
—
微
微
难
难
Al3+
难
溶
溶
溶
—
—
—
难
难
Mn2+
难
溶
溶
溶
难
难
难
难
难
Zn2+
难
溶
溶
溶
难
难
难
难
难
Cr3+
难
溶
溶
溶
—
—
—
难
难
Fe2+
难
溶
溶
溶
难
难
难
难
难
Fe3+
难
溶
溶
溶
—
—
—
难
难
Sn2+
难
溶
溶
溶
难
———难P2+难溶
微
微
难
难
难
难
难
Cu2+
难
溶
溶
溶
难
溶
—
难
难
Hg2+
—
溶
溶
溶
难
难
—
—
难
Ag+
—
溶
难
微
难
难
难
难
难
高中阶段常见酸碱盐溶解性表(25℃,101.3kPa)
