高一必修一化学方程式 及离子方程式
高一化学必修一化学方程式及离子方程式大全

高一化学必修一化学方程式及离子方程式大全1、金属钠投到硫酸铜溶液中的化学方程式:2na+2h2o=2naoh+h2↑2、金属钠与盐酸的化学方程式:2na+2hcl=2nacl+h2↑3、氢氧化钠方在空气中变质的化学方程式:2naoh+co2=na2co3+h2ona2co3+10h2o=na2co3·10h2o4、金属钠放到空气的水解:4na+o2=2na2o (银白色变暗)5、金属钠在空气燃烧:2na+o2=na2o2 δ (生成淡黄色粉末)6、过氧化钠在空气中变质:2na2o2+2h2o=4naoh+o2↑2na2o2+2co2=2na2co3+o27、过氧化钠与酸反应:2na2o2+4hcl=4nacl+2h2o+o2↑8、氧化钠在空气中变质:na2o+h2o=2naohna2o+co2=na2co39、氧化钠与酸反应:na2o+2hcl=2nacl+h2o10、氧化钠在空气中冷却:2na2o+o2=2na2o211、氯气与铁的反应方程式:2fe+3cl2=2fecl3 点燃(红棕色的烟)12、氯气与铜的反应方程式:cu+cl2=cucl2 熄灭(棕黄色的烟)13、氯气与氢气的反应方程式:cl2+h2=2hcl 点燃(苍白色火焰,生成白雾)14、氯气与钠单质的反应方程式:2na+cl2=2nacl 熄灭(淡黄色的烟)15、工业制漂白:2cl2+2ca(oh) 2=cacl2+ca(clo) 2+2h2o (为ca(oh) 2石灰乳)16、氯气与水的方程式:cl2+h2o=hcl+hclo17、消毒、处置多余的氯气、制84消毒液:cl2+2naoh=naclo+nacl+h2o18、次氯酸钠在空气中变质:2naclo+co2+h2o=2hclo+na2co3naclo+co2+h2o=hclo+nahco320、次氯酸见光分解:2hclo=2hcl+o2↑ 光照21、氯化铁灌入沸水中制氢氧化铁胶体:fecl3+3h2o=fe(oh) 3 (胶体)+3hcl δ22、碳酸钠与盐酸的反应方程式:na2co3+2hcl(过)=2nacl+co2↑+h2ona2co3+hcl(太少)=nahco3+nacl23、碳酸氢钠与盐酸的反应方程式:nahco3+hcl=nacl+h2o+co2↑24、碳酸氢钠与碱反应方程式:nahco3+naoh=na2co3+h2o25、碳酸氢钠熔化极易水解:2nahco3=na2co3+co2↑+h2oδ26、二氧化碳通入碳酸钠溶液中:na2co3+co2+h2o=2nahco327、混浊石灰水变小回应:co2+caco3+h2o=ca(hco3) 228、碳酸氢钙受热分解:ca(hco3) 2= co2↑+caco3+h2o δ29、氢氧化亚铁在空气中变质:4fe(oh) 2+o2+2h2o=4fe(oh) 3(由白色沉淀变成灰绿色再变成红褐色沉淀) 30、留存氯化亚铁溶液:2fecl3+fe=3fecl2 2fe3++fe=3fe2+31、生产印刷线路板:2fecl3+cu=2fecl2+cucl2 2fe3++cu=2fe2++cu2+32、2fecl2+cl2=2fecl3 2fe2++cl2=2fe3++2cl-33、fe2o3+3co = 2fe+3co2 高温35、zn+cu2+= zn2++cu zn+fe2+= zn2++fe36、溶洞的形成:co2+caco3+h2o=ca(hco3)2ca(hco3)2=co2↑+caco3+h2o δ37、nahco3+bacl2 ?不反应(通常情况下,强酸就可以制弱酸)38、工业上制取水煤气:c+h2o(g)=co+h2 高温39、自然界通过振动把氮气转变为一氧化氮:n2+o22no 振动(no无色、容易溶水)40、工业上制备氨气:n2+3h22nh3 高温、高压、催化剂41、一氧化氮在常温下被水解:2no+o2=2no2(no2红棕色、存有刺激性气味的有毒气体、易溶于水)42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:3no2+h2o=2hno3+no43、氨溶解于水:nh3+h2onh3·h2o(一水合氨、弱碱性、能使酚酞溶液变红)44、一水合氨的电离:nh3·h2onh4++oh-45、氨与盐酸的反应:nh3+hcl=nh4cl46、工业上制取硝酸须要的一氧化氮的方程式:4nh3+5o2=4no+6h2o 高温催化剂47、碳酸氢铵受热分解:nh4hco3=nh3↑+co2↑+h2o δ (密封保存在阴凉处、施肥时埋在土下)48、氯化铵受到热分解:n h4cl=nh3↑+hcl↑ δ49、铵态氮肥不能与碱(如草木灰)混合施用:nh4++oh-=nh3↑+h2o δ50、实验室制氨气:2nh4cl+ca(oh)2=2nh3↑+cacl2+2h2o δ(向上排在空气法搜集、湿润的红色石蕊试纸)51、硝酸受热分解:4hno3=4no2↑+o2↑+2h2o 受热或见光(应保存在棕色试剂瓶中、阴凉处)52、铜与硝酸的反应:cu +4hno3(浓) =cu(no3)2+2no2↑+2h2o (遇浓硝酸生成二氧化氮)3cu+8hno3(叶唇柱) =3cu(no3)2+2no↑+4h2o (突遇叶唇柱硝酸分解成一氧化氮)53、浓硝酸与木炭的反应:4hno3(浓)+c=co2↑+4no2↑+2h2o δ54、硫单质铁的反应:fe+s=fes δ(硫单质的氧化性、s黄色或淡黄色固体,不溶水、微溶酒精、易溶cs2)55、硫单质与氧气的反应:s+o2=so2 熄灭(硫单质的还原性、so2有刺激性气味的有毒气体、易溶于水)56、硫粉突遇碱出现异构化反应:3s+6naoh=2na2s+na2so3+3h2o δ57、黑火药爆炸的化学方程式:s+2kno3+3c=k2s+3co2↑+n2↑58、二氧化硫被氧气水解:2so2+o22so3 催化剂δ60、浓硫酸与铜加热发生反应:2h2so4(浓)+cu=cuso4+so2↑+2h2o δ61、浓硫酸与木炭冷却出现反应:2h2so4(淡)+c=2so2↑+co2↑+2h2o δ63、二氧化硫与氯气发生氧化还原反应:so2+cl2+2h2o=h2so4+2hcl64、酸雨的构成:2so2+o22so3 粉尘等催化剂so3+h2o=h2so4so2+h2oh2so32h2so3+o2=2h2so465、海水加镁第一步:mg+2h+=mg2++h2↑ (盐酸、稀硫酸)66、镁与氮气的反应:3mg+n2=mg3n2 点燃67、镁与二氧化碳反应:2mg+co2=2mgo+c 熄灭(镁起火无法用二氧化碳驱散)68、海水提溴单质:2br-+cl2=br2+2cl-69、半导体硅与氧气的'反应:si+o2=sio2 δ(自然界没游离态的硅)70、工业上制粗硅:sio2+2c=si+2co↑ 高温(光导纤维、沙子和石英的主要成分是sio2)71、硅与氟气的反应:si+2f2=sif472、硅与氢氟酸的反应:si+4hf=sif4+2h273、制作黏合剂:si+2naoh+h2o=na2sio3+2h2↑74、玻璃与烧碱反应:sio2+2naoh=na2sio3+h2o (na2sio3的水溶液称为水玻璃)75、二氧化硅与碱性氧化物的反应:sio2+cao=casio3 高温76、刻蚀玻璃:sio2+4hf=sif4↑+2h2o77、工业制玻璃:caco3+sio2=casio3+co2↑ 高温na2co3+sio2=na2sio3+co2↑ 高温78、金属铝在氧气中燃烧:4al+3o2=2al2o3 点燃79、铝热反应:2al+fe2o3=al2o3+2fe高温(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)80、金属铝与酸的反应:2al+6hcl=2alcl3+3h2↑81、金属铝与碱的反应:2al+2naoh+6h2o=2na[al(oh)4]+3h2↑ (四羟基再分铝酸钠)83、氢氧化铝溶于强酸中:al(oh)3+3h+=al3++3h2o84、氢氧化铝溶强碱中:al(oh)3+oh-=[al(oh)4]- (四羟基合铝酸根离子)85、氧化铝溶强酸:al2o3+6h+=2al3++3h2o (氧化铝为两性氧化物)86、氧化铝溶强碱:al2o3+2oh-+3h2o=2[al(oh)4]-87、碱式碳酸铜的制取:2cu+o2+h2o+co2=cu2(oh)2co3 (绿色)88、铜与氧气的反应:cu+o2=2cuo δ89、铜与硫粉的反应:2cu+s=cu2s δ90、4cuo=2cu2o+o2↑ 高温(黑色物质变成红色物质)91、cuso4·5h2o=cuso4+5h2o↑ δ (蓝色晶体变为白色粉末)93、氯化铝与过量的氢氧化钠反应:al3++4oh-=[al(oh)4]-95、实验室制取氯气:4hcl(淡)+mno2 =mncl2+cl2↑+2h2o δ (黄绿色气体、有害、密度比空气小) 96、实验室制取二氧化碳:caco3+2hcl=cacl2+h2o+co2↑ (无色无味、密度比空气小,溶水)。
高中化学必修1化学方程式以及离子方程式大全

必修一化学方程式以及离子方程式1、硫酸根离子的检验:BaCl2 + Na2SO4= BaSO4↓+ 2NaCl SO42- + Ba2+ == BaSO4↓2、碳酸根离子的检验:CaCl2 + Na2CO3= CaCO3↓ + 2NaCl CO32- + Ca2+== CaCO3↓3、碳酸钠与盐酸反应:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+== CO2↑+ H2O4、铝与硝酸铜溶液反应:2Al+3Cu(NO3)2= 2Al(NO3)3+ 3Cu 2Al+3Cu2+= 2Al3++ 3Cu5、钠在空气中燃烧(黄色的火焰) 2Na + O2 Na2O2钠块在空气中变暗 4Na+O2=2Na2ONa2O在空气中加热(变黄) 2Na2O+O2△2O26、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2 NaOH + H2↑2Na + 2H2O = 2Na++ 2OH-+H2↑7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+ 2H2O = 4NaOH + O2↑2Na2O2+2H2O =4Na++4OH-+O2↑碱性氧化物Na2O与水的反应 Na2O+H2O=2NaOH8、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+ 2CO2= 2Na2CO3+ O29、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl = 2NaCl+ H2O+CO2↑CO32-+ 2H+= H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+ HCl =NaHCO3+ NaCl CO32-+ H+= HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑10、小苏打受热分解2NaHCO3△Na2CO3+ H2O +CO2↑11、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+ NaOH △ Na2CO3+ H2OHCO3-+ OH -= H2O + CO32-(若是溶液中反应有离子方程式)12、铝箔在氧气中剧烈燃烧 4Al + 3O2点燃2Al2O313、铝片与稀盐酸反应2Al + 6HCl = 2AlCl3+ 3H2↑2Al + 6H+= 2Al3++3H2↑14、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O = 2NaAlO2-+3H2↑2Al + 2OH -+2H2O = 2AlO2-+ 3H2↑15、铝与三氧化二铁高温下反应(铝热反应)2Al + Fe2O3高温2Fe + Al2O316、氧化铝溶于氢氧化钠溶液Al2O3+ 2NaOH 2NaAlO2+H2OAl2O3+ 2OH -= 2AlO2-+ H2O17、硫酸铝溶液中滴过量氨水Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++ 3 NH3·H2O = Al(OH)3↓+ 3NH4+18、①氢氧化铝溶液中加盐酸Al(OH)3+ 3HCl = AlCl3+ 3H2OAl(OH)3+ 3H+= Al3++ 3H2O②Al(OH)3与NaOH溶液反应Al(OH)3+ NaOH NaAlO2+2 H2OAl(OH)3+ OH-=AlO2-+2 H2O19、高温下铁与水反应 3Fe + 4H2O(g) 高温 Fe3O4+ 4H220、铁与盐酸反应Fe + 2HCl = FeCl2+ H2↑ Fe + 2H+= Fe2++ H2↑21、氧化铁溶于盐酸中Fe2O3+ 6HCl = 2FeCl3+ 3H2OFe2O3+ 6H+= 2Fe3++ 3H2O22、氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3+ 3NaOH = Fe(OH)3↓+3NaClFe3++ 3OH -= Fe(OH)3↓23、氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)4Fe (OH)2+ O2+ 2H2O = 4Fe (OH)324、氯化亚铁溶液中通入氯气2FeCl2+ Cl2= 2FeCl32 Fe2++ Cl2= 2 Fe3++ 2Cl-25、氯化铁溶液中加入铁粉2FeCl3+ Fe = 3FeCl22Fe3++ Fe = 3Fe2+26、用KSCN检验Fe3+的存在离子方程式Fe3++3SCN-= Fe (SCN)3(血红色)27、工业制单质硅(碳在高温下还原二氧化硅)SiO2+ 2C 高温 Si + 2CO↑28、二氧化硅与氢氧化钠反应SiO2+ 2NaOH = Na2SiO3+ H2O(常温下强碱缓慢腐蚀玻璃)SiO2+ 2OH -= SiO32-+ H2O29、硅与氧气反应Si(粉)+O2△SiO230、硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑Si + 2OH- + H2O == SiO32- + 2H2↑31、制玻璃SiO2+Na2CO3高温Na2SiO3+CO2SiO2+CaCO3高温CaSiO3+CO232、氯气和非金属反应 Cl2 +H22HCl (或光照)3Cl2 +2P2PCl3Cl2+PCl3PCl533、氯气和金属反应 3Cl2 +2Fe2FeCl3Cl2+2Na2NaClCl2+Cu CuCl234、强氧化性: Cl2 +2FeCl2=2FeCl3Cl2+ 2Fe2+ == 2Fe3+ + 2Cl-Cl2+ 2NaBr = Br2+ 2NaCl Cl2+ 2Br-= Br2+ 2Cl-Cl2 + 2KI =2KCl + I2Cl2+ 2I- == 2Cl- + I235、氯气溶于水 Cl2+H2O=HCl +HClO Cl2+H2O ==Cl-+H++HClO2HClO 2HCl + O2↑光照36、氯气和二氧化硫Cl2+SO2+2H2O=H2SO4+2HCl37、制漂白液:Cl2+2NaOH=NaCl+NaClO+H2O38、制漂粉精、漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O39、漂白粉变质Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO40、氮气和氢气反应(工业合成氨)N2+ 3H2催化剂高温高压2NH341、氮气和氧气放电下反应(雷雨发庄稼)N2+ O22NO2NO + O2 2NO242、二氧化氮溶于水3NO2+ H2O 2HNO3+ NO3NO2+ H2O 2H++ 2NO3-+NO43、 NH3+HCl=NH4Cl(白烟)44、HNO3与Fe的反应Al、Fe遇冷浓HNO3、浓硫酸钝化(常温)Fe与浓HNO3加热Fe+6HNO3△Fe(NO3)3+3NO2↑+3H2O45、Fe与稀HNO3反应Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2O46、氨气的实验室制法:2NH4Cl + Ca(OH)2△CaCl2+ NH3↑ + H2O47、 4HNO34NO2↑+O2↑+2H2O48、 4HNO3(浓)+C△CO2↑+4NO2↑+2H2O49、 4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H24H++ 2NO3- + Cu == Cu2+ + 2NO2↑+ 2H2O8 HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O8H+ +2NO3- + 3Cu == 3Cu2++ 2NO↑+ 4H2O50、NO2、O2的混合气通入水中无剩余气体4NO2+ O2+ 2H2O = 4 HNO351、NO 、O2的混合气通入水中无剩余气体放电4NO+ 3O2+ 2H2O = 4 HNO352、氨的催化氧化4NH3+5O24NO + 6H2O53、碳酸氢铵受热分解NH4HCO3△NH3↑+ H2O↑ + CO2↑54、用浓盐酸检验氨气(白烟生成)HCl + NH3= NH4Cl55、硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4+2NaOH△2NH3↑+Na2SO4+2H2ONH4++ OH -△ NH3↑+ H2O56、硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3+ NaOH = NH3·H2O + NaNO3NH4++ OH-= NH3·H2O57、硫及其化合物的化学性质:S+H2△2S S+Fe△FeSS+2Cu△Cu2S S+O2点燃SO23S+6NaOH △2Na2S+Na2SO3+3H2O3S + 6OH-△2S2- + SO32- + 3H2OSO2 + 2H2S=3S+2H2O SO2+H2O=H2SO32NaOH+SO2(少量)=Na2SO3+H2O SO2+ 2OH- == SO32- + H2ONaOH+SO2(足量)=NaHSO3SO2+ OH- == HSO3-2SO2+O2催化剂加热2SO32H2SO4(浓)+C△CO2↑+2SO2↑+2H2O2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2ONa2SO3+H2SO4= Na2SO4+ SO2↑+ H2O SO32- + 2H+ == SO2↑+ H2O。
人教版高一化学必修1方程式归纳

人教版《化学必修1》化学方程式归纳一、铝及其化合物1.铝与氧气的反应:4Al + 3O2 2Al2O32。
铝与氧化铁反应(铝热反应):2Al + Fe2O3高温2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4。
铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5。
氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3+ 2NaOH = 2NaAlO2+H2O 离子方程式:Al2O3+ 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3+NaOH = NaAlO2+2H2O离子方程式:Al(OH)3+OH-=AlO2-+2H2O9。
氢氧化铝受热分解:_2Al(OH)3Al2O3+3H2O_10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=A l(O H)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3+ 4NaOH =NaAlO2+ 3NaCl+2H2O 12。
往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2A l(O H)3↓+Na2CO3往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO313.电解氧化铝: 2Al2O34Al+3O2↑二、钠及其化合物1。
高中必修一化学方程式以及离子方程式(按章节)

必修一化学方程式以及离子方程式1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42-+ Ba2+ == BaSO4↓2、碳酸根离子的检验:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl CO32-+ Ca2+== CaCO3↓3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32-+ 2H+== CO2↑+ H2O4、铝与硝酸铜溶液反应:2Al+3Cu(NO3)2= 2Al(NO3)3+ 3Cu 2Al+3Cu2+= 2Al3++ 3Cu5、钠在空气中燃烧(黄色的火焰)2Na +O2Na2O2钠块在空气中变暗4Na+O2=2Na2ONa2O在空气中加热(变黄)2Na2O+O2△2Na2O26、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2 NaOH +H2↑2Na +2H2O =2Na++2OH-+H2 ↑7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH-+O2↑碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH8、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O29、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑10、小苏打受热分解2NaHCO3△Na2CO3+H2O +CO2 ↑11、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)12、铝箔在氧气中剧烈燃烧4Al +3O2点燃2Al2O313、铝片与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑14、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2-+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑15、铝与三氧化二铁高温下反应(铝热反应)2Al +Fe2O3高温2Fe +Al2O316、氧化铝溶于氢氧化钠溶液Al2O3+2NaOH 2NaAlO2+H2OAl2O3+2OH -=2AlO2-+H2O17、硫酸铝溶液中滴过量氨水Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+18、①氢氧化铝溶液中加盐酸Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②Al(OH)3与NaOH溶液反应Al(OH)3+NaOH NaAlO2+2 H2OAl(OH)3+OH-=AlO2-+2 H2O19、高温下铁与水反应3Fe +4H2O(g) 高温Fe3O4+4H220、铁与盐酸反应Fe +2HCl =FeCl2+H2↑ Fe +2H+=Fe2++H2↑21、氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2OFe2O3+6H+=2Fe3++3H2O22、氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3+3NaOH =Fe(OH)3↓+3NaClFe3++3OH -=Fe(OH)3↓23、氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)4Fe (OH)2+O2+2H2O =4Fe (OH)324、氯化亚铁溶液中通入氯气2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-25、氯化铁溶液中加入铁粉2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+26、用KSCN检验Fe3+的存在离子方程式Fe3++3SCN-= Fe (SCN)3 (血红色)27、工业制单质硅(碳在高温下还原二氧化硅)SiO2+2C 高温Si +2CO↑28、二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃) SiO2+2OH -=SiO32-+H2O29、硅与氧气反应Si(粉)+O2△SiO230、硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑Si + 2OH-+ H2O == SiO32-+ 2H2↑31、制玻璃SiO2+Na2CO3高温Na2SiO3+CO2 SiO2+CaCO3高温CaSiO3+CO232、氯气和非金属反应Cl2+H22HCl (或光照)3Cl2 +2P2PCl3Cl2+PCl3PCl533、氯气和金属反应3Cl2 +2Fe2FeCl3Cl2 +2Na2NaClCl2+Cu CuCl234、强氧化性:Cl2 +2FeCl2=2FeCl3Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-Cl2 + 2KI =2KCl + I2Cl2 + 2I-== 2Cl-+ I235、氯气溶于水Cl2+H2O=HCl +HClO Cl2+H2O ==Cl-+H++HClO2HClO 2HCl +O2↑36、氯气和二氧化硫Cl2+SO2 +2H2O=H2SO4 +2HCl37、制漂白液:Cl2+2NaOH=NaCl+NaClO+H2O光照38、制漂粉精、漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O39、漂白粉变质Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO40、氮气和氢气反应(工业合成氨)N2+3H2催化剂高温高压2NH341、氮气和氧气放电下反应(雷雨发庄稼)N2+O22NO2NO +O22NO242、二氧化氮溶于水3NO2+H2O 2HNO3+NO3NO2+H2O 2H++2NO3-+NO43、NH3+HCl=NH4Cl(白烟)44、HNO3与Fe的反应Al、Fe遇冷浓HNO3、浓硫酸钝化(常温)Fe与浓HNO3加热Fe+6HNO3△Fe(NO3)3+3NO2↑+3H2O45、Fe与稀HNO3反应Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2O 46、氨气的实验室制法:2NH4Cl + Ca(OH)2△CaCl2 + NH3↑ + H2O47、4HNO34NO2↑+O2↑+2H2O48、4HNO3(浓)+C △CO2↑+4NO2↑+2H2O49、4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2放电4H++ 2NO3-+ Cu == Cu2+ + 2NO2↑+ 2H2O8 HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O8H+ +2NO3-+ 3Cu == 3Cu2++ 2NO↑+ 4H2O 50、NO2、O2的混合气通入水中无剩余气体4NO2+O2+2H2O =4 HNO351、NO 、O2的混合气通入水中无剩余气体4NO+3O2+2H2O =4 HNO352、氨的催化氧化4NH3+5O24NO +6H2O53、碳酸氢铵受热分解NH4HCO3△3↑+H2O↑ +CO2↑54、用浓盐酸检验氨气(白烟生成)HCl +NH3=NH4Cl55、硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4+2NaOH△3↑+Na2SO4+2H2O NH4++OH -△NH3↑+H2O56、硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3+NaOH =NH3·H2O +NaNO3NH4++OH-=NH3·H2O57、硫及其化合物的化学性质:S+H2△H2S S+Fe△FeSS+2Cu△Cu2S S+O2点燃SO23S+6NaOH△2Na2S+Na2SO3+3H2O3S + 6OH-△2S2-+ SO32-+ 3H2OSO2 + 2H2S=3S+2H2O SO2+H2O=H2SO32NaOH+SO2(少量)=Na2SO3+H2O SO2 + 2OH-== SO32-+ H2O NaOH+SO2(足量)=NaHSO3SO2 + OH-== HSO3-2SO32SO2+O2催化剂加热2H2SO4(浓)+C△CO2↑+2SO2↑+2H2O2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2ONa2SO3+H2SO4 = Na2SO4+ SO2↑+ H2O SO32-+ 2H+ == SO2↑+ H2O。
化学必修一化学方程式及离子方程式整理

化学必修一化学方程式及离子方程式整理化学是一门充满奥秘和神奇的科学,而化学方程式及离子方程式则是我们理解和描述化学反应的重要工具。
在化学必修一中,我们学习了众多的化学方程式和离子方程式,下面就来为大家进行一番整理。
一、金属及其化合物1、钠及其化合物(1)钠与氧气在常温下反应:4Na + O₂= 2Na₂O (化学方程式)4Na + O₂= 2Na⁺+ 2O²⁻(离子方程式)(2)钠在空气中燃烧:2Na + O₂点燃 Na₂O₂(化学方程式)2Na + O₂点燃 2Na⁺+ O₂²⁻(离子方程式)(3)钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑ (化学方程式)2Na + 2H₂O = 2Na⁺+ 2OH⁻+ H₂↑ (离子方程式)2、铝及其化合物(1)铝与氧气反应:4Al + 3O₂= 2Al₂O₃(化学方程式)无离子方程式(2)铝与盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑ (化学方程式) 2Al + 6H⁺= 2Al³⁺+ 3H₂↑ (离子方程式)(3)铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H₂O =2NaAlO₂+ 3H₂↑ (化学方程式) 2Al + 2OH⁻+ 2H₂O =2AlO₂⁻+ 3H₂↑ (离子方程式)3、铁及其化合物(1)铁与氧气反应:3Fe + 2O₂点燃 Fe₃O₄(化学方程式)无离子方程式(2)铁与盐酸反应:Fe + 2HCl = FeCl₂+ H₂↑ (化学方程式)Fe + 2H⁺= Fe²⁺+ H₂↑ (离子方程式)(3)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu (化学方程式) Fe + Cu²⁺= Fe²⁺+ Cu (离子方程式)二、非金属及其化合物1、硅及其化合物(1)硅与氧气反应:Si + O₂高温 SiO₂(化学方程式)无离子方程式(2)硅与氢氧化钠溶液反应:Si + 2NaOH + H₂O = Na₂SiO₃+ 2H₂↑ (化学方程式) Si + 2OH⁻+ H₂O = SiO₃²⁻+ 2H₂↑ (离子方程式)2、氯及其化合物(1)氯气与氢气反应:H₂+ Cl₂点燃 2HCl (化学方程式)无离子方程式(2)氯气与水反应:Cl₂+ H₂O ⇌ HCl + HClO (化学方程式)Cl₂+ H₂O ⇌ H⁺+ Cl⁻+ HClO (离子方程式)(3)氯气与氢氧化钠溶液反应:Cl₂+ 2NaOH = NaCl + NaClO+ H₂O (化学方程式) Cl₂+ 2OH⁻= Cl⁻+ ClO⁻+ H₂O (离子方程式)3、硫及其化合物(1)硫与氧气反应:S + O₂点燃 SO₂(化学方程式)无离子方程式(2)二氧化硫与水反应:SO₂+ H₂O ⇌ H₂SO₃(化学方程式)无离子方程式(3)二氧化硫与氧气反应:2SO₂+ O₂催化剂加热 2SO₃(化学方程式)无离子方程式4、氮及其化合物(1)氮气与氧气反应:N₂+ O₂放电 2NO (化学方程式)无离子方程式(2)一氧化氮与氧气反应:2NO + O₂= 2NO₂(化学方程式)无离子方程式(3)二氧化氮与水反应:3NO₂+ H₂O = 2HNO₃+ NO (化学方程式) 3NO₂+ H₂O = 2H⁺+ 2NO₃⁻+ NO (离子方程式)在学习和记忆这些方程式时,我们可以通过理解反应的原理、抓住反应的特点以及多做练习来加深印象。
高一必修一化学方程式及离子方程式

高一化学化学方程式及离子方程式1、铁与稀盐酸的反应: Fe + 2HCl == FeCl 2 + H 2↑ Fe + 2H + ==Fe 2+ + H 2↑2、NH 4+的检验:NH 4Cl+NaOH NaCl+H 2O+NH 3↑ NH 4++OH - NH 3↑+H 2O3、Cl -离子的检验:NH 4Cl+AgNO 3 == AgCl ↓+NH 4NO 3 Ag + +Cl - ==AgCl ↓4、SO 42-离子的检验:NH 42SO 4+BaCl 2==BaSO 4↓+2NH 4Cl Ba 2++SO 42-==BaSO 4↓1、工业制氯气:2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑2Na ++2H 2O 2OH -+H 2↑+Cl 2↑2、实验室制氯气:MnO 2+4HCl 浓MnCl 2+Cl 2↑+2H 2O3、铁与氯气的反应:2Fe + 3Cl 2 2FeCl 3 现象:棕黄色烟铜与氯气的反应:Cu + Cl 2 CuCl 2 现象:棕黄色的烟钠与氯气的反应:2Na + Cl 2 2NaCl 现象:白烟4、氢气与氯气的反应:H 2 + Cl 2 2HCl 或 H 2 + Cl 2 2HCl5、氯气与氢氧化钠的反应:Cl 2+2NaOH==NaCl+NaClO+H 2O Cl 2 + 2OH - == Cl - + ClO - +H 2O6、漂白粉的生产原理:2CaOH 2 + 2Cl 2 == CaClO 2 + CaCl 2 + 2H 2O7、漂白粉消毒原理:CaClO 2 +CO 2 +H 2O == CaCO 3 + 2HClO8、氯气溶于水:Cl 2 +H 2O HCl +HClO Cl 2 + H 2O H + + Cl - + HClO9、次氯酸见光分解:2HClO 2HCl + O 2↑10、氯、溴、碘之间的置换反应:Cl 2 + 2KBr == Br 2 + 2KCl Cl 2 + 2Br - == Br 2 + 2Cl – Cl 2 + 2KI == I 2 + 2KCl Cl 2 + 2I - == I 2 + 2Cl – Br 2 + 2KI == I 2 + 2KBr Br 2 + 2I - == I 2 + 2Br –11、氯、溴、碘离子的检验:NaBr+AgNO 3==AgBr ↓淡黄+NaNO 3 Ag + +Br - == AgBr ↓硝酸银和稀硝酸 NaI + AgNO 3 == AgI ↓黄+ NaNO 3 Ag + + I - == AgI ↓12、钠放置在空气中被氧化常温:4Na + O 2 == 2Na 2O 氧化钠,白色固体13、钠在空气中燃烧:2Na + O 2 Na 2O 2 过氧化钠,淡黄色固体14、钠与水的反应:2Na + 2H 2O == 2NaOH + H 2↑ 2Na + 2H 2O == 2Na + + 2OH - +H 2↑15、钠与四氯化钛的反应:TiCl 4 + 4NaTi + 4NaCl 16、钠的工业制法:2NaCl 熔融 2Na + Cl 2↑17、过氧化钠与二氧化碳的反应:2Na 2O 2 + 2CO 2 == 2Na 2CO 3 +O 218、过氧化钠与水的反应:2Na 2O 2 + 2H 2O == 4NaOH + O 2↑19、碳酸钠与氢氧化钙的反应:Na 2CO 3+CaOH 2==CaCO 3↓+2NaOHCa 2++CO 32-==CaCO 3↓20、碳酸钠与氯化钡的反应:Na 2CO 3+BaCl 2==BaCO 3↓+2NaCl Ba 2+ + CO 32- ==BaCO 3↓21、碳酸钠溶液中通入CO 2:Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2 + H 2O==2HCO 3 –22、NaHCO 3与NaOH 溶液反应:NaHCO 3+NaOH==Na 2CO 3+H 2O HCO 3 - +OH -==CO 32- +H 2O23、NaHCO 3与盐酸反应:NaHCO 3+HCl==Na 2CO 3+CO 2↑+H 2O HCO 3 - +H + == CO 2↑+ H 2O24、碳酸钠与不足的盐酸反应:Na 2CO 3+HCl==NaHCO 3+NaCl CO 32- + H + == HCO 3-25、碳酸钠与足量的盐酸反应:Na 2CO 3+2HCl==2NaCl+CO 2↑+H 2O CO 32-+2H +==CO 2↑+H 2O通电 通电 点燃 点燃 光 点燃 点燃 光 点燃 700~800℃ 通电26、碳酸氢钠固体受热分解:2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O27、侯氏制碱法:NaCl + NH 3 + CO 2 + H 2O == NaHCO 3 + NH 4Cl28、醋酸的电离方程式:CH 3COOHCH 3COO - + H + 29、一水合氨的电离方程式:NH 3·H 2O NH 4+ + OH -30、从海水中提取镁:CaCO 3 CaO + CO 2↑煅烧贝壳制得生石灰CaO + H 2O == CaOH 2 生石灰溶于水制成石灰乳CaOH 2 + MgCl 2 == MgOH 2↓+ CaCl 2 得到氢氧化镁沉淀 MgOH 2 + 2HCl == MgCl 2 + 2H 2O 得到无水氯化镁MgCl 2熔融 Mg + Cl 2↑ 电解熔融的氯化镁31、镁与水的反应:Mg + 2H 2O MgOH 2 + H 2↑32、镁与氮气的反应:3Mg + N 2 Mg 3N 233、镁与二氧化碳的反应:2Mg + CO 2 2MgO + C1、氧化铝与氢氧化钠反应:Al 2O 3 + 2NaOH == 2NaAlO 2 + H 2O Al 2O 3+2OH - ==2AlO 2-+H 2O2、氧化铝与硫酸反应:Al 2O 3 + 3H 2SO 4 == Al 2SO 43 + 3H 2O Al 2O 3 + 6H + == 2Al 3+ + 3H 2O3、偏铝酸钠溶液中通入过量CO 2:NaAlO 2 + CO 2 + 2H 2O == AlOH 3↓+ NaHCO 3 AlO 2 - + CO 2 + 2H 2O == AlOH 3↓+ HCO 3 –4、三氯化铝溶液中加入氨水:AlCl 3 + 3NH 3·H 2O == AlOH 3↓+ 3NH 4Cl Al 3+ + 3NH 3·H 2O == AlOH 3↓+ 3NH 4+5、可溶性偏铝酸盐中加入过量的盐酸: AlO 2 - + 4H + == Al 3+ + 2H 2O6、可溶性铝盐中加入过量的氢氧化钠: Al 3+ + 4OH - ==AlO 2 - + 2H 2O-7、氢氧化铝受热分解:2AlOH 3 Al 2O 3 +3 H 2O8、电解熔融的氧化铝:2Al 2O 3熔融 4Al + 3O 2↑ 9、氢氧化铝与盐酸的反应:AlOH 3+3HCl==AlCl 3+3H 2O AlOH 3 + 3H + == Al 3++ 3H 2O10、氢氧化铝与NaOH 的反应:AlOH 3+NaOH==NaAlO 2+2H 2O AlOH 3+OH -==AlO 2-+2H 2O11、明矾溶于水的电离方程式::KAlSO 42 == K + + Al 3+ + 2SO 42-12、铝离子与水反应生成AlOH 3胶体的离子方程式:Al 3+ + H 2OAlOH 3胶体 + 3H + 13、铝与盐酸的反应:2Al + 6HCl == 2AlCl 3 + 3H 2↑2Al + 6H + == 2Al 3+ + 3H 2↑14、铝与NaOH 反应:2Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑2Al+2OH -+2H 2O==2AlO 2-+3H 2↑15、铝与氧化铁发生铝热反应:2Al + Fe 2O 3 Al 2O 3 +2Fe 16、工业炼铁:CO 还原铁矿石:Fe 2O 3 + 3CO 2Fe+3CO 2还原剂的生成:C + O 2 CO 2 CO 2 + C2CO 除脉石的反应:CaCO 3 + SiO 2 CaSiO 3 + CO 2↑17、铜与硝酸银溶液的反应:Cu + 2AgNO 3 == 2Ag + CuNO 32 Cu + 2Ag + == Cu 2+ + 2Ag18、Fe 3+离子的检验:Fe 3+ + 3SCN - == FeSCN 3 血红色高温 通电 点燃 点燃 通电 高温 高温 高温 点燃 高温19、氯化亚铁与氯水的反应:2FeCl 2 +Cl 2 == 2FeCl 3 2Fe 2+ + Cl 2 == 2Fe 3+ + 2Cl –20、铁粉投入三氯化铁溶液中:Fe + 2FeCl 3 == 3FeCl 2 Fe + 2Fe 3+ ==3Fe 2+21、铜与三氯化铁溶液反应:Cu + 2FeCl 3 == CuCl 2 + 2FeCl 2 Cu + 2Fe 3+ == Cu 2+ + 2Fe 2+22、Fe 2+与碱反应的离子方程式:Fe 2+ + 2OH - == FeOH 2↓白色絮状沉淀23、Fe 3+与碱反应的离子方程式:Fe 3+ + 3OH - == FeOH 3↓红褐色沉淀24、氢氧化亚铁在空气中的氧化:4FeOH 2 + O 2 + 2H 2O == 4FeOH 325、碱式碳酸铜受热分解:Cu 2OH 2CO 3 2CuO +CO 2↑+ H 2O26、二氧化硅与氧化钙的反应:SiO 2 + CaO CaSiO 327、二氧化硅溶与强碱:SiO 2 + 2NaOH == Na 2SiO 3 + H 2O 28、硅的提纯:碳还原二氧化硅制取粗硅:SiO 2 + 2C Si + 2CO ↑ 粗硅的提纯:Si + 2Cl 2 SiCl 4SiCl 4 + 2H 2 Si +4HCl29、硅酸钠与盐酸的反应:Na 2SiO 3 + 2HCl == H 2SiO 3↓+ 2NaCl30、二氧化碳通入硅酸钠溶液中:Na 2SiO 3 + 2CO 2 + 2H 2O == H 2SiO 3↓+ 2NaHCO 31、二氧化硫溶于水:SO 2 +H 2O H 2SO 32、亚硫酸在空气中被氧化:2H 2SO 3 + O 2 == 2H 2SO 43、二氧化硫通入澄清石灰石:SO 2 + CaOH 2 == CaSO 3↓+ H 2O4、CaSO 3在空气中氧化:2CaSO 3 + O 2 == 2CaSO 45、氨水法脱硫的原理:SO 2 + 2NH 3 + H 2O == NH 4 2SO 3SO 2 + NH 3 + H 2O == NH 4HSO 32NH 4 2SO 3 + O 2 == 2NH 4 2SO 46、接触法制硫酸:4FeS 2 + 11O 2 2Fe 2O 3 + 8SO 2 或 S + O 2 SO 2 2SO 2 + O 2 2SO 3SO 3 + H 2O == H 2SO 47、铜与浓硫酸在加热的条件下的反应:Cu + 2H 2SO 4浓CuSO 4 + SO 2↑+ 2H 2O 8、浓硫酸与碳的反应:C + 2H 2SO 4浓CO 2↑+ 2SO 2↑+ 2H 2O9、汞与硫磺的反应:Hg + S == HgS10、实验室制备少量SO 2:Na 2SO 3+H 2SO 4浓==Na 2SO 4+SO 2↑+H 2OSO 32-+2H +==SO 2↑+H 2O11、亚硫酸钠暴露在空气中的反应:2Na 2SO 3 + O 2 == 2Na 2SO 412、实验室制备少量的H 2S :FeS + H 2SO 4 == FeSO 4 + H 2S ↑ FeS + 2H + == Fe 2+ + H 2S ↑13、硫化氢气体通入氯水中:H 2S + Cl 2 == S ↓+ 2HCl14、氢气与硫单质的反应:H 2 + S H 2S 高温 高温 高温 高温 高温 点燃催化剂 △15、SO 2与氢氧化钠溶液的反应:SO 2 + 2NaOH == Na 2SO 3 + H 2O SO 2 + 2OH - == SO 32- + H 2O16、 硫化氢在足量的氧气中燃烧:2H 2S + 3O 2 足量 2SO 2 + 2H 2O硫化氢与不足的氧气反应:2H 2S + O 2不足 2S + 2H 2O17、硫化氢与二氧化硫的反应:2H 2S + SO 2 == 3S ↓+ 2H 2O18、二氧化硫与氯水的反应:SO 2+Cl 2+2H 2O==2HCl+H 2SO 4SO 2+Cl 2+2H 2O==4H ++2Cl -+SO 42-19、氮气与氧气在放电条件下的反应:N 2 +O 2 2NO 20、NO 与氧气的反应:2NO + O 2 == 2NO 221、NO 2溶于水:3NO 2 + H 2O == 2HNO 3 + NO22、工业上合成氨:N 2 + 3H 2 2NH 323、氨气与水的反应同时一水合氨发生电离:NH 3 + H 2ONH 3·H 2O NH 4+ + OH – 24、氨气与盐酸的反应:NH 3 + HCl == NH 4Cl25、氨气与硫酸的反应:2NH 3 + H 2SO 4 == NH 42SO 426、氨水与盐酸的反应:NH 3·H 2O + HCl == NH 4Cl + H 2O27、氯化铵受热分解:NH 4Cl NH 3 + HCl28、碳酸氢氨受热分解:NH 4HCO 3NH 3↑+ CO 2↑+ H 2O 29、实验室制取氨气:CaOH 2 + 2NH 4ClCaCl 2 + 2NH 3↑+ 2H 2O 30、硝酸见光分解:4HNO 3 2H 2O + 4NO 2↑+ O 2↑31、铜与浓硝酸的反应:Cu + 4HNO 3浓 == CuNO 32 + 2NO 2↑+ 2H 2O32、铜与稀硝酸的反应:3Cu + 8HNO 3稀 == 3CuNO 32 + 2NO ↑+ 4H 2O33、碳与浓硝酸的反应:C + 4HNO 3浓CO 2↑+ 4NO 2↑+ 2H 2O 34、氨氧法制硝酸:4NH 3 + 5O 2 4NO + 6H 2O2NO+O 2=2NO 2 3NO 2+H 2O=2HNO 3+NO 点燃点燃 放电 光。
高一化学必修一方程式大全

高一必会化学方程式汇总【1】一、钠1、Na放置在空气中:4Na+O2=2Na2O2、Na在空气中燃烧:2Na+O2点燃Na2O23、Na和水反应:2Na+2H2O=2NaOH+H2↑ 离子方程式2Na+2H2O=2Na++2OH—+H2↑4、过氧化钠(Na2O2)与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑离子方程式 2 Na2O2+2H2O=4Na++4OH—+O2↑5、过氧化钠(Na2O2)与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O26、NaHCO3加热:2NaHCO3加热Na2CO3+H2O+CO2↑7、用小苏打治疗胃酸过多:NaHCO3+HCl==NaCl+H2O+CO2↑离子方程式HCO3_—+H+== H2O+CO2↑8、碳酸钠与盐酸反应Na2CO3+2HCl==2NaCl+H2O+CO2↑离子方程式CO3_2—+2H+== H2O+CO2↑认识本质(分步反应过程如下):Na2CO3+ HCl==2NaCl + NaHCO3 NaHCO3+HCl==NaCl+H2O+CO2↑9、氢氧化钠中通入少量的二氧化碳:2NaOH+ CO2= Na2CO3 + H2O10、氢氧化钠中通入过量的二氧化碳:2NaOH+ CO2= Na2CO3 + H2O和Na2CO3 + H2O+ CO2=2NaHCO3总反应:NaOH+CO2=NaHCO3二、铝11、Al与NaOH溶液反应方程式:2Al+2NaOH+2H2O == 2NaAlO2+3H2↑离子方程式2Al+2OH-+2H2O == 2AlO2—+3H2↑12、Al与HCl溶液反应方程式:2Al+6HCl==2AlCl3+3H2↑离子方程式2Al+6H+==2Al3++3H2↑ 13、Al2O3与稀HCl反应的方程式:Al2O3+6HCl == 2AlCl3+3H2O离子方程式Al2O3+6H+== 2Al3++3H2O14、Al2O3与NaOH溶液反应的方程式:Al2O3+2NaOH == 2NaAlO2+H2O离子方程式Al2O3+2OH—_== 2AlO2—+H2O15、AlCl3与少量NaOH溶液反应的离子方程式:Al3++3OH- == Al(OH)3↓16、Al(OH)3与NaOH溶液反应方程式:Al(OH)3+NaOH == NaAlO2+2H2O离子方程式Al(OH)3+OH— == AlO2—+2H2O17、AlCl3与过量NaOH溶液反应的离子方程式:Al3++4OH- == AlO2-+2H2O18、Al(OH)3与稀HCl反应的化学方程式Al(OH)3+3HCl ==AlCl3+ 3H2O离子方程式:Al(OH)3+3H+ == Al3++3H2O19、AlCl3与过量氨水反应的化学方程式:AlCl3+3NH3.H2O == Al(OH)3↓+3NH4Cl离子方程式:Al3++3NH3.H2O == Al(OH)3↓+3NH4+20、NaAlO2通入少量二氧化碳:2NaAlO2+CO2 +3H2O===Na2CO3+2Al(OH)3↓21、NaAlO2通入足量二氧化碳:NaAlO2+CO2 +2H2O===NaHCO3+Al(OH)3↓22、Al(OH)3受热分解方程式:2Al(OH)3加热Al2O3+3H2O三、铁23、铁与水蒸气高温:3Fe+4H2O(g) 高温Fe3O4+4H2↑24、氧化亚铁与稀盐酸反应:FeO+2HCl == FeCl2+H2O离子方程式:FeO+2H+ == Fe2+ + H2O25、氧化铁与稀盐酸反应:Fe2O3+6HCl == 2FeCl3+3H2O离子方程式:Fe2O3+6H+ ==2Fe3+ + 3H2O26、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl离子方程式:Fe3+ +3 OH—==Fe(OH)3↓27、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4离子方程式:Fe3+ +2 OH—==Fe(OH)2↓28、氢氧化亚铁在空气中露置的方程式:4Fe(OH)2+O2+2H2O == 4Fe(OH)329、铁粉与氯化铁溶液反应的化学方程式:2FeCl3 + Fe = 3FeCl2离子方程式:Fe + 2Fe3+ == 3Fe2+铜粉与氯化铁溶液反应的化学方程式:Cu+2FeCl3==2FeCl2+CuCl230、氯化亚铁溶液中通入氯气的化学反应方程式:2FeCl2 + Cl2 = 2FeCl3离子方程式:2Fe2++Cl2 == 2Fe3++2Cl-30、氯化亚铁溶液中通入氯气的化学反应方程式:2FeCl2 + Cl2 = 2FeCl3离子方程式:2Fe2++Cl2 == 2Fe3++2Cl-31、氢氧化铁胶体的制备:FeCl3 + 3H2O加热2Fe(OH)3(胶体)+ 3HCl四、硅31、SiO2与HF反应:SiO2+4HF==SiF4↑+2H2O32、SiO2与NaOH溶液反应:SiO2+2NaOH==Na2SiO3+H2O离子方程式SiO2+2OH—==SiO32—+H2O33、SiO2与CaO反应:SiO2+CaO高温CaSiO334、Na2SiO3与盐酸反应:Na2SiO3+2HCl==2NaCl+H2SO3↓35、Na2SiO3与少量二氧化碳反应:Na2SiO3+CO2 +H2O== H2SiO3↓+ Na2CO336、Na2SiO3与过量二氧化碳反应:Na2SiO3+2CO2 +2H2O= H2SiO3↓+2NaHCO3五、氯37、氯气和钠反应:Cl2+2Na点燃2NaCl38、氯气和铁反应:3Cl2+2Fe点燃2FeCl339、氯气和铜反应:Cl2+Cu点燃CuCl240、氯气和氢气反应:Cl2+H2 点燃2HCl41、氯气通入水中:Cl2+H2O HClO+HCl离子方程式Cl2 + H2O ==HClO+ H++Cl —42、用氢氧化钠溶液吸收多余的氯气:Cl2+2NaOH==NaCl+NaClO+H2O 离子方程式Cl2+2OH —==Cl —+ClO —+H2O43、氯气通入石灰乳中制漂粉精:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O 漂白粉的漂白原理:Ca(ClO)2+H2O+ CO2==2 HClO+ CaCO344、次氯酸见光分解 2HClO 光照2HCl+O2↑六、硫45 、硫单质与氧气反应:S+O2高温SO246、二氧化硫溶于水:SO2+H2O H2SO347、氢氧化钠与少量二氧化硫:SO2(少量)+ 2 NaOH = Na2SO3 + H2O 离子方程式:SO2 + 2 OH —= SO3 2—+ H2O48、氢氧化钠与过量二氧化硫:SO2 (过量) + NaOH = NaHSO3离子方程式:SO2 + OH —==HSO3—49、二氧化硫与氧化钠:SO2 + Na2O = Na2SO350、碳酸钠与少量二氧化硫:SO2(少量)+ Na2CO3 = Na2SO3 + CO2离子方程式:SO2 + CO32—= SO3 2—+ CO251、二氧化硫与氧气:2SO2+O22SO3(条件:加热、催化剂)52、二氧化硫与氧化剂氯气的反应:SO2 + Cl2+2H2O = H2SO4 + 2HCl(其中Cl2可以用Br2、I2替换)离子方程式:SO2 + Cl2 + 2H2O = 4H+ + SO42-+ 2Cl-★SO2也可以与高锰酸钾和氯化铁FeCl3发生氧化还原反应53、SO3与水的反应:SO3+H2O=H2SO454、SO3与Ca (OH )2反应:SO3+Ca (OH )2=CaSO4+H2O55、SO3与CaO 反应:SO3+CaO=CaSO4七、氮56、氮气与氧气化合:N2+O2放电 2NO57、NO 与空气接触:2NO+O2==2NO258、NO2溶于水:3NO2+2H2O==2HNO3+NO59、NO2与O2混合通入水中:4NO2+O2+2H2O==4HNO360、NO 与O2混合通入水中:4NO+3O2+2H2O==4HNO3八、氨硫酸硝酸61、氮气与氢气化合(工业合成氨):N2+3H2 2NH3(高温,高压,催化剂)氨的催化氧化:4NH3+5O2== 4NO+6H2O 62、氨气与水:NH3+H2O NH3﹒H2O63、加热浓氨水NH3﹒H2O 加热 NH3↑+H2O64、氨气与浓盐酸空中生烟:NH3+HCl=NH4Cl65、碳酸氢铵受热分解:NH4HCO3加热NH3↑+CO2↑+H2O催化剂 加热66、氯化铵受热分解:NH4Cl加热NH3↑+HCl↑67、实验室用固体和固体混合加热制氨气:2NH4Cl+Ca(OH)2加热CaCl2+2NH3↑+2H2O68、金属铜与浓硫酸混合加热:Cu+2H2SO4(浓) 加热CuSO4+SO2↑+2H2O69、铁少量:2Fe+6H2SO4(浓)加热Fe2(SO4)3+3SO2↑+6H2O铁过量:Fe+2H2SO4(浓)加热FeSO4+SO2↑+2H2O70、木炭与浓硫酸混合加热:C+2H2SO4(浓) 加热CO2↑+2SO2↑+2H2O71、铜与浓硝酸反应:Cu+4HNO3==Cu(NO3)2+2NO2↑+2H2O离子方程式Cu+4H++2NO3—==Cu2++2NO2↑+2H2O72、铜与稀硝酸反应:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O离子方程式3Cu+8H++2NO3—==3Cu2++2NO↑+4H2O。
高一化学必修一化学方程式大全及离子方程式

9、氯气的主要化学性质: Cl2+H22HCl(或光照) 3Cl2+2P2PCl3 Cl2+PCl3PCl5 3Cl2+2Fe2FeCl3 Cl2+2Na2NaCl Cl2+CuCuCl2 Cl2+2FeCl2=2FeCl3Cl2+2Fe2+==2Fe3++2Cl- Cl2+2NaBr=Br2+2NaClCl2+2Br-=Br2+2Cl- Cl2+2KI=2KCl+I2Cl2+2I-==2Cl-+I2 Cl2+H2O=HCl+HClOCl2+H2O==ClБайду номын сангаас+H++HClO 2HClO2HCl+O2↑ Cl2+SO2+2H2O=H2SO4+2HClCl2+SO2+2H2O==2Cl-+SO42-+4H+ Cl2+2NaOH=NaCl+NaClO+H2OCl2+2OH-==Cl-+ClO-+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O2Ca(OH)2+2Cl2 =2Ca2++2ClO-+2Cl-+2H2O Ca(ClO)2+CO2+H2O=CaCO3↓+2HClOCa2++2ClO-+CO2 +H2O=CaCO3↓+2HClO 10、铁及其化合物的主要化学性质: 2Fe+3Cl22FeCl3 3Fe+2O2Fe3O4 Fe+SFeS
高一化学必修一化学方程式大全及离子方程式
高一化学必修一化学方程式及离子方程式小结 必修一化学方程式及离子方程式小结 1、硫酸根离子的检验: BaCl2+Na2SO4=BaSO4↓+2NaClSO42-+Ba2+==BaSO4↓ 2、碳酸根离子的检验: CaCl2+Na2CO3=CaCO3↓+2NaClCO32-+Ca2+==CaCO3↓ 3、碳酸钠与盐酸反应: Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+==CO2↑+H2O 4、木炭还原氧化铜:2CuO+C2Cu+CO2↑ 5、钠与非金属单质反应: 4Na+O2=2Na2O 2Na+O2Na2O2 Cl2+2Na2NaCl 6、钠与水反应:2Na+2H2O=2NaOH+H2↑2Na+2H2O==2Na++2OH- +H2↑ 7、氧化钠的主要化学性质:2Na2O+O22Na2O2 Na2O+H2O=2NaOHNa2O+SO3=Na2SO4 Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O 8、过氧化钠的主要反应: 2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2 Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2
高一必修化学方程式以及离子方程式(含学习计划参考)

必修一化学方程式以及离子方程式1、铝片与稀盐酸反应2Al + 6HCl = 2AlCl3+ 3H2↑ 2Al + 6H+= 2Al3++3H2↑2、铝与氢氧化钠溶液反应 2Al+2NaOH +2H2O = 2NaAlO2-+3H2↑2Al + 2OH -+2H2O = 2AlO2-+ 3H2↑3、铝与三氧化二铁高温下反应(铝热反应) 2Al + Fe2O3高温2Fe + Al2O34、氧化铝溶于氢氧化钠溶液Al2O3+ 2NaOH 2NaAlO2+H2O Al2O3+ 2OH -=2AlO2-+ H2O5、硫酸铝溶液中滴过量氨水Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++ 3 NH3·H2O = Al(OH)3↓+ 3NH4+6、①氢氧化铝溶液中加盐酸 Al(OH)3+ 3HCl = AlCl3+ 3H2OAl(OH)3+ 3H+= Al3++ 3H2O②Al(OH)3与NaOH溶液反应 Al(OH)3+ NaOH NaAlO2+2 H2OAl(OH)3+ OH-=AlO2-+2 H2O7、钠在空气中燃烧 2Na+O2 Na2O2(黄色火焰、淡黄色固体)钠块在空气中变暗 4Na+O2=2Na2O(白色固体)Na2O在空气中加热(变黄) 2Na2O+O2△2Na2O28、钠与水反应(浮、熔、游、响、红)2Na + 2H2O =2 NaOH+H2↑ 2Na + 2H2O = 2Na++ 2OH-+H2↑9、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+ 2H2O=4NaOH+ O2↑ 2Na2O2+2H2O =4Na++4OH-+O2↑碱性氧化物Na2O与水的反应 Na2O+H2O=2NaOH10、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+ 2CO2= 2Na2CO3+ O211、小苏打受热分解 2NaHCO3△Na2CO3+ H2O +CO2↑12、高温下铁与水反应 3Fe + 4H2O(g) 高温 Fe3O4+ 4H213、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色最终变红褐色)4Fe (OH)2+ O2+ 2H2O = 4Fe (OH)314、氯气溶于水 Cl2 + H2O = HCl + HClO Cl2+ H2O == Cl-+ H+ + HClOHClO的不稳定性 2HClO 2HCl + O2↑15、氯气和二氧化硫 Cl2+SO2+2H2O=H2SO4+2HCl16、制漂白液:Cl2+2NaOH=NaCl+NaClO+H2O17、制漂粉精、漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O18、漂白粉变质 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO19、氨气的实验室制法: 2NH4Cl + Ca(OH)2△CaCl2+ NH3↑ + H2O20、 4HNO3(浓)+C△CO2↑+4NO2↑+2H2O21、Cu + 4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2Cu + 4H++ 2NO3-== Cu2+ + 2NO2↑+ 2H2O3Cu + 8 HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 3Cu + 8H+ +2NO3-== 3Cu2++ 2NO↑+ 4H2O22、氨的催化氧化(工业制硝酸的基础)4NH3+5O24NO + 6H2O23、S+H2 △H2S S+Fe△FeS S+2Cu△Cu2S S+O2点燃SO224、弱酸 SO2+H2O=H2SO325、SO2的弱氧化性 SO2+ 2H2S=3S↓+2H2O (淡黄色沉淀)26、SO2酸性氧化物的通性 2NaOH+SO2(少量)=Na2SO3+H2O SO2+ 2OH-== SO32-+ H2ONaOH+SO2(足量)=NaHSO3SO2+ OH- == HSO3-27、2SO2+O2催化剂加热2SO328、浓硫酸的强氧化性 2H2SO4(浓)+C△CO2↑+2SO2↑+2H2O2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2O29、实验室制备SO2 Na2SO3+H2SO4= Na2SO4+ SO2↑+ H2O SO32- + 2H+ ==SO2↑+ H2O30、硫酸根离子的检验: BaCl2 + Na2SO4= BaSO4↓+ 2NaCl SO42- + Ba2+ == BaSO4↓31、碳酸根离子的检验:CaCl2 + Na2CO3= CaCO3↓ + 2NaCl CO32- + Ca2+== CaCO3↓32、碳酸钠与盐酸反应: Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑CO32- + 2H+== CO2↑+ H2O33、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl = 2NaCl+ H2O+CO2↑ CO32-+ 2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量光照Na2CO3+ HCl =NaHCO3+ NaCl CO32-+ H+= HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑34、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+ NaOH△Na2CO3+ H2OHCO3-+ OH -= H2O + CO32-(若是溶液中反应有离子方程式)35、铝箔在氧气中剧烈燃烧 4Al + 3O2点燃2Al2O336、铁与盐酸反应 Fe + 2HCl = FeCl2+ H2↑ Fe+2H+=Fe2++H2↑37、氧化铁溶于盐酸中 Fe2O3+ 6HCl = 2FeCl3+ 3H2OFe2O3+ 6H+= 2Fe3++ 3H2O38、氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3+ 3NaOH = Fe(OH)3↓+3NaCl Fe3++ 3OH -= Fe(OH)3↓39、氯化亚铁溶液中通入氯气 2FeCl2+ Cl2= 2FeCl32 Fe2++ Cl2= 2 Fe3++ 2Cl-40、氯化铁溶液中加入铁粉2FeCl3+ Fe = 3FeCl22Fe3++ Fe = 3Fe2+41、用KSCN检验Fe3+的存在离子方程式Fe3++3SCN-= Fe (SCN)3(血红色)42、工业制单质硅(碳在高温下还原二氧化硅) SiO2+ 2C 高温 Si + 2CO↑43、二氧化硅与氢氧化钠反应SiO2+ 2NaOH = Na2SiO3+ H2O(强碱溶液不能使用磨口玻璃塞)SiO2+ 2OH -= SiO32-+ H2O44、硅与氧气反应Si + O2△SiO245、硅与氢氧化钠溶液反应Si+ 2NaOH + H2O= Na2SiO3 + 2H2↑Si + 2OH- + H2O == SiO32- + 2H2↑46、制玻璃(三大传统硅酸盐材料:水泥、玻璃、陶瓷)SiO2+Na2CO3高温Na2SiO3+CO2SiO2+CaCO3高温CaSiO3+CO248、氯气和非金属反应 Cl2 +H22HCl (或光照)3Cl2 +2P2PCl3(白雾) Cl2+PCl3PCl5(白烟)49、氯气和金属反应(最高价氯化物)3Cl 2 +2Fe 2FeCl 3 (棕黄色烟)Cl 2+CuCuCl 2 (棕黄色烟) Cl 2 +2Na2NaCl(白烟)50、强氧化性: Cl 2 +2FeCl 2 =2FeCl 3 Cl 2 + 2Fe 2+ == 2Fe 3+ + 2Cl -Cl 2 + 2NaBr = Br 2 + 2NaCl Cl 2 + 2Br - = Br 2 + 2Cl - Cl 2 + 2KI =2KCl + I 2 Cl 2 + 2I - == 2Cl - + I 251、氮气和氢气反应(工业合成氨) N 2 + 3H 2催化剂 高温高压2NH 352、氮气和氧气放电下反应(雷雨发庄稼)N 2 + O 2 2NO 2NO + O 22NO 2(气体由无色变红棕色) 53、二氧化氮溶于水 3NO 2 + H 2O 2HNO 3 + NO 3NO 2 + H 2O2H ++ 2NO 3-+NO54、 用浓盐酸检验氨气(白烟生成) HCl + NH 3 = NH 4Cl 55、HNO 3与Fe 的反应,Al 、Fe 遇冷浓HNO 3、浓硫酸钝化(常温)Fe 与浓HNO 3加热 Fe +6HNO 3△Fe(NO 3)3+3NO 2↑+3H 2O56、Fe 与稀HNO 3反应 Fe +4HNO 3(过量)=Fe(NO 3)3+NO ↑+2H 2O3Fe (过量)+8HNO 3=3Fe(NO 3)2+2NO ↑+4H 2O57、久置的浓硝酸因分解含NO 2而呈黄色 4HNO 34NO 2↑+O 2↑+2H 2O58、NO 2 、O 2 的混合气通入水中无剩余气体 4NO 2 + O 2 + 2H 2O = 4 HNO 3 59、NO 、O 2 的混合气通入水中无剩余气体 4NO + 3O 2 + 2H 2O = 4 HNO 3 60、 碳酸氢铵受热分解 【与(NH 4)2CO 3 分解产物相同】NH 4HCO 3△NH 3 ↑+ H 2O ↑ + CO 2↑61、硫酸铵溶液与氢氧化钠溶液混合加热 (NH 4)2SO 4 +2NaOH △2NH 3↑+Na 2SO 4 +2H 2ONH 4+ + OH - △NH 3 ↑+ H 2O62、 硝酸铵溶液与氢氧化钠溶液混合(不加热)NH 4NO 3 + NaOH = NH 3·H 2O + NaNO 3 NH 4++OH -=NH 3·H 2O必修二第一章 物质结构 元素周期律放电O2 2Li2O1、Li与O2反应(点燃): 4Li +2Na+O2Na2O2Na与O2反应(点燃):Na与H2O反应:2Na+2H2O===2NaOH + H2↑(浮、熔、游、响、红)K与H2O反应:2K+2H2O===2KOH + H2↑(浮、熔、游、爆、红)2Rb +2H2O===2KOH + H2↑2Cs + 2H2O === 2KOH + H2↑元素金属性:Li < Na< K < Rb < Cs 单质还原性:Li < Na< K < Rb < Cs对应最高价氧化物的水化物的碱性:Li OH< NaOH< KOH < RbOH < CsOH2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:F2 + H2=== 2HF Cl2+ H2=== 2HCl Br2+ H2=== 2Br I2+ H2=== 2HI元素非金属性:F > Cl > Br > I 单质氧化性:F2 > Cl2> Br2> I2对应氢化物的稳定性:HF > HCl > HBr > HI3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① Cl2+2NaBr===Br2+2NaCl② Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr4、Mg与H2O反应:Mg+2H2O Mg(OH)2+H2↑第二章化学反应与能量1、Ba(OH)2•8H2O与NH4Cl的反应(吸热反应) Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O周次日期范围5 3月16日-3月22日1-66 23日-29日7-117 3月30日-4月5日12-188 6日-12日19-239 13日-19日24-2810 20日-26日29-3411 4月27日-5月3日35-4112 4日-10日42-4713 11日-17日48-5114 18日-24日52-5615 25日-31日57-62。
高一化学必修1重要方程式及离子方程式汇总(精选)
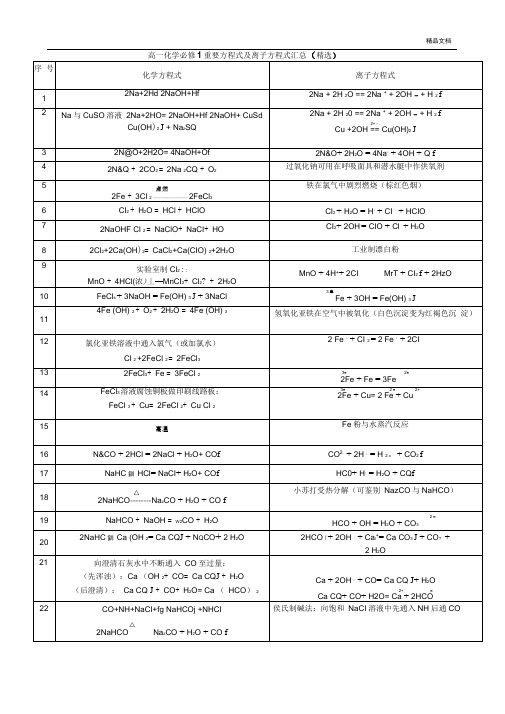
2FeCl3+Fe=3FeCl2
3+2+
2Fe+Fe=3Fe
14
FeCl3溶液腐蚀铜板做印刷线路板:
FeCl3+Cu=2FeCl2+Cu Cl2
3+2+2+
2Fe+Cu=2Fe+Cu
15
高温
Fe粉与水蒸汽反应
16
N&CO+2HCl=2NaCl+H2O+ COf
CO2-+2H+=H2。+CO2f
17
△
2fSQ(浓)+CuCuSO+ SO2T+2H2O
42
△
2H2SO(浓)+S3SOT+2H2O
Mg+2H2O=2Mg(OH)2J+H2T
43
点燃
2Mg+CO22MgO+C
现象:发出耀眼白光,试管壁纸生成黑色小颗粒
44
海水中提镁
Mg +Ca(OH)2(石灰乳)=Mg(OH)2J+Ca2
Mg(OH)+2HCI = MgCI2+2H2O MgCb(熔融)=Mg+CI2T
38
2NaOH+SQ(少量)=Na2SO + H2O
SO+2OH—==SO32—+H2O
39
NaOH+SO(足量)=NaHSO
SQ+OH—==HSOs—
40
Na^SO+H2SQ = NazSQ+SO2T+H2O
(实验室制SO)
SQ+2H==SO2T+H2O
高一必修1化学方程式以及离子方程式

高一化学必修 1 化学学方程式 一、化学方程式以及离子方程式 1、钠在空气中燃烧(黄色的火焰) 钠在空气中燃烧(黄色的火焰) 2Na + O2 钠块在空气中变暗 4Na+O2=2Na2O + Na2O 在空气中加热(变黄) 在空气中加热(变黄) 2Na2O+O2=2Na2O2 + 2、钠与水反应(浮、熔、游、响、红) 、钠与水反应( 2Na + 2H2O = 2 NaOH + H2 ↑ 2Na + 2H2O = 2Na+ + 2OH-+H2 ↑ 3、过氧化钠与水的反应(放热反应、Na2O2 是 、过氧化钠与水的反应(放热反应、 强氧化剂,用于漂白) 强氧化剂,用于漂白) 漂白 2Na2O2 + 2H2O = 4NaOH + O2 ↑ 2Na2O2+2H2O =4Na++4OH-+O2↑ 碱性氧化物 Na2O 与水的反应 Na2O+H2O=2NaOH + = 4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na2O2 + 2CO2 = 2Na2CO3 + O2 5、苏打(纯碱)与盐酸反应 、苏打(纯碱) ①盐酸中滴加纯碱溶液 Na2CO3+2HCl = 2NaCl+ H2O+CO2↑ + + CO32- + 2H+ = H2O + CO2↑ ②纯碱溶液中滴加盐酸,至过量 纯碱溶液中滴加盐酸, 盐酸 Na2CO3 + HCl =NaHCO3 + NaCl CO32- + H+ = HCO3- - + - - + + - + - Na2O2 NaHCO3+HCl=NaCl+H2O+CO2↑ = + + HCO3-+H+ = H2O +CO2↑ 6、小苏打受热分解 、 - + 第 1 页 共 6 页 高一化学必修 1 化学学方程式 △ 2NaHCO3 Na
高中化学必修1化学方程式以及离子方程式大全

必修一化学方程式以及离子方程式1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42-+ Ba2+ == BaSO4↓2、碳酸根离子的检验:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl CO32-+ Ca2+== CaCO3↓3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32-+ 2H+== CO2↑+ H2O 4、铝与硝酸铜溶液反应:2Al+3Cu(NO3)2= 2Al(NO3)3+ 3Cu 2Al+3Cu2+= 2Al3++ 3Cu5、钠在空气中燃烧(黄色的火焰)2Na +O2Na2O2钠块在空气中变暗4Na+O2=2Na2ONa2O在空气中加热(变黄)2Na2O+O2△2Na2O26、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2 NaOH +H2↑2Na +2H2O =2Na++2OH-+H2 ↑7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH-+O2↑碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH8、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O29、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑10、小苏打受热分解2NaHCO3△Na2CO3+H2O +CO2 ↑11、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)12、铝箔在氧气中剧烈燃烧4Al +3O2点燃2Al2O313、铝片与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑14、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2-+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑15、铝与三氧化二铁高温下反应(铝热反应)2Al +Fe2O3高温2Fe +Al2O316、氧化铝溶于氢氧化钠溶液Al2O3+2NaOH 2NaAlO2+H2OAl2O3+2OH -=2AlO2-+H2O17、硫酸铝溶液中滴过量氨水Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+18、①氢氧化铝溶液中加盐酸Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②Al(OH)3与NaOH溶液反应Al(OH)3+NaOH NaAlO2+2 H2OAl(OH)3+OH-=AlO2-+2 H2O19、高温下铁与水反应3Fe +4H2O(g) 高温Fe3O4+4H220、铁与盐酸反应Fe +2HCl =FeCl2+H2↑ Fe +2H+=Fe2++H2↑21、氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2OFe2O3+6H+=2Fe3++3H2O22、氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3+3NaOH =Fe(OH)3↓+3NaClFe3++3OH -=Fe(OH)3↓23、氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)4Fe (OH)2+O2+2H2O =4Fe (OH)324、氯化亚铁溶液中通入氯气2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-25、氯化铁溶液中加入铁粉2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+26、用KSCN检验Fe3+的存在离子方程式Fe3++3SCN-= Fe (SCN)3 (血红色)27、工业制单质硅(碳在高温下还原二氧化硅)SiO2+2C 高温Si +2CO↑28、二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+2OH -=SiO32-+H2O29、硅与氧气反应Si(粉)+O2△SiO230、硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑Si + 2OH-+ H2O == SiO32-+ 2H2↑31、制玻璃SiO2+Na2CO3高温Na2SiO3+CO2 SiO2+CaCO3高温CaSiO3+CO2 32、氯气和非金属反应Cl2 +H22HCl (或光照)3Cl2 +2P2PCl3Cl2 +PCl3PCl533、氯气和金属反应3Cl2 +2Fe2FeCl3Cl2 +2Na2NaClCl2+Cu CuCl234、强氧化性:Cl2 +2FeCl2=2FeCl3Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-Cl2 + 2KI =2KCl + I2Cl2 + 2I-== 2Cl-+ I235、氯气溶于水Cl2+H2O=HCl +HClO Cl2+H2O ==Cl-+H++HClO光照2HClO 2HCl +O2↑36、氯气和二氧化硫Cl2+SO2 +2H2O=H2SO4 +2HCl37、制漂白液:Cl2+2NaOH=NaCl+NaClO+H2O38、制漂粉精、漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O39、漂白粉变质Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO40、氮气和氢气反应(工业合成氨)N2+3H2催化剂高温高压2NH341、氮气和氧气放电下反应(雷雨发庄稼)N2+O2 2NO2NO +O22NO242、二氧化氮溶于水3NO2+H2O 2HNO3+NO3NO2+H2O 2H++2NO3-+NO43、NH3+HCl=NH4Cl(白烟)44、HNO3与Fe的反应Al、Fe遇冷浓HNO3、浓硫酸钝化(常温)Fe与浓HNO3加热Fe+6HNO3△Fe(NO3)3+3NO2↑+3H2O45、Fe与稀HNO3反应Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2O 46、氨气的实验室制法:2NH4Cl + Ca(OH)2△CaCl2 + NH3↑ + H2O47、4HNO34NO2↑+O2↑+2H2O48、4HNO3(浓)+C △CO2↑+4NO2↑+2H2O49、4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H24H++ 2NO3-+ Cu == Cu2+ + 2NO2↑+ 2H2O8 HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O8H+ +2NO3-+ 3Cu == 3Cu2++ 2NO↑+ 4H2O 50、NO2、O2的混合气通入水中无剩余气体4NO2+O2+2H2O =4 HNO351、NO 、O2的混合气通入水中无剩余气体放电4NO+3O2+2H2O =4 HNO352、氨的催化氧化4NH3+5O24NO +6H2O53、碳酸氢铵受热分解NH4HCO3△NH3↑+H2O↑ +CO2↑54、用浓盐酸检验氨气(白烟生成)HCl +NH3=NH4Cl55、硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4+2NaOH△3↑+Na2SO4+2H2ONH4++OH -△NH3↑+H2O56、硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3+NaOH =NH3·H2O +NaNO3NH4++OH-=NH3·H2O57、硫及其化合物的化学性质:S+H2△H2S S+Fe△FeSS+2Cu△Cu2S S+O2点燃SO23S+6NaOH△2S+Na2SO3+3H2O3S + 6OH-△2S2-+ SO32-+ 3H2OSO2 + 2H2S=3S+2H2O SO2+H2O=H2SO32NaOH+SO2(少量)=Na2SO3+H2O SO2 + 2OH-== SO32-+ H2O NaOH+SO2(足量)=NaHSO3SO2 + OH-== HSO3-2SO2+O2催化剂2SO3加热2H2SO4(浓)+C△2↑+2SO2↑+2H2O2H2SO4(浓)+Cu△4+SO2↑+2H2ONa2SO3+H2SO4 = Na2SO4+ SO2↑+ H2O SO32-+ 2H+ == SO2↑+ H2O。
高一化学必修一化学方程式及离子方程式

高一化学必修一化学方程式及离子方程式1、硫酸根离子的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl2、碳酸根离子的检验:CaCl2+Na2CO3=CaCO3↓+2NaCl3、碳酸钠与盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑4、木炭还原氧化铜:2CuO+C高温2Cu+CO2↑5、铁片与硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu6、氯化钙与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl7、钠在空气中燃烧:2Na+O2△Na2O2钠与氧气反应:4Na+O2=2Na2O8、过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑9、过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O210、钠与水反应:2Na+2H2O=2NaOH+H2↑11、铁与水蒸气反应:3Fe+4H2O(g)=F3O4+4H2↑12、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑13、氧化钙与水反应:CaO+H2O=Ca(OH)214、氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O15、氧化铝与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O17、氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3△Fe2O3+3H2O↑21、实验室制取氢氧化铝:Al2(S O4)3+6NH3?H2O=2Al(OH)3↓+3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O24、氢氧化铝加热分解:2Al(OH)3△Al2O3+3H2O25、三氯化铁溶液与铁粉反应:2FeCl3+Fe=3FeCl226、氯化亚铁中通入氯气:2FeCl2+Cl2=2FeCl327、二氧化硅与氢氟酸反应:SiO2+4HF=SiF4+2H2O硅单质与氢氟酸反应:Si+4HF=SiF4+2H2↑28、二氧化硅与氧化钙高温反应:SiO2+CaO高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2+2NaOH=Na2SiO3+H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓32、氯气与金属铁反应:2Fe+3Cl2点燃2FeCl333、氯气与金属铜反应:Cu+Cl2点燃CuCl234、氯气与金属钠反应:2Na+Cl2点燃2NaCl35、氯气与水反应:Cl2+H2O=HCl+HClO36、次氯酸光照分解:2HClO光照2HCl+O2↑37、氯气与氢氧化钠溶液反应:Cl2+2NaOH=NaCl+NaClO+H2O38、氯气与消石灰反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O39、盐酸与硝酸银溶液反应:HCl+AgNO3=AgCl↓+HNO340、漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO41、二氧化硫与水反应:SO2+H2O≈H2S O342、氮气与氧气在放电下反应:N2+O2放电2NO43、一氧化氮与氧气反应:2NO+O2=2NO244、二氧化氮与水反应:3NO2+H2O=2HNO3+NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2+O2催化剂2SO346、三氧化硫与水反应:SO3+H2O=H2SO447、浓硫酸与铜反应:Cu+2H2SO4(浓)△CuSO4+2H2O+SO2↑48、浓硫酸与木炭反应:C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O49、浓硝酸与铜反应:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑50、稀硝酸与铜反应:3Cu+8HNO3(稀)△3Cu(NO3)2+4H2O+2NO↑51、氨水受热分解:NH3?H2O△NH3↑+H2O52、氨气与氯化氢反应:NH3+HCl=NH4Cl53、氯化铵受热分解:NH4Cl△NH3↑+HCl↑54、碳酸氢氨受热分解:NH4HCO3△NH3↑+H2O↑+CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3+NaOH△NH3↑+NaNO3+H2O56、氨气的实验室制取:2NH4Cl+Ca(OH)2△CaCl2+2H2O+2NH3↑57、氯气与氢气反应:Cl2+H2点燃2HCl。
高一化学方程式大全

必修一化学方程式总结一、钠及其化合物1、钠与氧气:常温:4Na + O2 == 2Na2O 点燃:2Na + O2Na2O22、钠与水反应:2Na + 2H2O == 2NaOH + H2↑离子方程式:2Na + 2H2O == 2Na++ 2OH-+ H2↑3、钠与硫酸反应:2Na + H2SO4 == Na2SO4+ H2↑4、氧化钠与水反应:Na2O+H2O == 2NaOH5、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 == 2Na2CO3+ O26、过氧化钠与水反应:2Na2O2 +2H2O == 4NaOH + O2↑离子方程式:2Na2O2 +2H2O == 4Na+ + 4OH-+ O2↑7、NaOH溶液通入少量CO2:2NaOH +CO2 == Na2CO3 +H2O 离子方程式:2OH-+CO2 == CO3 2-+H2ONaOH溶液通入过量CO2:NaOH +CO2 == NaHCO3 离子方程式:OH-+CO2 == HCO3-8、①向碳酸钠溶液滴入少量稀盐酸:Na2CO3+ HCl == NaHCO3 + NaCl向稀盐酸溶液滴入少量碳酸钠:Na2CO3+ 2HCl == 2NaCl +CO2↑+H2O②除去碳酸氢钠中混有的碳酸钠:Na2CO3 + CO2 + H2O == 2NaHCO3③碳酸钠与氢氧化钙:Na2CO3 +Ca(OH)2 == CaCO3 ↓+2NaOH④碳酸氢钠与盐酸:NaHCO3 + HCl == NaCl +CO2↑+H2O⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCO3 +Ca(OH)2 ==NaOH+CaCO3 ↓+H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCO3 +Ca(OH)2 == Na2CO3 +CaCO3 ↓+2H2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH == Na2CO3 +H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3Na2CO3 +CO2↑+H2O⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 +CaCl2 == CaCO3 ↓+2NaCl二、铝及其化合物1、铝与氧气的反应:4Al + 3O2 2Al2O32、铝与氧化铁反应(铝热反应):2Al + Fe2O3 2Fe + Al2O33、铝和稀盐酸:2Al +6HCl == 2AlCl3 +3H2↑离子方程式:2Al+ 6H+ ==2Al3+ +3H2↑4、铝和NaOH溶液:2Al +2NaOH +2H2O == 2NaAlO2 +3H2↑离子方程式:2Al +2OH-+2H2O == 2AlO2-+3H2↑5、氧化铝和稀硫酸:Al2O3 +3H2SO4 == Al2(SO4)3 +3H2O 离子方程式:Al2O3 + 6H+ == 2Al3+ + 3H2O6、氧化铝和NaOH溶液:Al2O3 + 2NaOH == 2NaAlO2 +H2O 离子方程式:Al2O3 + 2OH-== 2AlO2-+ H2O7、氢氧化铝和稀盐酸:Al(OH)3 +3HCl == AlCl3 +3H2O 离子方程式:Al(OH)3 +3H+ == Al3+ + 3H2O8、氢氧化铝和NaOH溶液:Al(OH)3 + NaOH == NaAlO2 +2H2O 离子方程式:Al(OH)3 +OH-==AlO2-+ 2H2O9、氢氧化铝受热分解:2Al(OH)3Al2O3 +3H2O10、硫酸铝与氨水反应:Al2(SO4)3 +6NH3•H2O == 2Al(OH)3↓+3(NH4)2SO4离子方程式:Al3+ + 3NH3•H2O == Al(OH)3↓+3NH4+11、AlCl3溶液中加入少量NaOH溶液:AlCl3 + 3NaOH ==Al(OH)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH == NaAlO2+3NaCl+ 2H2O12、往NaAlO2溶液中通入少量CO2:2NaAlO2 +CO2 + 3H2O == 2Al(OH)3↓+ Na2CO3往NaAlO2溶液中通入过量CO2:NaAlO2 +CO2 + 2H2O == Al(OH)3↓+ NaHCO313、电解氧化铝:2Al2O3(熔融)4Al+3O2↑三、铁及其化合物1、铁与氧气反应:3Fe + 2O2Fe3O4铁与硫反应:Fe + S FeS2、铁与盐酸反应:Fe + 2HCl == FeCl2 +H2↑离子方程式:Fe + 2H+ == Fe2++H2↑铁与CuSO4溶液:Fe +CuSO4 == FeSO4 + Cu 离子方程式:Fe +Cu2+== Fe2++ Cu3、铁和水蒸气:3Fe +4H2O(g)Fe3O4 + 4H24、氧化亚铁与盐酸反应:FeO + 2HCl == FeCl2 +H2O 离子方程式:FeO + 2H+ == Fe2++H2O5、氧化铁与盐酸反应:Fe2O3 + 6HCl == 2FeCl3 +3H2O 离子方程式:Fe2O3 + 6H+ == 2Fe3++3H2O6、CO还原氧化铁:3CO+Fe2O33CO2 + 2Fe7、氯化铁与NaOH溶液:FeCl3 +3NaOH == Fe(OH)3 ↓+3NaCl 离子方程式:Fe3+ +3OH-== Fe(OH)3 ↓8、硫酸亚铁与NaOH溶液:FeSO4 + 2NaOH == Fe(OH)2 ↓+ Na2SO4 离子方程式:Fe2+ +2OH-== Fe(OH)2 ↓9、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 +3H2O10、氢氧化亚铁被氧化为氢氧化铁:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3(白色沉淀迅速变灰绿色,最后变为红褐色)11、除去FeCl2中的FeCl3:Fe +2FeCl3 == 3FeCl2 离子方程式:Fe +2Fe3+ == 3Fe2+12、FeCl2与Cl2反应:2FeCl2 + Cl2 == 2FeCl3 离子方程式:2Fe2+ +Cl2 == 2Fe3+ +2Cl-13、FeCl3与Cu反应:Cu +2FeCl3 == 2FeCl2 +CuCl2 离子方程式:Cu +2Fe3+ == 2Fe2++Cu2+14、氯化铁与硫氰化钾反应:FeCl 3 + 3KSCN Fe(SCN)3 + 3KCl(溶液变红)四、硅及其化合物1、硅与氧气加热:Si + O2 SiO2硅与氟气:Si + 2F2 == SiF42、硅单质与氢氟酸:Si + 4HF== SiF4↑+2H2↑3、硅与NaOH溶液反应:Si + 2NaOH+ H2O == Na2SiO3 + 2H2↑4、二氧化硅与氢氟酸反应:SiO2 + 4HF== SiF4↑+2H2O5、二氧化硅与氧化钙高温反应:SiO2 + CaO CaSiO36、二氧化硅与NaOH溶液反应:SiO2 + 2NaOH == Na2SiO3 +H2O7、二氧化硅与碳反应:SiO2 + 2C2CO + Si8、硅酸钠与与盐酸反应:Na2SiO3 + 2HCl == 2NaCl +H2SiO3↓离子方程式:SiO32-+ 2H+ ==H2SiO3↓9、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 +H2O == Na2CO3 +H2SiO3↓10、二氧化硅与纯碱反应:SiO2 +Na2CO3Na2SiO3 + CO2↑11、二氧化硅与石灰石反应:SiO2 +CaCO3CaSiO3 + CO2↑12、加热硅酸:H2SiO3SiO2 +H2O五、氯及其化合物1、实验室制氯气:MnO2 +4HCl(浓)MnCl2 +Cl2↑+2H2O 离子方程式:MnO2 +4H++2Cl-Mn2++Cl2↑+2H2O2、钠在氯气中燃烧:2Na +Cl22NaCl(产生大量白烟)铁在氯气中燃烧:2Fe +3Cl22FeCl3 (产生大量棕黄色的烟)铜在氯气中燃烧:Cu +Cl2CuCl2 (产生大量棕黄色的烟)氢气在氯气中燃烧:H2 +Cl22HCl(苍白色火焰,瓶口出现白雾)3、氯气和水反应:Cl 2 + H2O HCl+ HClO 离子方程式:Cl2 + H2O H++Cl-+ HClO4、次氯酸光照分解:2HClO2HCl+O2↑5、氯水中通入SO2:Cl2 +SO2 +2H2O==2HCl+H2SO4 离子方程式:Cl2 +SO2 +2H2O==4H++2Cl-+SO42-6、氯气与NaOH溶液:Cl2+2NaOH ==NaCl +NaClO +H2O 离子方程式:Cl2+2OH-==Cl-+ClO-+H2O7、工业生产漂白粉:2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2+2H2O8、漂白粉漂白原理:Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO9、向漂白粉溶液中加入稀盐酸:Ca(ClO)2+2HCl==CaCl2+2HClO10、氯气通入溴化钾溶液:Cl2 + 2KBr ==2KCl +Br2 离子方程式:Cl2 + 2Br-==2Cl-+Br2氯气通入碘化钾溶液:Cl2 + 2KI ==2KCl +I2 离子方程式:Cl2 + 2I-==2Cl-+I2溴水和碘化钾溶液:Br2 + 2KI ==2KBr +I2 离子方程式:Br2 + 2I-==2Br-+I211、氯化钠和硝酸银溶液:NaCl +AgNO3 ==AgCl ↓+Na NO3 离子方程式:Cl-+Ag+==AgCl ↓六、硫及其化合物1、硫在空气中燃烧:S + O2 SO2 硫与氢气加热:H2 + S H2S2、二氧化硫与水:SO 2 + H2O H2SO3二氧化硫与氧化钙:SO2 +CaO ==CaSO3少量SO2与NaOH溶液:SO2+2NaOH==Na2SO3 +H2O 离子方程式:SO2+2OH-==SO32-+H2O过量SO2与NaOH溶液:SO2+NaOH==NaHSO3 离子方程式:SO2+OH-==HSO3-3、SO2通入过量的澄清石灰水:SO2+Ca(OH)2 ==CaSO3↓+H2O 离子方程式:SO2+Ca2++2OH-==CaSO3↓+H2O过量的SO2通入澄清石灰水:2SO2+Ca(OH)2 ==Ca(HSO3)2 离子方程式:SO2+OH-==HSO3-4、二氧化硫与硫化氢:SO2 + 2H2S == 3S↓+ 2H2O5、二氧化硫催化氧化:2SO2+O22SO36、亚硫酸钠和硫酸反应:Na2SO3 +H2SO4 == Na2SO4+SO2↑+H2O7、Na2SO3 与氧气反应:2Na2SO3+O2==2Na2SO48、三氧化硫与水反应:SO3 + H2O==H2SO49、三氧化硫与氧化钙:SO3 +CaO ==CaSO410、三氧化硫与氢氧化钙:SO3 +Ca(OH)2==CaSO4↓+H2O11、铜与浓硫酸反应:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O12、碳与浓硫酸反应:C +2H2SO4(浓)CO2↑+2SO2↑+2H2O13、二氧化硫与过氧化氢反应:SO2+H2O2=H2SO4七、氮及其化合物1、氮气和氧气反应:N2+O22NO2、工业合成氨:N2+3H22NH33、一氧化氮与氧气反应:2NO+O2==2NO24、NO2溶于水:3NO2+H2O==2HNO3+NO5、氨气溶于水:NH 3+H2O NH3•H2O 氨水显弱碱性(电离方程式):NH3•H2O NH4++OH-6、浓氨水受热分解:NH3•H2O NH3↑+H2O7、氨气和氯化氢:NH3+HCl==NH4Cl(产生白烟)8、氨的催化氧化:4NH3+5O24NO+6H2O9、氯化铵受热分解:NH4Cl NH3↑+HCl↑10、碳酸氢铵受热分解:NH4HCO3NH3↑+CO2↑+H2O11、硝酸铵和NaOH:NH4NO3+NaOH NaNO3+NH3↑+H2O离子方程式:NH4++OH-NH3↑+H2O12、实验室制氨气:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O13、浓硝酸与铜反应:Cu +4HNO3==Cu(NO3)2+2NO2↑+2H2O 离子方程式:Cu +4H++2NO3-==Cu2++2NO2↑+2H2O14、稀硝酸与铜反应:3Cu +8HNO3==3Cu(NO3)2+2NO↑+4H2O离子方程式:3Cu +8H++2NO3-==3Cu2++2NO↑+4H2O15、硝酸见光分解:4HNO3==4NO2↑+O2↑+2H2O16、NH4+检验的离子方程式:NH4++OH-NH3↑+H2O17、NO2、O2混合气通入水中无剩余气体:4NO2+O2+2H2O==4HNO318、NO、O2混合气通入水中无剩余气体:4NO+3O2+2H2O==4HNO319、少量氨气与氯气2NH3+3Cl2 = N2+6HCl20、过量氨气与氯气8NH3+3Cl2 = N2+6NH4Cl。
必修一重要化学方程式及离子方程式

必修一重要化学方程式及离子方程式一、钠及其化合物1、钠与氧气(燃烧):2Na+O2点燃Na2O22. 钠与水反应:2Na+2H2O=2NaOH+H2↑2Na+2H2O = 2Na+ +2OH- + H2↑3、氧化钠与水反应:Na2O+H2O==2NaOH4. 碳酸氢钠与盐酸:HCl +NaHCO3=NaCl+H2O+CO2↑HCO3- + H+ == CO2↑+ H2O5、碳酸氢钠固体加热:2NaHCO3△2CO3 + CO2↑+ H2O 6、碳酸钠溶液通入二氧化碳:Na2CO3+CO2+H2O==2NaHCO3CO32- + CO2+H2O==2 HCO3-7、大理石与与盐酸反应CaCO3+2HCl=CaCl2+H2O+CO2↑CaCO3 + 2H+ == Ca2+ + CO2↑+ H2O二、铝及其化合物Al2O3是两性氧化物Al(OH)3是两性氢氧化物1、铝与盐酸2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+ == 2Al3+ + 3H2↑2.铝与氢氧化钠溶液2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑3、氧化铝与盐酸:Al2O3+6HCl=2AlCl3+3H2OAl2O3 + 6H+ == 2Al3+ + 3H2O4、氧化铝与氢氧化钠溶液Al2O3+2NaOH=2NaAlO2+H2OAl2O3 + 2OH- == 2AlO2- + H2O5、氢氧化铝与盐酸:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3 + 3H+ == Al3+ + 2H2O6、氢氧化铝与氢氧化钠溶液:Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3 + 2OH- == AlO2- + 2H2O7、加热氢氧化铝:2Al(OH)3△Al2O3+3H2O8、氯化铝与少量氢氧化钠溶液AlCl3+3NaOH=Al(O H)3↓+3NaClAl3+ + 3OH- == Al(OH)3↓9、氯化铝与氨水AlCl3+3NH3·H2O=Al(OH)3↓+3NH4ClAl3+ + 3NH3.H2O == Al(OH)3↓+ 3NH4+10.明矾净水原理Al3++3 H2O Al(OH)3(胶体) + 3H+三、铁及其化合物1、铁在与氯气中燃烧:2Fe + 3Cl2点燃2FeCl32. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铁与盐酸反应Fe+2HCl=FeCl2+H2↑Fe + 2H+ = Fe2+ + H2↑4、铁与氯化铁溶液:2FeCl3+Fe=3FeCl2Fe + 2Fe3+ == 3Fe2+5、铜与氯化铁溶液:2FeCl3+Cu=2FeCl2+CuCl2Cu + 2Fe3+ == 2Fe2+ + Cu2+6. 氯化铁溶液与氢氧化钠溶液FeCl3+3NaOH == Fe(OH)3↓+ 3NaClFe3+ + 3OH- == Fe(OH)3↓7、氯水(或氯气)与氯化亚铁溶液:Cl2 +2FeCl2=2FeCl3Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-8、氢氧化亚铁与氧气反应4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)39、氢氧化铁固体加热2Fe(OH)3△Fe2O3 + 3H2O10.Al、Fe在冷、浓的H2SO4、HNO3中钝化四、硅及其化合物1、二氧化硅与氢氧化钠溶液:SiO2+2NaOH=Na2SiO3+H2OSiO2+2OH -=SiO32-+H2O 2、硅酸的制取Na2SiO3+2HCl== H2SiO3↓+2NaClSiO32-+2H+ = H2SiO3↓五、硫及其化合物1、硫与氧气:S+O2点燃SO22、二氧化硫被氧气氧化2SO2+O2△2SO33、二氧化硫与水:SO2+H2O H2SO34. 稀硫酸与氢氧化钡溶液Ba(OH)2+ H2SO4= BaSO4↓ + 2H2OBa2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O 5、浓硫酸与碳共热:2H2SO4(浓)+C△CO2↑+2SO2↑+2H2O(浓H2SO4只作氧化剂)6、浓硫酸与铜共热Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(既表现氧化性又表现酸性)八、氮气及其化合物1、工业氮气与氢气合成氨气:N2+3H2催化剂高温高压2NH32、氮气与氧气在放电条件下反应:N2+O22NO3、一氧化氮与氧气:2NO+O2=2NO24、二氧化氮与水:3NO2+H2O=2HNO3+NO5、实验室制NH3:2NH4Cl(固)+C a(O H)2(固)△CaCl2+2NH3↑+2H2O 6、氨与氯化氢:NH3+HCl=NH4Cl(白烟)7、稀硝酸与铜:8HNO3+3Cu=3Cu (NO3)2+2NO↑+8H2O2NO3- + 3Cu + 8H+ == 3Cu2++ 2NO↑+ 4H2O8、浓硝酸与铜:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O2NO3- + Cu + 4H+ == Cu2+ + 2NO2↑+ 2H2O9、浓硝酸与碳共热: 4HNO3(浓)+C △CO2↑+4NO2↑+2H2O10、工业氨的催化氧化制硝酸(1).4NH3+5O24NO +6H2O (2)2NO+O2==2NO2(3).3NO2+H2O=2HNO3+NO九、氯、溴、碘及其化合物1、二氧化锰与浓盐酸共热(实验室制取氯气):4HCl(浓)+MnO2△MnCl2+Cl2+2H2O MnO2+ 2Cl-+ 4H+△Mn2++ Cl2↑+ 2H2O2、氯气与铁反应3Cl2 +2Fe2FeCl33、氢气在氯气中燃烧Cl2 +H22HCl (光照或点燃)4、氯气溶于水Cl2+H2O HCl +HClO Cl2+H2O H++Cl +HClO5.氯水与碘化钾溶液反应Cl2 +2KI= 2 KCl+ I2Cl2 + 2I- == 2Cl- + I26、氯气与氢氧化钠溶液反应:Cl2+2NaOH=NaCl+NaClO+H2OCl2 + 2OH- == Cl- + ClO- + H2O7、氯气与石灰乳反应(工业制取漂白粉)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O8、漂白粉的漂白原理Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO。
高中化学必修一全部化学方程式及离子方程式总结

其实你还是自己总结一下比较好,自己总结最后记忆相当深刻的。
全套无机方程式氯气、卤素2Na+Cl22NaCl Cu+Cl2CuCl22Fe+3Cl22FeCl3 H2+Cl22HClCl2+2NaBr=2NaCl+Br2 Cl2+2NaI=2NaCl+I2Cl2+2FeCl2=2FeCl3 Cl2+SO2 +2H2O=H2SO4 +2HClCl2+H2O=HCl+HClO 2HClO2HCl+O2↑2NaOH+Cl2=NaClO+NaCl+H2O2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2OCa(ClO)2+ CO2 +H2O=CaCO3↓+2HClOCa(ClO)2+2HCl=CaCl2+ 2HClOHCl+AgNO3=AgCl↓+HNO3NaCl+AgNO3=AgCl↓+NaNO3硫、氧族S+ O2SO2 S+ H2H2SS+FeFeS 2SO2+ O22SO3SO2+H2O =H2SO3 SO3+H2O =H2SO4SO3+2NaOH=Na2SO4+ H2O SO2+2NaOH=Na2SO3+ H2OSO2+NaOH=NaHSO3SO2+H2O H2SO3H++ HSO3-SO2+ NH3∙H2O=NH4HSO3 SO2+2NH3∙H2O=(NH4)2SO3+ H2O2H2SO4(浓)+CuCuSO4+ SO2↑+ 2H2O2H2SO4(浓)+CCO2↑+2SO2↑+ 2H2ONa2SO3+ H2SO4 =Na2SO4+ SO2↑ +H2OFeS+2HCl=H2S↑+FeCl2氮、氨气、硝酸、氮族N2+3H2 2NH3 N2+O22NO4NH3+5O2 4NO+6H2O NH3+HCl= NH4ClNH3+HNO3 =NH4NO3 NH3+H2ONH3· H2ONH4++OH-2NH4Cl+ Ca(OH)2CaCl2+2NH3↑+2H2O2NO+O2 =2NO2 2NO2 N2O4 3NO2+H2O =2HNO3 +NONH4Cl NH3+HCl NH4HCO3 NH3↑+CO2↑+H2O(NH4)2CO32NH3↑+CO2↑+H2O3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2OCu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2OC+4HNO3(浓) CO2↑+4NO2↑+2H2O碳族C+O2CO2 2C+O22CO2CO+O22CO2 C+CO22COC+H2O(g)CO+H23C+2Fe2O34Fe+3CO2↑ Fe2O3+3CO2Fe+3CO2CO2+H2O H2CO3H++ HCO3-CO2+ Ca(OH)2=CaCO3↓+ H2O CO2 +CaCO3+ H2O=Ca(HCO3)2Ca(HCO3)2CaCO3↓+H2O+CO2↑硅Si+O2SiO2 Si+2NaOH+H2O=Na2SiO3+2H2↑SiO2+2CSi+2CO↑ SiO2+CaOCaSiO3SiO2+2NaOH=Na2SiO3+H2O SiO2 +4HF=SiF4↑+ 2H2OSiO2 +Na2CO3Na2SiO3+CO2↑ SiO2 +CaCO3CaSiO3+CO2↑Na2SiO3+2HCl=H2SiO3↓+2NaCl Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3钠、碱金属4Na+O2 = 2Na2O 2Na+O2Na2O22Na+2H2O=2NaOH+ H2↑ 2Na+2C2H5OH=2C2H5ONa+H2↑Na2O+CO2= Na2CO3 Na2O+H2O=2NaOHNa2O+2HCl=2NaCl+H2O 2Na2O2+2H2O=4NaOH+O2↑2Na2O2 +2CO2=2Na2CO3+O2 2NaCl(熔融)2N a+Cl2↑NaOH+ HCl =NaCl+H2O 2NaOH+CuCl2=2NaCl+Cu(OH)2↓Na2CO3+ Ca(OH)2 =CaCO3↓+2NaOHNa2CO3+CO2+H2O =2NaHCO3Na2CO3+2HCl=2NaCl+ CO2↑+H2O Na2CO3+HCl=NaCl+ NaHCO32NaHCO3Na2CO3+CO2↑+H2O NaHCO3+ NaOH=Na2CO3+H2ONaHCO3+ HCl=NaCl+CO2↑+H2O2NaHCO3 + Ca(OH)2 =2H2O +CaCO3 ↓+Na2CO3NaHCO3 + Ca(OH)2 =H2O +CaCO3 ↓+NaOH2NaOH +Ca(HCO3)2 =2H2O +CaCO3 ↓+Na2CO3NaOH +Ca(HCO3)2 =H2O +CaCO3 ↓+NaHCO3镁2Mg+O22MgO 2Mg+CO2 2MgO+CMg+2H2OMg(OH)2 +H2↑ MgCl2(熔融)Mg+ Cl2↑铝4Al +3O22Al2O3 2Al+Fe2O3Al2O3+2Fe2Al2O3(熔融)4Al+3O2↑ 2Al(OH)3Al2O3+3H2O2Al+6HCl=2AlCl3+3H2↑ 2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+6HCl=2AlCl3+3H2O Al2O3+ 2NaOH=2NaAlO2+H2OAl(OH)3+3HCl=AlCl3+3H2O Al(OH)3 +NaOH=NaAlO2+2H2OAl(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O3NaOH+AlCl3=3NaCl+Al(OH)3↓AlO2-+ H++H2O =Al(OH)3↓ Al3++3OH- =Al(OH)3↓AlO2-+ 4H+ =Al3++2H2O Al3++ 4OH- =AlO2-+2H2OAlO2-+ CO2+2H2O =Al(OH)3↓+HCO3- Al3++3NH3· H2O =Al(OH)3↓+3N H4+ AlO2-+2H2O=Al(OH)3+OH- Al3++3H2O=Al(OH)3(胶体)+3H+Al3++3AlO2-+6H2O=4Al(OH)3↓铁3Fe+2O2Fe3O4 3Fe+4H2O(g)Fe3O4+4H2 Fe+SFeS2Fe+3Cl22FeCl3 Fe+ H2SO4 =FeSO4+ H2↑Fe+ CuSO4 =FeSO4+Cu2Al+Fe2O3Al2O3+2Fe Fe2O3+3CO2Fe+3CO2Fe2O3+6HCl=2FeCl3+3H2O FeCl2+2NaOH =Fe(OH)2↓+2NaCl FeCl3+3NaOH =Fe(OH)3↓+3NaCl4Fe(OH)2+O2+2H2O= 4Fe(OH)3 2Fe(OH)3Fe2O3+3H2OFe(OH)3+3HCl =FeCl3+3H2O2Fe3++Fe=3Fe2+ 2Fe3++Cu =2Fe2++ Cu2+ 2Fe3++ S2- =2Fe2++S↓Fe2++ S2-=FeS↓ 2Fe3++2I-=2Fe2++ I2 Fe3++3SCN- =Fe(SCN)3Fe3++3H2OFe(OH)3(胶体)+ 3H+ 2Fe2+ +Cl2=2Fe3+ +2Cl-其实你还是自己总结一下比较好,自己总结最后记忆相当深刻的。
高一必修一化学方程式及离子方程式

高一化学《化学方程式及离子方程式》化学家眼中的物质世界专题一、铁与稀盐酸的反应: Fe + 2HCl == FeCl+ H↑ ==Fe + H↑2222++ Fe + 2H1-++O+H↑ NHCl+NaOH+OHNHNaCl+HO+NH↑2、NH的检验:NH 2344324-+-↓3、Cl离子的检验:NHCl+AgNO== AgCl↓+NHNO Ag +Cl ==AgCl34432-2+2-+SO==BaSO↓SO+BaCl==BaSO↓+2NHCl Ba)4、SO离子的检验:(NH444244442从海水中获得的化学物质专题二通电通电 -+↑2Na+2H+ClO2OH+H1、工业制氯气:2NaCl+2HO 2NaOH+H↑+Cl↑↑222222O↑MnCl+Cl、实验室制氯气:2MnO+4HCl+2H(浓)2222点燃 3、铁与氯气的反应:2Fe + 3Cl 2FeCl现象:棕黄色烟32点燃现象:棕黄色的烟铜与氯气的反应:Cu + Cl CuCl222Na+ Cl现象:白烟 2NaCl 钠与氯气的反应:点燃2点燃光4、氢气与氯气的反应:H + Cl 2HCl 或 H + Cl 2HCl2222---O + 2OH== Cl+ ClO+H5、氯气与氢氧化钠的反应:Cl+2NaOH==NaCl+NaClO+HO Cl2222O + 2Cl == Ca(ClO) + CaCl + 2H6、漂白粉的生产原理:2Ca(OH)22222+ 2HClO +CO +HO == CaCO7、漂白粉消毒原理:Ca(ClO)3222+- + HClO+ ClCl +HOHCl +HClO Cl + HOH8、氯气溶于水:2222光9、次氯酸见光分解:2HClO 2HCl + O↑2- + 2Cl== Br + 2KCl Cl + 2Br 10、氯、溴、碘之间的置换反应:Cl + 2KBr == Br2222––- + 2Cl + 2KCl Cl + 2I == I Cl + 2KI == I2222–-== I+ 2Br Br + 2KI == I + 2KBr Br + 2I 2 222+-↓ == AgBr淡黄)+NaNO Ag +Br 11、氯、溴、碘离子的检验:NaBr+AgNO==AgBr↓(33-+ == AgI + I )+ NaNO Ag(硝酸银和稀硝酸) NaI + AgNO == AgI↓(黄33↓ O(氧化钠,白色固体)、钠放置在空气中被氧化(常温):4Na + O == 2Na1222点燃(过氧化钠,淡黄色固体)13、钠在空气中燃烧:2Na + O NaO 222↑O == 2NaOH + H↑ 2Na + 2HO == 2Na + 2OH 14、钠与水的反应:2Na + 2H2222℃700~+- +H800+ 4Na Ti + 4NaCl TiCl15、钠与四氯化钛的反应:4通电熔融2NaCl() 2Na+ Cl↑16、钠的工业制法:217、过氧化钠与二氧化碳的反应:2NaO + 2CO == 2NaCO +O 22232218、过氧化钠与水的反应:2NaO + 2HO == 4NaOH + O↑222219、碳酸钠与氢氧化钙的反应:NaCO+Ca(OH)==CaCO↓+2NaOH3223精选资料,欢迎下载。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学《化学方程式及离子方程式》1、铁与稀盐酸的反应: Fe + 2HCl == FeCl 2 + H 2↑ Fe + 2H + ==Fe 2+ + H 2↑2、NH 4+的检验:NH 4Cl+NaOH NaCl+H 2O+NH 3↑ NH 4++OH - NH 3↑+H 2O3、Cl -离子的检验:NH 4Cl+AgNO 3 == AgCl ↓+NH 4NO 3 Ag + +Cl - ==AgCl ↓4、SO 42-离子的检验:(NH 4)2SO 4+BaCl 2==BaSO 4↓+2NH 4Cl Ba 2++SO 42-==BaSO 4↓1、工业制氯气:2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑2Na ++2H 2O 2OH -+H 2↑+Cl 2↑2、实验室制氯气:MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H 2O3、铁与氯气的反应:2Fe + 3Cl 2 2FeCl 3 现象:棕黄色烟铜与氯气的反应:Cu + Cl 2 CuCl 2 现象:棕黄色的烟钠与氯气的反应:2Na + Cl 2 2NaCl 现象:白烟4、氢气与氯气的反应:H 2 + Cl 2 2HCl 或 H 2 + Cl 2 2HCl5、氯气与氢氧化钠的反应:Cl 2+2NaOH==NaCl+NaClO+H 2O Cl 2 + 2OH - == Cl - + ClO - +H 2O6、漂白粉的生产原理:2Ca(OH)2 + 2Cl 2 == Ca(ClO)2 + CaCl 2 + 2H 2O7、漂白粉消毒原理:Ca(ClO)2 +CO 2 +H 2O == CaCO 3 + 2HClO8、氯气溶于水:Cl 2 +H 2O HCl +HClO Cl 2 + H 2O H + + Cl - + HClO9、次氯酸见光分解:2HClO 2HCl + O 2↑10、氯、溴、碘之间的置换反应:Cl 2 + 2KBr == Br 2 + 2KCl Cl 2 + 2Br - == Br 2 + 2Cl – Cl 2 + 2KI == I 2 + 2KCl Cl 2 + 2I - == I 2 + 2Cl – Br 2 + 2KI == I 2 + 2KBr Br 2 + 2I - == I 2 + 2Br –11、氯、溴、碘离子的检验:NaBr+AgNO 3==AgBr ↓(淡黄)+NaNO 3 Ag + +Br - == AgBr ↓(硝酸银和稀硝酸) NaI + AgNO 3 == AgI ↓(黄)+ NaNO 3 Ag + + I - == AgI ↓12、钠放置在空气中被氧化(常温):4Na + O 2 == 2Na 2O (氧化钠,白色固体)13、钠在空气中燃烧:2Na + O 2 Na 2O 2 (过氧化钠,淡黄色固体)14、钠与水的反应:2Na + 2H 2O == 2NaOH + H 2↑ 2Na + 2H 2O == 2Na + + 2OH - +H 2↑15、钠与四氯化钛的反应:TiCl 4 + 4NaTi + 4NaCl 16、钠的工业制法:2NaCl(熔融) 2Na + Cl 2↑17、过氧化钠与二氧化碳的反应:2Na 2O 2 + 2CO 2 == 2Na 2CO 3 +O 218、过氧化钠与水的反应:2Na 2O 2 + 2H 2O == 4NaOH + O 2↑19、碳酸钠与氢氧化钙的反应:Na 2CO 3+Ca(OH)2==CaCO 3↓+2NaOHCa 2++CO 32-==CaCO 3↓20、碳酸钠与氯化钡的反应:Na 2CO 3+BaCl 2==BaCO 3↓+2NaCl Ba 2+ + CO 32- ==BaCO 3↓21、碳酸钠溶液中通入CO 2:Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2 + H 2O==2HCO 3 –22、NaHCO 3与NaOH 溶液反应:NaHCO 3+NaOH==Na 2CO 3+H 2O HCO 3 - +OH -==CO 32- +H 2O23、NaHCO 3与盐酸反应:NaHCO 3+HCl==Na 2CO 3+CO 2↑+H 2O HCO 3 - +H + == CO 2↑+ H 2O24、碳酸钠与不足的盐酸反应:Na 2CO 3+HCl==NaHCO 3+NaCl CO 32- + H + == HCO 3-25、碳酸钠与足量的盐酸反应:Na 2CO 3+2HCl==2NaCl+CO 2↑+H 2O CO 32-+2H +==CO 2↑+H 2O通电 通电 点燃 点燃 光 点燃 点燃 光 点燃 700~800℃ 通电26、碳酸氢钠固体受热分解:2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O27、侯氏制碱法:NaCl + NH 3 + CO 2 + H 2O == NaHCO 3 + NH 4Cl28、醋酸的电离方程式:CH 3COOHCH 3COO - + H + 29、一水合氨的电离方程式:NH 3·H 2O NH 4+ + OH -30、从海水中提取镁:CaCO 3 CaO + CO 2↑(煅烧贝壳制得生石灰) CaO + H 2O == Ca(OH)2 (生石灰溶于水制成石灰乳) Ca(OH)2 + MgCl 2 == Mg(OH)2↓+ CaCl 2 (得到氢氧化镁沉淀) Mg(OH)2 + 2HCl == MgCl 2 + 2H 2O (得到无水氯化镁) MgCl 2(熔融) Mg + Cl 2↑ (电解熔融的氯化镁)31、镁与水的反应:Mg + 2H 2O Mg(OH)2 + H 2↑32、镁与氮气的反应:3Mg + N 2 Mg 3N 233、镁与二氧化碳的反应:2Mg + CO 2 2MgO + C1、氧化铝与氢氧化钠反应:Al 2O 3 + 2NaOH == 2NaAlO 2 + H 2O Al 2O 3+2OH - ==2AlO 2-+H 2O2、氧化铝与硫酸反应:Al 2O 3 + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2O Al 2O 3 + 6H + == 2Al 3+ + 3H 2O3、偏铝酸钠溶液中通入过量CO 2:NaAlO 2 + CO 2 + 2H 2O == Al(OH)3↓+ NaHCO 3 AlO 2 - + CO 2 + 2H 2O == Al(OH)3↓+ HCO 3 –4、三氯化铝溶液中加入氨水:AlCl 3 + 3NH 3·H 2O == Al(OH)3↓+ 3NH 4Cl Al 3+ + 3NH 3·H 2O == Al(OH)3↓+ 3NH 4+5、可溶性偏铝酸盐中加入过量的盐酸: AlO 2 - + 4H + == Al 3+ + 2H 2O6、可溶性铝盐中加入过量的氢氧化钠: Al 3+ + 4OH - ==AlO 2 - + 2H 2O-7、氢氧化铝受热分解:2Al(OH)3 Al 2O 3 +3 H 2O8、电解熔融的氧化铝:2Al 2O 3(熔融) 4Al + 3O 2↑ 9、氢氧化铝与盐酸的反应:Al(OH)3+3HCl==AlCl 3+3H 2O Al(OH)3 + 3H + == Al 3++ 3H 2O10、氢氧化铝与NaOH 的反应:Al(OH)3+NaOH==NaAlO 2+2H 2OAl(OH)3+OH -==AlO 2-+2H 2O11、明矾溶于水的电离方程式::KAl(SO 4)2 == K + + Al 3+ + 2SO 42-12、铝离子与水反应生成Al(OH)3胶体的离子方程式:Al 3+ + H 2OAl(OH)3(胶体) + 3H + 13、铝与盐酸的反应:2Al + 6HCl == 2AlCl 3 + 3H 2↑2Al + 6H + == 2Al 3+ + 3H 2↑14、铝与NaOH 反应:2Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑2Al+2OH -+2H 2O==2AlO 2-+3H 2↑15、铝与氧化铁发生铝热反应:2Al + Fe 2O 3 Al 2O 3 +2Fe 16、工业炼铁:CO 还原铁矿石:Fe 2O 3 + 3CO 2Fe+3CO 2还原剂的生成:C + O 2 CO 2 CO 2 + C2CO 除脉石的反应:CaCO 3 + SiO 2 CaSiO 3 + CO 2↑17、铜与硝酸银溶液的反应:Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2 Cu + 2Ag + == Cu 2+ + 2Ag高温 通电 点燃 点燃 通电 高温 高温 高温 点燃 高温18、Fe 3+离子的检验:Fe 3+ + 3SCN - == Fe(SCN)3 (血红色)19、氯化亚铁与氯水的反应:2FeCl 2 +Cl 2 == 2FeCl 3 2Fe 2+ + Cl 2 == 2Fe 3+ + 2Cl –20、铁粉投入三氯化铁溶液中:Fe + 2FeCl 3 == 3FeCl 2 Fe + 2Fe 3+ ==3Fe 2+21、铜与三氯化铁溶液反应:Cu + 2FeCl 3 == CuCl 2 + 2FeCl 2 Cu + 2Fe 3+ == Cu 2+ + 2Fe 2+22、Fe 2+与碱反应的离子方程式:Fe 2+ + 2OH - == Fe(OH)2↓(白色絮状沉淀)23、Fe 3+与碱反应的离子方程式:Fe 3+ + 3OH - == Fe(OH)3↓(红褐色沉淀)24、氢氧化亚铁在空气中的氧化:4Fe(OH)2 + O 2 + 2H 2O == 4Fe(OH)325、碱式碳酸铜受热分解:Cu 2(OH)2CO 3 2CuO +CO 2↑+ H 2O26、二氧化硅与氧化钙的反应:SiO 2 + CaO CaSiO 327、二氧化硅溶与强碱:SiO 2 + 2NaOH == Na 2SiO 3 + H 2O28、硅的提纯:碳还原二氧化硅制取粗硅:SiO 2 + 2C Si + 2CO ↑ 粗硅的提纯:Si + 2Cl 2 SiCl 4SiCl 4 + 2H 2 Si +4HCl29、硅酸钠与盐酸的反应:Na 2SiO 3 + 2HCl == H 2SiO 3↓+ 2NaCl30、二氧化碳通入硅酸钠溶液中:Na 2SiO 3 + 2CO 2 + 2H 2O == H 2SiO 3↓+ 2NaHCO 31、二氧化硫溶于水:SO 2 +H 2O H 2SO 32、亚硫酸在空气中被氧化:2H 2SO 3 + O 2 == 2H 2SO 43、二氧化硫通入澄清石灰石:SO 2 + Ca(OH)2 == CaSO 3↓+ H 2O4、CaSO 3在空气中氧化:2CaSO 3 + O 2 == 2CaSO 45、氨水法脱硫的原理:SO 2 + 2NH 3 + H 2O == (NH 4) 2SO 3SO 2 + NH 3 + H 2O == NH 4HSO 32(NH 4) 2SO 3 + O 2 == 2(NH 4) 2SO 46、接触法制硫酸:4FeS 2 + 11O 2 2Fe 2O 3 + 8SO 2 或 S + O 2 SO 2 2SO 2 + O 2 2SO 3SO 3 + H 2O == H 2SO 47、铜与浓硫酸在加热的条件下的反应:Cu + 2H 2SO 4(浓)CuSO 4 + SO 2↑+ 2H 2O 8、浓硫酸与碳的反应:C + 2H 2SO 4(浓)CO 2↑+ 2SO 2↑+ 2H 2O9、汞与硫磺的反应:Hg + S == HgS10、实验室制备少量SO 2:Na 2SO 3+H 2SO 4(浓)==Na 2SO 4+SO 2↑+H 2OSO 32-+2H +==SO 2↑+H 2O11、亚硫酸钠暴露在空气中的反应:2Na 2SO 3 + O 2 == 2Na 2SO 412、实验室制备少量的H 2S :FeS + H 2SO 4 == FeSO 4 + H 2S ↑ FeS + 2H + == Fe 2+ + H 2S ↑13、硫化氢气体通入氯水中:H 2S + Cl 2 == S ↓+ 2HCl14、氢气与硫单质的反应:H 2 + S H 2S 高温 高温 高温 高温 高温 点燃催化剂 △15、SO 2与氢氧化钠溶液的反应:SO 2 + 2NaOH == Na 2SO 3 + H 2O SO 2 + 2OH - == SO 32- + H 2O16、 硫化氢在足量的氧气中燃烧:2H 2S + 3O 2 (足量) 2SO 2 + 2H 2O 硫化氢与不足的氧气反应:2H 2S + O 2(不足) 2S + 2H 2O17、硫化氢与二氧化硫的反应:2H 2S + SO 2 == 3S ↓+ 2H 2O18、二氧化硫与氯水的反应:SO 2+Cl 2+2H 2O==2HCl+H 2SO 4SO 2+Cl 2+2H 2O==4H ++2Cl -+SO 42-19、氮气与氧气在放电条件下的反应:N 2 +O 2 2NO 20、NO 与氧气的反应:2NO + O 2 == 2NO 221、NO 2溶于水:3NO 2 + H 2O == 2HNO 3 + NO22、工业上合成氨:N 2 + 3H 2 2NH 323、氨气与水的反应同时一水合氨发生电离:NH 3 + H 2ONH 3·H 2O NH 4+ + OH – 24、氨气与盐酸的反应:NH 3 + HCl == NH 4Cl25、氨气与硫酸的反应:2NH 3 + H 2SO 4 == (NH 4)2SO 426、氨水与盐酸的反应:NH 3·H 2O + HCl == NH 4Cl + H 2O27、氯化铵受热分解:NH 4Cl NH 3 + HCl28、碳酸氢氨受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O29、实验室制取氨气:Ca(OH)2 + 2NH 4ClCaCl 2 + 2NH 3↑+ 2H 2O 30、硝酸见光分解:4HNO 3 2H 2O + 4NO 2↑+ O 2↑31、铜与浓硝酸的反应:Cu + 4HNO 3(浓) == Cu(NO 3)2 + 2NO 2↑+ 2H 2O32、铜与稀硝酸的反应:3Cu + 8HNO 3(稀) == 3Cu(NO 3)2 + 2NO ↑+ 4H 2O33、碳与浓硝酸的反应:C + 4HNO 3(浓)CO 2↑+ 4NO 2↑+ 2H 2O 34、氨氧法制硝酸:4NH 3 + 5O 2 4NO + 6H 2O 2NO+O 2=2NO 2 3NO 2+H 2O=2HNO 3+NO 点燃点燃 放电 光。
