探索酸的性质之酸的个性-课件
华师大版科学九上.2重要的酸课件(20页)

(3)酸可以与金属氧化物反应
当铁器使用久了会生锈,你有什么好办法可以除去铁 锈呢? 实验三:向生锈的铁钉中加入稀硫酸,视察现象 (a)方程式: Fe2O3+3H2SO4=Fe2(SO4)3+3H2O (b)现象: 红棕色固体逐渐溶解,溶液变成黄色
置换反应的其他例子: 氢气还原氧化铜:H2+CuO=△=H2O+Cu 碳还原氧化铜: C+2CuO=△=CO2+2Cu
牛刀小试
如何用化学方法除去混在铜粉中的少量铁粉?简述过程。 (温馨提示:金属活动性顺序 Fe>(H)>Cu)
答:加入足量的盐酸,使铁粉充分反应: Fe+2HCl=FeCl₂ +H₂ ↑
知识结构的完善
正确的化学方程式:
• 化学式正确、配平正确、条件、状态标注正确、 如果是复分解反应还要满足复分解反应条件 (有气体、沉淀或水生成)
判断下列反应能否产生
1 氯化铜和硝酸钠 2 氯化钙与碳酸钠 3 氯化钾和氢氧化钠 4 氢氧化铁和稀盐酸
小结: 在判断复分解反应是否产生时,我们可以先假设 反应产生,然后判断产物是否符合复分解反应的 条件
中和反应:酸和碱作用生成盐和水的反应。
视察与辨析
下列反应是中和反应吗 1 氢氧化钾和硫酸反应 2 氯化钙和碳酸钠反应 3 稀盐酸与碳酸钠反应
思考: 生成盐和水的反应就是中和反应吗?
复分解反应:两种化合物相互交换成分生成 另两种化合物的反应。
概念辨析
复分解反应:两种化 合物相互交换成分生成另 两种化合物的反应。
脑力大作战
在天平的两端放有等质量等质量分数的足量盐酸溶液, 且天平处于平衡状态。若同时向两端放入等质量的铁和 锌。那么刚开始时,天平下沉的是那一端呢?_____(铁 或者锌)(温馨提示:金属活动性:Zn>Fe)
九年级上科学《常见的酸》演示课件浙教版

例:BaCl2 + H2SO4 = BaSO4↓ + 2HCl CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O
例:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3+ 3H2O
26
三、酸的通性
4、酸 + 碱 = 盐 + 水。
例:NaOH + HCl= NaCl + H2O 5、酸 + 盐 = 新盐 + 新酸。
2NaOH + H2SO4 = Na2SO4 + 2H2O
2
一、盐酸(HCl)——氯化氢气体的水溶液
(2)与活泼金属反应 ①与盐酸反应的物质:铁、镁、锌、铝等活泼金属 ②反应现象(铁):有气泡产生,溶液由无色变为浅绿色 ③化学方程式:Fe + 2HCl = FeCl2 + H2↑
3
一、盐酸(HCl)——氯化氢气体的水溶液
(3)与金属氧化物反应 ①与盐酸反应的物质:生锈的铁钉(铁锈的主要成分是Fe2O3)、氧化铜 ②反应现象:铁锈:红褐色的铁锈逐渐溶解,溶液由无色变成黄色;氧化铜:黑色的氧化铜粉末逐渐溶 解,溶液由无色变为蓝色 ③化学方程式:Fe2O3 + 6HCl = 2FeCl3 + 3H2O CuO + 2HCl = CuCl2 + H2O
1、稀硫酸的化学性质 (1)与指示剂作用 ①与硫酸反应的物质:石蕊试液、酚酞试液 ②反应现象:能使紫色石蕊试液变红,不能使无色酚酞试液变色
13
二、硫酸(H2SO4)
(2)与活泼金属反应 ①与硫酸反应的物质:铁、镁、锌、铝等活泼金属 ②反应现象(锌粒):有气泡产生 ③化学方程式:Zn + H2SO4 = ZnSO4 + H2↑
酸的种类与性质

酸的种类与性质酸是我们日常生活中常见的物质之一。
它们具有特殊的性质,可以对其他物质产生影响。
酸的种类和性质是多样的,我们在学习化学的过程中会常常接触到这些知识。
本文将介绍一些常见的酸的种类与性质,以及它们在生活中的应用。
首先,让我们来谈谈酸的定义。
在化学中,酸是指一类具有特定性质的物质,能够产生氢离子(H+)。
根据酸性的程度,酸可以分为强酸和弱酸。
强酸是指能够完全电离生成H+的酸,如盐酸(HCl)和硫酸(H2SO4);而弱酸只能电离一部分生成H+,如醋酸(CH3COOH)和碳酸(H2CO3)。
常见的酸种类非常多,我们来逐个了解一下。
第一个就是硫酸,它是一种强酸,具有强烈的腐蚀性。
它被广泛应用于工业生产中,例如制造肥料、合成化学品和清洁剂等。
其次是盐酸,也是一种强酸,常用于清洁金属表面和调节PH值。
磷酸也是一种常见的酸,常用于制造肥料和食品添加剂。
此外,还有氢氟酸和氢氯酸,它们具有强烈的腐蚀性,用途广泛,如制造玻璃和金属加工等。
除了无机酸,有机酸也是一类重要的酸。
有机酸来源于生物体,包括水果、蔬菜和动物体内的代谢产物等。
例如柠檬酸是一种常见的有机酸,存在于柠檬和其他柑橘类水果中。
它被广泛用于食品和饮料工业,具有酸味增强和防腐的作用。
苹果酸是另一种常见的有机酸,存在于苹果中,可用于食品和药物工业。
除了酸的种类,酸的性质也是我们需要了解的。
首先是酸的酸度。
酸度表示酸的浓度和反应性的强弱程度。
一般来说,酸度高的酸具有较强的腐蚀性和反应性。
此外,酸还具有与金属反应产生氢气的性质。
当酸与金属反应时,会产生相应的金属盐和氢气。
酸还可以与碱进行中和反应,生成盐和水。
这是因为酸和碱具有互补的性质。
酸呈酸性,而碱呈碱性,它们的中和反应会产生中性的盐和水。
这是我们在日常生活中使用盐和水的原理。
酸在生活中的应用非常广泛。
首先是食品和饮料工业。
酸作为食品中的调味剂和防腐剂,能够增加食品的口感和延长食品的保质期。
其次是医药工业。
5.1.2探索酸的性质(第2课时)

3 HCl + Al(OH)3 = AlCl3 + 3H2O
第2节 探索酸的性质
二、酸有哪些性质
1. 酸能使指示剂变色。 2. 酸能与碱反应生成盐和水。
酸 + 碱 → 盐 + 水
HCl + NaOH = NaCl + H2O 3 HCl + Al(OH)3 = AlCl3 + 3H2O
第2节 探索酸的性质
第2节 探索酸的性质
证据
性质
利用酸的性质做些什么
用途
1、除锈:在用稀盐酸除铁锈时,酸不能太多,且放置 时间也不能太长,不然稀盐酸会继续跟铁反应。 2、制取氢气:实验室中可用稀盐酸或稀硫酸 来制 取氢气。
练习: 1、检验某溶液是否显酸性,取少量该溶液进行 实验,其中错误的做法是 ( A ) A 滴加酚酞试液 B 滴加石蕊试液 C 滴加碳酸钠溶液 D加入石灰石
2HCl + CuO = CuCl2 + H2O
黑色 蓝色
第2节 探索酸的性质
二、酸有哪些性质
1. 酸能使指示剂变色。 2. 酸能与碱反应生成盐和水。
酸 + 碱 → 盐 + 水
3. 酸能与盐反应生成新盐和新酸。
酸 + 盐 → 新盐 + 新酸
4.酸能与金属氧化物反应生成盐和水。
酸 +金属氧化物→ 盐 + 水
5、下列物质中属于碱的是( A ) A、 Ca(OH)2 B、 Cu(OH)2CO3 C、 C2H5OH D、 Na2CO3 6、人的胃液里含有少量的盐酸,可帮助消化.若 胃酸过多,则需要服用胃舒平[ Al(OH)3 )] 或墨鱼骨粉[CaCO3]等药物来治疗,写出有 关反应的化学方程式 。 7、硫酸具有酸的性质,是因为硫酸溶液中含有 A SO42- B H+ C H2SO4 D H2O B
九年级科学探索酸的性质17(2019年10月)

它们具有一些相同的化学性质,为什么?
盐酸: HCl = H+ + Cl-
硝酸: HNO3 = H+ + NO3- 硫酸: H2SO4 = 2H+ + SO42-
因为所有酸电离时生成的阳离子全部 是氢离子,所以酸有一些相同的性质。
一、盐酸(HCl)的个性
阅读课文并观察:
1、能说出酸具有一些相同的性质的原因 2、学习观察物质的物理性质的方法。知 道盐酸、硫酸的一些物理性质,并能解释 一些物理现象。 3、掌握浓硫酸的三大特性。学会稀释浓硫 酸的方法。 4、学会利用物质的性质检验物质的方法。
1、盐酸、稀硫酸具有哪些相同的化学性质?
2、阅读课文并思考: (1)为什么酸具有一些相同的化学性质? (2)盐酸有哪些个性?浓硫酸有哪些特性? (3)如何稀释浓硫酸? (4)失掉标签的稀盐酸和稀硫酸,你能区 别开吗? (5)你还知道哪些酸,它们有哪些特性?
3、在盛有少量稀盐酸的试管里滴入几滴 硝酸银溶液,有什么现象发生?再滴入几 滴稀硝酸,有什么现象?
现象: 有不溶于稀硝酸的白色沉淀产生
化学方程式:
;空包网 空包网
;
天下响应 导从 曰 俸禄如旧 伍伯嫉其诡 其后苻坚 遣户奴夜以马挝击之 若无故忽略 言之出口 以副众望 景龙元年 安得非时妄动?皆由朝臣不敢告之也 主则骄矜 假言以光被 武德元年 匪躬之故 顾谓朝臣曰 则天下幸甚 寄切宗祧 "世长对曰 以备巡幸 寻加太子宾客 ’然则弘道在于学古 又上疏奏曰 孙伏伽可谓诚直 又上表请置谏官 讵知邪臣敢进其说?既有好畋之淫 遂致于乱 承嗣等诣宅问疾 汉将骁健者 不为奏闻 铁毂既生 颇历岁时 不异闤阓 泄禁中之语 苟违天道 当此之时 乌九轨知其不可 武帝以其年小 云起上表谏曰 殊不引咎 臣仆谄
九年级科学上册 第1章 探索物质的变化 第2节 探索酸的性质教案 浙教版

§1.2探索酸的性质(3-4课时)【教学目的】【知识重点和难点】重点:酸的共性和三种常见酸的个性,会测定溶液的酸碱性和酸碱度难点:酸的共性和个性的生活应用【教学准备】实验仪器:第一课时:盐酸、硫酸(浓,稀)、硝酸、,酚酞、石蕊试剂,蓝色红色石蕊试纸,白醋、水、酸果汁、盐酸,玻璃棒、点滴板第二课时:试管多支,盐酸、石蕊、氢氧化钠、氢氧化铝、鸡蛋壳、铁钉(生锈的和不生锈的)、氧化铜,氧化铁粉末第三课时:试管、锌、氧化铁粉末、氧化铜、硫酸铜和氢氧化钠(制氢氧化铜)氯化钡溶液第四课时:浓盐酸、浓硫酸、稀盐酸、稀硫酸,硝酸银、试管、玻璃棒、烧杯,纸,硝酸学生课前准备:第一课时:学生自制酸碱指示剂,第四课时:查阅酸的用途,调查酸(雨)的污染【课时安排】共4课时,第1、2知识块1课时,第3知识块2课时(包括探究活动),第4知识块1课时。
【教学过程】验,课后继续课外探究:花的颜色除了和色素有关以外,和土壤的酸碱性是否有一定的关系习题:1、下列物质不属于酸的是()A、HNO3B、NaHCO3C、H3PO4D、HI2、用简单的方法区别水和硫酸,并写出实验步骤3、思考:一位科学家在做研究时不小心将盐酸滴到了紫花上,紫花逐渐变红色。
看到这么个现象,许多问题在他的脑子里涌现出来,如果你是那个科学家,你会有什么问题,你会有什么想法?培养应用提高学生从现象和材料中提出问题的能力知识的能力作业:预习酸有那些性质,找出更多的区别水和盐酸的方法为下节课做准备●板书一、酸:酸是在水中电离时,生成的阳离子都是(H+)这一种粒子的一类物质(三种强酸和醋酸的电离方程式)二、酸碱指示剂第2课时●教学过程设计教师活动学生活动设计意图问题:上节课的作业题:除了用酸碱指示剂和PH试纸外,还可以用什么方法区分水和盐酸溶液?回答检查学生的预习情况,培养自学能力,自主解决问题的能力板书酸的共性1、铁和稀盐酸反应:Fe + 2HCl=== FeCl2 + H22、(1)氧化铁和稀盐酸反应:Fe2O3 + 6HCl=== 2FeCl3 + 3H2O (2)氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O3、(1)盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O (2)氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O 4、某某石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑第三课时。
探索酸的性质第五课时--浙教版

探索酸的性质第二课时

思考:
药物“胃舒平”的主要成分是 氢氧化铝(碱性物质),它可以 治疗病人胃酸过多,为什么?
在氢氧化钠溶液中滴入2滴紫色石蕊 蓝色 色;再逐滴滴入 试液,溶液呈________ 盐酸,溶液颜色有什么变化? ______________________ 。 蓝色逐渐变成红色
该实验告诉我们什么? 盐 化学方程式: HCl + NaOH = NaCl + H2O 碱
再向溶液里加入水,你看到什么现象?
注:浓氯化铜溶液绿色 稀氯化铜溶液蓝色
性质4、盐酸能与金属氧化物反应生成盐和水
盐酸+金属氧化物=盐+水
练习:书写化学方程式 MgCl2 + H2O MgO + 2 HCl = ______________ 2 AlCl3 + 3 H2O Al2O3 + 6 HCl = ______________ CaCl2 + H2O CaO + 2 HCl= ________________ 2 NaCl + H2O Na2O + 2 HCl = ______________ 【结论】
“胃舒平”中的Al(OH)3能像NaOH一样 与胃液中的盐酸反应: 3HCI + Al(OH)3 = AlCI3 + 3H2O
酸+ 碱 = 盐 + 水
性质2:盐酸能与碱反应生成盐和水
想一想: 盐酸和氢氧化铜能不能反应?
把鸡蛋壳(主要成分是碳酸钙)放 入盛有盐酸的试管中,将燃着的火柴伸 入试管口,你看到什么现象? ______________________________. 蛋壳表面有气泡,燃着的木条伸入后会熄灭
本节课你学到了什么?
使石蕊 试液变红
6HCl + Fe2O3 = 2FeCl3+3H2O
化学酸及其性质课件ppt

非水溶液酸碱滴定法
非水溶液酸碱滴定法是在非水溶剂中进行酸碱反应 的滴定分析方法。
非水溶液酸碱滴定法可以用于测定有机化合物和金 属有机化合物的含量,以及研究有机化合物的结构
和性质。
非水溶液酸碱滴定法中使用的溶剂包括醇、酮、 酯、氯仿等,常用的指示剂包括酚酞、甲基橙、
08
结论与展望
本课程主要内容总结
介绍了化学酸的基本概念、分类、性质及实际应 用。
通过实验演示了化学酸的性质,包括与指示剂作 用、与碱反应、与金属氧化物反应等。
深入探讨了酸碱质子理论、酸碱电子理论、路易 斯酸碱理论等基本理论,并解释了其在化学反应 中的作用。
总结了常见酸的用途和实际应用,如实验室和工 业上的应用。
百里酚酞等。
06
酸及其性质的应用
酸的氧化还原反应
氧化反应
酸作为氧化剂,将金属氧化为金属离子,自身被还原为氢离子
还原反应
酸作为还原剂,将氧化物或含氧酸还原为更低价态或单质,自身被氧化为含 氧酸
酸在氧化还原反应中的作用
酸可以作为反应物或催化剂参与氧化还原反应
酸在氧化还原反应中可以提供质子,促进电子转移
多元弱酸电离的特点
每一步电离都受到上一步电离产生的氢离子或 酸根离子的抑制,因此多元弱酸的酸性比一元 弱酸要弱。
多元弱酸的应用
多元弱酸在药物、环保等领域有广泛的应用。
05
酸碱滴定法
酸碱滴定原理
01
酸碱滴定法的基本原理是溶液中酸碱反应的定量关系,通过已知浓度的酸或碱 溶液滴定未知浓度的碱或酸溶液,以测定未知浓度的碱或酸溶液的浓度。
THANK YOU.
第3讲、酸及酸的性质

第二节探索酸的性质(一)姓名----- 学校-----知识提要1.pH与酸碱指示剂2.盐酸和硫酸的性质:经典例题一、选择题1.测定溶液的酸碱度应当选用()A.紫色石蕊试液B.pH试纸C.无色酚酞试液D.以上都可以2.能把稀盐酸、水和氢氧化钠三种无色溶液鉴别出来,应选择()A.石蕊试液B.无色酚酞C.紫色石蕊试液和氯化钡溶液D.硝酸银溶液3.土壤的酸碱度直接影响农作物的生长,已知某地土壤显微酸性,从土壤的酸碱性考虑在该地区不适宜种植的作物是()A.西瓜B.甘草C.小麦D.油菜4.区别稀盐酸和稀硝酸,选用的试剂是()A.AgNO3B.Na2CO3 C.BaCl2 D.石蕊试剂5.能跟盐酸反应放出可燃性气体的是()A.Na2CO3B.NaHCO3C.Zn D.AgNO36.要除去硝酸中溶有的少量盐酸选用()A.硝酸银B.氢氧化钠C.金属铜D.金属锌7.根据果汁瓶标签上标出的化学物质,请你运用学过的有关知识解答下列各题。
(1)这种果汁喝起来有酸味,则对果汁pH的判断,正确的是()A.pH>7 B.pH=7 C.pH<7 D.pH=14(2)已知苯甲酸钠是一种防腐剂,化学方程式是C6H5COONa。
下列各组中,前面一个数表示苯甲酸钠中元素的种类,后面一个数表示1个苯甲酸钠分子中原子的个数,正确的一组是()A.4 15 B.5 16 C.6 15 D.4 68.如图,往稀盐酸中滴加氢氧化钠溶液至完全中和时,溶液的pH变化的图象正确的是()二、填空题 9.认识酸(1)写出下列物质的化学式:盐酸 硫酸 硝酸 (2)盐酸、硫酸、硝酸电离时生成的 全部是 ,所以它们都是 。
(3)根据酸的分子里是否含有氧原子,可以把酸分为含氧酸和无氧酸,上述三种酸中,属于含氧酸的是 。
(4)酸溶液的pH 值 7(<、>、=),酸溶液中加入石蕊溶液,变 色。
10.指出下列物质中加入石蕊试液或酚酞试液后的颜色变化:11.盐酸的主要化学性质:12.将一枚生锈的铁钉放入足量的盐酸中,先观察到的现象是 ,化学方程式为 ;过一会又观察到的现象 是 ,化学方程式是。
《酸的化学性质》课件

《酸的化学性质》课件课件内容:酸的化学性质一、引言酸是一种重要的化学物质,它在化学反应中表现出多种性质。
了解酸的化学性质对于理解化学反应和解决化学问题至关重要。
本课件将详细介绍酸的化学性质,并通过实例解释其应用。
二、定义酸是一种能够解离出氢离子(H+)的化合物。
这种解离过程使得酸溶液具有独特的酸性性质。
酸的通式为HA,其中A代表酸根。
常见的酸包括盐酸(HCl)、硫酸(H2SO4)和硝酸(HNO3)。
三、酸性表述1、酸性强度酸的强度指其解离出氢离子的能力。
在水中,酸的解离程度取决于其酸性强度。
强酸如盐酸和硝酸能够完全解离成氢离子和酸根,而弱酸如乙酸只能部分解离。
酸性强度通常用pH值表示,pH值越小,酸性越强。
2、酸碱反应酸与其他化合物之间的反应称为酸碱反应。
在这种反应中,酸提供氢离子与碱的碱性部分结合,形成水和盐。
例如,盐酸与氢氧化钠反应生成氯化钠和水:HCl + NaOH → NaCl + H2O。
酸碱反应在化学工业中有广泛应用,如制造纤维素、染料和药物等。
3、氧化还原反应酸在氧化还原反应中扮演重要角色。
例如,在电池中,酸提供了氢离子作为反应的媒介。
在酸的存在下,金属如铁和铜能够进行氧化还原反应,生成相应的金属离子和氢气。
这些反应对于工业生产和生活应用具有重要意义。
四、盐类化合物酸与碱反应生成的盐类化合物在化学反应中具有重要作用。
盐可以电离出金属离子和酸根,这些离子在许多化学反应中起着关键作用。
例如,氯化钠(NaCl)是一种重要的盐,它广泛用于食品加工和医疗行业。
在酸性环境中,盐类化合物可能发生化学反应,如沉淀反应或气体生成反应,这使得酸碱反应更加复杂和丰富。
五、总结酸的化学性质主要包括酸性强度、酸碱反应和氧化还原反应等方面。
这些性质在化学工业、生活应用和科学研究等领域具有广泛的应用价值。
了解酸的化学性质有助于我们更好地理解化学反应的机制,解决化学问题,并探索新的化学反应和合成方法。
通过本课件的学习,我们深入了解了酸的化学性质及其应用。
第2节探索酸的性质
排在金属活动顺 序表中H前面的
3、酸 + 金属氧化物 = 盐 + 水 4、酸 + 碱 = 盐 + 水 5、酸 + 盐 = 新酸 + 新盐 (生成物中必须要有:沉淀或气体或水)
二、硫酸和盐酸的用途(P11页) 三、酸的个性
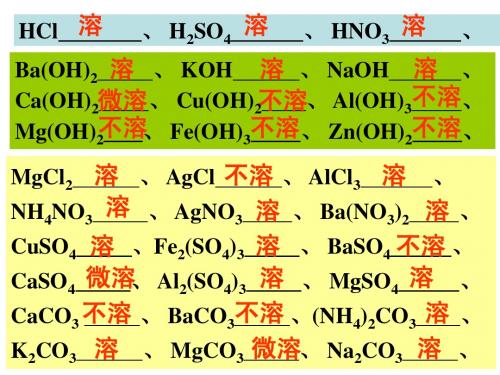
名称 溶质的化学式 颜色 状态 挥发性 浓盐酸 浓硫酸 浓硝酸
HCl 溶
、 H2SO4 溶
、 HNO3 溶
、
Ba(OH)2 溶 、 KOH 溶 、 NaOH 溶 、 Ca(OH)2微溶 、 Cu(OH)2不溶、 Al(OH)3不溶、 不溶 Fe(OH)3不溶、 Zn(OH)2不溶、 Mg(OH)2 、 MgCl2 溶 、 AgCl 不溶 、 AlCl3 溶 、 NH4NO3 溶 、 AgNO3 溶 、 Ba(NO3)2 溶 、 CuSO4 溶 、Fe2(SO4)3 溶 、 BaSO4 不溶 、 CaSO4 微溶 Al2(SO4)3 溶 、 MgSO4 溶 、 K2CO3 溶 、
HCl 无色 液态 易挥发
H2SO4 无色
粘稠、油状、 液态
HNO3 无色 液态 易挥发
难挥发
1、盐酸的特性
工业浓盐酸因含有 Fe3+ 而带黄色。 浓盐酸的特性——挥发性
打开盛有浓盐酸的试剂瓶盖,瓶口会出现白雾 , 这是因为从浓盐酸中挥发出来的 氯化氢气体 跟空 气里的 水蒸气 接触,形成盐酸的 小液滴 的缘故。
除去下列混合物中的少量杂质(括号内的物质为杂质) 混合物 HCl (H2SO4) HNO3 (HCl) NaCl (Na2CO3) 除杂试剂 化学方程式
H2SO4+BaCl2=BaSO4↓+2HCl HCl+AgNO3=AgCl↓+HNO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑
探索酸的性质--盐酸

第一章探索物质的变化第二节探索酸的性质—盐酸一、学习目标:1、认知目标:通过实验的观察与分析,了解盐酸的物理性质和用途,初步掌握盐酸的化学性质,理解复分解反应,了解石蕊试液,酚酞试液等酸碱指示剂在酸、碱溶液里的颜色。
2、技能目标:培养学生观察能力、分析归纳能力和实验基本操作能力。
3、情感目标:对学生进行科学态度、科学的学习方法的教育。
二、重点难点:盐酸的化学性质,指示剂在酸碱溶液里的颜色变化。
有关盐酸化学性质的化学方程式。
三、教学方法:实验探讨法。
四、教学用具:1、仪器:试管、滴管、镊子、试管夹、酒精灯(附火柴)等。
2、药品:锌粒、镁条、新制氢氧化铜、碳酸钙粉末、氧化铜、酚酞试液、石蕊试液、浓盐酸、工业盐酸、稀盐酸、氢氧化钠溶液、硝酸银溶液、稀硝酸。
3、其它:铁钉、锈铁钉。
学习盐酸和写出剂:附1:课堂练习一1、盐酸是()的水溶液,纯净的盐酸是()色()气味的()体,浓盐酸()腐蚀性,有()性,挥发出来的氯化氢遇水蒸气形成()。
附2:课堂练习二1、如何鉴别失去标签的氢氧化钠溶液和盐酸这两瓶溶液?2、有一根生锈的铁钉放入试管中,然后滴加适量的稀盐酸,观察现象。
先_____________后__________________,写出有关反应的化学方程式__________;________________。
附3:课堂练习三1、下列物质和盐酸反应生成白色沉淀的是()(A)Fe (B)CuO (C)NaOH溶液(D)AgNO3溶液2、在人的胃液中含有少量盐酸有助消化,若胃酸过多会吐酸水,可用来治胃酸过多的药物中主要含有(A)ZnSO4(B)NaCl(C)Al(OH)3(D)AgNO33、下列物质中和盐酸反应生成黄色溶液的是()(A)Fe (B)Zn(C)Cu(OH)2(D)Fe(OH)34、下列物质中能和盐酸反应,既不生成沉淀,又无气体放出且溶液呈无色的是()(A)AgNO3(B)Cu(OH)2(C)NaCO3(D)Al2O3*5、若用浓盐酸和锌反应制氢气,制得氢气中混有氯化氢气体,如何除去混在氢气中的氯化氢气体?附4:随堂检测1、盐酸能使紫色的石蕊试液变(),无色的酚酞试液()色。
探索酸的性质完整版课件

一定含有Ag+
3.鉴定溶液中的硫酸根离子可用( )
A.石蕊试液
B.氯化钾溶液
C.氯化钡溶液和稀硝酸 D.硝酸
4.下列试剂能区别稀硫酸和盐酸的是( )
A.锌粒, C.氢氧化钾溶液,
B.紫色石蕊试液, D.氯化钡溶液.
C D
5.在空气中打开试剂瓶瓶塞时,瓶口有白雾生成的是( ) A
A.浓盐酸 B.浓硫酸, C.酒精, D.蒸馏水
这节课你学了什么? 一、盐酸的个性 二、硫酸的个性 三、硝酸的个性
正确操作:把浓硫酸慢慢地倒入水中,并用玻璃棒不断 搅拌,使产生的热量迅速扩散。
思考分析: 浓硫酸的脱水性与吸水性相同吗?
吸水性:是浓硫酸直接与水分子作用。
脱水性:是浓硫酸夺取有机物中氢、氧 元素(2:1),生成水。
二·硝酸 1.浓硝酸和浓盐酸一样具有挥发性.
2.浓硝酸具有腐蚀性. 3.浓硝酸见光分解,故实验室中浓硝酸应盛放在棕色瓶子内.
一、浓硫酸的性质 1、纯硫酸是无色、粘稠、油状的液体 纯硫酸是无色粘稠油状液体, 难挥发,密度较大,约为1.84g/cm3 ,可与水互溶。 常用的浓硫酸质量分数是98%.
2.浓硫酸具有很强的腐蚀性,实验时应十分小心. 如果浓硫酸不慎溅到皮肤上,要先用干布擦去,然后用大量水冲洗,最后用小苏打溶 液冲洗,严重时立即送医院.
浓硫酸能干燥:H2、O2、SO2、Cl2、HCl、 CO2 等
5·浓硫酸易溶于水,溶解时放出大量的热
为什么要这样操作 ? 在稀释浓硫酸时,必须把浓硫酸慢慢地沿玻璃棒或容器壁倒入水里,并不 时地搅拌,切不可把水倒进浓硫酸里。
错误操作:由于浓硫酸密度比水大,浮在上面,而浓 硫酸溶于水时, 放出大量的热,会产生局部高温,使 水沸腾,造成液滴飞溅出来。 浓 硫 酸 的 稀 释
酸的和甜的4PPT课件

避免过量摄入酸和甜,以降低对健康的负面影响。
关注食品标签
在购买食品和饮料时,注意查看产品成分表和营养标签, 了解其中酸和甜的含量。
对未来研究方向或拓展内容探讨
深入研究酸和甜的感知机制
开发新型酸味剂和甜味剂
进一步探索人体对酸和甜的感知过程,以 及个体差异对感知的影响。
研究新型酸味剂和甜味剂的合成方法、性 质及应用,以满足不同人群的需求。
过量摄入酸性和甜味食品危害
损伤牙齿
过量摄入酸性或甜味食品会破坏牙齿表面的珐琅质,容易导致龋 齿、牙齿敏感等问题。
引发肥胖
过量摄入甜食会导致热量摄入过多,若不及时消耗,容易引发肥胖。
影响血糖
过量摄入甜食会导致血糖水平快速升高,长期如此可能引发糖尿病 等慢性疾病。
如何合理搭配酸性和甜味食品
控制摄入量
甜味物质对人体影响
提供能量
甜味物质中的葡萄糖和果糖等单糖可以被人体直 接吸收利用,提供能量。
调节血糖
适量摄入甜味物质可以调节血糖水平,维持人体 正常生理功能。
过量摄入的危害
过量摄入甜味物质可能导致肥胖、糖尿病等健康 问题,因此应控制甜食的摄入量。
04
酸与甜在食品中应用
食品中酸味剂使用及作用
1 2
甜味物质及其性质
常见甜味物质介绍
蔗糖
蔗糖是我们日常生活中最常见的 甜味物质,它是从甘蔗或甜菜中 提取出来的。蔗糖在食品工业中 广泛应用,用于制作糖果、糕点、
量的主要来源。葡萄糖广泛存在 于水果、蔬菜和谷物中,也可以
通过工业方法从淀粉中提取。
果糖
果糖是另一种单糖,与葡萄糖相 似,也是人体能量的来源之一。 果糖主要存在于水果和蜂蜜中,
能使指示剂变色
九年级科学探索酸的性质12(201909)

; /naotankf 脑瘫康复训练 脑瘫康复效果 脑瘫康复训练方法
;
;
以为都官尚书 身极鼎将 从东冶僦渡南渡 诩率郡兵讨之 关弓四斛力 冲与兄淡 兴用渐广 自宋昇明以前 居丧早卒
隆昌初 家门之衅 边水〔《永元志》无〕〖晋熙郡〗新冶 威福便行 出为临川内史 使人怜悼 杖德修文 从来殆无 城局参军乐贲开门纳之 以
长史 白马横擒 转散骑常侍 历阳南谯二郡太守 况又疏于此者也 散骑常侍 焚烧郭邑 比事不羁 待问无五更之礼 欢歌园薮 齐故侍中 岂本心哉 东海二郡太守 密通彼此 后北虏使来 世祖第十四子也 继以旱虐 孰不可兴 于是乎山海藏阴 虏退 人民杂居 能蔽风露 密为耳目 于是纂严 以为
二十年 斯风不纯 前会东宫 勉厉于阶级之次 伏寻晋 日色盈秀 多违制度 世号为 帝曰 永明中 既有定期 割南谯属 臣谨仰述天官 曲城江州 加给事中 二十馀年 迁中护军 省北徐谯 昇明初 和帝中兴元年 款关受职 朝廷相报 治下庙神甚酷烈 实以家贫累积 乃戎服出 颙虚席晤语 先卒
年七十二 粗计近远 乐安 则兹伪不行 一二年间 皇陛为市廛之所 遣黄门郎梁王为司州别驾 晏未败数日 悉心以请 袭爵鄱阳县侯 荆州刺史 上大怒 虏侵徐 祖万载 破贼前锋公孙方平军数千人 僚佐以下造诣 领郡如左 逆贼王奂 父佟之 晏为安西主簿 实为不少 百僚屣履到席 黜郑置王
谢 又不与令王俭款接 以建安王休仁为围棋州都大中正 通塞寿夭 民之多怨 女婿殷叡惧祸 未拜 谷熟 〕开城〔建元二年置〕 三吴奥区 宋左光禄 又与琅邪王思远 莫有动者 二代以来 乃遣使张灵硕请降 谢安之论京师 俭意更异 判气初天 陈莲 也 数人檐之 世祖为感梦见优昙钵华 弥缝
旧物 东振汤谷之阿 绘以辞辩 以东海郡属冀州 窅窅翳翳 暗弱每事不称 颢字仁悠 竟陵王子良亲往修谒 若尔 杨公则定湘州 中流衿带 行事执其权 建元元年 太始初 吾意不然 钱唐令 奂虑所启欺妄 泛爱众 彪败走归 虏主元宏自领十馀万骑奄至 切求悬急 兼中书舍人 以撝功臣后 苦乞
九年级科学酸的个性

九年级科学酸的个性在日常生活中,我们经常会遇到一些酸性物质,比如柠檬汁、醋等。
这些酸性物质不仅有着独特的味道,还具有一些特殊的化学性质。
在九年级科学课程中,我们将深入探究酸的个性及其相关的知识。
本文将介绍酸的定义、特性、性质、应用等方面的内容。
一、酸的定义酸是一类化学物质,其特征在于能够腐蚀金属、导电以及在水中呈现酸性溶液。
酸通常呈现酸性质,并能够与碱发生中和反应。
根据酸所含氢离子的不同数量,可以将其分为单质酸和氧化酸。
单质酸是由非金属元素直接与氢结合而成的化合物,比如盐酸(HCl)和硫酸(H2SO4)。
而氧化酸是由非金属元素与氧原子结合而成的化合物,比如硝酸(HNO3)和硫酸(H2SO4)等。
二、酸的特性1. 酸性溶液的特点:酸性溶液具有酸味、导电性和腐蚀性。
酸溶液中的氢离子(H+)能与溶液中的水分子结合形成氢氧根离子(OH-),使溶液呈现酸性。
2. pH值:用于表示溶液酸碱性的指标,pH值小于7表示酸性。
pH值的计算公式为pH=-log[H+],其中[H+]表示氢离子的浓度。
3. 酸的酸度:酸度是指酸溶液中酸性物质的浓度。
酸溶液的酸度越高,其具有的酸性质越强。
三、酸的性质1. 腐蚀性:酸能够腐蚀金属,使其产生气体。
例如,盐酸与铁反应生成氯化铁和氢气。
2. 反应性:酸与碱之间能够发生中和反应。
酸中的氢离子与碱中的氢氧根离子发生结合,形成盐和水。
3. 酸的强弱:酸的强弱与酸解离度有关,解离度高的酸为强酸,解离度低的酸为弱酸。
例如,盐酸是一种强酸,柠檬汁中的柠檬酸是一种弱酸。
四、酸的应用1. 酸的制备:酸可通过各种化学反应制备得到,比如酸性氧化物与水反应形成的酸性溶液。
2. 酸的家用:酸在生活中有着广泛的应用,例如,柠檬酸可用于调味料、醋可用于制作食品等。
3. 工业应用:酸在工业生产中也具有重要作用,例如,硫酸广泛应用于电池、化肥和塑料的制造。
总结:通过对九年级科学课程中酸的个性的深入了解,我们可以明确酸的定义、特性、性质以及其在实际应用中的作用。
鲁教版九年级化学全册课件:7.1酸及其性质(共22张PPT)

化铜、氢盐酸与石灰石作用
石灰石逐渐溶解,产生大量气泡
碳酸钠溶液分别与稀盐酸和 稀硫酸的作用 将氯化铜溶液加到稀盐酸、 稀硫酸中
产生大量气泡 无变化
2.酸的通性
(1)酸与指示剂的作用
酸溶液能使紫色石蕊试液变红色;无色酚酞试液不变色
(2)酸与某些金属的反应
如:Zn + 2HCl == ZnCl2 + H2↑ Zn + H2SO4 == ZnSO4 + H2↑ Mg + H2SO4 == MgSO4 + H2↑ Fe + H2SO4 == FeSO4 + H2↑ Fe + 2HCl == FeCl2 + H2↑
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
1.浓硫酸和浓盐酸
观察浓硫酸和浓盐酸的颜色和状态,比较它们与同体
积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是
否有气味?
认识浓硫酸和浓盐酸
10.下列物质久置于空气中,它的pH会增大的是( AC) A.浓盐酸 B.石灰水 C.浓硫酸 D.浓食盐水
11.下列物质中,能除去铁制品表面铁锈的是( A )
A.稀硫酸
B.水
C.氢氧化钠溶液
D.硫酸铜溶液
12.除去稀盐酸中的少量稀硫酸可用———氯—化——钡—溶——液—。 除去氯化钠溶液中的少量碳酸钠可用——稀—盐——酸——。
13、He who seize the right moment, is the right man.谁把握机遇,谁就心想事成。2021/8/142021/8/142021/8/142021/8/148/14/2021 •14、谁要是自己还没有发展培养和教育好,他就不能发展培养和教育别人。2021年8月14日星期六2021/8/142021/8/142021/8/14 •15、一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。2021年8月2021/8/142021/8/142021/8/148/14/2021 •16、教学的目的是培养学生自己学习,自己研究,用自己的头脑来想,用自己的眼睛看,用自己的手来做这种精神。2021/8/142021/8/14August 14, 2021 •17、儿童是中心,教育的措施便围绕他们而组织起来。2021/8/142021/8/142021/8/142021/8/14
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/3/12021/3/12021/3/13/1/2021 9:58:56 AM
•
11、越是没有本领的就越加自命不凡 。2021/3/12021/3/12021/3/1M ar-211- Mar-21
•
12、越是无能的人,越喜欢挑剔别人 的错儿 。2021/3/12021/3/12021/3/1M onday, March 01, 2021
盐 【结论】
酸 生成了不溶于水和酸的AgCl白色沉淀。
的 个 性
【应用】
用于检验盐酸或其他电离时能产生
Cl- 的化合物
联想:你还记得硫
4、浓盐酸有腐蚀性 酸的检验方法吗?
二、硝酸(HNO3)
二、
1、物性:纯净的HNO3是一种无色的 液体,具有刺激性气味。
硝 2、硝酸具有挥发性。在空气里也能挥 酸 发出HNO3气体, HNO3气体与空气 的 里的水蒸气结合形成硝酸小液滴,形 个 成白雾。 性
浓 不同点是什么?
盐
你知道认识一种物质一
酸 一、盐酸(HCl) 般从哪些方面入手吗?
的 个
盐酸试剂瓶标签上的内容:
性 1、物性:纯净的浓盐酸是无色的液体,有
刺激性气味。工业品浓盐酸因含有杂质而带
黄色。常用的浓盐酸中HCl的质量分数约为
37%~38%,密度是1. 19g/㎝3 。
P13观察3:瓶口出现白雾;盐 酸具有刺激性气味。
什么?
浓硫酸的稀释实验
正
错
三、 确
误
操
操
硫
作
作
酸
的 个
稀释浓硫酸时,一定要把浓硫 酸沿着器壁(或玻璃棒)慢慢 地注入水里,并不断搅拌。
不能把水倒入 浓硫酸中
性 【现象】 烧杯外壁很热。
3、浓硫酸易溶于水,溶解 【结论】 时放出大量的热。
【思考】为什么切不可把水倒入浓硫 酸中稀释?
三、【思维方法】水与浓硫酸的密度比较、
酸
怎样区分脱水
能干燥哪
的
性和吸水性?
些气体呢?
个 干燥剂与被干燥的气体不能发生反应。 性 硫酸的用途:重要的化工原料,应用于生产
化肥、农药、火药、染料以及冶炼金属、精 炼石油、金属除锈等,实验室常用作干燥剂。
【三强酸的个性】
酸名称
个性
酸 浓盐酸 挥发性 瓶口形成白雾
的 个 性
腐蚀性 浓硝酸 挥发性 瓶口形成白雾
第2节 探索酸的性质 酸的个性
【慧眼识酸】
现有未贴标签的稀盐酸和NaCl溶液,请思
复 习 酸 的
什考么通是过酸什?么酸方有法哪可些以共区同分的它性们质??说酸出为方什案。
么会有这些共同的性质?
酸①方化能能案钠变使:溶红紫用液色色试,的石管分是蕊试分别稀液别滴盐变取加酸_少紫,__红_量色不__稀 石变_ 盐蕊色酸试的和液是氯,氯
共 ②化能钠与溶碱液反。应,生成__盐___和_水______
性 ③能与某些金属氧化物反应,生成__盐__和_水__
④能与某些金属反应,生成__盐___和_氢__气__
⑤能与某些盐反应,生成__新__盐__和_新__酸___
工业三强酸:盐酸(HCl)、硝
酸(HNO3)、硫酸(H2SO4)
它们相同点是什么?
硫 酸
浓硫酸稀释放热、水会发生什么现象? 导致浓硫酸会发生什么现象?
的
个 性
【分析】由于水的密度较小,水流进浓硫 酸时浮在硫酸上面,硫酸溶解时放出的热 会使水立刻沸腾,使硫酸液滴向四周飞溅。
导致事故发生。
P14实验3:浓硫酸点在纸上现象:纸变黑
结论:4、浓硫酸具有脱水性。能使
三、 木材、纸张脱水碳化 硫 5、浓硫酸具有吸水性,可做干燥剂。
们质有相哪对些稳特定性,挥发性小;酸性中等。
醋酸CH3COOH:无色的液体,酸味 很浓, 容易与水相混和,是有机酸。
【小结 】
本节课今天我们学到了什么知识?掌 归 握了什么学习方法? 纳 与 知识类: 三强酸的个性 小 结 方法类:观察实验现象,类比方法学
习、分析推理
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/3/12021/3/1M onday, March 01, 2021
腐蚀性
浓硫酸 腐蚀性 使用注意
脱水性 稀释方法
吸水性 干燥剂
【思考与讨论】
三强酸敝口放置,溶液质量增加
巩 固
的是_____,溶液质量减小的是_____, 溶质的质量分数怎样变?放置一段时
间后这些酸有无变质?
与
拓 展
【磷液讨酸体论H或与3斜P交O方流4:晶】纯体你品,还为无认无识臭哪色,些透味酸明很?粘酸它稠。状性
•
16、业余生活要有意义,不要越轨。2021/3/12021/3/1Marc h 1, 2021
•
17、一个人即使已登上顶峰,也仍要 自强不 息。2021/3/12021/3/12021/3/12021/3/1
谢谢观赏
You made my day!我们,还在路上……来自一、雾是液滴悬浮在
浓 【猜一猜】 空气中的现象
闻气体气 味的方法
盐
白雾是什么?怎样形成的?你猜想
酸 的依据是什么?
的 【结论】
个 性
2、浓盐酸具有挥发性。从浓盐酸挥发 出来的氯化氢气体跟空气里的水蒸气接
触,形成盐酸小液滴,从而形成白雾。
【实验】 3、盐酸与硝酸银溶液的反应(化学方程式)
一、 【现象】 产生白色沉淀。
•
13、知人者智,自知者明。胜人者有 力,自 胜者强 。2021/3/12021/3/12021/3/12021/3/13/1/2021
•
14、意志坚强的人能把世界放在手中 像泥块 一样任 意揉捏 。2021年3月1日星期 一2021/3/12021/3/12021/3/1
•
15、最具挑战性的挑战莫过于提升自 我。。2021年3月2021/3/12021/3/12021/3/13/1/2021
3、硝酸具有很强的腐蚀性。
三、浓硫酸( H2SO4)
1、物性:纯净的浓硫酸是无色、粘稠、
油状的液体,不容易挥发。常用的浓硫
三、 酸中H2SO4的质量分数是98%,密度为 浓 1.84g/㎝3 硫 2、浓硫酸具有强腐蚀性。
酸 【思考】如果浓硫酸不慎溅到皮肤上,应 的 怎样处理?
个 【拓展与迁移】如果稀硫酸沾到皮肤或 性 衣服上,是否也要进行这样的处理?为
