化学生物学三生物催化PPT课件
合集下载
第三章 生物化学课件 酶与辅酶

发展史
(1)酶是蛋白质: 1926年,James Summer由刀豆制出脲酶结晶确立 酶是蛋白质的观念,其具有蛋白质的一切性质。 (2)核酶的发现: 1981~1982年,Thomas R.Cech实验发现有催化 活性的天然RNA—Ribozyme。
酶催化进行的反应——酶促反应 底物、产物(P50)
能 量 水 平
E1
ES
E2
E+S
G
途径进行,降低反应所
需活化能,所以能加快 反应速度。
P+ E
反应过程
中间产(络合)物学说
• 第一步是酶与底物形成酶-底物中间复合 物。当底物分子在酶作用下发生化学变化 后,中间复合物再分解成产物和酶。 E + S ==== E-S P + E • 许多实验事实证明了E-S复合物的存在。E -S复合物形成的速率与酶和底物的性质有 关。 • (中间产物很不稳定,存在时间非常短暂)
酶专一性的“诱导契合学说”
三、 酶高效催化的因素
(1)临近效应、定向效应: 在酶促反应中,底物分子结合到酶的活性中心,一方面底 物在酶活性中心的有效浓度大大增加,有利于提高反应速 度; 另一方面,由于活性中心的立体结构和相关基团的诱导和 定向作用,使底物分子中参与反应的基团相互接近,并被 严格定向定位,使酶促反应具有高效率和专一性特点。 (2)“张力”和“形变” : 底物与酶结合诱导酶的分子构象变化,变化的酶分子又使 底物分子的敏感键产生“张力”甚至“形变” ,从而促 使酶-底物中间产物进入过渡态。
消化道内几种蛋白酶的专一性
氨肽酶
(芳香) (硷性)
羧肽酶 羧肽酶
(丙)
胰凝乳 蛋白酶
胃蛋白酶
弹性蛋白酶 胰蛋白酶
酶—酶的催化特性(生物化学课件)

酶的催化特点
酶的催化特点
酶是生物催化剂,与无机催化剂相比,二者有共性; 但酶的化学本质是蛋白质,又在生物体内作用,因此酶的作用 又有特性。
2
酶和一般催化剂的共性
1.用量少而催化效率高; 2.它能够改变化学反应的速度,但是不能改变化学
反应平衡。 3.只能催化热力学允许的反应,在反应前后不发生
改变。
3
酶催化作用特性
高效性 专一性
4
1.高效性
酶的催化作用可使反应速度提高106 -1012倍。
例如:过氧化氢分解
2H2O2
2H2O + O2
用Fe3+ 催化,效率为6×10-4 mol/mol.S,而用过氧化氢酶催化,
效率为6×106 mol/mol.S。
用-淀粉酶催化淀粉水解,1克结晶酶在65C条件下可催化2吨淀粉 水解。
• (3)酸碱催化:
+
-COOH, -NH 3,
-SH,
+
OH HN
NH
广义酸基团 (质子供体)
-COO -,
..
-NH 2,
-S ,-
O-
:N
NH
广义碱基团 (质子受体)
(4)共价催化:
催化剂通过与底物形成反应活性很高的 共价过渡产物,使反应活化能降低,从 而提高反应速度的过程,称为共价催化。
酶中参与共价催化的基团主要包括 His 的咪唑基,Cys 的硫基,Asp 的羧基, Ser 的羟基等。
某些辅酶,如焦磷酸硫胺素和磷酸吡活的生理意义
避免细胞产生的酶对细胞进行自身消化,并使酶在特定的部 位和环境中发挥作用,保证体内代谢正常进行。
有的酶原可以视为酶的储存形式。在需要时,酶原适时地转 变成有活性的酶,发挥其催化作用。
酶的催化特点
酶是生物催化剂,与无机催化剂相比,二者有共性; 但酶的化学本质是蛋白质,又在生物体内作用,因此酶的作用 又有特性。
2
酶和一般催化剂的共性
1.用量少而催化效率高; 2.它能够改变化学反应的速度,但是不能改变化学
反应平衡。 3.只能催化热力学允许的反应,在反应前后不发生
改变。
3
酶催化作用特性
高效性 专一性
4
1.高效性
酶的催化作用可使反应速度提高106 -1012倍。
例如:过氧化氢分解
2H2O2
2H2O + O2
用Fe3+ 催化,效率为6×10-4 mol/mol.S,而用过氧化氢酶催化,
效率为6×106 mol/mol.S。
用-淀粉酶催化淀粉水解,1克结晶酶在65C条件下可催化2吨淀粉 水解。
• (3)酸碱催化:
+
-COOH, -NH 3,
-SH,
+
OH HN
NH
广义酸基团 (质子供体)
-COO -,
..
-NH 2,
-S ,-
O-
:N
NH
广义碱基团 (质子受体)
(4)共价催化:
催化剂通过与底物形成反应活性很高的 共价过渡产物,使反应活化能降低,从 而提高反应速度的过程,称为共价催化。
酶中参与共价催化的基团主要包括 His 的咪唑基,Cys 的硫基,Asp 的羧基, Ser 的羟基等。
某些辅酶,如焦磷酸硫胺素和磷酸吡活的生理意义
避免细胞产生的酶对细胞进行自身消化,并使酶在特定的部 位和环境中发挥作用,保证体内代谢正常进行。
有的酶原可以视为酶的储存形式。在需要时,酶原适时地转 变成有活性的酶,发挥其催化作用。
《生物催化剂技术》课件
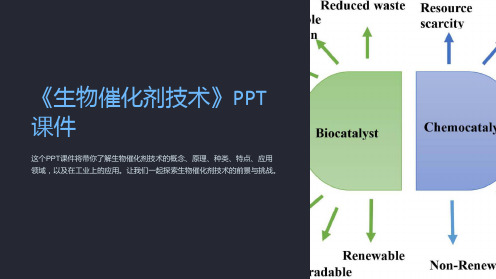
《生物催化剂技术》PPT 课件
这个PPT课件将带你了解生物催化剂技术的概念、原理、种类、特点、应用 领域,以及在工业上的应用。让我们一起探索生物催化剂技术的前景与挑战。
催化剂的概念与原理
催化剂是指能够加速化学反应速率,但本身在反应中不被消耗的物质。催化 剂通过降低反应的活化能,提供新的反应路径来促进反应的进行。
食品加工
酶在食品加工中的应用可以提 高产品质量、改善口感和延长 保质期。
生物催化剂的前景与挑战
1
前景
生物催化剂具有巨大的应用潜力,可以提高反应效率、节约资源,同时也对环境 友好。
2
挑战
生物催化剂在活性、稳定性、特异性等方面仍面临一定的挑战,需要进一步的研 究和发展。
3
研究方向
未来的研究重点包括提高催化剂的催化效率、改善催化剂的特异性以及提高催化 剂的稳定性。
3 组织
组织催化剂是一种利用生物组织中的酶或其他生物大分子来催化化学反应的生物催化剂。
生物催化剂的特点
高效选择性
酶对底物具有高度选择性,可以选择性地催化特定的反应。
温和条件
生物催化剂的反应一般在温和的条件下进行,不需要高温或高压。
可重复使用
生物催化剂可以通过简单的处理方法得到再生并且反复使用,降低了生产成本。
生物催化剂的应用领域
医药制造
• 药物合成 • 酶替代治疗
食品加工
• 酶改善食品质量 • 酶降解食品成分
环境保护
• 废水处理 • 废弃物降解
生物催化剂在工业上的应用
工业生产
生物催化剂在生物燃料生产、 生物塑料制造等工业领域发挥 着重要作用。
制药行业
酶催化技术在制药行业中得到 广泛应用,用于药物合成和药 物转化。
这个PPT课件将带你了解生物催化剂技术的概念、原理、种类、特点、应用 领域,以及在工业上的应用。让我们一起探索生物催化剂技术的前景与挑战。
催化剂的概念与原理
催化剂是指能够加速化学反应速率,但本身在反应中不被消耗的物质。催化 剂通过降低反应的活化能,提供新的反应路径来促进反应的进行。
食品加工
酶在食品加工中的应用可以提 高产品质量、改善口感和延长 保质期。
生物催化剂的前景与挑战
1
前景
生物催化剂具有巨大的应用潜力,可以提高反应效率、节约资源,同时也对环境 友好。
2
挑战
生物催化剂在活性、稳定性、特异性等方面仍面临一定的挑战,需要进一步的研 究和发展。
3
研究方向
未来的研究重点包括提高催化剂的催化效率、改善催化剂的特异性以及提高催化 剂的稳定性。
3 组织
组织催化剂是一种利用生物组织中的酶或其他生物大分子来催化化学反应的生物催化剂。
生物催化剂的特点
高效选择性
酶对底物具有高度选择性,可以选择性地催化特定的反应。
温和条件
生物催化剂的反应一般在温和的条件下进行,不需要高温或高压。
可重复使用
生物催化剂可以通过简单的处理方法得到再生并且反复使用,降低了生产成本。
生物催化剂的应用领域
医药制造
• 药物合成 • 酶替代治疗
食品加工
• 酶改善食品质量 • 酶降解食品成分
环境保护
• 废水处理 • 废弃物降解
生物催化剂在工业上的应用
工业生产
生物催化剂在生物燃料生产、 生物塑料制造等工业领域发挥 着重要作用。
制药行业
酶催化技术在制药行业中得到 广泛应用,用于药物合成和药 物转化。
生物催化

编号的第二个数字
表示在类以下的大组.
• 氧化还原酶:表示氧化反应供体基团 的类型; • 转移酶:表示被转移基团的性质; • 水解酶:表示被水解键的类型; • 裂解酶:表示被裂解键的类型; • 异构酶:表示异构作用的类型; • 连接酶:表示生成键的类型.
编号的第三和第四个数字
• 编号的第三个数字:表示大组下面的 小组,各个数字在不同类别,不同大 组中都有不同的含义; • 编号的第四个数字:是小组中各种酶 的流水编号.
1.2 生物催化的产生与发展
远古时代:酒的酿造,饴糖的制作,豆类做酱
酵母发酵的产物, 是细胞内酶作用的结果
用麦曲含有的淀粉酶 将淀粉降解为麦芽糖
在霉菌蛋白酶作用下,豆类蛋白质水解 得豆酱和豆鼓,压榨后制得酱油
• 1878年,Kuhne第一次提出 “酶”(Enzyme)的概念,意为“在酵母 中”(in yeast); • 1894年,Emil Fischer发现了酶对底物 (酶作用的物质)的专一性现象,提出了 “锁和钥匙”模型; • 酶晶体的获得,才认识到酶是蛋白质,是 由酰胺键连接的氨基酸组成; • 1926年,Sumner从刀豆中得到脲酶结晶, 催化尿素水解,产生CO2和NH3.
现 状
• 1996年生物催化剂已占世界催化剂90 亿美元市场的11%; • 美国EBC成功开发了一种生物脱硫的新 工艺; • 我国:生物催化丙烯腈制丙烯酰胺、有 机废水发酵法制氢技术、生物发酵法 制造甘油已建成投产或通过中试验证.
内 容
• • • • • • • • • • • 酶的结构和分类 酶的分离与纯化 酶活力测定 酶作用动力学 酶的抑制作用 pH值和温度对酶作用的影响 酶的作用机制 应用酶学 酶法制备L-氨基酸 生物催化反应器 生物有机化学与生物催化
生物催化剂 ppt课件

ppt课件 12
在食品工业中的应用
在食品工业中可以用来降低粘度、提高抽职效率(或 分离效率)、增香、实现生物转化等。在这些应用方 面也同样推广着固定酶技术, 目前世界上规模最大 的固定酶工艺就是用固定化葡萄糖异构酶以葡萄糖 为原料生产果糖糖浆。具体方法是将葡萄糖异构酶 固定在二乙胺乙基纤维素上,异构化条件是温度为 20℃,PH为6—9。这种固定酶的活力可达90% , 并且如果酶的皤性降低可加入新酶使之再生。
ppt课件 9
生物催化剂的来源
目前,少数生物催化剂是从动物肝脏或植物 中提取的,多数 来自于微生物细胞。除真核生物。 和单细胞酵母(如从南极 假丝酵母中得到了高效脂肪酶CalB)外,原核微生物是生物 催化剂的主要来源。由于原核微生物(细菌和古生菌)是地球 上出现最早和数量最多的生命形态,经历了漫长的演变后, 许多微生物为适应“恶劣”环境而具有了非常高的耐受性, 从而可从中得到大量高性能的生物催化剂。现在,虽然微生 物培养也有其局限性,如很多生物体用当前技术还无法进行 培养,但通过微生物培养来获得生物催化剂仍是最普通和最 有效的方法。这是因为微生物培养能加速生物体的新陈代谢 而增加其数量,为以后的高通量筛选提供了有利条件。
ppt课件 19
生物催化剂应用于酰胺的合成及 水解反应
一
酰胺和肽的合成 酶催化反应在青霉索和头孢菌素的酰胺键生 成中,起着极为重要的作用。例如在酶的作 用下,7一氨基去乙酰氧基头孢菌素酸(7一 ADAc)和D一苯基甘氮酸可以转变为头孢菌素。
ppt课件
20
当底物分子含有多种不同反应能力的官能团 时,若想得到单一的目标产物.选用酶作催 化剂是最佳的,例如天冬门酰胺的合成
ppt课件 17
ppt课件
在食品工业中的应用
在食品工业中可以用来降低粘度、提高抽职效率(或 分离效率)、增香、实现生物转化等。在这些应用方 面也同样推广着固定酶技术, 目前世界上规模最大 的固定酶工艺就是用固定化葡萄糖异构酶以葡萄糖 为原料生产果糖糖浆。具体方法是将葡萄糖异构酶 固定在二乙胺乙基纤维素上,异构化条件是温度为 20℃,PH为6—9。这种固定酶的活力可达90% , 并且如果酶的皤性降低可加入新酶使之再生。
ppt课件 9
生物催化剂的来源
目前,少数生物催化剂是从动物肝脏或植物 中提取的,多数 来自于微生物细胞。除真核生物。 和单细胞酵母(如从南极 假丝酵母中得到了高效脂肪酶CalB)外,原核微生物是生物 催化剂的主要来源。由于原核微生物(细菌和古生菌)是地球 上出现最早和数量最多的生命形态,经历了漫长的演变后, 许多微生物为适应“恶劣”环境而具有了非常高的耐受性, 从而可从中得到大量高性能的生物催化剂。现在,虽然微生 物培养也有其局限性,如很多生物体用当前技术还无法进行 培养,但通过微生物培养来获得生物催化剂仍是最普通和最 有效的方法。这是因为微生物培养能加速生物体的新陈代谢 而增加其数量,为以后的高通量筛选提供了有利条件。
ppt课件 19
生物催化剂应用于酰胺的合成及 水解反应
一
酰胺和肽的合成 酶催化反应在青霉索和头孢菌素的酰胺键生 成中,起着极为重要的作用。例如在酶的作 用下,7一氨基去乙酰氧基头孢菌素酸(7一 ADAc)和D一苯基甘氮酸可以转变为头孢菌素。
ppt课件
20
当底物分子含有多种不同反应能力的官能团 时,若想得到单一的目标产物.选用酶作催 化剂是最佳的,例如天冬门酰胺的合成
ppt课件 17
ppt课件
《催化作用原理》课件

要点二
详细描述
智能催化与人工酶是未来催化科学与技术的重要发展方向 。通过结合智能技术和生物酶的催化机制,设计具有优异 性能的智能催化剂和人工酶。这将有助于解决一些传统催 化方法难以解决的问题,提高催化反应的效率和选择性。
感谢您的观看
THANKS
详细描述
通过建立动力学模型,可以定量描述反应速 率与反应物浓度、温度等参数之间的关系。 这有助于优化反应条件,提高催化效率。
总结词
反应机理研究方法是探索催化反应如何 发生的重要手段,对于催化剂设计和性
能改进具有指导意义。
详细描述
常用的反应机理研究方法包括同位素示踪法、中间体捕获和红外光谱等。这些方法有助于揭示反应过程中的关键 步骤和中间产物,为催化剂的优化提供理论支持。
催化剂的选择性
总结词
催化剂的选择性是指催化剂对反应物转化为目标产物的选择性,即目标产物在所有产物 中的比例。
详细描述
催化剂的选择性对工业催化过程至关重要,可以提高目标产物的产率和纯度,降低副产 物的生成。影响催化剂选择性的因素包括催化剂的组成、结构、表面性质以及反应条件
等。
催化剂失活与再生
总结词
化工生产中的催化过程
乙烯的合成
通过催化剂的作用,将乙醇转化 为乙烯,是化工生产中重要的原
料。
丙烯腈的合成
通过催化剂的作用,将丙烯和氨转 化为丙烯腈,是重要的合成材料。
苯酚的合成
通过催化剂的作用,将苯和甲醛转 化为苯酚,是重要的化工原料。
环境治理中的催化过程
汽车尾气的催化转化
通过催化剂的作用,将汽车尾气中的有害物质转化为无害物质, 降低空气污染。
03
催化剂的活性与选择性
催化剂的活性
生物化学课件4酶与生物催化剂

辅酶辅基与维生素及核苷酸的关系
辅助成分 作 用 维生素组分 核苷酸组 分
NAD+(辅酶Ⅰ)
NADP+(辅酶Ⅱ) CoA-SH(辅酶A) FH4(四氢叶酸) 磷酸吡哆醛/胺
焦磷酸硫胺素TPP 黄素腺嘌呤二核苷酸FAD
递氢(脱氢酶)
转移酰基 转移一碳单位 转移氨基(转 氨酶)、羧基 (脱羧酶) 转移醛基
第四章 酶与生物催化剂
第一节 概 述
主要内容:介绍酶的概念、作用 特点和分类、命名,讨论酶的结 构特征和催化功能以及酶专一性 及高效催化的策略,进而讨论影 响酶作用的主要因素。对酶工程 和酶的应用作一般介绍。
酶是生物细胞产生的、具有催化能力的生 物催化剂。 定义:酶是生物体内进行新陈代谢不可 缺少的受多种因素调节控制的具有催化 能力的生物催化剂。 酶具有一般催化剂的特征:1.只能进行热力 学上允许进行的反应;2.可以缩短化学反应 到达平衡的时间,而不改变反应的平衡点; 3.通过降低活化能加快化学反应速度。
第四节 反应动力学
底物浓度的影响 酶浓度的影响 温度、pH的影响 抑制剂、激活剂的影响
一、底物浓度的影响
1、一种现象:酶被底物饱和 2、一种假说:酶-底物复合物中间产物学说 3、米氏方程:
V m a x [S ] V= K m + [S]
(1)v-[S]曲线:近似双曲线 (2)[s]<<Km([S]很小时),v与[s]成正比
二、共价调节酶 三、酶原(zymogen;proenzyme)激活
无活性的酶前体转变为有活性的酶的过程
四、同工酶(isoenzyme)
同工酶:分子结构、理化性质、免疫特性等 不同,但可以催化相同的化学反应的一组酶。
【经典举例】乳酸脱氢酶:由四个亚基组成,亚
酶是生物催化剂ppt课件

5.底物浓度
酶量一定的条件下,在一定范
反
应
围内随着底物浓度的增加,反 速 率
应速率也增加,但达到一定浓
底物浓度[s]
度后不再增加,原因是受到酶数量和酶活性的
限制。
6.酶浓度
反
应
在底物充足、其他条件适宜且 速
率
固定的条件下,酶促反应速率
与酶浓度成正比。
酶浓度[E]
7.影响酶活性的曲线(多因素)
支 应 物 乘 剩 余 量 ( 相对 量 )
④在各自所控制的温度下保温一段时间
⑤滴加 碘 液 ,观察颜色变化
步骤顺 序
3%淀粉 液
2%淀粉 酶液
温度预 处理
混合后 摇匀
控制温 度
试管1 试管1’ 2ml
1ml 0℃保温5min
混合 0℃保温5min
试管2 试管2 ’ 试管3 试 管 3 ’
2ml
2ml
1ml
1ml
60℃保温5min 100℃保温5min
3、在上述实验中,自变量是什么?无关变量是 什么?
自变量是不同的温度;无关变量是可溶性淀粉溶 液、新鲜淀粉酶溶液、碘液的量
酶活性受许多因素的影响
(1)本实验不宜选用过氧化氢酶催化H₂O₂分解,因为 过氧化氢酶催化的底物过氧化氢在加热的条件下分解 也会加快。
(2)本实验不宜选用斐林试剂鉴定,温度是干扰
淀粉(非还原糖)淀粉酶 麦芽糖(还原糖) ① 淀粉(非还原糖)蔗糖酶淀粉
②再用本尼迪特试剂鉴定,从而探究酶的专一性。
1、探究淀粉酶对淀粉和蔗糖的作用
第一步:1ml 水 水 水 淀粉酶淀粉酶 第二步:3ml 淀粉 蔗糖 淀粉酶淀粉蔗糖
第三步:各试管充分摇匀后,37℃保温15分钟
生物化学---酶催化作用的特点PPT课件

NAD+ (烟酰胺-腺嘌呤二核苷酸,又称为辅酶I) 和NADP+(烟酰胺-腺嘌呤磷酸二核苷酸,又称为辅 酶II )是维生素烟酰胺的衍生物,它们是多种重要 脱氢酶的辅酶。
NH2
CONH2 O- O- N
N+ O
CH2OPOPOCH2
N O
OO
N N
OH OH
OH OH(OPO3H2)
⑤ 维生素B6和磷酸吡哆醛 维生素B6包括吡哆醇、吡哆醛和吡哆胺。
(2)传递氢(递氢体):如 硫辛酸;
FMN/FAD、NAD/NADP、C0Q、
(3)传递酰基体:如 C0A、TPP、硫辛酸; (4)传递一碳基团:如 四氢叶酸;
(5)传递磷酸基:如 ATP,GTP;
(6)其它作用: 转氨基,如 VB6 ;传递CO2,如 生物素。
维生素和辅酶
维生素是机体维持正常生命活动所必不可少的一类小分子 有机物质。
NH2 N
ClCH2 N+
H3C N
S
CH3 CH2CH2 OH
焦磷酸硫胺素(TPP)是脱羧酶的辅酶,催化丙酮酸或α–酮
戊二酸的氧化脱羧反应,所以又称为羧化辅酶。
NH2 N
ClCH2 N+
H3C N
S
CH3
OO
CH2CH2 O P O P OH
OH OH
② 维生素B2和黄素辅酶 维生素B2又称核黄素,由核糖醇和6,7-二甲基异咯嗪
(1)活性中心:酶分子中直接和底物结合并起催化反应的空间 局限(部位)。
结合部位(Binding site):酶分子中与底 物结合的部位或区域
一般称为结合部位。
催化部位(Catalytic site): 酶分子中促使底物发生化 学变化的部位称为催化部 位。
NH2
CONH2 O- O- N
N+ O
CH2OPOPOCH2
N O
OO
N N
OH OH
OH OH(OPO3H2)
⑤ 维生素B6和磷酸吡哆醛 维生素B6包括吡哆醇、吡哆醛和吡哆胺。
(2)传递氢(递氢体):如 硫辛酸;
FMN/FAD、NAD/NADP、C0Q、
(3)传递酰基体:如 C0A、TPP、硫辛酸; (4)传递一碳基团:如 四氢叶酸;
(5)传递磷酸基:如 ATP,GTP;
(6)其它作用: 转氨基,如 VB6 ;传递CO2,如 生物素。
维生素和辅酶
维生素是机体维持正常生命活动所必不可少的一类小分子 有机物质。
NH2 N
ClCH2 N+
H3C N
S
CH3 CH2CH2 OH
焦磷酸硫胺素(TPP)是脱羧酶的辅酶,催化丙酮酸或α–酮
戊二酸的氧化脱羧反应,所以又称为羧化辅酶。
NH2 N
ClCH2 N+
H3C N
S
CH3
OO
CH2CH2 O P O P OH
OH OH
② 维生素B2和黄素辅酶 维生素B2又称核黄素,由核糖醇和6,7-二甲基异咯嗪
(1)活性中心:酶分子中直接和底物结合并起催化反应的空间 局限(部位)。
结合部位(Binding site):酶分子中与底 物结合的部位或区域
一般称为结合部位。
催化部位(Catalytic site): 酶分子中促使底物发生化 学变化的部位称为催化部 位。
生物化学3(酶,辅酶,生物氧化)

酶的活性中心与酶促反应的专一性 酶的活性中心也称为活性部位,是指酶分子上 直接与底物结合,并与催化作用直接相关的区 域。 活性中心由结合基团和催化基团组成。前者负 责与底物结合,决定酶的专一性,后者参与催 化,负责底物旧键的断裂和产物新键的形成, 决定酶的催化能力。但也可能有某些基团两者 兼而有之。
(3)多酶体系
• 由几种酶靠非共价键彼此嵌合而成。 • 它有利于一系列反应的连续进行。
• 这类多酶复合体分子量很高,一般在几百 万以上。 • 如:脂肪酸合成酶系
2、按结构分类
(1)单纯酶:仅含蛋白质的酶为单纯酶如: (2)结合酶(缀合酶):除了蛋白质以外,还结合某 些对热稳定的非蛋白质小分子或金属离子,它们统称 为辅助因子。
双倒数作图法
酶抑制剂作用的动力学
酶抑制剂的类型 ① 可逆性抑制剂。以次级键与酶可逆结合,使 用透析或超滤就可去除它们,让酶恢复活性 ;
② 不可逆性抑制剂。也被称为酶灭活剂,以强 的化学键(通常是共价键)与酶不可逆结合 ,可导致酶有效浓度的降低,因此一旦失活 就不可逆转。如果想恢复酶的活性,唯一的 手段只能是补充新酶。
EIS
Km 不变 vmax 降低
1/v
(1+[I]/KI)/Vmax
+抑制剂
斜率=Km/vmax
斜率= Km(1+[I]/KI)/vmax
[S]
-1/Km
1/vmax
1/[S]
反竞争性抑制剂
ES
Km 降低 vmax 降低
k1 k-1
ES
I
KI’
k2
EP
EIS
1/v
(1+ /(1+[I]/KI)/Vmax
新教材高中生物第三章酶的催化功能受多种条件的影响和综合课件浙科版必修第一册ppt

3.实验设计中对照的设置 一个实验通常分为实验组和对照组(控制组)。实验组是施加实 验变量处理的对象组,对照组是不施加实验变量处理的对象
组,无关变量对两者的影响是相同的,两组之间的差别被认 为是来自实验变量的影响。按照对照方式的不同可分为4种类 型:
Hale Waihona Puke 4.与酶相关的实验设计 (1)温度对酶活性的影响 ①实验原理
(1)本实验为什么需要使用新鲜肝脏?把新鲜肝脏做成匀浆的 目的是什么? (2)为什么必须使用新配制的过氧化氢溶液? (3)什么情况下开始计时? (4)整个实验过程中,除pH之外,其余的变量有哪些,为什么 相同? (5)在探究温度或pH对酶活性影响的实验中,控制条件的步骤 和酶量控制的步骤为什么一定不能颠倒顺序? (6)能否用本实验装置来探究温度对酶活性的影响?试说明原 因。
2.如图为在某温度和pH条件下,人血液中的碳酸酐酶酶促反应 速率随底物浓度变化的示意图。下列有关叙述中错误的是 ( B)
A.底物浓度为a时,再增加底物浓度,反应速率加快 B.底物浓度为b时,再增加底物浓度,反应速率加快 C.底物浓度为a时,若改变反应温度,反应速率可能改变 D.底物浓度为b时,若改变反应pH,反应速率可能改变
实验原理
肝脏中的过氧化氢酶能将H2O2催化分解成H2O和O2。用不同的 pH缓冲液处理过氧化氢酶和H2O2,收集O2的产生量,比较在不 同pH下过氧化氢酶的催化活性。
实验步骤
①将水槽中的水加至快满为止。
②将大小相同的8片滤纸片放在___盛__有__新__鲜__肝__脏__匀__浆__的__培__养__皿__中__ __浸泡1 min,然后用镊子夹起滤纸片,贴靠在培养皿壁上,使 ___多__余__的__匀__浆__流__尽____。 ③将3片含有酶的滤纸片小心放入反应小室的一侧内壁上,注意 滤纸片不要__碰__到__反__应__小__室__的__瓶__口____。 ④加入pH为5.0的缓冲液2 mL,然后再加入2 mL 3%的H2O2溶 液,将小室塞紧。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH OH
OH
CH2OH
CH2OH
O OH
OH OH
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
裂合酶 Lyase
• 裂合酶可催化从底物分子中移去一个基团或原子形成 双键的反应及其逆反应。
• 主要包括醛缩酶、水化酶及脱氨酶等。 • 如, 延胡索酸裂合酶催化的反应。
HOOCHC CHCOOH + H2O
R COOCH2CH3 H2O RCOOH CH3CH2OH
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学 氧化还原酶 Oxidoreductase
• 氧化-还原酶可以催化氧化-还原反应。 • 主要包括脱氢酶(dehydrogenase)和氧化酶(Oxidase)。 • 如乳酸(Lactate)脱氢酶催化乳酸的脱氢反应。
化学生物学
生物催化的定义
WHAT IS biocatalysis? 什么是生物催化?
生物催化( biocatalysis )是利用生物催化剂(主要是 酶或微生物)来改变(通常是加快)化学反应速度的作 用。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
Sidney Altman Yale University New
Haven, CT, USA
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化剂的来源
8% 4%
微生物 动物 植物
88%
目前,少数生物催化剂是从动物肝脏或植物中提 取的,多数来自于微生物细胞。除真核生物和单细胞 酵母外,原核微生物是生物催化剂的主要来源。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化剂的分类
克隆酶、遗传修饰酶
蛋白质类: Enzyme
蛋白质工程新酶
生物催化剂 Biocatalyst
(天然酶、生物工程酶)
核酸类:Ribozyme ; Deoxyribozyme
模拟生物催化剂 核酶
……
脱氧核酶
Enzyme(酶)-是一类由活细胞产生,对特有底物具有
HOOCH2C CHCOOH OH
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
合成酶 Ligase or Synthetase • 合成酶,又称为连接酶,能够催化C-C、C-O、C-N 以
及C-S 键的形成反应。但这类反应必须与ATP分解反应 相互偶联。 • A + B + ATP + H-O-H ===A B + ADP +Pi • 如,丙酮酸羧化酶催化的反应。 丙酮酸 + CO2 草酰乙酸
1897年 Buchner兄 弟证明不含 细胞的酵母 汁也能进行 乙醇发酵。
1926年 Sumner首 次从刀豆 中提出脲 酶结晶。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
1930年 Northrop等得到了胃蛋白酶、胰蛋白酶和胰 凝乳蛋白酶的结晶。Sumner证明了酶是蛋白质。
酵母发酵的产物,是 细胞内酶作用的结果
酒的酝酿
饴糖的制作 用麦曲含有的淀粉酶 将淀粉降解为麦芽糖
远古时代
豆类做酱
在霉菌蛋白酶作用下,豆类蛋白质水 解得豆酱和豆鼓,压榨后制得酱油
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
1857年 Pasteur提出 酒精发酵是 酵母细胞活 动的结果。
高效催化作用的蛋白质。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化酶的类别
水解酶 氧化还原酶
转移酶
生生物物催催化化酶酶
异构酶 裂合酶 合成酶
单纯酶
复合酶 大连民族学院生命科学学院
Prof. Dr. J.T. Liu
化学生物学 水解酶 hydrolase 水解酶可催化底物的加水分解反应。 主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。 如,脂肪酶(Lipase)催化的酯水解反应:
J.B.Sumner
J.H.Northrop
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
某些RNA有催化活性( ribozyme,核酶)
2人共同 获 1989 年诺贝 尔化学 奖。
Thomas Cech University of Colorado
at Boulder, USA
CH3CHCOOH NAD+ OH
CH3CCOOH NADH H+ O
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
转移酶 Transferase
• 转移酶可催化基团转移反应,即将一个底物分子的基团 或原子转移到另一个底物分子上。 如, 谷丙转氨酶催化的氨基转移反应。
CH3CHCOOH HOOCCH2CH2CCOOH
化学生物学
SUCCESS
THANK YOU
2019/5/2大7 连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
(2) 催化作用具有高效性:酶具有极高的催化效率。 相同条件下,以分子比表示: 酶(V)高于无酶(V)108 ~1020 倍 酶(V)高于普通催化剂(V)107 ~1013 倍
NH2
O
CH3CCOOH HOOCCH2CH2CHCOOH
O
NH2
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
异构酶 Isomerase
• 异构酶可催化各种同分异构体的相互转化,即催化底物 分子内基团或原子的重排过程。 如,6-磷酸葡萄糖异构酶催化的反应。
CH2OH O OH
化学生物学
第三章 生物催化 Chapter 3. Biocatalysis
大连民族学院生命科学学院 Prof. Dr. J.T. Liu 第四次课
化学生物学
Contents
1
生物催化的概述
2生物Biblioteka 化的作用机制3生物催化的应用
4
发展前景与展望
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
酶的作用特点
⑴ 对环境条件具有敏感性:酶易失活,要求的反应条 件温和,对环境条件敏感。
固氮酶
N2+6H++6e 常温、常压 2NH3
Fe
N2+3H2
2NH3
500℃,300大气压
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
OH
CH2OH
CH2OH
O OH
OH OH
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
裂合酶 Lyase
• 裂合酶可催化从底物分子中移去一个基团或原子形成 双键的反应及其逆反应。
• 主要包括醛缩酶、水化酶及脱氨酶等。 • 如, 延胡索酸裂合酶催化的反应。
HOOCHC CHCOOH + H2O
R COOCH2CH3 H2O RCOOH CH3CH2OH
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学 氧化还原酶 Oxidoreductase
• 氧化-还原酶可以催化氧化-还原反应。 • 主要包括脱氢酶(dehydrogenase)和氧化酶(Oxidase)。 • 如乳酸(Lactate)脱氢酶催化乳酸的脱氢反应。
化学生物学
生物催化的定义
WHAT IS biocatalysis? 什么是生物催化?
生物催化( biocatalysis )是利用生物催化剂(主要是 酶或微生物)来改变(通常是加快)化学反应速度的作 用。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
Sidney Altman Yale University New
Haven, CT, USA
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化剂的来源
8% 4%
微生物 动物 植物
88%
目前,少数生物催化剂是从动物肝脏或植物中提 取的,多数来自于微生物细胞。除真核生物和单细胞 酵母外,原核微生物是生物催化剂的主要来源。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化剂的分类
克隆酶、遗传修饰酶
蛋白质类: Enzyme
蛋白质工程新酶
生物催化剂 Biocatalyst
(天然酶、生物工程酶)
核酸类:Ribozyme ; Deoxyribozyme
模拟生物催化剂 核酶
……
脱氧核酶
Enzyme(酶)-是一类由活细胞产生,对特有底物具有
HOOCH2C CHCOOH OH
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
合成酶 Ligase or Synthetase • 合成酶,又称为连接酶,能够催化C-C、C-O、C-N 以
及C-S 键的形成反应。但这类反应必须与ATP分解反应 相互偶联。 • A + B + ATP + H-O-H ===A B + ADP +Pi • 如,丙酮酸羧化酶催化的反应。 丙酮酸 + CO2 草酰乙酸
1897年 Buchner兄 弟证明不含 细胞的酵母 汁也能进行 乙醇发酵。
1926年 Sumner首 次从刀豆 中提出脲 酶结晶。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
1930年 Northrop等得到了胃蛋白酶、胰蛋白酶和胰 凝乳蛋白酶的结晶。Sumner证明了酶是蛋白质。
酵母发酵的产物,是 细胞内酶作用的结果
酒的酝酿
饴糖的制作 用麦曲含有的淀粉酶 将淀粉降解为麦芽糖
远古时代
豆类做酱
在霉菌蛋白酶作用下,豆类蛋白质水 解得豆酱和豆鼓,压榨后制得酱油
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
1857年 Pasteur提出 酒精发酵是 酵母细胞活 动的结果。
高效催化作用的蛋白质。
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化酶的类别
水解酶 氧化还原酶
转移酶
生生物物催催化化酶酶
异构酶 裂合酶 合成酶
单纯酶
复合酶 大连民族学院生命科学学院
Prof. Dr. J.T. Liu
化学生物学 水解酶 hydrolase 水解酶可催化底物的加水分解反应。 主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。 如,脂肪酶(Lipase)催化的酯水解反应:
J.B.Sumner
J.H.Northrop
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
生物催化的产生与发展
某些RNA有催化活性( ribozyme,核酶)
2人共同 获 1989 年诺贝 尔化学 奖。
Thomas Cech University of Colorado
at Boulder, USA
CH3CHCOOH NAD+ OH
CH3CCOOH NADH H+ O
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
转移酶 Transferase
• 转移酶可催化基团转移反应,即将一个底物分子的基团 或原子转移到另一个底物分子上。 如, 谷丙转氨酶催化的氨基转移反应。
CH3CHCOOH HOOCCH2CH2CCOOH
化学生物学
SUCCESS
THANK YOU
2019/5/2大7 连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
(2) 催化作用具有高效性:酶具有极高的催化效率。 相同条件下,以分子比表示: 酶(V)高于无酶(V)108 ~1020 倍 酶(V)高于普通催化剂(V)107 ~1013 倍
NH2
O
CH3CCOOH HOOCCH2CH2CHCOOH
O
NH2
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
异构酶 Isomerase
• 异构酶可催化各种同分异构体的相互转化,即催化底物 分子内基团或原子的重排过程。 如,6-磷酸葡萄糖异构酶催化的反应。
CH2OH O OH
化学生物学
第三章 生物催化 Chapter 3. Biocatalysis
大连民族学院生命科学学院 Prof. Dr. J.T. Liu 第四次课
化学生物学
Contents
1
生物催化的概述
2生物Biblioteka 化的作用机制3生物催化的应用
4
发展前景与展望
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
化学生物学
酶的作用特点
⑴ 对环境条件具有敏感性:酶易失活,要求的反应条 件温和,对环境条件敏感。
固氮酶
N2+6H++6e 常温、常压 2NH3
Fe
N2+3H2
2NH3
500℃,300大气压
大连民族学院生命科学学院 Prof. Dr. J.T. Liu
