模式植物拟南芥T-DNA插入突变体的鉴定
T-DNA插入鉴定实验报告

T-DNA插入突变体的鉴定时明辉同组者:薛敏学号:201000220069摘要 Ti质粒是上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移进植物细胞,并插入植物染色体DNA中。
所以Ti质粒上的这一段能转移的DNA被叫做T-DNA。
将感兴趣的基因改造插入到T-DNA区段中,通过农杆菌侵染植物细胞,实现外源基因对植物的遗传转化,得到含有突变的植株。
通过本实验,我们将学习如何用PCR的方法检测所得植株是否为T-DNA的插入突变体。
1.引言T-DNA作为一种实验常用的遗传转化方法,在插入突变过程中,插入到植物染色体上的位置是随机的。
如果T-DNA插入进某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中,有T-DNA 插入的纯合突变体,杂合突变体,和野生型。
在突变体研究中,需要的材料是纯合突变体,所以必须从分离群体中将纯合突变体鉴定出来。
本次实验中,采用液CTAB(或者TSP法)提取拟南芥植株的DNA,然后PCR将所获DNA扩增,在之后采用琼脂糖凝胶电泳技术,分离处长度不一的DNA带,以确定样品是否为T-DNA插入突变纯和体。
PCR(Polymerase ChainReaction),即聚合酶链式反应是体外核算扩增技术,具有特异、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至百万倍,使肉眼能直接观察和判断。
(PCR基本原理如右图)DNA含有PO43-基团,在pH8.0 Buffer(本实验中为TAE)中带负电, 在电场中向正极移动。
自由电泳时,由于不同大小的DNA片段的电荷密度大致相同,各核酸分子难以分开;选用适当浓度的琼脂糖凝胶作为支持物,使之具备一定的孔径,即可发挥分子筛效应,使大小不同的核酸片段迁移率出现较大差异,达到分离的目的;同样条件对Marker电泳;起到鉴定的作用。
拟南芥TDNA插入突变体的鉴定

遗传学实验报告拟南芥T-DNA插入突变体的鉴定一、实验目的:1、学习和掌握基本的植物DNA的CTAB提取法,掌握PCR、琼脂糖凝胶电泳等基本实验操作技能2、了解T-DNA插入突变体的鉴定原理,掌握其方法。
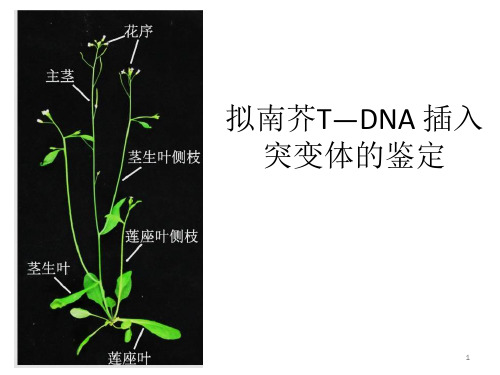
二、实验原理1、拟南芥(Arabidopsis thaliana)十字花科,植物遗传学、发育生物学和分子生物学的模式植物。
植株形态个体小,高度只有30cm左右;生长周期快,从播种到收获种子一般只需8周左右;种子多,每株可产生数千粒种子;形态特征简单,生命力强,用普通培养基就可作人工培养;遗传转化简单,转化效率高;基因组小,只有5对染色体,125MB;在2000年,拟南芥成为第一个基因组被完整测序的植物。
2、突变体突变体是遗传学研究的最重要材料。
突变体可以通过自然突变和人工诱变的方法获得。
拟南芥诱变常用方法有EMS诱变、T-DNA插入突变、激活标签。
由于T-DNA插入突变体便于对突变基因进行追踪,目前拟南芥、水稻中已经有大量的T-DNA插入突变体;SALK中心提供的拟南芥T-DNA插入突变体超过十万种。
3、T-DNA插入突变原理T-DNA,转移DNA(transferred DNA ),是根瘤农杆菌Ti质粒中的一段DNA序列,可以从农杆菌中转移并稳定整合到植物基因组。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
除用于转基因以外,T-DNA插入到植物的基因中可引起基因的失活,从而产生基因敲除突变体,T-DNA大多为单拷贝插入,使其利于进行遗传分析。
4、T-DNA插入突变体PCR鉴定图 1 结果鉴定图 2 PCR引物设计三、实验材料1、材料:T-DNA插入的突变拟南芥植株;2、仪器:离心管,离心机,水浴锅,移液枪,PCR仪,电泳槽等;3、试剂:液氮,CTAB提取液,氯仿/异戊醇(24:1),无水乙醇,70%乙醇,10xTaq buffer,MgCl2,引物,琼脂糖,溴化乙锭(EB)。
拟南芥T-DNA插入突变体的鉴定

拟南芥T-DNA插入突变体的鉴定09生工吴超 200900140129一、实验原理T-DNA插入法是反向遗传学研究的重要手段。
T-DNA是农杆菌的一个大质粒,长度在25kb左右。
野生型农杆菌的T-DNA上带有激素合成基因,感染植物后会导致植物细胞快速增殖形成愈伤组织,失去分化能力。
所以一般实验使用改造后的农杆菌——T-DNA中导入了卡那霉素抗性基因和抗除草剂基因。
因此在农杆菌感染植物后可用除草剂来筛选转化子。
在转化子培养到F2代出现分离后,就需要对其基因型进行鉴定。
T-DNA插入突变体鉴定方法主要有两种:三引物法和双引物法。
在本实验中使用三引物法。
三引物法的原理如图1所示,即采用三引物(LP、RP、BP)进行PCR扩增。
野生型植株目的基因的两条染色体上均未发生T-DNA插入,所以其PCR产物仅有1种,分子量约900bp(即从LP到RP);纯合突变体植株目的基因的两条染色体上均发生T-DNA插入,T-DNA本身的长度约为25kb,过长的模板会阻止目的基因特异性扩增产物的形成,所以也只能得到1种以BP与LP或RP为引物进行扩增的产物,分子量约为400-700bp;杂合突变体植株只在目的基因的一条染色体上发发生了T-DNA插入,所以PCR扩增后可同时得到两种产物。
上述3种情况的电泳结果差异明显,能有效区分不同基因型的植株。
此法优点是可同时鉴定出纯和突变体并确证T-DNA的插入情况。
图1 T-DNA插入示意图CATB,即十六烷基三甲基溴化铵,是一种离子型表面活性剂。
能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来。
并且CATB可在高离子强度的溶液里与蛋白质和大多数多聚糖形成复合物进而形成沉淀,但不沉淀核酸。
本实验使用CATB抽提DNA。
聚合酶链式反应(Polymerase Chain Reaction,PCR)是体外核酸扩增技术。
它具有特异性高、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至几万倍,使肉眼能直接观察和判断。
拟南芥TDNA插入突变
• 器材:离心机,离心管,PCR仪,点泳池,电泳现 象仪
(3)筛选纯和突变体 实验原理
双引物法
• 与“三引物法” 本质相同。 首先以基因组 D N A作为模板,用一对特异引物(LP和RP)扩增 目的基因片段,野生型和突变杂合体均一条带,纯合突变体 没有条带;然后再以基因组DNA 为模板,由T-DNA 片段的特异 引物(LB)与LP 或RP 组成一对引物,扩增目的基因T-DNA 插入 片,野生型没有条带,杂合体和纯合体一条410+N。 不足之处是完成最终鉴定需进行两轮P C R 扩增。
19
(3)筛选纯合突变体
实验方案设计
查看含有相关基因的种子信息
20
(3)筛选纯合突变体
实验方案设计
引物设计
21
(3)筛选纯合突变体
实验方案设计
中间引物的设计
22
(3)筛选纯合突变体
实验方案设计
两侧引物的设计
23
(3)筛选纯合突变体
2、实验材料
• 赤霉素糖基转移酶基因的T-DNA插入突变种子:
The complex that comprises of the T-DNA bound to the binding protein then moves into the nucleus and is integrated into the nuclear genome.
7
2、反向遗传学的重要手段——T-DNA插入突变技术
拟南芥T-DNA插入突变纯合体的鉴定

拟南芥T-DNA插入突变纯合体的鉴定余振洋(高山山、潘红芳)、09级生技1班、200900140156、2011/12/14摘要本实验通过CTAB法提取目的拟南芥的DNA,再用三引物法PCR扩增所需的目的基因后,用电泳检测该拟南芥是否为转基因的拟南芥,并判断其是纯合突变还是杂合突变。
关键词拟南芥;T-DNA;突变纯和体1.引言T-DNA是根癌农杆菌Ti质粒上的一段DNA序列,它能稳定地整合到植物基因组中并稳定地表达。
T—DNA在植物中一般都以低拷贝插入,多为单拷贝。
单拷贝T-DNA一旦整合到植物基因组中,就会表现出孟德尔遗传特性,在后代中长期稳定表达,且插入后不再移动,便于保存。
T—DNA插入突变在反向遗传学和功能基因组学研究中发挥着重要作用。
,T—DNA插入突变能方便地进行正向和反向遗传学研究,因而受到重视。
同时,基因组测序工作的完成使得从位点到表型的反向遗传学研究成为可能,从而使通过T—DNA插入技术构建突变体来研究功能的反向遗传学技术逐渐取代了传统的化学诱变、图位克隆等技术。
借助于农杆菌介导的遗传转化技术,T—DNA插入技术已被广泛应用于拟南芥等模式植物的突变体库构建中。
以T—DNA作为插入元件,不但能破坏插入位点基因的功能,而且能通过插入产生的功能缺失突变体的表型及生化特征的变化,为该基因的研究提供有用的线索。
由于插入的T—DNA序列是已知的,因此可以通过已知的外源基因序列,利用反向PCR、TAIL-PCR、质粒挽救等方法对突变基因进行克隆和序列分析,并对比突变的表型研究基因的功能。
还可以利用扩增出的插入位点的侧翼序列,建立侧翼序列数据库,对基因进行更全面的分析。
由此可见,T—DNA 插入标签技术已成为发现新基因、鉴定基因功能的一种重要手段。
CTAB法提取植物叶片中的DNA是我们常用的方法。
通常采用机械研磨的方法破碎植物的组织和细胞,由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性。
拟南芥atcwinv1基因T_DNA插入纯合突变体PCR鉴定及表型观察

河南农业科学,2011,40(5):62 66Jour nal of H enan Ag ricultural Sciences拟南芥atcwinv1基因T DNA插入纯合突变体PCR鉴定及表型观察阮燕晔*,张 莹,王 波(沈阳农业大学生物科学技术学院,辽宁沈阳110866)摘要:以拟南芥atcw inv1基因T DNA插入纯合突变体和野生型植株为材料,比较研究了2种基因型植株在营养期和生殖期的形态差异。
结果表明:拟南芥atcw inv1基因T DNA插入纯合突变体(简称突变体)较野生型萌发率平均下降5 88个百分点;突变体在44d抽薹,较野生型延后4d;分支数平均4支,较野生型下降20 84%;果荚开裂时间6d左右,较野生型延长2d;单株果荚数平均62 27个,较野生型降低11 00%;单株果荚种粒数平均45 87粒,较野生型降低21 46%;突变体的单果荚长度平均14 52cm,较野生型降低10 24%;单株果质量平均50 83mg,较野生型降低23 70%。
拟南芥突变体在营养生长时期的株高平均10 44cm,较野生型下降21 03%;主根长平均7 62cm,较野生型下降14 96%;单株莲座叶面积平均3 16cm2,较野生型下降13 90%;单株地上部分鲜质量平均81 81m g,较野生型下降11 11%;单株根鲜质量平均6 21m g,较野生型下降17 64%;单株地上部分干质量平均6 17m g,较野生型下降15 60%;单株根干质量平均0 55mg,较野生型下降6 78%。
拟南芥突变体在生殖生长时期的株高平均18 78cm,较野生型增加4 22%;主根长平均16 48cm,较野生型下降5 88%;单株莲座叶面积平均6 80cm2,较野生型下降6 21%;单株地上部分鲜质量平均129 85mg,较野生型下降9 69%;单株根鲜质量平均9 97mg,较野生型下降13 23%;单株地上部分干质量平均9 22mg,较野生型下降4 16%;单株根干质量平均0 70mg,较野生型下降6 67%。
实验十、模式植物拟南芥T-DNA插入突变体的鉴定-23页精选文档

模式植物拟南芥
拟南芥(Arabidopsis thaliana )又称为阿拉伯芥,是一种十字花 科植物,广泛用于遗传、发育和分子生物学的研究,已成为一种典 型的模式植物。该植物具有以下特点:
植株形态个体小,高度只有30cm左右,1个茶杯可种植好几棵; 生长周期快,每代时间短,从播种到收获种子一般只需8周左右; 种子多,每株可产生数千粒种子; 形态特征简单,生命力强,用普通培
养基就可作人工培养; 基因组小,只有5对染色体。 拟南芥是严格的闭花自花受粉植物,
基因高度纯合。易获通过理化处理 获得各种功能的突变体。
外成像仪
实验步骤-拟南芥的栽培
一.在播种前将种子进行消毒,然后置于4℃冰箱中,使 种子在湿润条件下春化2至3天。
二.将春化好的种子播种于有麦氏培养基(MS培养基)的 培养皿中,置于培养室内培养。
三.待幼苗长出后,再选择茁壮的幼苗移栽到土壤中,置 于培养室内培养。
实验步骤-拟南芥T-DNA插入突变体PCR鉴定法
1. CATB法提取DNA:液氮、2×CTAB抽提缓冲溶液、氯仿:异戊醇 =24:1、无水乙醇、70%乙醇、TE
2. PCR:ddH2O、Buffer、MgCl2、dNTP、引物(LP、RP、BP) 、DNA模版、Taq DNA聚合酶
3. 电泳:琼脂糖、Maker、Buffer、EB、TAE
❖ 仪器:离心机,水浴锅,移液器,PCR仪,电泳槽,紫
每小组按10倍准备混合体系; 每个同学需做一颗植株的鉴定(两管PCR)。
LP: JDM17-1NR2 RP: JDM17-1F2 BP: LBb1.3
拟南芥突变体的筛选与鉴定综述

本科生文献综述题目拟南芥突变体的筛选综述系别林学与园艺学院班级园艺102班姓名唐辉学号103231228答辩时间年月新疆农业大学林园学院拟南芥突变体的筛选综述唐辉指导老师:王燕凌摘要:本文归纳了拟南芥抗旱、抗氧化、耐低钾、耐硒、耐盐、晚花突变体筛选的研究内容。
在拟南芥抗旱突变体筛选中将用到甘露醇模拟干旱胁迫来进行试验。
在抗氧化、耐低钾、耐硒中将用到Na2SeO3、钾、硒、NaCl等化合物或者化学元素对拟南芥突变体的生长发育影响来进行拟南芥突变体的筛选。
概括了拟南芥突变体在甘露醇模拟干旱中的生长影响以及拟南芥突变体在抗氧化、耐低钾、耐硒、耐盐等逆境环境中生长研究方面的观点。
总结了拟南芥突变体在先如今人们研究中常用的几种筛选方法,指出了拟南芥突变体筛选的研究需求,并提出筛选拟南芥抗逆突变体的重要意义。
关键词:拟南芥;突变体;筛选;研究Screening Summary of Arabidopsis MutantsTang Hui Instructor:Wang YanlingAbstract: This paper summarizes the Arabidopsis drought, oxidation resistance, low potassium, selenium-resistant, salt, late-flowering mutants creening research.And detailed exposition of the various materials and processes Arabidopsis mutants creening methods needed in the screening process.In the anti-oxidation, anti-potassium, selenium resistance will be used Na2SeO3, potassium, selenium, NaCl chemical elements or compounds such mutations affect thegrowth and development of the body to be screened Arabidopsis thaliana mutants.Thus summarizes the growth of Arabidopsis mutants mannitol and simulated drought in Arabidopsis mutants in anti-oxidation, anti-potassium,selenium resistance point of view, salt and other adverse environments grow research.Arabidopsis mutants summarized earlier research that people now commonly used inseveral screening methods, pointed out the Arabidopsis mutant screening research needs and the importance of screeningproposed resilience of Arabidopsis mutants.Key words: Arabidopsis;Mutant;Filter;Research拟南芥(Arabidopsis)为十字花科(Cruciferous)、拟南芥属(Brassicaceae、Arabidopsis)一年生或二年生的细弱草本植物。
拟南芥突变体的功能鉴定及应用

拟南芥突变体的功能鉴定及应用拟南芥是一种模式植物,因其具有小型、短周期、基因底子丰富等特点,成为了植物学和遗传学领域的研究工具。
通过突变体的筛选,拟南芥成为了研究植物生长发育和基因功能的重要模式植物之一。
在拟南芥突变体筛选中,以T-DNA插入技术为主,通过敲定不同基因,以观察植物的生长发育状态,挖掘新的生物学机制。
拟南芥突变体是利用突变体筛选技术,自然形成的或通过基因操作人工获得,产生了某些特殊表型的植物。
以T-DNA插入技术为例,将T-DNA随机插入到植物基因组中,导致部分基因的功能紊乱,从而产生了特殊的表型表现。
因此,拟南芥突变体不仅具有丰富的基因型资源,也是研究基因功能、分子生物学和植物生长发育的重要材料,其发现和应用有直接联系。
因此,如何鉴定拟南芥突变体的功能尤为重要。
目前鉴定方法主要包括:表型分析、基因克隆、启动子分析、蛋白质相互作用网络分析、分子标记等技术手段。
表型分析是首先考虑的鉴定方法,通过比较突变体与野生型在不同生长条件下的表型差异,筛选出表现异常的突变体。
对鉴定有难度的突变体,使用其他鉴定方法,如基因克隆,会有更好的效果。
其中,启动子元素克隆有助于探究基因表达特异性。
蛋白质相互作用网络分析有用于探究基因调控网络方式。
分子标记在表型特征不明显时,如果phentoype特征无法激活突变体,可以发现突变原因及搜索对应的遗传切口。
同时,拟南芥突变体在研究中的应用也非常广泛。
例如:研究花器官发育中的关键基因,通过拟南芥突变体突变鉴定方法,筛选出相关基因,进而探究开花的分子机制。
利用拟南芥突变体进行耐盐性、耐旱性等方面的研究。
在探究植物防御基因的调节网络时,拟南芥突变体也广泛地使用。
此外,还可用作药物和环境污染物筛选的生物传感材料,如zinc、生物染色体修复等方面的研究。
拟南芥突变体是全面了解植物生物学机理的重要材料,是揭示生长发育和基因功能的主要途径之一。
随着逆境应对、营养吸收、发育调控等方向的研究的深入,对拟南芥突变体的催生和应用必将愈加广泛。
模式植物拟南芥T-DNA插入突变体的鉴定

模式植物拟南芥T-DNA插入突变体的鉴定摘要:通过本次实验,了解了拟南芥T-DNA插入突变体鉴定的原理,掌握了DNA提取技术、PCR技术以及电泳鉴定技术,对拟南芥的基因型做出判断。
实验首先提取拟南芥的DNA,将获得的DNA进行PCR扩增,将扩增好的DNA加入上样缓冲液后与DNAmarker一起进行电泳,用凝胶成像系统对凝胶进行处理,可以看到大小不同的DNA条带分离。
通过这种方法鉴定出拟南芥是否为突变体。
关键词:T-DNA插入突变体、DNA提取、PCR、电泳鉴定、凝胶成像系统1.前言拟南芥作为生物学研究的模式植物,由于其易于种植、生活周期短、遗传背景清晰、易于转基因操作等特点,已被广泛应用于植物学的各种基础和应用研究领域中。
同时,拟南芥T—DNA饱和突变体库的建立和T-DNA侧翼序列的确定,为功能基因组学提供了丰富、有效的遗传材料。
2.实验2.1实验目的(1)提取植物基因组DNA的方法;(2)PCR操作方法;(3)琼脂糖凝胶分离核酸方法。
2.2实验原理Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移进植物细胞,并插入植物染色体DNA中。
所以Ti质粒上的这一段能够转移的DNA被叫做T-DNA。
将Ti质粒进行改造,将感兴趣的基因放进T-DNA区段中没通过农杆菌侵染植物细胞,实现外源基因对植物的遗传转化。
T-DNA插图到植物染色体上的什么位置,是随机的。
如果T-DNA插入进某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
用PCR方法鉴定T-DNA插入船和突变体。
农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体汇总,有T-DNA插入的纯合突变体,杂合突变体和野生型。
在突变体研究中,需要的材料是纯合突变体,所以必须从分离群体中将纯合突变体鉴定出来。
“三引物法”的原理如图1所示,即用三种引物(LP、BP、RP)进行PCR扩增,野生型植株目的基因的两条染色体上均为发生T-DNA插入,所以其PCR产物仅有一种,分子量约为900bp(即从LP到RP);纯合突变体植株目的基因的两条染色体上均发生T-DNA插入,而T-DNA 本身的长度约为17kb,过长的模版会阻抑目的基因特异扩增产物的形成,所以也只能得到1种以LB与LP(或RP)为引物进行扩增的产物,分子量约为410+N bp(即从LP或RP到T-DNA 插入位点的片段),长度为300+N bp,再加上从LB到T-DNA载体左边界的片段,长度为110bp);杂合突变体植株只在目的基因的一条染色体上发生了T-DNA插入,所以PCR扩增后可同时得到410+N bp和900bp两种产物。
实验五 拟南芥T DNA插入突变纯合体的鉴定

一ml 一三五 三’引物[一0 mmol/L] 一ml 一三五 三’引物[一0 mmol/L]
三0ml反应体系二:
三0ml反应体系四:
二ml 植物基因组DNA样品[WT]
二ml 植物基因组DNA样品[一一一]
三ml 一0×扩增缓冲液
三ml 一0×扩增缓冲液
0.五 ml Taqase [五U/ml]
0.五 ml Taqase [五U/ml]
0.五 ml dNTP[一0 mmol/L]
0.五 ml dNTP[一0 mmol/L]
一ml 一三五 三’引物[一0 mmol/L] 一ml 一三五 三’引物[一0 mmol/L]
一ml LBa 引物[一0 mmol/L]
一ml LBa 引物[一0 mmol/L]
电泳检测
• 每个大组选两个人点样,电泳结果扫描保存, 下次课看结果,
• LBa一 of pBIN-pROK二 for SALK lines: TGGTTCACGTAGTGGGCCATCG
植物基因组DNA的快速提取
[一]取植物叶片[拟南芥一片叶子],置于一.五ml离心管中,加入四00 ml提取缓冲液;
[二]用研磨棒研磨植物材料,直至缓冲液变为绿色; [三]在台式离心机上一三000 rpm离心五分钟; [四]离心后将上清三00 ml转移至一个新的一.五 ml离心管中; [五]在上清中加入三00 ml异丙醇,混匀后于室温下一三000 rpm条
用无菌水补足体积,
PCR反应条件
八四℃ 三min 三0循环 [八四℃/一min,五五℃/一min,七二℃/一min]; 七二℃ 延伸一0min,
注:反应条件需根据所要扩增产物的大小和 引物的性质进行合适的调整,
PCR安排
拟南芥基因突变体研究及其分子机理分析

拟南芥基因突变体研究及其分子机理分析拟南芥是一种重要的模式植物,在基因突变体研究中发挥着重要的作用。
本文将从拟南芥基因突变体的定义、研究方法、重要性以及其分子机理等方面进行探讨和分析。
一、拟南芥基因突变体定义及研究方法基因突变体是指在基因序列中发生变异的个体,与野生型(WT)相比,基因突变体的表型有明显的差异。
拟南芥基因突变体是以拟南芥(Arabidopsis thaliana)为材料的基因突变研究。
它具有许多优秀的特性,如短生命周期、小型体型、遗传变异多样化和基因功能高度保守等。
目前,拟南芥基因突变体的研究方法主要分为化学诱变、遗传转化和基因编辑。
其中,化学诱变是通过化学物质引起基因突变,常用的化学物质有Ethyl methane-sulfonate (EMS)和Sodium azide (NaN3)等。
遗传转化是利用外源DNA片段引入目标基因,达到基因敲入/敲除的目的。
基因编辑则是指利用CRISPR/Cas9等基因编辑技术对目标基因进行精准的编辑,从而实现目的基因的敲入/敲除。
这些方法的优缺点各有不同,可以根据实验目的和条件选择适宜的研究方法。
二、拟南芥基因突变体的重要性拟南芥基因突变体研究有着重要的科研意义和现实意义。
首先,拟南芥是植物领域中最具代表性的模式植物之一,研究拟南芥基因突变体可以为解析生物分子机理和育种提供重要的理论依据。
其次,拟南芥基因突变体的发现对研究复杂性状、生长发育和环境响应等现象起着重要作用,同时也对人类生命健康、农业生产、环境保护等方面具有深远的影响。
三、拟南芥基因突变体分子机理分析拟南芥基因突变体分子机理分析是对基因突变体的表型变化进行解析的过程。
在基因突变体的研究中,通常采用遗传学、生物化学和分子生物学等多种技术手段进行深入研究。
遗传学方法主要包括染色体显微镜观察、连锁分析、基因定位和基因组学分析等。
在染色体显微镜观察中,通过观察细胞染色体数目、形状、大小和染色体带的特点,可以发现染色体异常和染色体突变。
t-DNA鉴定ppt课件

0.5ul 2ul
0.2ul
21
反应程序
PCR由变性--退火--延伸三个基 本反应步骤
变性— 退火— 延伸—
预变性94℃ 94℃ 53℃ 72℃ 循环35次
5min 40sec 50sec 80sec
72℃
10min
22
• LP • TCATCCACCATGG
AAGAAAAG • RP • TTGGATACGATGC
17
如何选择最合适的DNA聚合酶 -- DNA 聚合酶的特性
纯度 稳定性 酶活性
18
• 反应体系
H2O
10xTaq buffer (MgCl2free)
MgCl2 (25mM)
引物LP (10 uM)
•
引物RP (10 uM)
引物BP (10 uM)
dNTP (各2.5mM)
模板DNA(30-50ng/μl)
13
PCR标准反应体系
• DNA模板 • 引物 • 反应缓冲液 • dNTP • ddH2O • 耐热聚合酶
14
反应体系对PCR扩增的影响
DNA模板
•纯度 蛋白、多糖、酚类等杂质会抑制PCR反应 •完整性 模板降解会导致PCR扩增无产物 •浓度 加量过多导致非特异性扩增增加
引物
•特异性 长度适当、避免二级结构和二聚体 •完整性 避免反复冻融 •浓度 应适当,过高导致非特异性增加,过低则
Taq酶(5U/μl )
19
反应体系(三引物体系)
25ul体系
H2O
15ul
10xTaq buffer (MgCl2free) 2.5ul
MgCl2 (25mM)
2ul
引物LP (10 uM)
拟南芥β-罗勒烯合成酶基因T-DNA插入突变体的鉴定

2 ‘ 置 2 n ,400rm 离 心 1 n 吹干 , 于 0C放 0mi)1 0 p 0mi, 溶
灭菌 的超 纯水 中后作 为 P R扩增 的 D C NA模 板 。
1 2 3 DNA 的 P R 扩 增 . . C
相 似 基 因组 成 的 家 族 命 名为 At P T S家 族 。 t PS 3 A T 0
1 2 2 单株 植物 总 DNA 提取 ..
类 化 合物 都 具 有 环状 结 构 。单 萜 合酶 分 布 于 TP — , Sb
TP — , P — 和 T S g4个 亚家 族 。单 萜 合酶 基 因表 Sd T Sf P — 达 受 生物 钟 调节 , 表达 量 随 昼 夜周 期 交替 变换 而 出现
f罗勒烯 (-cmee 是 近 年 来 发 现 的 , 植 物 防 } -  ̄oi n ) 与 御 相 关 的 植 物 通 讯 (ln—o pa tcmmu i t n) 号 分 nc i 信 ao 子 [, 自然 界 中包 括 两 个 同分 异 构 体 : 式一 勒 1在 ] 顺 罗
烯 ( i一 c n c  ̄o i e)和 反 式一- 勒 烯 ( rn — s me f罗 }  ̄a s o i n ) 罗勒 烯 是 一 种 单 萜 ( n tre e ) 合 c me e 。 mo oep n s 化
su yterl o  ̄o i n c a i td oe f c h me emeh ns h moy o smua t i -c n y tae e eepes nse c s b o . m・ o zg u tn t oi esnh s n x rsi i nemu t eg t w h ̄ me g o l
R 0 1 L, d H2 补 足至 1 L。 . 用 d O 5
从拟南芥的T0123代获得纯合株系转基因必经之路

从拟南芥的T0123代获得纯合株系转基因必经之路作为模式生物,拟南芥(Arabidopsis thaliana)主要有以下几方面的优势:第一,拟南芥的基因组在常见的植物模型中是最小的,染色体数目也很少,只有五对同源染色体。
第二,植株体积小,对环境的适应性强,生活周期短,繁殖能力强,播种到收种需要两个月左右。
第三,自然条件下,拟南芥是严格的闭花自花传粉,基因高度纯合,易稳定遗传,强可诱变性。
第四,拟南芥研究的相关遗传手段和生化分子技术都已经比较成熟。
第五,丰富的种质资源。
运用高通量转化技术得到的T-DNA插入的突变体库,已经鉴定的独立的T-DNA插入株,几乎覆盖了所有的编码基因。
健康生长的时候还是蛮可爱的获得转基因拟南芥T0代:日常使用浸花法(floral dip method)(Clough等,1998)转化拟南芥。
将拟南芥的花序放到含有农杆菌的转化介质中浸泡3~5分钟,在转化介质的帮助下,农杆菌可以穿过植物细胞壁和质膜,侵染雌配子体即胚囊,并将带有目的基因和元件的T-DNA片段整合到雌配子的基因组上(Desfeux等,2000; Bent A, 2023)。
T1T2T3获得纯合株系:1.野生型拟南芥,称为T0代,经过侵染之后,而从T0代上收集到的种子是T1代种子(混合收种)2.将T1代种子铺种在含有抗生素的MS培养基上,直接筛选出转基因T1代阳性的幼苗,移栽到穴盘,悉心呵护,收集到T2代种子(单株收种)。
需要注意的是,T1代均为杂合子,但是并不确定是单拷贝或是多拷贝插入。
3.将T2代种子铺种在含有抗生素的MS培养基上,此时阳性苗:阴性苗(未发芽的种子不计入)如果符合3:1的分离比,则目的基因以单拷贝插入,将其中的阳性苗移栽,同样悉心呵护,收集T3代种子(单株收种)。
不符合3:1则可能有多个拷贝插入不同位点(多拷贝插入往往会引起基因沉默现象,扔了算了)。
4.将T3代种子铺种在含有抗生素的MS培养基上,一段时间之后,你发现一些培养皿里全是阳性苗,恭喜!你拿到了自己的转基因纯合株系。
拟南芥

姓名沈一鸣班级生技3班同组人无科目遗传学实验题目拟南芥T-DNA插入突变体的鉴定组别无—————————————————————————————————————————————————————一、实验目的1. 学习用PCR方法检测生物遗传差异;2. 了解植物T-DNA插入突变体的鉴定原理。
二、实验原理拟南芥(Arabidopsis thaliana):十字花科,植物遗传学、发育生物学和分子生物学的模式植物拟南芥特点:1)植株形态个体小,高度只有30cm左右;2)生长周期快,从播种到收获种子一般只需8周左右;3)种子多,每株可产生数千粒种子;4)形态特征简单,生命力强,用普通培养基就可作人工培养;5)遗传转化简单,转化效率高;6)基因组小,只有5对染色体,125MB;7)在2000年,拟南芥成为第一个基因组被完整测序的植物突变体是遗传学研究的最重要材料。
自然突变突变体的获得人工诱变拟南芥诱变常用方法:EMS诱变、T-DNA插入突变、激活标签由于T-DNA插入突变体便于对突变基因进行追踪,目前拟南芥、水稻中已经有大量的T-DNA插入突变体;SALK中心提供的拟南芥T-DNA插入突变体超过十万种。
T-DNA插入突变原理:Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移,插入植物染色体DNA中,Ti质粒上的这一段能转移的DNA被叫做T-DNA(transferred DNA )。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
T-DNA插入到植物染色体上的什么位置,是随机的。
如果T-DNA插入某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
T-DNA大多为单拷贝插入,使其利于进行遗传分析。
用PCR方法鉴定T-DNA插入纯合突变体:农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中,有T-DNA插入的纯合突变体,杂合突变体,和野生型。
拟南芥mapkkk15突变体的鉴定及非生物胁迫下的功能分析

热带作物学报2021, 42(9): 2494 2500 Chinese Journal of Tropical Crops收稿日期 2020-07-23;修回日期 2020-09-03基金项目 国家重点研发计划项目“橡胶树抗寒高产品种改良”(No. 2019YFD1001102);国家自然科学基金项目(No. 31870646)。
作者简介 梁 群(1993—),女,硕士,研究方向:作物遗传育种。
*通信作者(Corresponding auther ):程 汉(CHENG Han ),E-mail :******************。
拟南芥mapkkk15突变体的鉴定及非生物胁迫下的功能分析梁 群1,2,邓 治2,雷柯煜1,2,黄华孙2,安泽伟2,程 汉2*1. 海南大学热带作物学院,海南海口 570228;2. 中国热带农业科学院橡胶研究所,海南海口 571101摘 要:低温寒害是制约我国天然橡胶种植的最主要的环境限制因子,阐明橡胶树抗逆机制有助于保障天然橡胶的种植安全。
前期研究发现1个低温诱导的橡胶树MAPKKK 基因参与橡胶树抗寒能力调控,序列比对发现该基因与拟南芥MAPKKK15基因同源,但AtMAPKKK15的功能仍不清楚。
通过对拟南芥MAPKKK15基因功能的研究,揭示该类基因在植物逆境胁迫应答中的作用,将有助于进一步解析橡胶树MAPKKK 基因的功能。
本研究从DNA 和转录水平鉴定拟南芥mapkkk15纯合突变体植株,评价mapkkk15突变体低温和干旱胁迫抗性。
结果显示:低温抑制AtMAPKKK15基因表达。
对2个mapkkk15纯合缺失突变体进行分析,发现与野生型植株相比,mapkkk15突变体植株的抗冻存活率提高,电解质渗漏率下降。
脱水实验表明,突变体叶片脱水率要高于野生型。
上述结果表明,AtMAPKKK15基因在拟南芥中可能反向调控抗寒性,正向调控抗旱性。
关键词:mapkkk15突变体;拟南芥;非生物胁迫;功能鉴定;橡胶树 中图分类号:S961.6 文献标识码:AIdentification of mapkkk15 Mutant from Arabidopsis and Function Analysis to Abiotic StressLIANG Qun 1,2, DENG Zhi 2, LEI Keyi 1,2, HUANG Huasun 2, AN Zewei 2, CHENG Han 2* 1. College of Tropical Crops, Hainan Unviersity, Haikou, Hainan 570228, China; 2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, ChinaAbstract: Abiotic stress severely affects the natural rubber yield in China, so it is necessary to clarify the resistant mechanism of rubber tree to improve natural rubber yield. In previous studies, we found that a MAPPKKK was induced by low temperature in rubber tree. Sequence alignment showed that HbMAPKKK was homologous with MAPKKK15 from Arabidopsis . However, the function of AtMAPKKK15 is unclear. Function of AtMAPKKK15 was identified in re-sponding to stress and provide theoretical basis for further elucidating the function of MAPKKK in rubber tree. The homozygous T-DNA insertion mutants of AtMAPKKK15 were identified at DNA and transcription level, and evaluated resistance under low temperature and drought treatments. The results showed that the expression of AtMAPKKK15 was inhibited by low temperature. Two homozygous null mutants of MAPKKK15 were obtained from Arabidopsis . The mapkkk15 mutant improved low temperature tolerance by increasing survival and decreasing electrolyte leakage com-pared with the wild-type. However, the dehydration ration of mutant leaves increased with the extension of in vitro time. The results indicate that MAPKKK15 negatively regulated tolerance to low temperature and postively regulated resisi-tance to drought.Keywords: mapkkk15 mutant; Arabidopsis thaliana ; abiotic stress; function identification; Hevea brasiliensis DOI: 10.3969/j.issn.1000-2561.2021.09.008All Rights Reserved.第9期梁群等: 拟南芥mapkkk15突变体的鉴定及非生物胁迫下的功能分析 2495植物在整个生长发育过程中不可避免的会遭受低温、干旱和高盐等非生物胁迫危害,导致作物品质及产量下降。
模式植物拟南芥TDNA插入突变体的鉴定

T-DNA插入到植物染色体上的位置是随机的。如果T-DNA插入某个功 能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。利用 农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
2012.11.28
4
模式植物拟南芥
拟南芥全部基因组测序已经完成,每个单倍染色体组 (n=5)的总长只有7000万个碱基对(只有小麦染色 体组长的1/80),预测共有29,454个基因。这样科 学家就可以准确定位插入DNA的位置。
DIFF_TM 0.55 LP TCTAGGAAATCGATCGGGTTC
Len 21 TM 60.40 GC 47.62 SELF_ANY_COMPL 0.55
3'_COMPL 0.00 RP GAGAGCATGTAAGGATGCTGG
Len 21 TM 59.85 GC 52.38 SELF_ANY_COMPL 0.55
模式植物拟南芥T-DNA插 入突变体的鉴定
201L2.O11G.2O8
目录
实验设计思路和原理
拟南芥的栽培
拟南芥T-DNA插入突变体 的PCR鉴定
2012.11.28
1
实验设计的思路和原理
经典遗传学是从生物的性状、表型到遗传物质来研
究生命的发生与发展规律。
反向遗传学则是是在获得生物体基因组全部序列的
打开NCBI主页: http://www.ncbi.nl / 打开的页面如下: 在上面的search内查找 基因名称APETALA1:
从上面可以看到一共有19 个结果,其中第一个是拟 南芥中的,点击AP1:
根据上面的信息我们可以
得到基因在拟南芥内的系
统名称:AT1G69120
拟南芥酪氨酸蛋白磷酸酶PTP135基因克

山东农业大学学报(自然科学版),2022,53(5):803-810VOL.53NO.52022 Journal of Shandong Agricultural University(Natural Science Edition)doi:10.3969/j.issn.1000-2324.2022.05.021拟南芥酪氨酸蛋白磷酸酶PTP135基因克隆及功能分析刘静广东职业技术学院,广东佛山528041摘要:拟南芥PTP135T-DNA插入突变体ptp135具有与phyB突变体相似的特征,萌发时下胚轴伸长、子叶张开角度小、展开慢,后期表现为开花早、叶色浅、叶柄长、叶面积增大。
采用PCR法从拟南芥叶片中克隆PTP135启动子基因,PTP135启动子连接到载体pCAMBIA1391,构建植物双元表达载体pCAMBIA1391-135p,构建的载体经过鉴定后,运用农杆菌介导的沾花法将PTP135启动子转化野生型拟南芥,用潮霉素筛选转化阳性株,对阳性株进行GUS组织化学染色,结果表明PTP135基因定位在维管束、柱头和花丝。
采用PCR方法从拟南芥叶片中克隆PTP135基因,连接到载体pEZS-NL,构建瞬时表达载体pEZS-NL-135e,采用基因枪法转化洋葱表皮,结果表明PTP135编码的蛋白定位在细胞核和细胞膜。
拟南芥野生型、ptp135和phyB,待即开花时取样,做光周期特异性基因CO、FT 的RT-PCR表达分析,结果表明CO和FT基因在ptp135突变体中表达时间延长,表达量增加,证明PTP135可以在转录水平上调控CO和FT,PTP135参与植物开花调控途径,作用位点在CO上游。
关键词:拟南芥;酪氨酸蛋白磷酸酶;基因克隆中图法分类号:Q943.2文献标识码:A文章编号:1000-2324(2022)05-0803-08 Expression and Function Analysis on PTP135Gene of ProteinTyrosine Phosphatase in Arabidopsis thalianaLIU JingGuangdong Technical College,Foshan528041,ChinaAbstract:The characteristics of ptp135mutant of Arabidopsis thaliana was similar to phyB mutant.The young seeding had a higher hypocotyl,opening cotyledon with a smaller angle,and slower expansion.At the later stage,it showed early flowering, lighter leaf color.We cloned the PTP135promoter gene from type A.thaliana leaves by PCR.The PTP135promoter gene was connected to the vector pcambia1391,and the vector pcambia1391-135p was constructed.Then the vecter was transformed into wild type A.thaliana by Agrobacterium-mediated flower dipping method.The results showed that ptp135 gene was located in vascular bundle,stigma and filament.We cloned the PTP135gene from Arabidopsis thaliana leaves by PCR.The PTP135gene was connected to the vector pEZS-NL,and the vector pEZS-NL-135e was constructed and transformed into onion epidermis by particle bombardment.The results showed that the protein of ptp135was localized in the nucleus and cell membrane.The RT-PCR results showed that the expression time of CO and FT in ptp135was longer and the expression level was more than in the wild.It was proved that PTP135could regulate CO and FT at the transcriptional level.PTP135worked in the flowering regulation pathway,and the action site was in the upstream of CO gene. Keywords:Arabidopsis thaliana;protein tyrosine phosphatase;gene cloning高等植物的生活史包括种子萌发、营养生长、开花等一系列发育阶段,其中开花过程直接影响作物生育期,与作物产量品质密切相关,该领域相关研究对农业和园艺生产具有重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
姓名系年级学号日期
科目遗传学实验题目模式植物拟南芥T-DNA插入突变体的鉴定
模式植物拟南芥T-DNA插入突变体的鉴定
摘要:
农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中,有T-DNA插入的纯合突变体,杂合突变体,和野生型。
在突变体研究中,需要的材料是纯合突变体。
本次实验意在对模式植物拟南芥T-DNA插入突变体进行鉴定。
实验中用到的主要实验方法有:CTAB法提取拟南芥基因组DNA、PCR扩增目的基因片段、琼脂糖凝胶电泳分离核酸。
PCR技术的基本原理类似于DNA的天然复制过程。
PCR由变性--退火--延伸三个基本反应步骤构成。
每完成一个循环需2~4分钟,2~3小时就能将待扩增目的基因扩增放大几百万倍。
琼脂糖凝胶电泳是用琼脂糖作支持介质的一种电泳方法。
它兼有“分子筛”和“电泳”的双重作用。
带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小,这就大大提高了分辨能力。
DNA经EB染色,EB可与核酸结合,在紫外光激发下产生荧光。
现广泛应用于核酸的研究中。
引言
Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移进植物细胞,并插入植物染色体DNA中。
所以Ti质粒上的这一段能转移的DNA被叫做T-DNA。
将Ti质粒进行改造,将感兴趣的基因放进T-DNA区段中,通过农杆菌侵染植物细胞,实现外源基因对植物的遗传转化。
T-DNA插入基因内部导致基因突变:T-DNA插入到植物染色体上的位置是随机的。
如果T-DNA插入进某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的
一种重要方法。
农杆菌能在自然条件下感染双子叶植物和裸子植物,而对大多数
单子叶植物没有感染能力。
这使农杆菌Ti 质粒转化系统的应用范围受到了一定
的限制。
反向遗传学研究的首要条件是获得基因敲出突变体,建立可靠、有效、方便
的T-DNA插入突变体的鉴定方法。
其中,“三引物法”是主要鉴定方法之一。
“三引物法”即采用三个引物(LP、RP、BP)进行PCR扩增。
野生型植株目的基因的两条染色体上均未发生T-DNA插入,所以其PCR扩增产物仅有1种,电泳结果为一条大带(由LP+RP这一对引物扩增出来);纯合突变体植株目的基因的两条染色体上均发生T-DNA插入,也只能得到1种PCR扩增产物,电泳结果为一条小带(由BP+RP这一对引物扩增出来);杂合突变体植株只在目的基因的一条染色体上发生了T-DNA插入,所以PCR扩增产物有2种,电泳结果为一条大带由(LP+RP这一对引物扩增出来)和一条小带(由BP+RP这一对引物扩增出来)。
电泳结果差异明显,能有效区插入突变体的类型。
此法优点是可同时鉴定出纯合突变体并确证T-DNA的插入情况。
本方法操作
简单,成功率高,结果可靠,适用于从大量拟南芥T—DNA插入突变体中快速鉴
定出突变体。
【实验材料】
1.试剂:液氮,2*CTAB提取液,氯仿-异戊醇(24:1),无水乙醇,70%乙醇,TE,
PCR反应体系(DNA模板(基因组DNA),引物LP、RP、BP,缓冲液,
MgCl2,dNTP mixture,ddH2O,Taq酶),琼脂糖凝胶电泳(琼脂糖,1
×TAE缓冲液,Loading buffer,DL 2,000 DNA Marker,λ-Hind ⅢDNA
digest Marker,溴化乙锭。
2.器具:1.5ml离心管,水浴锅,微量移液器,离心机,PCR仪,微波炉,电泳
仪,电泳槽,梳子,三角瓶,微量天平,手套,染色盘,凝胶成像仪。
3.材料:拟南芥T-DNA插入突变体植株。
【实验步骤】
提取拟南芥基因组DNA
1. 在1.5ml离心管中放入2或3片拟南芥幼嫩叶片,用液氮将其研磨成细粉,向管中加入600ul预热至65℃的2×CTAB提取液,轻摇混匀。
2. 65℃水浴30 min,其间轻摇混匀。
3. 向上清液加入等体积的氯仿/异戊醇(24:1),室温下轻轻混匀10 min,12000 rpm离心15 min,再转移上清入新管。
4. 向上清液中2倍无水乙醇或等体积的异丙醇,小心混匀,-20 ℃下30 min,12000 rpm离心15 min,弃上清。
5. 用70%乙醇洗涤沉淀一次,12000 rpm稍离心,弃上清。
6. 将沉淀晾干,加20-50ul TE (pH 8.0),65℃水浴30 min溶解DNA。
PCR
取3个PCR小管(一个为三引物体系,另外两个为双引物体系),按照如下反应体系向PCR小管内加入样品,设定如下反应程序,进行PCR。
反应体系:
三引物反应体系25ul体系双引物反应体系25ul体系H2O 15ul H2O 16ul 10xTaq buffer (MgCl2free) 2.5ul 10xTaq buffer(MgCl2free) 2.5ul MgCl2(25mM) 2ul MgCl2(25mM) 2ul
引物LP (10 uM) 1ul 引物LP或BP (10 uM) 1ul
引物RP (10 uM) 1ul 引物RP(10 uM) 1ul
引物BP (10 uM) 1ul dNTP (各2.5mM) 0.5ul
dNTP (各2.5mM) 0.5ul 模板DNA(30-50ng/μl)2ul 模板DNA(30-50ng/μl)2ul Taq酶(5U/μl )0.2ul Taq酶(5U/μl )0.2ul
反应程序
预变性94℃5min
变性94℃40sec
退火53℃50sec
延伸72℃80sec
循环35次
72℃10min
琼脂糖凝胶电泳
注:①电泳这一步骤,我与其余五名同学共同完成,共用同一块胶板。
②基因组DNA的电泳所用琼脂糖凝胶浓度为0.8%,PCR产物的电泳所用琼
脂糖凝胶浓度为2% 。
1. 制胶:称取0.24g琼脂糖,加入30mlTAE缓冲液(用于基因组DNA的电泳);
另称取1.60g琼脂糖,加入80mlTAE缓冲液(用于PCR产物的电泳)。
放入微波炉中加热溶化。
2. 灌胶:待胶冷至50-60℃时,缓缓倒入胶板。
约半个30—40min后,胶已凝固,
拔去梳子,将胶板放在电泳槽中,补充槽内TAE缓冲液,至约高出胶板
1mm。
3. 加样:将样品与Loading buffer在封口膜上混匀,用微量移液器将样品加入到
点样孔内。
(基因组DNA加样量为5ul,PCR产物加样量为20ul)
4. 电泳:接通导线(加样端接负极),调节电压至5v/cm,当指示剂距胶板底部
1-2cm时,停止电泳。
5. 染色:将胶板放入含EB的染色盘中,染色约10min,再将胶板转移到清水中
清洗。
6. 观察:将凝胶放入凝胶成像仪内观察、拍照。
【实验结果】
理论上,电泳结果图上会出现一条大带或一条小带或两条带同时出现,并且可以对T-DNA插入突变体的类型做出准确鉴定。
各种可能的电泳结果对应插入突变的类型如下表:
电泳条带的有无
鉴定结果
1000-1500bp间800-900bp间
有无野生型
有有插入杂合突变体
无有插入纯合突变体
但是由于多种可能,最终基因组DNA和PCR扩增产物的电泳结果都没有出现预期条带。
对这一现象出现的原因分析如下:
由于班里大多数同学出现了同样的情况,只有极少数同学的电泳结果图上出现了条带,基本可以断定并非由实验操作造成。
【注意事项】
1. 实验取材为植株叶片,而不要将植株连根拔起。
否则的话即便检测出实验材料为插入纯合突变体,由于植株已经不存在,实验结果就没有了意义。
2. 液氮研磨实验材料时,注意不要将液氮倒在手上,以免将皮肤冻伤。
3. 配制PCR反应体系时由于各种试剂量较少,要靠壁滴加。
4. 在用微波炉加热溶解琼脂糖的过程中,TBE缓冲液中的水分会蒸发掉一少部分,所以,最好在加热前在三角瓶内补充少量蒸馏水。
5. 注意电泳方向,点样孔所在方向对准电泳槽的负极(DNA带负电荷,在电泳的过程中向正极移动)。
6. EB为强诱变剂,染色时要佩戴手套,实验技术后认真清洗双手。
参考文献
[1]模式植物拟南芥T-DNA插入突变体的鉴定.ppt。
