流式细胞仪Protocol
流式细胞仪培训课件

•流式细胞仪培训
•8
流式细胞仪的主要特点
➢ 高速测定细胞,大样本计数 ➢ 检测稀有细胞 ➢ 多参数分析 ➢ 自动化 ➢ 细胞分选
•流式细胞仪培训
•9
二、流式细胞仪工作原理
•流式细胞仪培训
•10
流式细胞仪工作原理
流式细胞仪通常以激光作为激发光源,经过 聚焦整形后的光束垂直照射在样品流上,被 荧光染色的细胞在激光束的照射下产生散射 光和激发荧光。这两种信号被光电二极管和 光电倍增管接收,之后转换为电信号,再通 过模/数转换器,将连续的电信号转换为可被 计算机识别的数字信号,最后由计算机进行 计算处理。
•32
Hoechst
Hoechst+Vera.
Side Population Cells
•流式细胞仪培训
•33
细胞凋亡研究
1. 鉴别凋亡与坏死: Annexin Ⅴ/PI
2. 测定凋亡率:Annexin Ⅴ、 Apo 2·7、TUNEL
3. 研究凋亡触发机制: Caspase、Fas及FasL
bcl-2/bax
疾病
CD3 CD4 CD8
自身免疫病
降低 增高
CD4/ NK CD8 降低 降低
AIDS SARS
降低 降低
严重降 增高 低
降低 降低
降低 降低 降低
慢性活动性肝 炎、肝硬化
肿瘤
降低
降低 降低
正常或 增高 增高
降低 降低 降低 降低
•流式细胞仪培训
•27
用荧光标记抗体
抗体特异性地结合细 胞上对应的抗原
•31
肿瘤干细胞中的研究应用 -Hoechst 33342 side population
细胞周期和ModFit的Protocol

n. 在“Choose Model”里面把“Linearity”调整为1.85,可以通过Linearity的 数值调整优化CV和RCS的数值。
k. 手动调节G1或者G2的位置。
L. 在工具栏的“Analysis”中选中“Fit with current model”,会出现G1/S/G2期 的比例和CV。
m. 在工具栏的“Analysis”中选择“Fit Diagnostics”;能看见CV和RCS等的数值, 绿色表示数据好,黄色表示数据一般,红色表示数据差。
2. 收获和固定细胞 a. 收获单个细胞,进行细胞计数。 b. 取3×106个新鲜的细胞到一个15 ml离心管中,用300 g的速度离心细胞5分钟。 c. 倒掉上清,用2 ml 不含钙和镁离子的DPBS重悬细胞,用300 g的速度离心细胞5分钟。 d. 倒掉上清,把离心管放在振动涡旋器上,往15 ml离心管里面滴加1 ml预冷的75%乙醇,边 滴加边涡旋。 e.盖上离心管盖子,用封口膜封住离心管盖子,把离心管放置在-20℃冰箱固定;细胞至少要 固定过夜,也可以在细胞固定1-2周后对细胞进行染色分析。
流式细胞仪操作规范

流式细胞仪的操作规范1.CXPCytometer:仪器操控软件,可与机器连线,收取ListModeData,也可进行简单的Data分析。
2.CXPAnalysis:离线分析软体,可进行较繁复的Data分析,包含等高线图(ContourPlot)”、密度图(DensityPlot)、岛屿图(SurfacePlot)、透试图(Tomogram)、叠图(OverlayPlot)的绘制,多档案分析与批次分析。
一、基本开机步骤与软体主画面说明。
1.依常规模式进入Window20000系统。
2.双点桌面上,即可启动机器并进入操作软体。
此时您可见到下面的画面:3.选取您自己的资料夹(请在Password处输入密码),并按下Next继续。
接着您能看到下面的画面:4.此时您能在左边的视窗选取您即将使用的Protocol,然后按下Finish进入软体,或不选取任何Protocol,直接按下Finish进入软体,您即可见到软体的工作区(workspace),如下图:工作区分成三部份:a.工具列(CXPToolbars):b.档案总管(ResourceExplorer):利用滑鼠在做切换,让您能够看到您专属资料夹中的Worklists、Panels、Protocols、LMDData和HSTData等档案。
若要开启档案总管中的资料时,只需利用滑鼠将这些档案直拖曳至软体的桌面上,便可打开各式档案或分析Data。
c. 工作清单编写区(AcquisitionManager):利用工作清单工具列您可以在此处编写您即将要收集的样本内容,包括设定本次实验的染剂名称参数名、ListModeData存档的模式等等。
二、开关机开机前之准备:补充PBS(约8~9分满)和Clenzsolution(约8~9分满),并倒去废液瓶中之液体。
开机:依一般程序开启您的电脑,点选桌面上的图示,即可进入软体。
关机:1、准备一管5%bleach(0.45μmfilter过滤)以及两管diwater。
流式细胞仪Protocol

第一章流式细胞仪的结构和原理第1节流式细胞术发展史纵观历史,几乎没有哪一门科学技术象流式细胞术这样凝结了众多不同学术背景、不同科研领域科学家的心血。
从流式细胞术的发明、改进、革新,到今天在各个领域应用的拓展,每一步都是诸如生物学、生物技术、计算机科学、流体力学、激光技术、高等数学、临床医学、分子生物学、有机化学和生物物理学等学科知识综合运用的结晶。
现代流式细胞术更是由于结合了单克隆抗体技术、定量细胞化学技术和定量荧光细胞化学,使其在生物学、临床医学、药物学等等众多研究领域中的应用有了更加突飞猛进的发展。
临床流式细胞术发展趋势可归纳为:①流式细胞仪从单纯大型仪器发展为适应各种实际应用的便携式、台式、高分辨率、高质量分选的研究型流式细胞仪;②对流式细胞术检测荧光参数,从采用荧光单色、双色分析发展为多色分析,目前最多可同时检测15 种荧光信号;③从检测参数的相对定量发展为绝对定量;④从检测参数的手动人工分析发展为计算机软件的自动分析;⑤所采用的荧光试剂,从非配套试剂发展为配套的试剂盒试剂。
而这一切,就要求我们流式细胞仪使用者和科研人员一定要不断地有意识地学习上述各门学科知识,只有这样才能更好地将流式细胞术应用到生物医学的临床实践和基础科学研究工作中去。
流式细胞术的发展简史:1930年 Caspersson 和 Thorell 开始致力于细胞的计数;1934年 Moldaven 是世界上最早设想使细胞检测自动化的人,他试图用光电仪记录流过一根毛细管的细胞数量;1936年 Caspersson等引入显微光度术;1940年 Coons 提出用结合了荧光素的抗体去标记细胞内的特定蛋白;1947年 Guclcer 运用层流和湍流原理研制烟雾微粒计数器;1949年 Wallace Coulter 提出在悬液中计数粒子的方法并获得专利;1950年 Caspersson用显微分光光度计的方法在紫外线(UV)和可见光光谱区检测细胞:1953年 Croslannd-Taylor应用分层鞘流原理,成功地设计红细胞光学自动计数器;1953年Parker和Horst描述一种全血细胞计数器装置,成为流式细胞仪的雏形;1954年 Beirne和Hutcheon发明光电粒子计数器;1959年B型Coulter计数器问世;1965年 Kamemtsky等提出两个设想,一是用分光光计定量细胞成份;二是结合测量值对细胞分类;1967年 Kamemtsky和Melamed在Moldaven的方法基础上提出细胞分选的方法;1969年Van Dilla,Fulwyler及其同事们在Los Alamos,NM(即现在的National Flow Cytometry Resource Labs),发明第一台荧光检测细胞计;1972年 Herzenberg 研制出一个细胞分选器的改进型,能够检测出经荧光标记抗体染色的细胞的较弱的荧光信号;1975年Kochler和Milstein提出了单克隆抗体技术,为细胞研究中大量的特异的免疫试剂的应用奠定了基础。
流式细胞术最全攻略:从protocol到问题解决

流式细胞术最全攻略:从protocol到问题解决文献中我们经常能看见这种图,也就是流式结果分析图,美观、简单、一目了然。
流式细胞术(flow cytometry)是20世纪60年代后期开始发展起来的利用流式细胞仪快速定量分析细胞群的物理化学特征以及根据这些物理化学特征精确分选细胞的新技术,主要分为流式分析和分选2部分。
今天我们主要介绍流式分析中基本操作与技巧,首先简要了解一下什么是流式细胞术。
一、流式细胞术的3大要素1. 流式细胞仪:现在市面上有多种型号的流式细胞仪,但其基本结构都是相同的,分析性流式细胞仪有液流系统、光路系统、监测分析系统。
(1)液流系统(2)光路系统光路系统始于激光器,其分类分法很多,最常用的分类方法是根据其发射的激光的波长来分,如常见的有488nm的蓝激光器、635nm的红激光器和405nm的紫激光器,不同的激光器发出的激光照射到细胞后产生的光信号会经过不同的光路系统被不同的通道接收。
流式细胞仪采集的光信号包括散射光信号和荧光信号,散射光信号也就是我们常说的FSC(前向散射光,反应细胞的大小)、SSC(侧向散射光,反应细胞的复杂程度);荧光信号是细胞上结合有荧光素,被激光激发以后,会发射荧光信号。
(3)检测分析系统:流式细胞仪的检测分析系统就是以通道为单位将细胞的各个通道的光信号汇总分析,最后得出样品群体中细胞的物理化学特征。
通道,我们可以理解为就是光电倍增管,有2个作用,①将光信号转变为电子信号;②放大电子信号。
可以分为散射光通道(FSC通道、SSC通道)和荧光通道,一个激光器下可以有多个荧光通道,一个通道对应多个荧光染料,例如以beckman的DXflex机器的638nm 红激光器为例,APC通道可以接收APC、Alexa Fluor647、eFluor660荧光信号,原则上,这3种荧光素不能同时标记一个样品,否则,就无法分析该通道上的信号是来自于哪种荧光素。
另一个重要组成部分就是计算机分析系统,例如BD的DIVA系统。
BD Accuri C6 流式细胞仪实验设置指南说明书

Protocol: Experiment Setup (BD Analog Instruments)1.Select either the FACS Comp or manual method from the chart below, and follow the steps for voltage setting, then compensation. Use theinstructions for “First-Time Run of a New Panel” when running a new combination of antibodies or an existing combination of antibodies on a new cell e the instructions for“Subsequent Runs of the Same Panel” when repeating experiments with the same antibodies and cells.2.Run experiment samples,followed by appropriate shutdown procedures for the instrument.1.FACSComp, while simple and highly automated, offers only two types of voltage settings (LW or LNW). In some cases, neither of these will be ideal for a particular reagent panel. Additionally,compensation can be slightly less accurate than with manual setup.2.Compensation should be calculated for each day’s experiment.Importing previous settings (including compensation) is onlyacceptable if there is to be NO change in PMT voltages, and if NO tandem dyes are used in the experiment (these can vary experiment-to-experiment in their compensation requirement).3.CompBeads are generally preferable to single-stained cells ascompensation controls, as long as the antibody efficiently binds the appropriate bead. Calibrite beads are also acceptable in most cases.4.PerCP and PerCP-Cy5.5 have different compensation requirements,and are best not combined in the same experiment.Steps:Notes:1. Run mid-range beads, and adjust voltages (if needed) to place medians within 10% of the target channel for each color.Voltage Setting1. Run unstained cells and place peak in the middle of the first decade for each color.2. Run fully stained cells and decrease the voltage for any color in which events are off-scale.3. Run mid-range beads and record medians in each color.These will be your target channels.1. Open FACSComp software, choose 3- or 4-color LNW or LW setup and appropriate FL3 color (PerCP or PerCP-Cy5.5).2. Load appropriate beads as prompted by the software.3. Opening CellQuest Pro after successful completion of FACSComp will automatically import the voltage and compensation settings thus established.Voltage SettingCompensationCompensation1. Run single-stained CompBeads for each color.2. Acquire with compensation off,and calculate compensation in FlowJo prior to analysis, using the compensation calculation tool.1. Run single-stained CompBeads for each color.2. Acquire withcompensation off, and calculate compensation in FlowJo prior to analysis, using the compensation calculation tool.ManualFACS CompSubsequent Runs of the Same Panel First-Time Run of a New Panel OptionProtocol: Experiment Setup (BD Analog Instruments)Reagent Recommendations:Use 1 drop + 350 µL FACS Flow buffer.556298 (Sphero rainbow particles, mid-range FL1 fluorescence)BD Mid-range beads Use 1 drop per sample. Negative CompBeads can be included in each tube and/or run as a separate negative control (the latter is preferable).552843 (anti-mouse κ)552844 (anti-rat κ)552845 (anti-rat/hamster κ)BDCompBeadsUse 1 drop + 350 µL FACS Flow buffer.340486 (unlabeled, FITC, PE, PerCP beads)340487 (APC beads)345036 (PerCP-Cy5.5 beads)BD Calibrite beadsInstructions for UseCatalog Number Reagent。
流式细胞仪操作规程SOP

流式细胞仪操作规程目录1:淋巴细胞亚群测定及绝对计数2:活化淋巴细胞亚群、记忆T及纯真T得检测3:HLA-B27测定4:CD55/CD59测定5:干细胞检测与绝对计数6:白血病免疫分型测定7:淋巴细胞T细胞亚群细胞内因子IFN—γ/IL-4测定8:细胞周期分析9:活化血小板检测10:血小板抗体测定11:红细胞抗体测定12:粒细胞抗体测定淋巴细胞亚群测定(流式细胞仪)医院检验科操作规程文件号:200 年月日起实施第1版(共3页)本规程每2年复审一次复审日期: 年月日复审人:规程编写者:审批者:批准日期: 年月日文件分发部门与/或个人院档案室保管者:检验科主任:检验科实验室:淋巴细胞亚群测定方案(Protocol) 1.选参数4色点击点击3色点击(命名,点击save) 2、画图结果此图为CD45圈门如果做绝对计数,则填写Flow-Count得浓度选中cell/ul即可方法流式细胞仪(BeckmanCoulter,贝克曼库尔特)原理:双/三色直接免疫荧光法、荧光素标记得各种单克隆抗体加入到全血中,与白细胞膜上相应得抗原结合,经过溶血、洗涤(与固定)等步骤后,在流式细胞仪上进行分析,从而得到相应各亚群得百分数。
活化淋巴细胞表面抗原为CD3+/CD25+与CD3+/HLA—DR+、CD3+/CD45RO+就是记忆型T细胞、CD3+/CD45RA+就是纯真型T细胞、HLA-B27测定点击点击键入文件名,点击Save2.画图结果1、positive(+)X-Mean=17、1 2.negative(—)X—Mean=1.2X-Mean=5、8CD55/CD59测定方案(Protocol)(同HLA—B27)结果1、RBC: normal2。
RBC: abnormal3。
WBC干细胞检测与绝对计数方案(Protocol)同淋巴细胞亚群检测结果(Result)白血病免疫分型测定T细胞亚群细胞内因子IFN-γ/IL-4检测正常参考值Thl(IFN—γ):17、39±5。
自己总结:流式细胞仪的原理和用途

流式细胞仪(Flow Cytometry)1 流式细胞仪的概念及其发展历史1.1 流式细胞仪的基本概念流式细胞仪(flow cytonletry,FCM)是对高速直线流动的细胞或生物微粒进行快速定量测定和分析的仪器,主要包括样品的液流技术、细胞的计数和分选技术,计算机对数据的采集和分析技术等。
流式细胞仪以流式细胞术为理论基础,是流体力学、激光技术、电子工程学、分子免疫学、细胞荧光化学和计算机等学科知识综合运用的结晶。
流式细胞术是一种自动分析和分选细胞或亚细胞的技术。
其特点是:测量速度快、被测群体大、可进行多参数测量,即对同一个细胞做有关物理、生物化学特性的多参数测量,且在统计学上有效。
1.2 流式细胞仪的发展简史最早的流式细胞仪雏形诞生于1934年,Moldavan提出使悬浮的单个血红细胞流过玻璃毛细管,在亮视野下用显微镜进行计数,并用光电记录装置测量的设想。
1953年Crosland-Taylor根据牛顿流体在圆形管中流动规律设计了流动室。
其后又经过Coulter、Parker & Horst、Kamentsky、Gohde、Fulwyler、Herzenberg等人的不断改进,设计了光电检测设备和细胞分选装置、完成了计算机与流式细胞仪的物理连接及多参数数据的记录和分析、开创了细胞的免疫荧光染色及检测技术、推广流式细胞仪在临床上的应用。
近20年来,随着流式细胞仪及其检测技术的日臻完善,人们越来越致力于样品制备、细胞标记、软件开发等方面的工作,以扩大FCM的应用领域和使用效果。
宋平根的《流式细胞术的原理和应用》是迄今为止对流式细胞仪及其技术阐述的最为详尽和透彻的中文著作。
这本书非常详细地介绍了流式细胞术的历史、结构、原理、技术指标等,例举了其在医学和生物工程中的应用,非常适合从事此方面专业研究的人。
由于这本书是13年前出版的,所以基本上没有涉及植物流式细胞仪检测技术。
此外对于只需要对流式细胞仪有些基本认识的人士来说,这本书太复杂太深奥。
流式细胞仪(flowcytometer)基本原理

流式细胞仪(flowcytometer)基本原理,详细流式细胞仪(Flow Cytometer)是一种用于细胞计数、细胞分类和细胞特性分析的重要实验室装置。
它能够快速地对成千上万的细胞进行分析,并且可以同时对多种细胞特性进行检测。
流式细胞仪的基本原理涉及到光学和流体力学的结合,这里是一个详细的解释:流体系统(Fluidics)流式细胞仪的流体系统负责将样本中的细胞悬液通过一个狭窄的管道(通常称为流室或喷嘴)输送,使细胞单个通过。
为了实现单个细胞的流动,采用了水力聚焦技术(hydrodynamic focusing),即使用一个不含细胞的剪切流(通常为盐溶液)将细胞流包围起来,迫使它们以单列的形式通过检测区。
光学系统(Optics)当细胞单个通过检测区时,流式细胞仪的光学系统开始发挥作用。
它通常包含一个或多个激光,激光束照射穿过流室的细胞。
细胞对光的散射和吸收会产生前向散射光(Forward Scatter, FSC)和侧向散射光(Side Scatter, SSC),分别与细胞的大小和内部复杂性(如颗粒性或结构)相关。
荧光检测(Fluorescence Detection)除了散射光,如果细胞被荧光标记,那么激光也会激发荧光染料,细胞将发出荧光信号。
不同的染料可以被激发并发出不同波长的荧光,这些荧光通过光学滤镜和分光器被检测,使得可以同时检测多个不同的荧光标记。
数据采集与分析(Data Acquisition and Analysis)每个通过检测区的细胞都会产生散射光和荧光信号,这些信号被光电管或光电倍增管(PMTs)检测,并转换为电信号。
这些电信号随后被数字化,并由计算机软件分析。
软件可以根据用户的需要进行细胞的分类、计数以及各种参数的量化,如细胞大小、颗粒性、荧光强度等。
通过流式细胞仪,研究人员可以进行多种分析,包括但不限于细胞周期分析、活细胞和死细胞的鉴别、细胞亚群的鉴定以及细胞内信号传导的研究。
流式细胞仪

流式细胞仪1、流式细胞术(英文flow cytometry)是一种生物学技术,用于对悬浮于流体中的微小颗粒进行计数和分选。
这种技术可以用来对流过光学或电子检测器的一个个细胞进行连续的多种参数分析。
目录* 1 原理* 2 流式细胞仪(flow cytometer)* 3 应用* 4 参见原理一束单色光(通常是激光)照到流体力学聚焦的一股流体上。
若干个检测器瞄向流束和激光相交的这个点,其中一个和激光在同一直在线(称作前散射(FSC)),其它几个和激光垂直(旁散射(SSC)和一个或几个荧光监测器)。
当每个悬浮颗粒通过光束时会按某种方式把光散射,同时所带有的荧光化合物被激发并发射出频率低于激发光的荧光。
这些散射光和荧光的组合数据被检测器记录,根据各检测器亮度的波动(每个细胞会显出一个散射或荧光的峰)就能够推算出每个颗粒的物理和化学性质。
前散射与细胞体积相关,而旁散射取决于颗粒的内部复杂程度(比如核的形状、胞质内颗粒的种类或者末的粗糙程度)。
可以检测的参数有:细胞的体积和形态复杂程度、细胞中的色素、DNA(细胞周期分析、细胞动力学、细胞增殖等)、RNA 染色体分析和分选(文库构建、染色体涂染)、蛋白质、细胞表面抗原(CD标记)、胞内抗原(各种细胞因子(cytokine)、次级媒介等)、核抗原、酶活性、pH,胞内离子化的钙、镁,膜电势、膜流动性细胞凋亡(apoptosis)(定量检测DNA降解、线粒体膜电位、通透性变化)、细胞存活能力、监测细胞电通透性、氧爆作用(oxidative burst) 、研究癌细胞中的多重耐药性(multi-drug resistance, MDR) 、谷胱甘肽、各种组合(DNA/表面抗原等等)流式细胞仪(flow cytometer)流式细胞仪又称荧光激活细胞分选器、荧光活化细胞分类计(FACS,Fluorescence Activated Cell Sorter)。
现代的流式细胞仪每秒可以实时检测几千个颗粒,并且可以主动分离具有不同特性的颗粒。
流式protocol

收获P3代生长状态良好细胞,0.25%胰酶消化,4 ℃离心,1 000 r/min,5 min。
↓用PBS(含1%BSA)清洗细胞3次,计数细胞。
↓各管依次加入单克隆抗体CD29、CD34、CD45、CD90。
↓同时每管样品设立同型阴性对照。
↓避光冰上孵育45 min。
↓用PBS(含1%BSA)洗涤细胞3次,以除去未结合抗体,用500 μL PBS(含1%BSA)重悬细胞,流式细胞仪进行检测分析。
(四个CD抗原分子,四个阴性对照,一个空白对照。
九个EP管)细胞一定要足够量,一般要求1×106个细胞。
对于直接标记单色样本,应该设置空白对照、阴性对照(同型抗体对照)和待测样本。
对于直接标记多色样本,在单色基础上另加补偿对照。
阴性对照的设置:在实验过程中,假设做直接标记法,可将实验组细胞,取一管,加上与实验抗体所标记的荧光颜色相同的同型对照来作为阴性对照。
空白对照:即不进行任何标记的细胞。
但是我们买的是pe和fitc荧光标记的抗体,那一管样品内可以同时加两中不同标记的抗体,那它们的同型对照怎么设置?我们的样品可以放在EP管里面吗?检测时,样品至少需要多少量?取第3代第3~5d BMSCs,胰蛋白酶-EDTA消化成为单细胞悬液;↓PBS(1到2ml)洗三次,离心,1000rpm,5min弃液;↓4%多聚甲醛1ml室温下固定40min,1000r/min,离心5min后弃去上清液↓PBS(1到2ml)洗两次,离心,1000rpm,5min弃液;↓分别加入500ul已经稀释的大鼠CD29、CD34、CD45及CD90单克隆抗体;↓避光孵育30min↓用PBS洗涤细胞两次,以除去未结合抗体;↓用PBS重悬细胞,流式细胞仪进行检测分析。
PBS洗涤细胞的过程中细胞丢失?解决办法有:(1)尽量采用尖底的离心管和水平离心机(2)离心后尽量用吸管吸取上清,不要倾倒;吸上清时最好残留1mm左右的水膜,不要吸完。
流式细胞仪试剂介绍

FITC+PE:最常用的双色组合 FITC+PE+PE-Cy5:最常用的三色组合,进行多色 荧光染色时荧光光谱重叠补偿很小 FITC+PE+PerCP+APC:BD最常用的四色组合 FITC+PE+ECD+PE-Cy5:贝克曼库尔特公司最常用 的四色组合 FITC+PE+ECD+PE-Cy5+PE-Cy7:贝克曼贝克曼 库尔特公司最常用的五色组合,而且PE-Cy7与FITC 、PE、PE-Cy5标记的抗体一同使用时的荧光补偿小 PE-Cy5可与FITC、PE同时使用,但不能与APC同时 使用,二者之间荧光干扰太大
Red APC APC-Cy7 UV DAPI Hoechst
Innovation – First Commercial Tandem Conjugates
APC Alexafluor™700 APC Alexafluor™750 PE-Texas Red PE-Cy7™
1985
性对照应为Mouse IgG1-FITC
如何看懂试剂的说明
临床试剂
RD1=PE
标 记 的 荧 光 素
试 剂 包 装 规 格 大 小
如何看懂试剂的说明
科研试剂
科研试剂,以mg/g表示试剂包装大小,需 要做滴度实验,摸索最佳实验所需试剂量
如何看懂试剂的说明-试剂的货号识别
6开头的试剂为美国库尔 特生产
200 of 208 New Drugs Are PKIs
The Competition: Western Blot vs Flow Cytometry
Western Blot
Untreated Treated
Flow Cytometry
流式细胞仪操作规程-SOP

WORD格式流式细胞仪操作规程目录1:淋巴细胞亚群测定及绝对计数2:活化淋巴细胞亚群、记忆T及纯真T的检测3:HLA-B27测定4:CD55/CD59测定5:干细胞检测和绝对计数6:白血病免疫分型测定7:淋巴细胞T细胞亚群细胞内因子IFN-γ/IL-4测定8:细胞周期分析9:活化血小板检测10:血小板抗体测定11:红细胞抗体测定12:粒细胞抗体测定WORD格式淋巴细胞亚群测定(流式细胞仪)医院检验科操作规程文件号:200年月日起实施第1版(共3页)本规程每2年复审一次复审日期:年月日复审人:规程编写者:审批者:批准日期:年月日文件分发部门和/或个人院档案室保管者:检验科主任:检验科实验室:淋巴细胞亚群测定方法流式细胞仪(BeckmanCoulter,贝克曼库尔特)原理:双/三色/四色直接免疫荧光法。
荧光素标记的各种单克隆抗体加入到全血中,与白细胞膜上相应的抗原结合,经过溶血、洗涤(和固定)等步骤后,在流式细胞仪上进行分析,从而得到淋巴细胞亚群的百分数,加入Flow-Count即可得出绝对计数。
淋巴细胞表面抗原分布如下:T淋巴细胞:CD3+;B淋巴细胞:CD3-,CDl9+;辅助性T淋巴细胞:CD3+CD4;+抑制性T淋巴细胞:CD3+CD8;+NK细胞:CD3-CDl6+56+等。
根据淋巴细胞膜上CD分子表达的不同,流式细胞仪可以分辨出淋巴细胞及其各种不同的亚群,利用计算机软件计算出淋巴细胞亚群的百分数,加入Flow-Count组会自动得出绝对计数。
标本采集与处理受检者的准备检查对象生活饮食处于日常状态。
采集部位静脉采血抗凝剂EDTA或肝素抗凝血要求1.样本量1ml。
2.样本应在采集后6小时内处理,冷冻或溶血的标本不能用。
3.样本白细胞计数应在4.0-10.0×109/L之间。
若>10.0×109/L,样本需要稀释,用PBS稀释;若<4.0×109/L,应分离单个核细胞。
流式细胞仪工作原理

流式细胞仪工作原理流式细胞仪(Flow Cytometer)是一种广泛应用于生物医学研究和临床诊断的仪器。
它通过将细胞悬浮液以单个细胞为单位通过流动细胞流进行检测和分析,能够快速准确地获取细胞的多个参数信息,如细胞数量、大小、形态、表面标记物的表达情况、细胞内分子的含量等,从而为细胞学研究提供了重要的数据支持。
流式细胞仪的工作原理主要包括细胞悬浮液的进样、细胞的定位与聚焦、激发光源的照射、细胞信号的收集和数据分析等几个关键步骤。
1. 细胞悬浮液的进样:将待检测的细胞悬浮液通过注射器或自动进样系统引入流式细胞仪的进样口。
为了避免细胞凝聚在一起,通常需要事先对细胞进行适当的处理,如酶消化、细胞分离等。
2. 细胞的定位与聚焦:进样后的细胞悬浮液通过微细管道进入流式细胞仪的流动细胞流中,细胞在流动细胞流中以单个细胞为单位依次通过激光束的照射区域。
通过调节流速和流体压力,使细胞在流动细胞流中保持分散状态,并且细胞以单个细胞的形式通过激光束,以确保每个细胞都能被准确地检测和分析。
3. 激发光源的照射:流式细胞仪通常使用激光器作为光源。
激光器发出的单色或多色激光经过适当的光学元件(如透镜、滤光片等)聚焦成一个细束,然后照射到流动细胞流中的细胞上。
不同的激光波长对应不同的荧光染料,可以用于标记不同的细胞成分或特定的细胞表面分子。
4. 细胞信号的收集:当激光照射到细胞上时,细胞内的荧光染料会受到激发并发射出特定的荧光信号。
流式细胞仪通过一组光学元件(如物镜、滤光片、光电倍增管等)收集并分离这些荧光信号,然后将其转化为电信号。
5. 数据分析:流式细胞仪将收集到的荧光信号转化为电信号后,通过连接到计算机的数据采集系统进行数字化处理和分析。
数据采集系统可以记录细胞的特定参数,如荧光强度、散射光强度等,并将其以图像或数值的形式显示出来。
研究人员可以根据需要对数据进行进一步的分析和解读,如细胞分类、细胞计数、表达量的定量等。
流式细胞仪检测细胞周期的protocol

流式细胞仪检测细胞周期的protocol 流式细胞仪检测细胞周期的protocol 应用: 通过流式细胞仪分析各时期的细胞百分数,可检测细胞的增殖、凋亡。
原理: 通常用PI染细胞核,PI在一定波长的光下发出荧光,其强度与DNA含量成正比。
绿色荧光蛋白、红色荧光蛋白及其它发光基团也可作为标记物,分选细胞。
方法:
1) 将细胞以1×106接种于60mm培养板,80,汇合后转染。
2) 24小时后在新鲜培养液中加入适当的抗生素(真核表达载体上的抗性标记)进行培养(该步可选)。
3) 48,72小时后用胰酶消化收集细胞,PBS洗两遍,弃上清,加入1ml 70,预冷乙醇中,吹打均匀,4?固定12小时以上。
4) PBS洗涤去乙醇,1000rpm, 5min,洗两遍。
5) 0.5mlPBS重悬细胞,加入PI和 RNaseA至终浓度50µg/ml,37? 温浴30 min。
6) 用流式细胞仪测定周期。
PI:碘化丙啶,以PBS配成1mg/ml,4?保存。
RNaseA:10mg/ml。
流式细胞仪

将其L拖OG至O 空白区。
Page 13
流式细胞仪基本操作流程
2、开启CellQuest 软件、编辑实验文件 检查现有仪器条件
从Cytometer菜单中选择Threshold,出现 Threshold 窗口在Threshold 窗口:确认FSC为设阈参数,初步确认 预设阈值52。将其拖至空白区。
从Cytometer菜单中选择Compensation,确认所有预 设数值皆为零。将其拖至空白区。
LOGO
Page 14
流式细胞仪基本操作流程
3、上样品、设置仪器
使仪器处于High RUN,支撑架左移,上阴性对照管样 品,支撑架回位。确认Acquisition Control 窗口中 Setup前需打叉或打勾 (即不储存数据),点击Acquire。观 察FSC/SSC图的变化
调节 FSC/SSC
流式细胞术的研究对象为生物颗粒,如各种细胞、染色体、 微生物、及人工合成微球等
流式细胞术研究的微粒特性包括多种物理及生物学特征,并
加以定量
LOGO
Page 3
二、流式细胞仪基本原理
流式细胞仪的组成
液流系统
聚焦细胞以供检测
光学系统
激发和收集光信号
电子系统
将光信号转化为电信号,并使其数字化以供计算机分析
LOGO
Page 17
流式细胞仪基本操作流程
4、收集实验数据 计数器Counters
从Acquire 菜单中选择Counters. 窗口会显示样品分析速 率、与总数进度。
LOGO
Page 18
流式细胞仪基本操作流程
4、收集实验数据 收集实验数据
样品放到检测区,在Acquisition Control窗口中,将 Setup
PI染色检测细胞周期protocol
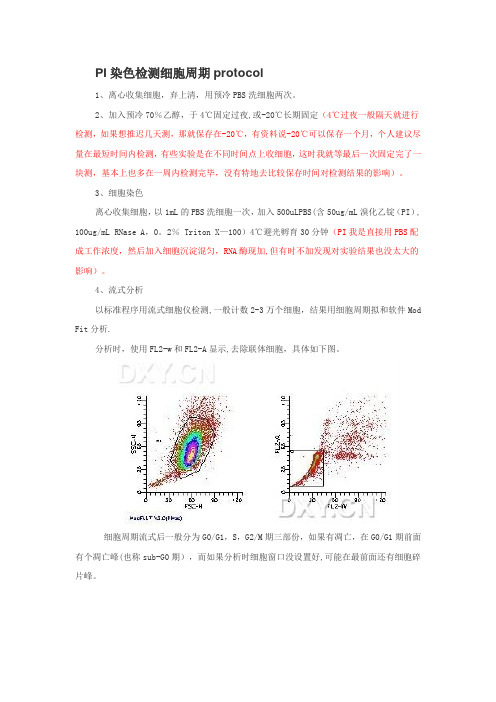
PI染色检测细胞周期protocol1、离心收集细胞,弃上清,用预冷PBS洗细胞两次。
2、加入预冷70%乙醇,于4℃固定过夜,或-20℃长期固定(4℃过夜一般隔天就进行检测,如果想推迟几天测,那就保存在-20℃,有资料说-20℃可以保存一个月,个人建议尽量在最短时间内检测,有些实验是在不同时间点上收细胞,这时我就等最后一次固定完了一块测,基本上也多在一周内检测完毕,没有特地去比较保存时间对检测结果的影响)。
3、细胞染色离心收集细胞,以1mL的PBS洗细胞一次,加入500uLPBS(含50ug/mL溴化乙锭(PI), 100ug/mL RNase A,0。
2% Triton X—100)4℃避光孵育30分钟(PI我是直接用PBS配成工作浓度,然后加入细胞沉淀混匀,RNA酶现加,但有时不加发现对实验结果也没太大的影响)。
4、流式分析以标准程序用流式细胞仪检测,一般计数2-3万个细胞,结果用细胞周期拟和软件Mod Fit分析.分析时,使用FL2-w和FL2-A显示,去除联体细胞,具体如下图。
细胞周期流式后一般分为G0/G1,S,G2/M期三部份,如果有凋亡,在G0/G1期前面有个凋亡峰(也称sub-G0期),而如果分析时细胞窗口没设置好,可能在最前面还有细胞碎片峰。
结果解读G0/G1期细胞占总的61.2%,峰位于横座标的45.76G2/M期占13.07,峰位于横座标的91.43S期占25。
73G2/G1为2.0(即G2期为4倍体细胞,而G1期为2倍体细胞,比值为2)峰的变异系数为4。
54%(好)细胞碎片为0.48%,细胞聚集体有0。
06%.总的细胞数(仪器检测到的)为17525个,在细胞周期中分析的细胞数为17431个(即排除了碎片及聚集体后)CV是变异系数.一般CV越小,峰形越好,越尖锐。
能控制在5%左右是比较好的结果,一般小于10%就可以认可了.Flow Cytometric Analysis of Cell CycleFixation1)Collect 2×106cells.2) Pellet cells by spinning at 1,000 rpm, 4°C for 5 minutes.3)Resuspend cell pellet in 1 ml of cold PBS。
流式细胞术

流式细胞术流式细胞术(flow cytometry)是利用流式细胞仪(flow cytometer)快速定量分析细胞群的物理化学特征以及根据这些物理化学特征精确分选细胞的新技术。
流式细胞仪通过接收激光照射后液流内细胞的散射光信号和荧光信号反映细胞的物理化学特征,如细胞的大小、颗粒度和抗原分子的表达情况等。
原理:流式细胞术是特定波长的激光束直接照射到高压驱动的液流,产生的光信号被多个接收器接收,一个是在激光束直线方向上接收到的散射光信号(前向角散射),其他是在激光束垂直方向上接收到的光信号,包括散射光信号(侧向角散射)和荧光信号。
液流中悬浮的直径从0.2~150μm的细胞能够使激光束发生散射光,细胞上结合的荧光素被激光激发后能够发射荧光。
散射光信号和荧光信号被相应的接收器接收,根据信号的强弱波动就能反映出每个细胞的物理化学特征。
三大要素:流式细胞术有三大要素,分别为流式细胞仪、样品细胞和荧光染料或者荧光素偶联抗体。
流式细胞术是在流式细胞仪上操作的,流式细胞仪根据其功能的不同可以分为分析型流式细胞仪和分选型流式细胞仪,前者只能流式分析,不能分选纯化目标细胞,后者能够同时进行流式分析和流式分选。
检测对象:流式细胞术检测的对象是细胞,而且是呈独立状态的悬浮于液体中的细胞,即单细胞悬液。
流式细胞术不能直接检测组织块中的细胞,要检测脏器或组织中的细胞,必须先用各种方法将脏器或组织制备成单细胞悬液,然后标记上荧光素偶联抗体,才能被流式细胞仪检测。
流式细胞术不能直接检测分子,但是用人工合成的颗粒代替细胞,然后将该分子的抗体与人工颗粒结合,可以间接检测分子,如用CBA法检测细胞因子等。
流式细胞术可以定量检测样品细胞的物理化学特征,其定量是以光信号为基础的,通过分析接收到的激光照射到细胞后的散射光信号和荧光信号完成定量分析。
样品细胞只有标记荧光染料或者荧光素偶联抗体进而被激光照射后才能发射荧光信号,从而得到样品细胞表达某抗原分子强弱情况等化学特征,否则只能通过分析散射光信号得到样品细胞体积大小和颗粒度等物理特征。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章流式细胞仪的结构和原理第1节流式细胞术发展史纵观历史,几乎没有哪一门科学技术象流式细胞术这样凝结了众多不同学术背景、不同科研领域科学家的心血。
从流式细胞术的发明、改进、革新,到今天在各个领域应用的拓展,每一步都是诸如生物学、生物技术、计算机科学、流体力学、激光技术、高等数学、临床医学、分子生物学、有机化学和生物物理学等学科知识综合运用的结晶。
现代流式细胞术更是由于结合了单克隆抗体技术、定量细胞化学技术和定量荧光细胞化学,使其在生物学、临床医学、药物学等等众多研究领域中的应用有了更加突飞猛进的发展。
临床流式细胞术发展趋势可归纳为:①流式细胞仪从单纯大型仪器发展为适应各种实际应用的便携式、台式、高分辨率、高质量分选的研究型流式细胞仪;②对流式细胞术检测荧光参数,从采用荧光单色、双色分析发展为多色分析,目前最多可同时检测15 种荧光信号;③从检测参数的相对定量发展为绝对定量;④从检测参数的手动人工分析发展为计算机软件的自动分析;⑤所采用的荧光试剂,从非配套试剂发展为配套的试剂盒试剂。
而这一切,就要求我们流式细胞仪使用者和科研人员一定要不断地有意识地学习上述各门学科知识,只有这样才能更好地将流式细胞术应用到生物医学的临床实践和基础科学研究工作中去。
流式细胞术的发展简史:1930年 Caspersson 和 Thorell 开始致力于细胞的计数;1934年 Moldaven 是世界上最早设想使细胞检测自动化的人,他试图用光电仪记录流过一根毛细管的细胞数量;1936年 Caspersson等引入显微光度术;1940年 Coons 提出用结合了荧光素的抗体去标记细胞内的特定蛋白;1947年 Guclcer 运用层流和湍流原理研制烟雾微粒计数器;1949年 Wallace Coulter 提出在悬液中计数粒子的方法并获得专利;1950年 Caspersson用显微分光光度计的方法在紫外线(UV)和可见光光谱区检测细胞:1953年 Croslannd-Taylor应用分层鞘流原理,成功地设计红细胞光学自动计数器;1953年Parker和Horst描述一种全血细胞计数器装置,成为流式细胞仪的雏形;1954年 Beirne和Hutcheon发明光电粒子计数器;1959年B型Coulter计数器问世;1965年 Kamemtsky等提出两个设想,一是用分光光计定量细胞成份;二是结合测量值对细胞分类;1967年 Kamemtsky和Melamed在Moldaven的方法基础上提出细胞分选的方法;1969年Van Dilla,Fulwyler及其同事们在Los Alamos,NM(即现在的National Flow Cytometry Resource Labs),发明第一台荧光检测细胞计;1972年 Herzenberg 研制出一个细胞分选器的改进型,能够检测出经荧光标记抗体染色的细胞的较弱的荧光信号;1975年Kochler和Milstein提出了单克隆抗体技术,为细胞研究中大量的特异的免疫试剂的应用奠定了基础。
从此,大量厂家不断研制生产出各具特色的流式细胞仪,流式细胞术进入了一个空前飞速发展的时代。
科学家们、仪器制造商们又纷纷将流式细胞仪的研究焦点转向染料的开发、细胞的制备方法和为提高电子信号的处理能力上来。
进入21 世纪,流式细胞术作为一门生物检测技术已经日臻完善,成为分析细胞学领域中无可替代的重要工具。
第2节流式细胞仪结构和工作原理流式细胞仪(Flow cytometry ,FCM)是一种集激光技术、电子物理技术、光电测量技术、电子计算机以及细胞荧光化学技术、单克隆抗体技术为一体的新型高科技仪器。
概括来说,流式细胞术就是对于处在快速直线流动状态中的细胞或生物颗粒进行多参数、快速的定量分析和分选的技术。
从开始设想到第一台仪器问世,科技工作者们进行了不懈的努力,随着各项相关技术的迅速发展,FCM技术已经成为日益完善的细胞分析和分选的重要工具。
流式细胞仪分为三大类:一类为台式机,临床型,其特点为:仪器的光路调节系统固定,自动化程度高,操作简便,易学易掌握,见图1-2-1。
图1-2-1 临床型台式流式细胞仪(左:BD FACSCalibur—2L,4F;右:Coulter EPICS XL/XL-MCL—1L,4F中:Partec,cyFlow—1L,3F)第二类为大型机,科研型,其特点为分辨率高,可快速将所感兴趣的细胞分选出来,并可以将单个细胞或指定个数的细胞分选到特定的培养孔或培养板上,同时可选配多种波长和类型的激光器,适用于更广泛更灵活的科学研究应用,见图1-2-2、1-2-3。
图1-2-2 大型科研型流式细胞仪(左:BD,FACSDiVa—14F,four-sorting;右:Coulter EPICS ALTRA—4L,8F;中:Partec,CyFlow SPACE―2L,6F)第三类为新型流式细胞仪,随着激光技术的不断发展,仪器选用2-4根激光管,最多检测十三个荧光参数,加上散射光信号可达到15个参数的同时分析。
并且可以实现高速分选,速度达到50,000个/秒,并可进行遥控分选,能够满足多种科学研究的要求。
图1-2-3 目前最新型流式细胞仪(左上:partec,CyFlow ML―FSC,2xSSC,FL1~FL13;右上:Coulter,Cytomics TM FC 500 左下:FACSAria,FSC,SSC,FL1-FL13;右下:BD,BD LSR,4L,10F)(一)流式细胞仪的结构FCM的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
见图1-2-4。
图1-2-4 流式细胞仪的光路结构1、流动室与液流驱动系统流动室(Flow Chamber 或 Flow Cell)是仪器核心部件,被测样品在此与激光相交。
流动室由石英玻璃钢制成,并在石英玻璃中央开一个孔径为430×180µm的长方形孔,供细胞单个流过,检测区在该孔的中心,这种流动室的光学特性良好,流速较慢,因而细胞受照时间长,可收集的细胞信号光通量大,配上广角收集透镜,可获得很高的检测灵敏度和测量精度。
流动室内充满了鞘液,鞘液的作用是将样品流环包,鞘液流是一种稳定流动,操作人员无法随意改变其流动的速度,样品流在鞘液的环包下形成流体力学聚焦,使样品流不会脱离液流的轴线方向,并且保证每个细胞通过激光照射区的时间相等,从而得到准确的细胞荧光信息,见图1-2-5。
图1-2-5 FCM的流动室和液流系统细胞流和鞘液流的驱动一般采用加正压的方法,流速和压力的关系服从Bernoulli方程,即P=(1/2)PV(勿略高度的变化),可见只要压力恒定,就可得到恒定的鞘液流流速,从而可确保每个细胞流经激光照射区的速度不变。
从图1-2-5可以知道,真空泵产生压缩空气,通过鞘液压力调节器加在鞘液上,一恒定的压力(压力的大小由工厂设定),这样鞘液以均速运动流过流动室,在整个系统运行中流速是不变的。
而改变样本的进样速率开关,可提高采样分析的速度。
但是,这并不是提高样本流的速度,而是改变了细胞间的距离,样品流变宽,细胞间距离缩短,这样单位时间内流经光照射区的细胞数就增加。
这种情况应在具体实验中引起注意,由于激光焦点处能量分布为正态分布(见图1-2-5),中心处能量最高,因此当样本速率选择高速(Hi)时,处在样品流不同位置的细胞或颗粒,受激光光照的能量不一样,从而被激发出的荧光强度也不相同,这样就会造成测量误差。
当在测量分辨率要求高时(如DNA分析)应选取用低速(Low)。
2、激光光源与光束成形系统目前台式机FCM,大多采用氩离子气体激光器。
激光(light amplification by stimulated emission of radiation , Laser)是一种相干光源,它能提供单波长、高强度及稳定性高的光照,是细胞微弱荧光快速分析的理想光源,这是因为由于细胞快速流动,每个细胞经过光照区的时间仅为1微秒左右,每个细胞所携带荧光物质被激发出的荧光信号强弱,与被照射的时间和激发光的强度有关,因此细胞必须达到足够的光照强度。
激光光束在达到流动室前,先经过透镜,将其聚焦,形成几何尺寸约为22×66μm即短轴稍大于细胞直径的光斑(见图1-2-6)。
这种椭圆形光斑激光能量分布属正态分布,为保证样品中细胞受到的光照强度一致,须将样本流与激光束正交且相交于激光能量分布峰值处,台式机FCM的光路调节对使用者是封闭的,即安装时由工程师调试完毕后,无需使用者作任何调节,所以使用者操作十分方便。
3、光学系统FCM的光学系统是由若干组透镜、滤光片、小孔组成,它们分别将不同波长的荧光信号送入到不同的电子探测器(见图1-2-6)。
在FCM的光学系统中主要光学原件是滤光片(Filter),主要分成3类:长通滤片(long-pass filter, LP)、短通滤片(short-pass filtr, SP)及带通滤片(band-pass filter, BP)。
(1)长通滤片:长通滤片使特定波长以上的光通过,特定波长以下的不通过。
如LP500滤片,将允许500μm以上的光通过,而500μm以下的光吸收或返回。
(2)短通滤片:与长通滤片相反,特定波长以下的光通过,特定波长以上的光吸收或返回。
如SP500滤片,将允许500μm以下的光通过,而500μm以上的光吸收或返回。
(3)带通滤片:带通滤片可允许相当窄的一波长范围内光通过,一般滤片上有两个数,一个为允许通过波长的中心值,另一为允许通过光的波段范围。
如BP500表示其允许通过波长范围为475μm-525μm。
图1-2-6 流式细胞仪的光学系统4、信号检测与分析系统当细胞携带荧光素标记物,通过激光照射区时,受激光激发,产生代表细胞内不同物质、不同波长的荧光信号,这些信号以细胞为中心,向空间360度立体角发射,产生散射光和荧光信号。
(1)散射光信号:散射光分为前向角散射(forward scatter,FSC)和侧向角散射(side scatter,SSC),散射光不依赖任何细胞样品的制备技术(如染色),因此被称为细胞的物理参数或称固有参数(见图1-2-7)。
①前向角散射:前向角散射与被测细胞的大小有关,确切说与细胞直径的平方密切相关,通常在FCM应用中,选取FSC作阈值,来排除样品中的各种碎片及鞘液中的小颗粒,以避免对被测细胞的干扰。
②侧向角散射:侧向角散射是指与激光束正交90o方向的散射光信号,侧向散射光对细胞膜、胞质、核膜的折射率更为敏感,可提供有关细胞内精细结构和颗粒性质的信息。
