肌红蛋白测定试剂盒(磁微粒化学发光法)产品技术要求meiliantaike
肌红蛋白(MYO)测定试剂盒(荧光免疫层析法)产品技术要求华科泰

肌红蛋白(MYO)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中肌红蛋白的含量。
1.1 包装规格10人份/盒、20人份/盒、50人份/盒。
1.2 主要组成成分每盒含10/20/50人份检测卡(每人份包装中含1袋干燥剂)、1个校准信息卡。
主要组成成分见表1:表12.1物理性能2.1.1 外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2 膜条宽度膜条的宽度≥3mm。
2.1.3 移行速度液体移行速度应不低于10 mm/min。
2.2 空白检测限空白检测限应不高于10 ng/mL。
2.3 准确度回收率应在85%~115%之间。
2.4 线性在企业线性范围内[10,500]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性用浓度为(25±2.5) ng/mL、(50±5) ng/mL和(450±45)ng/mL的样本重复检测15次,其变异系数(CV%)应不高于15.0%。
2.6 批间差用3个不同批号的检测卡分别检测浓度为(25±2.5)ng/mL、(150±15)ng/mL 的样本,则批间相对极差(R%)应不高于15.0%。
2.7 特异性表22.8 溯源性根据GB/T 21415-2008的有关规定,校准信息卡溯源至企业工作校准品,并与已上市产品比对赋值。
2.9 稳定性10℃~30℃保存,有效期12个月,效期后2个月内分别检测2.1~2.5、2.7项,其结果应符合各项要求。
肌红蛋白校准品产品技术要求senmeixikema

肌红蛋白校准品
适用范围:与本公司生产的试剂盒配套使用,用于肌红蛋白检测系统的校准。
1.1包装规格
水平1:1×0.5mL、水平2:1×0.5mL、水平3:1×0.5mL、水平4:1×0.5mL、水平5:1×0.5mL。
1.2主要组成成分
本产品状态为液体,是以人血清为基质,含肌红蛋白。
主要组分见表1:
表1主要组成成分
校准品靶值批特异,详见说明书。
2.1外观和性状
2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2应为无色或淡黄色澄清液体,无絮状物。
2.2准确度
做样品比对,待测系统与比对系统相关系数(r)应不小于0.975;在[200,500]ng/mL区间内,相对偏差应不超过±15%;在[10,200)ng/mL区间内,绝对偏差应不超过±30ng/mL。
2.3重复性
变异系数(CV)应不超过10%。
2.4批内瓶间差
变异系数(CV)应不超过10%。
2.5量值溯源
根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,本公司肌红蛋白校准品溯源至公司内部工作校准品,并与已上市产品比对赋值。
2.6稳定性
2.6.1开瓶稳定性
开瓶后的校准品在2℃~8℃条件下密闭保存,可以稳定3天,应符合2.2、2.3之规定。
2.6.2效期稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.2、2.3之规定。
肌红蛋白(MYO)测定试剂盒(磁微粒化学发光法)产品技术要求lideman

肌红蛋白(MYO)测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人体血清或血浆中的肌红蛋白(MYO)含量。
1.1规格100测试/盒。
1.2组成试剂盒由校准品、试剂1号、试剂2号、磁分离试剂和质控品组成。
试剂1号(5mL/瓶×2瓶):内容物含荧光素标记肌红蛋白单克隆抗体试剂2号(5mL/瓶×2瓶):内容物含碱性磷酸酶标记肌红蛋白单克隆抗体。
缓冲液:含1%羊血清蛋白、2%马血清蛋白、1%牛血清蛋白等的缓冲溶液。
磁分离试剂(2.5mL/瓶×2瓶):含有0.1%磁性微粒(共价包被抗荧光素抗体)和1%牛血清白蛋白的0.1mol/L Tris缓冲液,含0.2%w/v的NaN。
3校准品(0.5mL/瓶×6瓶):校准品分别含有0、25、100、300、500和1000ng/mL 的肌红蛋白,以含有的0.1mol/L Tris和0.2%w/v NaN的缓冲液配制而成。
3质控品(1.0mL/瓶×2瓶):2个水平,含一定量的肌红蛋白,以含有0.1mol/L Tris 的缓冲液配制而成。
质控范围详见质控单。
和0.2%w/v NaN32.1 试验条件以下所有试验,均要求环境温度为:18℃~25℃。
2.2 外观2.2.1试剂盒各组分应齐全、完整、液体无渗漏;2.2.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.2.3液体组分应澄清,无沉淀或絮状物;2.2.4包装标签应清晰,易识别。
2.3 特异性(交叉反应)试剂盒与表1中有关潜在交叉反应物应无显著的交叉反应表1 交叉反应2.4 准确度回收试验:应在85-115%范围内。
2.5 最低检测限应不大于2ng/mL。
2.6 线性在[2,1000]ng/mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.7 重复性用(60±12)ng/mL和(300±60)ng/mL 的样本各重复检测10次,其变异系数(CV)应不大于10%。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)产品技术要求tongxin

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中肌红蛋白(MYO)的含量。
1.1 包装规格
96人份/盒
1.2 主要组成成分
表1主要组成成分
注:校准品采用贝克曼MYO检测试剂盒(磁颗粒化学发光法)比对赋值,校准品(A~F)目标浓度为0、20、200、1000、2000、3000ng/ml。
2.1 外观
组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量
液体装量应不少于标示值。
2.3 准确度
在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在
85~115%范围内。
2.4 线性
在线性范围 [10,3000]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限
应不大于10ng/ml。
2.6 重复性
变异系数(CV)应不大于10.0%。
2.7 批间差
批间变异系数(CV)应不大于15.0%。
2.8 分析特异性
测定浓度为5mg/ml血红蛋白,交叉反应率小于0.002%。
2.9 稳定性
产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语
4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析
4.2 MYO:Myoglobin肌红蛋白
4.3 RLU:Relative Light Unit相对光单位。
肌红蛋白的化学发光定量检测试剂盒及其制备方法和检测方法[发明专利]
![肌红蛋白的化学发光定量检测试剂盒及其制备方法和检测方法[发明专利]](https://img.taocdn.com/s3/m/147322ea0740be1e640e9a5f.png)
专利名称:肌红蛋白的化学发光定量检测试剂盒及其制备方法和检测方法
专利类型:发明专利
发明人:韩美玉,王立英,孙成艳,高威,何浩会
申请号:CN201910235330.1
申请日:20190327
公开号:CN109991425A
公开日:
20190709
专利内容由知识产权出版社提供
摘要:本发明公开了一种肌红蛋白的化学发光定量检测试剂盒及其制备方法和检测方法,属于体外诊断试剂技术领域,解决现有技术灵敏度较低、反应时间较长、成本高等技术问题。
试剂盒包括以下试剂:R1:含有链霉亲和素包被的磁微粒的缓冲液;R2:含有化学发光标记物标记的肌红蛋白单克隆抗体的缓冲液。
R3:含有偶联标记物标记的肌红蛋白单克隆抗体的缓冲液;本发明采用双抗体夹心法的原理,利用亲和素‑偶联标记物体系,以及采用化学发光标记物进行化学发光,大大提高了试剂盒的检测灵敏度,减少反应时间,降低试剂成本,可用于血清/血浆中的肌红蛋白含量的定量检测。
申请人:迪瑞医疗科技股份有限公司
地址:130103 吉林省长春市高新区宜居路3333号
国籍:CN
代理机构:长春众邦菁华知识产权代理有限公司
代理人:刘微
更多信息请下载全文后查看。
心肌肌钙蛋白I测定试剂盒(磁微粒化学发光法)产品技术要求huaketaikang
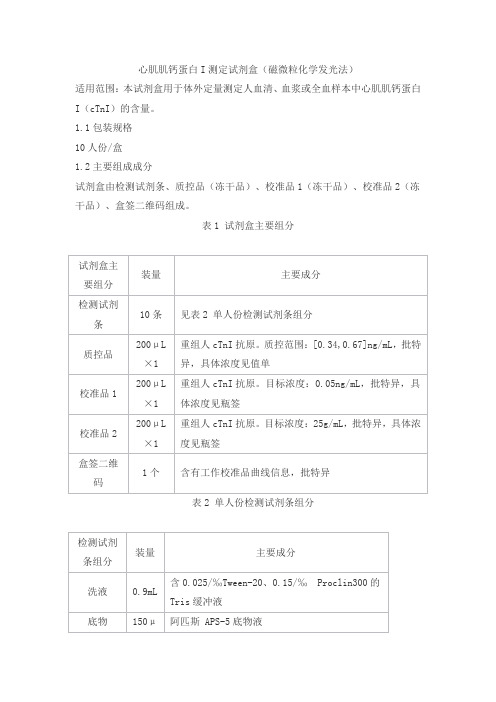
心肌肌钙蛋白I测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血样本中心肌肌钙蛋白I(cTnI)的含量。
1.1包装规格10人份/盒1.2主要组成成分试剂盒由检测试剂条、质控品(冻干品)、校准品1(冻干品)、校准品2(冻干品)、盒签二维码组成。
表1 试剂盒主要组分表2 单人份检测试剂条组分2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至出厂商的工作校准品。
2.3准确度将已知浓度的肌钙蛋白I加入到低值样本中,其回收率应在[85%,115%]范围内。
2.4空白限零浓度样本做20次重复,空白限应≤0.01ng/mL。
2.5线性在[0.05, 50]ng/mL的线性范围内,相关系数r应≥0.990。
2.6重复性对高、低值样本各测试10次,CV≤10%。
2.7批间差用三个批号的试剂盒对高、低值样本各测试10次,CV≤15%。
2.8 特异性浓度为1000ng/mL的心肌肌钙蛋白C(cTnC)、心肌肌钙蛋白T(cTnT)、骨肌心肌肌钙蛋白I(sTnI)交叉反应率应小于5%。
2.9质控品赋值有效性测定值在质控品质控范围内。
2.10校准品和质控品瓶间差校准品和质控品瓶间差CV<10%2.11稳定性2.11.1效期稳定性取效期后的试剂盒检测外观、准确度、空白限、线性、重复性、特异性,应符合2.1、2.3~2.6、2.8的要求。
2.11.2 质控品复溶稳定性质控品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测质控品重复性和赋值有效性,应符合2.6、2.9的要求。
2.11.3 校准品复溶稳定性校准品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测准确度和线性,应符合2.3、2.5的要求。
肌红蛋白(Myo)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求北京中航赛维

肌红蛋白(Myo)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中的肌红蛋白(Myo)的含量。
1.1产品规格
50测试/盒,100测试/盒,200测试/盒
1.2主要组成成分
注:校准品和质控品浓度具有批特异性,具体浓度详见每批的校准品和质控品标签。
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应澄清,无沉淀或絮状物;
2.1.4包装标签应清晰,易识别;
2.2溯源性
应根据GB/T21415-2008及有关规定提供校准品的来源、溯源的赋值方法和相应指标、以及不确定度等内容。
本试剂盒校准品可溯源至企业工作校准品,并与已上市产品比对赋值。
2.3准确度
回收率应在85%-115%范围内。
2.4分析特异性
测定浓度为10mg/mL的血红蛋白,其测定结果应不高于1ng/mL。
2.5空白限
应不大于1ng/mL。
2.6线性
在[3,2000]ng/mL的测量范围内,相关系数r应≥0.9900。
2.7重复性
变异系数(CV)应不大于8%。
2.8质控品的赋值有效性
质控品的测量值应在质控范围内。
2.9批间差
变异系数(CV)应不大于15.0%。
2.10稳定性
试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.3、2.4、2.5、2.6、2.7和2.8的要求。
肌红蛋白测定试剂盒说明书

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载肌红蛋白测定试剂盒说明书地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30 人份/盒、2×50 人份/盒、2×100 人份/盒【预期用途】用于体外定量测定人体血清或(和)血浆中肌红蛋白的含量。
肌红蛋白(MYO)分子量为 17.8 kD,由一个多肽链和一个亚铁血红素辅基组成,由人体骨骼肌和心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌和心肌来源的两种肌红蛋白无免疫学上的差异。
肌红蛋白的主要生理功能为携带氧气供细胞呼吸。
肌红蛋白是检测急性心肌梗死(AMI) 的早期指标,具有极高的灵敏度但是特异性较差,在 AMI 早期心肌细胞受损,由于 MYO 的分子量小,可以很快从破损的细胞中释放出来,在 AMI 发病 1~3 小时后血中浓度迅速上升,6~7 小时达峰值,12 小时内几乎所有 AMI 患者 MYO 都有升高,升高幅度大于各心肌酶,因此可以作为 AMI 的早期诊断标志物。
由于 MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重的充血性心力衰竭、长时间休克及各种原因引起的肌病患者、肌内注射、剧烈的锻炼、某种毒素和药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断 AMI 的早期指标,仅限于没有上述相关疾病的患者。
在有急性症状的患者中,4 小时内 MYO 水平不升高,AMI 的可能性极低。
由于在AMI 后血中 MYO 很快从肾脏清除,发病 l8~30 小时内可完全恢复到正常水平。
肌红蛋白质控品产品技术要求zhongshengbeikong

亮氨酸氨基肽酶测定试剂盒(L-亮氨酰-P-硝基苯胺底物法)适用范围:本产品用于体外定量测定人血清或血浆中亮氨酸氨肽酶的浓度。
1.1规格液体双剂型试剂1(R1):60mL×4,试剂2(R2):30mL×2;试剂1(R1):60mL×2,试剂2(R2):15mL×2;试剂1(R1):50mL×4,试剂2(R2):25mL×2;试剂1(R1):24mL×2,试剂2(R2):12mL×1;选配质控品:冻干粉型(2个水平):5mL×2。
1.2规格划分说明根据净含量、复溶体积划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体和选配质控品冻干粉组成。
1.3.1 试剂1(R1)液体:磷酸缓冲液100mmol/L1.3.2 试剂2(R2)液体:L-亮氨酰-P-硝基苯胺 20mmol/L1.3.3 质控品冻干粉:人血清水平1:15 U/L~70U/L;水平2:20 U/L~350U/L(每批定值)。
2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;c) 质控品应为白色或淡黄色冻干粉,复溶后应为无色或浅黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和试剂空白吸光度变化率在波长405nm(400nm~420nm)(光径1cm)处,试剂空白吸光度(A)应≤1.0000,试剂空白吸光度变化率(△A/min)的绝对值≤0.0100。
2.4准确度测定亮氨酸氨基肽酶纯品,回收率在80%~120%范围内。
2.5 分析灵敏度对应于浓度为100U/L的亮氨酸氨基肽酶所引起的吸光度变化率(△A/min)的绝对值应在0.005~0.080的范围内。
肌红蛋白纳米磁微粒化学发光免疫定量检测试剂盒及其设备制作方法与制作流程

图片简介:本技术介绍了一种肌红蛋白(MYO)纳米磁微粒化学发光免疫定量检测试剂盒,所述试剂盒包括:肌红蛋白校准品;偶联有链霉亲和素的纳米磁微粒悬浮液;生物素标记的肌红蛋白抗体;肌红蛋白抗体酶结合物,所用的酶为辣根过氧化物酶,辣根过氧化物酶纯度RZ≥3.0,活性≥250U/mL;肌红蛋白质控品;化学发光液A液和B液;20倍浓缩洗液;反应管。
另外本技术还介绍了本技术试剂盒的制备方法。
本技术试剂盒与现有试剂盒相比敏感性高、可测定浓度范围宽、试剂有效期长、操作简单、检测自动化程度高等优点。
技术要求1.一种肌红蛋白纳米磁微粒化学发光免疫定量检测试剂盒,所述试剂盒包括:1)肌红蛋白校准品,浓度为0,5,25,100,250,1000ng/mL;2)偶联有链霉亲和素的纳米磁微粒悬浮液;所述的纳米磁微粒是表面包裹带有氨基或羧基活性基团的四氧化三铁,粒径10-50nm;3)生物素标记的肌红蛋白抗体,所述抗体为单克隆抗体;4)肌红蛋白抗体酶结合物,所用抗体为单克隆抗体,与生物素标记的肌红蛋白抗体不为同一株,所用的酶为辣根过氧化物酶,辣根过氧化物酶纯度RZ≥3.0,活性≥250U/mL;5)肌红蛋白质控品;质控品包括浓度10ng/mL的低值质控品和500ng/mL的高值质控品;6)化学发光液A液和B液;A液为5mmol/L,pH8.6的Tris-HCl缓冲液,且该缓冲液中含有终浓度0.7g/L鲁米诺和终浓度0.165g/L对碘酚;B液为0.675g/L过氧化脲;7)20倍浓缩洗液;8)反应管,所述反应管的材料是透明聚苯乙烯、透明聚乙烯、透明聚丙烯或透明玻璃;其特征在于,所述试剂盒制备包括以下步骤:(1)肌红蛋白校准品的配制:将肌红蛋白抗原用山羊血清配制成校准品浓储液,以企业标准品进行定标,将浓储液用山羊血清稀释至工作浓度,分别为0,5,25,100,250,1000ng/mL;(2)肌红蛋白质控品的配制:用山羊血清将上述浓储液稀释至10ng/mL和500ng/mL,将10ng/mL作为低值质控,500ng/mL作为高值质控;(3)纳米磁微粒-链霉亲和素悬浮液的制备:A、四氧化三铁纳米磁微粒制备采用沉淀法制备四氧化三铁纳米磁微粒,具体制备方法如下:1)将FeCl3·6H2O和FeCl2·4H2O以摩尔比2:1加入到蒸馏水中,剧烈搅拌溶解;2)在氮气环境下加0.5M氨水于上述铁盐溶液中,调pH9-10,反应温度65℃,反应时间45min;3)反应结束后,用蒸馏水洗涤至中性,弃上清,于60℃烘干,即得10-50nm的四氧化三铁纳米磁微粒;B、纳米磁珠表面羧基的偶联采用分散聚合法进行偶联,具体制备方法如下:取上述制备的纳米磁微粒超声分散在10%PEG8000溶液中,得磁流体溶液,向磁流体溶液中按体积比1:10加入无水乙醇,搅拌30min后,移入带有搅拌器,冷凝管,氮气入口的三颈瓶中,加入交联剂N,N’-亚甲基双丙烯酰胺;在氮气的保护下,升温至60±1℃,恒温搅拌30min,之后依次加入过氧化苯甲酰,用量为磁流体用量的3%,搅拌速度约为500rpm,苯乙烯体积同磁流体溶液,丙烯酸体积为磁流体溶液的1/4,保持氮气气流,其余条件保持不变,反应8-10h,所得产物静置,用蒸馏水反复洗涤,再用盐酸调节pH=1,浸泡24h,静置;再用蒸馏水反复洗涤,除去未包覆的Fe3O4磁粉,把沉淀下来的产品放入真空干燥箱中50℃下干燥24h,得到表面联有羧基的纳米磁微粒;C、纳米磁微粒-链霉亲和素悬浮液的制备,配制1L,方法如下:取100mL0.1M MES缓冲液,加入10mg表面联有羧基的纳米磁微粒,室温搅拌40min,之后加入3.5mg链霉亲和素,然后加入8mg/mLEDC溶液,2-8℃反应1h后,用0.01M PBS缓冲液洗涤3次,最后用0.01M PBS定容至1L即可;(4)生物素标记的肌红蛋白抗体的制备取0.8mg肌红蛋白抗体,用硼酸盐缓冲液在2~8℃下透析1~3h;将透析后的抗体加入30μg生物素,同时加入二甲基亚砜,使二甲基亚砜最终浓度5-10%,缓慢振荡,避光反应3h;在上述溶液中加入250μL1M氯化铵溶液,常温避光反应30-60min;用0.01M PBS溶液在2~8℃下透析24h,期间换液2-4次;(5)肌红蛋白抗体酶结合物的制备采用改良高碘酸钠氧化法将肌红蛋白抗体与辣根过氧化物酶进行偶联后,用酶稀释液将其稀释至工作浓度1:5000,并加入13%酶稳定剂,储存于2~8℃;酶稀释液中包括10mL/L 2M NaOH,15g/L NaCl,10g/LBSA,5g/L Dextran T-2000,1.05g/L Triton X-100,2.5mL/L硫酸庆大霉素,1mL/L胭脂红,胭脂红为粉末固体,配制成浓度40mg/mL以后使用,2g/L Tween-20,1mL/L ProClin300;(6)20倍浓缩洗液的配制20倍浓缩洗液包括58g/L磷酸氢二钠,5.92g/L磷酸二氢钠,180g/L NaCl,10mL/L Tween-20和2%Proclin300;(7)化学发光液A液和B液的配制A液为0.7g/L鲁米诺,0.165g/L对碘酚,缓冲液为pH8.6的5mmol/L Tris-HCl,避光保存;B液为0.675g/L过氧化脲,用工艺用水配制;A液和B液在使用前5min混合;(8)组装:将上述试剂组装成盒,储存于2~8℃;(9)对采用该方法制备的试剂盒进行物理检查,对准确度、剂量-反应曲线的线性、精密度、特异性、灵敏度、质控品的测定值和稳定性进行测定。
肌红蛋白测定试剂盒(直接化学发光法)产品技术要求ja
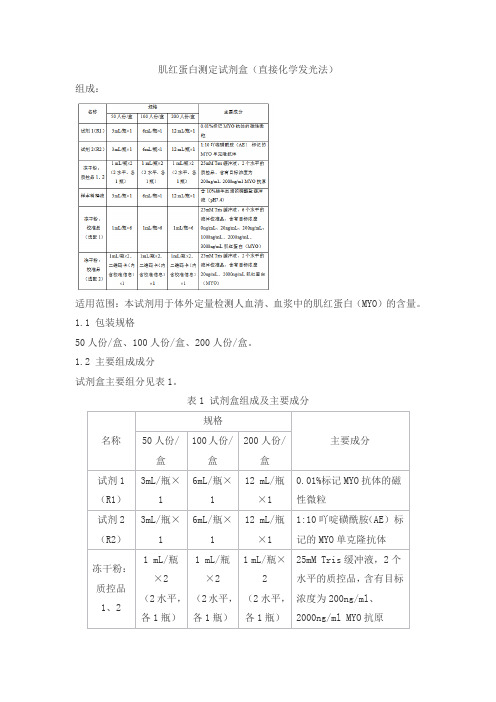
肌红蛋白测定试剂盒(直接化学发光法)组成:适用范围:本试剂用于体外定量检测人血清、血浆中的肌红蛋白(MYO)的含量。
批特异性:每批校准品的值、质控品的质控范围具有特异性,详见瓶签。
以上校准品(选配1)、校准品(选配2)须选择一项获取校准信息。
2.1 物理性状2.1.1外观本试剂盒中的组分齐全、完整,液体试剂澄清,无异物、沉淀物、絮状物和无渗漏。
各组分标签字迹清晰、无破损。
质控品、校准品为淡黄色冻干品,用蒸馏水复溶后应为淡黄色液体。
2.1.2 装量液体装量不少于标示值。
2.2线性在[2,3000]ng/mL范围内,用线性拟合公式拟合,相关系数应不低于0.9900。
2.3准确度将已知浓度的肌红蛋白(MYO)加入到低值样本中,其回收率应在85%-115%。
2.4空白限本试剂盒的空白限不大于2ng/mL。
2.5重复性分别用高、低2个浓度的样本,各重复检测10次,其变异系数(CV)不大于8.0%。
2.6 批间差用3个批号试剂盒分别检测高、低2个浓度的样本,则3个批号试剂盒之间的批间变异系数(CV)不大于15%。
2.7 质控品、校准品批内瓶间差质控品、校准品批内瓶间差CV(%)应不高于10%。
2.8特异性检测表2中相应浓度的交叉反应物,检测结果应小于2ng/mL。
表2 被测物常见的交叉反应物2.9 质控品赋值有效性质控品测定结果应在本试剂盒规定的范围内。
2.10 校准品溯源性应根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用校准品的来源、赋值过程以及测量不确定度等内容,校准信息可溯源至本公司工作校准品,工作校准品与已上市肌红蛋白检测系统比对赋值。
2.11 稳定性2.11.1效期稳定性将试剂盒在2℃~8℃的环境中放置12个月后,分别检测2.1、2.2、2.3、2.4、2.5、2.9项,结果应符合各项目的要求。
2.11.2复溶稳定性质控品复溶后在2℃~8℃条件下储存28天后,产品性能应符合2.7、2.9规定的要求。
肌红蛋白测定试剂盒说明书

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30人份/盒、2×50 人份/盒、2×100人份/盒【预期用途】用于体外定量测定人体血清或(与)血浆中肌红蛋白得含量。
肌红蛋白(MYO)分子量为17、8 kD,由一个多肽链与一个亚铁血红素辅基组成,由人体骨骼肌与心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌与心肌来源得两种肌红蛋白无免疫学上得差异。
肌红蛋白得主要生理功能为携带氧气供细胞呼吸。
肌红蛋白就是检测急性心肌梗死(AMI) 得早期指标,具有极高得灵敏度但就是特异性较差,在AMI 早期心肌细胞受损,由于MYO得分子量小,可以很快从破损得细胞中释放出来,在AMI发病1~3小时后血中浓度迅速上升,6~7小时达峰值,12 小时内几乎所有AMI 患者MYO 都有升高,升高幅度大于各心肌酶,因此可以作为AMI 得早期诊断标志物。
由于MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重得充血性心力衰竭、长时间休克及各种原因引起得肌病患者、肌内注射、剧烈得锻炼、某种毒素与药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断AMI得早期指标,仅限于没有上述相关疾病得患者。
在有急性症状得患者中,4小时内MYO 水平不升高,AMI 得可能性极低.由于在AMI 后血中MYO 很快从肾脏清除,发病l8~30 小时内可完全恢复到正常水平.故MYO 测定有助于在AMI病程中观察有无再梗塞或者梗塞再扩展。
MYO频繁出现增高,提示原有心肌梗死仍在延续。
另外,在神经肌肉疾病如肌营养不良、肌萎缩与多肌炎时血清MYO水平亦升高。
心脏外科手术患者血清MY O升高,可以作为判断心肌损伤程度及愈合情况得一项客观指标。
【检验原理】肌红蛋白测定采用双位点夹心化学发光免疫分析法,其检测原理如下:第一步:将样本与包被着抗肌红蛋白抗体得超顺磁性微粒(磁珠)以及抗肌红蛋白抗体—碱性磷酸酶标记物添加到反应管中,经过孵育,样本中得肌红蛋白与包被在磁珠上得抗肌红蛋白抗体结合,同时抗肌红蛋白抗体-碱性磷酸酶标记物与样本中肌红蛋白另一位点结合。
肌红蛋白测定试剂盒(荧光免疫层析法)产品技术要求北京康思润业

肌红蛋白测定试剂盒(荧光免疫层析法)组成:每种包装规格含相应人份数的检测卡、加样枪头、干燥剂、样品缓冲液及1个校准信息卡。
预期用途:用于体外定量测定人全血、血清、血浆中肌红蛋白(Myo)含量。
2.1 外观2.1.1 检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2.1.2 缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2 宽度试纸条宽度为4.0±0.2mm。
2.3 移行速度液体移行速度不低于10mm/min。
2.4 空白限试剂盒的空白限不大于2.4ng/mL。
2.5 线性在[2.4,400]ng/mL 范围内,线性相关系数应满足r≥0.990。
2.6 重复性用高浓度(200~300)ng/mL、低浓度(20~120)ng/mL两水平质控品重复测定10次,其测定值的变异系数(CV)应不大于10%。
2.7 准确度用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.8 特异性取不含肌红蛋白的EDTA全血样本,加入以下物质平行检测3次,结果均应不大于2.4 ng/mL。
表1特异性物质信息2.9 批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于15%。
2.10 稳定性原包装的试剂盒在2℃~30℃贮存,有效期为18个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.3,2.4,2.5,2.6,2.7,2.8项,结果应符合各项目的要求。
2.11 溯源性根据GB/T 21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
肌红蛋白测定试剂盒[实用新型专利]
![肌红蛋白测定试剂盒[实用新型专利]](https://img.taocdn.com/s3/m/ae5415fb6c175f0e7dd137c6.png)
专利名称:肌红蛋白测定试剂盒专利类型:实用新型专利
发明人:俞慧英,栾国金
申请号:CN201620952239.3申请日:20160825
公开号:CN206411126U
公开日:
20170815
专利内容由知识产权出版社提供
摘要:肌红蛋白测定试剂盒,第一试剂瓶上成型有第一试剂瓶螺纹瓶嘴、第一试剂瓶螺纹瓶嘴上螺接有密封第一试剂瓶瓶盖,第一试剂瓶螺纹瓶嘴位于第一试剂瓶的等腰梯形的大头端;第一试剂瓶的前侧面成型有第一试剂瓶半圆筋,第一试剂瓶的左右侧面上分别成型有外表面为弧面的第一试剂瓶凸柱筋;第一试剂瓶的纵向长度大于第二试剂瓶的纵向长度,第二试剂瓶的横向长度大于第一试剂瓶,第一试剂瓶和第二试剂瓶等高,第一试剂瓶和第二试剂瓶插套在泡沫块上相配合的插槽中。
它的试剂瓶拿放和用手拿着呈倾斜状更为方便,可以更方便地让操作人员拿着试剂瓶,同时方便操作人员一眼识别二种试剂瓶。
申请人:浙江康特生物科技有限公司
地址:312500 浙江省绍兴市新昌县省级高新技术产业园区(七星街道铁圈山2号)
国籍:CN
代理机构:北京众合诚成知识产权代理有限公司
更多信息请下载全文后查看。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肌红蛋白测定试剂盒(磁微粒化学发光法)
适用范围:本试剂盒用于体外定量测定人血清、血浆或全血样本中肌红蛋白(Myo)的含量。
1.1包装规格
10人份/盒
1.2主要组成成分
试剂盒由检测试剂条、质控品(冻干品)、校准品1(冻干品)、校准品2(冻干品)、盒签二维码组成。
表1 试剂盒主要组分
表2 单人份检测试剂条组分
2.1外观
试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性
根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至出厂商的工作校准品。
2.3准确度
将已知浓度的肌红蛋白(Myo)加入到低值样本中,其回收率应在[85%,115%]范围内。
2.4空白限
零浓度样本做20次重复,空白限应≤5ng/mL。
2.5线性
在[25, 1000] ng/mL的线性范围内,相关系数r应≥0.990。
2.6重复性
对高、低值样本各测试10次,CV≤10%。
2.7批间差
用三个批号的试剂盒对高、低值样本各测试10次,CV≤15%。
2.8 特异性
浓度为1000mg/dL 的血红蛋白交叉反应率应小于5%。
2.9质控品赋值有效性
测定值在质控品质控范围内。
2.10校准品和质控品瓶间差
校准品和质控品瓶间差CV<10%。
2.11稳定性
2.11.1效期稳定性
取效期后的试剂盒检测外观、准确度、空白限、线性、重复性、特异性,应符合2.1、2.3~2.6、2.8的要求。
2.11.2 质控品复溶稳定性
质控品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测质控品重复性和赋值有效性,应符合2.6、2.9的要求。
2.11.3 校准品复溶稳定性
校准品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测准确度和线性,应符合2.3、2.5的要求。
