(完整word版)中考化学专题复习—化学式化合价化学方程式.doc
(完整word版)初中常见化合价、化学式、化学方程式

初中常见化学式和化学方程式一、常见元素原子团化合价口诀元素化合价口诀:钾钠氢银正一价,氟氯溴碘负一价,钙镁钡锌正二价,通常氧是负二价,铜有正一、正二价,铁有正二、正三价,铝是正三价,硅是正四价,碳是正二、正四价,单质元素化合价为零!原子团化合价口诀:NH4+(铵根离子)、NO3-(硝酸根离子)、OH-(氢氧根离子)、CO32-(碳酸根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO42-(硫酸根离子)、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)初中常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S + O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O2 2CO29、二氧化碳和水反应生成碳酸:CO2 + H2O == H2CO310、二氧化碳通过灼热的炭层:CO2 + C 2CO点燃点燃点燃点燃点燃点燃点燃高温点燃11、生石灰作为干燥剂:CaO + H2O == Ca(OH)2二、分解反应11、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑12、氯酸钾制氧气:2KClO3 2KCl + 3O2↑13、双氧水制氧气:2H2O22H2O + O2↑14、电解水:2H2O 2H2↑+ O2↑15、碳酸分解:H2CO3H2O + CO2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO3 CaO +CO2↑三、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag + Cu(NO3)218、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO419、锌和硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑20、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑21、木炭还原氧化铁:3C + 2Fe2O34Fe + 3CO2↑木炭还原氧化铜:C + 2CuO 2Cu + CO2↑木炭还原四氧化三铁:2C + Fe3O43Fe +2CO2↑氢气还原氧化铜:H2 + CuO Cu + H2O四、复分解反应(一)酸 + 碱→盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H2O23、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O25、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O(二)酸 + 盐→新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl + AgNO3 == AgCl↓+ HNO3△MnO2△MnO2通电高温高温高温高温高温27、氯化钡溶液与硫酸溶液反应:BaCl2 + H2SO4== BaSO4↓+ 2HCl28、碳酸钠与稀盐酸:Na2CO3+ 2HCl == 2NaCl+ H2O + CO2↑碳酸氢钠与稀盐酸:NaHCO3 + HCl == NaCl+ H2O + CO2↑29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓31、氯化铁溶液和氢氧化钠溶液反应:FeCl3+3NaOH==Fe(OH)3↓+3NaCl(四)盐 + 盐→两种新盐32、硝酸银溶液与氯化钠溶液反应:AgNO3 + NaCl == AgCl↓+ NaNO333、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl(五)金属氧化物 + 酸→盐 + 水34、稀盐酸清洗铁锈:6HCl + Fe2O3== 2FeCl3+ 3H2O35、氧化铜与稀硫酸反应:CuO + H2SO4== CuSO4+ H2O五、非金属氧化物 + 碱→盐 + 水36、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2== CaCO3↓+ H2O37、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O38、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH==Na2SO3+ H2O39、氢氧化钠溶液吸收三氧化硫:SO3 + 2NaOH==Na2SO4+ H2O六、其他反应类型40、一氧化碳还原氧化铜:CO + CuO Cu + CO241、一氧化碳还原氧化铁:3CO + Fe2O32Fe + 3CO2↑42、一氧化碳还原四氧化三铁:4CO + Fe3O43Fe + 4CO2↑43、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O44、甲烷燃烧:CH4 + 2O2CO2+ 2H2O△点燃点燃高温高温。
中考化学专题复习 化学式 化合价

中考专题复习化学式化合价命题点分类集训命题点1化学式的书写及判断1.下列物质化学式书写正确的是()A. 铝:ALB. 氯化钾:KCl2C. 硫酸铜:CuSO4D. 四氧化三铁:O4Fe32.某同学制作的试剂标签如下,其中化学式书写不正确...的是()3.下列各组物质的俗称、化学式、用途不一致的是()4.从H、O(1)生活中最常用的溶剂是_____;(2)常用作食品干燥剂的氧化物是_____;(3)次氯酸钠溶液中的溶质是_____。
5. (2016荆门)写出符合下列要求的物质的化学式:(1)世界年产量最高的金属________;(2)通常状况下,一种有毒性的气态氧化物________;(3)汽车用铅酸蓄电池中含有的酸________;(4)可用于治疗胃酸过多的碱________;(5)可用于给人体补钙的盐________;(6)一种有机氮肥________。
命题点2化学式的意义及其相关计算6.化学式“H2O”表示意义错误的是()A. 水这种物质B. 一个水分子C. 水是由氢、氧两种元素组成D. 水是由两个氢原子和一个氧原子构成7.我国许多地区的家用燃料是天然气。
天然气的主要成分是甲烷,下列说法正确的是()A. 甲烷的相对分子质量为16 gB. 32 g甲烷含有24 g碳元素C. 甲烷中碳、氢元素的质量比为1∶4D. 甲烷由1个碳原子和4个氢原子构成8.炒菜时加点酒和醋能使菜味香可口,原因是有酯类物质生成。
下列有关乙酸乙酯的叙述正确的是()A. 乙酸乙酯是由碳、氢、氧元素组成的有机物B. 乙酸乙酯由碳、氢、氧原子构成C. 乙酸乙酯中碳、氧元素的质量比为2∶1D. 乙酸乙酯中氧元素的质量分数最大第8题图9.食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中代表一个碳原子,代表一个氢原子,代表一个氧原子。
下列说法不正确的是()A. 乙酸是一种化合物B. 乙酸的相对分子质量为60C. 乙酸中碳元素的质量分数为60%D. 乙酸分子中的碳原子、氢原子、氧原子的个数比为1∶2∶1 第9题图命题点3化合价10. 下列物质中氯元素化合价为零的是()A. KClB. Cl2C. KClO3D. NH4Cl11.铬酸钾(K2CrO4)是印染、医药、电焊、搪瓷等工业的原料。
[全]中考初中化学“化学式、化合价”必考知识点总结
![[全]中考初中化学“化学式、化合价”必考知识点总结](https://img.taocdn.com/s3/m/5ad2add8a6c30c2258019ea3.png)
初中化学“化学式、化合价”必考知识点总结
1.化学式
1.概念:用元素符号和数字表示物质组成的式子
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个2.化学式表示的含义(一般包括宏观和微观)
3.化学式的写法和读法
2.化合价
含义:由于形成化合物的元素有固定的原子个数比,所以化学上就用“化合价”来表示原子之间相互化合的数目
化合价的表示方法
化合价的一般规律
①单质中,元素的化合价为0,在化合物中,正、负化合价代数和为0
②在化合物中,氢元素的化合价通常为+1价,氧元素的化合价通常显示-2价
③金属元素在化合物里显正价,非金属元素在和金属元素化合时,通常显负价
④一些元素在不同物质中可显不同的化合价,如Fe有+2、+3价,S有-2、+4、-6价
备注:这里介绍两种化合价口诀供给同学们记忆:
口诀1:
一价钾钠氯氢银;
二价氧钙钡镁锌;
三铝四硅五价磷;
二三铁,二四碳;
二四六硫都齐全;
铜汞二价最常见;
莫忘单质为零价。
口诀2:
钾钠银氢正一价,钙镁钡锌正二价;氟氯溴碘负一价,通常氧是负二价;铜正一二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正。
【必背离子】
3.根据化学式的计算
(1)某物质的相对分子质量的计算
将化学式中所有的原子的相对原子质量相加之和,即是该物质的相对分子质量(2)计算化合物中的原子个数之比
(5)计算一定质量的物质中某元素的质量
某元素的质量=物质的质量×该元素在物质中的质量分数
小结归纳:
调皮的数字——不同位置的数字意义
元素符号周围数字的意义。
(完整word版)人教版_初三化学全册必背知识点(精华)

初中化学上册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OH-NO3-CO32-SO4 2-PO43-NH4+2、化合价口诀(1) 常见元素化合价口诀:钾钠银氢正一价;氟氯溴碘负一价;钙镁钡锌正二价; 铜一二铁二三铝三硅四氧负二二四六硫二四碳(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
4(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al ,Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) ,除了有颜色的固体,其他固体一般为白色。
2、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫磺:淡黄色4、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
中考化学化学方程式的计算20篇(附带答案解析)(word)

中考化学化学方程式的计算20篇(附带答案解析)(word)一、中考化学方程式的计算1.利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。
每次取100 g样品配制成溶液,向其中加入质量分数为10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:(1)求粗盐的纯度________。
(2)当样品与所加氢氧化钠溶液恰好完全反应时,求溶液中氯化钠的质量________。
(写出解题过程)【答案】90.5% 102.2 g【解析】【分析】【详解】解:根据题意设样品中MgCl2的质量为x,反应生成NaCl的质量为y。
22 MgCl2NaOH=2NaCl+Mg(OH)9511758x y 5.8g ↓+95x=58 5.8gx=9.5g117y=58 5.8gy=11.7gx=9.5 g,y=11.7 g(1)该粗盐纯度为:100g-9.5g100%=90.5% 100g⨯(2)当恰好完全反应时,溶液中氯化钠的质量为:100 g-9.5 g+11.7 g=102.2 g答:(1)样品中粗盐的纯度为90.5%;(2)恰好完全反应时,溶液中氯化钠的质量为102.2 g。
2.向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示,求(1)镁粉的质量_____;(2)NaOH 溶液的溶质质量分数_____. 【答案】3.6g 30% 【解析】 【分析】 【详解】(1)由图8可知,生成的2Mg(OH)质量为8.7g ,则:2Mg(OH)中金属镁的质量即为镁粉的质量:248.7g 3.6g 58⨯=; (2)由图8可知,与硫酸镁反应的NaOH 溶液质量为120g-80g=40g ,设NaOH 溶液的溶质质量分数为x ,则42422NaOH MgSO Na SO Mg(OH)+=805840gx 8.7g+↓8058=40gx 8.7g解得x=30% 。
中考化学同步考点梳理:化学式与化合价(含答案)

2019-2020年中考化学同步考点梳理:化学式与化合价(含答案)知识梳理一、化学式用元素符号和数字组合来表示物质组成的式子。
化学式的意义: 以H 2O 为例对化学式的意义的几种错误说法水由两个氢元素和一个氧元素组成;水由氢分子和氧分子构成水由氢气和氧气组成; 水由氢分子和氧原子构成水分子由氢分子和氧原子构成; 水由两个氢原子和一个氧原子构成水分子由氢元素和氧元素组成化学式的写法:书写化合物的化学式时,首先要弄清以下两点:① 这种物质由哪种元素组成; ② 化合物中各元素的原子个数比是多少。
二、化合价:元素化合价是一个原子在化合时表现出来的性质。
在元素符号或原子团的上方标出化合价,“+”、“-”写在前,数字写在后。
化合价的一般规律:金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
氧元素通常显-2价,氢元素通常显+1价。
在化合物里正负化合价的代数和为0。
在单质中元素的化合价为0。
同一元素在不同物质里可显不同的化合价。
在同一种物质里,同一元素也可显不同的化合价(如NH 4NO 3)。
三、化合价和化学式的关系:根据化合价写化学式:“正价前,负价后,十字交叉右下处,化简才是原子数”。
根据化学式求化合价:根据记忆的其他元素的化合价,利用“化合物中正负化合价的代数和为0”四、数字的意义:① 元素符号前的数字表示几个某原子。
如2H 中的“2”表示2个氢原子。
② 化学式前的数字表示几个某分子。
如2H 2O 中的“2”表示2个水分子。
③ 元素符号右下角数字表示一个某分子或离子中有几个某原子。
如CO 2中的“2”表示1个二氧化碳分子-3 +5 水;水由氢元素和氧元素组成;一个水分子;中有2个氧原子。
④元素符号右上角的数字表示一个某离子中带几个单位的正或负电荷。
如Fe3+中的“3”表示1个铁离子带3个单位的正电荷。
⑤元素符号正上方数字表示某元素的化合价。
如Fe表示铁元素的化合价是+3。
五、化合价与离子的关系:考点练习相对原子质量:C:12 H:1 O:16 N:14 S:32 Cl:35.51.(xx.泰安市)下列有关化合价的叙述正确的是()A.化合价与原子最外层电子数无关B.氨气(NH3)中氮元素的化合价为+3C.氧气中氧元素的化合价为-2 D.有些元素在不同条件下可表现出不同化合价2.(xx.兰州市)美国阿拉莫斯国家实验室5月13日宣布,首次从辐照后低浓铀溶液中生产出钼-99。
初中常见化合价化学式及化学方程式
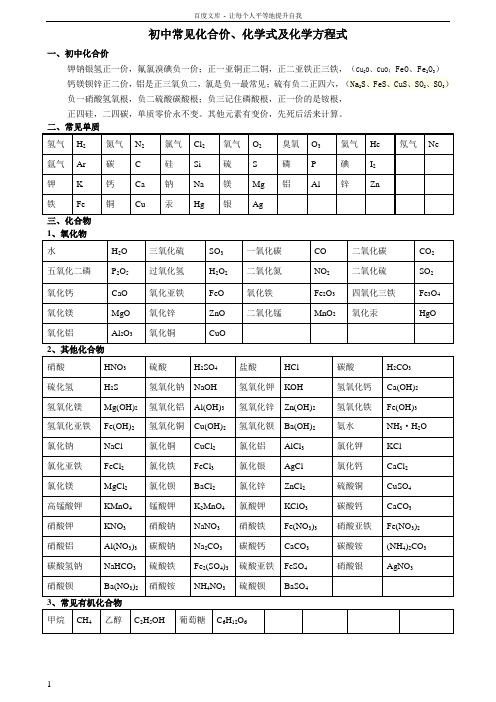
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
新人教版中考化学复习精品 化学式与化合价.doc

化学式与化合价自主梳理一、化学式1.化学式的定义用__________________表示物质_______________的式子叫做化学式。
由分子构成的物质的化学式,又叫_______________。
2.化学式表示的意义(1)宏观意义:①表示_______________;②表示该物质的_______________。
(2)微观意义:由分子构成的物质,化学式还能①表示该物质的_______________;②表示该物质的_______________。
(3)化学式前和化学式中的数字的意义:化学式前的数字表示_____________________________________________。
化学式中右下角的数字表示_____________________________________________。
3.化学式的写法和读法(1)单质的化学式①用元素符号表示:铁_______________,铝_______________,镁_______________,磷_______________,氦_______________;②双原子构成的分子:氢气_______________,氧气_______________,氯气_______________。
(2)化合物的化学式在书写某化合物的化学式时,除了知道这种化合物含有哪几种元素及不同元素的原子个数比之外,还应注意以下几点:①当某组成元素的原子个数比为1时,1可_______________;②氧化物化学式的书写,一般把氧的元素符号写在_______________,另一种元素的符号写在_______________;③由金属元素和非金属元素组成的化合物,书写化学式时,一般把金属的元素符号写在_______________,非金属的元素符号写在_______________。
(3)化学式的读法:由两种元素组成的化合物的名称,一般从右向左读作“某化某”。
(word完整版)初三化学化学式与化合价练习题(含答案),推荐文档

第四单元同步练习题:化学式与化合价一、选择题:1.下列物质的化学式书写正确的是A.氧化锌OZnB. 三氧化硫O3SC. 氦气He2D. 氧化钙CaO2.已知二氧化碳的化学式为CO2,关于它的说法正确的是A.由一个碳元素和两个氧元素组成.B.由一个碳原子和一个氧分子构成.C.由碳元素和氧元素两种元素组成.D.一个二氧化碳分子由一个碳原子和两个氧原子构成.3.下列符号只具有微观意义的是A. B. C. D.4.某工地发生多人食物中毒,经化验为误食工业用盐亚硝酸钠(NaNO2)所致。
亚硝酸钠中氮元素的化合价是A. +1B. +2C. +3D. +55.航天飞船常用铝粉和高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中Cl 的化合价是A. +1B. +3C. +5D. +76.与中数字“1”关系密切的是A.元素的化学性质、化合价B. 元素的种类、原子的质量C. 元素的核电荷数、原子的数目D. 物质的状态、原子的稳定性7.化学用语是国际通用的化学语言,下列有关说法正确的是A.2H 表示2 个氢分子B. 镁离子的符号为Mg2+C. O2中氧元素的化合价为-2 价D. 一氧化碳的化学式是Co8.下列微粒符号中,对“2”的含义理解正确的是A.2Cu 中的“2”表示2 个铜元素B.Fe2+中的“2”表示每个亚铁离子带有2 个单位的正电荷C.H2S 中的“2”表示1 个硫化氢分子中含有2 个硫原子中化学式上方的“2”表示硫元素为-2 价D.Al2( 2 )3SO 49.明矾[KAl (SO4)m]可用作净水剂,在该物质中m 的值是A. 1B. 2C. 3D. 10*10. H2SO3和H2SO4两种物质中,不同的是A.物质的类别B. 所含元素种类C. 硫元素化合价D. 氧元素化合价*11、元素A 与元素B 能形成AB2型化合物,则A、B 元素的核电荷数可能为A. 13 和17B. 11 和8C. 6 和8D. 12 和912.下列五种物质中均含有氮元素,它们是按氮元素的化合价由低到高的顺序排列的:①NH3;②N2;③NO;④X;⑤N2O5。
(完整版)九年级化学_化学式和化合价专题复习和答案解析.doc

.WORD 格式整理 ..化学式与化合价复习讲义一、基础知识知识点一、化学式1.化学式的定义:用元素符号和数字的组合表示物质组成的式子,叫做化学式。
2.化学式的意义:分类意义实例(以 H2O为例)①表示一种物质水宏观②表示该物质的元素组成水是由氢、氧两种元素组成的③表示物质的一个分子一个水分子④表示物质的分子构成一个水分子是由两个氢原子和一个氧原子构成的微观⑤表示组成物质的各种元素水分子中 H、 O原子的个数比为 2:1的原子个数比3.化合物化学式的书写:金属单质、稀有气体单质、其他由原子构成的物质——直接用元素符号表示(如Fe、 Al )单质常温下为固态的非金属单质——用元素符号表示(如S、 P、C)由双原子分子或多原子分子构成——在元素符号右下角标出原子个数(如O2、H 2、 Cl 2)纯净物正价元素或原子团写在前,负价元素或原子团写在后(特例:NH 3 氨气、 CH 4 甲烷)。
在元化合物素符号右下角写出该种元素的原子数目,所有元素的原子个数比为最简比(特例:H2 O2)。
当原子团不是一个时需要加括号,把个数写在括号的右下角( 1 省略不写)。
书写化合物的化学式时,首先要弄清以下两点:① 这种物质由哪种元素组成;② 化合物中各元素的原子个数比是多少。
【注意】1.纯净物的组成是固定不变的,只有纯净物才有化学式(混合物没有固定的组成,因此没有化学式),且一个化学式只表示一种纯净物。
2.化学式右下角的数字为整数,原子个数为“1”时一般不写出。
化学式中数字的含义(以水为例):知识点二、化合价元素的化合价是元素的原子之间形成化合物时表现出来的一种性质,用来表示原子之间相互化合的数目。
1. 化合价的表示方法:通常在元素符号或原子团(作为整体参加反应的原子集团)的正上方用+n 或— n 表示。
2.化合价的一般规律:(1)在化合物中氢元素通常显 +1 价;氧元素通常显 -2 价;在氧化物中氧元素显 -2 价,其他元素显正价;金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
(word完整版)初三化学知识点总结:化学式和化合价-推荐文档

+2 化学式和化合价考点归纳1.化学式的含义(重点、考点)2.元素化合价的一般规律(重点)3.化学式书写方式(重点)4.有关化学式的计算(重难点、考点)知识点1.化学式的含义: 是用元素符号和数字的组合表示物质组成的式子。
(以CO2为例说明)表示一种物质: 表示二氧化碳。
⑴宏观上表示该物质由哪些元素组成: 表示二氧化碳由碳元素和氧元素组成。
表示该物质的一个分子: 表示一个二氧化碳分子。
⑵微观上表示分子的构成: 表示每个二氧化碳分子由一个碳原子和二个氧原子构成。
注: 表示每种物质的组成的化学式只有一个2.化合价元素的化合价是元素的原子在形成化合物时表现出来的一种化学性质, 化合价有正价和负价元素化合价的一般规律⑴一般情况下, 元素化合价为常见化合价, 氢元素的化合价通常显+1价, 氧元素的化合价显-2价。
⑵在化合物中, 金属元素为正价。
⑶非金属与氢或金属化合时, 非金属元素显负价;非金属与氧元素化合时, 非金属元素显正价。
⑷在化合物中, 正、负化合价的代数和为零。
⑸在单质中元素的化合价为零。
(6)有些元素有可变化学价, 如Fe2O3中铁元素为+3价, FeSO4中铁元素为+2价。
(7)有些元素在同一化合物里可显不同的化学价, 如NH4NO3中氮元素的化合价分别为-3和+5。
表示方法:标化合价是, 先写“+”或“—”, 再写化合价的数值, 标在元素符号的正上方。
要注意化合价的表示方法与离子符号的区别, 离子所带电荷符号用+、2+、-、2-……表示, 标在元素符号的右上角, 如: Na+、Cl-、Mg2+、O2-。
例如:Ca表示钙元素显+2价(或钙元素的化合价为+2价);Ca2+表示一个钙离子带2个单位的正电荷+1 钾、钠、氢、银+2 钡、镁、钙、锌+3 铝-1 氯、氟-2 氧+2.+3 铁- 1 -常见元素的化合价(正价):一价钾钠氢与银, 二价钙镁钡与锌, 三价金属元素铝;一五七变价氯, 二四五氮, 硫四六, 三五有磷, 二四碳;一二铜, 二三铁, 二四六七锰特别。
中考化学专项训练化合价(word版含解析)(1)

化合价一.选择题(共30小题)1.含氟牙膏中常添加氟化钠,NaF中F元素的化合价是()A.﹣1B.﹣2C.0D.+12.高铁酸钾是一种新型、高效、多功能的“绿色”水处理剂,已知其化学式为K2FeO4,则Fe元素的化合价为()A.+2B.+6C.+5D.+43.交警用于检验司机是否驾车的检测仪中含有一种成分是重铬酸钾(K2Cr2O7),其中铬(Cr)元素的化合价是()A.+3B.+4C.+5D.+64.交通警察使用的一种酒精检测仪中装有重铬酸钾(K2Cr2O7),它对酒精非常敏感,该化合物中铬元素(Cr)的化合价为()A.+3B.+4C.+5D.+65.我国科学家发现用含硒(Se)化合物亚硒酸钠能消除掉加速人体衰老的活性氧.亚硒酸钠中的硒元素为+4价,氧元素为﹣2价,则亚硒酸钠的化学式为()A.Na2SeO3B.Na2Se04C.NaSeO3D.Na2SeO26.下列物质中氮元素的化合价正确的是()A.NH3:+3B.NO:﹣2C.NaNO2:+2D.HNO3:+57.海藻中含有丰富的碘化钠(NaI),食用海藻可以补充人体所需的碘元素.NaI中碘元素的化合价是()A.+1B.+2C.﹣1D.﹣28.高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂,其中铁元素的化合价为()A.+3B.+2C.+5D.+69.“84消毒液”中的有效成分叫次氯酸钠,已知其中的氯元素为+1价、氧元素为﹣2价,则次氯酸钠的化学式为()A.NaClOB.NaClO2C.NaClO3D.NaClO410.下列五种物质中均含有碘元素,它们按碘的化合价的顺序排列:①KI ②I2③HIO ④X ⑤NaIO4.则根据这种排列规律,X不可能是()A.KIO3B.AgIC.I204D.I20511.美国阿拉莫斯国家实验室5月13日宣布,首次从辐照后低浓铀溶液中生产出钼﹣99.其中Na2MoO4是Mo元素的重要化合物,那Mo元素的化合价是()A.+4价B.+6价C.+5价D.+7价12.2014年3月15日,央视新闻曝光明胶黑幕.据报道,由嘉利达等明胶生产企业生产的“垃圾明胶”,被用于雅客、金冠和蜡笔小新等品牌,严重危害人们的身体健康.工业明胶中含有毒的重铬酸钠(Na2CrO4),其中Cr元素的化合价为()A.+1价B.+2价C.+4价D.+6价13.某融雪剂含有Na2SiO3(硅酸钠),Na2SiO3中Si元素的化合价为()A.+4价B.+2价C.+3价D.+1价14.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O3+mNa2O2=nNa2FeO4+Na2O,下列说法中正确的是()A.Na2FeO4中,铁元素的化合价+6价B.高铁酸钠中铁元素质量分数最大C.化学计量数m=nD.消毒的作用是除去水中可溶性杂质15.著名科学家张存浩获得2013年度“国家最高科学技术奖”,他研究的火箭燃料常用的氧化剂是高氯酸铵(NH4ClO4),其中氯元素的化合价为+7价,则氮元素的化合价是()A.﹣1B.+3C.﹣3D.+516.下列含有硫元素的物质中,硫元素的化合价最高的是()A.H2SB.H2SO4C.KHSO3D.Na2S2O317.下列五种物质中均含有氯元素,它们按氯元素的化合价的顺序排列:①KCl②Cl2③HClO④X⑤NaClO4,则根据这种排列规律,X不可能是()A.AgClB.ClO2C.KClO3D.HClO218.今年9月27日,日本御岳山火山喷发,造成多人伤亡.火山灰里含有大量的硅酸钙(CaSiO3),硅酸钙中硅元素的化合价为()A.+3B.+4C.+5D.﹣419.壹佰元人民币的防伪油墨中含有MgF2,其中F元素的化合价是()A.﹣1B.+2C.+1D.﹣220.铜长期暴露在潮湿的空气中在表面会生成一层绿色的物质,俗称铜绿,其化学式为 Cu2(OH)n CO3,如果铜元素的化合价为+2价,那其中n的值是()A.1B.2C.3D.421.用自来水养鱼时,残留在水中的氯气会对鱼造成危害,常加入大苏打(化学式为Na2S2O3)来除去水中的氯气.已知Na为+1价,O为﹣2价,那么S的化合价为()A.﹣2B.+2C.+4D.+6。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)列比例,解方程
(5)简明地写出答案
1.根据化学式、化学方程式的计算还需要注意以下几点:
(1)解题格式的规范化和程序化
(2)化学方程式和化学式的书写要正确,方程式要配平完整。
(3)若有一定体积的气体参加反应,则先要将它换成气体的质量;若要求出待求物气体的体积数,则要将已求出的气体质量换算成体积。
表示一个分子的构成
4.化合价——一种元素一定数目的原子跟其他元素一定数目的原子化合的性质,叫做这种元素的化合价。
化合价是元素的性质, 因此,通常称为元素的化合价而不应称为原子的化合价。 化合价有正负之分。
(1)规定
化合价的数值
正价
负价
一个原子得失电子
失电子的原子 (阳离
得电子的原子 (阴离
离子化合物
(3)定律中的“质量”指的是参加化学反应的反应物的质量总和,而不是提供的质量的简单加和。
例如:将24gMg放入32gO2中反应,生成的质量是:24g+32g=56g吗?
由方程式:2Mg O2
点燃
2MgO,可知,24g的Mg完全燃烧只消耗
16gO2所生成的
MgO的质量应为:24g+16g=40g,尚有32g-16g=16gO2未参与反应,不能计算在内。
方程式时,必须配平。
(3)化学反应类型
化合反应:由两种或两种以上的物质生成另一种物质的反应。ABAB
分解反应:由一种物质生成两种或两种以上其它物质的反应。ABAB
置换反应:由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应。
ABCBAC
复分解反应:两种化合物互相交换成分,生成另外两种化合物的反应叫复分解反应。
(二)化学符号及其意义
-1-/11
1.原子结构示意图各部分表示的意义
Na+11281
表示该电子层上的电子数
表示电子层
表示原子核内有11个质子
表示钠原子
表示一种元素
2.元素符号:
表示这种元素的一个原子
3.化学式——用元素符号表示物质组成的式子。
表示一种物质
表示组成这种物质的元素有哪些
表示这种物质的一个分子(限于由分子构成的物质)
理解质量守恒定律可归纳为五个不改变,两个一定改变,一个可能改变:
宏观1
反应物和生成物总质量
不变
2
元素的种类不变
五个不改变
1
原子种类不变
微观
2
原子数目不变
3
原子质量不变
宏观物质种类一定改变
两个一定改变
微观分子种类一定改变
一个可能改变分子的总数可能改变
4.运用时应注意:
(1)质量守恒定律的运用范围是化学变化,不包括物理变化。
例如:1g冰加热成为1g水,发生的是物理变化, 虽然变后前后质量也未改变,但不能将其说成是符合质量守恒定律。
(2)质量守恒定律பைடு நூலகம்的是质量守恒而不包括其它方面的守恒。
点燃
例如:2COO22CO2
该反应中反应物,生成物中均有气体,是遵守质量守恒定律的,但其体积由反应前的
2
体积+1体积=3体积变为反应后的2体积并不守恒。
子)显正价
子)显负价
的数目
一个原子形成共用
电子对偏离的原子
电子对偏向的原子
共价化合物
显正价
显负价
电子对的数目
不论在离子化合物还是共价化合物中,正负化合价的代数和为零。
化合价原则
在单质分子里,元素的化合价为零
(2)常见元素的化合价和常见原子团的化合价
一价钾钠氯氢银,二价镁钙钡和锌,三价元素就是铝,铜二一,铁二三,碳有二四要记
专题复习—化学式、化合价、化学方程式
一.内容:
化学式、化合价、化学方程式
二.重点、难点:
1.理解质量守恒定律的普遍意义。
2.会熟练使用化学式、化合价、化学方程式等化学用语,进一步明确各种符号的涵义。
3.掌握有关化学式、化学方程式计算的方法和步骤
三.知识要点:
(一)质量守恒定律:
1.内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
不同时,它们所显示的化合价就可能不同,因此有些元素有多种化合价。如氮元素有3、
+2、+3、+5等几种化合价,硫有2、+4、+6等几种化合价。
-2-/11
2
1
1
1
常见原子团的化合价:SO4
NO3OHNH4
4.化学方程式——用化学式来表示物质化学反应的式子叫做化学方程式。
表示反应物和生成物各是什么物质读法的依据
全。
一般规律:
氢+1,氧2;金正,非负,单质零;许多元素有变价,条件不同价不同。
注:①在上述一般规律中,金正,非负是指金属元素通常显正价,非金属元素通常显
负价。如果是由金属元素跟非金属元素组成的化合物,金属元素显正价, 非金属元素显负价;
如果是由两种非金属元素组成的化合物,则共用电子对偏向的元素显负价,偏离的元素显正
2.准确理解守恒定律应抓的几个关键词: “参加”“各物质”“生成”“质量总和。 ”
3.理解:质量守恒定律是从量的方面来研究化学反应的客观规律,要理解它,必须运用
物质结构的知识, 从化学反应的实质去分析。 化学反应的过程是原子重新组合的过程。在一
切化学反应中, 反应前后原子的种类没有改变, 原子的数目没有增减, 原子的质量也没有变化,所以化学反应前后各物质的质量总和必然相等。
ABCDADCB
注意:
①分清宏、微观意义——当元素符号、化学式前有系数时,数字表示该微粒的个数,此时该符号只有微观意义,而无宏观意义。
②分清系数、角数意义2SO3
③不能用符号解释符号
④化学方程式的书写、配平、读法、
(三)关于化学式、化学方程式的计算
1.根据化学方程式计算的一般步骤
(1)设未知数
(2)写出完整的化学方程式
(4)代入方程式计算时要用纯净物的质量。
(1)质的意义:反应物的一种性质
生成物的一种制法
反应物和生成物各物质间的分子或原子个数比
(2)量的意义:
反应物和生成物各物质间的质量比计算的依据
参加反应的各物质的质量总和等于反应后生成的各物质的质量总和
(3)书写原则:①必须以客观事实为基础。绝不能凭空设想,臆造事实上不存在的物质和化学反应。②必须遵守质量守恒定律。 在化学反应前后, 原子种类和原子数目保持不变。 书写化学
价。一般来说,在化合物中,氧通常显-2价,氢通常显+1价,在氯化物中,氯显-1价,
在硫化物中,硫显2价。
② 对于有些元素的原子来说,它的最外层电子数比较少,在反应中很容易全部失去,
这些元素一般在化合物中只显一种化合价。而有些元素的原子,它们的最外层电子数较多,
在形成化合物时,既有失去部分电子的可能,也有得到部分电子的可能,因此,当反应条件
