工程热力学课件:第12章 理想气体混合物及湿空气
12理想气体混合物及湿空气讲解

水蒸气
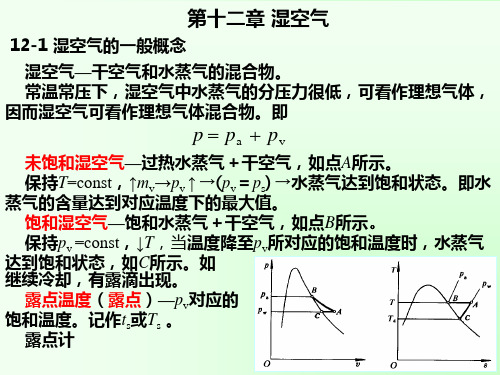
饱和蒸汽 1、未饱和湿空气
T
ps
pv
干空气 + 过热水蒸气
pv < ps(T)
加入水蒸气,pv
s
12-3 湿空气
2、饱和湿空气 干空气 + 饱和水蒸气
pv = ps(T)
T
ps
温度一定,不能再加入水蒸气。
s
12-3 湿空气
1 T 加水蒸气 从未饱和到 2 3
12-3 湿空气
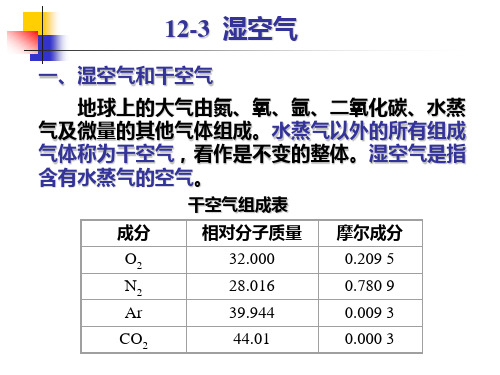
一 干空气和湿空气 地球上的大气由氮、氧、氩、二氧化碳、水蒸气及极微 量的其他气体组成。 干空气:完全不含水蒸气的空气。干空气可看作是不变 的整体。 湿空气:干空气与水蒸气的混合物。 应用:空调、通风、烘干、冷却塔、储存等。 湿空气中水蒸气分压力很低,一般处于过热状态。因此,
湿空气中水蒸气也可作为理想气体计算,故而湿空气是理 想气体混合物,理想气体遵循的规律有理想气体混合物的 计算公式都可以应用。
12-3 湿空气
下标约定:a -干空气 s-饱和水蒸气 v -水蒸气 -无下标为湿空气参数
湿空气=(干空气+ 水蒸气 ) 分压低(0.003~0.004MPa, 一般处于过热状态,可按理 想气体计算)
理想气体混合物
p pa pv
湿空气与一般理想混合气体的最大区别: 水蒸气的含量是变量!!
12-3 湿空气
12-1 理想气体混合物
处理气体混合物的基本原则 1)混合气体混合物的组分都处理想气体状态,则混合气体也 处理想气体状态; 2)混合气体可作为某种假想气体,其质量和分子数与组分气 体质量之和及分子数之和相同。 平均摩尔质量, 折合摩尔质量
pV m混 Rg ,eq T
工程热力学十二、理想气体混合物及湿空气(15)

(2)混合气体中氧和氮各自的
分压力PA2、 PB2;
(3)混合前后熵变量ΔS。按定 A B
值比热容计算
O2
N2
§12-3 湿空气
• 湿空气 湿空气是干空气与水蒸气的混合物。
• 涉及湿空气的常见的工业过程 空气温度与湿度调节过程、物体的干燥过程、冷却水塔中的水
冷却过程等。
§12-3 湿空气
• 分析湿空气时假定: ➢把气相混合物看作是理想气体混合物; ➢当蒸汽凝结成液相或固相时,液相或固相中不包含溶解的空气; ➢空气的存在不影响蒸汽与其凝聚相之间的相平衡。
第十二章 理想气体混合 物及湿空气
§12-1 理想气体混合物
理想气体混合物中各组元气体均为理 想气体,因而混合物的分子都不占体积, 分子之间也无相互作用力。因此混合物必 遵循理想气体方程,并具有理想气体的一 切特性。
一、分压力定律和分体积定律
✓分压力
在与混合物温度相同的情况下,每一种组成气体 都独自占据体积V时,组成气体的压力称为分压力。
✓混合气体成分的几种表示方法:
质量分数: 摩尔分数: 体积分数:
wi
mi m
xi
ni n
i
Vi V
Vi为分体积
✓ 混合气体的折合摩尔质量
m mi nM eq niM i
M eq
ni M i n
xi M i
✓ 混合气体的折合气体常数
Rg ,eq
R M eq
R nR niM i Rg,i mi Rg,i
Vi表示。
✓分体积定律
pVi ni RT
pVi ni RT
pVi RT ni nRT pV
V Vi
理想气体混合物的总体
工程热力学课件12理想气体的混合物和湿空气共43页

36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
40、人类法律,事物有规律,这是不 容忽视 的。— —爱献 生
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
Hale Waihona Puke
工程热力学与传热学12)_湿空气

以及理想气体摩尔成分xv与分压力pv的 关系,相对湿度可以表示为:
pv vs v mv xv ps vv s ms xs
三、饱和蒸汽压、露点、绝热饱和温度
未饱和湿空气达到饱和有三种典型的途径:
1、温度不变的情况下,水 分向空气中蒸发,蒸汽 的分压力增加,可以达 到饱和空气状态,如图 中定温过程A-C。达到 饱和时,蒸汽分压力就 是对应此空气温度的饱 和蒸汽压力ps。
水蒸气饱和压力
• 的变化范围为 0~1(0%~100%,对
于饱和空气,其相对湿度为1或100%)
• 相对湿度 愈小,表明什么? • 相对湿度 愈小,表示空气中水蒸气离 饱和状态越远,即越干燥,此时空气吸 收水分的能力越强;反之空气愈潮湿, 吸湿能力越弱。★
根据水蒸气的理想气体状态方程: RvT RvT pv ps vv vs 和湿空气中水蒸气组元的状态方程: mv pv V RvT
绝热
四、湿空气的含湿量d
定义:1kg干空气所携带的水蒸气质量,称 “含湿量”
水蒸气的摩尔质量 =18.016×103kg/mol
由分压力定律可知:理想 气体混合物中各组元的摩 尔数之比,等于其分压力 之比
kg kg ( 干空气)
mv M v nv d ma M a na
干空气的摩尔质量 =28.97×103kg/mol
当我们给盛有空气的密闭容器加热的时候,则其压强当然也会 增大.而对大气来说情况就不同了.当某一区域的大气温度因某种 因素而升高时,必将引起空气体积的膨胀,空气分子势必要向周围 地区扩散.温度高,气体分子固然会运动得快些,这将成为促进压 强增大的因素.但另一方面,随着温度的升高,气体分子便向周围 扩散,则该区域内的气体分子数就要减少,从而形成一个促使压强 减小的因素.而实际的情况乃是上述两种对立因素共同作用的结 果.至于这两种因素中哪个起主要作用,我们不妨来看一看大陆及 海洋上气压随气温变化的实际情况.我们说,夏季大陆上气温比海 洋上高,由于大陆上的空气向海洋上扩散,而使大陆上的气压比海 洋上低;冬季大陆气温比海洋上低,由于海洋上空气要向大陆上扩 散,又使大陆上气压比海洋上高.而由此可见,在温度变化和分子 扩散两个因素中,扩散起着主要的、决定性的作用.应当指出,这 里所说的扩散,是指空气的横向流动.因为由空气的纵向流动并不 能改变竖直气柱的重量(有的文献②把因温度而产生的气压变化说 成是空气沉浮的结果,这是不妥的),因而也就不能改变大气的压 强(对重力加速度g因高度变化而产生的影响完全可以忽略).
理想气体混合物及湿空气

第十二章理想气体混合物及湿空气本章基本要求掌握理想气体混合物的比热、焓、熵、热力学能的计算方式; 掌握湿空气的性质、焓湿图及其基本热力过程。
§12-1 理想气体混合物理想气体混合物中各组元气体均为理想气体,因而混合物的分子都不占体积,分子之间也无相互作用力。
因此混合物必遵循理想气体方程,并具有理想气体的一切特性。
∑∑==iiiiM x nM n ∑=ig iig iimR m mRM n ,,w i 、x i 、ϕi 的关系iii iV n x Vnφ=⇒=iii i i i w M MM m M m n n x ===二、分压力定律和分体积定律✓分体积在与混合物温度相同的情况下,每一种组成气体都独自占据体积V时,组成气体的压力称为分压力。
用p i 表示。
各组成气体都处于与混合物温度、压力相同的情况下,各自单独占据的体积称为分体积。
用V i 表示。
✓分压力§12-3湿空气概述干空气—不含水蒸汽的空气称为干空气。
湿空气—含水蒸汽的空气称为湿空气。
湿空气=干空气+水蒸汽分析湿空气时假定:把气相混合物看作是理想气体混合物;当蒸汽凝结成液相或固相时,液相或固相中不包含溶解的空气;空气的存在不影响蒸汽与其凝聚相之间的相平衡。
注:以上假定在高压下可能导致较大的误差。
涉及湿空气的常见工业过程:空气温湿度调节过程、物体干燥过程、冷却塔水冷却过程等。
在给定的水蒸汽分压力下,使未饱和湿空气变成饱和湿空气时所对应的那个温度(水蒸汽分压力所对应的饱和温度)称为露点温度td 或简称露点。
一、未饱和湿空气和饱和湿空气未饱和湿空气—干空气+过热蒸汽饱和湿空气—干空气+饱和蒸汽下标约定:a-干空气v-水蒸汽s-饱和水蒸汽-无下标为湿空气参数二、露点v pTR p v v g v v v ,1==ρ湿空气中水蒸汽的分压力愈大,其绝对湿度愈大;水蒸汽的分压力不可能超过该温度下水蒸汽的饱和压力,§12-5相对湿度测定§12-6湿空气的焓湿图相同,状态不同的湿空气具有相同的露点。
第十二章理想气体混合物及湿空气

武汉大学动力与机械学院 刘先斐
12-2 理想气体混合物的比热容、 热力学能、焓和熵
一、理想气体混合物的比热容
质量比热容:c wi ci
i 1 n
摩尔比热容: C m xi C m, i
i 1
n
容积比热容:C i C i
i 1
n
武汉大学动力与机械学院 刘先斐
13
二、理想气体混合物的热力学能和焓
理想混合气体的热力学能等于各组分气体的热力学 能之和。
U Ui
i 1 n n
1kg理想混合气体的热力学能: u wi ui
i 1
理想混合气体的焓等于各组分气体的焓值之和。
H Hi
i 1 n
1kg理想混合气体的焓: h wi hi wi (ui RiT )
n ni
( Mv)0 22.4 103 m3 / mol
nM eq ni M i
4
理想气体混合物可作为Rg,eq和Meq的“某种”理想气体。
武汉大学动力与机械学院 刘先斐
二、分压力和分体积定律
1.分压力定律 分压力——在与混合气体相同的温度下,各组成 气体单独占有混合气体的体积V时给予容器壁的 压力。
pO2 ,2
1 xO2 p2 p A1 2
pN2 ,2
1 xN2 p2 pB1 2
18
武汉大学动力与机械学院 刘先斐
取混合前气体状态(pA1,TA)为参考状态,则O2 及 N2 终态的熵值即为从参考状态到终态的熵变,所以
dS m xi C pmi 0
dpi dpi dT xi R Rxi T pi pi
武汉大学动力与机械学院 刘先斐 3
沈维道《工程热力学》(第4版)笔记和课后习题(含考研真题)详解(第12~13章)【圣才出品】

V Vi
i
道尔顿分压力定律和亚美格分体积定律只适用于理想气体状态。
2.混合气体的成分
(1)气体混合物占组成含量百分数分类
①质量分数;
1 / 64
(12-3)
圣才电子书 十万种考研考证电子书、题库视频学习平台
②摩尔分数;
③体积分数。
(2)各种百分数的表示方法
①质量分数是组分气体质量与混合气体总质量之比,第 i 种气体的质量分数用 wi 表示
律。
(2)分体积定律
另一种分离方式如图 l2-1 所示。各组成气体都处于与混合物相同的温度、压力(T、p)
下,各自单独占据的体积Vi 称为分体积。对第 i 种组成写出状态方程式为 pVi ni RT
(12-2)
图 l2-1 理想气体分体积示意图 对各组成气体相加,得出
pVi RT ni
i
i
可得
i
xi
i
Rg ,eq
1
Rg ,eq Rg .i wi
i
(12-10)
二、理想气体混合物的比热容、热力学能、焓和熵 1.理想气体混合物的比热容
混合气体的比热容是 lkg 混合气体温度升高 l℃所需热量。1kg 混合气体中有 wi kg 的
第 i 组分。因而,混合气体的比热容为
c wici
i
同理可得混合气体的摩尔热容和体积热容分别为
圣才电子书 十万种考研考证电子书、题库视频学习平台
沈维道《工程热力学》(第 4 版)笔记和课后习题(含考研真题)详解
第 12 章 理想气体混合物及湿空气
12.1 复习笔记
一、理想气体混合物 1.分压力定律和分体积定律 (1)分压定律
p pi
工程热力学 第十二章 理想气体混合物及湿空气 图文

平均气体常数, 折合气体常数
理想气体混合物
u
cv
t2 t1
(t2
t1 )
h
cp
t2 t1
(t2
t1 )
cp cv Rg,eq
因此,把理想气体混合物看出是气体常数和摩 尔质量分别为Rg,eq和Meq的某种假想气体。
pV m混 Rg,eqT
南京航空航天大学
混合气体的分压力定律
分压力——组分气体处在与混合气体相同容积、 相同温度单独对壁面的作用力。
1 ln 2
pN2 ,2 pB1
南京航空航天大学
2R ln 1 2R ln 2 2
湿空气与干空气
地球上的大气由氮、氧、氩、二氧化碳、水蒸 气及极微量的其他气体组成。水蒸气以外的所有组 成气体称为干空气,看作是不变的整体。湿空气是 指含有水蒸气的空气。
南京航空航天大学
成分 O2 N2 Ar CO2
pV nRT p1V n1RT piV ni RT pmV nm RT
南京航空航天大学
Vpi RT ni nRT
p pi 道尔顿分压力定律
混合气体的分体积定律
分体积——组分气体处在与混合气体同温、 同压单独占有的体积。
pV nRT
pV1 n1RT pVi ni RT
pVm nmRT
T
ps
干空气 +
过热水蒸气
pv
pv < ps(T)
南京航空航天大学
加入水蒸气,pv
s
未饱和湿空气和饱和湿空气
2、饱和湿空气
干空气 +
饱和水蒸气
T
ps
pv = ps(T)
南京航空航天大学
湿空气
分析湿空气时假定: 1)把气相混合物看作是理想气体混合物; 2)当蒸汽凝结成液相或固相时,液相或固相
混合气体与湿空气.ppt

pb
pv
2. 饱和湿空气和未饱和湿空气
根据其中水蒸气所处状态(pv,t)的不同,湿空气可分为:
如大气
如图中A点
pv < ps(t)
未饱和湿空气 饱和湿空气
干空气 + 过热蒸汽
干空气 + (干)饱和蒸汽
Pv=ps(t)
饱和湿空气吸收水蒸气的能力达
ps(t):同温度下水 蒸气的饱和压力
定温(t )吸湿A-B, Pv增大至Ps
i 1 n
3 2 8 . 81 0( k gm / o l )
所以,该烟气的气体常数为
R 8 . 3 1 4 8 . 3 1 4 R 2 8 8 . 6 8 [ J / k g K ] g 3 M M 2 8 . 8 1 0
又由式(6-14),可得各组成气体的分压力为
i 1
n
混合气体的成分
三种成分间的换算
ri与xi : gi与ri:
rixi
M M i i g r x i i i M M
Mi和M分别表示某组成气体与混合气体的摩尔质量。
三、混合气体的折合摩尔质量和 折合气体常数
1. 折合摩尔质量M
已知ri (或xi)和Mi : 已知gi和Mi :
n M i i n n m i 1 M x M r M k gm / o l ) i i i i( n n i 1 i 1
如图中B点 定温(t )加入水蒸气
析出水滴
到极限; 升温可继续吸湿。
二、湿空气的湿度 湿度: 湿空气中水蒸气的含量。 绝对湿度
三种湿度
相对湿度 含湿量
1. 绝对湿度
湿空气的湿度
—— 1m3湿空气中所含水蒸气的质量,称 为绝对湿度。即湿空气中水蒸气的密度: mv v V pv v pVmR T g R g, vT • Rg,v ——水蒸气的气体常数,Rg,v461.5J(kgK)。
12工程热力学第十二章 湿空气
h3 h4 = q + 0.001( d 3 d 4 ) h v
式中: 为冷却介质带走的热量; 为凝结水的比焓. 式中:q为冷却介质带走的热量;hv为凝结水的比焓.
三,绝热加湿过程 在绝热的条件下, 湿空气吸收水分, 在绝热的条件下 , 湿空气吸收水分 , 其 含湿量增加的过程, 含湿量增加的过程 , 称为湿空气的绝热加湿 过程. 过程. 绝热加湿过程中, 绝热加湿过程中 , 单位质量干空气的湿 空气吸收的水分为 d2 - d1 , 湿空气的焓增为 水分带入的能量, 水分带入的能量,即 h2 h1 = 0.001( d 2 d 1 ) h v 式中: 为水的焓. 式中:hv为水的焓.因为水分带入湿空气中的能量0.001(d2-d1) hv 相比很小,可忽略不计, 与湿空气的焓h1,h2相比很小,可忽略不计,即
mv pv ρv = = V Rg, v T ρv = 相对湿度 ρs 说明了吸收水蒸气的能力. ↓→吸收水蒸气的能力 吸收水蒸气的能力↑ 说明了吸收水蒸气的能力. ↓→吸收水蒸气的能力↑,当 =
饱和湿空气) 吸收水蒸气的能力为零. 100% (饱和湿空气)→吸收水蒸气的能力为零. 由理想气体状态方程, 由理想气体状态方程,相对湿度可表示为 pv = ps 相对湿度的测量:毛发湿度计 相对湿度的测量: 干湿球温度计
1212-4
湿空气的热力过程
湿空气热力过程的分析,主要讨论湿空气的状态变化, 湿空气热力过程的分析,主要讨论湿空气的状态变化,及其与 外界的能量交换情况. 外界的能量交换情况. 一,加热过程 加热过程一般在定压条件下完成. 加热过程一般在定压条件下完成. 特征: 特征:湿空气T↑,d=const. 过程线沿定含湿量线向温度升高的方向进行, 过程线沿定含湿量线向温度升高的方向进行, 过程中, 过程中,h↑, ↑. 加热过程中,吸热量等于焓值的增加,即 加热过程中,吸热量等于焓值的增加,
工程热力学-第十二章 理想气体混合物及湿空气
含湿量d
d = 0.622
j
p-
ps j ps
焓-湿图以1kg干空气量的湿空气为基准
注意:h-d 图随 pb 改变而改变
温度范围:-20~50℃,总压力:0.1MPa
h-d 图由下列五种线群组成: 1、等湿线(等d 线)
等d线是一组平行于纵坐标的直线群。
h
d
2、等焓线(等h线)
h = 1.005t + d (2501+ 1.86t )
t
100%
pv
d
6、露点td
pv下饱和湿空 h
气 1
h
td
t
100%
pv
d
温度范围:-20~50℃,总压力:0.1MPa
12-7 湿空气过程及其应用
湿空气热力过程求解主要研究过程中湿空气焓 值及含湿量与温度、相对湿度之间的变化关系;
研究方法:利用稳定流动能量方程和质量守恒 方程,并利用湿空气焓湿图。
露点可用湿度计 或露点仪进行测量 。
湿润的夏天水管上常出现水珠?
干燥的冬天pv小,td< 0.0 oC 结霜 结雾? 整个空气温度降低,水出来的过程
T
pv=0.04bar 大气温度t=30oC d td=28.98oC 冷水管t=20oC
s
12-4 湿空气的状态参数
一、相对湿度
绝对湿度:每立方米湿空气中水蒸气的质量 kg/m3
一般d很小,因此等h线与等t线接近重合。 因此等h线是一组与横坐标轴成135°的直线群。
h 135度 h
d
3、等温线(等t 线)
h = 1.005t + d (2501 + 1.86t )
¶h ¶d
工程热力学:第12章 混合气体和湿空气

pi p
6. 利用混合物成分求M混和Rg混
1)已知质量分数
Rg混 wi Rgi
M混
R Rg混
wi
Rg混 Rgi
xi
wi Rgi Rg混xi Rg混xi Rg混
7
2)已知摩尔分数
M混 Mi xi
Rg混
R M混
n混M混 niMi
M混
ni M i
n混
ni n混
Mi
xiMi
ln T2 T1
Rxi
ln
pi,2 pi,1
11
例A4412551 例A4412552 讨论混合熵变
12
12–2 湿空气
一、干空气和湿空气
地球上的大气由氮、氧、氩、二氧化碳、水蒸气及极微量 的其他气体组成。水蒸气以外的所有组成气体称为干空气,看 作是不变的整体。因此,大气是干空气与水蒸气组成的混合气 体。
▲混合气体可作为某种假想气体,其质量和分子数与组 分气体质量之和及分子数之和相同。
平均摩尔质量, 折合摩尔质量
pV m混Rg混T
平均气体常数, 折合气体常数
M 混 Rg混 R
(Mv)0 22.4 103 m3 / mol
n混 ni
n混M 混 niM i
理想气体混合物可作为Rg混和M混的“某种”理想气体。2
例A711143 例A411143
8
四、理想气体混合物的比热容、热力学能、焓和熵
1.比热容 c混 wici c混 xici
Cm混 xiCmi
Cmp CmV R
2.热力学能 U混 Ui
u混
U m
miui m
(wiui )
3.焓 H混 Hi Ui piV Ui Vpi U pV H混
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
湿空气模型
常温常压下湿空气中的干空气基本上是 一个稳定的混合物,可视为纯物质。
常温常压下湿空气中的水蒸气量可能变。
在需要考虑湿度的热力过程中,湿空气可 视为干空气与水蒸汽的混合物
第十二章
理想气体混合物及 湿空气
纯物质
混合物与纯物质
一种化学成分组成 H2O CO2
混合物 多种化学成分(纯物质)组成
混合物中 的纯物质 称组元
CH O .N = CO +HO+.N
Air(干) 燃烧产物
过程中组元的量不变的混合物可 视为纯物质(如干空气)
压气机Air
干空气的标准成分
湿空气
湿度控制的应用
在通信行业的应用:确保设备可靠性
混合物热力性质
1 混合物的状态公理如何表达 2 如何确定混合物中各组元的状态 3 如何确定混合物整体的状态
理想气体混合物
§12-1.道尔顿分压力定律 §12-2.亚美格分体积定律 §12-3.三种分数的关系 §12-4.混合物的比热容与能、焓、熵变
wisi12
查表
si12
s20 (T2 ) s10 (T1) Rgi ln
pi 2 pi1
当组分不变时
pi2 xi p2 p2 pi1 xi p1 p1
si12
si02 (T2 )
si01(T1) Rgi
ln
p2 p1
si02 (T2 ) Rgi ln p2 si01(T1) Rgi ln p1
水在液相(或固相、气相) k =1,f=1,
故n =1-1+2,此时压力,温度均可 独立变化。水在汽液共存时k = 1,f = 2,
故n =1,此时压力和温度中仅有一个可 自由变化。三相点:k =1,f = 3 故n = 0
混合物的比热容与能、焓、熵变
u wiui T h wihi T
cV
在空气调节的应用:提高人体舒适感
环境湿度过低时,体表汗液蒸发量增加, 皮肤会感觉过于干燥。而湿度过大时,体 表出的汗不能及时、充分地蒸发掉,积于 皮肤表面,使人体不舒适感觉加大。因此, 为了提高人体热舒适性,应正确控制室内 相对湿度值。
湿度控制的应用
在航天科技中的应用:将乘员舱大 气湿度控制于乘员的舒适水平
分体
n pV RT 积
n1 pV1 RT n2 pV2 RT
V Vi
容易 测量
pV
xi
ni n
pVi pV
RT RT
Vi V
i
T
麽尔分数
体积分数
分容前后各组分的状态发生了变化
三种分数的关系
wi
mi m
麽尔分数
ni Mi nM
xi
Mi M
xi
R R
Rgi Rg
体积分数 质量分数
xi
Rg Rgi
mi n
niMi n
xi M i
Rg
R M
nR m
niR m
mi Rgi m
wi Rgi
又
pv RgT
vV /m
pVm R T
Vm V n
亚美格分体积定律(Amagat law of partial volume)
p V1 T
p V2 T
n1 n2
同温
pV1 V2 RT 同压
dT T
Rgi
dpi pi
s12
wi
2
1 cpi
dT T
Rgi
dpi pi
wisi12
dSm
xi
Cmpi
dT T
R
dpi pi
Sm12
xi
2
C 1 mpi
dT T
R dpi pi
wiSmi12
s12
பைடு நூலகம்i
2
1 cpi
dT T
Rgi
dpi pi
临界温度
Tac 140.15 oC TVc 373.85 oC
为什么要研究湿空气
在冷却塔、空调、烘干等工程中,空气 的湿度与温度是两个相关的热工参数, 它们具有同样的重要意义。
湿度控制有何 应用呢?
冷却塔(自然对流式)
水量平衡需要计算含湿量
7
冷却塔(强迫对流式)
水量平衡需要计算含湿量
湿度控制的应用
道尔顿分压力定律(1801)
(Dalton law of partial pressure)
p1 n1 TV
p2 n2 TV
pn TV
ni piV RT
Ui Ui T, pi ,ni
H
i
H
i
T, pi
, ni
Si Si T, pi ,ni
分压
理想气体混合 物各组成气体 的状态与该气 体在同体同温 下的状态相同, 气体的总效应 由状态量(广延) 的可加性确定.
ni n
U mi
T
xiUmi T
Hm xiHmi T Sm xiSmi T, pi
麽尔分数
xi
ni n
piV RT pi pV RT p
xi 1
令 M m 折合麽尔质量 n
如何求其它形 式的状态方程?
n pV RT
pV
Mn
R M
T
mRgT
Rg
R M
折合气体常数
M m n
能 焓
U H
HUii
T, T,
pi pi
, ,
ni ni
Ui Hi
TT,,nnii
熵 S
Si T, pi ,ni
u U m
mi m
ui
T
wiui T
理想 气体
h wihi T s wisi T, pi 性质与组
质量分数
wi
mi m
wi 1
分有关
Um U n
组元状态
p1 n1 TV
p2 n2 TV
pn TV
由于温度、体积(气体分子的活动空间)与气 体组成无关,混合前后各组元状态没有改变, 组元状态量(广延)为
i i T,V ,ni i T, pi ,ni
分压
pi
ni RT V
U,H,S
n ni pi V RT pV RT
p pi
du dT
wi
dui dT
wicVi
Rg = wiRgi
CmV xiCmVi
cp
dh dT
wi
dhi dT
wicpi
Cmp xiCmpi
cp cV wi cpi cVi wiRgi Rg
u wiui h wihi
s wisi
ds
widsi
wi
cpi
xi
i
wi
Rgi Rg
wi
M Mi
pi p
Vi V
T, p, w1,..., wk wi 1
比参数 u, h, s, v 独立参数符合吉布斯相律
n=k–f+2
吉布斯相律(P230)
对于多元(如k个组元)多相(如 f 个相)的热力系,其独立的强度参 数,即自由度 n = k – f + 2
