基团贡献法课件
基团贡献方法UNIFAC估算局部组成模型NRTLWILSONUNIQUAC的二元参数
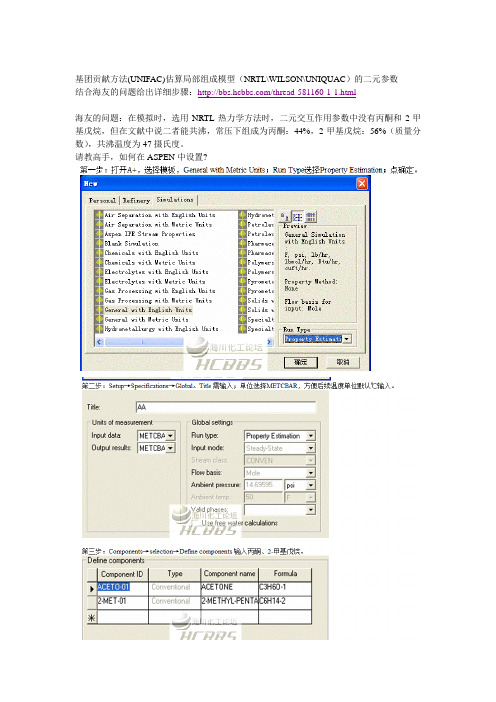
基团贡献方法(UNIFAC)估算局部组成模型(NRTL\WILSON\UNIQUAC)的二元参数结合海友的问题给出详细步骤:/thread-581160-1-1.html海友的问题:在模拟时,选用NRTL热力学方法时,二元交互作用参数中没有丙酮和2-甲基戊烷,但在文献中说二者能共沸,常压下组成为丙酮:44%,2-甲基戊烷:56%(质量分数),共沸温度为47摄氏度。
请教高手,如何在ASPEN中设置?问题:1. 在第五步中的Method为什么选Unif-DMD,而没有选其他的方法,比如UNIF-LBY、UNIF-R4等,这些方法有什么本质上的区别吗UNIFAC-DMD,LBY等没有本质区别,只是修正模型不同而已。
你找我发的那个A+10说明书看下,有详细介绍是什么修正。
2. 如果我不想使用Aspen自带的unifac基团交互参数,而是用自己的unifac基团交互参数(基团参数rq仍旧采用软件自带的),来进行楼主帖子中这样的估算,如何操作?另外,除了上面的问题外,还有一问,那就是如果我自己定义了Aspen中没有的新基团(有时候想把一个物质自己来进行拆分),而且通过别的途径得到了新基团的基团参数RQ以及所需要的相关基团交互参数,那么在这种情况下,在Aspen中怎么样来定义新基团,然后进行楼主帖子中的估算操作呢?还请楼主解答。
今天研究了一下,你的这两个问题应该都可以解决:1、当你选择UNIFAC方法的时候,A+默认使用数据库中参数,但也可以修改。
你只需要在parameters→unifac group binary→GMUFB-1中输入参数即可。
但这前提是你在components中有定义unifac groups,否则gmufb-1是灰色。
2、a+ components的UNIFAC group支持定义新的基团。
号码可以自己定义。
关键是你能定义官能团(方法有很多,bondi、unifac等等),这一步在分子结构中实现,并可以求的q、r的值。
计算环烷烃沸点的新方法——基团键贡献法

计算环烷烃沸点的新方法——基团键贡献法2∞2第22卷第3期.194~199有机化学Chine~Joamalof(…0…v0l22.2∞2I3.J94~199研究简报?计算环烷烃沸点的新方法——基团键贡献法王克强,王捷冯瑞英(.洛阳师范学院化学系洛阳471022)(许昌职业技术学院许昌461000)洛阳市第一高级中学洛阳471002)摘要根据分子中基团的特性和连接性.发展了一种直接根据分子结构信息计算环烷烃沸点的新方法基团键贡献法,该方法既考虑分子中基团的特性,又考虑基团之问的连接性(化学键),具有基团贡献法和化学键贡献法的特点对256种环烷烃沸点的计算结果表明,计算值与宴验值的一致性令人满意,平均误差071啦.关键词结构性能关系,基团键,基团键贡献法,沸点,烷烃GroupBondContribution'__.?.___-——ANewMethodforCalculating BomngPointsofCycloalkanesW ANG,Ke-QiangwA№,Jie.FENG,Rui—Yiag(mofChoTaist~,Normalc.,h~/ang471022)(~XuchangI.'ocatiormlTerhnical0f,461000)('.增sHigh&hodNoJ,4~002) AbslractOilcharacteristicsandconnectivi~,ofthegroupsinmolecules.groupbondscanbea ppliedtocharacterizemolecularstructure.Groupbondscontaininformationofgrouppropertyandco nnectivityinmoleculcs.Groupbonds,obtaineddirectlyfr(1堋molecularstructure,COIlbeusedtocNcuhWthepropertiesofmolecules.Anewmethod,thegroupbondcontributionmeth~,WItSdevelopedtocalculatetb eboilingpoints0fcycloalkmmsfrommolecularstructurelrhecalculatndresultsshowedthatthecaleutatedb oilingpointsof cycloalkaneswereingoodagreementwiththeexperimentaldata,withilloanrelativedeviatio nbeing0.71%for256cyeloalkanes(includingmonoeycloalkanesandpolyeycloalkmaes)egroupbondcontri butionmethodhasadvantagesoverthegroupcontributionmethodKeywordsatrueture-prepet~-relationship,groupbond,groupbendcontributhmmethod.bo ilingpoints,CVC】0日Ikane有机化台物结构性能定量关系的研究,是化学中'个十分活跃的研究领域.多年来,国内外许多研究者作了大量研究的工作,发展了许多根据分子结构预测化合物性能的方法.在有机化台物性能的预测方法中,应用较广的是基团贡献法和化学键贡献法,由于这些方法对同分异构体的区分能力相对较差,预测精度不够理想,作者之?4—6根据分子结构的特点,将基团贡献法和化学键贡献法结合在一起,发展了一种预测化合物性能的新方法一基团键贡献法,该方法具有基团贡献法和化学键贡献法的特点.可有效地预测化合物的性能.在有机化合物结构性能研究中,环状化台物的研究相对较为E-nHn:~'3558101@sdauO00t.~3558IOI@37InelRemlwdApril28,2001;re~sedSeptetnber17,2001;~ptedOctober22.ⅫNo3王克强等:计算:烷烃沸点的新方法摹囝键贡献法困难,无论是基团贡献法.还是化学键贡献法,都需要刘同的环进行修正,拓扑方法也需要对环状化台物分别处理.例如在环烷烃的研究中,拓扑方法对链烷烃和环烷烃的研究是分成陌类进行的,Estrade【提出计算环烷烃拓扑指数的方法.Schultz对单环烷烃的沸点与分子结构之间的关系作了研究,取得了较好的结果.本文用基团键贡献法发展一种计算环皖烃沸点的方法.对环烷烃沸点的计算结果表明.计算值与实验值的一致性令人满意1基本原理和方法结构决定性能是化学中的一条基本规律.化合物的性能不仅与分子中原子的种类和数El有关,而日更与原子的连接性有关根据前文的研究结果町知,分子结构可用基团键进行表征.显然,分子中基团的种类不同,基团键就不同;分子中基团的连接性不同,基团键也不同为简化起见,我们暂不考虑分子中环的大小,将环烷烃分子中的基团分为烷烃基团和环烷烃基团两大类,据此确定分子中基团键的数日对于烷烃,分子中有4种基团:分子中存在着1O种基团键.对于环烷烃,分子中有7种基团c其中包括烷烃分子的3种基团).其中三种新的基团为:为简化起,我们将环烷烃基团与烷烃基团之问形成的基团键作为烷烃基团键处理,仅考虑环烷烃基团之间形成的新基团键.同时根据环的大小进行适,的修正.环烷烃分子中有3种新基团,根据排列组台原理可以确定环烷烃分子中存在着C{+C;=6种新的基团键.表1列出了烷烃和环烷烃分子中存在的16种基团键,其中前l0种(C~C139)为烷烃基团键,后6种(GB『1_~GB』)为环烷烃基团键.分子中基团键的种类和数日可以直接根据分子结构确定,也可以根据分子结构的邻接矩阵和染色矩阵计算得到,具体计算方法见前文6.环烷烃与烷烃的主要差别在于前者分子中存在着环状结构,我们分两步计算环烷烃的沸点.第一步暂不考虑环烷烃与烷烃的差别,将环烷烃摹团烷烃基团处理,计算得到环烷烃沸点的近似值rlI(烷烃);第二步考虑环烷烃与烷烃的差别,计算环烷烃基团和环对沸点的影响,计算沸点的修JE量△r¨1这样即可计算得到环烷烃的沸点:(环烷烃)=Tb(烷烃J+AT1.(1)因此,只要根据分子结构计算,(烷烃)和△,即可得到环烷烃的沸点r(环烷烃).自先.我们探讨烷烃沸点T(烷烃)的计算.沸点是与分子结构密切相关的物理量,分了结构不同,沸点就不同既然分子结构可用基团键表征,那么,沸电必然为基团键的函数,因此.,(烷烃)满足:rlIc烷烃)=fl(GB)].显然,从理论上确定这函数是相当困难的,我们用数学方法进行近似处理我们发现,烷烃的沸点r(烷烃)随着分子巾碳原子数(碳原子数"与基团键之间存在着定量关系[TJ)的增加而增大,烷烃同分异构体之问的沸差异可用基团键定量描述,即碳原子数反映烷烃沸点的体变化趋势,基团键则从细节上反映r分子结构差异对沸点的影响.对烷烃沸点的拟台结果表明,沸点随着分子中碳原子的增加而增大,随着基团键的变化而改变,且烷烃的沸点1(烷烃)/n与基团键数n(GB)的线性函数和n(GB)/n显着相关,因此.我们选择的函数为b(烷烃)/=144.723+∑(+/)n(GB)…(2)式中为分子中的碳原子数,12.(GB,)为基团键GB. 的数目,日和C是与基团键特性有关的常数(基团键参数).表l列出了本文用753种烷烃沸点数据J 拟合得到基团键参数.其次,我们探讨环对沸点的影响.环烷烃中环对沸点的影响△r与环的大小及环上取代基的位置有关,前者对沸点的影响可根据环的人小进j修正, 后者对沸点的影响可根据环烷烃的基团键修正我们发现,环对△.的影响不仪与环的大小和数日有关,而且与分子中的碳原子数有关,在环的数目和大小一定的条件下,环的影响随着碳原子数的增加而增大;环烷烃基团键对沸点的影响同样与基团键的数目和分子中的碳原于数有关,且基团键的影响随着分子中碳原子数的增加而减小因此,我们选择的△函数为:l96有机化学V ol22.2002Bj)e-O.frS~c/n+哺㈥Tal~~靴2ParametersB.雌ofth团e式中(GBj)为环烷烃基团键GBj的数目,日是与基团键特性有关的常数(基团键参数),为环的数目.A为环的修正量.表2列出了本文用256种环烷烃沸点数据[拟合得到基团键参数和环修正量.表3列出了确定基团键参数所用的基团键数目. 表1计算Tb(烷烃)的基团键参数日和l'al~e1ParametemBi,Cofthegroupbondsforcalculating (alkane)2计算结果及讨论应用表2提供的基团键参数日,,c和环修正量△,可直接根据分子结构计算环烷烃的沸点.值得指出的是,在确定分子中环的大小和数目时,应注意各环应尽可能独立,不能存在环包含环的情况,即以取小环为主,所取的大环不能包含小环.例如,四环[2, 2,I,02一,os,]庚烷(图1)分子中的环为:1个四元环,2个三元环,1个五元环;三环r5,2,1,o2]癸烷分子中有3个五元环计算沸点的基本方法是:第一ringsforcalculatingATb下标C表示环烷烃基团之间形成的基团键表3确定基团键参数所用基团键的数目NTalde3Numberofthegroupbondstrsedincorre]atingthe paratt~etem丑andC代码Ⅳ代码Ⅳ代码Ⅳ代码N代码GB112492187G355GB】0737GB"9lGB2l5l91337G252GBl_494GB】d14G璐l015G57027GB】246GB】51由于G玮仅存在于乙烷中.其基团键的数目为H川H2圈1P耳环[2,2.1,o2~,os:庚烷和--~[5.2.1,0=]癸烷Figure1Quadrlcyclo[2.2,1.~,.]heptmr~andlricyclo[52,1.02,]deeane步暂不考虑环烷烃与烷烃的差别,将环烷烃基团作为烷烃基团处理,根据分子结构确定分子中基团键的种类,数目,代人式(2)计算(烷烃);第二步考虑环烷烃与烷烃的差别,根据分子中环烷烃基团之03王克强等:计算环烷烃沸点的新方法一基团键贡献法197 间形成的基团键及环的大小和数曰,代人式(3)计算△Th,将计算得到的I(烷烃)和△I代人式(1)即呵计算得到环烷烃的沸点.例如四环一2,2,l,.",03']庚烷,"=7,第一步,将环烷烃基团作为烷烃基团处理,分子中有2种基团键:n(G)=2,n(GB7)=8,代人式(2)得到Th(烷烃)=3O4.24K;第2步,考虑环烷烃基团的与烷烃基团的差别.环烷烃基团之间形成2种基团键:n(GB】1):2,n(GB】3)=8,分子中有1个四元环,2个三元环和1个五元环,代人式(3)可得△=82.5lK,代人式(1)得(环烷烃)=(烷烃)+△】,=386.75K;对于三环[5,2,1,02,]癸烷,,fr=10,第一步,将环烷烃基团作为烷烃基团处理,分子中有3种基团键:n(G)=3,(G)=6,n(GB7)=3,代人式(2)得到Th(烷烃)=339,05K;第2步.考虑环烷烃基团的与烷烃基团的羞别,环烷烃基团之间形成3种基团键:n(GB)=3,n(GB】1)=6,n(GBl)=3,分子中有3个五元环,代人式(3)可得△Tb=120.41K,代人式(1)得I(环烷烃)=(烷烃)+△TI=45946K.为确定本文方法的可靠程度和适用范围,我们对环烷烃(包括环丙烷到环二十烷)进行计算,并与实验值I进行比较.限于篇幅,表4列出了部分环烷烃沸点的计算结果,全体256种环烷烃的计算结果绘于图2.表4部分环烷烃沸点it-算值(ca1.)和实验值Tb(exl~)的比较Table4CⅥ)aI1s0nofthec~leulatedboilingpointTbmt}Iexperime.t.1dataofsoⅡcyclOalka~es环烷烃Tk,(exp)Th(ca1)E1%环烷烃(唧)Tb(eat)£/%甲基环丙烷27388271.88—0.73戊基环烷4768247587—0201一顺一2-二甲基环丙烷31018310.81020辛基环己烷5367553303—0.69异丙基环丙烷154340.57272十一烷基环己烷58635581.60—0.811一甲基一反2-£基环丙烷331.8133714161十四烷基环己烷6281562366—071 1顺一2一反一3三甲基环丙烷332.853H430.48十七烷基环己烷664.1566o58—054己基环丁烷34:375344.300.16=十烷基环己烷6951569332—0261一反一2-二甲基环丁烷33315337.30l24二十三烷基环己烷72215722.560.06秫-1'1AIA1nm+"1…AA…丙基环戊烷己基环戊烷壬基环戊烷十二烷基环戊烷五烷基环戊烷十八烷基环戊烷=十一烷基环1萱烷二四烷基环戊烷=十七烷基环戊烷三}烷基环戊烷三十三烷基环戊烷三十六烷基环戊烷己摹环戊烷】一反_2'二甲基环戊烷丙基环戊烷l一甲基一顺一2一乙基环戊烷】一甲基一反一3一乙基环戊烷1一』匝一2一顺一3一三甲基环戊烷l一顺一2顺一4-i甲基环戊烷丁基环戊烷特丁基戊烷1一甲基一反一2一丙基环戊烷41)4.1O476055351558435626.15662.1569'3157201574515767】57s7.15805.1537662 365024O4.10 401.20 39425 39615390.15 429754l800419.5241)447O.09 473】8—0.60 529.82一1.00 5_77.91—1.10 61952—106 65601—093 68834—069 717.】9—041 743.09—028 7054.5—009 787610068o6阻0.21 377.86033 37083】59 404.47009 39856—0.66 394.980l9 39150一l17 38793—0.57429.03—0.17422.5811O422.55072=十九烷基环己烷三十=烷基环己烷三十五烷基环己烷甲基环己烷1一顺一2一=甲基环己烷1一反一3-二甲基环己烷l雨基环己烷1甲基一顺2-乙基环己烷l一甲基一反一3一己基环己烷1,1,2一三甲基环己烷】一顺0丽一3一三甲基环已烷1一顺2一顺4三甲基环己烷l一反2一反4三甲基环己烷二环己甲烷1,】一二环己丁烷l_l一二环己庚烷1.1一二环己癸烷1.1一二环己十三烷】,】一二环己十六烷环千烷环十二烷环十五烷68.15788l5妍15374084O2939760 42987 42925424】5 418.35426l54211541437525.95 566.12605l564.O15 670.15 697.15 451555l2l5559】5772O58 794080758】3.640.8O 37806106 39953—084 39596—041 43】350.34 424.87一1.o2 421.63一O59 4】575—062 4l779一】96 414.55一1.57 414.5500452489一O205690305l608.9l0.62643.42O516736】()527002】04444896—0.57510.75—02755537一O68l98有机化学V o1.22,2g02续表环烷烃TbE/%环烷烃To7E/%(exp)(ca1)(exp.)(ca1)1一甲基一1一异而基环戊烷42l1542319048环十八烷5981560246()721一甲基一顺一3一异丙基环戊烷4151541717049联环庚烷56415565870311圳2一二己基环戊烷4267l42315~083环戊基环己烷4882548244—119I一反一3一二乙基环戊烷423154199l~0762,4,6-三甲基二环[3,1.1]庚烷4426543597—15】l一顺一2一二甲基一1一乙基环戊烷41715417740142一甲基二环[2,2.2]辛烷43l15435541O21一顺一2一一甲基一反一3一乙基环戊烷418.15416.07~050二环[2.1.O]戊烷318.653155l一0981一顺一2一二甲基一顺4乙基环戊烷420.1541284~17,4环『1n]_丁辟1'11钔一n11一顺一3一_I甲基一反一2一乙基环戊烷410.15416.07I44四环[2,2.I,.03]庚烷381.15386.75I.471一顺一3一二甲基反4乙基环戊烷410.15412.84065顺一一环[3.3,0]辛烷410.15412300.521.1,2,2_四甲基环戊烷496.15405.27~0.22反.=环[3,3.O]辛烷405.15412301.76 1.1-顺一2_顺一4一四甲基环戊烷403.15403.720.142一甲基二环l2,2,2辛烷43115435541.o21,1一顺一3一顺一4一四甲基环戊烷496.154.9O.89~I.313二环4,2.0一辛烷4091540892-一0.嘶1,2,2-反一3一四甲基环虎烷4l1.15409.79~0.33二环4.1,0.庚烷3896538017—2.43I一顺一2一反一3一婀4四甲基环戊烷4O415408.991.20三环:5,2,l,02癸烷4661545946—1.44I一反2一反一3一顺4四甲基环戊烷4O4154O8991.20螺[2.2]戊烷3131530746一12己基环己烷4O493406.5904l顺一六氢茚44O1543886—0.29表中环烷烃是用计算机选取的,方法是:对256种环烷烃编号为No1~256,选取No. 2,N05.8,….约占总数的三分之一!II2环烷烃沸点计算值Tb(c)与实验值(.xp)的比较Figure2(_^】m90nofthecalctrlatedboihngI~intTh(ca1)htheexperimentaldatars(e~p)ofcycl0alkane对256环烷烃的计算结果表明,无论是对含有一个环的简单环烷烃,还是对含有多个环的复杂环烷烃,沸点的计算值与实验值".]的一致性令人满意,计算结果的平均绝对误差3.29K,平均相对误差0.71%在计算的256种环烷烃中,计算误差小于0.5%的106种,计算误差在0.5%~l0%之问的90种,计算误差1.0%一1.5%之间的38种,计算误差1.5%~2.0%之间的l2种,计算误差2.0%~2.5%之间的6种,计算误差2.5%~3.0%之间的2种.计算误差大于3.0%的2种,最大计算误差3.13%.显然,绝大多数化合物的计算误差在l0%以内.文献上应用较广的计算烷烃沸的方法是Jobaek方法",该方法对上述256种烷烃计算结果的平均绝对误差46.89K,平均相对误差7.1】%.显然,与Joback方法相比,基团键贡献法将计算精度提高了一个数量级.因此,基团键贡献法具有适用范围,..,计算结果可靠的特点.此外,基团键贡献法是根据分子中基团的特性和连接性发展的,易丁实现计算机程序化设计,我们开发了相应的计算机程序,只需输A少量分子结构参数即可计算得到沸点预测值3结论本文根据分子中基团的特性和连接性,发展了一种根据计算环烷烃沸点的新方法——基团键贡献法,该方法既考虑了分子中基团的特性,又考虑了基团的连接性,同时具有基团贡献法和化学键贡献法的特点,对环烷烃(包括单环和多环烷烃)的计算结果表明,沸点计算值与实验值的一致性令人满意.No3王克强等:计算环烷烃沸点的新方法一基团键贡献法l99 1Reid,R.C;Prausrdtz,J.M;Poling,BE.Properties‰andt/qt,i&,4thEd.,McGraw-HillBook Company.NewY0rk.1987.2Xu,ZH;Mao,Z.X.;Wang,LS;Pang,YLHandbo&Chemi*'alProperey"EstimationMeth,~,Huaxue Got~,gyeChiCle.Bing,I99l(inCtfine~)(许志宏.毛卓雄,王乐珊,鹿瑶琳译,亿学性质估算方法手册,化学工业出版社,北京,1991.)3Wang,K.Q;Hu.YChin,.忡Ctwm.1997,17,230(inChinese)(王克强.胡英,有机化学,1997.t7.230.)4Wang,KQJ~.jiHngHuax,w1996,13.182 (inChisese)(土克强.计算机与应用化学,1996,17,182.)5Gutman,I;Estrade,E.JChemComputSci1996.36.5416schuhz.HP:Schultz1993.33,2407Wang,K.Q.Ch/nJChit~se)PjCheml《0唧nOrgCtwm.1999,19,304(in(于克强,有机化学,1997,19,304)8:~ericanPetroleumhmfituteResearchProject44,Seleaed pⅡofl#opertyofH)~warbonsandRelatedCom~unds1lrmo[hIacResearchCenterdtheAmericanPetroleum hrstitute,Texas,1,Tablea9Weast,RCCRCHandbookChen~tO,andm.66thFA.CRCPress.h,e..Horida,l986,04210Dean,J.Ahinge'HandbookofChemic-.13thEd. McGraw-HillBookCompany,NewY ork.1赠5.PP.7~82. 】lMa,PS踊uHuagong肛^u卧咖S,%uce,Huaxue Gon~,eChubami~e,l~ijing,1993(inChinese).(马肺生,石油化工数据手册,化学工业出版社,北京, 1993,(Y0104281LI,L.T:F,YY)。
酯交换制油酸甲酯的基团贡献法热力学分析

。 原市 塑料 研 究 所 , 山西 太 原 0 0 2 ) 太 3 0 4
摘要:采用基团贡献法和赵氏经验公式( s a p—A lT + B )计算了三油酸甘油酯与甲醇之间发生的三步连续 b g
第6卷 3
第 6期
化
工 学
报
V01 3 N O .6 .6
21 0 2年 6月
CI ESC J u n l o r a
J n 2 1 ue O2
酯 交 换 制 油 酸 甲 酯 的 基 团 贡 献 法 热 力 学 分 析
张继 龙 ,赵 志仝 ,乔 燕 ,林 昊 ,庞先 勇 , 白启荣。 ,李瑞 丰
Ab t a t Bid e e F sr c : o is l( AM E) i a b o e r d b e c e n e e g e o r e c mp ie fm o o l y s e s o s i d g a a l la n r y r s u c o rs d o n a k le t r f
(Colg f C e sr n h mi lE gn eig,T i u n Unvri f Tc n lg l eo h mity a d C e c n iern e a ay a iest o eh oo y,T iu n 0 0 2 y ay a 3 0 4,S a x ,C ia h n i hn ; 。 le eo M ii g Teh oo y, T i u nUn v ri f c n lg Colg f n n c n lg a y a ie st o Teh oo y,Ta y a 3 0 4 h n i h n y i u n0 0 2 ,S a x ,C ia; 。 i u nI siu eo a tc,Tay a 3 0 4 h n i Ta y a ntt t f Plsi i u n 0 0 2 ,S a x ,Chn ) ia
北京化工大学高等化热大作业-基团贡献法

浅谈基团贡献法引言不久前,我前往导师XXX的办公室,与他沟通交流学业上的问题。
谈话间,王老师提及的一种建立自由基聚合反应过程机理模型的方法──链节分析法[1],引起了我极大的兴趣。
这一方法可以对复杂的聚合反应过程进行准确的动态模拟,解决了以往须同时求解无限多个微分方程才能模拟聚合过程的难题。
通过这篇文献[1]我得知,对于高分子聚合物体系的热力学性质的处理,一直是建立聚合反应机理模型的难题之一。
此法[1]不再把组成和链长不同的无穷多的聚合物大分子作为组分,而是将流程模拟系统的组分中出现的C、E、A·、R·等基本单元,参考其相应的单体物性,从而得到大分子聚合物的各种热力学性质。
高分子的绝大部分热力学性质如密度ρ、比热容C p、焓H、摩尔体积V b、各种临界参数都能利用Joback基团贡献法,由基本单元的物性计算得到。
联想到化热课堂上与基团贡献法有关的似乎只有UNIFAC模型,因此我想对物性估算法中的基团贡献法展开讨论,描述各种不同的方法并加以简单的评价。
这便是本题目的来源。
第1章临界参数估算方法不论是通过自己对化工热力学的学习,还是通过对文献的查阅,都不难得出这样的结论:对纯物质而言,临界参数是最重要的物性参数之一。
其实,在所有的PVT关系中,无论是对应状态法还是状态方程法都与临界数据有关。
对应状态法已成为应用热力学的最基本法则[2],借助于对应状态法,物质的几乎所有的热力学参数和大量的传递参数可被预测,而对应状态法的使用又强烈地依赖于临界数据。
此外,涉及到临界现象的高压操作,如超临界萃取和石油钻井[2],也与临界参数密切相关。
总而言之,临界数据是化工设计和计算中不可缺少的重要数据。
临界参数如此重要,前人自然少不了花费巨大精力对其进行收集、整理和评定,但据我了解,所收集的临界数据大多局限于稳定物质的临界数据。
虽然近几年对不稳定物质临界参数测定方法的研究在开展着,并且也测定了一些不稳定物质的临界参数,但大部分的不稳定物质仍由于测定难度大而缺乏实测的临界数据。
基团贡献法及其应用讲解

5.2.2 分子性质与基团元贡献值的关联
分子性质的值与基团元贡献值之间的关联有下列的一些形式:
(1)直接加和法 就是分子性质值直接由各基团的贡献值以及各
种修正项直接加和而得,即 A niai
i
式中A代表分子的某一性质;ni为i基团的数目;ai为i基团的元贡献或 某种修正项。
(2)函数式法 这种关联法将分子的性质A作为某些参数B,
参照基团所在分子的主体结构及其特点将同一基团再加细分 :如: OH基团,在醇与酚中表现出不一样的性质
按照分子的立体构型划定基团 :顺反结构基团
在划分基团时往往把有共轭效应的基团分开:如1,3丁二烯中的C-C键 比没有共轭分子中的C-C键要短一些
同系物的第一化合物常被当作一个基团单独列出:如甲酸与羧基相连 的是氢原子,而醋酸与羧基相连的是碳原子
5.2.3 基团贡献法中的修正项
分子内构型强烈的影响分子性质的值,而采用纯粹由基团 性质的元贡献值加和,往往不能充分反映分子构型的差异 对分子性质影响的大小。除按基团加和外,常常还要加上 一些修正项,这些修正项常见的有:
1)环式构型修正
如环丙烷、环丁烷、环戊烷、环己烷与环庚烷比较: n<6 的环烃每个-CH2-具有不同的燃烧热,n6以后的环烃每个CH2-具有正常和相同的燃烧热。因此估算环状结构的化合 物的性质时常有修正项,尤其是碳数少的环。
同一种键在各种化合物中不但基本保持一定长度,而且,在典型的
键中A-B的距离可以很准确的表示为A-A及B-B距离的算术平均值
(A和B均代表原子,d代表距离)
d AB
1 2
(d
A
A
dBB )
例如(硅晶体中),由此求得
dCC 1.54A,dSiSi 2.34A
利用基团贡献法计算生物柴油体系临界性质参数

在生物柴油 的生产制备过程 中 ,生 成物 主要 是甘油 和脂 肪 酸 甲酯 ,以及过剩的 甲醇 ,这些物质 的名称和分子式 列于表 1 , 各物质 的结构式如 图 1 ~图 7 。为了把生 成物各组 分分 离出去 , 设计的分离工艺 中,就需要用 到各 组分 的热 力学参 数 ,比如 临 界温度 T c ,临 界 压 力 P c和 偏 心 因 子 ( | ) 。 但是这些醇类 ,酯类物质 ,在 高温下 易分解 ,因此 用实 验 的方法去测定热力学性质很 困难。为 了解决 上述 问题 ,前人 提 出 了利用分子结构 的加和性质 ,来 估算热力 学性质 。就 是利用
表1 生 物 柴 油 体 系 各 物 质 名 称 及 分 子 式
或 乙醇 ) 经酯交换 反应得 到 的脂肪 酸单烷 基酯 ,最 典型 的是脂 肪酸 甲酯 。与传统 的石化能源相 比,其硫及 芳烃含 量低 、闪点 高 、十六烷值高 、具有 良好 的润滑性 ,可部分 添加 到化石柴 油
中 。
关键 词 :基团贡献法;生物柴油;物性估算
中图分类 号 :T E 6 5
文 献标 志码 :A
文章编 号 :1 0 0 1 — 9 6 7 7 ( 2 0 1 4 ) 0 1 8 — 0 0 4 0 — 0 3
The Ca l c ul a t i 0 n 0 f Bi o di e s e l Cr i t i c a l Pa r a me t e r s
基团贡献法及其应用

5.1.2 分子内原子的作用距离
✓有机化合物分子中直接相连两个原子之间的作用多为共价键,共价 键的键长多数在1至2Å之间 ✓分子内以形成化学键的相邻两原子的相互作用最为强烈 ✓诱导效应 ✓共轭效应 ✓空间效应
总目录
本章目录
上页
下页
5.1.3 结构单元的选择与加和性规则的近似程度
加和性规则是一种近似规则,其近似的程度取决于我们所 选择的结构单元精细程度
子中的手征性碳原子数。
对CӨp和HӨf,则不必作对映异构体修正。
总目录
本章目录
上页
下页
5.3 基团贡献法估算纯组分的基本性质
5.3.1 纯物质临界性质估算
临界性质包括临界温度(Tc)、临界压力(Pc)、临界体 积(Vc)等。在各种临界参数估算法中,比较通用而又可 靠的是基团加和法。
1)Joback法
4)邻位修正
由于邻位的两个基团(或原子)较接近,基团之间便产 生排斥作用,这是不相邻基团所没有的,这种相互作用不能 忽略,而基团贡献参数又无法反映它的存在,故需另加设邻 位修正。
总目录
本章目录
上页
下页
5)对称性修正 用键贡献法和基团贡献法估算理想气体熵SӨ时,通常
必须作分子对称性的修正。 ▪对称数为定义是:分子刚性转动时,分子内相同原子 (或基团)出现独立互换的总次数(不得反转)。为便于 计算,通常把分解为外和内,即: =外. 内 ▪计算分子的对称数一些规律 CP
键中A-B的距离可以很准确的表示为A-A及B-B距离的算术平均值
(A和B均代表原子,d代表距离)
d AB
1 2
(d
A
A
dBB )
例如(硅晶体中),由此求得
dCC 1.54A,dSiSi 2.34A
溶液理论和活度系数课件

将式(5-2)代入,得:
无热量旳放出或 吸收,也无体积
旳变化。
5.1 过量函数
5.1.2 过量函数旳基本关系式
过量函数是指溶液旳热力学性质超出相同温度、压力和构 成条件下理想溶液(或理想稀溶液)旳热力学性质旳部分。
对于理想溶液,全部过量函数都等于零。
类似旳定义也合用于过量体积VE,过量熵SE,过量焓HE,
不能用于液液部分互溶旳场合。
5.5 活度系数关联式
5.5.2 局部构成型
2)NRTL方程(Nonrandom Two-Liquids) 可同步合用于部分互溶及完全互溶系统。
式中 :
gij是i-j相互作 用旳能量参数
5.5 活度系数关联式
5.5.3 UNIQUAC方程
(5-1a)
式中,Ki 为百分比常数,它取决于温度和压力,与构成无关。
从式(5-1)中能够看出,假如令
,那么,
。
在这种情况下,若逸度等于分压,即可得到熟悉旳拉乌尔定
律。
另一种情况:理想稀溶液—亨利定律。
5.1 过量函数
5.1.1 理想溶液
3)理想溶液旳混合热和混合体积变化
拉乌尔定律:
(5-2)
为了以便,这里删去了上标L。目前利用两组严格旳热力 学关系式,
背面旳章节中,式(5-5)和(5-6)将反复利用。
5.2 活度与活度系数
5.2.3 活度系数对温度和压力旳导数
在全部构成范围内都符合拉乌尔定律旳理想溶液满足:
在恒定旳p和x下对温度求导,得:
在恒定旳T和x下对压力求导,得:
5.2 活度与活度系数
5.2.4 基于理想稀溶液定义旳过量自由能
理想稀溶液由大量旳溶剂1和极少旳溶质2构成。
化工热力学基团贡献法

配 位 数 Z 取 为
ln γ
R i
( = ∑ν ki ) (ln Γk − ln Γk( i ) ) k
N
(i ) Γk是基团 的活度系数 是基团k的活度系数 的活度系数; Γk 是在纯溶剂 中基团k的活度系数; 是在纯溶剂i中基团 的活度系数 中基团 的活度系数;
纯组分i中基团 的活度系数 纯组分 中基团k的活度系数 中基团
Tc = 181.728 × ln
( ∑ n ∆T + ∑ n ∆T )
i bi j bj
( ∑ n ∆T + ∑ n ∆T )
i ci j cj
pc = 0.13705 + 0.1 0.100220 + ∑ ni ∆pci + ∑ n j ∆pcj
Vc = −4.350 + ln
(
)
−2
( ∑ n ∆V + ∑ n ∆V )
基团法发展和分类
早期的基团法很简单,基团划分“粗糙”,所划基团很少。 早期的基团法很简单,基团划分“粗糙” 所划基团很少。 20世纪中叶,用基团法估算标准生产焓及临界性质时,划分 世纪中叶,用基团法估算标准生产焓及临界性质时, 世纪中叶 的基团较多较细。 的基团较多较细。 早期的基团法中,不考虑各种基团间的交互作用。 早期的基团法中,不考虑各种基团间的交互作用。从20世纪 世纪 40年代起,开始修正临近基团的影响。 年代起, 年代起 开始修正临近基团的影响。 基团法从估算固定温度点开始,经过发展, 基团法从估算固定温度点开始,经过发展,目前基团法已经 提出了温度关联式,用于各种温度下。 提出了温度关联式,用于各种温度下。 开始基团法仅用于纯物质的物性估算, 开始基团法仅用于纯物质的物性估算,目前已用于汽液平衡 估算,并用于多种相平衡估算中, 估算,并用于多种相平衡估算中,成为唯一的估算相平衡的 方法。 方法。
基团贡献法及其应用

5.1.2 分子内原子的作用距离
分子许多性质之所以具有加和性,与分子内原子的相互作用的特点 有关,分子内的原子间相互作用属于短程作用( 1至3Å ),有机化合 物分子中直接相连两个原子之间的作用多为共价键,共价键的键长多 数在1至2Å之间,最长C-I为2.1 Å,最短O-H为0.096 Å,所以分子内 以形成化学键的相邻原子间的相互作用最为强烈。 分子内以形成化学键的相邻两原子的相互作用最为强烈
5.2 基团贡献法 5.2.1 基团的划分
按功能团划分基团,这是基团划分的最基本依据,因为每种功能团 往往表现出有其独特的物理化学性质,即使在不同类型的分子中也是如 此,在同系物分子中规律性尤其明显。这正好与划分结构单元的目的相 符合,而功能团之所以具有独特的物理化学性质,正是由于它所具有的 是特定原子间的特定相互作用。除了按功能团划分基团外,还从下面几 个方面加以细分。(功能团划分依据) 参照基团所在分子的主体结构及其特点将同一基团再加细分 :如: OH基团,在醇与酚中表现出不一样的性质 按照分子的立体构型划定基团 :顺反结构基团 在划分基团时往往把有共轭效应的基团分开:如1,3丁二烯中的C-C键 比没有共轭分子中的C-C键要短一些 同系物的第一化合物常被当作一个基团单独列出:如甲酸与羧基相连 的是氢原子,而醋酸与羧基相连的是碳原子
5.3.2 纯物质正常沸点的估算 正常沸点的实验数据相当丰富,可靠性也高,许多文献中, 有大量实验数据,但仍然有一些物质的Tb值有待估算。正 常沸点较难估算,虽然提出了一些Tb的估算方法,但有实 用价值的只有基团贡献法。
1)Joback法
式中Tb的单位是K,基团贡献值△Tbi见表5-10,通过438种 有机物的数据检验,式(5-15)的平均误差为3.6%。 2)C-G法
《化工设计》第二节基本物性数据课件

T2
C pdT
Cp
T1
T2
T1
(3-40)
从附录六表查得的为25℃与较高温度区间的平均 值。即:
Cp
Qp T2 25
或
Qp Cp (T2 25)
当我们遇到问题为初温不是25℃,而是Ti时, 应用下式求Qp:
Qp H nCp25T2 (T2 25) nCp25Ti (Ti 25)
i
i
i
i
(二)平均热容与真热容
1.平均热容:若恒压下,当温度自T1变化至T2, 1mol物质所需的热量为Qp,则T1至T2温度范围 内物质的平均热容为:
Cp
Qp T2 T1
2.真热容 在恒压下,1摩尔物质的真恒压热容为
Cp H Q T P T P
即:在一温度下的真恒压热容
3.平均热容与真热容CP的关系为:
=447620J (3)取平均温度0.5×(1100+400)=750K 查750K平均热容(实际为750K真热容)为 44.79kJ/(kmol.K )。 Qp=ΔH=10×44.79(1100-400)=313530J
分析上述的方法那种可用,为什么? 注意正确的做法及三种错误的做法。
为什么当热容与温度为直线关系时第三种 方法可用?热容与温度是直线关系吗? 收集数据时,需注意计算自始至终应尽量保 持同一数据来源。
f
0
Tr
5.92714
6.09648 Tr
1.28862
ln Tr 0.169347 Tr 6
f
1Tr
15.2518
15.6875
Tr
13.4721 ln Tr
0.43577 Tr 6
例题:P53
第5章基团贡献法及其应用

5)对称性修正 用键贡献法和基团贡献法估算理想气体熵SӨ时,通常必 须作分子对称性的修正。
对称数为定义是:分子刚性转动时,分子内相同原子 (或基团)出现独立互换的总次数(不得反转)。为便于 计算,通常把分解为外和内,即: =外. 内 计算分子的对称数一些规律 CP
对称性修正只对估算标准熵SӨ和标准生成只有焓GӨf才需 要修正。对于CӨp和HӨf等则不必要
在划分基团时往往把有共轭效应的基团分开
同系物的第一化合物常被当作一个基团单独列出
总目录
本章目录
上页
下页
5.2.2 分子性质与基团元贡献值的关联 分子性质的值与基团元贡献值之间的关联有下列的一些形式: 就是分子性质值直接由各基团的贡献值以及各 种修正项直接加和而得,即
(1)直i为i基团的数目;ai为i基团的元贡献或 某种修正项。
n a
i i
这种关联法将分子的性质A作为某些参数B, C,….等等的函数,而B,C,….各基团的元贡献加和而得, 即: B nb
(2)函数式法
A f ( B, C , )
i
i i
C
n c
i
i i
其中bi和ci分别代表i基团对B和C的元贡献值。
总目录
本章目录
上页
下页
(3)统计力学模型法 溶液的活度系数。
总目录
本章目录
上页
下页
5.4.2 纯物质的汽化热的估算 1) 基团对应状态法(CSGC)
Li等基于CSGC法,提出从正常沸点汽化热ΔHVb求取ΔHV的方法,即 CSGC-HW1法,其基本关系式与Watson公式类似:
1 Tr* H V H Vb 1 T br
式中, Tr T / Tc
环境热力学第7章基团贡献法.ppt

Tc Tb 0.584 0.965 niTci
ni Tci
2 1
2
pc 0.113 0.0032nA ni pi 0.1
Vc 40 niVci
方法缺点:未考虑邻近基团影响,特别是-F、-Cl基团简单加和。
Constantinous-Gani法(C-G法)估算Tb 和临界性质
基团法介绍
• 乙烷 CH3-CH3
基团 2个 CH3
• 丙烷 CH3-CH2-CH3
基团 CH2
基团 2个 CH3+1个CH2
• 异丙烷 CH3-CH-CH3 CH3
基团 2个CH3+1个CH
基团 CH
基团法特点
一些基团法不依赖于任何其他物性,但有的 基团法关系式中需要其他物性参数。 如:计算临界温度Tc时,需要引入沸点Tb值; 在估算相平衡时,要引入表面积参数和体积 参数等微观参数。
化工数据估算的要求
误差小,同时要注意不同物性项目对误差要求不同; 尽量少用其他物性参数 计算过程或估算方程不要太复杂 估算方法要尽可能具有通用性,特别是关注对极性
化合物使用的可能性。 具有理论基础的方法常常有更好的发展前景。
估算方法
每项物性有各自的多种估算方法; 同一类型的估算方法又用于不同的物性项; 目前,实用的估算方法主要是对应状态法和基团
Tb 204.359 ln niTbi njTbj
Tc 181.728 ln niTci njTcj 2
pc 0.13705 0.1 0.100220 nipci njpcj
Vc 4.350 ln niVci njVcj
40年代起,开始修正临近基团的影响。 基团法从估算固定温度点开始,经过发展,目前基团法已经
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工数据估算的要求
误差小,同时要注意不同物性项目对误差要求不同;
尽量少用其他物性参数 计算过程或估算方程不要太复杂 估算方法要尽可能具有通用性,特别是关注对极性
化合物使用的可能性。
具有理论基础的方法常常有更好的发展前景。
估算方法
每项物性有各自的多种估算方法; 同一类型的估算方法又用于不同的物性项; 目前,实用的估算方法主要是对应状态法和基团
l n ic l n li
i
xi
Z qi l n i l i i 2 i xi
x l
j
j j
Z ri qi ri 1 2 qx i i i qj xj
j
i
ri x i rj x j
j
k qi k Qk k ri k Rk
(2)假定在任何体系中,同一种基团对于 某个物性的贡献值都是相同的。
基团法介绍
• 乙烷 CH3-CH3 基团 2个 CH3
• 丙烷 CH3-CH2-CH3 基团 CH2 基团 2个 CH3+1个CH2 • 异丙烷 CH3-CH-CH3 CH3 基团 2个CH3+1个CH 基团 CH
基团法特点
一些基团法不依赖于任何其他物性,但有的
开始基团法仅用于纯物质的物性估算,目前已用于汽液平衡 估算,并用于多种相平衡估算中,成为唯一的估算相平衡的 方法。
基团法发展情况
随着基团划分细致,计算精度提高,但基团数膨胀造成了 计算的复杂性; 加入结构修正项,计算结果更好,但估算方法更加繁琐, 通用性也差; 温度关联式的提出,使基团法便于计算机使用。 为了使用,应该将基团法的基团划分和结构校正控制在适 度的范围内。否则将失去基团法通用性的优点。
2
0.1
Vc 40 ni Vci
方法缺点:未考虑邻近基团影响,特别是-F、-Cl基团简单加和。
Constantinous-Gani法(C-G法)估算Tb 和临界性质
Tb 204.359 ln
Tc 181.728 ln
n T n T
i bi j bj
Joback法估算Tb和临界性质
是一个简单且比较可靠的方法
Tb 198 ni Tbi
2 Tc Tb 0.584 0.965 n T n T i ci i ci 1
pc 0.113 0.0032nA ni pi
物性数据的估算
本章主要内容
估算的必要性及基本要求 估算的主要方法 基团(贡献)法。出发点、发展和分类 (沸点、临界性质)基础物性的估算 UNIFAC法介绍
化工数据估算的必要性
虽然在文献中或手册中已有许多数据,但化学工业中 化合物品种太多,且要考虑不同温度、压力下,物性值 的变化。 工业中处理的又多是混合物,物性项目中必须考虑浓 度的影响; 实测值远远不能满足需要,有时测定技术上存在难以 克服的困难; 估算求取化工数据成为极重要的方法。
开始基团法仅用于纯物质的物性估算,目前已用于汽液平衡估算,并用 于多种相平衡估算中,成为唯一的估算相平衡的方法。
基团法发展和分类
早期的基团法很简单,基团划分“粗糙”,所划基团很少。 20世纪中叶,用基团法估算标准生产焓及临界性质时,划分 的基团较多较细。 早期的基团法中,不考虑各种基团间的交互作用。从20世纪 40年代起,开始修正临近基团的影响。 基团法从估算固定温度点开始,经过发展,目前基团法已经 提出了温度关联式,用于各种温度下。
配 位 数 Z 取
ln
临界性质时,划分的基团较多较细。大体上已可计 算各类有机物了。 包括:-CH3、-CH2-、 =CH2、-OH(醇)、
-OH(酚)、-CHO、-COOH、-COO,-F、- Cl、-Br、-I
基团法发展和分类
早期的基团法很简单,基团划分“粗糙”,所划基团很少。 20世纪中叶,用基团法估算标准生产焓及临界性质时,划分的基团较多 较细。 20世纪80年代,提出了一些更细致的基团。 早期的基团法中,不考虑各种基团间的交互作用。从20世纪40年代起, 开始修正临近基团的影响。 基团法从估算固定温度点开始,经过发展,目前基团法已经提出了温度 关联式,用于各种温度下。
n T n T
i ci j cj
pc 0.13705 0.1 0.100220 ni pci n j pcj
Vc 4.350 ln
2
n V n V
i ci j cj
典型的考虑邻近基团的影响,二级基团也可以不加, 可能误差大些。另一个优点是求Tc时不要Tb数据。
UNIFAC 法
•UNIFAC法是1975年发表的,是将基团法和UNIQUAC 模型结合起来的,目前广泛用于活度系数的估算。 •基本公式为:
ln i ln iC ln iR
ln iC 为活度系数组合项,主要反映分子大小和形状的差别;
只与纯物质结构和性质有关,与其他分子存在无关。
ln iR 为活度系数剩余相,表示基团之间相互作用的影响。
贡献法;
此外还有参考物质法和物性间的相互估算法。
对应状态法(对比态法)
基团贡献法
基团贡献法
基团法概述
基团法主要用于估算有机物的物性
由于构成常见化合物的基团只有约 100 个,
因此 100 个基团就基本上可估算各类有机化 合物的物性了。
基团法假设
基团法假定有两个基本点: (1)纯物质或混合物的物性等于构成此化 合物或混合物的各种基团对此物性的贡献 值的总和;
基团法关系式中需要其他物性参数。 在估算相平衡时,要引入表面积参数和体积 参数等微观参数。
基团法的优点是具有最大的通用性。
如:计算临界温度Tc时,需要引入点Tb值;
基团法发展和分类
早期的基团法很简单,基团划分“粗糙”,所划基
团很少。也难于计算各类有机物。
20世纪中叶,用基团法估算25℃下的标准生成焓及
