第二十章 氨基酸与蛋白质
生命活动的主要承担者—蛋白质知识点总结

生命活动的主要承担者—蛋白质知识点总结第二节生命活动的主要承担者——蛋白质>一、氨基酸结构及其种类1.氨基酸的组成元素:C、H、O、N,有的含有S等元素。
2.氨基酸的结构通式:结构特点:1)氨基酸分子中,-NH2和-COOH至少各有一个;2)至少一个-NH2和一个-COOH连在同一个碳原子上;3)生物体中氨基酸种类、性质不同是由R基决定的。
即:“一个中心三个基本点”巧记】可把氨基酸想象成一个人,R基是人脸,我们分辨一个人时,主要看人的脸;羧基和氨基代表该人的双手;H代表双腿。
3.氨基酸种类:生物体中含氨基酸约20种必需氨基酸(8)种:人体不能合成,必须从外界环境中获取。
(巧计:“一家来写两三本书”)即:异亮氨酸、甲硫氨酸、赖氨酸、缬氨酸、亮氨酸、色氨酸、苯丙氨酸、苏氨酸非必需氨基酸(12)种:人体能够合成,能够不消从外界环境中获取。
二、蛋白质的结构及其多样性1、※氨基酸形成蛋白质的方式——→脱水缩合(书22页过程)注意:1)脱水缩合:一个氨基酸分子的氨基(—NH2和另一个氨基酸分子的羧基(—COOH)相连接,同时脱去一分子的水的结合方式.2)连接两个氨基酸分子的化学键叫做肽键,其表达式写成以下几种形式都能够:—CO—NH—或—NH—CO—或—C—NH—或—N—C—肽键透露表现式中两端的“—”透露表现不成对的电子,不能漏写。
3)回响反映产品中有“H2O”。
脱去的水分子中的“H”分别来自羧基和氨基,脱去的水分子中的“O”来自羧基。
4)参与脱水缩合的分别是两个氨基酸分子中与中心碳原子相连的氨基和羧基,R基中的-NH 2和-COOH不介入脱水缩合。
5)一条肽链至少含有一个游离的-NH2和一个游离的-COOH,分别位于肽链的两端。
6)二肽:是指由两个氨基酸分子脱水缩合而成的化合物;多肽:由三个或三个以上氨基酸分子脱水缩合而成的化合物,多肽通常呈链状布局,又叫肽链。
2、氨基酸组成卵白质的过程氨基酸→二肽→三肽→多肽链→一条或若干条多肽链盘曲折叠→蛋白质(连接方式:脱水缩合)△一个蛋白质分子由一条或几条多肽链组成多肽链具备一定的空间结构后即为蛋白质,因此蛋白质与多肽的差别在于有无空间结构。
蛋白质结构与功能-----氨基酸

蛋白质结构与功能-----氨基酸蛋白质结构与功能——氨基酸2010遗传学Chapter 1 氨基酸I 蛋白质的天然组成天然蛋白质几乎都是由18种普通的氨基酸组成:L-氨基酸,L-亚氨基酸(脯氨酸)和甘氨酸。
一些稀有的氨基酸在少量的蛋白质中结合了L-硒代胱氨酸。
II 氨基酸的结果每种氨基酸(除了脯氨酸):都有一个羧基,一个氨基,一个特异性的侧链(R基)连接在α碳原子上。
在蛋白质中,这些羧基和氨基几乎全部都结合成肽键。
在一般情况下,除了氢键的构成以外,是不会发生化学反应的。
氨基酸的侧链残基(R基)提供了多种多样的功能基团,这些基团赋予蛋白质分子独特的性质,导致:A.一种独特的折叠构象B.溶解性的差异C.聚集态D.和配基或其他大分子构成复合物的能力,酶活性等等。
蛋白质的功能是与蛋白质氨基酸排列顺序和每个氨基酸残基的特征有关。
那些残基赋予蛋白质独一无二的功能。
氨基酸的分类是依照它的侧链性质的A.非极性侧链的氨基酸B.不带电的极性侧链氨基酸C.酸性侧链的氨基酸D.碱性侧链的氨基酸A.非极性侧链氨基酸非极性氨基酸在蛋白质中的位置:在可溶性蛋白质中,非极性氨基酸链趋向于集中在蛋白质内部。
甘氨酸(Gly G )结构:最简单的氨基酸,在蛋白质氨基酸当中,是唯一缺乏非对称结构的氨基酸。
特征:甘氨酸在蛋白质结构中起到一个很重要的作用,与其它氨基酸残基相比,由于缺少-碳原子,它在蛋白质的构象上有很大的灵活性和更容易达到它的空间结构。
功能和位置:1.甘氨酸经常位于紧密转角;和出现在大分子侧链产生空间位阻影响螺旋的紧密包装处(如胶原)和结合底物的地方。
2.由于缺乏空间位阻侧链,所以甘氨酸在邻近的肽键的位置有更强化学反应活性。
例如:Asn-Gly3.甘氨酸也出现在酶催化蛋白质特异性修饰的识别位点,例如N端的十四酰基化(CH2(CH2)12CO -)和精氨酸甲基化的信号序列。
丙氨酸(Ala A )结构:是20种氨基酸中最没有“个性”的氨基酸,没有长侧链,没有特别的构象性质,可以出现在蛋白质结构的任何部位。
蛋白质合成原料

蛋白质合成原料蛋白质合成是细胞内重要的生化过程之一。
在蛋白质合成中,需要大量的蛋白质合成原料来支持。
这些原料不仅是蛋白质合成的基础,还可以影响蛋白质的合成效率、质量和功能。
因此,充足地提供蛋白质合成原料对于蛋白质生物学研究以及生命科学的发展具有重要的意义。
1.氨基酸:蛋白质的基本单元氨基酸是蛋白质的基本单元,充足的氨基酸是支持蛋白质合成的关键。
常见的氨基酸有20种,其中有9种被称为必需氨基酸,因为它们不能被人体合成,只能通过食物摄入。
这些必需氨基酸包括异亮氨酸、缬氨酸、亮氨酸、苯丙氨酸、色氨酸、赖氨酸、精氨酸、组氨酸、甲硫氨酸。
因此,蛋白质合成需要人体提供足够的必需氨基酸来完成。
2.核糖体:蛋白质合成的场所核糖体是进行蛋白质合成的场所。
它是由多个蛋白质和核糖体RNA(rRNA)组成的复合体,能够将mRNA上的密码子与tRNA上的氨基酸配对,从而通过肽键连接氨基酸合成多肽。
大部分细胞都有多个核糖体,每个核糖体可以同时合成多个蛋白质。
核糖体的组成和数量会影响蛋白质合成的速度和效率,因此细胞需要适量的核糖体支持蛋白质合成。
3.转录因子:调控蛋白质合成转录因子是一类能够结合DNA与RNA的蛋白质,它们在转录过程中起到调控蛋白质合成的作用。
转录因子包括:起始因子、促进因子、抑制因子、复制因子等。
启动因子与谷氨酸富集区域结合,PMAP kinase等因子对Ser位点进行磷酸化,然后启动蛋白合成基因的转录。
抑制子的功能是调节蛋白合成的速度,避免过度合成而导致细胞损害。
因此,细胞需要适量的转录因子来调节蛋白质合成的速度和效率。
4.ATP:能量来源蛋白质合成是一个消耗能量的过程。
在肽键合成时需要ATP提供能量。
细胞内的ATP主要通过细胞呼吸来产生,同时还需要补充一些输入的营养物质,包括糖类、脂类和蛋白质。
此外,ATP还可以通过一些途径被再生使用。
总之,蛋白质合成过程涉及到氨基酸、核糖体、转录因子和ATP等多方面的因素,因此只有充足地提供蛋白质合成原料,才能高效地完成蛋白质合成,支持我们对生物学更深入的认识和精准地进行生物医学研究。
02-氨基酸

氨基酸和蛋白质的一级结构
2.1 氨基酸 2.1.1 氨基酸的种类和结构 2.1.2 非标准氨基酸 2.1.3 氨基酸的旋光性和构型 2.1.4 氨基酸的酸碱性质
2.2 氨基酸分离和分析 2.2.1 氨基酸的电泳分离 2.2.2 离子交换层析
2.3 肽
2.3.1 肽、肽键和肽链 2.3.2 肽的性质 2.3.3 生物活性肽 2.4 蛋白质的分离与鉴定 2.4.1 溶解性质和盐析分离 2.4.2 离子交换柱层析 2.4.3 凝胶过滤层析 2.5 蛋白质的一级结构测定
● 非极性氨基酸
4
● 极性但不带电荷氨基酸
5
● 带电荷氨基酸
天冬氨酸Asp 谷氨酸Glu
赖氨酸Lys 精氨酸Arg 组氨酸His
6
● 氨基酸名称的缩写符号
每个氨基酸都有一个3英文字母缩写组成的符号 与之相对应,有时还用单个字母符号来代表氨基酸。
名称
三字母 单字母
中文名称符号 3字符母号 缩名写称 单个字母
参与氧化还原过程,清除内源性过氧化物和自由基,
维护蛋白质活性中心的巯基处于还原状态。
还原型谷胱甘肽,含有游离SH基,用GSH表示 氧化型谷胱甘肽,含二硫键,用GSSG表示
H2O2 + 2GSH
2H2O + GS—SG
34
H2O2 2H2O
2GSH
GSH过氧 化物酶
GSSG
NADP+
GSH还原酶
NADPH+H+
H R1
H R2
H R3
H R4
H Rn
肽键
多肽链的结构 AA残基
氨基酸残基 多肽链上的每个氨基酸,由于形成肽键而失
去了一分子水,成为不完整的分子形式。
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
氨基酸和蛋白质结构和功能

氨基酸和蛋白质结构和功能一、组成蛋白质的20种氨基酸的分类1、非极性氨基酸包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸2、极性氨基酸极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸酸性氨基酸:天冬氨酸、谷氨酸碱性氨基酸:赖氨酸、精氨酸、组氨酸其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸属于亚氨基酸的是:脯氨酸含硫氨基酸包括:半胱氨酸、蛋氨酸注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组二、氨基酸的理化性质1、两性解离及等电点氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。
在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
2、氨基酸的紫外吸收性质芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。
3、茚三酮反应氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。
由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。
(注意与实验一结合)三、肽两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。
二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。
10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。
多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。
人体内存在许多具有生物活性的肽,重要的有:谷胱甘肽(GSH):是由谷、半胱和甘氨酸组成的三肽。
半胱氨酸的巯基是该化合物的主要功能基团。
GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。
《基础应用化学》课件 第二十章-生物高分子

C6 Hα-2DOH-(-O)-吡喃果C1 H糖2OH
5H
OH 2
H4
3 OH
OH
H
α-D-(-)-呋喃果糖
HH
H
6
H
6
1
COHO2O
H1
OCHH2OH
5 5 OHHOHH2 CHHO 22
OHOHHH4OH4
3CO3OHHH3
COHH2O H 1
C6Hβ2-OαDHC-6D-H(--2HO(O-H)-)4吡-吡CO喃喃果OO果H糖H糖C1 H2OH
第二十章 生物高分子
目录
CONTENTS
1 糖类
2
氨基酸和蛋白质
PART 1
糖类
糖类
一、单糖
1、单糖的结构
(1)单糖的开链式结构
单糖分子中都含有手性碳原子,所以 都有立体异构体。例如五羟基己醛分 子中有四个手性碳原子,其立体异构 体总数应为 24 个,天然葡萄糖是其中 的一个,其构型如右图:
CHO H C OH HO C H H C OH H C OH
CH2OH
CO
HO
H
H
OH
H
OH
CH2OH
+ 托伦试剂(斐林试剂)COOHH NhomakorabeaOH
OH H
H OH
+ Ag↓(Cu2O↓)
H
OH
CH2OH
糖类
一、单糖
(2)氧化反应
2、单糖的性质
在不同条件下,醛糖可被氧化成不同产物,比如用硝酸氧化葡萄糖时,得到葡萄糖 二酸,而用溴水氧化葡萄糖则得到葡萄糖酸。反应式如下:
抗生素中的链霉素含有氨基糖的 组分。
糖类
二、二糖
生物化学实验一蛋白质和氨基酸的呈色反应
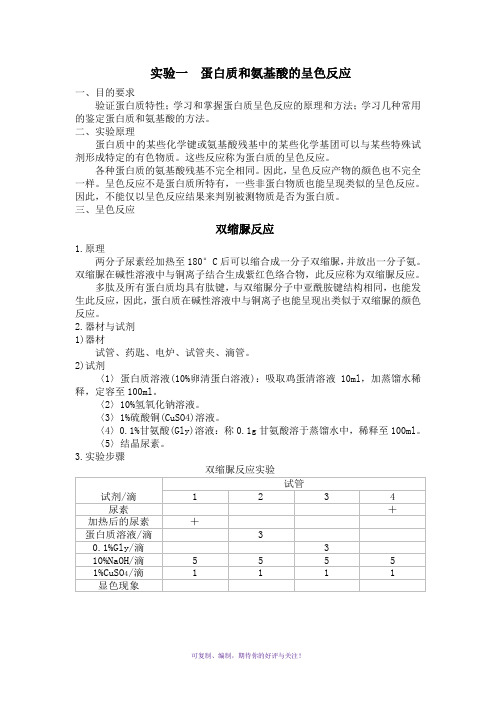
实验一蛋白质和氨基酸的呈色反应一、目的要求验证蛋白质特性;学习和掌握蛋白质呈色反应的原理和方法;学习几种常用的鉴定蛋白质和氨基酸的方法。
二、实验原理蛋白质中的某些化学键或氨基酸残基中的某些化学基团可以与某些特殊试剂形成特定的有色物质。
这些反应称为蛋白质的呈色反应。
各种蛋白质的氨基酸残基不完全相同。
因此,呈色反应产物的颜色也不完全一样。
呈色反应不是蛋白质所特有,一些非蛋白物质也能呈现类似的呈色反应。
因此,不能仅以呈色反应结果来判别被测物质是否为蛋白质。
三、呈色反应双缩脲反应1.原理两分子尿素经加热至180°C后可以缩合成一分子双缩脲,并放出一分子氨。
双缩脲在碱性溶液中与铜离子结合生成紫红色络合物,此反应称为双缩脲反应。
多肽及所有蛋白质均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似于双缩脲的颜色反应。
2.器材与试剂1)器材试管、药匙、电炉、试管夹、滴管。
2)试剂〈1〉蛋白质溶液(10%卵清蛋白溶液):吸取鸡蛋清溶液10ml,加蒸馏水稀释,定容至100ml。
〈2〉10%氢氧化钠溶液。
〈3〉1%硫酸铜(CuSO4)溶液。
〈4〉0.1%甘氨酸(Gly)溶液:称0.1g甘氨酸溶于蒸馏水中,稀释至100ml。
〈5〉结晶尿素。
3.实验步骤双缩脲反应实验(1)制备双缩脲:取结晶尿素少许(约火柴头大小),放入干燥的小试管中。
微火加热至尿素熔解至硬化,刚硬化时立即停止加热,尿素放出氨,此时双缩脲即已形成。
冷却后作为双缩脲样品(1号管)。
(2)另取3支试管,与1号管一起按表加样,混匀,观察各管颜色变化,记录结果并解释现象。
茚三酮反应1.原理蛋白质或氨基酸在弱碱性条件下,其上的氨基与茚三酮共热可产生蓝紫色缩合物。
此反应为一切蛋白质和α-氨基酸所共有,具有亚氨基的脯氨酸和羟脯氨酸与茚三酮反应产生特征性的黄色化合物,含有氨基的其他化合物也能呈此反应。
2.器材与试剂1)器材滤纸、试管、试管夹、药匙、电炉、滴管、吸管、水浴锅。
生化蛋白质降解和氨基酸的分解代谢讲课PPT

生物化学中将具有一个碳原子的基团称为“一碳单位”或“一碳基团”。
的蛋白质,已变成短链的肽和部分游离氨基酸。 转氨基作用可以在氨基酸与酮酸之间普遍进行。
在这一反应中天冬氨酸的氨基已经转移而成为精氨酸的组分。 1、丙氨酸、苏氨酸、丝氨酸、半胱氨酸、甘氨酸、苯丙氨酸、酪氨酸、亮氨酸、赖氨酸及色氨酸共10种氨基酸分解后形成乙酰CoA。 一、形成乙酰辅酶A的途径
天冬氨酸 α-酮戊二酸 草酰乙酸 谷氨酸 催化转氨基反应的酶称为转氨酶、或称氨基移换酶。
G这T种P、代A谢T缺P是陷例变属构于如抑分制子L剂疾—;病。谷氨酸的氨基在酶的催化下转移到丙酮酸上,谷氨酸变 成了α—酮戊二酸,而丙酮酸则变成丙氨酸。 4.亚甲基又称(甲叉基) —CH2—
有些氨基酸在神经系统活动中起着重要作用,它们本身都属于生物活性物质,此外,生物体在生命活动中还需要由氨基酸合成许多其 他生物分子来调节代谢及生命活动。 动物和高等植物的转氨酶一般只催化L—氨基酸和α—酮酸的转氨作用。 亚精胺和精胺的分子中,含有许多氨基,因此又统称多胺。 催化转氨基反应的酶称为转氨酶、或称氨基移换酶。 3.尿素循环有关酶的遗传缺欠症: 创伤性休克或炎症病变部位都有组胺释放。 迄今所发现的转氨酶都是以磷酸吡哆醛作为辅基。 (一)酪氨酸代谢与黑色素的形成:
有些细菌又以氨基酸作为唯一碳源,这类细菌则以氨基 酸的分解为主。
高等植物随着机体的不断增长而不断需要氨基酸,因 此合成过程胜于分解过程。
第二节 氨基酸的脱氨基作用
氨基酸失去氨基的作用称为脱氨基作用,是机体氨基酸分解代 谢的第一个步骤。
脱氨基作用有氧化脱氨基和非氧化脱氨基作用两类。氧化脱氨 基作用普遍存在于动植物中。动物的脱氨基作用主要在肝脏中进行。 非氧化脱氨基作用见于微生物中,但并不普遍。
第2章氨基酸和蛋白质优秀课件

一、氨基酸 ——蛋白质的构件分子
Protein Architecture
(一) 蛋白质水解
蛋白质——多肽——肽——AA
1*104
1000 200 100
-500
➢蛋白质和多肽的肽键可被催化水解
➢酸/碱能将蛋白完全水解
得到各种AA的混合物 ➢酶水解一般是部分水解
得到多肽片段和AA的混合物
CN键长比较:
O -C-N-
H
-C=N-C-N-
0.132nm
0.127nm 0.149nm
肽键性质:
1,刚性,不可旋转 2,反式排列 3,处于同一平面上,与前后-C构成肽单元
二硫键
牛胰岛素的空间结构
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
第二节 肽、蛋白质的高级结构
四、蛋白质的结构
一级结构(primary structure)
二级结构(secondary structure) 三级结构(tertiary structure) 四级结构(quaternary structure)
高级结构 或 空间构象
(conformation)
第一节
肽和蛋白质的一级结构
Primary Structure of Peptides and Proteins
多肽链从氨基末端走向羧基末端。
N末端
C末端
牛核糖核酸酶
肽是根据由N-端至C-端参与其组成的氨基酸残基命名的
O
O
NH2-CH-C
NH-CH-C
H OH + H H OH甘来自酸甘氨酸-HOH
O
O
NH2-CH-C-N-CH-C
蛋白质和氨基酸

蛋白质生物学价值
蛋白质吸收后在体内被利用的程度。它的 高低取决于必需氨基酸的含量和比值。食 物蛋白质的必需氨基酸比值与人体组织蛋 白质中氨基酸的比值越接近该食物蛋白质 生物学价值越高。一般动物性食物比植物 性食物的蛋白质生物学价值要高。
几种常见食物蛋白质的生物价值
蛋白质 生物价 蛋白质 生物价 蛋白质 生物价
3.9
2.4 2.5 2.8 1.7 2.7 2.4
6.3
6.1 6.0 4.9 6.4 5.1 5.8
2.7
2.7 3.5 3.0 2.7 1.8 2.3
4.0
3.5 3.9 3.2 3.5 2.7 3.4
1.0
1.0 1.0 1.0 1.0 1.0 1.0
限制氨基酸(1imiting amino acid):是 指食物蛋白质中一种或几种必需氨基酸相 对含量较低,导致其它的必需氨基酸在体 内不能被充分利用而浪费,造成其蛋白质 营养价值降低,这些含量相对较低的必需 氨基酸,称为限制氨基酸。
常见食物胆固醇含量(mg/100g)
食物名称 猪肉 牛肉 鸭蛋 草鱼 鸡肉 牛奶 奶油 羊肝 鸡肝 鲫鱼
含量 107 194 634 81 117 13 168 323 429 93
食物名称 猪肝 羊肉 鸡蛋 鲤鱼 鸭肉 牛油 猪油 牛肝
鸡蛋黄 带鱼
含量 368 173 680 83 101 89 85 257 1705 97
三、蛋白质在体内的消化、吸 收和代谢
摄入的蛋白质在体内经酶的水解 最终成为各种氨基酸,但实际上人体 的血浆中存在两种氨基酸的来源:即 从体外摄入蛋白质和体内蛋白质分解 后被机体吸收再利用的氨基酸。
食物中蛋白质
分
肠解 道
AA
课堂新坐标高中化学鲁教选修教师用书:第章 第节 第课时 氨基酸和蛋白质 含解析

第3课时氨基酸和蛋白质1.了解氨基酸的结构特点和性质。
(重点)2.理解肽键的形成。
3.了解蛋白质的结构特点和主要性质。
(重点)氨基酸、多肽基础·初探]1.氨基酸(1)定义氨基酸是氨基取代了羧酸分子中烃基上的氢原子所形成的取代羧酸。
(2)分子结构(4)化学性质①两性:氨基酸分子中既含有氨基(显碱性)又含有羧基(显酸性),因此氨基酸是两性化合物。
②缩合:在一定条件下能够缩合成多肽,构成蛋白质。
(1)属于氨基酸。
()(2)甘氨酸与1-硝基乙烷互为同分异构体。
()(3)氨基酸分子中只有一个官能团。
()(4)H2NCH2CH2COOH既能与盐酸反应又能与NaOH溶液反应。
()(5)1 mol—NH2含有10 N A的电子。
()【提示】(1)×(2)√(3)×(4)√(5)×2.多肽(1)定义一个α氨基酸分子的羧基与另一个α氨基酸分子的氨基脱去一分子水所生成的化合物。
(2)官能团酰胺键,又叫肽键,表示为(3)分类①二肽:由两个氨基酸分子脱水缩合形成。
②多肽:由三个或三个以上氨基酸分子脱水缩合形成。
如二分子甘氨酸生成的二肽表示为H2N—CH2—COOH+H2N—CH2—COOH―→H2N—CH2—CO—NH—CH2—COOH+H2O。
核心·突破]氨基酸的缩合规律1.两分子间缩合一个氨基酸分子中的氨基和另一个氨基酸分子中的羧基,发生分子间脱水反应生成肽键。
A、B两种不同的氨基酸生成二肽时,可能是A的氨基脱去氢、B的羧基脱去羟基形成肽键;也可能是A的羧基脱去羟基而B的氨基脱去氢形成肽键;还有可能是两个A分子之间或两个B分子之间形成肽键。
2.分子间或分子内缩合成环3.缩聚生成多肽或蛋白质题组·冲关]1.氨基酸不能发生的反应是()A.酯化反应B.与碱的中和反应C.成肽反应D.水解反应【答案】 D2.如图所示是某有机物分子的简易球棍模型,该有机物中含C、H、O、N四种元素。
高中生物中有关氨基酸蛋白质的相关计算

高中生物中有关氨基酸、蛋白质的相关计算1.一个氨基酸中的各原子的数目计算:C原子数=R基团中的C原子数+2,H原子数=R基团中的H原子数+4,O原子数=R基团中的O原子数+2,N原子数=R基团中的N原子数+12.肽链中氨基酸数目、肽键数目和肽链数目之间的关系:若有n个氨基酸分子缩合成m条肽链,则可形成(n-m)个肽键,脱去(n-m)个水分子,至少有-NH和-COOH各m个。
游离氨基或羧基数=肽链条数+R2基中含有的氨基或羧基数。
例.(2005·上海生物·30)某22肽被水解成1个4肽,2个3肽,2个6肽,则这些短肽的氨基总数的最小值及肽键总数依次是(C)A、6 18B、5 18C、5 17D、6 17解析:每条短肽至少有一个氨基(不包括R基上的氨基),共有5个短肽,所以这些短肽氨基总数的最小值是5个;肽链的肽键数为n-1,所以肽键数为(4-1)+2×(3-1)+2×(6-1)=17。
例.(2003上海)人体免疫球蛋白中,IgG由4条肽链构成,共有764个氨基酸,则该蛋白质分子中至少含有游离的氨基和羧基数分别是( D ) A.746和764 B.760和760 C.762和762 D.4和43.氨基酸的平均分子量与蛋白质的分子量之间的关系:n个氨基酸形成m条肽链,每个氨基酸的平均分子量为a,那么由此形成的蛋白质的分子量为:na-(n-m)18 (其中n-m为失去的水分子数,18为水的分子量);该蛋白质的分子量比组成其氨基酸的分子量之和减少了(n-m)·18。
(有时也要考虑因其他化学建的形成而导致相对分子质量的减少,如形成二硫键。
例.(2003上海)某蛋白质由n条肽链组成,氨基酸的平均分子量为a,控制该蛋白质合成的基因含b个碱基对,则该蛋白质的分子量约为( D ) A. B.C. D.4.在R基上无N元素存在的情况下,N原子的数目与氨基酸的数目相等。
有机化学 第二十一章 氨基酸、蛋白质和核酸

氨基酸等电点可由相应氨基酸盐酸盐的pKa值求 出。如丙氨酸盐酸盐,可看作一个二元酸,具有两
个平衡常数K1和K2
用碱调节丙氨酸盐酸盐水溶液pH值,当加入 0.5mol碱时,平衡中氨基酸正离子4的浓度与偶极 离子5的相同,[4] =[5]此时溶液pH值等于pK1,实 际上此溶液中只有50%的偶极离子5。当加入1.5mol 碱时,溶液中氨基酸偶极离子5的浓度等于负离子6, [5]=[6]此时溶液的pH值等于pK2 ,溶液中也含50% 偶极离子5。所以使丙氨酸完全以偶极离子5存在时, pH值应为pK1和pK2的平均值,这个pH值即为丙氨酸 的等电点(pI),pI=(pK1 + pK2)/2。根据表21-2数据, 丙氨酸盐酸盐的pK1为2. 3、pK2为9. 7,可求出丙 氨酸等电点为6. 0:
三、氨基酸的来源与合成 氨基酸不仅是组成蛋白质的结构单元,而且它
们本身也是人体生长的重要营养物质,具有特殊的 生理作用,因此氨基酸的生产和应用早就得到人们 的重视。
生产氨基酸主要有以下四条途径: 1.蛋白质的水解
由蛋白质水解制备氨基酸是从1820年开始的, 这是一个最古老的方法。味精早期就是由小麦蛋白 质—面筋水解得到。胱氨酸、半咣氨酸是由头发水 解制得的。
天然氨基酸,除甘氨酸外, α碳原子都有手 性,且都是L构型。氨基酸的构型是与乳酸相比而 确定的(也就是从甘油醛导出来的)。例如,与L -乳酸相应的L -丙氨酸的构型是:
正像糖类化合物一样,氨基酸的构型习惯于用 D,L标记法。如果用R/S法标记,那么天然氨基酸大 多属于S构型。但也有R构型的,如L-半胱氨酸为R构 型。
胺与羧酸反应很容易形成铵盐,当氨基和羧基存在 于同一分子时,可在分子内发生质子迁移而形成内盐 (zwitterion):
高中化学 第4节 羧酸、氨基酸和蛋白质课件 鲁科版选修5

按烃基的不同脂芳肪香酸酸::如如CC6HH3C5CHO2OCOHO苯H甲丙酸酸 按羧基的数目一二元元羧羧酸酸::CHHO2O==C=—CCHO—OCHOO乙H二丙酸烯 酸
栏 目 链 接
低级脂肪酸:CH3COOH乙酸 按碳原子数目高级脂肪酸CC1177HH3353CCOOOOHH硬油脂酸酸
第七页,共75页。
第二十页,共75页。
(4)氨基酸的等电点是氨基酸水溶液中阴、阳离子浓度 相等时的pH;达到等电点时,氨基酸在水中的溶解度最小。
(5)可发生缩合(suōhé)反应。
栏
目
2.多肽。
链 接
(1)酰胺键的结构式为
,可简写为___________。
它又称为________,它是由一个 α氨基酸分子的________
栏 目
羟基上的氢原子________以离子形式电离出来,所以羧酸有酸 更易
链 接
性。与醛、酮的羰基相比,羧基中的羰基较________发生加成
反应。羧酸________通过催化加氢的方法被还原,用强还原剂 如氢化难铝锂(LiAlH4)时才可以将羧酸很还难原为相应的醇。与羧基
相连的αH较活泼,易被取代。
栏
目
5.认识人工合成多肽、蛋白质和核酸的意义,体会
链
接
化学科学在生命科学发展中的重要意义。
第四页,共75页。
栏 目 链 接
第五页,共75页。
一、羧酸(suō suān)
1.羧酸概述。
(1)定义。
叫做(ji分ào子zu由ò)_羧__酸烃__,基__官_(能或团氢是原—子C)和OO__H_。___羧__相基连(su而ō组jī)成的有机化合物
栏 目 链 接
(2)羧酸的分类。
食品营养与安全 第二讲蛋白质和氨基酸

食品工业中常常需要测定食品的 蛋白質含量,由於直接測量蛋白 質技术上比较复杂,所以常用一 种叫做凯氏定氮法,通过测定氮 原子的含量來间接推算食品中蛋 白質的含量。由于三聚氰胺(含 氮量66%)与蛋白質(平均含氮量 16%)相比含有更高比例的氮原 子,所以被一些造假者利用,添 加在食品中以造成食品蛋白质含
N
1.4
11
P
0.22 3.3
S
0.05 1.0
Na+
0.03 0.7
K+
0.06 1.3
Mg+2 0.01 0.3
Ca+2
0.31 5.0
Cl?
0.08 0.7
Fe
4500
10--18
F
2600
0.1 — 4
Zn
2000
3—15
Si
24
1g
Se
பைடு நூலகம்
13
10—200ug
Mn
12
0.5 — 5
I
11
40—150ug
Mo
9
0.1 5 — 0.5
Cr
6
10—20ug
Co
1.1
140—580ug
Ni
Sn
V
Sr
B
Al
构成生命的化合物
不同的生物体,其分子组成也大体相同
生物体都是由蛋白质、核 酸、脂类、糖、无机盐和 水组成。
哪一种分子含量最高?
蛋白质、核酸、脂类和多糖 是组成生物体最重要的生物 大分子,水是生物体内所占 比例最大的化学成分。
制(催化)下的老 细胞计划性凋亡 和新细胞 的再生(细胞新陈代谢)、活细胞物质的代 谢。
? 老?-蛋白质功能的普遍衰退。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2-CH-COO N N H NH3
+
-
组氨酸
四 名称和物理性质 名 称
氨基酸的碳原子(除甘氨酸外)都是手性碳原子。
其构型的表示方法与糖一样,用D或L表示。 每个氨基酸都有俗名,并都用一个缩写符号表示。
物 理 性 质
大部分的氨基酸在水中有一定的溶解度; 酸性的氨基酸在水中的溶解度较差;
氨基酸在200度以下都是稳定的;
S
S
牛催产素
性质:多肽和氨基酸一样,是两性离子。它们的性 质同氨基酸有许多相似之处。例:多肽也有等电点。 在等电点时溶解度最小。氨基酸和多肽都可以用离
子变换层析法进行分离。
第五节 多肽结构的测定
确定多肽的结构是一项非常复杂而细致的工作。英国化学 家桑格(F. Sanger)花了十年的时间,在1955年首次测定出 牛胰岛素的氨基酸顺序,于1958年获得诺贝尔化学奖。桑格 的工作为多肽结构的测定奠定了基础。近三十年来,随分离 分析技术的发展,有不少多肽(蛋白质)的结构相继被确定。
NH2-NH2 100oC 5-10h
Gly-Ala-Phe
O O O H2NCH2CNHNH 2 + H 2NCHCNHNH2 + H2NCHCOH CH2C6H5 CH3
形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰
氨键叫肽键。二分子氨基酸失水形成的肽叫二肽,多个分 子氨基酸失水形成的肽叫多肽。 多肽:指2-50个独立α–氨基酸单位的分子用肽键连接而生 成的化合物。分子量超过一万的多肽实际上就是蛋白质。 多肽和蛋白质没有明显的界限。
二 命名
命名:开链状的肽总有两个末端,一般游离–NH2写在左边, 称N–端,游离–COOH写在右边,称C–端。
H2/Pt 醋酸
COOEt H-C-NHCOCH 3 COOEt
+ NC-CH=CH2
麦克尔加成 碱
H2/催化剂
H3+O
加热 -CO2
H2NCH2CH2CH2CHCOOH NH2
丝氨酸的合成
COOEt H-C-NHCOCH 3 COOEt COOEt HOCH2-C-NHCOCH3 COOEt
+ CH2=O
OH -
H3
+O
-CO2
HOCH2CHCOONH3
+
丝氨酸 (65%)
2. 通过溴代丙二酸酯法合成
O NK
CH2(COOEt)2
O
Br2 CCl4
BrCH(COOEt)2
O
O
N-CH(COOEt)2 O
ClCH2CH2SCH3 Na
烷基化
COO NH-C-CH2CH2SCH3 O COO
COOEt N-C-CH2CH2SCH3 COOEt O
谷氨酸
- H2O
NH2 COO焦谷氨酸
+
α– 氨基酸的物理性质说明它具有内盐的结构,即为两性离子:
O R CHC OH NH 2 O R CHC O NH 3
α– 氨基酸为两性化合物,与强酸或强碱作用成盐:
O R CHC O NH 3 + HCl O R CHC OH Cl NH 3
O R CHC O NH 3
四 盖布瑞尔法
O NK O + RCHCOOCH3 Br O N O CHCOOCH3 R
H3O+
COOH COOH
+ + NH3CHCOO + CH3OH
R
应用盖布瑞尔法可以制备很纯的氨基酸。
五 丙二酸酯法
1. 通过酰基丙二酸酯法
COOEt CH2 COOEt COOEt H-C-NHCOCH 3 COOEt COOEt NCCH2CH2-C-NHCOCH3 COOEt + O=N-OH COOEt C=N-OH COOEt
+
NaOH
O R CHC O NH 2
Na +
氨基酸的特殊性质
一 等电点
一个氨基酸总可以找到一个pH值,在该pH值下,正、 负离子的浓度完全相等,此时向阳极移动和向阴极移动的离 子彼此抵消(即没有净的迁移),或者说,电场中不显示离 子的迁移。将此时的pH值称为该氨基酸的等电点。
R-CH-COO NH2
NH 2
成盐 与亚硝酸反应 与甲醛反应 酰化 烃基化
O R CHC OH NH 2
HNO 2
O R CHC OH OH
NO 2 O2N F + H2NCHCOOH R O2N
NO 2 NHCHCOOH R
黄色 可用来鉴别氨基酸。
第三节 氨基酸的合成
一 α – 卤代酸的氨解
二 斯瑞克合成法--醛的氨氰化法
氨基酸的pKa为2左右; 每一个光学纯的氨基酸都有旋光值。
五 八个必需氨基酸
(CH3)2CHCH(NH2)COOH
缬氨酸
(CH3)2CHCH2CH(NH2)COOH
亮氨酸
C2H5CHCH(NH2)COOH CH3
异亮氨酸
CH3CHCH(NH2)COOH OH
苏氨酸
C6H5CH2CH(NH2)COOH
确定多肽结构
氨基酸种类 氨基酸数目
氨基酸在肽链中的排列顺序
测定肽或蛋白质的一级结构需要进行下面几项工作:
一 测定分子中是否存在二硫键 二 检测氨基酸的组成及其相对比例
三 测定肽或蛋白质中各氨基酸的排列顺序
一 测定分子中是否存在二硫键
多肽或蛋白质分子中有二硫键,需要切断。 其方法是用过酸氧化。
二 三
三 结构
1. 肽键和肽的几何形状
H N H C O C R H N H C R C O H N H C O C R
2. 二硫键
CH2SH CHNH3 COO+
空气氧化
Na +液NH3
CH2S CHNH 3 COO+
SCH2
CHNH 3 COO-
+
Cys-Tyr-Ile-Glu-Arg-Cys-Pro-Leu-Gly •NH2
脯氨酸的合成
O
NaOEt
N-CH(COOEt)2 O O COOEt N-C-CH2CH2CH2Br COOEt O
Br(CH2)3Br
NaOH
EtOH
Br H 2N
COOCOO-
分子内亲核取代
N H
COOCOO-
H3+O
COON H2
+
H
脯氨酸 70%
第四节 多肽的定义、命名和结构
一 定义
一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,
H O N O
互变异构
O
紫色
三 氨基酸金属盐络合物的形成
O=C-O Cu CH2NH2 O-C=O NH2CH2
金属上有空轨道,N上有未共用电子对! 氨基酸金属盐络合物具有很好的结晶形状, 该 反应可用来沉淀和鉴别某些氨基酸。
四、 α– 氨基酸的反应
成盐 成酰氯 成酯 成酰胺 还原
成叠氮化合物
COOH
O O O H2N-CH2-COH + H2N-CH-COH + H2N-CH-COH CH3 CH2CH(CH3)2
-2H2O
甘氨酸
丙氨酸
亮氨酸
肽键
O O O N端 H2N-CH2-C- NH-CH-C-NH-CH-COH C-端 CH3 CH2CH(CH3)2
产物三肽的名称为:甘氨酰-丙氨酰-亮氨酸 (甘-丙-亮)(Gly-Ala-Leu)
H+ HO
-
R-CH-COO NH3
+
-
H+ HO
-
R-CH-COOH NH3
+
R-CH-COOH NH2
等电点时,以两性离子形式存在的氨基酸浓度最大 (在水溶液中),氨基酸的溶解度最小。
不同的氨基酸有不同的等电点,所以可以通过测定氨基 酸的等电点来鉴别氨基酸。
中性氨基酸的等电点:pH=6.2~6.8
第二十章
蛋白质和氨基酸
本章提纲
第一节 第二节 第三节 第四节 第五节 第六节 第七节 第八节 第九节 氨基酸的结构、名称及物理性质 氨基酸的性质 氨基酸的合成 多肽的定义、命名和结构 多肽的合成 多肽结构的测定 蛋白质的结构和特性 酶 核酸
第一节 氨基酸的结构、命名及物理性质
氨基酸: 羧酸分子中烃基上的氢被氨基取代生成的化合物。
测定相对分子质量 检测氨基酸的组成及其相对比例
该工作由氨基酸自动分析仪完成
四 测定肽或蛋白质中各氨基酸的排列顺序 1. N-端氨基酸单元的分析
在N-端引入具有特定基团的标记化合物,这种标记基
团有颜色、荧光、紫外吸收等性质,然后分离鉴定具有这
种基团的氨基酸衍生物。
二硝基氟苯法(桑格尔法)
O O O H2NCH2CNHCHCNHCHCOH pH=8-9 室温 CH3 CH2C6H5
O N H COOH
谷半胱甘肽 蛋白质:由多种α–氨基酸用肽键连接起来的、分子量很大 的多肽。
蛋白质、碳水化合物、脂肪(甘油醇的脂肪酸酯) 是人所需营养中的三种要素。
一 定义
羧酸分子中烃基上的一个或几个氢原子被氨基取代
生成的化合物叫氨基酸。
CH2-CH-COO N N H NH3
+
-
R-CH-COOH NH2
酸性氨基酸的等电点:pH=2.8~3.2
碱性氨基酸的等电点:pH=7.6~10.8
二 与茚三酮的反应
O O O O酮
凡是有游离氨基的氨基酸都可以和茚三酮发生呈紫色的反应。
R-CH-COOH NH2
O
O OH OH
