高一化学必修化学方程式总汇
必修一化学方程式归纳

一、钠及其化合物2.钠与水反应:_2Na + 2H2O = 2NaOH + H2↑_离子方程式:2Na + 2H2O = 2Na++2OH - + H↑25.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 +O2↑6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na ++4OH-+O↑2二、铝及其化合物2.铝与氧化铁反应(铝热反应):2Al + Fe2O3高温 2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3+ 3H2↑离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑7.氢氧化铝和盐酸:Al(OH)3+3HCl =AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3HO28.氢氧化铝和NaOH溶液:Al(OH)3+NaOH = NaAlO2+2H2O离子方程式:Al(OH)3 +OH-= AlO2-+2H2O13.电解氧化铝 2AlO34Al+23O2↑三、铁及其化合物铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu 离子方程式:Fe+Cu2+=Fe2++Cu_11.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2 _离子方程式:2Fe3+ + Fe = 3Fe2+_12.FeCl2和Cl2反应:_2FeCl2 + Cl2 = 2FeCl3_离子方程式:_2Fe2+ + Cl2 = 2Fe3++2Cl-13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+14.氯化铁与硫氰化钾溶液反应:_ Fe3++3SCN- = Fe(SCN)3 ___四、硅及其化合物9.往硅酸钠溶液中通入二氧化碳:_Na2SiO3 +CO2+H2O == H2SiO3↓+ Na2CO3_10.二氧化硅与纯碱反应:SiO2+Na2CO3高温Na2SiO3+CO2↑_五、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl -+ClO-+HO2710.氯气通入溴化钾溶液:Cl2+ 2KBr = Br2 + 2KCl离子方程式:Cl2+ 2Br- = Br2+ 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl 离子方程式:_ Cl2+ 2I- = I2+ 2Cl -溴水和碘化钾溶液反应:Br2+2KI = I2+2KBr 离子方程式:Br2 +2I- = I2+2Br-七、氮及其化合物2.工业合成氨:_ N2 + 3H2催化剂高温高压2NH3_3.一氧化氮与氧气反应:2NO + O2= 2NO2 _4.NO2溶于水:_3NO2+ H2O = 2HNO3+ NO _5.氨气溶于水: NH3 + H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O NH4+ + OH-11.硝酸铵和NaOH:NH4NO3 + NaOH NaNO3 + NH3↑+H2O _离子方程式:NH4++ OH-NH3↑+H2O12.实验室制氨气:_2NH4Cl +Ca(OH)2CaCl2 + 2NH3↑ + 2H2O13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O。
高中化学必修一二化学方程式汇总

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
高中化学必修一方程式大全

高中化学必修一方程式大全在高中化学的学习中,方程式是必不可少的。
方程式是描述化学反应的重要工具,它可以让我们更加直观地了解化学反应的过程和原理。
下面是高中化学必修一中的方程式大全,供大家参考。
1. 氧化铁的生成反应:4Fe + 3O2 → 2Fe2O32. 碳酸钙分解反应:CaCO3 → CaO + CO23. 氢氧化钠与盐酸中和反应:NaOH + HCl → NaCl + H2O4. 硝酸与铜的反应:3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O5. 氢氧化铜的生成反应:Cu + 2KOH + H2O → Cu(OH)2 + 2KOH6. 氢氧化铁的生成反应:Fe + 2KOH + H2O → Fe(OH)2 + 2KOH7. 氢氧化铝的生成反应:Al + 3KOH + 3H2O → Al(OH)3 + 3KOH8. 氢化铝反应:Al + 3HCl → AlCl3 + 3H29. 氯化铜的生成反应:Cu + 2HCl → CuCl2 + H210. 硝酸银与氯化钠反应:AgNO3 + NaCl → AgCl + NaNO311. 氯气与钠的反应:2Na + Cl2 → 2NaCl12. 硫酸铜的生成反应:Cu + H2SO4 → CuSO4 + H213. 羟基化钠的反应:2Na + 2H2O → 2NaOH + H214. 氧化钠的生成反应:4Na + O2 → 2Na2O15. 氧化铜的生成反应:2Cu + O2 → 2CuO以上是高中化学必修一中的方程式大全,希望对大家的学习有所帮助。
同时也提醒大家,在学习化学方程式时要注意掌握反应物和生成物的比例关系,以及反应条件和反应类型等重要知识点。
高一必修一化学方程式大全
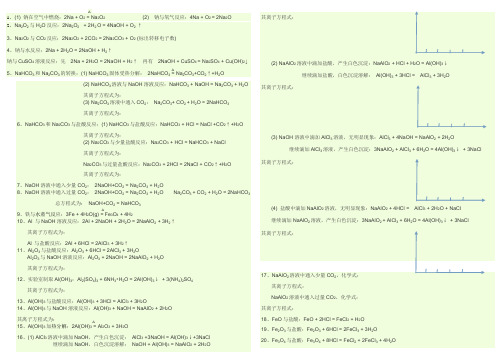
1、(1) 钠在空气中燃烧:2Na + O 2 = Na 2O 2 (2) 钠与氧气反应:4Na + O2 = 2Na 2O 2、Na 2O 2与H 2O 反应:2Na 2O 2 + 2H 2 O = 4NaOH + O 2 ↑3、Na 2O 2与CO 2反应:2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2 (标出转移电子数)4、钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑钠与CuSO 4溶液反应:先 2Na + 2H 2O = 2NaOH + H 2↑ 再有 2NaOH + CuSO 4 = Na 2SO 4 + Cu(OH)2↓ 5、NaHCO 3和Na 2CO 3的转换:(1) NaHCO 3固体受热分解: 2NaHCO 3 = Na 2CO 3+CO 2↑+H 2O(2) NaHCO 3溶液与NaOH 溶液反应:NaHCO 3 + NaOH = Na 2CO 3 + H 2O 其离子方程式为:(3) Na 2CO 3溶液中通入CO 2: Na 2CO 3+ CO 2 + H 2O = 2NaHCO 3 其离子方程式为:6、NaHCO 3和Na 2CO 3与盐酸反应:(1) NaHCO 3与盐酸反应:NaHCO 3 + HCl = NaCl +CO 2↑+H 2O 其离子方程式为:(2) Na 2CO 3与少量盐酸反应:Na 2CO 3 + HCl = NaHCO 3 + NaCl 其离子方程式为:Na 2CO 3与过量盐酸反应:Na 2CO 3 + 2HCl = 2NaCl + CO 2↑+H 2O 其离子方程式为:7、NaOH 溶液中通入少量CO 2: 2NaOH+CO 2 = Na 2CO 3 + H 2O8、NaOH 溶液中通入过量CO 2: 2NaOH+CO 2 = Na 2CO 3 + H 2O Na 2CO 3 + CO 2 + H 2O = 2NaHCO 3 总方程式为: NaOH+CO 2 = NaHCO 39、铁与水蒸气反应:3Fe + 4H 2O(g) = Fe 3O 4 + 4H 210、Al 与NaOH 溶液反应:2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑其离子方程式为:Al 与盐酸反应:2Al + 6HCl = 2AlCl 3 + 3H 2↑11、Al 2O 3与盐酸反应:Al 2O 3 + 6HCl = 2AlCl 3 + 3H 2OAl 2O 3与NaOH 溶液反应:Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O其离子方程式为:12、实验室制取Al(OH)3:Al 2(SO 4)3 + 6NH 3•H 2O = 2Al(OH)3↓ + 3(NH 4)2SO 4 其离子方程式为:13、Al(OH)3与盐酸反应:Al(OH)3 + 3HCl = AlCl 3 + 3H 2O14、Al(OH)3与NaOH 溶液反应:Al(OH)3 + NaOH = NaAlO 2 + 2H 2O 其离子方程式为: 15、Al(OH)3加热分解:2Al(OH)3 = Al 2O 3 + 3H 2O16、(1) AlCl 3溶液中滴加NaOH ,产生白色沉淀: AlCl 3 +3NaOH = Al(OH)3↓+3NaCl 继续滴加NaOH ,白色沉淀溶解: NaOH + Al(OH)3 = NaAlO 2 + 2H 2O△△△△21、FeSO 4与NaOH 溶液:FeSO 4 + 2NaOH = Fe(OH)2↓+ Na 2SO 4 22、FeCl 3 与NaOH 溶液:FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl 23、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H 2O + O 2 = 4Fe(OH)3 现象叙述: 24、Fe(OH)3加热分解:2Fe(OH)3 = Fe 2O 3 + 3H 2O 25、Fe 与盐酸:Fe + 2HCl = FeCl 2 + H 2↑26、Fe 与CuSO 4溶液:Fe + CuSO 4 = FeSO 4 + Cu 27、Fe 在Cl 2中点燃:2Fe + 3Cl 2 = 2FeCl 3 FeCl 2溶液中通入氯气:2FeCl 2 + Cl 2 = 2FeCl 328、FeCl 3 溶液与铁粉反应:2FeCl 3 + Fe = 3FeCl 229、硅单质与氢氟酸反应:Si + 2NaOH +H 2O = Na 2SiO 3 + 2H 2↑粗硅提纯: SiO 2 + 2C = Si + 2CO ↑ Si + 2Cl 2 = SiCl 4 SiCl4 + 2H 2 = Si + 4HCl 30、SiO 2与氢氟酸反应:SiO 2 + 4HF = SiF 4↑ + 2H 2O31、SiO 2与CaO 高温反应:SiO 2 + CaO = CaSiO 332、SiO 2与NaOH 溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O33、SiO 2 + Na 2CO 3 = Na 2SiO 3 + CO 2↑34、H 2SiO 3 = SiO 2 + 2H 2O35、Na 2SiO 3溶液中通入二氧化碳:Na 2SiO 3 + CO 2 + H 2O = Na 2CO 3 + H 2SiO 3↓ 36、Na 2SiO 3与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓37、Fe 在Cl 2中点燃:2Fe + 3Cl 2 = 2FeCl 3 现象:38、Cu 在Cl 2中点燃:Cu + Cl 2 = CuCl 2 现象:39、Na 在Cl 2中点燃:2Na + Cl 2 = 2NaCl 现象:40、H 2在Cl 2中点燃:Cl 2 + H 2 = 2HCl 现象:41、Cl 2与H 2O 反应:Cl2 + H 2O = HCl + HClO (歧化反应) Cl 2:既是氧化剂又是还原剂42、HClO 光照分解:2HClO = 2HCl + O 2↑43、实验室制Cl 2(标出电子转移):MnO 2 + 4HCl(浓) = Cl 2↑+MnCl 2 + 2H 2O 其离子方程式:44、Cl 2与NaOH 溶液反应:Cl 2+ 2NaOH = NaCl + NaClO + H 2O其离子方程式:45、Cl 2与Ca(OH)2溶液反应:2Cl 2+ 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O 其离子方程式:46、漂白粉长期置露在空气中:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO 2HClO = 2HCl + O 2↑△点燃高温△高温点燃点燃点燃光照△点燃高温高温点燃光照。
高一化学必修一化学方程式大全

1、钠在空气中燃烧(黄色(de)火焰)2Na + O2==点燃Na2O2钠块在空气中变暗4Na+O2=2Na2ONa2O在空气中加热(变黄)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2H2O + H2 ↑2Na + 2H2O = 2Na+ + 2OH- + H2↑3、过氧化钠与水(de)反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2 + 2H2O = 4NaOH + O2 ↑2Na2O2 + 2H2O = 4Na+ +4OH -+O2↑碱性氧化物Na2O与水(de)反应Na2O+H2O=2NaOH4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O25、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑CO32- + 2H+= H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3 + HCl =NaHCO3 + NaClCO32- + H+ = HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+ = H2O +CO2↑6、小苏打受热分解2NaHCO3==加热Na2CO3 + H2O +CO2 ↑7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO3 + NaOH==加热Na2CO3 + H2OHCO3-+ OH - = H2O + CO32-(若是溶液中反应有离子方程式)8、金属锂在空气中燃烧4Li + O2==加热2Li2O9、氯气(de)性质铜丝在氯气中剧烈燃烧(棕色烟)Cu + Cl2==点燃CuCl2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)Cl2 +2FeCl2 =2FeCl32Cl2+2NaBr=2NaCl+Br2Cl2 +2NaI =2NaCl+I2Cl2+SO2 +2H2O=H2SO4 +2HCl2Na + Cl2 ==点燃2NaCl10、铁在氯气中剧烈燃烧2Fe +3Cl2==点燃3FeCl311、氢气在氯气中燃烧(苍白色火焰)H2 + Cl2==点燃2HCl氟气与氢气反应(黑暗处即可爆炸)H2+F2=2HF12、氯气溶于水(新制氯水中含H+、Cl-、ClO-、OH-、Cl2、HClO、H2O) Cl2 + H2O = HCl + HClOCl2 + H2O = H++ Cl- + HClO13、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)2HClO==光照2HCl + O2↑14、工业制漂白粉(de)原理及漂白粉(de)失效2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 +2H2O2Ca(OH)2 +2Cl2 =2Ca2++2ClO-+2Cl-+2H2OCa(ClO)2+CO2+H2O=CaCO3↓+2HClO2HClO==光照 2HCl + O2↑Ca2-+2ClO-+ CO2 + H2O =CaCO3↓+ 2HClO15、氯气(de)实验室制法:(仪器:分液漏斗,圆底烧瓶)MnO2 +4HCl(浓)==加热 MnCl2+Cl2↑+2H2OMnO2 +4H++2Cl-==加热Mn2++Cl2↑+2H2O16、新制氯水注入盛溴化钠溶液(de)试管中Cl2 + 2NaBr = Br2 + 2NaClCl2 + 2Br- = Br2 + 2Cl-17.铁与硫加热反应 Fe + S==加热FeS铁与氧气加热反应 3Fe+2O2==加热Fe3O4铁在氯气中加热反应 2Fe+3Cl2==加热2FeCl3 18、铜与浓硫酸反应:Cu+2H2SO4 (浓) ==加热CuSO4 +2H2O+SO2 ↑19、碳与浓硫酸反应:C+2H2SO4(浓)==加热2H2O+CO2↑+2SO2↑20、工业制单质硅(碳在高温下还原二氧化硅)SiO2 + 2C=(高温)Si + 2CO↑21、二氧化硅与氢氧化钠反应SiO2 + 2NaOH = Na2SiO3 + H2OSiO2 + 2OH+ = SiO32- + H2O22、氮气和氢气反应(工业合成氨)N2 + 3H2→催化剂 2NH32NH3→高温高压N2 + 3H223、氮气和氧气放电下反应(雷雨发庄稼)N2 + O2=(放电)2NO2NO + O2=2NO2二氧化氮溶于水3NO2 + H2O =2HNO3 + NO3NO2 + H2O =2H++ 2NO3-+NO24、HNO3与Fe(de)反应Al、Fe遇浓HNO3、浓硫酸钝化(常温)Fe与浓HNO3加热Fe+6HNO3==加热 Fe(NO3)3+3NO2↑+3H2OFe与稀HNO3反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O25、NO2 、O2 (de)混合气通入水中无剩余气体4NO2 + O2 + 2H2O = 4 HNO326、NO 、O2 (de)混合气通入水中无剩余气体4NO + 3O2 + 2H2O = 4 HNO327. 氨(de)催化氧化4NH3 +5O2 ==催化剂、加热4NO + 6H2O28. 碳酸氢铵受热分解NH4HCO3==加热 NH3 ↑+ H2O↑+ CO2↑29. 用浓盐酸检验氨气(白烟生成)HCl + NH3 = NH4Cl30. 硫酸铵溶液与氢氧化钠溶液混合加(NH4)2SO4 +2NaOH==加热2NH3↑+Na2SO2 +2H2O NH4++ OH-==加热NH3 ↑+ H2O31. 硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3 + NaOH = NH3·H2O + NaNO3NH4++ OH-= NH3·H2O32. 铝箔在氧气中剧烈燃烧4Al + 3O2 ==2Al2O333. 铝片与稀盐酸反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+= 2Al3++3H2↑34. 铝与氢氧化钠溶液反应2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑2Al + 2OH-+2H2O = 2AlO2-+ 3H2↑35. 铝与三氧化二铁高温下反应(铝热反应)2Al + Fe2O3==高温 2Fe + Al2O336. 镁在二氧化碳中燃烧2Mg + CO2 ==点燃2MgO + C37. 氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH = 2NaAlO2 +H2OAl2O3 + 2OH-= 2AlO2-+ H2O38. 硫酸铝溶液中滴过量氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4 Al3++ 3 NH3·H2O = Al(OH)3↓+ 3NH4+39. ①氢氧化铝溶液中加盐酸Al(OH)3 + 3HCl = AlCl3 + 3H2OAl(OH)3 + 3H+= Al3++ 3H2O②Al(OH)3与NaOH溶液反应Al(OH)3 + NaOH = NaAlO2 +2 H2OAl(OH)3 + OH-= AlO2-+2 H2O40. 高温下铁与水反应3Fe + 4H2O(g)==高温 Fe3O4 + 4H241. 铁与盐酸反应Fe + 2HCl = FeCl2 + H2↑Fe + 2H+= Fe2++ H2↑42.氧化铁溶于盐酸中Fe2O3 + 6HCl = 2FeCl3 + 3H2OFe2O3 + 6H+= 2Fe3++ 3H2O43.氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaClFe3++ 3OH-= Fe(OH)3 ↓44.氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀) 4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)345. 氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl32 Fe2++ Cl2 = 2 Fe3++ 2Cl-46. 氯化铁溶液中加入铁粉2FeCl3 + Fe =3FeCl22Fe3++ Fe = 3Fe2+47. 用KSCN检验(de)存在离子方程式Fe3++3SCN-= Fe(SCN)3。
(完整版)高一所有化学方程式

(完整版)高一所有化学方程式
1. 水的电解:2H2O → 2H2 + O2
这个方程式表示水在电解过程中分解成氢气和氧气。
2. 酸碱中和反应:HCl + NaOH → NaCl + H2O
这个方程式表示盐酸和氢氧化钠反应氯化钠和水。
3. 铁的氧化:4Fe + 3O2 → 2Fe2O3
这个方程式表示铁在氧气中燃烧氧化铁。
4. 铝与盐酸反应:2Al + 6HCl → 2AlCl3 + 3H2
这个方程式表示铝与盐酸反应氯化铝和氢气。
5. 硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
这个方程式表示硫酸铜与氢氧化钠反应氢氧化铜和硫酸钠。
6. 氢气与氧气反应:2H2 + O2 → 2H2O
这个方程式表示氢气与氧气反应水。
7. 碳酸钙与盐酸反应:CaCO3 + 2HCl → CaCl2 + CO2 + H2O
这个方程式表示碳酸钙与盐酸反应氯化钙、二氧化碳和水。
8. 硫酸铜与铁反应:CuSO4 + Fe → FeSO4 + Cu
这个方程式表示硫酸铜与铁反应硫酸亚铁和铜。
9. 氢氧化钠与硫酸反应:2NaO H + H2SO4 → Na2SO4 + 2H2O
这个方程式表示氢氧化钠与硫酸反应硫酸钠和水。
10. 氯化钠与硝酸银反应:NaCl + AgNO3 → AgCl + NaNO3
这个方程式表示氯化钠与硝酸银反应氯化银和硝酸钠。
高一化学必修一化学方程式大全(精选96例)

高一化学必修一化学方程式大全(精选96例)高一化学必修一化学方程式大全化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。
化学方程式反映的是客观事实。
用化学式(有机化学中有机物一般用结构简式)来表示物质化学反应的式子,叫做化学方程式。
以下是小编为大家整理的高一化学必修一化学方程式大全(精选96例)相关内容,仅供参考,希望能够帮助大家!高一化学必修一化学方程式大全(精选96例)1、金属钠投到硫酸铜溶液中的化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH) 2↓+ Na2SO4 (先冒气泡再蓝色沉淀)2、金属钠与盐酸的化学方程式:2Na+2HCl=2NaCl+H2↑3、氢氧化钠方在空气中变质的化学方程式:2NaOH+CO2=Na2CO3+H2ONa2CO3+10H2O=Na2CO3·10H2O4、金属钠放在空气的氧化:4Na+O2=2Na2O (银白色变暗)5、金属钠在空气燃烧:2Na+O2=Na2O2 Δ (生成淡黄色粉末)6、过氧化钠在空气中变质:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O27、过氧化钠与酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑8、氧化钠在空气中变质:Na2O+H2O=2NaOHNa2O+CO2=Na2CO39、氧化钠与酸反应:Na2O+2HCl=2NaCl+H2O10、氧化钠在空气中燃烧:2Na2O+O2=2Na2O211、氯气与铁的反应方程式:2Fe+3Cl2=2FeCl3 点燃(红棕色的烟)12、氯气与铜的反应方程式:Cu+Cl2=CuCl2 点燃(棕黄色的烟)13、氯气与氢气的反应方程式:Cl2+H2=2HCl 点燃(苍白色火焰,生成白雾)14、氯气与钠单质的反应方程式:2Na+Cl2=2NaCl 点燃(淡黄色的烟)15、工业制漂白:2Cl2+2Ca(OH) 2=CaCl2+Ca(ClO) 2+2H2O (为Ca(OH) 2石灰乳)16、氯气与水的方程式:Cl2+H2O=HCl+HClO17、消毒、处理多余的氯气、制84消毒液:Cl2+2NaOH=NaClO+NaCl+H2O18、次氯酸钠在空气中变质:2NaClO+CO2+H2O=2HClO+Na2CO3NaClO+CO2+H2O=HClO+NaHCO319、漂白在空气中变质:Ca(ClO) 2+CO2+H2O=CaCO3↓+2HClO20、次氯酸见光分解:2HClO=2HCl+O2↑ 光照21、氯化铁通入沸水中制氢氧化铁胶体:FeCl3+3H2O=Fe(OH) 3 (胶体)+3HCl Δ22、碳酸钠与盐酸的反应方程式:Na2CO3+2HCl(过)=2NaCl+CO2↑+H2ONa2CO3+HCl(少)=NaHCO3+NaCl23、碳酸氢钠与盐酸的反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑24、碳酸氢钠与碱反应方程式:NaHCO3+NaOH=Na2CO3+H2ONaHCO3+Ca(OH) 2=2H2O+Na2CO3+CaCO3↓25、碳酸氢钠受热易分解:2NaHCO3=Na2CO3+CO2↑+H2O Δ26、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2+H2O=2NaHCO327、浑浊石灰水变澄清:CO2+CaCO3+H2O=Ca(HCO3) 228、碳酸氢钙受热分解:Ca(HCO3) 2= CO2↑+CaCO3+H2O Δ29、氢氧化亚铁在空气中变质:4Fe(OH) 2+O2+2H2O=4Fe(OH) 3(由白色沉淀变成灰绿色再变成红褐色沉淀)30、保存氯化亚铁溶液:2FeCl3+Fe=3FeCl2 2Fe3++Fe=3Fe2+31、制造印刷线路板:2FeCl3+Cu=2FeCl2+CuCl2 2Fe3++Cu=2Fe2++Cu2+32、2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl-33、Fe2O3+3CO = 2Fe+3CO2 高温34、Ba2++SO42+=BaSO4↓ Ag++Cl-= AgCl↓35、Zn+Cu2+= Zn2++Cu Zn+Fe2+= Zn2++Fe36、溶洞的形成:CO2+CaCO3+H2O=Ca(HCO3)2Ca(HCO3)2=CO2↑+CaCO3+H2O Δ37、NaHCO3+BaCl2 ?不反应(一般情况下,强酸才能制弱酸)38、工业上制取水煤气:C+H2O(g)=CO+H2 高温39、自然界通过放电把氮气转化为一氧化氮:N2+O22NO 放电(NO无色、难溶于水)40、工业上制备氨气:N2+3H22NH3 高温、高压、催化剂41、一氧化氮在常温下被氧化:2NO+O2=2NO2(NO2红棕色、有刺激性气味的有毒气体、易溶于水)42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO43、氨溶解于水:NH3+H2ONH3·H2O(一水合氨、弱碱性、能使酚酞溶液变红)44、一水合氨的电离:NH3·H2ONH4++OH-45、氨与盐酸的反应:NH3+HCl=NH4Cl46、工业上制备硝酸需要的一氧化氮的方程式:4NH3+5O2=4NO+6H2O 高温催化剂47、碳酸氢铵受热分解:NH4HCO3=NH3↑+CO2↑+H2O Δ (密封保存在阴凉处、施肥时埋在土下)48、氯化铵受热分解:NH4Cl=NH3↑+HCl↑ Δ49、铵态氮肥不能与碱(如草木灰)混合施用:NH4++OH-=NH3↑+H2O Δ50、实验室制氨气:2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O Δ(向上排空气法收集、湿润的红色石蕊试纸)51、硝酸受热分解:4HNO3=4NO2↑+O2↑+2H2O 受热或见光(应保存在棕色试剂瓶中、阴凉处)52、铜与硝酸的反应:Cu +4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O (遇浓硝酸生成二氧化氮)3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O (遇稀硝酸生成一氧化氮)53、浓硝酸与木炭的反应:4HNO3(浓)+C=CO2↑+4NO2↑+2H2O Δ54、硫单质铁的反应:Fe+S=FeS Δ(硫单质的氧化性、S黄色或淡黄色固体,不溶水、微溶酒精、易溶CS2)55、硫单质与氧气的反应:S+O2=SO2 点燃(硫单质的还原性、SO2有刺激性气味的有毒气体、易溶于水)56、硫粉遇碱发生歧化反应:3S+6NaOH=2Na2S+Na2SO3+3H2O Δ57、黑火药爆炸的化学方程式:S+2KNO3+3C=K2S+3CO2↑+N2↑58、二氧化硫被氧气氧化:2SO2+O22SO3 催化剂Δ59、二氧化硫与硫化氢发生归中反应:SO2+2H2S=3S↓+2H2O (H2S臭鸡蛋气味)60、浓硫酸与铜加热发生反应:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O Δ61、浓硫酸与木炭加热发生反应:2H2SO4(浓)+C=2SO2↑+CO2↑+2H2O Δ62、二氧化硫能使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3↓+H2O63、二氧化硫与氯气发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl64、酸雨的形成:2SO2+O22SO3 粉尘等催化SO3+H2O=H2SO4SO2+H2OH2SO32H2SO3+O2=2H2SO465、海水提镁第一步:Mg+2H+=Mg2++H2↑ (盐酸、稀硫酸)66、镁与氮气的反应:3Mg+N2=Mg3N2 点燃67、镁与二氧化碳反应:2Mg+CO2=2MgO+C 点燃(镁着火不能用二氧化碳扑灭)68、海水提溴单质:2Br-+Cl2=Br2+2Cl-69、半导体硅与氧气的'反应:Si+O2=SiO2 Δ(自然界没有游离态的硅)70、工业上制粗硅:SiO2+2C=Si+2CO↑ 高温(光导纤维、沙子和石英的主要成分是SiO2)71、硅与氟气的反应:Si+2F2=SiF472、硅与氢氟酸的反应:Si+4HF=SiF4+2H273、制作黏合剂:Si+2NaOH+H2O=Na2SiO3+2H2↑74、玻璃与烧碱反应:SiO2+2NaOH=Na2SiO3+H2O (Na2SiO3的水溶液称为水玻璃)75、二氧化硅与碱性氧化物的反应:SiO2+CaO=CaSiO3 高温76、刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O77、工业制玻璃:CaCO3+SiO2=CaSiO3+CO2↑ 高温Na2CO3+SiO2=Na2SiO3+CO2↑ 高温78、金属铝在氧气中燃烧:4Al+3O2=2Al2O3 点燃79、铝热反应:2Al+Fe2O3=Al2O3+2Fe高温(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)80、金属铝与酸的反应:2Al+6HCl=2AlCl3+3H2↑81、金属铝与碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ (四羟基合铝酸钠)82、实验室制氢氧化铝:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl(白色沉淀)83、氢氧化铝溶于强酸中:Al(OH)3+3H+=Al3++3H2O84、氢氧化铝溶于强碱中:Al(OH)3+OH-=[Al(OH)4]- (四羟基合铝酸根离子)85、氧化铝溶于强酸:Al2O3+6H+=2Al3++3H2O (氧化铝为两性氧化物)86、氧化铝溶于强碱:Al2O3+2OH-+3H2O=2[Al(OH)4]-87、碱式碳酸铜的制取:2Cu+O2+H2O+CO2=Cu2(OH)2CO3 (绿色)88、铜与氧气的反应:Cu+O2=2CuO Δ89、铜与硫粉的反应:2Cu+S=Cu2S Δ90、4CuO=2Cu2O+O2↑ 高温(黑色物质变为红色物质)91、CuSO4·5H2O=CuSO4+5H2O↑ Δ (蓝色晶体变为白色粉末)92、氯化铝与少量的氢氧化钠反应:Al3++3OH-=Al(OH)3↓93、氯化铝与过量的氢氧化钠反应:Al3++4OH-=[Al(OH)4]-94、四羟基合铝酸根离子与酸的反应:[Al(OH)4]-+H+=H2O+Al(OH)3↓95、实验室制取氯气:4HCl(浓)+MnO2 =MnCl2+Cl2↑+2H2O Δ (黄绿色气体、有毒、密度比空气大)96、实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑ (无色无味、密度比空气大,溶于水)。
高中必修一化学方程式汇总

1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2非金属氧化物1,低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H22,氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O碱1,低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32,与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
高一化学必修一方程式大全

高一必会化学方程式汇总【1】一、钠1、Na放置在空气中:4Na+O2=2Na2O2、Na在空气中燃烧:2Na+O2点燃Na2O23、Na和水反应:2Na+2H2O=2NaOH+H2↑ 离子方程式2Na+2H2O=2Na++2OH—+H2↑4、过氧化钠(Na2O2)与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑离子方程式 2 Na2O2+2H2O=4Na++4OH—+O2↑5、过氧化钠(Na2O2)与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O26、NaHCO3加热:2NaHCO3加热Na2CO3+H2O+CO2↑7、用小苏打治疗胃酸过多:NaHCO3+HCl==NaCl+H2O+CO2↑离子方程式HCO3_—+H+== H2O+CO2↑8、碳酸钠与盐酸反应Na2CO3+2HCl==2NaCl+H2O+CO2↑离子方程式CO3_2—+2H+== H2O+CO2↑认识本质(分步反应过程如下):Na2CO3+ HCl==2NaCl + NaHCO3 NaHCO3+HCl==NaCl+H2O+CO2↑9、氢氧化钠中通入少量的二氧化碳:2NaOH+ CO2= Na2CO3 + H2O10、氢氧化钠中通入过量的二氧化碳:2NaOH+ CO2= Na2CO3 + H2O和Na2CO3 + H2O+ CO2=2NaHCO3总反应:NaOH+CO2=NaHCO3二、铝11、Al与NaOH溶液反应方程式:2Al+2NaOH+2H2O == 2NaAlO2+3H2↑离子方程式2Al+2OH-+2H2O == 2AlO2—+3H2↑12、Al与HCl溶液反应方程式:2Al+6HCl==2AlCl3+3H2↑离子方程式2Al+6H+==2Al3++3H2↑ 13、Al2O3与稀HCl反应的方程式:Al2O3+6HCl == 2AlCl3+3H2O离子方程式Al2O3+6H+== 2Al3++3H2O14、Al2O3与NaOH溶液反应的方程式:Al2O3+2NaOH == 2NaAlO2+H2O离子方程式Al2O3+2OH—_== 2AlO2—+H2O15、AlCl3与少量NaOH溶液反应的离子方程式:Al3++3OH- == Al(OH)3↓16、Al(OH)3与NaOH溶液反应方程式:Al(OH)3+NaOH == NaAlO2+2H2O离子方程式Al(OH)3+OH— == AlO2—+2H2O17、AlCl3与过量NaOH溶液反应的离子方程式:Al3++4OH- == AlO2-+2H2O18、Al(OH)3与稀HCl反应的化学方程式Al(OH)3+3HCl ==AlCl3+ 3H2O离子方程式:Al(OH)3+3H+ == Al3++3H2O19、AlCl3与过量氨水反应的化学方程式:AlCl3+3NH3.H2O == Al(OH)3↓+3NH4Cl离子方程式:Al3++3NH3.H2O == Al(OH)3↓+3NH4+20、NaAlO2通入少量二氧化碳:2NaAlO2+CO2 +3H2O===Na2CO3+2Al(OH)3↓21、NaAlO2通入足量二氧化碳:NaAlO2+CO2 +2H2O===NaHCO3+Al(OH)3↓22、Al(OH)3受热分解方程式:2Al(OH)3加热Al2O3+3H2O三、铁23、铁与水蒸气高温:3Fe+4H2O(g) 高温Fe3O4+4H2↑24、氧化亚铁与稀盐酸反应:FeO+2HCl == FeCl2+H2O离子方程式:FeO+2H+ == Fe2+ + H2O25、氧化铁与稀盐酸反应:Fe2O3+6HCl == 2FeCl3+3H2O离子方程式:Fe2O3+6H+ ==2Fe3+ + 3H2O26、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl离子方程式:Fe3+ +3 OH—==Fe(OH)3↓27、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4离子方程式:Fe3+ +2 OH—==Fe(OH)2↓28、氢氧化亚铁在空气中露置的方程式:4Fe(OH)2+O2+2H2O == 4Fe(OH)329、铁粉与氯化铁溶液反应的化学方程式:2FeCl3 + Fe = 3FeCl2离子方程式:Fe + 2Fe3+ == 3Fe2+铜粉与氯化铁溶液反应的化学方程式:Cu+2FeCl3==2FeCl2+CuCl230、氯化亚铁溶液中通入氯气的化学反应方程式:2FeCl2 + Cl2 = 2FeCl3离子方程式:2Fe2++Cl2 == 2Fe3++2Cl-30、氯化亚铁溶液中通入氯气的化学反应方程式:2FeCl2 + Cl2 = 2FeCl3离子方程式:2Fe2++Cl2 == 2Fe3++2Cl-31、氢氧化铁胶体的制备:FeCl3 + 3H2O加热2Fe(OH)3(胶体)+ 3HCl四、硅31、SiO2与HF反应:SiO2+4HF==SiF4↑+2H2O32、SiO2与NaOH溶液反应:SiO2+2NaOH==Na2SiO3+H2O离子方程式SiO2+2OH—==SiO32—+H2O33、SiO2与CaO反应:SiO2+CaO高温CaSiO334、Na2SiO3与盐酸反应:Na2SiO3+2HCl==2NaCl+H2SO3↓35、Na2SiO3与少量二氧化碳反应:Na2SiO3+CO2 +H2O== H2SiO3↓+ Na2CO336、Na2SiO3与过量二氧化碳反应:Na2SiO3+2CO2 +2H2O= H2SiO3↓+2NaHCO3五、氯37、氯气和钠反应:Cl2+2Na点燃2NaCl38、氯气和铁反应:3Cl2+2Fe点燃2FeCl339、氯气和铜反应:Cl2+Cu点燃CuCl240、氯气和氢气反应:Cl2+H2 点燃2HCl41、氯气通入水中:Cl2+H2O HClO+HCl离子方程式Cl2 + H2O ==HClO+ H++Cl —42、用氢氧化钠溶液吸收多余的氯气:Cl2+2NaOH==NaCl+NaClO+H2O 离子方程式Cl2+2OH —==Cl —+ClO —+H2O43、氯气通入石灰乳中制漂粉精:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O 漂白粉的漂白原理:Ca(ClO)2+H2O+ CO2==2 HClO+ CaCO344、次氯酸见光分解 2HClO 光照2HCl+O2↑六、硫45 、硫单质与氧气反应:S+O2高温SO246、二氧化硫溶于水:SO2+H2O H2SO347、氢氧化钠与少量二氧化硫:SO2(少量)+ 2 NaOH = Na2SO3 + H2O 离子方程式:SO2 + 2 OH —= SO3 2—+ H2O48、氢氧化钠与过量二氧化硫:SO2 (过量) + NaOH = NaHSO3离子方程式:SO2 + OH —==HSO3—49、二氧化硫与氧化钠:SO2 + Na2O = Na2SO350、碳酸钠与少量二氧化硫:SO2(少量)+ Na2CO3 = Na2SO3 + CO2离子方程式:SO2 + CO32—= SO3 2—+ CO251、二氧化硫与氧气:2SO2+O22SO3(条件:加热、催化剂)52、二氧化硫与氧化剂氯气的反应:SO2 + Cl2+2H2O = H2SO4 + 2HCl(其中Cl2可以用Br2、I2替换)离子方程式:SO2 + Cl2 + 2H2O = 4H+ + SO42-+ 2Cl-★SO2也可以与高锰酸钾和氯化铁FeCl3发生氧化还原反应53、SO3与水的反应:SO3+H2O=H2SO454、SO3与Ca (OH )2反应:SO3+Ca (OH )2=CaSO4+H2O55、SO3与CaO 反应:SO3+CaO=CaSO4七、氮56、氮气与氧气化合:N2+O2放电 2NO57、NO 与空气接触:2NO+O2==2NO258、NO2溶于水:3NO2+2H2O==2HNO3+NO59、NO2与O2混合通入水中:4NO2+O2+2H2O==4HNO360、NO 与O2混合通入水中:4NO+3O2+2H2O==4HNO3八、氨硫酸硝酸61、氮气与氢气化合(工业合成氨):N2+3H2 2NH3(高温,高压,催化剂)氨的催化氧化:4NH3+5O2== 4NO+6H2O 62、氨气与水:NH3+H2O NH3﹒H2O63、加热浓氨水NH3﹒H2O 加热 NH3↑+H2O64、氨气与浓盐酸空中生烟:NH3+HCl=NH4Cl65、碳酸氢铵受热分解:NH4HCO3加热NH3↑+CO2↑+H2O催化剂 加热66、氯化铵受热分解:NH4Cl加热NH3↑+HCl↑67、实验室用固体和固体混合加热制氨气:2NH4Cl+Ca(OH)2加热CaCl2+2NH3↑+2H2O68、金属铜与浓硫酸混合加热:Cu+2H2SO4(浓) 加热CuSO4+SO2↑+2H2O69、铁少量:2Fe+6H2SO4(浓)加热Fe2(SO4)3+3SO2↑+6H2O铁过量:Fe+2H2SO4(浓)加热FeSO4+SO2↑+2H2O70、木炭与浓硫酸混合加热:C+2H2SO4(浓) 加热CO2↑+2SO2↑+2H2O71、铜与浓硝酸反应:Cu+4HNO3==Cu(NO3)2+2NO2↑+2H2O离子方程式Cu+4H++2NO3—==Cu2++2NO2↑+2H2O72、铜与稀硝酸反应:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O离子方程式3Cu+8H++2NO3—==3Cu2++2NO↑+4H2O。
高一化学方程式总结通用7篇

高一化学方程式总结通用7篇高一化学方程式总结篇一化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧:S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层:C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑CO32- + 2H+ = H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3 + HCl =NaHCO3 + NaClCO32- + H+ = HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+ = H2O +CO2↑小苏打受热分解2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑氧化还原反应:1. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O2. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑5. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO26.一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO27.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2氧化性:2FeCl3 + Fe === 3FeCl22FeCl3 + Cu === 2FeCl2 + CuCl2 (用于雕刻铜线路版)2FeCl3 + Zn === 2FeCl2 + ZnCl2FeCl3 + Ag === FeCl2 + AgCFe2(SO4)3 + 2Ag === FeSO4 + Ag2SO4(较难反应)Fe(NO3)3 + Ag 不反应2FeCl3 + H2S === 2FeCl2 + 2HCl + S2FeCl3 + 2I === 2FeCl2 + 2Cl + I2FeCl2 + Mg === Fe + MgCl2还原性:2FeCl2 + Cl2 === 2FeCl33Na2S + 8HNO3(稀) === 6NaNO3 + 2NO + 3S + 4H2O3Na2SO3 + 2HNO3(稀) === 3Na2SO4 + 2NO + H2O2Na2SO3 + O2 === 2Na2SO4硫和硫的化合物1、硫和钠反应的方程式:2Na+S=Na2S (条件:研磨) 现象:轻微爆炸2、硫和铁反应的方程式:Fe+S=FeS(条件加热)3、硫和浓硫酸反应的化学方程式:S+2H2SO4 =SO2↑ +2 H2O (条件:加热)4、硫和氢氧化钠溶液反应的化学方程式:3S+6NaOH=2Na2S+Na2SO3 + 3H2O(除硫的`化学方法)5、SO2与水反应的方程式:SO2 + H2O =H2SO3 (可逆反应要用可逆符号)6、少量的SO2与NaOH溶液反应的化学方程式:SO2 +2NaOH=Na2SO3 + H2O7、过量的SO2与NaOH溶液反应的化学方程式:SO2 + NaOH=NaHSO38、少量的SO2与澄清石灰水反应的化学方程式:SO2 + Ca(OH)2= CaSO3↓ + H2O9、少量的SO2与饱和的碳酸氢钠溶液反应的化学方程式:SO2 +2NaHCO3= Na2SO3 +2CO2 +H2O10、SO2与Na2SO3溶液反应的化学方程式:SO2 + Na2SO3 +H2O =2NaHSO311、SO2与氢硫酸反应的化学方程式:SO2 + 2H2S=3S↓+2H2O高一化学方程式总结篇二钠及其化合物的性质1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na+O2点燃====Na2O23.钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
高一必修化学方程式大全

高一必修化学方程式大全
化学方程式是化学教学中一个重要的组成部分,在深入研究和探索化学律下实验过程中具有至关重要的意义。
以下是高一必修化学方程式大全:
一、酸和碱的中和反应
HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)
二、气体反应
CO2(g)+2H2(g)→CH3OH(l)+H2O(g)
三、金属与稀盐溶液反应
2Fe(s)+2HCl(aq)→2FeCl2(aq)+H2(g)
四、无机化合物反应
2KOH(aq)+H2(g)→K2O(s)+2H2O(l)
五、乙醇燃烧反应
C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(g)
六、水素氧化反应
H2(g)+1/2O2(g)→H2O(l)
七、氧化还原反应
3MnO4(aq)+8H+(aq)+5Fe2(aq)→3Mn2+(aq)+5Fe3+(aq)+4H2O(l)
八、醇中容积反应
C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(g)
九、焦硫水解反应
C6H14(l)+7O2(g)→6CO2(g)+7H2O(g)+2SO2(g)
以上就是高一必修化学方程式大全,虽然少数反应式可能会比较复杂,但他们都被不失时机地应该和掌握,以便于在学习的过程中能够更加有效地运用。
关于化学方程式,除了熟练掌握一些基础反应式外,还要经常总结练习,培养化学的“合成性思维”,以便于解决实际问题。
同时,在日常学习中,要深刻理解化学本质,掌握反应原理,加深对基础知识的理解,让单纯的记忆变成深入洞察的思维过程。
高中化学必修1化学方程式总结
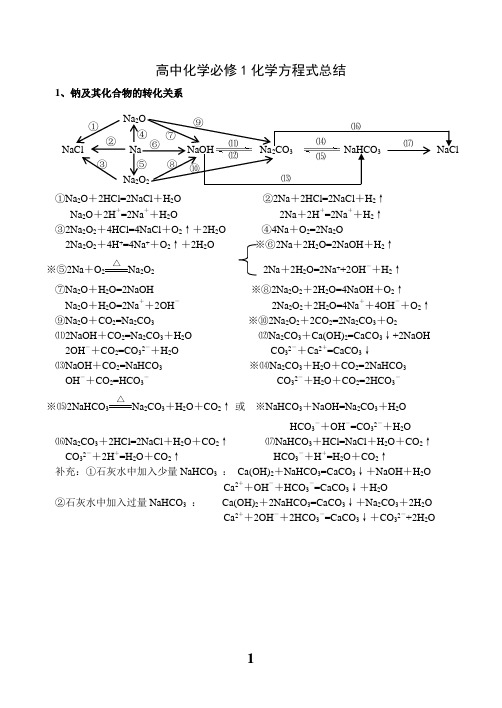
高中化学必修1化学方程式总结1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2ONaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④2、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2OAl Al 2O 3 A l (O H )3 KAl(SO 4)2NaAlO 2AlCl 3 ① ② ③ ④ ⑤ ⑥⑦⑧ ⑨⑩⑾⑿①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
高一化学必修一化学方程式总结

高一化学必修一化学方程式总结在高一化学必修一中,我们学习了众多重要的化学方程式,这些方程式是理解化学知识的关键。
下面就为大家详细总结一下。
一、金属及其化合物相关的化学方程式1、钠及其化合物(1)钠在空气中燃烧:2Na + O₂=点燃= Na₂O₂(2)钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑(3)过氧化钠与水反应:2Na₂O₂+ 2H₂O = 4NaOH + O₂↑(4)过氧化钠与二氧化碳反应:2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂2、铝及其化合物(1)铝与氧气反应:4Al + 3O₂= 2Al₂O₃(2)铝与盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑(3)铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H₂O =2NaAlO₂+ 3H₂↑(4)氧化铝与盐酸反应:Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O+ H₂O(6)氢氧化铝与盐酸反应:Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O (7)氢氧化铝与氢氧化钠溶液反应:Al(OH)₃+ NaOH =NaAlO₂+ 2H₂O3、铁及其化合物(1)铁与氧气反应:3Fe + 2O₂=点燃= Fe₃O₄(2)铁与盐酸反应:Fe + 2HCl = FeCl₂+ H₂↑(3)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu(4)氧化亚铁与盐酸反应:FeO + 2HCl = FeCl₂+ H₂O(5)氧化铁与盐酸反应:Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O (6)四氧化三铁与盐酸反应:Fe₃O₄+ 8HCl = FeCl₂+2FeCl₃+ 4H₂O(7)氢氧化亚铁与氧气、水反应:4Fe(OH)₂+ O₂+ 2H₂O =4Fe(OH)₃二、非金属及其化合物相关的化学方程式1、硅及其化合物(1)硅与氧气反应:Si + O₂=高温= SiO₂(2)二氧化硅与氢氟酸反应:SiO₂+ 4HF = SiF₄↑ + 2H₂O+ H₂O(4)硅酸钠溶液与盐酸反应:Na₂SiO₃+ 2HCl = 2NaCl +H₂SiO₃↓2、氯及其化合物(1)氯气与金属钠反应:2Na + Cl₂=点燃= 2NaCl(2)氯气与金属铁反应:2Fe + 3Cl₂=点燃= 2FeCl₃(3)氯气与氢气反应:H₂+ Cl₂=点燃= 2HCl(4)氯气与水反应:Cl₂+ H₂O = HCl + HClO(5)次氯酸光照分解:2HClO =光照= 2HCl + O₂↑(6)氯气与氢氧化钠溶液反应:Cl₂+ 2NaOH = NaCl + NaClO + H₂O3、硫及其化合物(1)硫在氧气中燃烧:S + O₂=点燃= SO₂(2)二氧化硫与水反应:SO₂+ H₂O ⇌ H₂SO₃(3)二氧化硫与氧气反应:2SO₂+ O₂⇌ 2SO₃(4)三氧化硫与水反应:SO₃+ H₂O = H₂SO₄(5)铜与浓硫酸反应:Cu + 2H₂SO₄(浓) =△= CuSO₄+SO₂↑ + 2H₂O(6)碳与浓硫酸反应:C + 2H₂SO₄(浓) =△= CO₂↑ + 2SO₂↑ + 2H₂O4、氮及其化合物(1)氮气与氧气反应:N₂+ O₂=放电= 2NO(2)一氧化氮与氧气反应:2NO + O₂= 2NO₂(3)二氧化氮与水反应:3NO₂+ H₂O = 2HNO₃+ NO(4)氨气与水反应:NH₃+ H₂O ⇌ NH₃·H₂O(5)氨气与盐酸反应:NH₃+ HCl = NH₄Cl(6)氯化铵受热分解:NH₄Cl =△= NH₃↑ +HCl↑(7)碳酸氢铵受热分解:NH₄HCO₃=△= NH₃↑ + CO₂↑ +H₂O(8)硝酸铵与氢氧化钠反应:NH₄NO₃+ NaOH =△= NH₃↑ + NaNO₃+ H₂O(9)铜与浓硝酸反应:Cu + 4HNO₃(浓) = Cu(NO₃)₂+ 2NO₂↑ + 2H₂O(10)铜与稀硝酸反应:3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O这些化学方程式在高一化学学习中非常重要,同学们一定要牢记并理解其反应原理,通过多做练习来熟练掌握,为后续的化学学习打下坚实的基础。
必修一化学方程式大全

必修一化学方程式大全必修一化学方程式1.澄清石灰水中通入少量二氧化碳:ca(oh)2+co2══caco3+h2o2.回应石灰水中灌入过量二氧化碳:ca(oh)2+2co2══ca(hco3)23.氢氧化钠溶液中通入少量二氧化碳:2naoh+co2====na2co3+h2o4.氢氧化钠溶液中灌入过量二氧化碳:co2+naoh=nahco35.碳酸钠溶液中加入少量盐酸:na2co3+hcl=nahco3+nacl6.碳酸钠溶液中重新加入足量盐酸:nahco3+hcl=nacl+h2o+co2↑7.硫酸氢纳溶液中加入少量氢氧化钡溶液:2nah2so4+ba(oh)2=baso4↓+naso4+2h2o8.硫酸氢纳溶液中加入过量的氢氧化钡溶液:nah2so4+ba(oh)2=baso4↓+naoh+h2o9.碳酸氢钙溶液中加入少量氢氧化钠溶液:ca(hco3)2+naoh=nahco3+caco3↓+h2o10.碳酸氢钙溶液中加入足量氢氧化钠溶液:2naoh+ca(hco3)2=caco3↓+2h20+na2co311.澄清石灰水中加入少量的碳酸氢钠溶液:nahco3+ca(oh)2=naoh+h2o+caco3↓12.澄清石灰水中加入少量的碳酸氢钠溶液:2nahco3+ca(oh)2=na2co3+2h2o+caco3↓二、钠及其化合物1.钠在空气中冷却:4na+o2=2na2o2.钠在氧气中加热:2na+o2na2o2cl2+2na2nacl3.钠与水反应:2na+2h2o=2naoh+h2↑2na+2h2o==2na++2oh-+h2↑4.钠与硫酸铜溶液反应:2na+2h2o+cuso4=cu(oh)2↓+na2so4+h2↑5.钠和氯化铁溶液反应:6na+6h2o+2fecl3=2fe(oh)3↓+6nacl+3h2↑6.氧化钠的主要化学性质:△2na2o+o2na2o+h2o=2naohna2o+so3=na2so4na2o+co2=na2co3na2o+2hcl=2nacl+h2o7.过氧化钠与水反应:2na2o2+2h2o=4naoh+o2↑8.过氧化钠与二氧化碳反应:2na2o2+2co2=2na2co3+o29.过氧化钠和硫酸反应:na2o2+h2so4(热、叶唇柱)=na2so4+h2o210.过氧化钠和二氧化硫反应na2o2+so2=na2so411.土法制烧碱:ca(oh)2+na2co2=caco3↓+2naoh12.二氧化碳通入饱和碳酸钠溶液:na2co3+h2o+co2=2nahco3↓13.碳酸氢钠受到热分解:2nahco3====na2co3+h2o+co2↑三、铝和铝的化合物:铝和氧气反应分解成氧化铝:4al+3o22al2o3(纯氧)铝热反应(2al+fe2o3高温al2o3+2fe)铝和酸反应2al+3h2so4=al2(so4)3+3h2↑2al+6h+=2al3++3h2↑铝和碱反应2al+2naoh+2h2o=2naalo2+3h2↑铝和水的反应是2al+6h2o↓+3h2↑,反应条件为加热。
高中化学必修一方程式大全

高中化学必修一方程式大全
高中化学必修一中包含了大量的化学方程式,这些方程式是学生进行化学学习和实验的基础。
下面是一些常见的化学方程式:
1. 酸碱反应方程式:酸 + 碱→盐 + 水
例如:HCl + NaOH → NaCl + H2O
2. 氧化还原反应方程式:氧化剂 + 还原剂→氧化物 + 还原物
例如:Cu + 2HNO3 → Cu(NO3)2 + 2NO2 + H2O
3. 燃烧反应方程式:燃料 + 氧气→二氧化碳 + 水
例如:C3H8 + 5O2 → 3CO2 + 4H2O
4. 氧化反应方程式:元素 + 氧气→氧化物
例如:2Mg + O2 → 2MgO
5. 还原反应方程式:氧化物 + 还原剂→元素或化合物
例如:ZnO + C → Zn + CO
6. 酸化反应方程式:酸 + 金属→盐 + 氢气
例如:2HCl + Zn → ZnCl2 + H2
7. 沉淀反应方程式:离子反应产生的固体产物
例如:AgNO3 + NaCl → AgCl↓ + NaNO3
以上是高中化学必修一中常见的化学方程式,掌握这些方程式可以帮助学生更好地进行化学实验和理论学习。
- 1 -。
高一化学方程式大全

必修一化学方程式总结一、钠及其化合物1、钠与氧气:常温:4Na + O2 == 2Na2O 点燃:2Na + O2Na2O22、钠与水反应:2Na + 2H2O == 2NaOH + H2↑离子方程式:2Na + 2H2O == 2Na++ 2OH-+ H2↑3、钠与硫酸反应:2Na + H2SO4 == Na2SO4+ H2↑4、氧化钠与水反应:Na2O+H2O == 2NaOH5、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 == 2Na2CO3+ O26、过氧化钠与水反应:2Na2O2 +2H2O == 4NaOH + O2↑离子方程式:2Na2O2 +2H2O == 4Na+ + 4OH-+ O2↑7、NaOH溶液通入少量CO2:2NaOH +CO2 == Na2CO3 +H2O 离子方程式:2OH-+CO2 == CO3 2-+H2ONaOH溶液通入过量CO2:NaOH +CO2 == NaHCO3 离子方程式:OH-+CO2 == HCO3-8、①向碳酸钠溶液滴入少量稀盐酸:Na2CO3+ HCl == NaHCO3 + NaCl向稀盐酸溶液滴入少量碳酸钠:Na2CO3+ 2HCl == 2NaCl +CO2↑+H2O②除去碳酸氢钠中混有的碳酸钠:Na2CO3 + CO2 + H2O == 2NaHCO3③碳酸钠与氢氧化钙:Na2CO3 +Ca(OH)2 == CaCO3 ↓+2NaOH④碳酸氢钠与盐酸:NaHCO3 + HCl == NaCl +CO2↑+H2O⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCO3 +Ca(OH)2 ==NaOH+CaCO3 ↓+H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCO3 +Ca(OH)2 == Na2CO3 +CaCO3 ↓+2H2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH == Na2CO3 +H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3Na2CO3 +CO2↑+H2O⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 +CaCl2 == CaCO3 ↓+2NaCl二、铝及其化合物1、铝与氧气的反应:4Al + 3O2 2Al2O32、铝与氧化铁反应(铝热反应):2Al + Fe2O3 2Fe + Al2O33、铝和稀盐酸:2Al +6HCl == 2AlCl3 +3H2↑离子方程式:2Al+ 6H+ ==2Al3+ +3H2↑4、铝和NaOH溶液:2Al +2NaOH +2H2O == 2NaAlO2 +3H2↑离子方程式:2Al +2OH-+2H2O == 2AlO2-+3H2↑5、氧化铝和稀硫酸:Al2O3 +3H2SO4 == Al2(SO4)3 +3H2O 离子方程式:Al2O3 + 6H+ == 2Al3+ + 3H2O6、氧化铝和NaOH溶液:Al2O3 + 2NaOH == 2NaAlO2 +H2O 离子方程式:Al2O3 + 2OH-== 2AlO2-+ H2O7、氢氧化铝和稀盐酸:Al(OH)3 +3HCl == AlCl3 +3H2O 离子方程式:Al(OH)3 +3H+ == Al3+ + 3H2O8、氢氧化铝和NaOH溶液:Al(OH)3 + NaOH == NaAlO2 +2H2O 离子方程式:Al(OH)3 +OH-==AlO2-+ 2H2O9、氢氧化铝受热分解:2Al(OH)3Al2O3 +3H2O10、硫酸铝与氨水反应:Al2(SO4)3 +6NH3•H2O == 2Al(OH)3↓+3(NH4)2SO4离子方程式:Al3+ + 3NH3•H2O == Al(OH)3↓+3NH4+11、AlCl3溶液中加入少量NaOH溶液:AlCl3 + 3NaOH ==Al(OH)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH == NaAlO2+3NaCl+ 2H2O12、往NaAlO2溶液中通入少量CO2:2NaAlO2 +CO2 + 3H2O == 2Al(OH)3↓+ Na2CO3往NaAlO2溶液中通入过量CO2:NaAlO2 +CO2 + 2H2O == Al(OH)3↓+ NaHCO313、电解氧化铝:2Al2O3(熔融)4Al+3O2↑三、铁及其化合物1、铁与氧气反应:3Fe + 2O2Fe3O4铁与硫反应:Fe + S FeS2、铁与盐酸反应:Fe + 2HCl == FeCl2 +H2↑离子方程式:Fe + 2H+ == Fe2++H2↑铁与CuSO4溶液:Fe +CuSO4 == FeSO4 + Cu 离子方程式:Fe +Cu2+== Fe2++ Cu3、铁和水蒸气:3Fe +4H2O(g)Fe3O4 + 4H24、氧化亚铁与盐酸反应:FeO + 2HCl == FeCl2 +H2O 离子方程式:FeO + 2H+ == Fe2++H2O5、氧化铁与盐酸反应:Fe2O3 + 6HCl == 2FeCl3 +3H2O 离子方程式:Fe2O3 + 6H+ == 2Fe3++3H2O6、CO还原氧化铁:3CO+Fe2O33CO2 + 2Fe7、氯化铁与NaOH溶液:FeCl3 +3NaOH == Fe(OH)3 ↓+3NaCl 离子方程式:Fe3+ +3OH-== Fe(OH)3 ↓8、硫酸亚铁与NaOH溶液:FeSO4 + 2NaOH == Fe(OH)2 ↓+ Na2SO4 离子方程式:Fe2+ +2OH-== Fe(OH)2 ↓9、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 +3H2O10、氢氧化亚铁被氧化为氢氧化铁:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3(白色沉淀迅速变灰绿色,最后变为红褐色)11、除去FeCl2中的FeCl3:Fe +2FeCl3 == 3FeCl2 离子方程式:Fe +2Fe3+ == 3Fe2+12、FeCl2与Cl2反应:2FeCl2 + Cl2 == 2FeCl3 离子方程式:2Fe2+ +Cl2 == 2Fe3+ +2Cl-13、FeCl3与Cu反应:Cu +2FeCl3 == 2FeCl2 +CuCl2 离子方程式:Cu +2Fe3+ == 2Fe2++Cu2+14、氯化铁与硫氰化钾反应:FeCl 3 + 3KSCN Fe(SCN)3 + 3KCl(溶液变红)四、硅及其化合物1、硅与氧气加热:Si + O2 SiO2硅与氟气:Si + 2F2 == SiF42、硅单质与氢氟酸:Si + 4HF== SiF4↑+2H2↑3、硅与NaOH溶液反应:Si + 2NaOH+ H2O == Na2SiO3 + 2H2↑4、二氧化硅与氢氟酸反应:SiO2 + 4HF== SiF4↑+2H2O5、二氧化硅与氧化钙高温反应:SiO2 + CaO CaSiO36、二氧化硅与NaOH溶液反应:SiO2 + 2NaOH == Na2SiO3 +H2O7、二氧化硅与碳反应:SiO2 + 2C2CO + Si8、硅酸钠与与盐酸反应:Na2SiO3 + 2HCl == 2NaCl +H2SiO3↓离子方程式:SiO32-+ 2H+ ==H2SiO3↓9、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 +H2O == Na2CO3 +H2SiO3↓10、二氧化硅与纯碱反应:SiO2 +Na2CO3Na2SiO3 + CO2↑11、二氧化硅与石灰石反应:SiO2 +CaCO3CaSiO3 + CO2↑12、加热硅酸:H2SiO3SiO2 +H2O五、氯及其化合物1、实验室制氯气:MnO2 +4HCl(浓)MnCl2 +Cl2↑+2H2O 离子方程式:MnO2 +4H++2Cl-Mn2++Cl2↑+2H2O2、钠在氯气中燃烧:2Na +Cl22NaCl(产生大量白烟)铁在氯气中燃烧:2Fe +3Cl22FeCl3 (产生大量棕黄色的烟)铜在氯气中燃烧:Cu +Cl2CuCl2 (产生大量棕黄色的烟)氢气在氯气中燃烧:H2 +Cl22HCl(苍白色火焰,瓶口出现白雾)3、氯气和水反应:Cl 2 + H2O HCl+ HClO 离子方程式:Cl2 + H2O H++Cl-+ HClO4、次氯酸光照分解:2HClO2HCl+O2↑5、氯水中通入SO2:Cl2 +SO2 +2H2O==2HCl+H2SO4 离子方程式:Cl2 +SO2 +2H2O==4H++2Cl-+SO42-6、氯气与NaOH溶液:Cl2+2NaOH ==NaCl +NaClO +H2O 离子方程式:Cl2+2OH-==Cl-+ClO-+H2O7、工业生产漂白粉:2Cl2+2Ca(OH)2 ==CaCl2+Ca(ClO)2+2H2O8、漂白粉漂白原理:Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO9、向漂白粉溶液中加入稀盐酸:Ca(ClO)2+2HCl==CaCl2+2HClO10、氯气通入溴化钾溶液:Cl2 + 2KBr ==2KCl +Br2 离子方程式:Cl2 + 2Br-==2Cl-+Br2氯气通入碘化钾溶液:Cl2 + 2KI ==2KCl +I2 离子方程式:Cl2 + 2I-==2Cl-+I2溴水和碘化钾溶液:Br2 + 2KI ==2KBr +I2 离子方程式:Br2 + 2I-==2Br-+I211、氯化钠和硝酸银溶液:NaCl +AgNO3 ==AgCl ↓+Na NO3 离子方程式:Cl-+Ag+==AgCl ↓六、硫及其化合物1、硫在空气中燃烧:S + O2 SO2 硫与氢气加热:H2 + S H2S2、二氧化硫与水:SO 2 + H2O H2SO3二氧化硫与氧化钙:SO2 +CaO ==CaSO3少量SO2与NaOH溶液:SO2+2NaOH==Na2SO3 +H2O 离子方程式:SO2+2OH-==SO32-+H2O过量SO2与NaOH溶液:SO2+NaOH==NaHSO3 离子方程式:SO2+OH-==HSO3-3、SO2通入过量的澄清石灰水:SO2+Ca(OH)2 ==CaSO3↓+H2O 离子方程式:SO2+Ca2++2OH-==CaSO3↓+H2O过量的SO2通入澄清石灰水:2SO2+Ca(OH)2 ==Ca(HSO3)2 离子方程式:SO2+OH-==HSO3-4、二氧化硫与硫化氢:SO2 + 2H2S == 3S↓+ 2H2O5、二氧化硫催化氧化:2SO2+O22SO36、亚硫酸钠和硫酸反应:Na2SO3 +H2SO4 == Na2SO4+SO2↑+H2O7、Na2SO3 与氧气反应:2Na2SO3+O2==2Na2SO48、三氧化硫与水反应:SO3 + H2O==H2SO49、三氧化硫与氧化钙:SO3 +CaO ==CaSO410、三氧化硫与氢氧化钙:SO3 +Ca(OH)2==CaSO4↓+H2O11、铜与浓硫酸反应:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O12、碳与浓硫酸反应:C +2H2SO4(浓)CO2↑+2SO2↑+2H2O13、二氧化硫与过氧化氢反应:SO2+H2O2=H2SO4七、氮及其化合物1、氮气和氧气反应:N2+O22NO2、工业合成氨:N2+3H22NH33、一氧化氮与氧气反应:2NO+O2==2NO24、NO2溶于水:3NO2+H2O==2HNO3+NO5、氨气溶于水:NH 3+H2O NH3•H2O 氨水显弱碱性(电离方程式):NH3•H2O NH4++OH-6、浓氨水受热分解:NH3•H2O NH3↑+H2O7、氨气和氯化氢:NH3+HCl==NH4Cl(产生白烟)8、氨的催化氧化:4NH3+5O24NO+6H2O9、氯化铵受热分解:NH4Cl NH3↑+HCl↑10、碳酸氢铵受热分解:NH4HCO3NH3↑+CO2↑+H2O11、硝酸铵和NaOH:NH4NO3+NaOH NaNO3+NH3↑+H2O离子方程式:NH4++OH-NH3↑+H2O12、实验室制氨气:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O13、浓硝酸与铜反应:Cu +4HNO3==Cu(NO3)2+2NO2↑+2H2O 离子方程式:Cu +4H++2NO3-==Cu2++2NO2↑+2H2O14、稀硝酸与铜反应:3Cu +8HNO3==3Cu(NO3)2+2NO↑+4H2O离子方程式:3Cu +8H++2NO3-==3Cu2++2NO↑+4H2O15、硝酸见光分解:4HNO3==4NO2↑+O2↑+2H2O16、NH4+检验的离子方程式:NH4++OH-NH3↑+H2O17、NO2、O2混合气通入水中无剩余气体:4NO2+O2+2H2O==4HNO318、NO、O2混合气通入水中无剩余气体:4NO+3O2+2H2O==4HNO319、少量氨气与氯气2NH3+3Cl2 = N2+6HCl20、过量氨气与氯气8NH3+3Cl2 = N2+6NH4Cl。
完整版)高一化学必修一化学方程式大全

完整版)高一化学必修一化学方程式大全高一化学必修一化学方程式大全1.钠在空气中燃烧,产生黄色火焰。
化学方程式为2Na + O2 → Na2O2(点燃)和4Na + O2 → 2Na2O,钠块在空气中变暗。
2.钠与水反应,产生浮、熔、游、响、红等现象。
化学方程式为2Na + 2H2O → 2H2O + H2↑和2Na + 2H2O → 2Na+ + 2OH- + H2↑。
3.过氧化钠与水反应,是放热反应。
Na2O2是强氧化剂,用于漂白。
化学方程式为2Na2O2 + 2H2O → 4NaOH + O2↑和2Na2O2 + 2H2O → 4Na+ + 4OH- + O2↑。
碱性氧化物Na2O与水的反应为Na2O + H2O → 2NaOH。
4.过氧化钠可用在呼吸面具和潜水艇中作为氧气来源。
原因是2Na2O2 + 2CO2 → 2Na2CO3 + O2.5.苏打(纯碱)与盐酸反应,有两种情况。
①盐酸中滴加纯碱溶液,化学方程式为Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑和CO32- + 2H+ → H2O + CO2↑。
②纯碱溶液中滴加盐酸至过量,化学方程式为Na2C O3 + HCl → NaHCO3 + NaCl、CO32- + H+ → HCO3-、NaHCO3 + HCl → NaCl + H2O +CO2↑和HCO3- + H+ → H2O + CO2↑。
6.小苏打受热分解,化学方程式为2NaHCO3(加热)→ Na2CO3 + H2O + CO2↑。
7.固体氢氧化钠和碳酸氢钠混合物在密闭中加热,化学方程式为NaHCO3 + NaOH(加热)→ Na2CO3 + H2O + CO2↑和HCO3- + OH- → H2O + CO32-。
8.金属锂在空气中燃烧,化学方程式为4Li + O2(加热)→ 2Li2O。
9.氯气的性质,铜丝在氯气中剧烈燃烧,产生棕色烟。
化学方程式为Cu + Cl2(点燃)→ CuCl2.之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学必修化学方程
式总汇
TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-
必修2化学方程式总汇
第一章物质结构元素周期律
1、Li与O
2反应(点燃)4Li + O
2
2Li
2
O
Na与O
2反应(点燃)2Na + O
2
Na
2
O
2
Na与H
2O反应:2Na + 2H
2
O = 2NaOH+H
2
↑
2、卤素单质F
2、Cl
2
、Br
2
、I
2
与氢气反应F
2
+ H
2
= 2HF、Cl
2
+ H
2
= 2HCl、Br
2
+ H
2 = 2HBr、I
2
+ H
2
= 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:Cl
2
可以从溴化物(或碘化
物)中置换出Br
2(或I
2
):
①Cl
2 + 2NaBr = Br
2
+ 2NaCl ②Cl
2
+ 2KI = I
2
+ 2KCl
(2)溴水与碘化钠溶液反应:Br
2可以从碘化物中置换出I
2
:Br
2
+ 2KI = I
2
+ 2KBr
4、Mg与H
2O反应:Mg + 2H
2
O = Mg(OH)
2
↓ + H
2
↑
5、Na与Cl
2、
反应(点燃):
第二章化学反应与能量
1、Ba(OH)
2·8H
2
O与NH
4
Cl的反应Ba(OH)
2
·8H
2
O+2NH
4
Cl==BaCl
2
+2NH
3
↑+10H
2
O
2、原电池原理(1)概念:原电池是把化学能转变成电能的装置(2)典型的原电池(Zn-Cu原电池)
典型的原电池(Zn-Cu原电池)
负极(锌):负极(锌):Zn - 2e- = Zn2+ (氧化反应)正极(铜):正极(铜):2H+ + 2e- = H
2
↑(还原反应)电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn + 2H+ = Zn2+ + H
2
↑
第三章有机化合物
1、甲烷的主要化学性质
(1)氧化反应(与O
2的反应):CH
4
+ 2O
2
−
−→
−点燃 CO
2
+ 2H
2
O
(2)取代反应(与Cl
2
在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质
(1)氧化反应(与O
2的反应):C
2
H
4
+ 3O
2
−
−→
−点燃 2CO
2
+2H
2
O
(2)加成反应(与Br
2的反应): CH
2
=CH
2
+ Br
2
→ CH
2
BrCH
2
Br
(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:
① CH
2=CH
2
+ H
2
CH
3
CH
3
② CH
2=CH
2
+ HCl CH
3
CH
2
Cl(一氯乙烷)
③ CH
2=CH
2
+ H
2
O CH
3
CH
2
OH(乙醇)
(4)聚合反应:
(乙烯制聚乙烯) ①(氯乙烯制聚氯乙烯) ②3、苯的主要化学性质:
(1)氧化反应(与O 2的反应):2C 6H 6+15O 2 −−→−点燃 12CO 2+6H 2O (2)取代反应
① 与Br 2的反应: + Br 2
−−→−3
FeBr + HBr ② 2味、密度大于水的油状液体——硝基苯。
+ HO-NO 2
浓硫酸 △
+ H 2O
用镍做催化剂,苯与氢发生加成反应: + 3H 2 −−
→−催化剂
4、乙醇的重要化学性质
(1)乙醇与金属钠的反应: 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑
(2)乙醇的氧化反应
①乙醇的燃烧: CH 3CH 2OH + 3O 2 −−→
−点燃
2CO 2 + 3H 2O ②乙醇的催化氧化反应 2CH 3CH 2OH + O 2 −−→−Ag
Cu 或 2CH 3CHO(乙醛) + 2H 2O ③乙醇在常温下的氧化反应
CH 3CH 2OH −−−−−−−−→
−或酸性重铬酸钾溶液
酸性4KMnO CH 3COOH
5、乙酸的重要化学性质 (1) 乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO 3):
2CH 3COOH + CaCO 3
(CH 3COO)2Ca + H 2O + CO 2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体: 2CH 3COOH + Na 2CO 3
2CH 3COONa + H 2O + CO 2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2) 乙酸的酯化反应
①反应原理(与乙醇的反应):
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、①蔗糖水解反应:C 12H 22O 11 + H 2O→C 6H 12O 6 + C 6H 12O 6 ②淀粉(纤维素)水解反应: ③油脂的重要化学性质——水解反应
—NO 2 Br
a)油脂在酸性条件下的水解
油脂+H
2O−→
−酸甘油+高级脂肪酸
b)油脂在碱性条件下的水解(又叫皂化反应)
蛋白质 + H
2O−
−→
−酶等各种氨基酸
石油的催化裂化,例如:C
4H
10
裂化得到乙烯和乙烷:C
4
H
10
→C
2
H
4
+ C
2
H
6
一定条件下
例如,十六烷的裂化: C
16H
34
→ C
8
H
18
+ C
8
H
16
催化剂加热。
