最新常见的酸和碱人教版
九年级化学人教版下册-10.1常见的酸和碱-课件

课题1 常见的酸和碱
柠檬
山楂 “尝起来酸酸的”
酸桔子
“摸起来滑滑的”
1.常见的酸有盐酸(HCl)、硫酸(H2SO4)、 硝酸(HNO3)、还有磷酸(H3PO4)、碳酸(H2CO3)、 醋酸(CH3COOH)等。
从名称上看它们最后一个字都是“酸”,从 结构上看都含有氢离子(H+)
PH > 7 ___碱____性溶液
PH = 7 ___中____性溶液 PH值越小,溶液的____酸_性__越__强____________
PH值越大,溶液的____碱__性_越__强____________
1、某溶液PH值是6,加入下列溶液能使该 溶液的PH值升高的是( C D ) A PH=3 B PH=6 C PH=7 D PH=10
石蕊和酚酞是常见的两种酸碱指示剂
物质
食醋 石灰水 盐酸
实验现象记录
紫色石蕊 颜色变化
变红 变蓝 变红
无色酚酞 颜色变化
不变色 变红
不变色
氢氧化钠溶液
变蓝
变红
➢
小 结:
石蕊及酚酞试液变色规律
1、紫色石蕊试液遇酸溶液变红,遇碱溶液变蓝。 2、无色酚酞试液遇酸溶液不变色,遇碱溶液变红。
石蕊变色 酚酞变色 酸性溶液 红 色 无 色 中性溶液 紫 色 无 色 碱性溶液 蓝 色 红 色
如何用酸碱指示剂检验溶液的酸碱性?
检验酸性溶液的方法:取少量该溶液,滴 加紫色石蕊溶液,若紫色石蕊溶液变红色, 则该溶液为酸性溶液。
检验碱性溶液的方法:取少量该溶液,滴 加紫色石蕊溶液,若紫色石蕊溶液变蓝色, 则该溶液为碱性溶液。
或取少量该溶液滴加无色酚酞溶液, 若无色酚酞溶液溶液呈现红色,则说明该 溶液为碱性溶液。
初中化学人教第十单元 常见的酸和碱 知识点整理(全面,带答案)
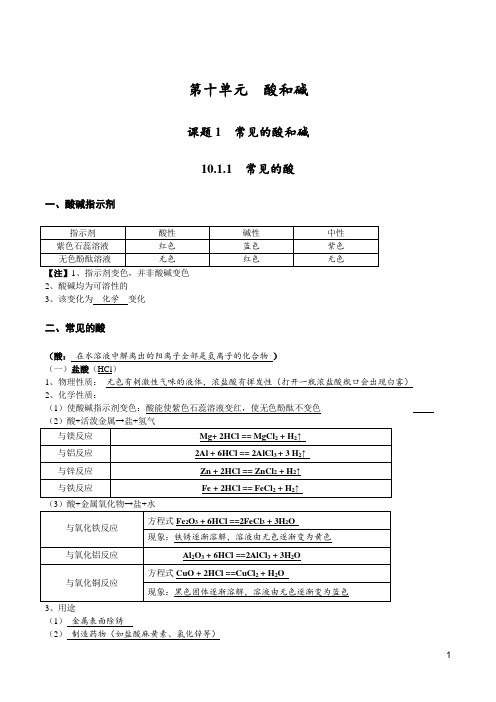
第十单元酸和碱课题1 常见的酸和碱10.1.1 常见的酸一、酸碱指示剂2、酸碱均为可溶性的3、该变化为化学变化二、常见的酸(酸:在水溶液中解离出的阳离子全部是氢离子的化合物)(一)盐酸(HCl)1、物理性质:无色有刺激性气味的液体,浓盐酸有挥发性(打开一瓶浓盐酸瓶口会出现白雾)2、化学性质:(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色(1)金属表面除锈(2)制造药物(如盐酸麻黄素、氯化锌等)(3)人体胃液中的含有盐酸,可帮助消化(二)硫酸(H2SO4)1、浓硫酸(1)物理性质:无色粘稠油状液体,无气味,浓硫酸具有吸水性(2)化学性质:腐蚀性(3)浓硫酸的稀释:将浓硫酸沿着烧杯壁慢慢注入水中,并用玻璃棒不断搅拌(4)浓硫酸的事故处理:先用大量的水冲洗,再涂3%-5%的碳酸氢钠溶液。
2、稀硫酸的化学性质(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色3、用途(1)用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油(2)金属除锈(3)汽车铅酸蓄电池中含有硫酸(4)浓硫酸在实验室常用作干燥剂三、酸的通性1、酸能与指示剂作用2、酸能与活泼金属反应3、酸能与金属氧化物反应4、酸能与碱反应5、酸能与盐反应注:酸溶液具有相似化学性质的原因:酸溶液中都含有H+四、复分解反应1、定义:两种化合物相互交换成分生成另外两种化合物的反应。
2、表达式:AB+CD=AD+CB3、反应前后各元素化合价不变(“变”或“不变”),属于基本反应类型。
4、10.1.2 常见的碱一、氢氧化钠(NaOH)1、俗称:烧碱、火碱、苛性钠2、物理性质:白色固体,易溶于水,溶解时放出大量的热。
3、化学性质(1)与酸碱指示剂反应:碱溶液能使紫色石蕊溶液变蓝,使无色酚酞变红、事故处理:先用大量的水冲洗,再涂上硼酸溶液5、制取:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (化学方程式)6、密封保存的原因:(1)NaOH固体容易吸收空气中的水分发生潮解。
人教版常见的酸和碱(13)

课题1 常见的酸和碱
一、酸和碱
本课小结
1、酸:由氢离子和酸根离子形成的化合物。 2、碱:由金属离子和氢氧根离子形成的化合物。
二、酸碱指示剂
1、定义: 能跟酸、碱的溶液起作用而显示不同 颜色的物质。
2、规律: 紫色石蕊溶液:酸红碱蓝中性紫 无色酚酞溶液:酸无碱红中性无
3、自制酸碱指示剂
课题1 常见的酸和碱
实验探究:向溶液中加酸碱指示剂
食 白 稀 石 溶 氢 醋 盐 灰 液氧
酸水 化 钠
白 稀 石 溶氢 醋 盐 灰 液氧
酸水 化 钠
课题1 常见的酸和碱
[实验10-1]
液体中有 的物质
变红色 变红色 变蓝色 变蓝色
不变色 不变色 变红色 变红色
醋酸(酸)
稀盐酸(酸) 氢氧化钙(碱) 氢氧化钠(碱)
课题1 常见的酸和碱
硫酸 H2SO4 氢氧化钠 NaOH 盐酸 HCl 硝酸 HNO3 氢氧化钙 Ca(OH)2 碳酸 H2CO3 氢氧化镁 Mg(OH)2
酸 碱
课题1 常见的酸和碱
一、认识酸和碱
2、碱:由金属离子和氢氧根离子形成 的化合物。(读作:氢氧化某)
氢氧化钙 Ca(OH)2 两碱
氢氧化钠 NaOH
将上述植物色素提取液分别滴入稀盐酸、澄清 石灰水中,观察颜色的变化,并记录。
课题1 常见的酸和碱
小试牛刀:
4、某学生取四种植物的花瓣的浸出液,用食醋、石灰 水实验花瓣变色情况,结果如下表所示:
问:(1)能做酸碱指示剂的是 A.B.D (填序号)。 (2)若玫瑰汁中加NaOH溶液,呈现的颜色是绿色 。 (3)小明用此大红花花汁检测造纸厂排放废液的酸 碱性,溶液显绿色,则此废液显 碱 性。
新人教版九年级化学下册:常见的酸和碱(二)课件.ppt

常见的酸和碱(一 二)
10
常见的酸和碱(二一)
②氢氧化钠跟二氧化碳的反应
11
常见的酸和碱(一 二)
氢氧化钠跟二氧化碳的反应示意
2NaOH+CO2=Na2CO3+H2O
12
常见的酸和碱(一 二)
13
常见的酸和碱(一 二)
HCl在水中会解离出H+和Cl-,H2SO4在水中会解 离出H+和SO42-;NaOH在水中会解离出Na+和OH-, Ca(OH)2在水中会解离出和Ca2+和OH-。
3
常见的酸和碱(一 二)
氢氧化钠曝露在空气中时容易吸收水分,表面 潮湿并逐渐溶解,这种现象叫做潮解。
氢氧化钠可做某些气体的干燥剂。
4
常见的酸和碱(一 二)
氢氧化钠有强腐蚀性
5
常见的酸和碱(一 二)
氢氧化钠有强烈的腐蚀性,所以,它的俗名 叫做苛性钠、火碱或烧碱。如果不慎将碱液沾到 皮肤上,要用较多的水冲洗,再涂上硼酸溶液。 注意:
第10单元 酸和碱 常见的酸和碱(二)
1
常见的酸和碱(一 二)
2
常见的酸和碱(一 二)
一、几种常见的碱
1、氢氧化钠(NaOH)
பைடு நூலகம்
实验
现象
观察氢氧化钠的颜色、 状态
白色固体
将氢氧化钠放在表面皿 表面潮湿并
上,放置一会儿
逐渐溶解
将氢氧化钠放入盛有少 量水的试管里,并用手 试管壁发热 触摸试管外壁
分析
氢氧化钠有吸 水潮解的性质 氢氧化钠溶解 时放出大量的 热
7
常见的酸和碱(一 二)
二、碱的化学性质
1、碱跟酸碱指示剂的反应
加紫色石蕊溶液 加无色酚酞溶液 氢氧化钠溶液 氢氧化钙溶液
最新人教版九年级化学下册第十单元《常见的酸和碱》实验说明和建议

《常见的酸和碱》实验说明和建议
1.【实验 10-1】石蕊溶液用0.5%的水溶液;酚酞溶液用0.5%的酒精溶液。
2.【实验10-3】实验前应提醒学生注意安全,不要将浓硫酸沾到皮肤和衣服上;实验应在玻璃片上做,做完后也应将物品放在玻璃片上。
浓硫酸最好由教师统一管理。
3.【实验10-7】氢氧化钠溶液不需很浓。
氢氧化钠溶液的浓度和鸡爪浸泡时间可自行掌握,但不宜使鸡爪腐蚀过度,否则难以取出。
氢氧化钠的腐蚀性很强,特别要注意不要溅到眼睛里。
4.【实验10-9】教材中的装置供参考,教学中可根据实验室情况自行设计实验装置。
为了节省实验时间,并便于学生记录和思考,也可将装置做成并联方式(如图1)。
图1 并联导电装置
建议导电性实验中所用溶液的配制比例及浓度:
盐酸:浓盐酸和水的体积比为1∶11
硫酸:浓硫酸和水的体积比为1∶34
氢氧化钠溶液:0.5 mol/L
氢氧化钙溶液:饱和溶液。
(最新整理)人教版九年级化学10.1常见的酸和碱(共37张PPT)

2021/7/26
1
课题1 常见的酸和碱
2021/7/26
2
教学目标
1. 认识几种常见酸和碱的主要性质和用途。 2. 会用酸碱指示剂验证溶液的酸碱性。 3. 认识酸和碱的腐蚀性以及使用时的安全注意事 项。
2021/7/26
3
“酸” 对你来说一定不陌生。调味用食醋有酸 味, 是因为食醋中含有醋酸;一些水果有酸味, 是 因为水果中含有各种果酸。“碱” 对你来说可能不 如酸那样熟悉, 其实你也遇到过。石灰水中含有氢 氧化钙,炉具清洁剂中含有氢氧化钠,它们都属于碱。 酸和碱是两类不同的物质。
2021/7/26
8
资料卡片 酸碱指示剂的发现
英国科学家波义耳在一次实验中不慎将浓盐酸溅到一 束紫罗兰花的花瓣上,喜爱花的他马上进行冲洗,一会儿 却发现紫色的花瓣变红了。惊奇的他没有放过这一偶然的 发现,而是进行了进一步的实验和思考。结果发现,许多 种植物花瓣的浸出液遇到酸性溶液或碱性溶液都能变色, 其中变色效果最好的是地衣类植物——石蕊,这就是最早 使用的酸碱指示剂。之后,人们从地衣类植物中提取蓝色 粉末状的石蕊色素,制成了酸碱指示剂。
讨论:上面反应的生成物有什么共同之处?
2021/7/26
22
(3)在盛有稀盐酸和稀硫酸的试管里分别放入一根生 锈( 铁锈的主要成分是Fe2O3) 的铁钉,过一会儿取出铁钉, 用水洗净,铁钉表面和溶液颜色有什么变化?
现象
化学方程式
铁锈+ 稀盐硫酸 铁锈消失,铁钉变得 光亮,无色溶液变黄
Fe2O3 + 6HCl=2FeCl3 + 3H2O
2021/7/26
19
常见的酸和碱PPT课件42 人教版

巩固练习:
5.下表是四种花的提取液实验的(酒精用于提取花中的色素)
大红花 紫罗兰 万寿菊
酒精中 粉红色 紫 色 黄 色
酸溶液中 橙 色 红 色 黄 色
碱溶液中 绿 色 蓝 色 黄 色
大红花、紫罗兰 ⑴上表中能做酸碱指示剂的花汁是; ____________ ⑵将厨房中的少量白醋滴入大红花的花汁中,可以 橙色 ; 看到的现象是_________ ⑶若将紫罗兰提取液滴入氯化钠溶液中,则可看到 紫色 的现象是____________ 。
①
汽水 红色 无色
②
白醋 红色 无色
③
盐酸 红色 无色
④
⑤
⑥
NaOH 蒸馏水 石灰水 溶 液 紫色 无色 蓝色 红色 蓝色 红色
象紫色石蕊和无色酚酞等能跟酸或碱的溶液起 作用而显示不同的颜色的物质叫做酸碱指示剂。 石蕊和酚酞溶液是常用的酸碱指示剂。
酸碱指示剂在不同液体中的变色 情 况
酸性溶液 紫 色 石 蕊 溶 液 无 色 酚 酞 溶 液 红色 无色 中性溶液 紫色 无色 碱性溶液 蓝色 红色
思考:它们为什么可以作代用酸碱指示剂?
指 示 剂 (溶 液)
食醋
在不同溶液中的颜色变化 石灰水 盐酸 氢氧化钠溶液
紫色菊花瓣汁
金盈菊花瓣汁 三角梅花瓣汁 紫色包菜叶汁
红色
黄色 红色 红色
绿色
黄色 黄色 绿色
红色
黄色 红色 红色
绿色
黄色 黄色 绿色
讨论:上述实验结果,哪些可以作酸碱指示剂, 哪些不可以作酸碱指示剂,原因是什么?
紫萝卜
自 制 指 示 剂 原 料
美人
胡萝卜
紫包菜
焦
植物花朵的酒精浸出液在
人教版初中化学九下10.1常见的酸和碱常见碱变质的问题说课稿

3.碱的变质对实验和实际应用的影响。
4.如何防止碱的变质。
(二)教学目标
1.知识与技能:
-掌握常见酸和碱的性质,能够鉴别不同的酸和碱。
-理解碱的变质原因,掌握碱的变质过程中发生的化学反应。
-学会防止碱变质的方法,能够应用到实验和实际生活中。
2.过程与方法:
-通过观察、实验等方法,探究酸和碱的性质及鉴别方法。
课后作业的布置旨在巩固学生的知识,提高他们的独立思考和应用能力。我会布置以下作业:
1.完成一些书面练习题,包括选择题、填空题和解答题,以检验学生对课堂内容的掌握。
2.设计一个小实验,让学生在家中观察某种碱的变质现象,并撰写实验报告。
3.要求学生思考碱变质对日常生活和环境可能造成的影响,并提出自己的预防措施。
2.安排小组实验,让学生亲自操作,观察碱变质的现象,并记录实验结果。
3.提供一些实际问题情境,要求学生运用所学知识提出解决碱变质问题的方案。
4.组织学生进行小组讨论,分享实验经验和学习心得,互相学习和借鉴。
(四)总结反馈
在总结反馈阶段,我将采取以下措施引导学生自我评价,并提供有效的反馈和建议:
1.我会让学生回顾本节课的学习内容,总结自己学到了哪些新知识,哪些地方理解得较好,哪些地方还需要进一步学习。
二、学情分析
(一)学生特点
本节课所面向的学生为初中九年级学生,他们处于青春期,具有以下特点:年龄特征上,他们好奇心强,对未知事物充满探索欲望;认知水平上,已经具备了一定的化学基础知识,能够理解基本的化学概念和原理;学习兴趣上,对实验操作和实际应用有较高的兴趣,喜欢通过实践来学习;学习习惯上,学生可能习惯于记忆性学习,而缺乏深度思考和探究的习惯。因此,在教学中需要引导学生从记忆型学习转向理解型和探究型学习。
人教版九年级下册化学 第十单元 酸和碱 常见的酸和碱

C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中, 并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
11.下列物质可以利用金属和稀盐酸直接制取的是(AB )
A.MgCl2
B.FeCl2
C.CuCl2
铜与盐酸
D.生Fe成Cl3
不反应
FeCl2
巩固练习
13.将锈铁钉放入稀盐酸中看到哪些现象?并写出 化学方程式。
为了防止发生事故,在稀释浓硫酸时,一 定要_将__浓_硫__酸__沿__着_杯__壁__慢__慢_注__入__水__中_____, 并不断搅拌。
巩固练习
下列说法错误的是( B )
A.浓盐酸放置一段时间后,溶液的质量会减少
B.浓盐酸在空气中会冒白烟 应该是冒白雾
C.浓硫酸敞口放置一段时间后,溶液的质量会增加 D.浓硫酸溶于水时会放出大量的热
①酸能使酸碱指示剂显示不同的颜色; ②酸能与多种活泼金属反应,生成氢气; ③酸能与某些金属氧化物反应,生成水。
练习:向放有铁锈的钉子的试管中加入过量盐酸,充分 反应后,铁锈消失, 并有气泡产生,写出有关反应的化学方 程式:__F_e_2_O_3_+__6_H_C_l_=__2_F_e_C_l_3_+_3_H__2O_、 ____F_e_+__2_H_C__l =__F_e_C_l_2_+_H__2_↑______ .
1.在不同的酸溶液中都含有相同的H+,因此不同的酸的化学 性质是相似的。
(2)酸溶液能与活泼金属反应(请回忆第八单元并填表)
与稀盐酸反应
与稀硫酸反应
镁 Mg+2HCl=MgCl2+H2 ↑ Mg+H2SO4=MgSO4+H2 ↑ 锌 Zn+2HCl=ZnCl2+H2 ↑ Zn+H2SO4=ZnSO4+H2 ↑ 铁 Fe+2HCl=FeCl2+H2↑ Fe+H2SO4=FeSO4+H2↑
九年级化学下册 10.1《常见的酸和碱》课件1 (新版)新人教版

选择颜色变化明显的植物色素提取液作为酸碱 指示剂,并检验稀盐酸、氨水、食盐水等溶 液的酸碱性。
花的颜色
一般花瓣内通常含有两种色素。这些色素在不同的 温度、不同的酸碱性环境下,呈现不同的颜色。不 同的花,花瓣中两种色素的含量不同,由于花瓣内 的酸碱性不同,因此花会呈现不同的颜色。同一种 花,在开放的不同时期,花瓣中两种色素的含量不 同,花瓣内的酸碱性不同,花也呈现不同的颜色。 这就有“百花盛开,万紫千红”美丽景观的描绘。
4.浓硫酸的稀释:
在稀释浓硫酸时,一定要把浓硫 酸沿器壁慢慢注入水里,并不断搅拌。 切不可将水倒入浓硫酸里。
WHY?
我入水中较安全; 水入我中真危险。 我与水合多放热; 实验牢记保平安。
打一实验操作
你想怎样给酸分类?
H2SO4 HNO3 H3PO4 HClO3
HCl H2S HF CH3COOH
实验现象记录
提问:
以上四种物质,哪些可能是酸, 哪些可能是碱?
酸碱指示剂与酸碱溶液作用时显示 的颜色:
溶 液 试 液
酸
溶 液
碱
溶 液
石 蕊 试 液
变
红 色
变
蓝 色
自制酸碱指示剂
收集不同颜色的新鲜花瓣或紫萝卜皮,各取适 量,研碎,加入适量水和酒精(两者体积比 为1:1),浸泡,过滤,得到植物色素提取液。 将提取液分别装入小试剂瓶中备用。
判断金属跟酸能否发生置换 反应及其反应的快慢的条件:
1.排在氢前面的金属才能置换 酸中的氢. 2.酸指盐酸和稀硫酸,不能用 浓流酸、硝酸。
3.生成的盐必须是可溶。
酸+金属氧化物 盐+水
第十单元 课题2 常见的酸和碱 第3课时 九年级化学下册人教版2024

注意:不是所有 的盐都含有金属 离子(如铵盐—
NH4NO3)
金属离子 酸根离子
NaCl、CuSO4 、CaCO3 、Na2CO3、FeSO4
Expand and improve
生成盐和水的反应,不一定都是中和反应。 如: 1.酸+金属氧化物→盐+水
Fe2O3+6HCl= 2FeCl3+ 3H2O 2.碱+非金属氧化物→盐+水
2、将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均无明显 现象。混合后相关变化的微观示意图如图,下列说法正确的是( D )
A.物质间均未发生化学反应 B.变化中都有新物质产生 C.混合后溶液酸碱性都不变 D.图甲可表示酸碱反应的实质
3、室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边 滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相关 叙述错误的是( C )
CO2+2NaOH=Na2CO3+H2O 强调:中和反应特指酸和碱反应生成盐和水
中和反应图像分析C
B点
B-C
溶液颜色
红色 粉红色
无色 无色
溶质 NaOH NaOH、NaCl NaCl NaCl、HCl
1、某实验小组测得稀盐酸和氢氧化钠溶液反应的pH随时间变化曲线(图1)、电导率随 时间变化曲线(图2)(电导率的数值越大,溶液的导电性越强)。下列说法正确的是
1、如图是室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线。 下列说法不正确的是( D )
A.实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中 B.a点到b点pH变化的原因是H+和OH﹣发生反应 C.b点时,参加反应的HCl与NaOH的质量比为36.5:40 D.c点时,溶液中的Na+个数大于Cl﹣个数
人教版九年级下册化学 第十单元 酸和碱 《常见的酸和碱》教学课件

铁锈溶解,溶液变黄 氧化铜溶解,溶液变蓝
新知学习
2.酸的通性
(1)酸与指示剂的作用
酸溶液能使紫色石蕊试液变红色;无色酚酞试液不变色 (2)酸与某些金属的反应
如:Zn + 2HCl === ZnCl2 + H2↑ Zn + H2SO4 === ZnSO4 + H2↑ Mg + H2SO4 === MgSO4 + H2↑ Fe + H2SO4 === FeSO4 + H2↑ Fe + 2HCl === FeCl2 + H2↑ 金属 + 酸 → 盐 + 氢气
(D)
A.食盐
B.石灰水
C.氢氧化钠溶液 D.稀盐酸
经典例题
知识点二、常见的酸 【典例2】下列物质质量置于空气中,一段时间后,质量 减小的是( C ) A.碳酸钙 B.氯化钠 C.浓盐酸 D.氢氧化钠
经典例题
知识点三、常见的碱 【典例3】下列有关Ca(OH)2的说法,错误的是( B ) A.俗称熟石灰或消石灰 B.可用于治疗胃酸过多症 C.可用于改良酸性土壤 D.可用于处理硫酸厂排出的酸性废水
实验
放置一会儿后 的现象
原理
用玻璃棒蘸 浓硫酸在纸上写字
用小木棍蘸 少量浓硫酸 将浓硫酸滴到 一小块布上
浓硫酸能夺取含 碳、氢、氧等元 素组成的化合物 里的水分( 氢、氧 元素 ), 生成黑色 的炭和水。
新知学习
思考:怎样稀释浓硫酸?
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而 是要将浓硫酸沿着容器壁慢慢注入水中,而且还要不断搅 拌吗?
打开瓶塞发生的现 象
无明显现象
