人类间充质干细胞库建设与管理规范
第二部分干细胞临床研究相关管理规范与文件

第二部分干细胞临床研究相关管理规范与文件前言干细胞技术促进了再生医学的发展,是继传统的药物治疗、手术治疗之后的又一场医疗革命,为人类治疗各种疑难疾病提供了新的视角、手段和方法。
随着干细胞技术的迅猛发展,其临床研究与应用的种类,也从最初单一的造血干细胞向脐带、胎盘、脂肪和乳牙等多种组织来源的干细胞发展,且发展的广度和深度也在不断加强。
围绕干细胞产业的发展,国家正加快形成与之相匹配的产业政策,并逐步完善落地。
为便于行业同仁系统了解目前国内干细胞行业有关的管理规范和文件,进一步发挥这些文件在实际工作中的指导作用,特将相关文件汇编,以供大家了解学习。
本汇编分为五部分:第一部分内容为脐带血造血干细胞相关管理规范与文件。
第二部分内容为干细胞临床研究相关管理规范与文件。
第三部分内容为干细胞制剂和免疫细胞制剂制备的质量管理自律规范。
第四部分内容为综合细胞库与细胞制备中心的建设与管理规范。
第五部分内容为细胞制品作为药物申报相关的药品管理规范。
目录一、干细胞临床研究管理办法(试行) (3)二、干细胞制剂质量控制及临床前研究指导原则(试行) (17)三、人体细胞治疗研究和制剂质量控制技术指导原则 (31)四、细胞治疗产品研究与评价技术指导原则(试行) (41)五、干细胞通用要求 (63)六、干细胞临床研究备案 (72)(一)、干细胞临床研究备案条件 (72)(二)、干细胞临床研究项目备案资料 (73)(三)、干细胞临床研究对干细胞制剂质量要求 (87)第二部分干细胞临床研究相关管理规范与文件一、干细胞临床研究管理办法(试行)第一章总则第一条为规范和促进干细胞临床研究,依照《中华人民共和国药品管理法》、《医疗机构管理条例》等法律法规,制定本办法。
第二条本办法适用于在医疗机构开展的干细胞临床研究。
干细胞临床研究指应用人自体或异体来源的干细胞经体外操作后输入(或植入)人体,用于疾病预防或治疗的临床研究。
体外操作包括干细胞在体外的分离、纯化、培养、扩增、诱导分化、冻存及复苏等。
喜格干细胞库建设之设计要求

《人间充质干细胞库建设与管理规范》DB33/T2030—2017SICOLAB干细胞库建设之设计要求范围:人间充质干细胞库、胎盘组织造血干细胞库的建设、操作规范、质量管理的基本方法。
适用:人间充质干细胞库、胎盘组织造血干细胞库建设与管理。
一、喜格选址要求1、选择周围环境较好的场地,空气质量标准应符合GB3095标准分级二级标准;2、不能建设在易发生自然灾害(地震、洪水、海啸等)的地区;3、不能建设在将要拆迁的建筑;不能建设在市政规划不明确区域。
二、建设基本要求1、干细胞库实验室建设与设计应与GB19489、GB50346、GB50591规定相符2、干细胞库实验室应包括业务区与办公区。
①业务区包括:样本接收室、干细胞制备室、配液室、检验室、干细胞存储室、更衣室、缓冲室、物料存储室、医疗垃圾存放室、消毒清洗室等(应标识洁净和风险级别)。
②办公区包括办公室、会议室、档案室和监控室等。
3、设计注意①洁净区、非洁净区完全分开。
②办公区域与实验区域的通风系统应独立分开;③不同科室应设有防污染措施,如缓冲间、气闸室和传递窗等。
4、人流、物流通道应独立设置,避免混杂和交叉污染。
5、物料、废弃物应设专用传递窗,并具备消毒灭菌功能。
6、办公区域与实验区域应进行物理隔离,工作人员由专用通道进入实验区。
7、门、窗、压差①洁净室内的密闭门应朝空气洁净度较高的房间开启并加设闭门器;②无窗洁净室的密闭门上宜设观察窗;③不同等级的洁净室、洁净区与非洁净区的压差,应不小于5Pa;④洁净区与室外的压差,应不小于10Pa。
8、建设材料应防渗漏、防火、耐腐蚀、防水和不起尘等,易于清洁和消毒灭菌。
9、库内所有窗户应为密闭窗,玻璃耐撞击、防破碎。
10、洁净室内不宜安装水池和地漏。
三、设施系统1、消防要求①应符合GB50016要求。
②干细胞库内宜安装火灾自动烟感报警装置、消防疏散警示标识、紧急逃生通道、安全出口;③安全出口(全封闭的玻璃门,并备有安全锤),安全出口设计应能够使仪器设备进出。
干细胞制剂机构相关设施、环境和安全管理规范

干细胞制剂机构相关设施、环境和安全管理规范干细胞制剂机构相关设施、环境和安全管理规范:1、机构内应设立限制区,制备、贮存、检测、包装等可能影响细胞质量与安全的工作应在限制区域内进行。
限制区域应设立人员准入授权制度和登记制度,进入人员和进入时间应有记录。
加装门禁:卡、指纹识别,自动记录2、机构内应设置功能区。
功能区可包括细胞制备区、质量检测区、细胞贮存区、物料库区、医疗废物存放区、行政区、辅助区等。
各功能区总体布局应合理且不得互相妨碍。
其他:工作人员洗浴,重复应用的器皿洗刷消毒。
3、机构应建立在远离严重空气污染、水质污染、病原微生物(含未知或无检测手段的病原微生物)丰富的场所,应远离辐射、振动或噪声干扰的区域。
4、机构应采用高可靠性供电方式供电。
双路供电5、机构的内环境应清洁,地面、路面及运输等不应对细胞的制备和贮存造成污染。
不要养花6、细胞制备区、细胞贮存区、质量检测区应为相互独立或相互物理隔离的区域。
7、进入洁净区(室)的空气必须经过净化,并根据制备工艺要求划分空气洁净度级别,应符合协会质量管自律理规范要求。
8、与细胞制备和细胞贮存的质量要求相关的、在非完全密封状态下的细胞操作应在B级背景下的A级洁净等级进行。
9、洁净区内人员净化用室和制备用室的建筑面积应与工艺要求、空气洁净度等级和工作人员数量相适应。
10、细胞制备区中的有菌操作区和无菌操作区应有各自独立的空气净化系统,应配置状态标识(如工作中、消毒中等)。
11、洁净区的出风口和回风口设置应合理,不应产生空气流通的死角。
可能涉及高危致病因子的操作,其空气系统等设施应符合特殊要求。
正压全排、负压。
12、洁净区应配备良好的加湿、除湿、排风、除尘、降温、升温、消毒等设施。
臭氧、UV13、机构应建立洁净区环境监测的标准操作规程,应定期监测洁净区动态条件下的环境温度、湿度、尘埃粒子数和微生物数,监测结果应符合设计要求并记录存档。
14、洁净区与非洁净区之间应设置缓冲间。
喜格干细胞库建设之操作规范

《人间充质干细胞库建设与管理规范》DB33/T2030—2017SICOLAB干细胞库建设之操作规范范围:人间充质干细胞库、胎盘组织造血干细胞库的建设、操作规范、质量管理的基本方法。
适用:人间充质干细胞库、胎盘组织造血干细胞库建设与管理。
一、概要1、符合GB/T22278要求,并严格按照标准和规范执行;2、制定相应标准和管理规范(样本采集、运输、接收、分离、培养、冻存和复苏等涉及干细胞操作所有过程);3、人组织样本采集由专业的医护人员完成,样本制备由经过专业培训的人员完成。
二、样本采集场所1、洁净手术室(无菌采集):人组织样本。
2、无洁净级别要求:人月经血样本、乳牙样本(并保持个人基本卫生)。
3、Ⅱ级洁净手术室要求:新生儿脐带、胎盘、骨髓样本。
4、Ⅲ级洁净手术室要求:脂肪组织样本。
三、样本采集方法1、新生儿脐带来源间充质干细胞①胎儿分娩后,在距胎儿脐部5cm至8cm处,用止血钳分别夹住脐带上下两端,消毒剂消毒脐带。
②用消毒剪刀于两钳中间断脐,截取至少15cm无针孔的脐带置于无菌采集瓶中,同时加入保存液以浸没脐带组织。
贴条形码作为唯一标识。
③脐带的两端需要用手术线结扎。
2、新生儿胎盘来源间充质干细胞或造血干细胞①胎儿娩出后,待胎盘与母体完全分离,用生理盐水充分清洗胎盘,再用75%医用酒精快速冲洗表面。
②迅速将胎盘放入胎盘采集盒,再加入保存液予以全部浸没。
③采集盒密闭包装,并贴上条形码作为唯一标识。
3、人脂肪来源间充质干细胞①脂肪组织采集过程由整形科医生实施,需制定抽脂方案和术前术后的防感染措施。
②行脂肪抽吸术时应尽可能保证抽脂过程无菌,采集完毕转移至采集瓶中,确保密封,并贴上条形码作为唯一标识。
4、人骨髓来源间充质干细胞①骨髓组织采集前应联系负责骨髓采集医师,制定骨髓穿刺方案和术前术后的防感染措施。
②行骨髓穿刺术,抽取骨髓液,即时转移至无菌采集瓶中保存,确保密封,并贴上条形码作为唯一标识。
5、人子宫内膜来源间充质干细胞①组织来源:手术切除成年女性子宫内膜增厚组织或子宫内膜异位组织,置于采集液中保存,并贴上条形码作为唯一标识。
喜格干细胞库建设之干细胞质量检验要求
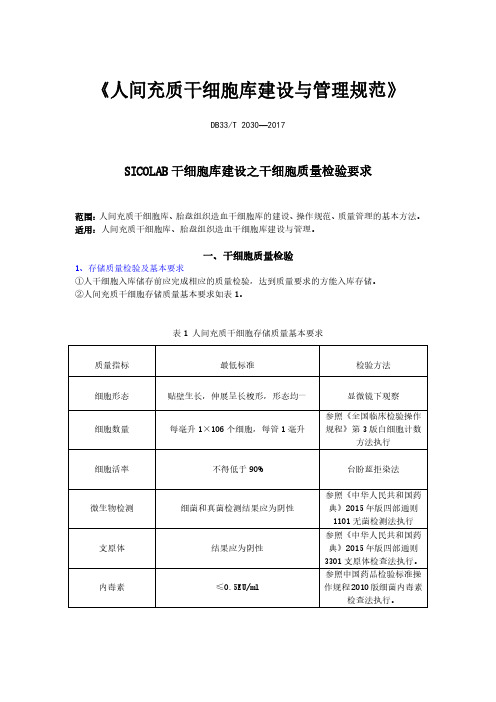
《人间充质干细胞库建设与管理规范》DB33/T2030—2017SICOLAB干细胞库建设之干细胞质量检验要求范围:人间充质干细胞库、胎盘组织造血干细胞库的建设、操作规范、质量管理的基本方法。
适用:人间充质干细胞库、胎盘组织造血干细胞库建设与管理。
一、干细胞质量检验1、存储质量检验及基本要求①人干细胞入库储存前应完成相应的质量检验,达到质量要求的方能入库存储。
②人间充质干细胞存储质量基本要求如表1。
表1人间充质干细胞存储质量基本要求质量指标最低标准检验方法细胞形态贴壁生长,伸展呈长梭形,形态均一显微镜下观察细胞数量每毫升1×106个细胞,每管1毫升参照《全国临床检验操作规程》第3版白细胞计数方法执行细胞活率不得低于90%台盼蓝拒染法微生物检测细菌和真菌检测结果应为阴性参照《中华人民共和国药典》2015年版四部通则1101无菌检测法执行支原体结果应为阴性参照《中华人民共和国药典》2015年版四部通则3301支原体检查法执行。
内毒素≤0.5EU/ml 参照中国药品检验标准操作规程2010版细菌内毒素检查法执行。
表2人胎盘造血干细胞存储质量基本要求病毒检测HIV 抗体、HBsAg、HCV 抗体、TP 抗体、CMV-IgM、HTLV 抗体、EBV 抗体检测应为阴性;HCV、HBV、HIV 病毒核酸检测应为阴性。
血清ELISA 检测核酸检测细胞表型CD73、CD90和CD105阳性率不低于95%;CD45、CD34、CD14、CD19和HLA-DR 阳性率不高于2%。
采用流式细胞术进行测定染色体核型染色体数量应为46,XX/XY,无染色体缺失、异位和重排现象采用G 带分析法进行测定三系分化能力在体外条件培养基诱导培养下,能够分化成脂肪、成骨和软骨细胞采用国际惯用(条件培养基)方法质量指标最低标准检验方法有核细胞数量总数应不少于5×108个参照《全国临床检验操作规程》第3版血细胞自动分析仪检测有核细胞数量细胞活率不得低于90%台盼蓝拒染法微生物检测细菌和真菌检测结果应为阴性参照《中华人民共和国药典》2015年版四部通则1101无菌检测法执行支原体结果应为阴性参照《中华人民共和国药典》2015年版四部通则3301支原体检查法执行。
《细胞库质量管理规范》起草说明

《细胞库质量管理规范》起草说明一、起草背景在我国,细胞治疗产业正以50%的年复合增长率快速发展。
目前,国内已形成了近百家不同规模的公司,并建立多家产业化基地,覆盖了从细胞存储到细胞制剂制备、细胞治疗技术研发等各个方面。
为了促进细胞治疗产业的有序管理和健康发展,多年来国家相关部门采取了多项措施,1999年卫生部发布了《脐带血造血干细胞库管理办法》(试行),并随后在全国范围批准了7家脐血库。
随着细胞治疗技术的发展,细胞存储业务的产业化发展速度很快,目前很多机构开展了间充质干细胞存储和免疫细胞存储业务。
虽然国家在之后相继发布了一些政策法规以规范细胞制剂的研发和临床应用,进行了干细胞临床治疗和免疫细胞临床治疗的专项整顿,对规范细胞治疗产业的发展起到了良好的作用,但是在细胞存储方面仍然缺少对相关机构的监管与规范。
高质量的细胞制剂研发制备和高质量的细胞治疗离不开高质量的细胞存储。
只有确立了安全、规范、稳定、可追溯的细胞存储的管理,才能从源头保证制备出符合质量标准的细胞制剂,并进一步保证细胞制剂临床应用和研究的安全性。
在缺少监管和规范的情况下,细胞储存机构良莠不齐,竞争无序,细胞存储质量难以保证,严重影响细胞产业的健康发展。
此外,由于缺乏统一的行业标准和管理规范,各细胞库之间,细胞库与细胞制备机构和应用机构之间无法进行正常的评估和交流,阻碍了细胞治疗产业的专业化发展,一定程度上导致社会资源的重复投入和浪费。
综上所述,目前国内的细胞存储产业急需一部覆盖本领域的细胞库质量管理规范。
二、起草过程2015年12月5日,中国医药生物技术协会根据专家共识启动了《细胞库质量管理规范》(以下简称《规范》)的编制工作,授权中国医药生物技术协会骨组织库分会和浙江金时代生物技术有限公司组织编写,并成立了由多名行业内骨干企业的专家组成的起草小组。
2015年12月18日,《规范》起草小组在湖州召开了开题论证会,制定了大纲的草稿、任务分工和时间表。
临床研究用人间充质干细胞质量检验规范-讨论版

临床研究用人间充质干细胞质量评价规范(讨论稿)前言人间充质干细胞(human MSCs, hMSCs)是一类具有一定的自我复制更新和多向分化潜能的成体干细胞,广泛存在于胎儿和成人各组织中,如骨髓、脂肪、皮肤、牙髓、肌腱,以及新生儿附属组织,如脐带、胎盘、羊膜等等组织。
除一定程度的分化潜能外,hMSCs还具有独特的免疫调控和组织再生功能,参与调控异常免疫反应、维护免疫平衡,帮助机体形成有利于病损组织细胞修复或再生的微环境,以促进损伤组织细胞的修复或再生。
hMSCs独特的生物学功能决定了其应具有广泛的临床适应症,并使其成为近十年来细胞治疗领域中发展最为广泛、最为迅速的干细胞类型。
过去10年来所积累的大量临床前及临床研究数据显示,不同组织来源的hMSCs均具有不同程度,针对不同临床适应症的治疗效果。
目前在登记的各种自体或异体组织来源的hMSCs临床适应症类型或疾病亚型已有上百种,其中常见的临床适应症类型包括骨关节疾病、心血管疾病、器官功能衰竭、神经退行性疾病、移植物抗宿主病、多发性硬化、脊髓损伤、炎性结肠炎、脊髓侧索硬化、系统性红斑狼疮,等等。
然而,无论是临床前或临床研究阶段,现有的研究结果仍都存在不同程度的问题,而所有问题又都不同程度地汇聚到hMSCs的质量问题上。
其中临床前研究所表现的问题是,不同研发者所使用的hMSCs来源、培养体系、制备工艺、质量标准、评价技术等存在很大差异,也存在质量评价内容和技术的合理性等问题,因此导致不同研究者间的研究结果很难具有可比性,或结果难以重复,因此也很难形成相对统一的质量标准。
而临床研究中所存在的问题是,绝大多数临床研究还处在早期阶段,所观察的病例数还很有限,临床研究中细胞质量的标准化和细胞使用的规范性仍存在巨大差异,所有这些尚不足以完全支持hMSCs的安全性和/或疗效。
除此以外,因hMSCs临床前研究还远不够完善,对其临床研究的指导作用还不强,或者临床前研究与临床研究存在严重脱节现象,临床研究阶段细胞质量的稳定性研究欠缺,细胞质量评价和受试者评估体系尚未建立,等等。
样本库行业相关的标准与规范(全文)

样本库行业相关的标准与规范(全文)随着近年来样本库行业的快速发展,业内各种标准和规范也相继出台。
去年我们梳理了样本库相关各种认可准则、行业标准、法律法规等文件,现予以增补,共34份,以供参考。
通用要求1.《ISO20387-2018 生物样本库质量和能力认可准则》(英文)专门征对样本库行业的国际认可准则。
2.《ISO20387-2018 生物样本库质量和能力认可准则》(CNAS版)由中国标准认可委牵头对国际认可准则ISO20387的汉化版本。
目前国内有两家单位通过该准则的认可,第一家是国家干细胞库,第二家是广州中医院生物资源中心。
3.《GBT37864-2019 生物样本库质量和能力通用要求》与ISO20387对标的样本库行业中国国家标准。
4.《ISBER 最佳实践-2018版》是国际生物及环境样本库协会(ISBER)出的样本库领域的最佳实践,2018版是第四版,全面介绍了样本库规划建设与管理、样本处理与存储、质量控制和安全等相关要求。
法律规范5.《中华人民共和国人类遗传资源管理条例》2019年7月1日正式实施的中国利用人类遗传资源进行科研活动方面的法律规范。
6. 《中华人民共和国生物安全法》内容管辖微生物、病毒、植物、动物和人体样本等多种样本库,2021年4月15日,正式实施。
7.《医疗卫生机构开展研究者发起的临床研究管理办法》国家卫生健康委为规范IIT研究制定的管理办法,征求意见阶段(2021.01.31)已结束。
伦理8.《涉及人的生物医学研究伦理审查办法》由国家卫生和计划生育委员会颁发的,于2016年12月1日正式实施的中国人体相关生物医学研究的法律规范。
9.《GBT38736-2020 人类生物样本保藏伦理要求》将于2020年11月1日正式实施的样本库领域关于人类生物样本保藏的伦理相关国家标准。
10.《人类生物样本库伦理审查范本-上海》系统规范样本库如何进行伦理审查的上海地区行业指导准则。
干细胞库管理制度

干细胞库管理制度第一章总则第一条为了规范干细胞库的管理工作,促进科学研究的顺利开展,保护干细胞样本的隐私和安全,特制定本制度。
第二条干细胞库管理制度是针对干细胞采集、保存、利用以及相关活动进行管理的规范性文件,适用于所有进行干细胞研究和应用的单位。
第三条干细胞库管理制度的主要内容包括干细胞采集管理、干细胞保存管理、干细胞利用管理、干细胞库安全管理、干细胞库信息管理等方面的规定。
第四条干细胞库管理制度的遵循性和执行力为干细胞库实际运营提供了有力的支持,也是干细胞库综合管理的基础。
第二章干细胞采集管理第五条干细胞库应当确保干细胞样本的采集过程符合伦理规范和法律法规的要求,确保采集程序的合法、科学和公正性。
第六条干细胞采集工作应当在具备相应资质和技术水平的医疗机构开展,确保干细胞的采集过程和设备符合相关标准和规范。
第七条干细胞采集对象应当签署知情同意书,对采集过程和可能产生的风险有清晰的了解,且应当尊重干细胞采集者的自愿原则。
第八条干细胞采集单位应当对采集、识别、分类和标记进行规范管理,确保采集样本的准确性、一致性和完整性。
第九条干细胞采集工作应当及时记录相关信息,包括采集时间、采集地点、采集操作人员、采集过程等,以确保数据的真实性和可追踪性。
第三章干细胞保存管理第十条干细胞库应当建立健全的干细胞保存体系,确保干细胞样本的安全、稳定和长期保存。
第十一条干细胞保存条件应当符合相关规范和标准,包括温度、湿度、光照等方面的要求,以确保干细胞样本的生物学特性不受影响。
第十二条干细胞库应当对保存的干细胞样本进行定期检测和评估,确保保存的干细胞样本质量的稳定和可靠性。
第十三条干细胞库应当建立样本储存和检索系统,明确干细胞样本的位置、数量、状态等信息,以便随时进行查询和管理。
第十四条干细胞库应当建立失效样本的处理机制,对长期未被利用或失效的干细胞样本进行安全销毁和记录,确保废弃样本的安全处理。
第四章干细胞利用管理第十五条干细胞库应当严格遵守相关法律法规和伦理准则,对干细胞的利用行为进行规范和管理。
人类间充质干细胞库建设与管理规范

5.2.1 空调与通风系统
5.2.1.1 通风系统应符合 GB/T 18883 的规定,气流由“清洁”空间向“污染”空间流动, 最大限度减少室内回流与涡流。 5.2.1.2 人类间充质干细胞库实验室空调系统应符合 GB 19489-2008 的规定,有足够的温 度和湿度控制能力,实验室各个区域的温度与湿度应控制在规定范围内。
5.2.2 照明系统
人类间充质干细胞库的照明系统应符合 GB 19489-2008 的规定,干细胞库及实验室的核 心工作区的照度不低于 350 勒克斯,其它区域不低于 200 勒克斯。
5.2.3 备用电源
3 术语和定义
1
SZDB/Z 126—2015
下列术语和定义适用于本指导性技术文件: 3.1
干细胞库 stem cell bank 用于储存不同来源干细胞的专门机构。 3.2 样本 specimen 在特定时间从受试者或捐献者中采集的器官、组织等标本。 3.3 接收区 receiving zone 样本到达时用于初步检查、清点接收或样本转移前进行包装、清点的缓冲区域。 3.4 冷藏区 refrigerated storage zone 为样本提供冷藏储存环境(2 ℃~8 ℃)或冷藏设备(温度为2 ℃~8 ℃)的区域。 3.5 冷冻区 frozen storage zone 为样本提供0 ℃以下储存环境或设备的区域。根据低温程度的不同,可分为普通低温 冷冻储存区(–4℃低温设备区)、超低温冷冻储存区(–86 ℃低温设备区)、深低温冷冻 储存区(–135 ℃以下低温设备区)。 3.6 细胞制备 cell preparation 细胞样本经过一系列规范处理达到入库标准的过程。 3.7 质量控制 quality control 为达到入库质量要求所采取的操作技术和活动。 3.8 样本编码 sample coding 根据编码规则对样本进行编号的过程。 3.9 细胞分离 cell isolation 从机体组织或器官中分离出单个细胞的过程。
临床级人体组织来源间充质干细胞质量控制管理规范

DB32/T3544-2019临床级人体组织来源间充质干细胞质量控制管理规范1范围本标准规定了临床级人体组织来源间充质干细胞制备的基本要求、操作规范和质量控制。
本标准适用于临床级人体组织来源间充质干细胞的样本采集、制备、冻存、复苏与质量控制。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB3095环境空气质量标准GB19489-2008实验室生物安全通用要求GB50073-2001洁净厂房设计规范GB50346实验室建筑技术规范GB50591洁净室施工及验收规范WHO实验室生物安全手册(第三版)药品生产质量管理规范(卫生部令第79号)中华人民共和国药典(2015年版)干细胞制剂质量控制及临床前研究指导原则(试行)(国卫办科教发﹝2015〕46号)T11/CSSCR001-2017干细胞通用要求(中国细胞生物学学会-干细胞生物学分会团体标准)3术语和定义下列术语和定义适用于本标准。
3.1临床级人间充质干细胞clinical grade human mesenchymal stem cells符合质量要求,可用于临床研究和应用的人多种组织来源(脐带血、脐带、胎盘、子宫内膜、脂肪、牙齿、骨髓等组织)间充质干细胞。
3.2伦理审查委员会ethical review committee负责对科学研究中涉及的伦理道德问题进行评估和审查的专门组织。
3.3科学审查委员会scientific review committeeDB32/T3544-2019负责对生物样本采集和使用的方案进行科学性审查的专门组织。
3.4生物安全委员会institutional biosafety committee负责制定生物安全政策和安全操作规范的专门组织。
3.5知情同意informed consent具有完全民事行为能力的自然人在重复获取信息并准确理解其内容后,作出接受或不接受样本采集的决定,此决定不受恐吓、利诱或其他不当行为的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
SZDB/Z 126—2015
下列术语和定义适用于本指导性技术文件: 3.1
干细胞库 stem cell bank 用于储存不同来源干细胞的专门机构。 3.2 样本 specimen 在特定时间从受试者或捐献者中采集的器官、组织等标本。 3.3 接收区 receiving zone 样本到达时用于初步检查、清点接收或样本转移前进行包装、清点的缓冲区域。 3.4 冷藏区 refrigerated storage zone 为样本提供冷藏储存环境(2 ℃~8 ℃)或冷藏设备(温度为2 ℃~8 ℃)的区域。 3.5 冷冻区 frozen storage zone 为样本提供0 ℃以下储存环境或设备的区域。根据低温程度的不同,可分为普通低温 冷冻储存区(–4℃低温设备区)、超低温冷冻储存区(–86 ℃低温设备区)、深低温冷冻 储存区(–135 ℃以下低温设备区)。 3.6 细胞制备 cell preparation 细胞样本经过一系列规范处理达到入库标准的过程。 3.7 质量控制 quality control 为达到入库质量要求所采取的操作技术和活动。 3.8 样本编码 sample coding 根据编码规则对样本进行编号的过程。 3.9 细胞分离 cell isolation 从机体组织或器官中分离出单个细胞的过程。
III
SZDB/Z 126—2015
人类间充质干细胞库建设与管理规范
1 范围
本标准规定了人体来源间充质干细胞库相关的生命伦理、间充质干细胞库建设、机构设 置、操作规范和安全管理的基本方法。
本标准适用于人体来源间充质干细胞库的建设与管理规范。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本 适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有修改单)适用于本文件。
GB/T 1.1-2009 标准化工作导则 第1部分:标准的结构和编写 GB 2894-2008 安全标志及其使用导则 GB/T 5458-2012 液氮生物容器 GB 7000.2-2008 应急照明灯具安全要求 GB/T 12905-2000 条码术语 GB 13690-2009 化学品分类和危险性公示通则 GB 15258 化学品安全标签编写规定 GB/T 17172-1997 417 条码 GB/T 18347-2001 128 条码 GB/T 18883-2002 室内空气质量标准 GB 19489-2008 实验室生物安全通用要求 GB 19652-2005 放电灯(荧光灯除外)安全要求 GB/T 20269-2006 信息安全技术信息系统安全管理要求 GB/T 22278-2008 良好实验室规范原则 GB/T 27025-2008 检测和校准实验室能力的通用要求 GB 50016-2006 建筑设计防火规范 GB 50034-2004 建筑照明设计标准 GB 50052-2009 供配电系统设计规范 GB 50140-2005 建筑灭火器配置设计规范 GB 50346-2012 实验室建筑技术规范 GB 50351-2005 储罐区防火堤设计规范 AQ 3013-2008 危险化学品从业单位安全标准化通用规范 CNAS-CL05-2009 实验室生物安全认可准则 MH/T 1019-2005 民用航空危险品运输文件 WS/T 224-2002 真空采血管及其添加剂 WHO Third Edition 实验室生物安全手册
II
SZDB/Z 126—2015
前言
本指导性技术文件按GB/T 1.1–2009给出的规则起草。 本标准由深圳市经济贸易和信息化委员会归口。 本标准负责起草单位:深圳华大基因研究院。 本标准主要起草人:周欣、张勇、张曦、冀旭、燕舞、林洁璇、张家文、黄海军、彭冬秀、孙长斌、 杨阳、黎苑杰。 本标准为首次发布。
ICS 07.080 C 04
SZDB/Z SZDB/Z 126—2015
深圳市标准化指导性技术文件
SZDB/Z 126-2015
人类间充质干细胞库建设与管理规范
2015 - 02 -06 发布
2015-03 -01 实施
I
深圳市市场监督管理பைடு நூலகம் 发 布
SZDB/Z 126—2015
目次
前言 .................................................................................III 1 范围 .................................................................................1 2 规范性引用文件 .......................................................................1 3 术语和定义 ...........................................................................1 4 生命伦理 .............................................................................4 5 人类间充质干细胞库建设 ...............................................................4 6 机构设置 .............................................................................5 7 操作规范 .............................................................................6 8 安全管理 ............................................................................10 附录 A(资料性附录)供者健康信息采集 ...................................................16 附录 B(资料性附录)人类间充质干细胞样本编码规则 .......................................17 附录 C(资料性附录)人类间充质干细胞库整体的操作流程 ...................................18 参考文献 ..............................................................................19
