第三节电解池
人教化学选修4第四章第3节 电解池(共28张PPT)

二、电解原理的应用
应用一:氯碱工业即电解饱和食盐水
阳极:2Cl- 阴极:2H+ +
2e-= Cl2如↑ 何检验两极产物? 2e- = H2↑
总反应:
电解
2NaCl + 2H2O==
CC
存在问题: 2NaOH + H2↑+ Cl22↑
H2+ Cl2=2HCl爆炸 氯气溶于水与水反应 氯气与NaOH反应产物不纯更纯
AgNO3溶液
当阳极金属与电解质溶液中的金属 阳离子相同,则为电镀
例:在50mL 0.2mol/L的硫酸铜溶液中插入两个
电极,通电电解(不考虑水分蒸发),则:
⑴若两极均为铜片,试说明电解过程中溶液
溶质浓度将怎样变化 不变
。
⑵若阳极为纯锌,阴极为铜片,阳极反应式
是 Zn -2e-=Zn2+
⑶如果两极均为铜片且不考虑H+在阴极上放电,
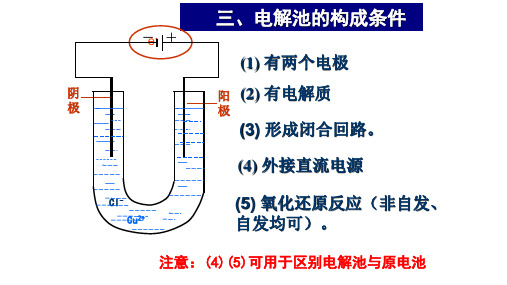
3、构成电解池的条件: ① 直流电源;
② 阴、阳电极
③ 电解质溶液或熔融电解质; ④ 形成闭合回路。
⑤非自发进行的氧化还原反应
原电池与电解池的比较
比较内容
原电池
电解池
装置举例 铜锌原电池
电解氯化铜
电极名称 正极、负极
阴极、阳极
电极反应 负极氧化反应 正极还原反应
能量转变 将化学能转变成电能
阳极氧化反应 阴极还原反应
实质:电解水
溶液pH变化: 增大 溶液复原方法:加入H2O
1、复习提问:
电极名称_阴__极____ C
反应类型_还__原____
C 电极名称__阳__极___
反应类型__氧__化___
电极反应_Cu_2+ _+_2e_- _= C_u 实验现象_红_色__固__体_
高中化学选修四电解池知识点

第三节电解池一、电解原理1、电解池:把电能转化为化学能的装置叫做电解池或电解槽。
2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程。
反应条件:①连接直流电源②阴阳两极阴极:与电源负极相连;极:与电源正极相连。
③两极处于电解质溶液或熔融电解质中④两电极形成闭合回路4、电子流向:电源负极一电解池阴极一离子定向运动(电解质溶液)一电解池阳极一电源正极5、电极名称及反应:阳极:与直流电源的正极相连的电极,发生氧化反应失去电子;阴极:与直流电源的负极相连的电极,发生还原反应得到电子。
7、电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程8、反应规律:阳极:活泼金属一电极失电子6“ Pt除外);惰性电极一溶液中阴离子失电子阴离子失电子能力:活泼金属(除Pt, Au)>S2->|->Br->Cl->OH->含氧酸根(NO3->SO42-)>F-阳离子得电子能力:Ag+>Hg2+>Fe3+>Cu2+>H+ (酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+ (水)>Al3+>Mg2+>Na+>Ca2+>K+ (即金属活泼性顺序表的逆向)规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
9、四类电解型的电解规律(当阳极为惰性电极时)①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。
电解质溶液复原一加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐),无氧酸pH变大,不活泼金属的无氧酸盐pH不变。
电解质溶液复原一加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。
人教版高中化学选修4第四章第三节 电解池 课件(共16张PPT)

湿润的 淀粉KI
试纸
滴几滴 酚酞
LOGO
【演示实验】
取一张用饱和NaCl溶液浸湿的滤纸,两根铅笔芯作电 极,接直流电源。
正极
负极
阳极
阴极
电解池 电解槽
电解:在直流电的作用下,两电极上分别发生氧化反应 和还原反应的过程叫做电解。
LOGO
Cl-
OH-
H+ OH-
发生还原反应
Cl-
Na+
H+
Na+
H+Cl-
CHl- + Na+
OH-
Na+Cl-
电解的总化学方程式:
阴极产物
阳极产物
2NLaOGCOl+2H2O 电解 2NaOH + H2 ↑ + Cl2 ↑
探秘电解时离子的放电顺序
【小组合作实验】
1.每组选出记录员、板书展示员和口头展示员各一名。
HCl CuCl2 NaCl
CuSO4
电解
2HCl== Cl2 ↑+ H2 ↑
电解
CuCl2== Cl2 ↑+ Cu
电解
2NaCl+2H2O 2NaOH + H2 ↑ + Cl2 ↑
电解
2CuSO4 +2H2O == 2Cu+O2↑ +2H2SO4
溶液变化 PH
减小 增大 不变
增大 增大
增大
减小
我比较
温 2.请按导学设计中的实验操作步骤,组装仪器,
馨
连接电路。认真观察实验现象,并做记录。
电解池知识点

第三节 电解池1.电解(1)定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。
在此过程中,电能转化为化学能。
(2)特点:①电解是不可逆的;②电解质导电一定发生化学变化。
2.电解池(1)概念:电解池是把电能转化为化学能的装置。
(2)电解池的构成条件 ①有与电源相连的两个电极。
②两个电极插入电解质溶液(或熔融电解质)中。
③形成闭合回路。
(3)电极名称及电极反应式以用惰性电极电解CuCl 2溶液为例:总反应方程式:CuCl 2=====电解Cu +Cl 2↑。
(4)电解池中电子和离子的移动方向①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流向电源的正极。
②离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极。
3.电解产物的判断及有关反应式的书写(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(勿忘水溶液中的H +和OH -)。
(3)排出阴、阳两极的放电顺序4.电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程☆规律总结:电解反应离子方程式书写: 稀溶液中离子放电顺序: 阳离子放电顺序Ag +>Hg 2+>Fe 3+>Cu 2+>H +(指酸电离的)>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H 2O>Al 3+>Mg 2+>Na +>Ca 2+>K + 阴离子的放电顺序是惰性电极时:活性金属>S2->SO32->I->Br->Cl->OH->H2O>NO3->SO42-(等含氧酸根离子)>F-是活性电极时:电极本身溶解放电注意先要看电极材料,是惰性电极还是活性电极,若阳极材料为活性电极(Fe、Cu)等金属,则阳极反应为电极材料失去电子,变成离子进入溶液;若为惰性材料,则根据阴阳离子的放电顺序,依据阳氧阴还的规律来书写电极反应式。
《电解池》PPT-课件【人教版】

串联电解池
• 先判断电极
• 串联的特点是两个电解池中通过的 电子数相等,每一个电极上得到或 失去的电子数相等。
《电解池》PPT-课件【人教版】优秀 课件( 实用教 材)
《电解池》PPT-课件【人教版】优秀 课件( 实用教 材)
2、下图所示装置中,a、b都是惰性电极, 通电一段时间后,b极附近溶液呈红色。下
3.用铂电极电解下表中各组物质的水溶液,电解一段时
间以后,甲、乙两池中溶液的pH值均减小,而在①和
④两极,电极产物的物质的量之比为1︰2的是( D )
A 甲 KOH 乙 CuSO4
甲 B
H2SO4 AgNO3
乙 C Na2SO4 HCl
D CuSO4 HNO3
《电解池》PPT-课件【人教版】优秀 课件( 实用教 材)
总反应:
电解
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
例2:用铜作电极电解Na2SO4溶液
阳极:
Cu - 2e- = Cu2+ 阴极:
2H+ + 2e- = H2↑
总反应:
Cu
+
电解
2H2O ==
Cu(OH)2
+
H2↑
例3:用Ag作电极电解AgNO3溶液 阳极:Ag - e- = Ag+ 阴极:Ag+ + e- = Ag 溶液中AgNO3浓度保持不变。
a负极:Zn-2e-=Zn2+ b正极:2H+ +2e-=H2
工作一段时间后溶液pH
增大
B池:电解池 c阳极:4OH--4e-=2H2O+O2
d阴极:Cu2+ +2e- = Cu 工作一段时间后溶液pH减 小
第三节 电解池

还原反应
+2Cl
–
通电
Cu + Cl2↑
尝试小结电解氯化铜溶液这一过程的特点和规律。 电源、电极、电极反应关系 与电源正极相连 阴离子移向 阳离子移向 阳极 阴极 发生氧化反应 发生还原反应
与电源负极相连
在溶液中存在Cu2+ 、Cl-、H+、OH-四种离子,为何发生氧
化还原反应的是Cu2+ 、Cl- ?
CuCl2
减小
Cu+Cl2↑
阳极
阴极 H2
Na2SO4溶液
O2
实例
电极反应 阳极:4OH--4e-====2H2O+O2↑
浓度
pH
Na2SO4
阴极: 4H++ 4e- ==== 2H2↑
变大
2H2O
电解
2H2↑ + O2↑
不 变
阳极
阴极
氯 气
实例
NaCl溶液
氢 气
浓度 pH
电极反应
阳极: 2Cl- -2e- ==== Cl2↑
第三节
电解池
电解法在元素发展史上的作用
如果提供的电解质溶液是CuCl2溶液,电极均为石 墨棒,请猜想并画出电解装置的草图。利用这个装置, 可能获得什么单质?这些单质分别在哪一个电极上生 成?
看视频,看阴阳两极有何变化?
[看完视频,回答下列问题] 实验现象: 阳极-与电源正极相连的碳棒有气泡 产生,且有刺激性气味, 能使湿润的KI-淀粉试纸变蓝. Cl2 阴极--- 与电源负极相连的碳棒上有红色 的固体析出. Cu
阳极产物 Cl2 和阴极产物 NaOH(H2)如何检验? 阳极: 使湿润的KI淀粉试纸变蓝 阴极: 滴入酚酞,溶液变红
人教版化学选修四第四章第三节《电解池 金属的电化腐蚀与防护》课件

主干知识梳理
(2)工作原理(以电解CuCl2溶液为例)
电极 名称
电极 材料
电极 反应
反应 类型
阴极(接电源负极)
石__墨__
C__u_2_+_+__2_e_-_=_=__=_C_u_ 还__原__反__应____
阳极(接电源正极)
__石__墨__
_2__C_l_-_-__2_e_-_=_=_=__C_l_2↑_ 碳
例2.电解原理在化学工业中有广泛应用。下图表示两个串联 的电解池。图中B装置中盛有1 L 2 mol·L-1Na2SO4溶液,A装 置中盛有1 L 2 mol·L-1AgNO3溶液。通电后,铂片上有气体 生成。
(1)电源X极为__负______极。 (2)B池中阳极电极反应式为___C_u_-_2_e_-_=_=_=_C_u_2_+_________,
(1)冶炼钠 2NaCl(熔融)=电==解==2Na+Cl2↑ 电极反应:
阳极: 2Cl--2e-===Cl2↑ ,阴极:2Na++2e-===2Na 。 (2)冶炼铝 2Al2O3(熔融)=电==解==4Al+3O2↑ 电极反应: 阳极:6O2--12e-===3O2↑ ,阴极:4Al3++12e-===4Al。
4.3.1电解池(电解池的工作原理)(课件)高二化学(沪科版2020选择性必修第一册)

二、电解池的相关规律
总结
01 书写电解池中电极反应式时,强电解质以实际放电的离
子表示,弱电解质写成化学式,总反应注明条件“通电”。
电极反应式的书写首先根据题干要求及信息写出反应
物和生成物,然后根据“阴(极)得(e-)阳(极)失(e-)”加
上得失电子数目,最后根据电解质溶液酸碱性补上H+、
02
OH-或H2O,依据电荷守恒配平。 酸性溶液中不能出现OH-,碱性溶液中不能出现H+。
其放电顺序: 活泼金属阳极>S2->I->Cl->OH->含氧酸根。
阳极发生氧化反应,还原性强的粒子优先放电
还原性: 活泼金属阳极>S2->I->Cl->OH->含氧酸根。
二、电解池的相关规律
思考 如何判断电解池 如何判断电解时电极产物?
惰性电极为铂、 金、石墨电极, 活性电极(除铂、 金、石墨电极之 外的电极)在阳极 时优先放电。
阳极反应式
2Cl--2e-===Cl2↑
阴极反应式
2H++2e-===H2↑
Cu2++2e-===Cu
pH变化
增大
——
复原加入物质
加入HCl
加入CuCl2
二、电解池的相关规律 3、电解质和水都发生电解型
用惰性电极电解酸、碱、盐溶液
电解质
NaCl
CuSO4
溶液中离子 Na+ 、Cl- 、H+ 、OH-Cu2+ 、SO42- 、H+ 、OH-
4 电解质溶液(或熔融电解质)的导电过程,就是电解质溶液(或熔融电
解质)的电解过程,是化学变化,而金属的导电是利用其物理性质。
5 电解法是一种强氧化还原手段,可以完成非自发的氧化还原反应。
高中化学-第三节 电解池
电解时离子放电顺序
1、阴极:阳离子放电,金属活动顺序的 顺序
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+ >Zn2+ >H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
得电子能力(氧化性)强的阳离子先放电
2、阳极:
(1)若阳极材料为活性电极---金属电极(除Pt 、Au、 外),则阳极电极反应为金属失电子
C2-uSO4 = Cu2++ SO4 阴极: H+ < Cu2+
H2O
H++OH- 阳极:OH- > SO4 2-
②、然后写电极反应式 :阴极: 2Cu2++4e=
阳极: 42OCHu - -4e=O2↑+2H2O
③、最后判断反应物和生成物,写出总方程式;
2Cu2++2H2O 电解 2Cu+O2↑+4H+ (电解离子方程式)
4H++O2 ↑+4Ag
反应物是银离子和氢氧根离子(水和硫酸银),
生成物是氧气,银和硫酸,电解水和溶质型
17
阳极: 阴极:
总反应:
C
C
熔融NaCl
四、电解质溶液发生电解的类型(惰性电极)
1.电解溶质型
例:CuCl2 HCl 2.电解水型
例:NaOH H2SO4 Na2SO4 3.放氢生碱型
例:NaCl KBr 4.放氧生酸型
考点.电解池和原电池的计算
电解池知识点

1.电解(1)定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。
在此过程中,电 能转化为化学能。
(2)特点:①电解是不可逆的;②电解质导电一定发生化学变化。
2.电解池(1)概念:电解池是把电能转化为化学能的装置。
(2)电解池的构成条件 ①有与电源相连的两个电极。
②两个电极插入电解质溶液(或熔融电解质)中。
③形成闭合回路(3)电极名称及电极反应式以用惰性电极电解CuCl 2溶液为例:电极名称:阴极反应类型:还原反应A电极反应式:产+2e-= Cu J电解总反应方程式:CuCl 2====Cu +Cl 2 f (4)电解池中电子和离子的移动方向①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流向电源的正极 ②离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极 3.电解产物的判断及有关反应式的书写(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(勿忘水溶液中的H +和OH -)。
(3)排出阴、阳两极的放电顺序4 .电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程☆规律总结:电解反应离子方程式书写: 稀溶液中离子放电顺序: 阳离子放电顺序Ag +>Hg 2+>Fe 3+>Cu 2+>H + (指酸电离的)>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H 2O>Al 3+>Mg 2+>Na +>Ca 2+>K + 阴离子的放电顺序第三节电解池CuQ 籀液电极名称:阳极J 反应类型:氧化反应电极反应式:2Cl--2e-=CK '是惰性电极时:活性金属〉S 2->SO 32->I ->Br ->Cl ->OH ->H 2O>NO 3->SO 42-(等含氧酸根离子)〉F - 是活性电极时:电极本身溶解放电注意先要看电极材料,是惰性电极还是活性电极,若阳极材料为活性电极(Fe 、Cu )等金属,则阳极 反应为电极材料失去电子,变成离子进入溶液;若为惰性材料,则根据阴阳离子的放电顺序,依据阳氧阴 还的规律来书写电极反应式。
第三节电解池

第四章第三节电解池教学目标:1.理解电解原理,初步掌握一般电解反应产物的判断方法2.了解氯碱工业,电镀,电冶金的原理3.掌握电解电极反应式的书写。
教学重点:电解原理及应用教学过程:我们知道化学能可以转变为热能,即反应热。
化学能也能转变为电能,用原电池装置。
今天这节课我们来学习电能如何转化为化学能。
第三节电解池一、电解原理[讲]:首先我们来比较金属导电和电解质溶液导电的区别。
[过渡]:电解质溶液导电的实质是什么呢?一起看实验。
[实验]:现象—一极有气泡,检验为氯气;另一极有红色的物质析出,分析为铜。
[讲]:要分析此现象我们得研究此装置,首先看电极。
1.电极阳极—与电源正极相连阴极—与电源负极相连惰性电极—只导电,不参与氧化还原反应(C/Pt/Au)活性电极—既导电又可参与氧化还原反应(Cu/Ag)问:通电前和通电时分别发生了怎样的过程?通电前:CuCl2=Cu2++2Cl- H2O H++OH-通电中:阳离子(Cu2+,H+)向阴极移动被还原;阴离子(Cl-,OH-)向阳极移动被氧化[讲]:即在电极上分别发生了氧化和还原反应,称电极反应。
2.电极反应( 阳氧阴还 )阳极:2Cl- -2e-=Cl2(氧化)阴极:Cu2++2e-=Cu(还原)总电解方程式:___________________放电:阴离子失去电子或阳离子得到电子的过程叫放电。
3.电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程叫电解。
讲:所以电解质溶液导电的过程,就是电解质溶液的电解过程。
电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置叫电解池或电解槽。
问:构成电解池的条件是什么?电源、电极、电解质溶液构成闭合回路。
[思考]:电解CuCl2水溶液为何阳极是Cl-放电而不是OH-放电,阴极放电的是Cu2+而不是H+?4.离子的放电顺序阴极:(阳离子在阴极上的放电顺序(得e-))Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+阳极(1)是惰性电极时:阴离子在阳极上的放电顺序(失e-)S2->I->Br->Cl->OH->NO3->SO42-(等含氧酸根离子)>F-(2) 是活性电极时:电极本身溶解放电[问]:电解水时为了增强水的导电性常常需加入氢氧化钠或稀硫酸,而不能加食盐原因何在?[练习]:写出电解碘化汞、硝酸铜、氯化锌、盐酸、硫酸、氢氧化钠溶液的电极反应式。
电解池课件.ppt

实验三:电解CuSO4溶液
CuSO4溶液
9
CuSO4 == Cu2+ + SO42-
H2O
H + + OH -
阳极:4OH- ─ 4e- = 2H2O + O2↑ 阴极:2Cu2+ + 4e- = 2Cu
2CuSO4+ 2H2O
电解 2Cu + O2↑+ 2H2SO4
10
4、解决电解问题的步骤:
6
实验二:电解NaCl溶液
7
3、离子的放电顺序 金属活动性顺序:
K Ca Na Mg Al Zn Fe(H)Cu Ag 逐渐减弱
(1)在阴极,阳离子得电子的能力:
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
逐渐增强
(2)在阳极,阴离子失电子的能力: I- > Br- > Cl- > OH- > 含氧酸根离子
第四章 电化学基础 第三节 电解池
点燃
Cu + Cl2===CuCl2
?
CuCl2 ===Cu + Cl2↑
2
实验一、电解CuCl2溶液
CuCl2溶液
3
4
1、电解的定义: 使电流通过电解质溶液而在阴阳两 极引起氧化还原反应的过程叫电解。
5
2、电解池的组成:
电极材料 电解质溶液 闭合回路 电源 导线
(1)分析溶液中的离子 (2)在阴极,根据阳离子得电子能力判断产物, 写出电极反应式 (3)在阳极,根据阴离子失电子能力判断产物, 写出电极反应式
(4)写出总反应方程式
11
5、讨论:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节电解池
一、教学目标:
1.理解电解原理,初步掌握一般电解反应产物的判断方法
2.了解氯碱工业,电镀,冶金的原理
3.掌握电解电极方程式的书写。
二、教学重点:
电解原理及应用
三、教学过程:
我们知道化学能可以转变为热能,即反应热。
化学能也能转变为电能,用原电池装置。
今天这节课我们就来学习电能如何转化为化学能。
第三节电解池
一、电解原理
过渡:电解质导电的实质是什么呢?一起看实验。
实验:现象—一极有气泡,检验为氯气;另一极有红色的物质析出,分析为铜。
讲:要分析此现象我们得研究此装置,首先看电极。
1.电极
阳极—与电源正极相连
阴极—与电源负极相连
隋性电极—只导电,不参与氧化还原反应(C/Pt/Au)
活性电极—既导电又参与氧化还原反应(Cu/Ag)
问:通电前和通电时分别发生了怎样的过程?
通电前:CuCl2=Cu2++2Cl- H2O H++OH-
通电中:阳离子(Cu2+,H+)向阴极移动被还原;
阴离子(Cl-,OH-)向阳极移动被氧化
讲:即在电极上分别发生了氧化还原反应,称电极反应。
2.电极反应( 阳氧阴还 )
阳极:2Cl- -2e-=Cl2 (氧化)
阴极:Cu2++2e-=Cu(还原)
总电极方程式:___________________
放电:阴离子失去电子或阳离子得到电子的过程叫放电。
3.电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程叫电解。
讲:所以电解质导电的实质便是——电解
电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置叫电解池或电解槽。
问:构成电解池的条件是什么?
电源、电极、电解质构成闭和回路。
思考:
电解CuCl2水溶液为何阳极是Cl-放电而不是OH-放电,阴极放电的是Cu2+而不是H+?
4.离子的放电顺序
阴极:(阳离子在阴极上的放电顺序(得e-))
Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阳极(1)是惰性电极时:阴离子在阳极上的放电顺序(失e-)
S2->I->Br->Cl->OH->NO3->SO42-(等含氧酸根离子)>F-(SO32-/MnO4->OH-)
(2) 是活性电极时:电极本身溶解放电
问:放电能力弱于H+和OH–的物质在水溶液中放电吗?
否,但亚铁离子浓度远大于氢离子浓度时,亚铁离子放电。
问:电解水时为了增强水的导电性常常需加入氢氧化钠或稀硫酸,为什么?可以加食盐吗?练习:电解碘化汞、硝酸铜、氯化锌、盐酸、硫酸、氢氧化钠的电极方程式。
5.电解规律:
(1)电解含氧酸、强碱溶液及活泼金属的含氧酸盐,实质上是电解水,电解水型。
问:初中电解水时加硫酸或氢氧化钠增强导电性,影响水的电解吗?
电解硫酸和氢氧化钠时为何H2和O2之比大于2?氧气溶解度大于氢气
又为何硫酸一定大于2,而氢氧化钠可能等于2?硫酸根可能放电。
(2)电解不活泼金属的含氧酸盐,阳极产生氧气,阴极析出不活泼金属,放氧生酸型。
练习:电解硫酸铜方程式。
加入下列哪些物质可以恢复到硫酸铜原来的溶液:氧化铜、氢氧化铜、铜、碳酸铜。
(3)电解不活泼金属无氧酸盐,实际上是电解电解质本身,分解电解质型。
(4)电解活泼金属(K/Ca/Na)的无氧酸盐,阴极产生氢气,阳极析出非金属,放氢生碱型。
6.电解中电极附近溶液pH值的变化。
(1)电极区域 A.阴极H+放电产生H2,阴极区域pH变大。
B.阳极OH-放电产生O2,阳极区域pH变小。
(2)电解质溶液中 A.电解过程中,既产生H2,又产生O2,则原溶液呈酸性的pH变小,原溶液
呈碱性的pH变大,原溶液呈中性的pH不变(浓度变大)。
B.电解过程中, 无H2和O2产生, pH几乎不变。
但象CuCl2变大
C.电解过程中,只产生H2, pH变大。
D.电解过程中,只产生O2, pH变小。
过渡:如果把阳极换成铜棒,阳极发生的反应就是铜自身溶解,如果电解质是硫酸,阴极析出的是什么?也是铜,这就是我们的铜的电解精炼法。
二、电解原理的应用
1.铜的电解精炼
阳极:粗铜棒
阴极:精铜棒
电解质:含铜电解质
问:精炼中硫酸铜的浓度怎样?基本不变,但变小。
过渡:若把阴极精铜棒换成铁棒,电解过程变吗?
不变,但不是精炼铜了,而叫电镀铜。
2.电镀铜
阳极:镀层金属
阴极:待镀金属(镀件)
电镀液:含镀层金属的电解质。
3.电解饱和食盐水——氯碱工业
问:1、电解饱和食盐水的阴极产物、阳极产物分别是什么?
2、转移的电子数和氢氧化钠的物质的量的关系?
3、从
Cl - Cl 2一定需要加氧化剂吗? 4、阴极产物和阳极产物能接触吗?
5、饱和食盐水为何需要精制?如何精制?
精制:步骤一、1)先加过量的BaCl 2和过量的NaOH (顺序可换),再加入过量的Na 2CO 3 2)过滤
3)加盐酸调节pH 为7
步骤二、送入阳离子交换塔除去Ca 2+、Mg 2+
等。
4.电冶金
电解熔融氯化钠:2NaCl(熔融)=(电解)2Na+Cl 2 适用范围:活泼金属K~Al 练习:
1、在水中加等物质的量的Ag +,Pb 2 +,Na +, SO 42-, NO 3- , Cl -,该溶液放在用惰性电极做电极
的电解槽中,通电片刻,则氧化产物与还原产物质量比为( ) A. 35.5:108 B. 16:207 C.8:1 D.108:35.5
2、用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质溶液能与原来完全一样的是
氯化铜加硫酸铜、氢氧化钠加氢氧化钠、氯化钠加氯化氢、硫酸铜加氢氧化铜 3、0.1摩氯化铜和0.1摩溴化钠共0.4摩电子转移,分析过程。
4、铁、C/硫酸——C 、C/氯化铜用导线相连,分析正负极和阴阳极及两装置的p H 的变化。
5、如何判断电解池的阴阳极?
与正极相连的、发生氧化反应的、阴离子移向的一极是阳极,反之是阴极。
如:高锰酸钾的做电解质,发现红色加深的是什么极?
湿润的淀粉KI 试纸并滴有酚酞,变红的是什么极?变蓝的是什么极?
6、以A 、B 两根石墨电极电解足量的硝酸银溶液,通电t 分钟,在B 极收到11.2mL 标况下气体,此后将电源反接,以相同的电流强度通电t/2分钟。
问:(1)A 、B 分别是什么极?(2)电源反接后A 、B 电极质量如何变化?(3)若溶液体积为200mL ,则通电t/2分钟时。
