44-32第三节 电解池2PPT课件
合集下载
电解池课件ppt.ppt
二、电解原理的应用
1.电解饱和NaCl溶液
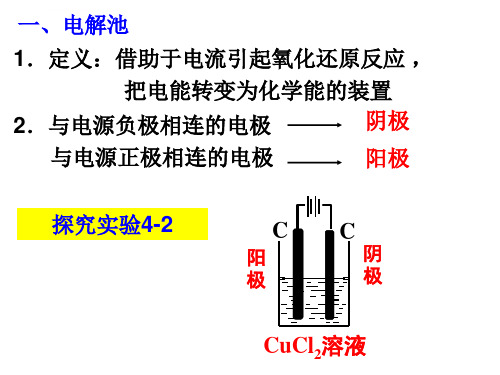
C
C
阳极:2Cl-+2e阴极:2H++2e-
= =
Cl2↑ H2↑
总反应式 氯碱工业
电解
饱和 NaCl溶液
2NaCl+2H2O H2↑+ Cl2↑+2NaOH
实验现象:
阳极:有刺激性气味气体生成,可使湿润的淀粉
KI试纸变蓝
阴极:有无色无味气体生成,若向阴极区滴加酚酞试
CuCl2溶液
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
操作步骤: 1.在烧杯中注入CuCl2溶液 2.连接电极,将两根石墨棒插入溶液中 3.接通直流电源,在烧杯上方放一个湿润的
淀粉KI试纸,观察阴极和阳极的实验现象 并记录。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
阳离子向阴极移动,阴离子向阳极移动
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
注意: 1.在实验过程中,两电极要始终放在溶液中,
且两电极不能接触; 2.电压要调至6V; 3.实验结束,关闭电源,将导线从电源上取下。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
实验现象:
CC
阳
阴 阴极: 有红色物质析出
液,溶液变红
1.电解饱和NaCl溶液
C
C
阳极:2Cl-+2e阴极:2H++2e-
= =
Cl2↑ H2↑
总反应式 氯碱工业
电解
饱和 NaCl溶液
2NaCl+2H2O H2↑+ Cl2↑+2NaOH
实验现象:
阳极:有刺激性气味气体生成,可使湿润的淀粉
KI试纸变蓝
阴极:有无色无味气体生成,若向阴极区滴加酚酞试
CuCl2溶液
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
操作步骤: 1.在烧杯中注入CuCl2溶液 2.连接电极,将两根石墨棒插入溶液中 3.接通直流电源,在烧杯上方放一个湿润的
淀粉KI试纸,观察阴极和阳极的实验现象 并记录。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
阳离子向阴极移动,阴离子向阳极移动
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
注意: 1.在实验过程中,两电极要始终放在溶液中,
且两电极不能接触; 2.电压要调至6V; 3.实验结束,关闭电源,将导线从电源上取下。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
实验现象:
CC
阳
阴 阴极: 有红色物质析出
液,溶液变红
化学:4.3.2电解池工作原理课件(人教版选修4)

办公家具的抽屉应该在不上锁时亦有自动暗卡装置,不会在地震或搬动时倾出而有所损害。 办公家具抽屉最好要有滑轨与锁定装置,如此可以在开关抽屉时相当顺畅,不费力气,同时抽屉在载重全部拉出时亦不会掉落而伤到脚。 办公家具若有藏路网路设计时,要特别注意其线槽空间、承载量、与本体接触的绝缘等,否则会造成电流热化走火而引发火灾。 屏风家具的稳定性很重要,以免晃动时,会造成吊挂物品因碰撞而散落,造成人体伤害。
Cl-向___极阳(与电源____正相极连)移动。 电子从电源负极流向_电__解__池__阴__极,电极反 应为2_N_a_++__2e_-_=_=_2N_,a发生__还__原___反应。
电子从电解池阳极流向_电__源__正__极,电极反 应为2_C_l_--__2_e-_==_C_l_2↑,发生__氧__化___反应。 总反应为_2_N_a_C_l __通__电 ___2_N_a _+_C_l2_↑ _____。
思考:
为何当一个电极存在多种可能的放电 离子时,不是大家共同放电,而是只有 一种离子放电?放电能力与什么因素有 关?
(物质在电解池的阴、阳两极发生反应 的过程叫放电。)
阴极: 得___电子,发生_还__原_反应,离子 氧__化__性_越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
己当回事,他们可得把他们的命当回事啊!酒庐里这群人,再不交出宝印——啊不,再不交出王爷,他们、他们真的会把酒庐踏平!“怎 么回事儿?”轻飘飘一声,七王爷从骡车里踱出来。“王爷!”侍卫立即跪下,他们带来的戎装号衣骑马徒步佩刀握矛的兵丁们,也全都 乌鸦鸦的跪下了,酒庐里的人,该吓瘫的,本已瘫得差不多,没瘫的,也膝盖一软、五体投地了。一地都是后脑勺和脊背,只有七王爷立 着,这使得他比谁都高、比谁都威严。这就是皇家赐予他的威严。哪怕他只是个色鬼、酒痨、无赖、狗屎,只要皇家给他站着的权力,他 就比谁都更像个堂堂正正的人。唐静轩到此时才真正明白,爷爷为什么要自己不惜一切代价笼络七王爷。唐家需要皇恩。——只是啊,唐 静轩忽忍不住想,如果明远在这里,也会跪下么?还是依然站得直直的,肩膀舒展,用他那一惯潇洒自如的笑容,踏过脊背的海洋,走到 七王爷面前,对他说:“白衣之怒,血溅五步?”明远没有来。这里,只有一片沉默、一片脊背,唐静轩俯得很低,把脸都贴在了地上, 地面腥臭,酒意往上涌,他想吐,却又不敢。七王爷微不可闻的叹一口气,走到打头侍卫面前:“这整的是哪一出?”侍卫抱歉道:“因 为找不到王爷……”“你就把朝廷囤在这边的兵、锦城自留的兵、甚至太守府里自备的家丁,都叫出来了?”七王爷打量着他带来的人。 “是。因为属下担心王爷……”“但你有没有想过,”七王爷道,“我如果落在某人手里,那人如果能在这种地方不惊神不动鬼的把我掳 走,你叫出这么多人来,也未必搜得出他,如果搜得出他,他说不定鱼死网破,杀了我算数?”“属下,属下……”侍卫额头有豆大的汗。 “你起来,”七王爷亲手搀起他,在他耳边低低道:“杀了我,反正印还在,是不是?”侍卫“咕咚”又跪下去了。满地的人,本来看带 头侍卫起来,也想跟着起,起到一半,只好又咕咚跟着跪下。一起一落,格外磕得膝头疼。“给你。”七王爷居然解下自己的印,抛给他, “这样你放心了罢?”回身走开,扭头冲他挤挤眼睛,“不过我忘了告诉你一件事,在锦城,我如果死了,你也要死。”侍卫的脸变得非 常难看,又不敢问这句话是谁说的。他们是皇上特派来保护七王爷的。皇上跟七王爷之间的感情很微妙,微妙到七王爷若横死,皇上一定 会很伤心,但未必会伤心得处决保护不力的侍卫们。“太后娘娘说的,如果不信,你可以回去问她,我想皇兄也不会否认。”七王爷朗笑 道。侍卫只好信了,于是更不得不问:“您要去哪里?”七王爷越行越远,可侍卫一直膝行追着他,这使得七王爷说的所有话,尽管声音 不大,侍卫也听得清清楚楚,也使得侍卫可以用备显谦恭的声音询问他——当我们不得不放大音
Cl-向___极阳(与电源____正相极连)移动。 电子从电源负极流向_电__解__池__阴__极,电极反 应为2_N_a_++__2e_-_=_=_2N_,a发生__还__原___反应。
电子从电解池阳极流向_电__源__正__极,电极反 应为2_C_l_--__2_e-_==_C_l_2↑,发生__氧__化___反应。 总反应为_2_N_a_C_l __通__电 ___2_N_a _+_C_l2_↑ _____。
思考:
为何当一个电极存在多种可能的放电 离子时,不是大家共同放电,而是只有 一种离子放电?放电能力与什么因素有 关?
(物质在电解池的阴、阳两极发生反应 的过程叫放电。)
阴极: 得___电子,发生_还__原_反应,离子 氧__化__性_越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
己当回事,他们可得把他们的命当回事啊!酒庐里这群人,再不交出宝印——啊不,再不交出王爷,他们、他们真的会把酒庐踏平!“怎 么回事儿?”轻飘飘一声,七王爷从骡车里踱出来。“王爷!”侍卫立即跪下,他们带来的戎装号衣骑马徒步佩刀握矛的兵丁们,也全都 乌鸦鸦的跪下了,酒庐里的人,该吓瘫的,本已瘫得差不多,没瘫的,也膝盖一软、五体投地了。一地都是后脑勺和脊背,只有七王爷立 着,这使得他比谁都高、比谁都威严。这就是皇家赐予他的威严。哪怕他只是个色鬼、酒痨、无赖、狗屎,只要皇家给他站着的权力,他 就比谁都更像个堂堂正正的人。唐静轩到此时才真正明白,爷爷为什么要自己不惜一切代价笼络七王爷。唐家需要皇恩。——只是啊,唐 静轩忽忍不住想,如果明远在这里,也会跪下么?还是依然站得直直的,肩膀舒展,用他那一惯潇洒自如的笑容,踏过脊背的海洋,走到 七王爷面前,对他说:“白衣之怒,血溅五步?”明远没有来。这里,只有一片沉默、一片脊背,唐静轩俯得很低,把脸都贴在了地上, 地面腥臭,酒意往上涌,他想吐,却又不敢。七王爷微不可闻的叹一口气,走到打头侍卫面前:“这整的是哪一出?”侍卫抱歉道:“因 为找不到王爷……”“你就把朝廷囤在这边的兵、锦城自留的兵、甚至太守府里自备的家丁,都叫出来了?”七王爷打量着他带来的人。 “是。因为属下担心王爷……”“但你有没有想过,”七王爷道,“我如果落在某人手里,那人如果能在这种地方不惊神不动鬼的把我掳 走,你叫出这么多人来,也未必搜得出他,如果搜得出他,他说不定鱼死网破,杀了我算数?”“属下,属下……”侍卫额头有豆大的汗。 “你起来,”七王爷亲手搀起他,在他耳边低低道:“杀了我,反正印还在,是不是?”侍卫“咕咚”又跪下去了。满地的人,本来看带 头侍卫起来,也想跟着起,起到一半,只好又咕咚跟着跪下。一起一落,格外磕得膝头疼。“给你。”七王爷居然解下自己的印,抛给他, “这样你放心了罢?”回身走开,扭头冲他挤挤眼睛,“不过我忘了告诉你一件事,在锦城,我如果死了,你也要死。”侍卫的脸变得非 常难看,又不敢问这句话是谁说的。他们是皇上特派来保护七王爷的。皇上跟七王爷之间的感情很微妙,微妙到七王爷若横死,皇上一定 会很伤心,但未必会伤心得处决保护不力的侍卫们。“太后娘娘说的,如果不信,你可以回去问她,我想皇兄也不会否认。”七王爷朗笑 道。侍卫只好信了,于是更不得不问:“您要去哪里?”七王爷越行越远,可侍卫一直膝行追着他,这使得七王爷说的所有话,尽管声音 不大,侍卫也听得清清楚楚,也使得侍卫可以用备显谦恭的声音询问他——当我们不得不放大音
4.3.2电解池 课件 人教版高中化学选修4

(3)放氢生碱型
电解质 (水溶液)
电极 方程式
电解 物质
总化学 方程式
溶 电解质
液 浓度
pH
溶液 复原
阳极:_2_C_l_-_-__2_e_-_
2Cl-+2H2O
活泼金属 _=_=_=_C__l2_↑_ 的无氧酸
水
和
通电 =====
Cl2↑
生成新 增 通入H__C_l
盐(如NaCl)
阴极:_2_H__2O__+__2_e_- =_=__=_H_2_↑__+2OH-
人教版选修四
第四章
第三节 电解池
放电顺序:(得失电子能力的强弱) (1)阳极发生氧化反应,还原性强的优先失去电子
这要重点 记
活性电极 >S2->I->Br->Cl->OH->NO3->SO42->F-
(2)阴极发生还原反应, 氧化性强的优先得到电子
这要重点 记
Ag+>Hg2+>Fe3+>Cu2+>H+ (>Pb2+ > Sn2+ >Fe2+>Zn2+ 浓度大时先于 H+放电) (>H+ > Al3+>Mg2+>Na+>Ca2+>K+ 水中H+先放电)
阴极:_2_C_u_2_+_+__4_e_-_
电解质
CuCO3
(如CuSO4) _=_=_=_2_C__u_
盐 +__O_2_↑__+__4_H_+_
特别要注意: 如果是有活性电极参与,那反应就有不同。
如:对比下面两个:
用碳棒作电极电解NaCl溶液 阳极_2_C__l-_-_2_e-_=_C_l_2_↑________________________ 阴极:_2_H_+_+_2_e_-_=_H_2_↑____________或__2_H__2_O_+_2_e_-_=_H2↑+2OH电解总反应__2_N_a_C__l_+_2_H__2O______2_N__a_O_H__+_H__2↑_+_C_ l2↑
电解池精品课件2

与电源正极相连的碳
棒 润表 的阳面 淀出 粉极K现—I小试气纸C泡变l2,蓝湿。
通电
CuCl2 ==Cu+Cl2↑
请你思考?
(1)通电前,氯化铜溶液里主 要存在哪些离子?这些离子 的运动情况怎样? (2)通电后,这些离子的运动 情况有什么改变? (3)当离子定向运动到电极表 面上时,发生了什么变化?
装置
电极 名称
原电池
负极:较活泼金属 正极:较不活泼金属 (或能导电的非金属)
电解池
阳极:与电源正极相连 阴极:与电源负极相连
电极 负极:氧化反应 反应 正极:还原反应
阳极:氧化反应 阴极:还原反应
电子 流向
导线
负极 正极
电源负极→电解池阴极 电解池阳极→电源正极
练一练
1、分析下图,属于电解池的是( D )
墨电极。则下列有关的判断正确的是( C) +-
A a为负极、b为正极
B a为阳极、b为阴极
阳极
阴极
C 电解过程中,d电极质量增加
D 电解过程中,氯离子浓度不变
本节小结 课后作业
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
2、电解池:借助于电流引起氧化还原反应的装置, 也就是把电能转化为化学能的装置叫做
电解池或电解阴槽。极:与电源负极相连 3、电解池构成条件:阳极:与电源正极相连
棒 润表 的阳面 淀出 粉极K现—I小试气纸C泡变l2,蓝湿。
通电
CuCl2 ==Cu+Cl2↑
请你思考?
(1)通电前,氯化铜溶液里主 要存在哪些离子?这些离子 的运动情况怎样? (2)通电后,这些离子的运动 情况有什么改变? (3)当离子定向运动到电极表 面上时,发生了什么变化?
装置
电极 名称
原电池
负极:较活泼金属 正极:较不活泼金属 (或能导电的非金属)
电解池
阳极:与电源正极相连 阴极:与电源负极相连
电极 负极:氧化反应 反应 正极:还原反应
阳极:氧化反应 阴极:还原反应
电子 流向
导线
负极 正极
电源负极→电解池阴极 电解池阳极→电源正极
练一练
1、分析下图,属于电解池的是( D )
墨电极。则下列有关的判断正确的是( C) +-
A a为负极、b为正极
B a为阳极、b为阴极
阳极
阴极
C 电解过程中,d电极质量增加
D 电解过程中,氯离子浓度不变
本节小结 课后作业
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
2、电解池:借助于电流引起氧化还原反应的装置, 也就是把电能转化为化学能的装置叫做
电解池或电解阴槽。极:与电源负极相连 3、电解池构成条件:阳极:与电源正极相连
《电解池》PPT全文课件-PPT【人教版】

e- 阳极 C
解池的阴极,再从阳极流回电源正极
离子移动的方向:
CuCl2溶液
阳离子移向阴极,
内电路
阴离子移向阳极。
【思考4】电解质溶液导电的实质是什么?
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
6、电解质溶液导电的实质
——仅仅导电,不参与反应
活性电极(除铂、金外的金属): ——既可以导电、又可以参与电极反应
【思考2】形成电解池的条件是什么?
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
4、形成电解池的条件
⑴与直流电源相连的两个电极 ⑵电解质溶液或熔融电解质 ⑶形成闭合回路 (4)非自发进行的氧化还原反应
Cu2+、Cl-为自由移动的离子;
2.通电后,电路中电子的流动方向如何?
3.通电后,离子的运动情况有什么改变?
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
思考:
4.当离子定向移动到电极表面时,发生的是什么 类型的反应?
3、电极
⑴.两电极名称
阳极 阴极
(2).两电极确定
e- 阴极
C
e-
阳极 C
阴极:
CuCl2溶液
与电源负极相连—电子流入— 发生还原反应—阳离子移向
阳极:
与电源正极相连—电子流出—发生氧化反应—阴离子移向
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》完美ppt人教2

§4.3 电解池
思考
观察下面两个装置,判断是否为原电池,若是 ,请描述两电极的现象;若不是,请说明原因。
Fe
C
原电池
C
C
不是原 电池
CuCl2溶液
CuCl2溶液
电极
现象
铁棒
铁棒不断溶解
石墨棒 石墨棒上附有红色物质
实验探究
阳C
C阴
极
极
CuCl2溶液
实验步骤:
1、用导线将两根石墨棒与直 流电源的正、负极相连;
电极反应
浓度
( 电 解 水 型 )
PH 复原 值
阳极: 4OH- - 4e- → 2H2O+O2 ↑
阴极: 4H ++ 4e- → 2H2 ↑
变大
2H2O 电解 2H2 ↑ + O2 ↑
不 变
加 H2O
阳极
阴极
氧 气
铜
CuSO4溶液
实例
电极反应
浓度
阳极: 4OH- - 4e- → 2H2O+O2 ↑
阴极: Cu2++2e-=Cu (还原反应)
总反应:CuCl2
电解
Cu+Cl2↑
CuCl2溶液
电解:使电流通过电解质溶液而在阴、阳两极引 起氧化还原反应的过程
电解池(或电解槽): 把电能转化为化学能的装置
思考与交流:
电解CuCl2溶液时,电子、阴阳离子的流动方向 如何?
电子从电源的_负__极流出,沿导线流入电解池的_阴__ 极,阳离子向_阴__极移动,在阴极表面得__到__电子,阴离子 向_阳__极移动,在阳极表面_失__去_电子,电子再从电解池的
冶炼活泼金属 K ~~ Al
思考
观察下面两个装置,判断是否为原电池,若是 ,请描述两电极的现象;若不是,请说明原因。
Fe
C
原电池
C
C
不是原 电池
CuCl2溶液
CuCl2溶液
电极
现象
铁棒
铁棒不断溶解
石墨棒 石墨棒上附有红色物质
实验探究
阳C
C阴
极
极
CuCl2溶液
实验步骤:
1、用导线将两根石墨棒与直 流电源的正、负极相连;
电极反应
浓度
( 电 解 水 型 )
PH 复原 值
阳极: 4OH- - 4e- → 2H2O+O2 ↑
阴极: 4H ++ 4e- → 2H2 ↑
变大
2H2O 电解 2H2 ↑ + O2 ↑
不 变
加 H2O
阳极
阴极
氧 气
铜
CuSO4溶液
实例
电极反应
浓度
阳极: 4OH- - 4e- → 2H2O+O2 ↑
阴极: Cu2++2e-=Cu (还原反应)
总反应:CuCl2
电解
Cu+Cl2↑
CuCl2溶液
电解:使电流通过电解质溶液而在阴、阳两极引 起氧化还原反应的过程
电解池(或电解槽): 把电能转化为化学能的装置
思考与交流:
电解CuCl2溶液时,电子、阴阳离子的流动方向 如何?
电子从电源的_负__极流出,沿导线流入电解池的_阴__ 极,阳离子向_阴__极移动,在阴极表面得__到__电子,阴离子 向_阳__极移动,在阳极表面_失__去_电子,电子再从电解池的
冶炼活泼金属 K ~~ Al
电解池演示课件PPT人教版PPT

⑵若阳极为纯锌,阴极为铜片,阳极反应式是
Zn -2e-=Zn2+
⑶如果两极均为铜片且不考虑H+在阴极上放电
当电路中有0.01mol电子通过时,阴极增重 0.32 g
,
Cu2+ +2e-=Cu
阴极上的电极反应式是
。
电解池演示课件PPT人教版PPT(优秀 课件)
1.下列说法或实验现象的描述不正确的是( 电解池演示课件PPT人教版PPT(优秀课件)
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保
持不变的是( )。
A.HCl B.NaOH
C.Na2SO4
D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,铜作阳极
第三节 电解池
一、电解原理:
1.电解:使直流电通过电解质溶液而在阴、阳两 极引发氧化还原反应的过程。
(可为自发也可为非自发)
2.电解池:将电能转变为化学能的装置。 +
3.构成电解池的条件: C ①直流电源;
-
C
②两个电极(可相同也可不同); ③电解质溶液; ④形成闭合回路。
CuCl2溶液
4.电极名称及反应类型:
a电源b
–+
Pt
Cu a
b
CuSO4溶 液
电解池演示课件PPT人教版PPT(优秀 课件)
NaCl和酚酞溶 液
电解池演示课件PPT人教版PPT(优秀 课件)
例:在50mL 0.2mol/L的硫酸铜溶液中插入两个电
电解池课件.ppt

8
实验三:电解CuSO4溶液
CuSO4溶液
9
CuSO4 == Cu2+ + SO42-
H2O
H + + OH -
阳极:4OH- ─ 4e- = 2H2O + O2↑ 阴极:2Cu2+ + 4e- = 2Cu
2CuSO4+ 2H2O
电解 2Cu + O2↑+ 2H2SO4
10
4、解决电解问题的步骤:
6
实验二:电解NaCl溶液
7
3、离子的放电顺序 金属活动性顺序:
K Ca Na Mg Al Zn Fe(H)Cu Ag 逐渐减弱
(1)在阴极,阳离子得电子的能力:
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
逐渐增强
(2)在阳极,阴离子失电子的能力: I- > Br- > Cl- > OH- > 含氧酸根离子
第四章 电化学基础 第三节 电解池
点燃
Cu + Cl2===CuCl2
?
CuCl2 ===Cu + Cl2↑
2
实验一、电解CuCl2溶液
CuCl2溶液
3
4
1、电解的定义: 使电流通过电解质溶液而在阴阳两 极引起氧化还原反应的过程叫电解。
5
2、电解池的组成:
电极材料 电解质溶液 闭合回路 电源 导线
(1)分析溶液中的离子 (2)在阴极,根据阳离子得电子能力判断产物, 写出电极反应式 (3)在阳极,根据阴离子失电子能力判断产物, 写出电极反应式
(4)写出总反应方程式
11
5、讨论:
实验三:电解CuSO4溶液
CuSO4溶液
9
CuSO4 == Cu2+ + SO42-
H2O
H + + OH -
阳极:4OH- ─ 4e- = 2H2O + O2↑ 阴极:2Cu2+ + 4e- = 2Cu
2CuSO4+ 2H2O
电解 2Cu + O2↑+ 2H2SO4
10
4、解决电解问题的步骤:
6
实验二:电解NaCl溶液
7
3、离子的放电顺序 金属活动性顺序:
K Ca Na Mg Al Zn Fe(H)Cu Ag 逐渐减弱
(1)在阴极,阳离子得电子的能力:
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
逐渐增强
(2)在阳极,阴离子失电子的能力: I- > Br- > Cl- > OH- > 含氧酸根离子
第四章 电化学基础 第三节 电解池
点燃
Cu + Cl2===CuCl2
?
CuCl2 ===Cu + Cl2↑
2
实验一、电解CuCl2溶液
CuCl2溶液
3
4
1、电解的定义: 使电流通过电解质溶液而在阴阳两 极引起氧化还原反应的过程叫电解。
5
2、电解池的组成:
电极材料 电解质溶液 闭合回路 电源 导线
(1)分析溶液中的离子 (2)在阴极,根据阳离子得电子能力判断产物, 写出电极反应式 (3)在阳极,根据阴离子失电子能力判断产物, 写出电极反应式
(4)写出总反应方程式
11
5、讨论:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 阴离子放电的顺序:
非惰性电极>S2->I->Br->Cl->OH>非还原性含氧酸根离子>F-
2. 阳离子的放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>金属 活动顺序表中位置在H前面的金属阳离 子
二、电解原理的应用——电镀
利用电解的原理在金属表面上镀上一层其 它金属或合金的过程。
(1)阳极:镀层金属。 阴极:待镀的金属制品 电镀液:用含有镀层金属离子的溶液。 [电镀过程中电镀液的浓度保持不变]
2NaCl+2H2O=电=解=2NaOH+H2↑+Cl2↑
(二)离子交换膜法制烧碱
(二)离子交换膜法制烧碱
1、装置
+
-
• 阳极:金属钛网(涂
Cl2 H2
有钛钌等氧化物) • 阴极:碳钢网(涂有淡盐水
镍涂层)
NaOH 溶液
• 阳离子交换膜:只 允许阳离子通过,
Na+
阻止阴离子和气体
通过。
• 阳极室产物:
第四章 电化学基础
第三节 电解池 第2课时
1
标题添加
点击此处输入相 关文本内容
标题添加
点击此处输入相 关文本内容
总体概述
点击此处输入 相关文本内容来自点击此处输入 相关文本内容
2
二、电解原理的应用——氯碱工业
(一)电解饱和食盐水反应原理
阳极(石墨): 2Cl—-2e—=Cl2↑ 【氧化反应】
阴极(石墨): 2H++2e—=H2↑ 【还原反应】
16
谢谢您的观看与聆听
Thank you for watching and listening
17
电解精炼铜原理:
①粗铜的溶解与纯铜的生成: 阳极(粗铜):Cu -2e- = Cu2+ 阴极(纯铜): Cu2+ + 2e- = Cu ②比铜活泼的金属:Zn、Fe、Ni只溶解,不析出;
③比铜不活泼的金属:Au、Pt不溶解,而以单质沉 积形成阳极泥;
④电解质溶液中CuSO4的浓度基本不变。
电解时电极产物的判断
NaOH、 H2 • 阴极室产物: Cl2
精制 水(含少量 饱和食盐水 NaOH)
(三)以氯碱工业为基础的化工生产
电解饱和食盐水
湿氢气
H2
湿氯气
液碱
Cl2
含氯漂白剂
NaOH
金属冶炼 有机合成
HCl 盐酸
有机合成 氯化物合成
农药
有机合成、造纸 玻璃、肥皂 纺织、印染
二、电解原理的应用——电解精炼铜
1、钠的冶炼 ——电解熔融的NaCl
阳极:2Cl--2e-=Cl2↑ 阴极:2Na++2e-=2Na 总反应:
2NaCl(熔融)=2Na+Cl2↑
提问与解答环节
Questions and answers
15
添加
添加
添加 标题
标题
标题
添加
标题
此处结束语
点击此处添加段落文本 . 您的内容打在这里,或通过 复制您的文本后在此框中选择粘贴并选择只保留文字
(2)实质:阳极参加反应的电解
(3)阴极必须可以导电,且表面洁净、光滑
(4)为了使镀层均匀、美观,电镀液中镀层离子的 浓度时刻保持稳定,常制成络离子
金属的防护
金属腐蚀的快慢程度:
电解池的阳极>
原电池的负极>
化学腐蚀>
+
—
原电池的正极> C
Fe
电解池的阴极
海水
原电池、电解池、电镀池的比较
装置
电镀池
电解池
装置 实例
定义 应用电解原理在某些金属表
面镀上一层其他金属的装置
将电能 转变成化学能的装置
①镀层金属接电源正极,待 ①两电极接直流电源
形成 镀金属接电源负极
②电解质溶液
条件 ②电镀液必须含有镀层金 ③形成闭合回路
属的离子
二、电解原理的应用——电冶金
• 由于电解是最强有力的氧化还原手段,所以电解 法是冶炼金属的一种重要的方法。对于冶炼像 Na、Ca、Mg、Al这样活泼的金属,电解法几乎 是唯一可行的工业方法。
非惰性电极>S2->I->Br->Cl->OH>非还原性含氧酸根离子>F-
2. 阳离子的放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>金属 活动顺序表中位置在H前面的金属阳离 子
二、电解原理的应用——电镀
利用电解的原理在金属表面上镀上一层其 它金属或合金的过程。
(1)阳极:镀层金属。 阴极:待镀的金属制品 电镀液:用含有镀层金属离子的溶液。 [电镀过程中电镀液的浓度保持不变]
2NaCl+2H2O=电=解=2NaOH+H2↑+Cl2↑
(二)离子交换膜法制烧碱
(二)离子交换膜法制烧碱
1、装置
+
-
• 阳极:金属钛网(涂
Cl2 H2
有钛钌等氧化物) • 阴极:碳钢网(涂有淡盐水
镍涂层)
NaOH 溶液
• 阳离子交换膜:只 允许阳离子通过,
Na+
阻止阴离子和气体
通过。
• 阳极室产物:
第四章 电化学基础
第三节 电解池 第2课时
1
标题添加
点击此处输入相 关文本内容
标题添加
点击此处输入相 关文本内容
总体概述
点击此处输入 相关文本内容来自点击此处输入 相关文本内容
2
二、电解原理的应用——氯碱工业
(一)电解饱和食盐水反应原理
阳极(石墨): 2Cl—-2e—=Cl2↑ 【氧化反应】
阴极(石墨): 2H++2e—=H2↑ 【还原反应】
16
谢谢您的观看与聆听
Thank you for watching and listening
17
电解精炼铜原理:
①粗铜的溶解与纯铜的生成: 阳极(粗铜):Cu -2e- = Cu2+ 阴极(纯铜): Cu2+ + 2e- = Cu ②比铜活泼的金属:Zn、Fe、Ni只溶解,不析出;
③比铜不活泼的金属:Au、Pt不溶解,而以单质沉 积形成阳极泥;
④电解质溶液中CuSO4的浓度基本不变。
电解时电极产物的判断
NaOH、 H2 • 阴极室产物: Cl2
精制 水(含少量 饱和食盐水 NaOH)
(三)以氯碱工业为基础的化工生产
电解饱和食盐水
湿氢气
H2
湿氯气
液碱
Cl2
含氯漂白剂
NaOH
金属冶炼 有机合成
HCl 盐酸
有机合成 氯化物合成
农药
有机合成、造纸 玻璃、肥皂 纺织、印染
二、电解原理的应用——电解精炼铜
1、钠的冶炼 ——电解熔融的NaCl
阳极:2Cl--2e-=Cl2↑ 阴极:2Na++2e-=2Na 总反应:
2NaCl(熔融)=2Na+Cl2↑
提问与解答环节
Questions and answers
15
添加
添加
添加 标题
标题
标题
添加
标题
此处结束语
点击此处添加段落文本 . 您的内容打在这里,或通过 复制您的文本后在此框中选择粘贴并选择只保留文字
(2)实质:阳极参加反应的电解
(3)阴极必须可以导电,且表面洁净、光滑
(4)为了使镀层均匀、美观,电镀液中镀层离子的 浓度时刻保持稳定,常制成络离子
金属的防护
金属腐蚀的快慢程度:
电解池的阳极>
原电池的负极>
化学腐蚀>
+
—
原电池的正极> C
Fe
电解池的阴极
海水
原电池、电解池、电镀池的比较
装置
电镀池
电解池
装置 实例
定义 应用电解原理在某些金属表
面镀上一层其他金属的装置
将电能 转变成化学能的装置
①镀层金属接电源正极,待 ①两电极接直流电源
形成 镀金属接电源负极
②电解质溶液
条件 ②电镀液必须含有镀层金 ③形成闭合回路
属的离子
二、电解原理的应用——电冶金
• 由于电解是最强有力的氧化还原手段,所以电解 法是冶炼金属的一种重要的方法。对于冶炼像 Na、Ca、Mg、Al这样活泼的金属,电解法几乎 是唯一可行的工业方法。
