《冶金物理化学》答案解析
冶金物理化学(标注)-复习题

《冶金物理化学》复习题一、填空题1.冶金物理化学的理论基础包括、、等知识;冶金物理化学的理论基础包括普通化学、高等数学、物理化学等知识;标注:第1次作业填空2.热力学三大定律是:、、。
第一定律(能量守恒,转化);第二定律(反应进行的可能性及限度)、第三定律(绝对零度不能达到)。
标注:第1次作业填空3.在外界条件改变时,体系的状态就会发生变化,这种变化称为,变化前称,变化达到的状态称。
实现过程的方式称为。
在外界条件改变时,体系的状态就会发生变化,这种变化称为过程,变化前称始态,变化达到的状态称终态。
实现过程的方式称为途径。
标注:第3次作业填空4.状态函数的特点:只取决于,与达到此无关,等都是状态函数,U、H、S、G等也是状态函数。
状态函数的特点:只取决于体系的状态,与达到此状态的途径无关,p、V、T 等都是状态函数,U、H、S、G也是状态函数。
标注:第3次作业填空5、二元相图的反应类型有形成、、、共析反应、偏晶反应、带有固溶体的共晶反应等。
二元相图的反应类型有形成完全固溶体、共晶反应、包晶反应、共析反应、偏晶反应、带有固溶体的共晶反应等。
标注:第5次作业填空6、三元相图有:,如CaO-SiO 2-Al 2O 3三元相图;和、图和等温截面图。
三元相图有:普通相图,如CaO-SiO 2-Al 2O 3三元相图;和等活度、等黏度图和等温截面图。
标注:第4次作业填空7、炉渣的理化性质包括:、、、表面张力(界面张力)、导电性、氧化性(还原性)、气体在渣中溶解度等六个方面。
炉渣的理化性质包括:碱度、黏度、熔点、表面张力(界面张力)、导电性、氧化性(还原性)、气体在渣中溶解度等六个方面。
标注:第5次作业填空8、分子结构理论认为,分子间的作用力为。
标注:第5次作业填空9、离子结构理论认为,离子间的作用力为。
10、高炉渣内的、、、等表面张力,这些物质在表面层中的浓度大于内部的浓度,称为。
高炉渣内的SiO 2、TiO 2、K 2O 、CaF 2等表面张力较低,这些物质在表面层中的浓度大于内部的浓度,称为表面活性物质。
北京科技大学-冶金物理化学-模拟三套卷及答案

北京科技大学-冶金物理化学-模拟三套卷及答案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN北京科技大学2012年硕士学位研究生入学考试模拟试题(一)试题编号:809 试题名称:冶金物理化学一.简答题(每题7分,共70分)1.试用热力学原理简述氧势图中各直线位置的意义。
2.简述规则溶液的定义。
3.简述熔渣分子结构理论的假设条件。
4.已知金属氧化反应方程式(1)、(2)、(3),判断三个方程式中,哪个M是固相,液相,气相?确定之后,计算M的熔点和沸点。
已知(1)2M+O2 = 2MO(s)ΔG1θ= -1215000 + 192.88T(2)2M+O2 = 2MO(s)ΔG2θ = -1500800 + 429.28T(3)2M+O2 = 2MO(s)ΔG3θ = -1248500 + 231.8T5. 简述三元系相图的重心规则。
6. 试推导当O2在气相中的分压小于0.1Pa时硫容量的一种表达式。
7. 试写出熔渣CaO-SiO2的光学碱度的表达式。
8. 推导在铁液深度为H的耐火材料器壁上活性空隙的最大半径表达式。
9. 简述双膜传质理论。
10. 试推气固相反应的未反应核模型在界面化学反应为限制环节时的速率方程。
二.计算题(30分)在600℃下用碳还原FeO制取铁,求反应体系中允许的最大压力。
已知:FeO(s) = Fe(s)+ 1/2 O2(g) Δr Gθ= 259600 –62.55T ,J/molC(s) + O2 = CO2(g) Δr Gθ= -394100 + 0.84T,J/mol2C(s) + O2(g) = 2CO(g) Δr Gθ= -223400 - 175.30T ,J/mol 三.相图题(25分)1)标明各相区的组织。
2)分析x点的冷却过程,画出冷却曲线,并用有关相图的理论解释。
四.对渣-钢反应 [A] +(B2+) = (A2+) + [B] (25分)(1)分析该反应有几个步骤组成。
冶金物理化学课后习题解答PPT学习教案

2)在金属液或气泡表面上发生界面化学反应,生成气体分子;
3)气体分子通过气体边界层扩散进入气相,或被气泡带入气相,并被真空
泵抽出。
第133页/共134页
1)固体反应物B是致密的或者无孔隙的;
2)反应发生在气-固相的界面上,即具有界面化学反应特征。
第129页/共134页
7-3 由外扩散、界面化学反应、内扩散控制的气-固反应
各有什么动力学特点?
外扩散控速:若界面化学反应不可逆,由于外扩散是限制环节,可认为通过产物的反应物气
体物质扩散到未反应核界面上应立即和固体反应,可以认为 = 0。
第75页/共134页
第76页/共134页
第77页/共134页
第78页/共134页
第79页/共134页
第80页/共134页
第81页/共134页
第82页/共134页
第83页/共134页
第84页/共134页
第85页/共134页
第86页/共134页
第87页/共134页
第88页/共134页
界面之间的区域叫做有效边界层,用’ 来表示。
( )=0 =
−
’
’ =
−
(
)=0
第100页/共134页Hale Waihona Puke 推导菲克第二定律(一维扩散)
菲克第二定律:在物质的浓度随时间变化的体系中,即
≠ 0,体系中发生的是非稳态扩散。
在一维体系中,单位体积单位时间浓度的变化等于在该方向上通量(单位时间通过单位面积的物质的量)
第109页/共134页
第110页/共134页
第111页/共134页
第112页/共134页
《冶金物理化学》答案解析

=-492310
J/mol
1-9 用 Si 热法还原 MgO, 即 Si+2MgO2=2Mg(s)+SiO2(s0 的标准吉布斯自由能与温度的 关系为: ∆ r G =
θ
( 523000 − 211.71T )
J/mol
试计算: (1)在标准状态下还原温度; (2)若欲使还原温度降到 1473K,需创造什么条件? 解:(1) 令 即 523000-211.71T=0 ∆ r Gθ = 0
1 Fes + O2( g ) + Al2O3 = FeO • Al2O3 (s) 2
3.128 ×104 lg( pO2 / pa ) = − + 12.895 T
∆ f Gθ = ( −578200 + 166.5T ) J / mol
在 1373-1700K 的平衡氧分压为 已知 Mo+O2=MoO2(S)
0 -601.8
θ θ H 298 − H0 / kJ / mol
-212.12
8656.7
解:先将气态 O2 的 fef 值换算为 298K 时的 fef
θ θ θ θ GT − H 298 Gθ − H 0 H θ − H0 [ = ]O2 [ T ]O2 − [ 298 ]O2 T T T
=-212.12-8656.7/1000 =-220.78 J/mol ⋅ k 由反应式
= 2 × (−1986300 + 402.1T ) − 2 × (−1687200 + 326.8T ) − (−578200 + 166.5T )
= −20000 − 15.9T
代入 T=1600K 则有 ∆ r G = −45440 J / mol
冶金物理化学答案

冶金物理化学答案冶金物理化学是研究金属和合金在制备、加工、合成和结构过程中物理和化学变化的科学。
它涵盖了从矿石到最终产品的整个过程,包括提取、分离、合成和加工。
冶金物理化学在工业和科学研究中扮演着重要角色,对于理解金属和合金的性质以及优化其制备过程至关重要。
在冶金物理化学的研究中,人们通常的是金属和合金的物理和化学变化,包括相变、扩散、还原和氧化等。
这些变化受到温度、压力、浓度和时间等因素的影响。
通过对这些变化的深入研究,人们可以更好地理解金属和合金的结构和性质,并优化其制备过程。
在工业生产中,冶金物理化学的应用广泛且重要。
例如,在钢铁工业中,冶金物理化学可以帮助人们理解钢铁的相变和结构,从而优化其制备和处理过程。
在铝工业中,冶金物理化学可以帮助人们理解铝的熔炼和铸造过程,从而提高铝的质量和性能。
除了在工业生产中的应用,冶金物理化学还在材料科学和工程领域发挥了重要作用。
通过对金属和合金的深入研究,人们可以开发出具有优异性能的新材料,例如高强度钢、轻质铝合金和高导电铜合金等。
冶金物理化学是理解和优化金属和合金制备和处理过程的关键。
通过深入研究和应用冶金物理化学,我们可以提高工业生产的效率和质量,同时推动新材料的发展和进步。
冶金物理化学是一门研究金属和合金的冶炼、分离、精炼和提纯的学科。
它主要涉及金属和合金的物理和化学性质,以及这些性质在冶炼、分离、精炼和提纯过程中的变化。
冶金物理化学的研究范围广泛,包括金属和合金的相图、热力学性质、动力学性质、电化学性质以及表面化学性质等。
它可以帮助我们了解金属和合金在不同条件下的物理和化学行为,从而指导冶炼、分离、精炼和提纯的过程。
在冶炼过程中,冶金物理化学可以用来确定最佳的冶炼方法和工艺参数。
例如,通过研究铁、锰、铬等金属的氧化还原反应,我们可以了解它们在不同温度和压力下的行为,从而优化它们的冶炼过程。
在分离过程中,冶金物理化学可以用来研究不同金属之间的相互作用,以及它们与分离剂之间的相互作用。
冶金物理化学学习指导及习题解答

冶金物理化学学习指导及习题解答1.冶金热力学辅导热力学内容下四个部分1)冶金热力学基础2)冶金熔体(铁溶液、渣溶液)3)热力学状态图(Ellingham图,相图)注:把各个知识点划分成三个等级;最重要的等级―――“重点掌握”第二等级―――“掌握”,第三等级―――“了解”,这便于学习者在自学或复习内容时参考。
也便于在学习时能抓住重点,更快更好地掌握冶金物理化学这门重要基础学科。
1.1 冶金热力学基础共7个知识点1) 重点掌握体系中组元i 的自由能表述方法;(包括理想气体、液体、固体)理想气体的吉布斯自由能封闭的多元理想气体组成的气相体系中,任一组元i 的吉布斯自由能为ln i i i G G RT P ∅=+i P '-i 组分气体的实际压强,Pa ;P ∅-标准压强,Pa ,也即Pa 51001325.1⨯。
应该注意的是,高温冶金过程中的气体由于压强比较低,都可以近似看作理想气体。
液相体系中组元i 的吉布斯自由能在多元液相体系中,任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+其中,i a ----组元的活度,其标准态的一般确定原则是:若i 在铁液中,选1%溶液为标准态,其中的浓度为质量百分数,[%i]; 若i 在熔渣中,选纯物质为标准态,其中的浓度为摩尔分数,i X ;若i 是铁溶液中的组元铁,在其他组元浓度很小时,组元铁的活度定义为1。
固相体系中组元i 的吉布斯自由能在多元固相体系中,其中任一组元i 的吉布斯自由能为 ln i i i G G RT a ∅=+i a 确定原则是:若体系是固溶体,则i 在固溶体中的活度选纯物质为标准态,其浓度为摩尔分数,i X ; 若体系是共晶体,则i 在共晶体中的活度定义为1; 若体系是纯固体i ,则其活度定义为1。
2)重点掌握化学反应等温方程式ln G G RT Q ∅∆=∆+G ∆有三种情况 1)0>∆G ,以上反应不可以自动进行;2) 0<∆G ,以上反应可以自动进行; 3) 0=∆G ,以上反应达到平衡,此时G RTLnK ∅∅∆=-注:(1)G ∆是反应产物与反应物的自由能的差,表示反应的方向(反应能否发生的判据);表示任意时刻(不平衡状态)的压强商或活度商。
北京科技大学冶金物理化学2009真题解析

2.3 热力学计算题
10
解析;此题难度不大,主要是搞清楚如果要反应朝着特定方向进行,有几个典型 方法,考虑压强、考虑温度这两个方面即可。参考答案:
令 r G 0 ,得到 T=2470K。
考虑到镁熔点 648.9℃,镁沸点 1090℃,在 1473K 时,镁呈现气态,因此可以创 造真空条件,还可以加入添加剂 CaO ,借以降低 SiO2 的含量,进而促进反应的 进行。综合考虑,采取创造真空条件来实现温度的降低。 (标准态压强记熟,为
4
解析:熔渣结构理论中的分子理论模型及活度计算是重点内容。参考答案: 分子结构理论假设: ① ② ③ 炉渣是由简单氧化物分子及其相互作用形成的复杂氧化物分子所组成; 炉渣中只有简单氧化物才能参与金属液间的反应; 由酸性氧化物及碱性氧化物复合成复杂氧化物的过程存在着动态平衡。
自由氧化物的浓度(活度)等于由化学分析所测定的氧化物的总浓度与该氧化物 的结合浓度之差,即 n B (自) n B(总)- n B (结),组分B的活度为 a B nB(自)/ n ,其 中, n B(自) 、n B 结) 、 n 分别指组分B的自由氧化物、复合氧化物、自由氧化物及 复合氧化物的物质量的总和。
解析:有效边界层的定义已经多次强调,注意有效边界层概念实际上是将边界层 中的湍流传质和分子扩散等效地处理为厚度为 c 的边界层的分子扩散。 参考答案为:
'
5
解析:实质上是考查双模理论,双模理论为液液相传质理论模型,界面两侧各存 在一个边界层, 过程的总阻力包括两个边界层的传质阻力和界面化学反应的化学 阻力,相关机理也很简单,参考答案: (1)钢种 Mn 原子向钢渣界面迁移; (2)渣中 SiO4 离子向钢渣界面迁移 (3)钢渣界面发生化学反应
2014年北京科技大学冶金物理化学真题解析

北 京 科 技 大 学2014年硕士学位研究生入学考试试题=============================================================================================================试题编号: 809 试题名称: 冶金物理化学 (共7页) 适用专业: 冶金工程、冶金工程(专业学位) 说明: 所有答案必须写在答题纸上,做在试题或草稿纸上无效。
=============================================================================================================以下适合所有报考冶金工程专业的考生(但本科为生态学专业的考生不做)一、简要回答下列问题,每题10分(共70分)1.对于等温方程式ln G RT K ∅∅∆=-,方程式的左边和右边是描述同一个状态吗?如果是写出所描述的状态,如果不是,分别写出所描述的状态都是什么?它们之间的关系如何?答:方程式的左边和右边描述的不是同一个状态,左边的φG ∆是反应在标准态时产物的自由能与反应物的自由能的差,可以通过热力学数据表查出。
而右边表示的是平衡态,φK 是反应的平衡常数,可以通过bBa A dD c C a a aa K =φ求出。
当dD cC bB aA +=+反应处于平衡态时,ln G RT K ∅∅∆=-成立。
2. 在Ellingham 图中,试用热力学原理分析,冶炼不锈钢去碳保铬在标态和非标态的最低温度(假设p CO =1)?答:已知,铬的氧化反应 和c 的氧化反应如下:)(32)(2)(3234l g l O Cr O Cr =+ ……① )()(2)(22g g l CO O C =+ ……② (②-①)÷2得到)()()(32)(3231l g l l Cr CO O Cr C +=+假设反应K RT G G ln +∆=∆φ,bT a G +=∆φ在标准态时,φG G ∆=∆,反应平衡时G ∆=0,求得反应温度baT -=1,即为标准态时去碳保铬的最低温度在非标准态时,K RT G G ln +∆=∆φ,反应平衡时,313232)(O Cr C Crco aa a p p K φφ=,由于Cr a =1,1,132==O Cr C a a ,因此p p K co=。
2009-10冶金物理化学2标准答案和评分标准格式

(1 分)
fCr=0.9515
aCr=0.9515×18= 17.127
C Cr Ni lg f C eC w[C ] eC w[Cr] eC w[ Ni ]
=0.14×0.15-0.024×18+0.012×9= -0.303 (1 分) (1 分)
fC=0.4977
aC=0.4977×0.15=0.0747
(1 分) (1 分) (1 分) (1 分)
相应地加入硅铁=
六(10 分). 溶解于钢液中[Cr]的选择性氧化反应为 2[Cr]+3CO=(Cr2O3)+3[C]。试求钢液成分为 w[Cr]=18%、w[Ni]=9%、w[C]=0.15%及 p'CO =100kPa 时,[Cr]和[C]氧化的转化温度。 已知: 解: (1)求[Cr]-[C[氧化的转化温度,根据反应 2[Cr]+3CO=(Cr2O3)+3[C],Δ Gθ =-819989+448.59 T J/mol
= 1460 + 8314 lnJ ≤0
(2 分)
(2 分) (1 分) (2 分)
+ φ
CO
CO
=100%,
CO2
所以 :φ
= 54.4%,φ
= 45.6 %
三(15 分). 在真空中向含 Cr18%,Ni9%的不锈钢吹氧,使含碳量降低到 0.025%,钢液的温度不高于 1650℃,问需要多大的真空度? 已知:4[C]+Cr3O4(s)=3[Cr]+4CO,Δ Gθ =934706-617.22T J/mol 解:反应的平衡常数 K 1650℃
C[A] C(A) / K 1/ k[A] 1/ k(A) .K
冶金物理化学

v
B
C p ,m ( B)dT
——基希霍夫公式
习 题
已知CH3COOH(g), CH4(g), CO2 (g),的平均定压热容 C p,m分 别为52.3J· –1· –1, 37.7J· –1· –1,31.4J· –1· –1 。试由 mol K mol K mol K 附录中的各化合物的标准摩尔生成焓计算1000K时下列反应的 rHɵm。 CH3COOH(g)=CH4(g)+CO2 (g) 解: 1000K CH3COOH(g) rHɵm(1000K) 1000K CH4(g) H2
标准态:任意温度T,标准压力pɵ=100 kPa下的纯物质。
§ 2.8 标准摩尔生成焓的计算
标准摩尔反应焓— 在某温度下,各自处在标准态下的反应物
,反应生成同样温度下各自处于标准态下的产物,该过程的
摩尔反应焓即为标准摩尔反应焓。 用公式表示:
r H m νB H m (B)
B
在实际上,通过物质的标准摩尔生成焓、标准摩尔燃烧焓 来计算标准摩尔反应焓。
热力学第一定律即能量转化与守恒定律,利用它可解决过
程的能量衡算问题。 封闭体系热力学第一定律:
U Q W
在本章中,U、H、Q、W 等物理量被引入,其中U 和H 为状态函数, Q和W为途径函数,它们均具有能量单位。 为了计算过程的Q、U及H 等,本章重点介绍了三类基 础热数据: 摩尔定容(压)热容 摩尔相变焓
1. 标准摩尔生成焓
定义:物质B在某温度的标准摩尔生成焓是,在一定温度T , 由热力学稳定相态单质生成化合物B,而且B的化学计量数 νB=1的反应的标准摩尔反应焓,记为 f H m 。
几点说明:
1)所谓“一定温度”,一般指 25 °C。 2)所谓“稳定相态单质”:碳指 C(石墨);硫指 S(正交) ;磷 ,过去指白磷,近年有些文献指红磷;溴指Br2(l);汞指Hg(l) ;稀有气体指单原子气体;氢、氟、氧、氮等指双原子气体 3) 显然,稳定相态单质本身的标准摩尔生成焓为零。
冶金物理化学答案

一、解释下列概念(每题5分,共20分)1、扩散脱氧:在炼钢过程中,根据分配定律钢液中的[O]向熔渣中扩散,而与加入渣相中的脱氧元素进行的脱氧反应称为扩散脱氧。
2、炉渣:炉渣是火法冶金中以氧化物为主要成分形成的多组分熔体,是金属提炼和精炼过程中除金属熔体以外的另一产物。
3、硫容量:炉渣容纳或溶解硫的能力,即2/122)/()(%S O S P P S C ⨯=。
4、偏摩尔量:在恒温、恒压及其他组分的物质的量保持不变的条件下,溶液的广度性质X (X 代表U 、H 、V 、S 、G )对其组分摩尔量的偏微商值。
二、简答题(共60分)1、简述热力学计算中活度标准态之间的转换关系。
答:(1)纯物质标准态活度与假想纯物质标准态活度之间的转换:][0][0*)()(*][][//H B B R B BBx H x H B B B H B R B a r a r pK K p p p a a ====故(2)纯物质标准态活度与质量1%溶液标准态活度之间的转换:*)(*(%)(%)*[%]][100100//B BA Bx H BA BH H B B B B R B r MMp K MMp K K p p p a a ⨯=⨯===(3)假想纯物质标准态活度与质量1%溶液标准态活度之间的转换:BA x H H HB x H B B H B MMK K K p K p a a 100//)((%)(%))([%]][===2、简述炉渣氧化脱磷的热力学条件。
答:由炉渣脱磷反应可知:9245245252)(%)(%][%)(%O CaPCaOFeO PP P fCaO FeO K P O P L γγγ⋅==由上述公式可知,为使脱磷反应进行完全,必要的热力学条件是: (1) 较高的炉渣碱度; (2) 较高的氧化铁含量; (3) 较低的熔池温度;大渣量。
3、铁氧化物被CO 还原的顺序是什么?写出反应方程式(配平)。
答:氧化铁被CO 还原在570℃以上及其下有不同的转变顺序,因此氧化铁还原是逐级的,反应如下:25324332224324332)(43)(41)(2)(3570)()()(3)()(2)(3570COs Fe CO s O Fe CO s O Fe CO s O Fe Ct COs Fe CO s FeO CO s FeO CO s O Fe CO s O Fe CO s O Fe Ct oo+=++=+<+=++=++=+>4、正规溶液的定义及其热力学特征。
北京科技大学冶金物理化学2009-2010学年期末试题(B)试卷and答案

装 订 线 内 不 得 答 题自觉遵 守考 试 规 则,诚 信 考 试,绝 不作 弊3、完全离子溶液形成时其混合焓为零。
阳离子与阳离子、阴离子与阴离子分别形成理想溶液;4、碱性氧化物以简单阳离子存在,酸性氧化物以复杂阴离子存在。
故,完全离子溶液=理想阳离子溶液+理想阴离子溶液,且++=22M M x a ,++=22O O x a4.试写出正规溶液定义。
解:正规溶液定义:过剩混合热不为零(Δmix H m E ≠0),过剩混合熵为零的溶液(Δmix S m E=0)叫做正规溶液。
5.试写出硫容量的一种表达式。
解:当气相分压小于0.1Pa 时,硫以硫化物的形式存在。
硫化物容量表示为:⎪⎪⎭⎫⎝⎛⋅⋅=⎪⎪⎭⎫ ⎝⎛⋅=--∑2222)32()(2/1%S O S O S a n K p p S w C γθ 当体系的气相分压大于0.1Pa 时,渣中硫以硫酸盐形式存在,定义硫酸盐的容量为:2/12/3%22)(⎪⎪⎭⎫ ⎝⎛⋅⎪⎪⎭⎫ ⎝⎛=θθp p p p S w C S O S6.简述有效边界层的定义。
答:当流体速度为u b 的粘性流体绕固体表面流动时,由于表面的摩擦作用在固体表面附近会形成具有很大速度梯度的区域。
在固体表面上流体速度u x 为零,而在距固体表面一小距离处,流体速度就等于99%的流体本体速度u b 。
这个区域叫速度边界层,距固体表面这一距离称为速度边界层厚度δu 。
当含某一组元A 浓度为C b 的流体绕固体表面流动时,如果由于流体与固体表面含组元A 的浓度不同,则会在固体垂直方向建立起浓度梯度。
在固体表面上组元A的浓度为C s ,而在距固体表面一小距离处,组元A 的浓度就降到99%的流体本体浓度C b 。
这个区域叫浓度边界层,距固体表面这一距离称为浓度边界层厚度δc 。
为了数学上的处理方便,将分子扩散(D )和湍流传质(ED )折算成稳态的分子扩散,为此由浓度为C s 的固体表面点作浓度曲线的切线,使之与本体浓度C b 的延长线相交于一点,过这点作一平行于固体表面的平面,该平面与固体表面之间的区域称为有效边界层,其厚度用δc ′表示。
冶物化课后习题答案
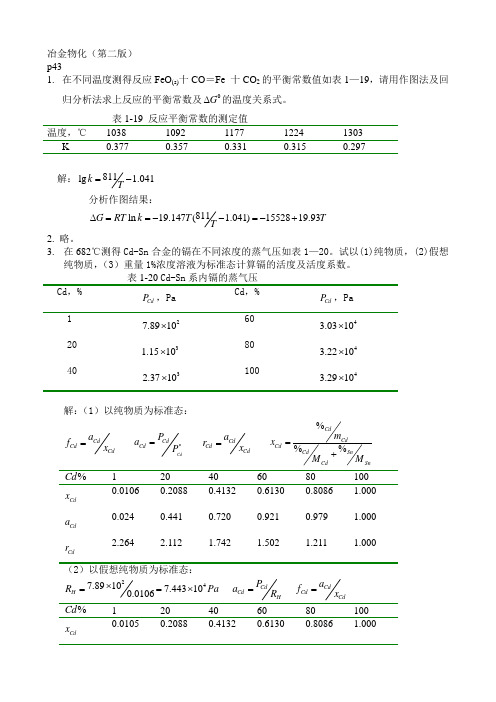
冶金物化(第二版) p431. 在不同温度测得反应FeO (s)十CO =Fe 十CO 2的平衡常数值如表1—19,请用作图法及回归分析法求上反应的平衡常数及0G ∆的温度关系式。
表1-19 反应平衡常数的测定值 温度,℃ 1038 1092 1177 1224 1303 K 0.377 0.357 0.331 0.315 0.297解:811lg 1.041k T=-分析作图结果:811ln 19.147( 1.041)1552819.93G RT k T T T∆==--=-+2. 略。
3. 在682℃测得Cd-Sn 合金的镉在不同浓度的蒸气压如表1—20。
试以(1)纯物质,(2)假想纯物质,(3)重量1%浓度溶液为标准态计算镉的活度及活度系数。
Cd P ,Pa Cd P ,Pa 1 27.8910⨯ 60 43.0310⨯ 20 31.1510⨯ 80 43.2210⨯ 40 32.3710⨯10043.2910⨯解:(1)以纯物质为标准态:CdCd Cd a f x =CdCdCd P a P *=CdCd Cd a r x =%%%CdCd Cd CdSnCdSnm x M M =+%Cd120 40 60 80 100 Cd x 0.0106 0.2088 0.4132 0.6130 0.8086 1.000 Cd a0.024 0.441 0.720 0.921 0.979 1.000 Cd r2.2642.1121.7421.5021.2111.000(2)以假想纯物质为标准态:247.89107.443100.0106H R Pa ⨯==⨯ CdCd H P a R =CdCdCd a f x =%Cd120 40 60 80 100 Cd x0.0105 0.2088 0.4132 0.6130 0.8086 1.000Cd a Cd f1.0000.9330.7700.6640.5350.44227.89101%i i DK Pa ==⨯ %%Cd Cda f =%Cd120 40 60 80 100 Cd a1.000 18.38 30.04 38.40 40.81 41.70 %f1.0000.9170.7510.6400.5700.4174. A-B 系合金在1000K 时组分A 的蒸气压如表1-21。
冶金物理化学 2

-1 θ ∆H 298 =-943.5(kJ·mol )
L 转变=3680 J·mol
-1
Ti(α ) Ti( β )
O2(g) TiO2(s)
C p =22+10.04×10-3T (J·K-1·mol-1) C p =28.90 (J·K-1·mol-1) C p =29.96+4.18×10-3T-1.67×105 T-2(J·K-1·mol-1) C p =75.19+1.17×10-3T-18.20×105 T-2(J·K-1·mol-1)
6.试求熔化 298K 下的 lkg 的 Pb 需多少热量。 已知:Pb(s)
C p =23.56+9.75×10-3T (J·K-1·mol-1)
T 熔点=600K,Mpb=207
7.已知: Ti(α ) + O2 ( s ) = TiO2 ( s )
K Ti(α ) 1155 → Ti( β )
PDF 文件使用 "pdfFactory Pro" 试用版本创建
转化 已知:1033K α Fe(强磁) 磁性 → α Fe(顺磁),△H 磁化=2760 J·mol
-1
→ γ Fe, ∆H ′ =920 J·mol 1183K α Fe(顺磁)
FeO Fe O2 FeO
例题
[例题 1]:电炉炼钢还原期,加入渣面上的碳粉能与渣中 CaO 作用生成 CaC2
(CaO)+ 3C(s)= (CaC2)+ CO(g) 试计算在高炉中能否发生上述反应生成 CaC2?已知高炉炉缸温度为 1523℃,高 炉渣中 (CaO) 活度 (以纯 CaO 为标准态) 为 0.01, 炉缸中 CO 分压为 1.5×105Pa。 假设高炉渣中 (CaC2) 服从拉乌尔定律, 渣中 CaC2 的摩尔分数 xCaC 2 达到 1.0×10-4 时即可认为有 CaC2 生成。已知下列热力学数据: Ca(l)+2C(s)= CaC2(s) Ca(l)= Ca(g) C(s)+
冶金物理化学3

(3) γ MnO = 1.2, γ SiO 2 = 1.4 (4) M Al 2O3 = 102kg⋅mol-1, M SiO 2 = 60 kg⋅mol-1, M MnO = 71 kg⋅mol-1 (答案:(1)不能,(2)能) 7. 根据铝在铁、银间的分配平衡实验,得到 Fe-Al 合金(0< xAl <0.25)中铝的活度系数在 1600℃时为 ln γ Al = 1.20 xAl -0.65。求 铁的摩尔分数 xFe =0.85 的合金中在 1600℃时铁的活 度。 (答案:0.83) *8. 将含 w[C] =3.8%、w[Si] =1.0% 的铁水兑入转炉中,在 1250℃下吹氧炼钢,假定气体 压力为 100kPa,生成的 SiO2 为纯物质,试问当铁水中[C]与[Si]均以纯物质为标准态以及均 以 1%溶液为标准态时,铁水中哪个元素先氧化? 已知:
习题
*1. 实验测得 Fe—C 熔体中碳的活度 a C (以纯石墨为标准态)与温度 T 及浓度 x C 的关系 如下 lg a C =lg (
xC x ) + 1180 -0.87+(0.72+ 3400 ) ( C ) T T 1 − 2 xC 1 − xC
(1) 求 lg γ C 与温度 T 及浓度 x C 的关系式;
*2.
Fe—Si 溶液与纯固态 SiO2 平衡,平衡氧分压 PO 2 =8.26×10-9Pa。试求 1600℃时[Si]在
以下不同标准态时的活度。(1) 纯固态硅 (2)纯液态硅 (3)亨利标准态 (4) w[Si] =1%溶 液标准态,已知 Si(s)+O2(g)= SiO2(s) ∆fGθ=(-902070+173.64T) Jžmol-1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
∆ r Gθ = RT ln PO2 = − RT ln PO2 / Pa 1.0315 ×105
= RT ln
= RT × 2.3lg( PO2 / Pa ) − RT ln1.0315 ×105
= −29.91×104 + 75.3T
由
1 Fe( s ) + O2( g ) + Al2O3 = FeO • Al2O3( S ) 2 3 2 Al( s ) + O2( g ) = Al2O3( S ) 2
Mn+ O2= MnO2
1mol O2 条件下: ∆GMnO2 θ = ∆ f GMnO2 θ = (−52300 + 201.76T )
代入 T=1000K
4 ○
则有
∆GMnO2 θ = 14.9 KJ / mol
Mn3O4
1 3 Mn+ O2= Mn3O4 2 2 1 1 ∆ f GMn3O4 θ = × (−1384900 + 350.62T ) 2 2
0 -601.8
θ θ H 298 − H0 / kJ / mol
-212.12
8656.7
解:先将气态 O2 的 fef 值换算为 298K 时的 fef
θ θ θ θ GT − H 298 Gθ − H 0 H θ − H0 [ = ]O2 [ T ]O2 − [ 298 ]O2 T T T
=-212.12-8656.7/1000 =-220.78 J/mol ⋅ k 由反应式
3 2 Al(l ) + O2 = Al2O3( S ) 2
∆ f Gθ = ( −1687200 + 326.8T ) J / mol
θ
试计算(1)FeAl2O4 的标准生成吉布斯自由能 ∆ f G 与 T 的关系式 (2)在 1600K 时上述电池的电动势为多少? 解 :(1) Fes +
1 O2( g ) + Al2O3 = FeO • Al2O3 (s) 2
= 2 × (−1986300 + 402.1T ) − 2 × (−1687200 + 326.8T ) − (−578200 + 166.5T )
= −20000 − 15.9T
代入 T=1600K 则有 ∆ r G = −45440 J / mol
θ
而由反应的电子交换数目知 z=4,则代入式 ∆G = − zFE 得 E=0.12V 1-8 利用吉布斯自由能函数法计算下列反应在 1000K 时的 ∆ f G
1 Mg (l ) + O2 = MgO( S ) 2 1 可知: ∆fef = fef MgO − fef O2 − fef Mg 2 1 = 48.1 − × (−220.78) − (−47.2) 2
=109.49 在 1000K 时有
θ ∆ f Gθ = ∆H 298 + T ∆fef
= −601.8 ×1000 + 1000 ×109.49
⇒ ∆H 0 =1681280
3 ∆S θ = S θ 298( Al2O3 ) − 2 S θ 298( Al ) − S θ 298(O2 ) 298 2 = 51.04 − 28.33 × 2 − 105.13 × 1.5
=-313.315
∆Gθ 298 = ∆H θ 298 − T ∆S θ 298
∆ r Gθ
∆ f GAl2O3
可知 FeAl2O4 的生成吉布斯自由能应为:
∆ f GFeAl2O4 = ∆ r Gθ + ∆ f GAl2O3
=−29.91× 104 + 75.3T + (−1687200 + 326.8T )
(2)
= −1986300 + 402.1T ∆G = − zFE
F 为法拉第常数,96487 C/mol
M= ln 0 T 298 298 + −= 1 ln T − 4.7 + 298 T T
(T − 298) 2 T 1 M1 = = − 298 + 44402 × 2T 2 T
代入上式可得:
∆Gθ T = −1673600 + 313.315T − T × [28.49 × ln T + T 1 −18.265 ×10−3 × ( − 298 + 44402 × )] 2 T
=28.49-18.265 ×10 T
−3
∆a = 28.49
∆b = −18.265 ×10−3
∆c = 0
∆c ' = 0
∆H θ T = ∆H 0 + ∆a • T +
∆b 2 ∆c 3 •T + • T − ∆c 'T −1 2 3
∆H θ 298 =∆H 0 + 28.49 × 298 + (−18.265 ×10−3 ) / 2 × 2982 =−16736H 2( g ) + O2( g ) = H 2O( g ) ∆ f GH = −249580 + 51.11TJ / mol 2O 2 1 Fe+ O2=FeO(S) ∆ f Gθ FeO 2 1 H2+ O2=H2O(g) ∆ f Gθ H 2O 2
∆Gθ (1)
由此可得:FeO(s)+H2(g)=Fe(s)+H2O(g) 且: ∆G(1) = ∆ f G 已知:T=1273K
1 Fes + O2( g ) + Al2O3 = FeO • Al2O3 (s) 2
3.128 ×104 lg( pO2 / pa ) = − + 12.895 T
∆ f Gθ = ( −578200 + 166.5T ) J / mol
在 1373-1700K 的平衡氧分压为 已知 Mo+O2=MoO2(S)
298 − 4.7 T
= −1681279 − 28.49T ln T + 498.75T + 9.13 × 10 T J / mol
2
−3
解法三:直接用 ∆G
θ
T
= ∆H θ 298 − T ∆S θ 298 + ∫ ∆c p dT − T ∫
298
T
T
∆c p T
298
dT
(适用于简单的 ∆c p 表达式) 1-6 利用气向与凝聚相平衡法求 1273K 时 FeO 的标准生成吉布斯自由能 ∆ f GFexO 。 已知:反应 FeO( S ) + H 2( g ) = Fe( s ) + H 2O( g ) 在 1273K 时的标准平衡常数 K = 0.668
=-1580232 因此: ∆ f G
θ
Al2O3
⇒I= 498.7
= −1681280 − 28.49 × T × ln T + 9.13 × 10−3 T 2 + 498.7T
解法二(定积分法) : 有以上 ∆c p 同样可知 ∆a , ∆b , ∆c = ∆c = 0
'
∆Gθ 298 = ∆H θ 298 − T ∆S θ 298 − T (∆aM 0 + ∆bM 1 + ∆cM 2 + ∆c ' M −2 )
=-1673600+313.315 × 298 =-1580232 因为: ∆G
θ
T
∆b 2 ∆c 3 ∆c ' −1 = ∆H 0 − ∆aT ln T − T − T + T + IT 2 3 2 −18.265 ×10−3 ) × 2982 + I × 298 2
∆Gθ 298 = −1681280 − 28.49 × 298 × ln 298 − (
则可得 T=2470K 故标准状态下的还原温度为 T=2470K (2)
2 ∆G = ∆ r Gθ + RT ln PMg
= ( 523000 − 211.71T ) + RT ln PMg
解法一(不定积分法) : ∆c p = ∆a + ∆bT + ∆cT + ∆c
2 '
1 T2
2Al+
3 O2=Al2O3 2
3 ∆c p ( Al3O2 ) = c p , Al3O2 ( s ) − c p ,O2 − 2c p , Al ( s ) 2 3 = (114.77 + 12.80 ×10−3 T ) − × (29.96 + 4.19 × 10−3 T ) − 2 × (20.67 + 12.39 × 10−3 T ) 2
J/mol J/mol J/mol J/mol J/mol
2Mn+O2=2 MnO 1mol O2 条件下: ∆GMnOθ =2∆ f GMnOθ =−2 × (−38490 + 76.36T )
代入 T=1000K
2 Mn2O3 ○
则有 ∆GMnO = −617.140 J / mol = 61.7 KJ / mol
θ θ θ
H 2O
− ∆ f Gθ FeO
K θ (1) =0.668
θ
则有 ∆G(1) = − RT ln K = 4270 J / mol
−249580 + 51.11×1273 − 4270 ∆ f Gθ FeO = ∆ f Gθ H 2O − ∆Gθ (1) =
=-188787 J/mol 1-7 利用电池 (Pt –Rh)|Fe(s),FeO • Al2O3,Al2O3(S)|ZrO2(CaO)(s)|MoO2(s),Mo(s)|(Pt-Rh) 测得反应
1mol O2 条件下: ∆GMn3O4 θ =
