秀丽线虫的研究和饲养PPT课件
秀丽线虫综述 (1)

4
喂养方法
➢ 用冰M9缓冲液清洗虫体 ➢ 置4℃环境20min ➢ 1000r离心,弃上清,沉淀物用M9缓冲液重悬 ➢ 置4℃环境20min 弃上清 ➢ 取200ul沉淀物以靠接法接种到涂有大肠杆菌OP50的 NGM培养基上 ➢将培养基放置到16℃生化培养箱中,72h后可繁育至第二 代
精选课件
5
• 冻存 准备1mlEP管,加入700ul30%甘油(s缓冲
秀丽隐杆线虫的饲养及研究用途
精选课件
By 王传杰
1
介绍
• 秀丽隐杆线虫(Caenorhabditis elegans),属于线形动物 门、线虫纲。体形非常小,成虫只有1mm左右。 线 虫 是 细 胞 定 数 动 物 , 两性 成虫 只有 9 5 9 个 体 细 胞 , 雄 性 成 虫 只 有 1 0 3 1 个 体细 胞 , 其 中 1 3 1个 细 胞 注 定 要 接 一 定 的发 育 程 序 陆续 死 亡 。 神 经 系 统解 剖结 构 十 分 简 单 , 仅有 3 0 2个细 胞 , 约 占整 个 动 物 体 细 胞 总 数 的 三 分 之 一 。它身体透明,能感 知气味和味道,对光线、温度有反应。研究者很容易在显 微镜下对其细胞和组织进行跟踪观察
显微注射后的整合
•目前常用的整合方法有:用 y射线和 X射线照射,或用光敏剂补骨脂素 加长波紫外线照射整合(TMP/UV integration). 基本策略是大量筛选经 •射线照射过的转基因线虫,一般挑取数百只 F1 代繁殖,筛选 F4 代, 检测是否有 100%的转基因表达,若是则说明整合成功. 一般一次整合 能得到若干个独立种系,可选择最好的一个进行实验.
出
容易脱水 而死
后的性腺被液体充 满.
精选课件
秀丽线虫

性别不同具有不同的细胞数。雌雄同体成虫含有959个体细 胞,约2000个生殖细胞,而雄性成虫则具有1031个体细胞 和1000个生殖细胞。
5.秀丽线虫有两种性别:雌雄同体和雄性。 雌雄同体可进行自我繁殖,也可与雄性交配繁殖;与雄
性交配的后代,50%是雌雄同体,50%为雄性。自我繁殖的 大多是雌雄同体,雄性个体以很低的频率自发产生。一条未 经交配的雌雄同体在生殖期可产生约300个后代。若与雄性 个体交配则产生多达1000个。
John E. Sulston
H. Robert Horvitz
2002年,Brenner和Horvitz、Sulston对器官 发育的遗传基础及程序性细胞死亡基因调控机 制的揭示,荣获了诺贝尔生理医学奖
Sydney Brenner
Andrew Z. Fire
Craigc. Mell
2006年,安德鲁· 法尔和克雷格· 梅洛获得诺贝尔生理医学奖, 以表彰他们发现了RNA干扰现象。
参考文献:
[1] Breener.S, The genetics of Caenorhabditis elegans [J].Genetics ,1974,77(1):7194 [2] /view/705699.htm [3] Stephen.J, Kenney.A, Garyl, et al. Persistence of EscherichiacoliO157: H7, Salmonella Newport and Salmonella Poona in thegut of a free-living nematode, Caenorhabditis elegans, and trans-mission to progeny and uninfected nematodes [ J]. International Journal of Food Microbiology,2005, 101: 227-236. [4] 庞林海,杜爱芳,李孝军等.秀丽隐杆线虫培养特性与保存方法研究[J].浙江农业学 报,2007,19(1):34-36 [5] Sulston JE. Neuronal cell lineages in the nematode, Caenorhabditis elegans [J]. Cold Spring Harb Symp Quant Biol,1983,48(2):443-452 [6] Simonetta SH, Golombek DA. An automated tracking system for Caenorhabditis elegans locomotor behavior and circadian studies application[J]. J Neurosci Methods, 2007, 161:273— 280. [7] Benedetti MG Foster AL,Vantipalli MC,et a1.Compounds that confer thermal stress resistance and extended lifespan[J]. Exp Gerontol, 2008, 43:882—89 1. [8] Verwaerde P'Cuvillier G Improved assay techniques using nematode worms: USA,US7083947[PI.2006-08—01.
【初中生物】线形动物和环节动物PPT课件15

线形动物和环节动物
一、线形动物
1.线形动物种类
寄生 生活
钩虫
蛲虫
蛔虫
自由生活 秀丽隐杆线虫
2.代表动物—蛔虫
2.1生活习性: 寄生在人的小肠里 2.2形态: 身体细长,呈圆柱形 雌虫较大,尾端尖直; 雄虫较小,尾部向腹面卷曲
雌虫
雄虫
蛔虫
2.3结构: 有口和肛门,体表包裹着一 层密不透水的角质层 2.4消化: 消化管结构简单,肠仅由一 层细胞构成 2.5生殖: 生殖器官发达 2.6运动: 没有专门的运动器官,靠 身体的弯曲和伸展缓慢蠕动
氧气
外界空气
湿润黏滑的体表还可以减少身体与土壤 表面的摩擦
1.4食性
蚯蚓以土壤中的有机物或植物的茎、叶为食。
好啊,要 吃饼干吗?
你好。
小结
项目 特点
身体呈圆筒形, 有许多相似的环 状体节构成,有 刚毛 体壁可分泌粘 液,有丰富的 毛细血管
适应环境
使运动灵活, 适应陆地环境
形态结构
生理功能
可与外界进 行气体交换, 进行呼吸
总结
线形动物的主要特征:
身体细长,呈圆柱形;体表有角质层; 有口有肛门。
二、环节动物
实验:观察蚯蚓
1.蚯蚓的身体是否呈两侧对称? 2.身体分节对运动有什么意义?刚毛在运 动中起到什么作用? 3.体表粘液有什么意义?在实验中为什么 要保持蚯蚓体表的湿润?
1.代表动物——蚯蚓
• 1.1蚯蚓的形态结构 蚯蚓的身体呈圆筒形,有许多相似的环状体节构成。 肛 门 体 节 环 带 口
线形动物
有无体节 体表特征
无体节 体表光滑,有角质层
环节动物
有环形体节
体表有粘液, 有刚毛或疣足 靠刚毛或疣足辅助 运动,运动时身体 粗细与长短的变化
秀丽线虫综述(1)

需要确定荧光蛋白的连接不影响目的蛋白的功能; b. 目的基因与荧光标记基因共注射;c. 目的基因 与具有明显表型的标记基因共注射,我们通常使用易观察的 pmyo-3::TDimer II作为
荧光标记,它在所有体壁肌肉细胞表达,转基因效率高且本身对线虫的行为 和功能 没有 影响。
显微注射后的整合
•目前常用的整合方法有:用 y射线和 X射线照射,或用光敏剂补骨脂素 加长波紫外线照射整合(TMP/UV integration). 基本策略是大量筛选经 •射线照射过的转基因线虫,一般挑取数百只 F1 代繁殖,筛选 F4 代, 检测是否有 100%的转基因表达,若是则说明整合成功. 一般一次整合
CED-3:凋亡蛋白,与 ICE(caspase家族)同 源
低氧能够引起秀丽线虫发生相应的生理和行为学变 化,并可保护机体免受缺氧损伤。秀丽 线虫的低氧诱导因子(HIF-1)的恒定性调控通路和人 类的相应通路之间具有高度保守性,因此秀丽线虫 也已成为研究低氧应答调控通路进化保守性的重要 工具之一。阐明秀丽线虫的低氧应答机制将为了解 人类低氧相关疾病的发病机制提供有价值的线索。
注射时将 线虫挑至 琼脂糖固 定垫上, 调整线虫 使性腺暴 露,滴加 注射油覆 盖整个虫 体. 固定 好后的操 作要迅速, 否则线虫 容易脱水 而死
将琼脂糖固定垫放 在载物台上,40x物 镜下找到线虫,使 性腺聚焦在正确的 平面. 操作微操或 轻移滑动载物台, 将注射针尖刺入性 腺. 启动微量加压 器进行注射,能观 察到注射液在性腺 中快速流动,注射 后的性腺被液体充 满.
• 冻存 准备1mlEP管,加入700ul30%甘油(s缓冲 液溶解)
用冰M9缓冲液清洗虫体
置4℃环境20min,1000r离心弃去上清
寄生虫线虫PPT课件

寄生虫线虫的生活史
生活环境
寄生虫线虫通常生活在 宿主体内或与宿主接触
的环境中。
感染途径
寄生部位
生命周期
宿主通过摄入被寄生虫 污染的食物或水,或者
通过皮肤接触感染。
寄生虫线虫通常寄生于 宿主的消化系统、呼吸 系统、泌尿系统等部位。
寄生虫线虫的生命周期 通常包括孵化、感染、
繁殖和传播等阶段。
02 寄生虫线虫的传播途径
寄生虫线虫可以通过接触被污染的物品传播,如接触被感染的土壤、水源或与 感染者的日常接触。
生物媒介传播
昆虫传播
某些寄生虫线虫可以通过昆虫媒介传播,如蚊子、苍蝇或其他昆虫叮咬感染者和 易感者之间的传播。
动物传播
某些寄生虫线虫可以通过动物媒介传播,如啮齿动物、家禽、宠物等携带线虫, 并通过与人类接触传播给人类。
寄生虫线虫的寄生会影响宿主 的生理机能,如影响宿主的消 化、呼吸、循环等系统。
寄生虫线虫的寄生会导致宿主 出现各种生理症状,如恶心、 呕吐、腹泻、发热等。
寄生虫线虫的寄生还会导致宿 主出现病理生理变化,如贫血、 低蛋白血症等。
寄生虫线虫对宿主的行为影响
寄生虫线虫的寄生会影响宿主的 行为,使宿主表现出异常的行为,
04
粪便检查
通过粪便检查可以检测到寄生 虫线虫的卵囊或幼虫,常用的 方法有直接涂片法和沉淀法。
血液检查
对于一些寄生于血液中的线虫 ,如非洲锥虫等,可以通过血
液检查来确诊。
组织检查
对于一些寄生于组织器官中的 线虫,如肺吸虫等,可以通过
组织活检来确诊。
其他检测方法
如免疫学检测、分子生物学检 测等,也可以用于寄生虫线虫
疫苗免疫保护机制研究
深入研究疫苗免疫后机体的免疫应答机制,包括体液免疫和细胞免 疫,以及免疫保护的持久性和免疫记忆。
秀丽隐杆线虫

研究历史
秀丽隐杆线虫1900年,Maupas把这种棒状的蠕虫命名为Rhabditis elegans,因为群体繁殖为“r-选择”的 缘故,早在1948年Dougherty and Calhoun便指出了它在遗传学研究中的重要性。1952年,Osche把它置于 Caenorhabditis亚属,1955年Dougherty最终把它命名为Caenorhabditis elegans(其中Caeno意为 recent; rhabditis意为 rod; elegans意为nice)。广泛使用N2 Bristol品系,由Staniland从英格兰Bristol附近的 蘑菇堆肥中分离,1965年被定为参考种N2。在此过程中,Dougherty建立了线虫的琼脂板接种,大肠杆菌的培养 方法和无菌单培养方法。对秀丽线虫的早期研究工作,主要集中在解剖、营养、生理和生殖等方面,直到1960s 中期,随着DNA双螺旋结构的揭示和遗传密码的发现,使得当时的生物学家认为,“人脑是生命科学研究的最后 堡垒。”
研究意义
细胞凋亡现象及其机理,最早是在线虫中被揭示的。凋亡(apoptosis)是一个希腊文来源的词语,这个字 眼表达的是花儿凋谢,树叶飘零的景色。“梧桐一叶落而知天下秋 ”、“搦搦兮秋风,洞庭波兮木叶下 ”的意 象恐怕正是说的这种意境:优雅,含蓄,还带点淡淡的忧伤,更因为飘落时那种虽然有些无奈却坦然以受之的美。 由于线虫研究开创了一个对今日生物医学发展,具有举足轻重的全新领域,同时也因为以线虫为基础的凋亡研究 对基础和应用生物学,产生的巨大推动作用,卡罗林斯卡医学院的诺贝尔奖评选委员,会将年2002年生理和医学 奖授予了,线虫生物学的开拓者:西德尼·布雷纳(Sydney Brenner)、约翰·萨尔斯顿(John Sulston)和 线虫凋亡之父罗伯特·霍维茨(Robert Horvitz)。
线虫 概论PPT课件

成虫内部构造
1.体壁 体壁 线虫体壁 自外向内由角皮 层、皮下层及纵 肌层组成。
成虫内部构造
纵肌层:由纵向单行排列的无横纹梭形细胞构成, 被纵索分割为四区。按每区肌细胞的数量、大小以 及排列方式,可将纵肌层分为三种肌型,即肌细胞 少而大的为少肌型,如钩虫;肌细胞多而长的为多 肌型,如蛔虫;以及肌细胞细而密的细肌型,如鞭 虫。
肺蛔虫症,亦称Loffler’s syndrome: 这种由蛔虫幼虫引起的肺炎及哮喘也
称之为肺部的炎性浸润和血中嗜酸性细胞 增多通常称之为肺蛔虫症。
2.成虫
蛔虫对人体的致病作用主要由成虫 引起,可有以下几种表现: (1)损伤肠粘膜 蛔虫唇齿机械作用
和代谢产物化学刺激损伤肠粘膜。 临床称之为肠蛔虫病。 (2)夺取营养 蛔虫不但掠夺宿主营 养,损伤肠粘膜,造成食物的消 化和吸收障碍。 (3)引起变态反应 蛔虫亦可使宿 主出现-------------------------------------------------幼虫---------------
经门静脉系统到肝----经右心到肺---穿过肺毛细血管进入肺泡 约在感染后10d内
沿支气管、气管移行至咽部----被吞咽入食管---经胃到小肠---第四次蜕皮
四、实验诊断
常见并发症的诊断:
④肝蛔虫病,主要表现为蛔虫性肝脓肿 或肝破裂,临床特点为右上腹痛(初 为阵发性,后变为持续性)、持续高 热和肝肿大,要明确诊断靠剖腹探查。
五、流行
蛔虫感染十分普遍的主要原因是: ①在外界环境中无需中间宿主而直接发育为感染
期卵; ②蛔虫产卵量大; ③虫卵对外界不利因素的抵抗力强; ④使用未经无害化处理的人粪施肥或随地大便,
(4)常见的并发症
胆道蛔虫症是最常见的并发症。 蛔虫性肠梗阻。 蛔虫性阑尾炎。 蛔虫性胰腺炎。
秀丽隐杆线虫的培养与保存研究

操作同 1. 4, 将 L B 培养液换成蒸馏水。
2 结果
2. 1 不同培养基对虫体生长发育的影响 将同量秀丽隐杆线虫分别接种于 OP50- NGM、
JM 109- NGM 、OP50- L B、JM109- L B 四种 不同 培养 基上, 每组培养基各 2 份, 置于 20 培养箱中培养。 在 4 种不同培养基上, 肉眼可见有大量虫体蠕动, 镜 检发现大量不同期的 幼虫和成虫。第 1 组( OP 50NGM) : 第 4 天, 成虫和虫卵数均达到最高值, 成虫 数大约 2. 5 个/ mm2 , 虫卵数大约 17. 0 个/ mm2; 第 6 天, 幼虫 数达 到最 高值, 75. 0 个/ mm2。 第 2 组 ( JM109- NGM ) : 第 4 天, 成虫和虫卵数均达到最高 值, 成 虫 数 大 约 1. 0 个/ mm2 , 虫 卵 数 大 约 12. 0 个/ mm2 ; 第 6 天, 幼 虫 数 达 到 最 高 值, 60. 0 个/ mm2 。第 3 组 ( O P50- L B) : 第 4 天, 成虫和虫卵 数均达到最高值, 成虫数大约 1. 3 个/ mm2 , 虫卵数 大约 4. 3 个/ m m2; 第 6 天, 幼虫数达到最高值, 9. 3 个/ mm2 。第 4 组 ( JM 109- L B) : 第 4 天, 成虫和虫 卵数均达到最高值, 成虫数大约 0. 7 个/ mm2 , 虫卵 数大约 3. 2 个/ mm2 ; 第 6 天, 幼虫 数达到最 高值,
( K ey L abor ator y of Veter inar y P ar asitology of Gans u P ro vince/ State K ey L abor ator y of Veter inar y Etiolog ical Biology / L anz hou Veter inar y Resear ch I nstitute , Chinese A cademy of A gr icul tur al Sciences , L anz hou 730046, China)
秀丽线虫

秀丽线虫的研究进展秀丽线虫(Caenorhadits elegans)是研究动物遗传、个体发育及细胞生命活动的重要模式动物。
近年来,国际上以秀丽线虫为实验材料的生命科学研究取得了重要突破,分别在2002 年和2006 年两次获得诺贝尔生理医学奖。
在国内,越来越多的科研人员开始将秀丽线虫应用于自己的研究领域。
近年来,随着人们对其的研究日益深人,秀丽隐杆线虫以其独特的优势成为生物学家借以了解诸多基本生命现象的优良。
秀丽隐杆线虫(Caenorhabditis elegans)在当代生命科学的发展过程中起着举足轻重的作用。
20 世纪60年代,分子遗传学的奠基人之一Brenner在和Crick等人一起确立了分子遗传学的中心法则以后,感到分子生物学的主要问题已经解决,生物学的未来应着眼于发育生物学和神经生物学等复杂问题的研究。
Brenner 试图寻找一种比果蝇更简单的、具有神经细胞的多细胞生物来探索个体及神经发育的遗传调控机制。
在经过了一系列的尝试后,他最终选择了秀丽线虫(C. elegans)为研究对象。
在此之前,Nigon 和Dougherty等已经在秀丽线虫的营养生长和有性生殖等方面做了许多前期工作。
线虫作为模式动物的优势线虫的饲养条件具有简单、廉价、易操作的特点,线虫成虫体长1mm,身体半透明,以大肠杆菌为食饵,从受精卵发育到成虫仅需不到四天时间。
在自然状态下线虫是一种可以自我繁殖的雌雄同体生物,因此繁殖起来也很迅速,这种能自我繁殖的能力还非常有利于得到具有同一基因结构的纯合体线虫。
另外,秀丽线虫还存在一种雄性个体,它不能自我繁殖,必须与雌雄同体的线虫交配才可繁衍后代。
利用雄性个体,人们可以将突变基因从一种线虫转移到另一种线虫中去。
线虫还可以像培养细胞一样保存在- 80℃。
这一优势是果蝇和小鼠等模式生物所不具备的。
秀丽线虫是第一个完成基因组测序的动物,它的约20 000个基因中有40%和人类基因具有同源性。
秀丽线虫电子教案

秀丽线虫秀丽线虫的研究进展摘要:秀丽线虫(Caenorhadits elegans)是研究动物遗传、个体发育及细胞生命活动的重要模式动物。
近年来利用线虫这种模式生物已经在生命科学的许多领域取得了突破性的研究成果:信号转导、衰老、细胞凋亡、热应激反应、环境科学、性别决定、神经肌肉发育、细胞分化、神经分化诱导和行为认知等。
关键词:秀丽线虫;衰老;细胞凋亡;环境科学;性别决定;神经分化诱导;行为认知导言:秀丽隐杆线虫(Caenorhabditis elegans)在当代生命科学的发展过程中起着举足轻重的作用。
近年来,随着人们对其的研究日益深人,秀丽隐杆线虫以其独特的优势成为生物学家借以了解诸多基本生命现象的优良。
近年来,国际上以秀丽线虫为实验材料的生命科学研究取得了重要突破,分别在2002 年和2006 年两次获得诺贝尔生理医学奖。
在国内,越来越多的科研人员开始将秀丽线虫应用于自己的研究领域。
20 世纪60年代,分子遗传学的奠基人之一Brenner在和Crick等人一起确立了分子遗传学的中心法则以后,感到分子生物学的主要问题已经解决,生物学的未来应着眼于发育生物学和神经生物学等复杂问题的研究。
Brenner 试图寻找一种比果蝇更简单的、具有神经细胞的多细胞生物来探索个体及神经发育的遗传调控机制。
在经过了一系列的尝试后,他最终选择了秀丽线虫(C. elegans)为研究对象。
在此之前,Nigon 和Dougherty等已经在秀丽线虫的营养生长和有性生殖等方面做了许多前期工作。
1、线虫作为模式动物的优势线虫的饲养条件具有简单、廉价、易操作的特点,线虫成虫体长1mm,身体半透明,以大肠杆菌为食饵,从受精卵发育到成虫仅需不到四天时间。
在自然状态下线虫是一种可以自我繁殖的雌雄同体生物,因此繁殖起来也很迅速,这种能自我繁殖的能力还非常有利于得到具有同一基因结构的纯合体线虫。
另外,秀丽线虫还存在一种雄性个体,它不能自我繁殖,必须与雌雄同体的线虫交配才可繁衍后代。
5.1.2线形动物和环节动物(1)PPT课件

2、体形:呈 圆柱形,前端有 口 ,后 端有 肛门 。
3、体表:包裹着一层 角质层,能抵抗
消化液侵蚀,具有 保护 作用。
蛔虫结构示意图
4
-
4、消化:消化管结构 简单 ,肠仅由
一层细胞 组成,可消化小肠中的食糜。
5、生殖:生殖器官发达,生殖能力 强 。
6、运动:没有专门的 运动器官,只能 靠身体的弯曲和伸展缓慢地 蠕动 。
2.身体分节对于运动有什么意义?刚毛在运动中 起什么作用?
3.体表黏液有什么意义?在实验过程中为什么要 使蚯蚓体表保持湿润 ?
12
-
点拨指导
(一)蚯蚓的外部形态:
体形:呈 长圆筒 形。 身体:许多相似环形 体节 。 体表:有 黏液 。
肛 门
体 节
腹面:有许多小突起,这些小突后端 起就是 刚毛 , 触摸有粗糙感
3.它的体壁能分泌_黏__液___,使体表保持_湿__润__。体壁密布__毛__细__血__管_,氧气可 溶于体表的黏液里,再进入体壁的毛细血管中,体内的二氧化碳经体壁 的____毛__细__血__管由体表排出
6
-
合作交流
观察思考:
1、观察课本P8蛔虫结构示意图,看雌雄蛔虫的形状、大小有什么不 同,体色和体表有什么特征。 2、观察蛔虫的内部结构,你认为蛔虫的哪些结构特点是与寄生生活 相适应的? 3、列出常见的线形动物并归纳线形动物的主要特征。 4、蛔虫寄生在人体,会引起哪些疾病? 5、如何预防蛔虫病?
___A__C_D___属于线形动物。
A.蛔虫; B.蚯蚓; C.小麦线虫; D.丝虫; E.蛭; F.沙蚕。
23
-
3.如何区别某个动物是环节动物还是 线形动物?
4.雨后,蚯蚓往往会爬到地面上来, 这是为什么?如果农田中的蚯蚓消失 了,农作物的生长会不会受到影响? 为什么?
线虫
2015/10/16
无脊椎动物学
3
•
此外,线虫的生命周期很短,它从生 到死的全过程只有3天半,可不间断的观 察并追踪每个细胞的演变。
•
通过20年的努力,到90年代中期,人 们已经建立了完整的线虫从受精卵到所有 成体细胞的谱系图。
2015/10/16
无脊椎动物学
4
• 精子和卵细胞的形成是贯穿个体发育的主
贝尔奖。
2015/10/16 无脊椎动物学 10
•
• 秀丽线虫,成为模型动物之一,研究者由此获得了2002年诺
8.2 线虫动物门
8.2.3.线虫动物门的主要特征
1、生活环境:分布极广,约15000种
• 植食性线虫:以细菌、藻类、真菌及腐败
有机物为食。 • 肉食性线虫:以原生动物、轮虫及其它线 虫为食 • 寄生线虫:以人、植物、动物为寄主
•
2015/10/16 无脊椎动物学 9
• 8.2 线虫动物门 • 线虫发育时共有1090个细胞产生,但经过细胞编 程性死亡,正好消灭131个细胞,结果构成了一个由 959个体细胞组成的线虫。
•
细胞编程性死亡是一种主动的由基因决定的细胞 自我破坏过程,是正常的细胞死亡。现在我们还知道, 有关线虫细胞死亡的绝大多数基因,在人的体细胞中 也都能找到。 若人体内细胞不能进行正常的程序性死亡,则会患 病,如艾滋病、癌症等。
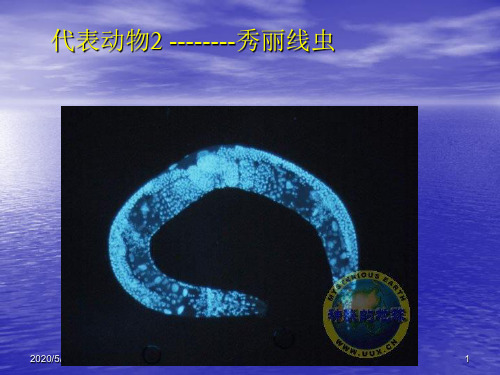
代表动物2 --------秀丽线虫
2015/10/16
无脊椎动物学
1
•
秀丽线虫是研究动物遗传、个体发育及 细胞生命活动的重要模式动物。
•
近年来,国际上以秀丽线虫为实验材料 的生命科学研究取得了重要突破,分别在 2002年和2006年两次获得诺贝尔生理医学奖。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射时将 线虫挑至 琼脂糖固 定垫上, 调整线虫 使性腺暴 露,滴加 注射油覆 盖整个虫 体. 固定 好后的操 作要迅速, 否则线虫 容易脱水 而死
将琼脂糖固定垫放 在载物台上,40x物 镜下找到线虫,使 性腺聚焦在正确的 平面. 操作微操或 轻移滑动载物台, 将注射针尖刺入性 腺. 启动微量加压 器进行注射,能观 察到注射液在性腺 中快速流动,注射 后的性腺被液体充 满.
饲养与冻存
设备试剂: 大肠杆菌OP50 —— 大肠杆菌OP50是尿嘧啶渗漏突变型,作为 秀丽隐杆线虫的食物。
NGM培养基——1000ml的NGM培养基内加有:3gNaCl,2.5g蛋白 胨,17g琼脂,1mol/LK2HPO4-KH2PO4缓冲液(pH=6.0)25ml,975ml蒸 馏水,灭菌后加入分别抽滤除菌的1ml胆固醇溶液(5mg/ml乙 醇),1mol/LMgSO41ml,1mol/L的 CaCl 21ml
肪代谢等)
方法 —— 线虫基因显微注射
显微注射技术是线虫研究领域的常用技术,对 线虫进行转基因操作的一种高效且相对简单的 方法,主 要用于研究线虫突变种系的功能恢 复(mutant rescue)、特定基因的过表达或异 位表达、标 签 蛋白的 表达、特 定 蛋白 质 结构域的功 能、DNA 或 RNA 调节元件的分析 及 RNA 干扰等. 此外,这项转基因技术对于 特异表型的筛选也是个强有 力 的 工具 , 并 且 它还 可 用于 将人 工 合 成 mRNAs 或其他分子接引入细胞
设备
• 显微注射全套仪器 • 琼脂糖固定垫• 添 加 了 4% 葡萄糖 (glucose) 的 M9 缓
冲液
注射步骤
制剂及破针
固定虫
注射
恢复
将纯化的 DNA 溶解在 TrisEDTA(TE)缓冲液中即可接用于 注射。在注射液中加入终浓 度约 10 mg/L 的线虫基因组 DNA,则会有效地提高转基因 效率。 将一小玻片放在加了注射油的 固定垫上,操纵微操使注射针 与玻片边缘相撞,若针头尖端 撞破,可观察到有液泡自动渗 出
显微注射后的整合
•目前常用的整合方法有:用 y射线和 X射线照射,或用光敏剂补骨脂素 加长波紫外线照射整合(TMP/UV integration). 基本策略是大量筛选经 •射线照射过的转基因线虫,一般挑取数百只 F1 代繁殖,筛选 F4 代, 检测是否有 100%的转基因表达,若是则说明整合成功. 一般一次整合 能得到若干个独立种系,可选择最好的一个进行实验.
CED-9:抗凋亡蛋白,与 人体bcl-2同源
CED-4:促凋亡蛋白,同 源体为Apaf-1
CED-3:凋亡蛋白,与 ICE(caspase家族)同 源
低氧能够引起秀丽线虫发生相应的生理和行为学变 化,并可保护机体免受缺氧损伤。秀丽 线虫的低氧诱导因子(HIF-1)的恒定性调控通路和人 类的相应通路之间具有高度保守性,因此秀丽线虫 也已成为研究低氧应答调控通路进化保守性的重要 工具之一。阐明秀丽线虫的低氧应答机制将为了解 人类低氧相关疾病的发病机制提供有价值的线索。
置4℃环境20min
1000r离心,弃上清,沉淀物用M9缓冲液重悬
置4℃环境20min 弃上清
取200ul沉淀物以靠接法接种到涂有大肠杆菌OP50
的NGM培养基上
将培养基放置到16℃生化培养箱中,72h后可繁育至第二代
• 冻存 准备1mlEP管,加入700ul30%甘油(s缓冲液
溶解)
用冰M9缓冲液清洗虫体
秀丽隐杆线虫的饲养及研究用途
By 王传杰
介绍
• 秀丽隐杆线虫(Caenorhabditis elegans),属于线形动 物门、线虫纲。体形非常小,成虫只有1mm左右。 线 虫 是 细 胞 定 数 动 物 , 两性 成虫 只有 9 5 9 个 体 细 胞 , 雄 性 成 虫 只 有 1 0 3 1 个 体细 胞 , 其 中 1 3 1个 细 胞 注 定 要 接 一 定 的发 育 程 序 陆续 死 亡 。 神 经 系统解 剖结 构 十 分 简 单 , 仅有 3 0 2个细 胞 , 约 占整 个 动 物 体 细 胞 总 数 的 三 分 之 一 。它身体透明,能感知气味和味道,对 光线、温度有反应。研究者很容易在显微镜下对其细胞和 组织进行跟踪观察
M9缓冲液——每升缓冲液中含15.12gNa2HPO4#12H2O(或 6gNa2HPO4),3gKH2PO4,5gNaCl,0.25gMgSO4#7H2O,宜现用现配
S缓冲液——0.1mol/LNaCl,0.05mmol/L K2HPO4-KH2PO4缓冲液 (pH=6.0)
喂养方法
用冰M9缓冲液清洗虫体
置4℃环境20min,1000r离心弃去上清
将虫体转入事先准备好的EP管中,置于-80℃ 冰箱冻存(可保存2个月),需要时取出室 温解冻重置培养基
研究范围
细胞程序性死亡的遗传调控机制 RNAi 及其作用机制 秀丽线虫的功能基因组学及其他研究 低氧应答模式生物
基因组学和功能蛋白组学的研究 其他(MAPK 信号传导 、 TGF- b 信号传递途径 、衰老和年龄及脂
现阶段研究已发现了十几个控制细胞 凋亡的基因,这些凋亡基因之间通过 遗传相互作用组成一条线性的调控途 径控制细胞程序性死亡,包括凋亡的 激活阶段、凋亡的起始 、凋亡细胞的 清除及凋亡细胞内部的 DNA 降解
EGL-1:促凋亡蛋白,属 BCl—2蛋白家族,与哺乳动 物BAD、BIK/NBK及HRK同源
在体视显微镜下, 滴加恢复缓冲液至 注射后的线虫正上 方,由于与油互不 相溶,缓冲液会渗 入油下使线虫浮起 . 一般等待 2~ 5 min,线虫活力 恢复,身体开始游 动,即可挑至培养 板上,20℃ 常规 培养.
SUCCESS
THANK YOU
2019/7/25
子代目的基因表达检测
注射后约 3 天,观察孵出的 F1 代是否有目的 DNA 表达. 目前,线虫外源基因表达的标记通常 用:a. 荧光蛋白与目的蛋白形成融合蛋白,但 需要确定荧光蛋白的连接不影响目的蛋白的功能; b. 目的基因与荧光标记基因共注射;c. 目的基因 与具有明显表型的标记基因共注射,我们通常使用易观察的 pmyo-3::TDimer II作 为荧光标记,它在所有体壁肌肉细胞表达,转基因效率高且本身对线虫的行为 和功 能没有 影响。
