中山大学1996年无机化学(高分子)
中山大学化学与化学工程学院年硕士研究生复

中山大学化学与化学工程学院年硕士研究生复试名单-副本中山大学化学与化学工程学院2014年硕士研究生复试名单考生姓名报考专业名称报考研究方向名称总分复试专业复试方向江春燕化学无机化学413化学无机化学谢凯平化学无机化学403化学无机化学张艳丽化学无机化学387化学无机化学王思敏化学无机化学386化学无机化学周萌化学无机化学382化学无机化学刘冰洋化学无机化学376化学无机化学蒋忠霞化学无机化学370化学无机化学钟镇松化学无机化学370化学无机化学孙敬华化学无机化学366化学无机化学曹剑骏化学无机化学365化学无机化学郭振斌化学无机化学363化学无机化学易夏化学无机化学361化学无机化学严华化学无机化学360化学无机化学张祥琼化学无机化学357化学无机化学李碧权化学无机化学352化学无机化学万琴化学无机化学352化学无机化学范文杰化学无机化学345化学无机化学莫宗文化学无机化学342化学无机化学姜方茹化学无机化学341化学无机化学熊健化学无机化学339化学无机化学陈上超化学无机化学333化学无机化学周晓薇化学无机化学322化学无机化学梁玲化学无机化学312化学无机化学李海荣化学无机化学311化学无机化学郭岩化学无机化学310化学无机化学王顺化学无机化学310化学无机化学卢琳化学无机化学303化学无机化学陈韦良化学无机化学300化学无机化学刘泽邦化学分析化学407化学分析化学郑诗越化学分析化学394化学分析化学扶昭富化学分析化学393化学分析化学李三梅化学分析化学384化学分析化学詹以森化学分析化学375化学分析化学朱厚亚化学分析化学374化学分析化学罗静静化学分析化学373化学分析化学张池芳化学分析化学363化学分析化学易佳化学分析化学363化学分析化学王子杏化学分析化学359化学分析化学黄小楠化学分析化学358化学分析化学陈俊化学分析化学358化学分析化学黎佩珊化学分析化学352化学分析化学何园缘化学分析化学351化学分析化学梁塑化学分析化学351化学分析化学何秋桔化学分析化学351化学分析化学李立平化学分析化学351化学分析化学陈亚琴化学分析化学345化学分析化学冯燕燕化学分析化学342化学分析化学赵英化学分析化学341化学分析化学许冬琳化学分析化学330化学分析化学吴晓娟化学分析化学329化学分析化学田炎祖化学分析化学328化学分析化学张丽云化学分析化学325化学分析化学罗杰化学有机化学421化学有机化学刘想化学有机化学416化学有机化学曹庆翔化学有机化学409化学有机化学谭春兵化学有机化学386化学有机化学刘辉化学有机化学384化学有机化学张建友化学有机化学383化学有机化学彭志刚化学有机化学383化学有机化学吴雪彬化学有机化学381化学有机化学朱国勋化学有机化学380化学有机化学王岩化学有机化学375化学有机化学符国华化学有机化学374化学有机化学付洪光化学有机化学374化学有机化学王丹丹化学有机化学374化学有机化学黄冬婷化学有机化学372化学有机化学周嘉明化学有机化学372化学有机化学孙国权化学有机化学371化学有机化学李永芳化学有机化学366化学有机化学王新峰化学有机化学365化学有机化学何雄斌化学有机化学365化学有机化学林雨翔化学有机化学364化学有机化学孙荣钦化学有机化学358化学有机化学朱蓉蓉化学有机化学350化学有机化学谢洋化学有机化学350化学有机化学陈丽化学有机化学349化学有机化学肖斌化学有机化学349化学有机化学曾紫毅化学有机化学339化学有机化学黄东鹏化学有机化学338化学有机化学邓袁元化学有机化学308化学有机化学许佳怡化学有机化学305化学有机化学杨杰波化学有机化学305化学有机化学刘丽平化学物理化学407化学物理化学邱伟涛化学物理化学400化学物理化学张竹莲化学物理化学399化学物理化学冯娟化学物理化学386化学物理化学王树加化学物理化学374化学物理化学尹少云化学物理化学374化学物理化学王峰化学物理化学373化学物理化学刘世君化学物理化学364化学物理化学王中恒化学物理化学361化学物理化学骆阳化学物理化学359化学物理化学邓阳华化学物理化学356化学物理化学李胤午化学物理化学350化学物理化学丁亚娟化学物理化学343化学物理化学王二荣化学物理化学339化学物理化学王付鑫化学物理化学333化学物理化学谭铭希化学物理化学325化学物理化学李雨晴化学高分子化学与物理398化学高分子化学与物理黎天云化学高分子化学与物理397化学高分子化学与物理谭韵红化学高分子化学与物理392化学高分子化学与物理许鸿基化学高分子化学与物理389化学高分子化学与物理陈辉豪化学高分子化学与物理388化学高分子化学与物理吴嘉龙化学高分子化学与物理388化学高分子化学与物理应宗航化学高分子化学与物理388化学高分子化学与物理黄有娣化学高分子化学与物理379化学高分子化学与物江远文化学高分子化学与物理379化学高分子化学与物理郑成章化学高分子化学与物理379化学高分子化学与物理张谭妹化学高分子化学与物理376化学高分子化学与物理彭斯敏化学高分子化学与物理371化学高分子化学与物理王贤宏化学高分子化学与物理367化学高分子化学与物理罗浩化学高分子化学与物理367化学高分子化学与物理徐军化学高分子化学与物理365化学高分子化学与物理蒋莉化学高分子化学与物理360化学高分子化学与物理刘莹化学高分子化学与物理359化学高分子化学与物理李婷化学高分子化学与物理359化学高分子化学与物理左铭祥化学高分子化学与物理357化学高分子化学与物理胡杜化学高分子化学与物理355化学高分子化学与物理郭毅洋化学高分子化学与物理352化学高分子化学与物理瞿伦君化学高分子化学与物理351化学高分子化学与物郑丽敏化学高分子化学与物理351化学高分子化学与物理陈嘉瑶化学高分子化学与物理349化学高分子化学与物理辛亚川化学高分子化学与物理348化学高分子化学与物理张超化学高分子化学与物理347化学高分子化学与物理杨柳鸿化学高分子化学与物理346化学高分子化学与物理梁慧化学高分子化学与物理343化学高分子化学与物理张力化学高分子化学与物理343化学高分子化学与物理杨鸿毓化学高分子化学与物理341化学高分子化学与物理罗凌超化学高分子化学与物理332化学高分子化学与物理李晓栋化学高分子化学与物理329化学高分子化学与物理熊锦城化学高分子化学与物理326化学高分子化学与物理邓乐杰化学高分子化学与物理325化学高分子化学与物理梁锐轩化学高分子化学与物理321化学高分子化学与物理彭璞璞化学高分子化学与物理314化学高分子化学与物理叶盼化学高分子化学与物理311化学高分子化学与物理姚国欢化学高分子化学与物理311化学高分子化学与物理韦天富化学高分子化学与物理311化学高分子化学与物理陈俊达化学高分子化学与物理308化学高分子化学与物理杨柳化学高分子化学与物理307化学高分子化学与物理王爽化学高分子化学与物理301化学高分子化学与物理侯斌化学化学生物学358化学化学生物学钟志伟化学化学生物学333化学化学生物学陈林林材料科学与工程材料物理与化学343材料科学与工程材料物理与化学文阿浩材料科学与工程材料物理与化学334材料科学与工程材料物理与化学李志浩化学工程与技术工业催化372化学工程与技术工业催化张玉银化学工程与技术工业催化350化学工程与技术工业催化谢桂雄化学工程与技术工业催化345化学工程与技术工业催化何千化学工程与技术化学工程405化学工程与技术化学工程杨腾飞化学工程与技术化学工程397化学工程与技术化学工程徐芳芳化学工程与技术化学工程374化学工程与技术化学工程陈俊杰化学工程与技术化学工程370化学工程与技术化学工程包江威化学工程与技术化学工程350化学工程与技术化学工程陈宏现化学工程与技术化学工程332化学工程与技术化学工程周君贤化学工程与技术化学工程311化学工程与技术化学工程汤敏妮化学工程与技术化学工艺395化学工程与技术化学工艺龙碑化学工程与技术化学工艺345化学工程与技术化学工艺孟秋霞化学工程与技术化学工艺334化学工程与技术化学工艺周玲玲化学工程与技术化学工艺325化学工程与技术化学工艺刘正芳化学工程与技术化学工艺323化学工程与技术化学工艺彭奕化学工程与技术化学工艺322化学工程与技术化学工艺刘意化学工程与技术应用化学393化学工程与技术应用化学刘雪耀化学工程与技术应用化学350化学工程与技术应用化学全霖阳化学工程与技术应用化学313化学工程与技术应用化学田亚华工程硕士(化学工程)不分方向336工程硕士(化学工程)不分方向张龙霞工程硕士(化学工程)不分方向329工程硕士(化学工程)不分方向吴晓焜工程硕士(化学工程)不分方向300工程硕士(化学工程)不分方向万力工程硕士(化学工程)不分方向300工程硕士(化学工程)不分方向王小曼工程硕士(化学工程)测试中心联合培养项目(大型仪器测试与维护)327工程硕士(化学工程)测试中心联合培养项目(大型仪器测试与维护)刘涛工程硕士(化学工程)惠州研究院联合培养项目332工程硕士(化学工程)惠州研究院联合培养项目易丹工程硕士(化学工程)惠州研究院联合培养项目321工程硕士(化学工程)惠州研究院联合培养项目。
无机化学(化学工程)课程教学大纲

无机化学课程教学大纲课程名称:无机化学英文名称:Inorganic Chemistry课程编号:x2030471学时数:56其中实践学时数:0 课外学时数:0学分数:3.5适用专业:化学工程一、课程简介本课程是化学工程专业学生的专业基础课。
本课程讲授了化学反应原理、物质结构的基础理论、元素、单质及无机化合物的基本知识;是后续化学课程及相关专业课程学习的基础。
通过对本课程的学习,学生掌握化学反应原理、物质结构的基础理论、元素、单质及化合物的基本知识;培养学生自学能力,使之具有自学无机化学书刊的能力;培养学生学以致用的能力,使之具有解决一般无机化学问题的能力。
二、课程目标与毕业要求关系表三、课程教学内容、基本要求、重点和难点(一)气体及热化学基础1.要求学生熟练掌握理想气体状态方程式及其应用、气体分压定律及其应用、盖斯定律及其应用;了解分压、体系、环境、状态、功、热及热力学能等概念;理解热力学第一定律,理解焓、焓变的概念,掌握状态函数和标准摩尔生成焓的概念。
2.重点:状态函数的概念及特点,标准生成焓的概念,理想气体状态方程式和分压定律的应用,运用盖斯定律和标准生成焓计算反应热。
3.难点:状态函数、焓及标准生成焓的理解。
(二)化学反应速率和化学平衡1.要求学生了解化学反应速率,基元反应和反应级数的概念,理解浓度对反应速率的影响和温度对反应速率的影响,熟练掌握质量作用定律,了解速率理论,并能用活化能和活化分子的概念说明浓度、温度和催化剂对反应速率的影响,了解影响反应速率的因素。
要求学生理解可逆反应与化学平衡的概念,掌握标准平衡常数ΘK 及其应用,掌握化学平衡的移动的规律,掌握热力学第二定律及热力学第三定律,掌握有关化学平衡组成的计算。
要求学生熟练掌握标准摩尔反应焓变、标准摩尔反应熵变和标准摩尔反应吉布斯函数变的关系,熟练掌握ΘK 与Θ∆m r G 的关系,熟练掌握Θ∆mr G 和m r G ∆的计算方法,熟练掌握转变温度的计算方法,熟练掌握吉布斯函数判据,熟练掌握通过计算判断反应方向和反应程度的方法。
国家重点学科名单 (1988年审批)

4.固体力学 (中国科学技术大学)
5.固体力学 (西安交通大学)
6.流体力学 (北京大学)
7.空气动力学 (北京航空航天大学)
8.空气动力学 (南京航空学院)
9.计算力学 (大连理工大学)
10.生物力学 (重庆大学)
机械设计与制造
1.机械学 (清华大学)
2.机械学 (北京航空航天大学)
教育学
1.教育基本理论 (北京师范大学)
2.教育基本理论 (华东师范大学
3.中国教育史 (华东师范大学)
4.比较教育学 (北京师范大学)
5.高等教育学 (厦门大学)
心理学
1.生理心理学 (北京大学)
2.工业心理学 (杭州大学)
中国语言文学
1.文艺学 (复旦大学)
2.中国现代文学 (北京大学)
3.中国古代文学 (北京大学)
4.民法 (中国人民大学)
5.国际经济法 (武汉大学)
6.国际法 (北京大学)
政治学
1.中共党史 (中国人民大学)
国际政治和国际关系
1.国际政治和国际组织 (北京大学)
2.国际关系史 (复旦大学)
社会学
1.社会学ቤተ መጻሕፍቲ ባይዱ(北京大学)
2.新闻学 (中国人民大学)
3.人口学 (中国人民大学)
民族学
1.民族学 (中央民族学院)
建筑学
土建、水利
测绘
非金属材料
化学工程和工业化学
自动控制
管理工程
地质勘探、矿业、石油
铁道、公路、水运
船舶
纺织、轻工
林业工程
原子能科学与技术
航空与宇航技术
兵器科学与技术
农学
中山大学考研参考书目

241 英语:①《新编英语教程》(1-3册),李观仪等,上海外语教育出版社,1999。
242 俄语:①《俄语入门》第二册,周鼎、徐振新编,外语教学与研究出版社,2000。
②《大学俄语基础教程》第二、三册,张智罗、童强等,高等教育出版社,1994。
243 日语:①《中日交流标准日本语》初级上、下册,集体合著,人民教育出版社、光村图书出版株式会社,2005。
244 法语:①《公共法语》上、下册,吴贤良主编,上海外语教育出版社,1997。
245 德语:①《大学德语》修订本(1-2册),赵仲、戴鸣钟等编,高等教育出版社,2001-2002。
246 西班牙语:①董燕生、刘建:《现代西班牙语》第一册,外语教学与研究出版社,1999。
②董燕生、刘建:《现代西班牙语》第二册,外语教学与研究出版社,1999。
③岑楚兰、蔡绍龙:《新编西班牙语阅读课本》第一册,外语教学与研究出版社,1999。
247 韩语:①郭一诚:《韩国语能力考试真题精解及模拟800题(中级)》,世界图书出版公司。
248 阿拉伯语:①新编阿拉伯语( 1-4册),国少华主编,外语教学与研究出版社,ISBN②《阿拉伯语阅读》(上、下),《阿拉伯语阅读》组,出版社:外语教学与研究出版社,ISBN。
308 护理综合:根据考试大纲确定。
332 教育综合:①王道俊、王汉澜主编,《教育学》,人民教育出版社,2004年版。
341 社会工作原理:①《社会工作概论》,王思斌,高等教育出版社,1999(2004)。
②《社会学》,戴维.波普诺,中国人民大学出版社,2000。
③《西方社会学理论教程》侯均生主编,南开大学出版社,2001。
343 汉语基础:《现代汉语》344 口腔综合:①《牙体牙髓病学》(第三版),樊明文主编,人民卫生出版社;②《口腔颌面外科学》(第六版),邱蔚六主编,人民卫生出版社;③《口腔修复学》(第六版),赵铱民主编,人民卫生出版社;④《口腔解剖生理学》(第六版),皮昕主编,人民卫生出版社;⑤《口腔组织病理学》(第六版),于世凤主编,人民卫生出版社。
中山大学化学考研真题(含答案)

中山大学1999—2000考研《无机化学》真题(含答案)考试科目:无机化学专业:无机化学、分析化学、有机化学、物理化学研究方向:以上各专业所有方向(考生注意:全部答案必须写在答卷纸(簿)上,写在试题上无效,答案要注明题号,不用抄题。
)一.选择题(共10分)。
(请标明题次,并把所选答案前的字母写在答卷纸上)1. 根据“酸碱质子理论”,都属于“两性电解质”的是A.HAc,H2O,HPO42-;B.HF,F-,HSO4-;C.HCO3-,CO32-,HS-;D.OH-,H2PO4- ,NH4+2.在相同温度下,2H2(g)+S2(g)=2H2S(g) KP12Br2(g)+2H2S(g)=4HBr(g)+S2(g) KP2H2(g)+Br2(g)=2HBr(g) KP3则KP2=A.KP1*KP3B.2KP3*KP1C.KP1/(KP3)2 D(KP3)2/KP13. 下列电对中Φθ,最小的是A.Ag+/Ag;B.AgBr/Ag;C.Ag(NH3)2+/Ag;D.Ag(CN)2-/Ag4. 某反应速度常数K的量纲为dm3.mol-1.s-1,该反应是A.一级反应;B. 三级反应;C. 二级反应;D.1/2级反应5. 下列卤化物中,共价性最强的是A. LiI;B. BeI2C.LiClD.MgI26. 单键键能正确的大小顺序是A.O-----O>S-S>Se-SeB.O-O>S-S>Se-SeC. O-O>S-S>Se-SeD. O-O>S-S>Se-Se7 以Cr2O3为原料制备铬酸盐,应选的试剂是A.Cl2;B.H2O2;C.KOH和KClOD.浓HNO38. 下列盐中,属于正盐的是A.NaH2PO2B.NaH2PO3C.Na2HPO4D.NaH2PO49. 既能溶于Na2S溶液,又能溶于Na2S2溶液的硫化物是A.ZnSB.As2S3C.CuSD.HgS10. 下列含氧酸Ka1变化顺序不正确的是A. HBrO4>HClO3>HClOB. H3SO4>H2P2O7>H3AsO4C. H2SO4>H2SeO4>H6TeH6D. HClO3>HIO3>H5IO6二、填空题(共28分)(请按空格上的序号在答卷纸上写出相应的答案)1. 写出下列化合物水解的主要产物:NCl3: (1)__________________; PCl3:(2)_________________2.硼烷分子中所含的缺电子多中心键类型包括:(3)______________________ (4)_________________________ 和(5)_______________________3、在298K,反应CaCO3(s)=CaO(s)+CO32-(g)的ΔHθ=178.3KJ·mol-1 ΔSθ=160.4J·mol-1·k-1,则正反应可自发进行的温度是(6)______________________.4、CH4,NH3,NO2,H2O分子中,键角由大到小的顺序是(7)____________________原子轨道dx2-y2的角度分布图是(8)_____________________该图的物理意义是表示(9)______________________;(10)、--_________________; (11)___________________;5、MO法中,原子轨道有效组合成分子轨道必须满足的原则是:(12)________________;(13)__________________;和(14)__________________;“谰系收缩”是指(15)_____________________________________________________;8、实验测定,H2(g)+I2(g)=2HI(g)的反应机理是:(1)I2(g)=I(g)+I(g) (平衡常数K) (快步骤)(2)H2(g)+I(g)+I(g)-->2HI(g) (慢步骤)则该反应的速率方程式是(16)________________________;反应级数是(17)___________________________化学反应2Ag(s)+2H++2I-=2AgI(g)+H2(g)设计为原电池,其表达式是(18)__________ H2[PtCl6]名称(19)_____________________________;10、六硝基合钴(III)酸钠二钾的化学式是(20)_______________11、配合物[Fe(CN)6]4-、[Os(CN)6]4-、[FeF6]4-和[Ru(CN)6]4-的晶体场稳定花能由大到小的顺序是(21)_____________________12、O3(g)分子含有的化学键包括(22)__________________; 它是一种(23)_________磁性物质。
中山大学无机化学教案

课程名称:无机化学授课班级:2019级化学专业授课教师:XXX教学目标:1. 让学生掌握无机化学的基本概念、基本原理和基本方法。
2. 培养学生的实验操作能力和分析问题、解决问题的能力。
3. 培养学生的科学素养和团队协作精神。
教学重点:1. 无机化学的基本概念和基本原理。
2. 无机化学实验的基本操作和实验数据处理。
教学难点:1. 无机化学实验的误差分析和数据处理。
2. 复杂无机化合物的制备和性质研究。
教学过程:一、导入1. 复习高中化学知识,回顾无机化学的基本概念。
2. 引入无机化学的研究领域和重要性。
二、讲授新课1. 无机化学的基本概念:元素、化合物、单质、同素异形体等。
2. 无机化学的基本原理:原子结构、化学键、分子结构、晶体结构等。
3. 无机化学实验的基本操作:称量、溶解、过滤、蒸馏、滴定等。
4. 无机化学实验的误差分析和数据处理:误差来源、误差分类、数据处理方法等。
三、实验演示1. 演示无机化学实验的基本操作:称量、溶解、过滤、蒸馏、滴定等。
2. 演示复杂无机化合物的制备和性质研究。
四、课堂练习1. 让学生独立完成无机化学实验的基本操作练习。
2. 让学生分析实验数据,计算实验误差。
五、课堂讨论1. 讨论无机化学实验的误差来源和误差分类。
2. 讨论复杂无机化合物的制备和性质研究。
六、总结1. 总结无机化学的基本概念、基本原理和基本方法。
2. 强调无机化学实验的重要性。
教学评价:1. 课堂表现:学生的出勤率、课堂纪律、积极参与程度等。
2. 实验操作:学生的实验技能、实验数据准确性等。
3. 作业完成情况:学生的作业质量、完成时间等。
教学反思:1. 分析教学过程中存在的问题,如学生理解困难、实验操作不规范等。
2. 改进教学方法,提高教学质量。
中山大学无机化学实验教学大纲

无机化学实验教学大纲(2010)中山大学化学与化学工程学院课程名称(中文)无机化学实验课程名称(英文) Experimental Inorganic Chemistry课程编号 02141071课程性质独立设课课程属性基础课教材及实验指导书名称:《基础化学实验》第一版,刘汉标、石建新、邹小勇等编著,科学出版社,2008年《无机化学实验》第三版,中山大学等校编,高等教育出版社,1992年《无机化学实验补充教材》,无机化学实验教学小组编著,2009年学时学分:总学时 90 总学分 3 实验学时 90 实验学分 3应开实验学期一~二年级一、四学期适用专业化学类各专业先修课程无机化学(可同时开课)一、课程简介及基本要求《无机化学实验》是以实验操作为主的技能课程,它既是一门独立的课程,又与相应的理论课——《无机化学》——有紧密的联系。
它具有自己的培养目标、教学思想、教学内容和方法。
本课程的目标是:在培养学生掌握实验的基本操作、基本技能和基本知识的同时,努力培养学生的创新意识与创新能力。
为了达到这一目标,本课程按照下述指导思想进行改革:压缩单纯的验证性实验内容、将基本操作融入综合实验、增加综合与设计实验。
本课程的内容分为三个层次:基础实验(验证性实验与基本操作)、综合实验和设计实验(含学生自带课题)。
在后两个层次的实验中,融入了我校化学院教师具有特色的科研项目,目的是通过完成这些带有研究性质的实验,使学生有独立解决问题的机会,以培养学生的科研意识与创新意识。
通过实验课的训练,学生应达到下列要求:1. 从实验获得感性认识,深入理解和应用《无机化学》理论课中的概念、理论,并能灵活运用所学理论知识指导实验。
2. 规范地掌握化学实验的基本操作与基本技能,包括:玻璃仪器的清洗,简单玻璃仪器的制作,加热和冷却方法,常见离子的基本性质与鉴定,基本物理常数的测定方法,典型无机化合物的基本合成、分离、纯化方法,紫外-可见分光光度法等。
中山大学考研之学校历史发展进程

中山大学考研之学校历史发展进程截止2013年12月,中山大学有42个博士学位授权一级学科、52个硕士学位授权一级学科,2个博士专业学位,25个硕士专业学位,博士后科研流动站39个,一级学科国家重点学科2个、二级学科国家重点学科23个,国家重点培育学科6个。
在教育部学位与研究生教育发展中心于2012年组织开展的第三轮全国学科水平评估中,学校有16个学科进入前5,32个学科进入前10。
中山大学一级国家重点学科:生物学、工商管理中山大学二级国家重点学科:逻辑学、马克思主义哲学、人类学、思想政治教育、中国古代文学英语语言文学中国古代史中国近现代史、基础数学、凝聚态物理、无机化学、高分子化学与物理、人文地理学、药理学、内科学(内分泌与代谢病)、内科学(肾病)、神经病学外科学(普外)、眼科学、耳鼻咽喉科学、肿瘤学卫生毒理学行政管理、中山大学二级国家重点(培育)学科:中国哲学、社会学、马克思主义基本原理、光学地图学与地理信息系统、病原生物学学校使命:坚持社会主义办学方向,培养振兴中华的领袖型人才和社会主义事业建设者和接班人,建设勇于创新的学术重镇,促进国家社会文明事业进步,传承创新优秀文化。
战略目标:把中山大学建设成为文理医工各具特色融合发展,具有广泛国际影响的世界一流大学。
办学理念:中山大学倡导“人心向学”,用心做好大学“精心育人”和“追求学术”这两方面核心工作,提高学校教育质量和教师学术整体水平,学生勤奋学习,努力创新,提高能力和素质;坚持“教授就是大学”的理念,确立教授在学校事务中的学术主导地位;坚持“善待学生”,为学生的学习、生活和工作创造有利条件。
学校特色:综合性、创新性、开放性。
发展模式:综合性:多学科综合发展;研究型:突出学术研究的地位;开放式:对国际与海外、社会开放办学。
原中山医科大学岭南大学医学院1835年11月,美国公理会传教士伯驾( Peter Parker )在广州十三行开设眼科医局,并于1859年改称“博济( Pok Tsai )医局”。
中山大学--无机化学课件

说明: ①、气体的标准态:P⊙ = 1.013×105 ②、溶液中溶质的标准态:标准压强下,溶质的 浓度为 1mol/, 即 C⊙ =1mol/ ③、液体和固体的标准态: P⊙下的纯物质。 7、反应热的计算 ①、原则——Hess定律 [问题] 能否通过较少的实验数据获得任意化学反 应的热效应? [分析] 反应 A + B C + D △H⊙ = H ⊙产物 - H ⊙反应物
绝对法难确定△H⊙ ,可用相对法解决
②、标准生成焓——△fH⊙ 定义:温度T、标态时,由指定单质生成1mol某 物质(以化学式表示)的焓变。 [说明] 指定单质:多为元素的最稳定单质,状态亦指定。 生成反应:指定单质反应生成1mol生成物的过程。 [推论]: 指定单质△fH⊙ =0 △fH⊙ 非绝对值 熟悉元素的指定单质、物质的生成过程。 H, Na, K, C, O, N, F, Cl, Br, I 写出生成过程:CO2 , MgO, KBr, NaI
热力学简介
它是研究能量转换过程中所遵循规律的一门学科。于19世纪 中叶,蒸汽机的发明和应用,研究热和机械功之间的转换关 系形成,后来研究范围推广到各种能量之间的相互转换中。
特点:
1、基础是两个经验定律; 2、结论具有统计意义:是讨论大量质点的平均行为, 不涉及物质的微观结构和过程机理。
局限性:不能讨论过程如何进行和进行的快慢; 结论不能说明过程进行的机理和快慢。
㈢ 无机化学研究对象和内容 对象:除炭、氢化合物及其衍生物外所有元素的 单质和化合物。 内容:这些对象的组成、结构、性质和反应规律 以及它们之间的相互联系。
二、课程的教学目的及安排
1、任务: • 承接作用:中学和大学两学习阶段的桥梁; • 后续课程的基础: 它是培养目标的整体知识结构和能力结构的重 要组成部分。 2、特点: • 实验性; • 课程内容多,杂。
简历_中山大学_无机化学_暴欣

健康状况:良好
教育背景
2011-2012 2008-至今 2004-2008 联培博士 硕博连读 理学学士 法国国家科学研究院 中山大学 (保送) 东北师范大学 材料化学 无机化学 化 学 Prof. Azzedine Bousseksou 童明良教授
语言水平
• 普通话 •英 •法 语 语 普通话水平测试:一级乙等;获得教师资格证,表达能力强,有较丰富的课堂授课经验 雅思:7 分; CET-6:531 分; CET-4:603 分; CET 口语:B+ 初级水平,能够进行简单会话
中山大学 2013 年应届博士毕业生
暴欣
Tel: 159 2042 9834 / 020-84110836 Email: baox199@ 广州市海珠区新港西路 135 号中山大学丰盛堂 C802
基本情况
出生年月:1986 年 1 月 籍 贯:黑龙江 民 族:满族 性 别:女
政治面貌:中共党员
研究领域
自旋交叉磁开关及信息存储材料:具有 d4- - d7 电子构型的过渡金属离子可以对温度、光照及压力等外部扰动产 生响应发生电子高低自旋转变,导致配合物光、电、磁等性质随之变化,成为信息存储、光学传感器、自旋开关等新 型智能材料开发领域的一大研究热点。根据实际应用的需要,制备能够在室温范围发生突越型转变且伴有明显回滞的 自旋交叉材料是该领域的重点与难点。我们选用场强适宜的多氮杂环类配体构筑了系列结构新颖、性质可观的二价铁 簇核物及多维聚合物,通过对结构的微调控制自旋转变温度,成功获得了可应用于室温或超高温的自旋转换分子基材 料。近期我们又开创性地提出了利用活性客体分子调控自旋交叉行为。通过外界扰动诱发客体分子结构转变,进而使 得主客体作用发生变化并最终导致自旋行为的转换。我们相信这一新概念的提出将为磁开关及分子传感器的研发提供 一条更为简单有效的途径。部分工作已发表在 SCI 检索论文 Angew. Chem. Int. Ed.、 Chem. Sci. 和 Chem. Eur. J.。
中山大学无机化学实验第四版思考题答案

中山大学无机化学实验第四版思考题答案1、牛蒡子属于()[单选题] *A香豆素类B木脂内酯(正确答案)C苯丙酸类D2、水提醇沉法可以沉淀下列()等成分()[单选题] *A葡萄糖B多糖(正确答案)C树脂D生物碱3、挥发油常见属于哪类萜类化学物()[单选题] *A半萜与单萜B单贴与倍半萜(正确答案)C倍半萜与二萜D二萜与三萜4、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)D升华法5、二氢黄酮类专属性的颜色反应是()[单选题] *A盐酸-镁粉反应B四氢硼钠反应(正确答案)C硼酸显色反应D锆盐-枸橼酸反应6、以黄芩苷、黄芩素、汉黄芩素为指标成分进行定性鉴别的中药是()[单选题] *A葛根B黄芩(正确答案)C槐花D陈皮7、香豆素及其苷发生异羟肟酸铁反应的条件为()[单选题] *A在酸性条件下B在碱性条件下C先碱后酸(正确答案)D在中性条件下8、下列化合物可用水蒸汽蒸馏法提取的是()[单选题] * A七叶内酯(正确答案)B七叶苷C厚朴酚D五味子素9、检识黄酮类化合物首选()[单选题] *A盐酸-镁粉反应(正确答案)B四氢硼钠反应C硼酸显色反应D锆盐-枸橼酸反应10、萜类化合物在化学结构上的明显区别是()[单选题] * A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同11、在高效液相色谱法中,常用的柱内填料是()[单选题] *A氧化铝B活性炭C十八烷基硅烷键和硅胶(正确答案)D羧甲基纤维素12、纸色谱是分配色谱中的一种,它是以滤纸为(),以纸上所含的水分为固定相的分配色谱。
()[单选题] *A固定相B吸附剂C展开剂D支持剂(正确答案)13、E连续回流提取法(正确答案)下列方法中能始终保持良好浓度差的是()*A浸渍法B渗漉法(正确答案)C煎煮法D回流提取法14、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷15、下列化合物中具有强烈天蓝色荧光的是()[单选题] * A七叶内脂(正确答案)B大黄素C麻黄碱D大豆皂苷16、单萜和倍半萜在化学结构上的明显区别是()[单选题] * A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同17、以下哪种分离方法是利用分子筛的原理的()[单选题] * A吸附色谱法C沉淀法D透析法(正确答案)18、阿托品是莨菪碱的()[单选题] *A左旋体B右旋体C同分异构体D外消旋体(正确答案)19、挥发油的溶解性难溶于()[单选题] *A水(正确答案)B乙醇C石油醚D乙醚20、在溶剂沉淀法中,主要是在溶液中加入另一种溶剂一改变混合溶剂的什么实现的()[单选题] *ApH值B溶解度C极性(正确答案)21、下列化合物中β位有-COOH取代的是()[单选题] *A大黄素B大黄酸(正确答案)C大黄素甲醚D芦荟大黄素22、E何首乌(正确答案)下列不含蒽醌类成分的中药是()*A丹参(正确答案)B决明子C芦荟D紫草(正确答案)23、乙醇不能提取出的成分类型是()[单选题] *A生物碱B苷C多糖D鞣质(正确答案)24、以下哪种方法是利用成分可以直接由固态加热变为气态的原理()A [单选题] *A升华法(正确答案)B分馏法C沉淀法D透析法25、具有挥发性的生物碱是()[单选题] *A吗啡碱B麻黄碱(正确答案)C苦参碱D小檗碱26、具有挥发性的生物碱是()[单选题] *A苦参碱B莨菪碱C麻黄碱(正确答案)D小檗碱27、由两个苯环通过三碳链相互连接成的具有6C-3C-6C基本骨架的一系列化合物是()[单选题] *A苷类B黄酮类(正确答案)C醌类D生物碱类28、提取遇热不稳定的成分宜用()[单选题] *A回流法B煎煮法C渗漉法(正确答案)D蒸馏法29、不属于木脂素类化合物的物理性质的是()[单选题] * A一般没有挥发性B有光学活性C易溶于有机溶剂D有色晶体(正确答案)30、区别挥发油与油脂常用的方法是()[单选题] *A相对密度B溶解性C油迹试验(正确答案)D沸点。
中山大学2004年招收硕士学位研究生按院系分专业录取情况统计表(一)
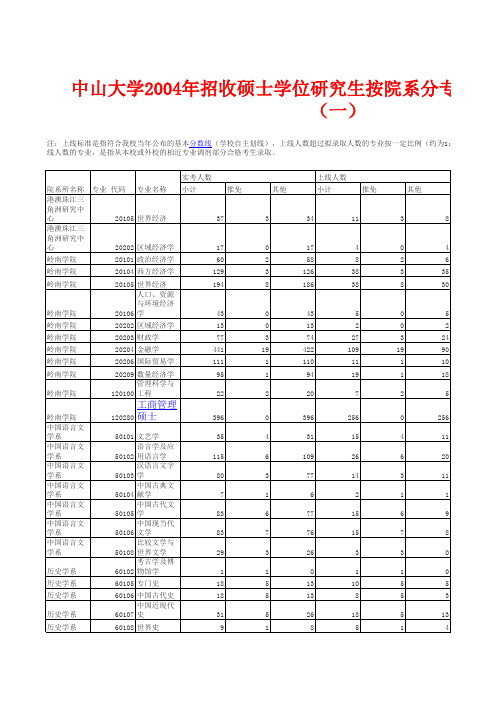
注:上线标准是指符合我校当年公布的基本分数线(学校自主划线),上线人数超过拟录取人数的专业按一定比例(约为1:1.2)进行差 上线人数的专业,是指从本校或外校的相近专业调剂部分合格考生录取。 实考人数 院系所名称 专业 代码 专业名称 小计 港澳珠江三 角洲研究中 心 20105 世界经济 港澳珠江三 角洲研究中 心 20202 区域经济学 岭南学院 岭南学院 岭南学院 20101 政治经济学 20104 西方经济学 20105 世界经济 人口、资源 与环境经济 20106 学 20202 区域经济学 20203 财政学 20204 金融学 20206 国际贸易学 20209 数量经济学 管理科学与 120100 工程 120280 推免 其他 上线人数 小计 推免 其他
50 1 18 7 21 180 4 96
2 0 0 0 0 1 0 0
48 1 18 7 21 179 4 96
23 1 4 1 7 62 1 30
2 0 0 0 0 1 0 0
21 1 4 1 7 61 1 30
70201 理论物理
9
2
7
4
2
2
70205 凝聚态物理
36
8
28
26
8
18
70207 光学
港澳珠江三角洲研究中心港澳珠江三角洲研究中心人口资源与环境经济学工商管理硕士语言学及应用语比较文学与世界文学考古学及博物馆法律硕士政治与公共事务管理学院政治与公共事务管理学院政治与公共事务管理学院政治与公共事务管理学院政治与公共事务管理学院政治与公共事务管理学院政治与公共事务管理学院管理学院120100管理科学与工程管理学院120201会计学378113676211515350管理学院120202企业管理567215467721565959管理学院120203旅游管理939016管理学院120204技术经济及管理261818管理学院120220财务与投资管理2318121313管理学院120280工商管理硕士417417214214190185外国语学院50201英语语言文学391143778014664444外国语学院50203法语语言文学外国语学院50204德语语言文学外国语学院50205日语语言文学353025202121外国语学院5021127827337321616教育学院30204中共党史教育学院30205504823211919教育学院40101教育学原理教育学院40106高等教育学18教育学院40110教育技术学教育学院40201基础心理学211110教育学院40203应用心理学18017962611515教育学院40303体育教育训练学教育学院120403教育经济与管理96963070201理论物理70205凝聚态物理36282618272770207光学37361918191980102固体力学80103流体力学80104工程力学1180300光学工程18121312131380501材料物理与化学8090333252113202070301无机化学50452419212170302分析化学31232214181870303有机化学59563027212170304物理化学15131370305771166491138353570320化学生物学1180501材料物理与化学18地球科学系709012018111211地球科学系70904构造地质学地球科学系70905第四纪地质学地球科学系81401岩土工程生命科学学院70703海洋生物学201812生命科学学院71001植物学312918161515生命科学学院71002动物学2020生命科学学院71003生理学181811生命科学学院7100
中山大学无机化学第8章配位化合物与配位平衡习题及答案

第8章 配位化合物与配位平衡一、选择题8-1 下列配合物的命名不正确的是: ( ) (A) (B)(C)(D)答案: B8-2 下列离子都可以作为配合物的中心原子,但生成的配合物稳定性最差的是: ( ) (A) (B) (C) (D) 答案: D 8-3 的名称是: ( )(A) 三氯化一水二吡合铬(III ) (B) 一水合三氯化二吡合铬(III ) (C) 三氯一水二吡合铬(III ) (D) 一水二吡三氯合铬(III ) 答案: C8-4 下列哪种物质是顺磁性的: ( )(A)(B) (C)(D) 答案: B 8-5用溶液处理再结晶,可以取代化合物中的,但的含量不变,用过量处理该化合物,有氯含量的氯以沉淀析出,这种化合[]()3233K Co(NO )Cl III 三氯三硝基合钴酸钾[]()3233K Co(NO )Cl III 三硝基三氯合钴酸钾()()()2323Co OH NH Cl Cl III ⎡⎤⎣⎦氯化二氯一水三氨合铬[]()26H PtCl IV 六氯合铂酸3+Sc 3+Cr 3+Fe 3+La ()()232Cr py H O Cl ⎡⎤⎣⎦()234Zn NH +⎡⎤⎣⎦()336Co NH +⎡⎤⎣⎦[]4TiF ()336Cr NH +⎡⎤⎣⎦33CoCl 4NH ⋅24H SO 2-4SO -Cl 3NH 3AgNO 1/3AgCl物应该是: ( )(A)(B) (C)(D)答案: A 8-6 羰基合物的磁矩为零,它的空间构型为: ( )(A) 三角双锥形 (B) 四方形(C) 三角锥形 (D) 四方锥形 答案: A8-7 配离子的磁矩为: ( ) (A) 3.88(B) 2.83 (C) 5.0 (D) 0 答案: D8-8 配离子的稳定性与其配位键类型有关,根据价键理论,可以判断下列配合物稳定性的大小,指出正确的是: ( )(A)(B)(C) (D) 答案: B 8-9 化合物的磁矩为,而的磁矩为,对于这种差别可以用下列哪一项所叙述的理由来解释: ( )(A) 铁在这两种化合物中有不同的氧化数 (B) 氰离子比氟离子引起更多的轨道分裂 (C) 氟比碳、氮具有更大的电负性 (D) 氰离子是弱的电子授体 答案: B8-10 某金属中心离子形成配离子时,由于配体的不同,其电子分布可以有1个未成对电()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()5Fe CO ⎡⎤⎣⎦()32Cu NH +⎡⎤⎣⎦()B.M.()()33266Fe CN Fe H O -+⎡⎤⎡⎤<⎣⎦⎣⎦()()32266Fe CN Fe H O -+⎡⎤⎡⎤>⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤=⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤<⎣⎦⎣⎦[]36K FeF 5.9B.M.()36K Fe CN ⎡⎤⎣⎦2.4B.M.d d子,也可以有5个未成对电子,此中心离子是: ( ) (A) (B) (C) (D)答案: C8-11 根据晶体场理论,高自旋配合物的理论判据是: ( ) (A) 分裂能 > 成对能 (B) 电离能 > 成对能 (C) 分裂能 > 成键能 (D) 分裂能 < 成对能 答案: D8-12 某金属离子在八面体弱场中的磁矩为 4.9 B.M.,而它在八面体强场中的磁矩为零,该中心金属离子可能是: ( ) (A) (B) (C)(D) 答案: D二、计算题和问答题8-13 用晶体场理论判断配离子,,,(,Co(III) 的电子成对能)是高自旋还是低自旋,并计算配合物的磁矩以及晶体场稳定化能(CFSE )。
中山大学化学学院2009年硕士考生复试名单

化学学院2009年硕士考生复试名单、复试安排及有关要求作者:院办文章来源:本站原创点击数:2670 更新时间:2009年04月07日根据学校招生工作安排,我们不再寄发纸面的复试通知,考生可凭报名号或证件号码在研究生院主页的“硕士招生--信息查询--复试通知查询”处查询本人是否可复试,并打印出复试通知,按时来校参加复试。
一、各专业复试名单无机化学专业:16人孟苗王超敏王保营闫岩钱晨谢丰孙静李毅严霞苏博超张冬菊苏华刘春梦李烨梁荣辉陈达分析化学专业:13人杨丽萍朱丽王利华张红黄杏娇胡筱李玉容程珍张静孟岩黄贤伟杨丽蓉雷佳佳有机化学专业:5人李嘉乔利涛李莹施步席陈霸天物理化学专业:5人曲亚南罗建毛彦超王素娟相升林高分子化学与物理专业:17人胡玉娟任林德刘俊尹齐和孙浩王瑞丁茜邓敏敏刘益片钟辉周炜郑雄彬郑宝液陈俊生林劲新吴清华方铭岳材料化学与物理专业:2人韩涛王辉化学工艺:3人雷杨郑闯戚丽丹二、各专业复试时间、地点安排(以下为笔试时间、地点,笔试后再向考生宣布面试时间、地点)复试专业复试科目复试地点复试时间联系人联系电话各位考生应提前30分钟到达复试地点办理报到1、无机化学专业各研究方向同专业招生目化学院丰盛堂B1042009年4月17日上午9:00洪惠玲84113986录 手续,并交纳复试费100元,带齐资格审查所需要的材料,逾期不参加复试者视为放弃复试资格。
1、分析化学专业各研究方向同专业招生目录 化学院丰盛堂 B1012009年4月15日上午8:00罗学军841109221、 有机化学专业各研究方向同专业招生目录 化学院南楼 2012009年4月17日上午9:00余惠娟841109181、 物理化学专业各研究方向同专业招生目录 化学院丰盛堂 B1022009年4月17日上午9:00杨薇841109231、 高分子化学与物理专业01-10、18、19研究方向同专业招生目录化学院丰盛堂 B1012009年4月17日上午9:00贾虹841136911、 高分子化学与物理专业11-17研究方向 2、 材料物理与化学专业08研究方向同专业招生目录 化学院丰盛堂 B1012009年4月17日上午9:00孙鹏841127151 化学工艺专业各研究方向同专业招生目录化学院丰盛堂 B1022009年4月17日上午9:00曾晖84113653三、复试资格审查及收费:(复试时须带如下1-6材料原件,同时需备2-6复印件存放考生档案)1、网上打印的复试通知书;2、有效身份证件;(身份证、军官证、护照)3、应届本科毕业生的学生证;4、本科毕业生的毕业证、学位证;5、《本科阶段学习成绩单》(应届毕业生成绩单由所在学校教务部门加盖公章,非应届本科生成绩单由考生档案单位加盖公章)6、以同等学力报考者的大专生毕业证书、大学本科8门以上主干课程成绩证明、国家英语水平考试四级证书、学术论文等。
中山大学无机化学精品课程 第1章 绪论

2 .化学变化的特点:
2. 1 化学变化是质变 H2O (l) = H2O (s) 2H2O (l) = 2H2 (g) + O2 (g) 2. 2 化学变化是定量的 2H2O (l) = 2H2 (g) + O2 (g) 36 4 32 吸热 (△H ﹥0) 2 . 3 化学变化伴随能量变化:放热、吸热 2H2 (g) + O2 (g) = 2H2O (l) 放热 (△H ﹤0)
第1章 绪 论
一、化学是中心科学
1.材料:高纯Si、 GaN、超导材料、塑料、 医药、仿生材料 2.生命:
Hem + O2 = HemO2 (血红蛋白Hem) CO (g) + HemO2 (aq) = O2 (g) + Hem(CO) (aq) K = 210
3.环境:环境污染治理 4.能源:煤、石油、核燃料发电
诺贝尔化学奖获奖名单及研究领域 (1994 – 2006) (续)
2003年:美国的彼得· 阿格雷和罗德里克· 麦金农,表彰他们在细 胞膜通道方面做出的开创性贡献。 彼德.阿格雷(54岁), 罗德里克.麦金农 (47岁) : 细胞膜: H2O通道 金属离子(K+, Na+, Ca2+…)通道 从分子 – 原子水平研究生物!
诺贝尔化学奖获奖名单及研究领域 (续)
(1994 – 2006) (续)
1997年:美国的保罗· 博耶、英国的约翰· 沃克、丹 麦的詹 斯· 斯科,表彰他们在研究身体细胞是如何 储存和传递能量 方面所取得的成果。 1996年:英国的哈诺德· 克奥托、美国的小罗伯 特· 荷尔、 理查德· 斯莫利,表彰他们发现了布基球 (C60, C70, C140 …),这是一种球型的 碳分子。 1995年:荷兰的保罗· 克鲁特恩、美国的马里奥· 莫 利纳、 F· 罗兰,表彰他们在研究臭氧层形成和破坏 方面所取得的 成果。 1994年:美国的乔治· 欧拉,表彰他在碳氢化合物 A· 即烃 类研究领域所作出的杰出贡献。
1998年中山大学研究生(无机化学)入学试题

1998年攻读硕士学位研究生入学考试试题考试科目:无机化学专业:无机化学、分析化学、有机化学、物理化学研究方向:以上专业所有方向一、选择题(共15分)1、在一定温度下:2、一定温度下,已知某反应ΔG0>0,则该反应的平衡常数K0 ______A、>0B、<0C、<1D、>13、室温下,0.20mol.dm-3HCOOH溶液电离常数为3.2%,HCOOH的电离常数=________A、2.0×10-4B、1.3×10-3C、6.4×10-3D、6.4×10-44、已知Φ0(Au+/Au)=1.68V,K稳(Au(CN)2-)=2.0×1038,则Φ0(Au(CN)2-/Au)=_______A、-0.58VB、+0.58VC、-1.16VD、+1.16V5、对于3H2(g)+N2(g)à2NH3(g),反应速率可表示为________6、下列哪个轨道上的电子在XY平面上出现的几率密度为零:________A、3PzB、3dx2-y2C、3sD、3dz27、下列分子中,呈逆磁性的是_________A、B2B、NOC、COD、O28、据VSEPR,BrF3分子的几何结构是_________A、平面三角形B、三角锥C、三角双锥体D、T形9、下列分子中,偶极矩不为零的是_________A、BeCl2B、BF3C、NF3D、SO310、下列分子中,键角最小的是_____A、NO2B、OF2C、Icl2D、XeF211、58Ce3+离子的价层电子结构为______A、4f2B、4f05d1C、4f1D、6s112、金属钾晶体为体心立方结构,在单位晶胞中钾原子的个数是_______A、2B、4C、6D、913、晶体场稳定化能正确的大小顺序是_________A、[Mn(H2O)6]2+ <[Fe(CN)6]3-<[Fe(H2O)6]3+<[Ru(CN)6]3-B、[Fe(H2O)6]3+<[Mn(H2O)6]2+<[Ru(CN)6]3-<[Fe(CN)6]3-C、[Fe(CN)6]3-<[Fe(H2O)6]3+<Mn(H2O)6]2+<[Ru(CN)6]3-D、[Mn(H2O)6]2+<[Fe(H2O)6]3+<[Fe(CN)6]3-<[Ru(CN)6]3-14、下列配合物中,磁矩最小的是________A、[Cr(H2O)6]2+B、[Fe(CN)6]3-C、[Co(H2O)6]2+D、[Co(NH3)6]3+15、下列同浓度含氧酸中,氧化性最强的是_______A、HBrO4B、HClO4C、HBrO3D、H5IO6二、填空题(共25分)1、某温度下,N2(g)+3H2(g)=2NH3(g),△rHm0<0。
中山大学无机化学(上册)第5章习题答案

第5章 溶液与电离平衡习题答案原子量取四位有效数字,计算过程采用“四舍六入五成双”取舍,热力学数据除题目给出外均引用自书后附录以及兰氏手册。
1. 实验室某些常用的试剂百分浓度及密度分别是:(1)浓盐酸:含HCl 37.0%,密度1.19 g ⋅cm -3;加至3位有效数字 (2)浓硫酸:含H 2SO 4 98.0%,密度1.98 g ⋅cm -3; (3)浓硝酸:含HNO 3 70.0%,密度1.42 g ⋅cm -3; (4)浓氨水:含NH 3 28.0%,密度0.900 g ⋅cm -3。
试分别计算它们的物质的量浓度。
解:(1) -33-3-131.19g cm 1000cm 37.0%12.0mol dm 36.5g mol 1.0dmn c V ⋅⨯⨯===⋅⋅⨯ (2)19.8 mol·dm -3(3)15.8 mol·dm -3 (4)14.8 mol·dm -3 2. 是非题(1) 0.10 mol .dm -3 HAc 溶液中c (H +) = 1.3⨯10-3 mol .dm -3,故0.050 mol .dm -3 HAc 溶液中c (H +) = 0.65⨯10-3 mol .dm -3;(2)向浓度均为0.10 mol .dm -3的NH 3⋅ H 2O- NH 4Cl 的缓冲溶液中,加入HCl 使c (HCl) = 0.099 mol .dm -3,则由于溶液的缓冲作用,pH 不变;(3)Na 2CO 3溶液中通入适量CO 2气体,便可得到一种缓冲溶液; (4)多元弱酸盐的水解(如Na 3PO 4),以第一步水解为主;(5)将浓度均为0.10 mol .dm -3的HAc 和NaAc 混合溶液冲稀至浓度均为0.05 mol .dm -3,则由于HAc 电离度增大,混合溶液的酸度降低; (6)在一定的温度下,改变溶液的pH ,水的离子积不变; (7)弱电解质的电离度随弱电解质浓度降低而增大;(8)NH 4Ac 为一元弱酸碱盐,水解程度很大,故其水溶液的酸碱性很大。
用科研之光照亮征程——记中科院温州生物材料与工程研究所研究员沈建良

用科研之光照亮征程——记中科院温州生物材料与工程研究所研究员沈建良作者:肖延胜来源:《海峡科技与产业》 2018年第2期对科研的无比热爱,铸就了他的满腔热情;对科研的坚定执着,成就了他的事业追求。
在砥砺前行的路途中,他不停地探索着科研的奥秘,追求着科研的真谛。
正是他的这种积极向上的心态,成为推动他在科研路上不断前进的动力源泉。
他,就是中科院温州生物材料与工程研究所研究员沈建良。
为了推动科研的发展和进步,近年来,他痴心于科研,用自己的努力拼搏出了一方蓝天,成为业界新的蓝星,用闪烁的科研之光照亮了科研的征程。
国外科研用心情深2007年,沈建良毕业于湖南科技大学化学化工学院。
2010年,他在湘潭大学获无机化学专业硕士学位。
2014年,他从中山大学无机化学专业博士毕业(师从毛宗万教授),期间在美国康奈尔大学医学院休斯敦卫理公会研究所经过两年的博士联合培养,丰富了他的科研知识,提高了他的科研素养。
2014年6月—2017年6月,他在美国康奈尔大学医学院休斯敦卫理公会研究所Haifa Shen教授课题组从事博士后研究。
2017年9月,他受聘于中科院温州生物材料与工程研究所、温州医科大学生物医学工程学院和眼视光学院—眼视光学和视觉科学国家重点实验室。
他对纳米材料、纳米技术在生物医学领域中的探究产生了浓厚的兴趣。
因此,他以金属无机抗肿瘤药物、智能多功能化纳米制剂在肿瘤中的诊疗应用为主要科研方向,开始专心自己的科学研究。
沈建良利用纳米材料技术和多学科的交叉优势,通过合理的设计和优化具有智能多功能化的纳米/微米材料,从而使药物递送的瓶颈得到了完美的解决,在癌症的成像和治疗以及其他疾病的诊疗一体化应用方面得到了广泛的应用。
在国外学习工作期间,沈建良一心扑在科研事业上。
据统计,乳腺癌已经成为全球女性最常见且死亡率最高的癌症,每年有近50万人因此失去宝贵的生命。
在现代诊断工具的急速发展形势下,利用辅助性进行全身治疗,可以使早期的乳腺癌患者治疗收到明显的效果,从而使其生存率大大提高。
中山大学662化学A考研专业课真题及答案

中山大学考研历年真题解析——662化学A主编:弘毅考研弘毅教育出品【资料说明】中大的化学A考研试卷考三门:无机化学,有机化学,高分子化学。
根据历年的统计,无机化学,有机化学每门50到60分左右。
高分子化学是20分左右。
无机化学建议大家用中大编写的版本,主编是蔡少华。
他们有一本习题解答,那是相当重要!有机化学建议用中山大学和香港科技大学合编的版本,主编是汪波。
高分子用也可以用中大编写的,封面是红色的,比较薄。
下面说下无机化学。
无机化学主要考上册,下册考的很少。
上册的配合物,原电池,电解池,化学键理论是重点。
下册主要就考推断题和分离题。
下册的推断题和分离题只要做了中大编写的那本书上的题目就可以了。
下册其他也不用看。
上册的计算题考的很难。
尤其是2013年的。
只有在相当了解各个知识点的情况下才能在考研考试那种时间紧压力大的情况下游刃有余的做出来。
所以对于上册的中大那本书上的计算题必须得非常熟练。
还有,各位学弟学妹一定要弄懂化学键理论(价键理论,价层电子对互斥理论,杂化轨道理论,分子轨道理论),晶体场理论,配位场理论到底是什么,有什么区别!只有在相互比较的情况下才能深刻的理解,才能深刻的记住!一定不要死记硬背!否则过了一个月半个月就忘了。
无机化学对于镧系收缩的定义,原因,影响一定要熟记。
对于有机化学,主要就是考反应,性质及其比较,合成,机理,推断(核磁,红外,质谱)。
对于反应就必须得理解,得记忆了。
性质的话其实都可以通过理解来做出来。
只要理解了各种性质及其比较的原因,过了几个月都是不会忘的。
所以一定不要死记。
很多性质的比较有相似之处,大家一定要注意前后对应的看看,比较比较。
这样就会清楚的知道,不会模棱两可。
合成的话,大家一定形成一种思路。
比如看到1,5二羰基就要知道是通过迈克尔加成得来的,看到一个羟基碳上连有两个相同的基团就知道那是酯的亲核取代合成得来的。
看到1,3 1,4 1,6二羰基又是通过哪类人名反应得来的,等等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中山大学1996硕士研究生入学考试无机化学(高分子)试题考试科目:无机化学(含分析化学)专业:高分子化学与物理研究方向:以上各专业所有方向一、选择题(请将正确的选择填在括号内):(共10分)1、任意温度下都是“非自发过程”的是A.△H<0, △S<0;B.△H>0, △S<0;C.△H>0, △S>0;D.△H<0, △S>0;2、元素的第一电子亲合能大小正确的顺序是A.C<N<O<F;B.C>N>O>F;C.C>N<O<F;D.C>N<O>F;3、偶极矩不为零的分子是A.PCl5(g);B.NF3;C.SF6;D.BeCl2(g);4、按“MO”法,键级最大的是A.O2;B.O2+;C.O2-;D.CO5、不存在分子间或分子内氢键的分子是A.NH3;B.对羟基苯甲酸;C.CF3H;D.HNO36、路易斯酸性强弱正确的顺序是A.BF3<BCl3<BBr3;B.BF3>BCl3>BBr3;C.BF3<BCl3>BBr3;D.BF3>BCl3<BBr3;7、晶体熔点高低正确的顺序是A.NaCl>SiO2>HCl>HF;B.SiO2>NaCl>HCl>HF;C.NaCl>SiO2>HF>HCl;D.SiO2>NaCl>HF>HCl8、路易斯碱性强弱正确的顺序是A.NH3<N2H4<NH2OH;B.NH3>N2H4<NH2OH;C.NH3<N2H4>NH2OH;D.NH3>N2H4>NH2OH;9、不属于二元质子酸的是A.H3PO3;B.H2SO4;C.H3PO2;D.NaH2PO410、氧化性强弱正确的顺序是A. HClO4<HbrO4<H5IO6;B. H2SO4<H2SeO4>H2TeO4;C. HClO4<H2SO4<H3PO4;D. HNO3<H3PO4<H3AsO4二、填空题:(每空1分,共16分)1、H2(g)+I2(g)=2HI(g),Kθ=50.3(713k).某状态下,P氢气=P碘=5.379×105Pa,P碘化氢=62.59×105Pa.则自发进行的方向是______________,原因是________________。
2、2NH3(g)=N2(g)+3H2(g).298k,△r H mθ=+92.22kJ·mol-1,△r S mθ=+198.53J·mol-1·K-1,则标准状态下,NH3(g)自发分解的温度是_________________。
3、根据反应速率的“过度状态理论”,“反应的活化能”是指__________________,反应的恒压热效应与正、逆反应活化能的关系是_______________________。
4、0.10mol·dm-3醋酸溶液100mL与0.10mol·dm-3氢氧化钠溶液50ml混合后,溶液的pH=_____________。
(K3=1.8×10-5)5、第四周期某元素M的气态自由离子M2+的自旋磁矩约为5.9B.M.,该元素位于元素周期表的_________族,描述基态M2+(g)最高占有轨道上电子运动状态的一组合理的量子数的值可以是______________________。
6、键角大小比较:NH3___NF3,原因是____________________。
7、金属镍晶胞是面心立方晶胞,每个晶胞含镍原子树木计算如下:_________________________。
8、[CoCl(NH3)5]Cl2称为___________;四异硫氰酸根·二氨合铬(Ⅲ)的化学式__________________。
9、以cm-1为能量单位,[Fe(CN)6]4-,[Os(CN)6]4-,[Ru(CN)6]4-和[Co(CN)]4-的大小顺序为_______________________。
10、比较一氧化氮的红外伸缩振动频率大小:NO(ClO4)___________自由NO(g),这是因为____________________。
三、完成下列反应的化学方程式:(每小题2分,共30分)1、Co2O3(s)溶于盐酸中;2、由金红石制取四氯化钛;3、工业上自海水制备溴;4、用重铬酸钾溶液鉴别过氧化氢;5、碱性介质中Bi(Ⅲ)与氯气反应;6、硝酸亚汞溶液与过量KI溶液反应;7、以硫化硫酸钠溶液滴定碘;8、高锰酸钾在碱性介质(KOH)中与NaNO2反应;9、室温下,碘与NaOH溶液反应;10、碱性介质中,用氯水处理含氰(CN-)废水;11、NCl3水解;12、酸性介质中,NaBiO3(s)与Mn2+反应;13、泡沫灭火剂由Al2(SO4)和NaHCO3浓溶液组成,二者混合后反应;14、Na2O2在潜水舱中与水的反应;15、Cu2SO4(s)溶于水中;四、问答题(每小题6分,共30分)1、蛋白质由多肽链组成,多肽链的基本单元如图所示。
已知其中的C-N键长为132pm,C-O而键长为124pm.通常键长:C—N 148pm,C=N 127pm,C—N 143pm,C=O 120pm。
根据“杂化轨道理论”,讨论多肽链基本单元中中心的C和N原子的杂化成键过程,解释肽键6个原子基本共平面以及室温下蛋白质可以维持稳定构象的原因。
2、实验测出反应2NO+O→2NO的速率方程为V=k[NO]2[O2],有人提出以下反应机理:机理一:2NO k1<=>k2N2O2(快步骤)N2O2+O2k3→2NO2(慢步骤)机理二:NO+O2k1<=>k2NO3(快步骤)NO3+NO k3→2NO2(慢步骤)试分析、评价。
五、计算题:(每小题7分,共14分)1、通过计算,说明Ag可否从饱和H2S溶液中置换出氢。
实际上把Ag片投入到饱和H2S溶液中,可观察到什么现象?(已知:H2S(aq)的Ka1=1.3×10-7,Ka2=7.1×10-15,Ag2S的K sp=2.0×10-49,ΦθAg+/Ag=0.7996v)2、在酸性介质中,Co3+(aq)氧化性很强;而在过量氨水中,土黄色的[Co(NH3)6]2+却被空气中的氧气逐步氧化为淡红棕色的[Co(NH3)6]3+,使Co3+稳定化:4[Co(NH3)6]2++O2+2H2O=4[Co(NH3)6]3++4OH- 试求该反应在298K的平衡常数。
(已知:ΦθCo3+/Co2+=1.82v,ΦθO2/OH-=0.401v,K稳Co(NH3)62+=1.28×105,K稳Co(NH3)63+=1.60×1035)(以上第一到第五题为“无机化学”部分,共70分;以下第六和第七题为“分析化学”部分,共30分)“分析化学”部分(共30分)六、填空题(1.5×8=12分)1、为了标定盐酸溶液,需配制100mL硼砂基准溶液,宜用________瓶。
若硼砂保存不妥引起风化,将使盐酸浓度____。
若标定读数时,滴定管内壁挂液滴,将使盐酸浓度________。
2、有一水溶液,可能含NaOH、NaHCO3和Na2CO3中的一种或两种。
现取一份溶液,以酚酞作指示剂进行滴定,消耗0.1000mol·L-1JHCl10.00mL。
继续在此溶液中加入甲基橙作指示剂进行滴定,又消耗HCl28.00mL。
因此,此溶液含___________。
3、已知:㏒K ZnY=16.50;在pH10,㏒αY(H)=0.45,αZn(NH3)=105.1,αZn(OH)=102.4. ㏒K’ZnY=_______.4、在pH5.5,以二甲酚橙为指示剂,用EDTA滴定Zn2+,在Na+,Mg2+,Cd2+,Pb2+,Bi3+和NO3-中,含干扰得离子是________________.5、指出下列络合滴定法所需得掩蔽剂:(1)滴定BI3+时可用______________消除Fe3+的干扰。
(2)NH4F置换滴定法测定Al3+时可用_______________消除Ti4+的干扰。
(3)滴定镁时得用___________消除Zn2+的干扰。
6、用络合滴定法测定水的总硬度(钙镁总量),应加入pH___________的____________缓冲溶液,以_____________作指示剂。
7、莫尔法的合适酸度是______________,适宜于直接滴定_____________,与佛尔哈德法相比,莫尔法的选择性较____。
8、重量法测定磁铁矿中的铁,称量形式为Fe2O3,以Fe3O4%表示分析结果,则换算因数式为____________。
七、计算题(4+4+10=18分)1、用丁二酮肟法测定钢铁中的镍的百分含量,得到下列结果:10.48,10.37,10.47,10.43,和10.40,计算结果的平均值,平均偏差,相对平均偏差,标准偏差和相对标准偏差。
2、以0.1000mol/L盐酸滴定20.00mL0.1000mol/LNH3·H2O溶液,试计算达到化学计量点时溶液的pH值。
应选用何种指示剂?已知NH3·H2O的pK b=4.75。
3、某硅酸盐试样1.000g。
用重量法测得(Fe2O3+Al2O3)得总量为0.5000g。
将沉淀溶解在酸性溶液中,并将Fe3+还原为Fe2+,然后用0.03333mol/LK2Cr2O7溶液滴定,用去25.00mL。
计算试样中Fe2O3%和Al2O3%。
相对原子质量:O 15.9994,Fe 55.847,Al 26.98154。
参考答案一、选择题:1-B,2-C,3-B,4-D,5-C,6-A,7-D,8-C,9-A,10-D二、填空题:1、逆反应;Q r((135.4)>Kθ(50.3)或△r G m>02、>464.5K(由△r G mθ=△r H mθ-T△r S mθ<0算出)3、活化配合物分子的平均能量-反应物分子的平均能量;△H=Ea(正)-Ea(逆)4、4.74(由[H+]=KaC HAc/C NaAc算出)5、VⅡ2222B;n=3,l=2,m=0,m s=+1/2(或-1/2)6、>(键角NH3107°,NF3102°);电负性N>H,而N<F故氮核附近的电子密度及电子互斥作用,NH3>NF37、8×1/8+6×1/2=48、二氯化一氯·五氨合钴(Ⅲ);NH4[Cr(NCS)4(NH3)2]9、[Co(CN)6]4-<[Fe(CN)6]4-<[Ru(CN)6]4-<[Os(CN)6]4-10、>;NO(ClO4)中,NO+的键级为3,而自由NO键级为2.5,根据虎克定律V=1/2π×(k/μ)可得。
