稳定性试验方案
注射用重组人生长激素稳定性试验方案

注射用重组人生长激素稳定性试验方案一、研究目的本试验旨在评估注射用重组人生长激素的稳定性,以确定其在一定条件下的质量保持期限。
二、试验方法1.试验样品-收集符合规定的注射用重组人生长激素样品,确保其符合药品质量标准。
-样品应避免暴露在光线和高温等有害因素下,同时在试验过程中避免反复冻融。
2.试验条件-温度:在25°C±2°C的条件下进行试验。
-湿度:相对湿度控制在60%±5%。
-光照条件:采用黑暗遮光的环境,避免光照影响。
-储存容器:试验样品储存在由玻璃或塑料制成的密封容器中。
3.试验项目-化学稳定性:包括药物活性、纯度、杂质含量、溶解度等方面的评估内容。
-物理稳定性:包括药物的颜色、外观、稠度等方面的评估内容。
-微生物稳定性:包括细菌、真菌等微生物污染的评估。
4.试验过程-样品储存在不同时间点下,在试验结束时进行检测。
-化学稳定性:使用适当的化学分析方法,对样品进行相关化学指标的测定。
-物理稳定性:通过观察样品的外观、颜色、气味等特征判断其稳定性。
-微生物稳定性:使用适当的微生物检测方法,对样品进行微生物污染的评估。
5.数据分析-根据试验结果,综合分析药物在不同条件下的稳定性表现。
-结合药物质量标准,确定药物的质量保持期限。
三、质量控制2.试验操作:试验过程中严格按照标准操作规程进行,保证数据的准确性和可靠性。
3.试剂和仪器设备:选择合适的试剂和仪器设备,保证试验结果的准确性和可靠性。
4.数据分析:对试验结果进行统计分析和合理解释。
四、安全防范措施1.安全操作:试验过程中保持良好的个人卫生,严格遵循实验室的操作规程。
2.废弃物处理:将试验所产生的废弃物进行分类和正确处理,遵循相关的废弃物处理规范。
通过以上试验方案,可以对注射用重组人生长激素的稳定性进行评估,并确定其质量保持期限,以保证药物在使用过程中的有效性和安全性。
同时,该方案还包括了质量控制和安全防范措施,以确保试验过程的可靠性和安全性。
特医食品稳定性试验设计方案范文

特医食品稳定性试验设计方案范文下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!1. 引言特医食品是针对特殊人群的膳食补充剂,其稳定性对于产品质量和疗效起着关键作用。
留样观察及稳定性试验(GMP)方案

留样观察
留样观察要填写留样申请单和留样登记表。
留样申请单内容包括:
文件编号、代号、品名、批号、规格、日期、留检样 品的法定样及实验样、需要的样品量及理由、申请人签 名留样员签名和填写申请单日期等。
留样登记表内容包括:
文件编号、日期、代号、品名、批号、数量单位、留 样量及经手人等
3
留样观察
留样观察还要填写留样观察记录,并建立 留样台帐。
2、质量管理部门应开展对原料、中间产品 及成品质量稳定性的考察,根据考察结果 来评价原料、中间产品及成品的质量稳定 性,为确定物料储存期和有效期提供数据。 3、稳定性试验的内容:
(1)加速破坏试验,预测样品的有效期; (2)样品在规定的保存条件下观察若干年限的
检测结果。
8
稳定性试验
4、稳定性试验的基本要求:
(1)稳定性试验包括影响因素试验、加速试验 和长期试验。 影响因素试验适用于原料药的考察,用 1
批原料药进行; 加速试验和长期试验适用于原料药与药物制
剂,要求用 3 批供试品进行。
9
稳定性试验
4、稳定性试验的基本要求:
(2)原料药供试品是一定规模生产的,供试品量相 当于制剂稳定性实验所要求的批量,原料药合成 工艺路线、方法、步骤应与大生产一致。 药物制剂的供试品应是放大试验的产品(如片 剂或胶囊剂在10000片左右或10000粒左右,特殊 剂型、特殊品种所需数量,根据具体情况灵活掌 握),其处方与生产工艺应与大生产一致。
稳定性试验
1、影响因素试验:
(2)高湿度试验:
供试品置于恒湿密闭容器中,在25℃分别于相对 湿度90%±5%条件下放置10天,于第5天和第10天取 样,按稳定性重点考察项目要求检验,同时准确称量 试验前后供试品的重量,以考察供试品的吸湿潮解 性能。若吸湿增重5%以上,则在相对湿度75%±5% 条 件下,同法进行试验;若吸湿增重5%以下,且其他考 察项目符合要求,则不再进行此项试验。
稳定性考察方案
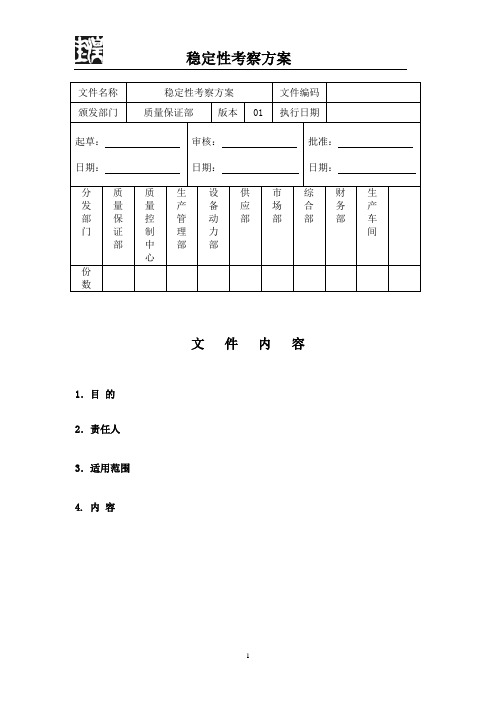
文件名称稳定性考察方案文件编码颁发部门质量保证部版本01 执行日期起草:日期:审核:日期:批准:日期:分发部门质量保证部质量控制中心生产管理部设备动力部供应部市场部综合部财务部生产车间份数文件内容1.目的2.责任人3.适用范围4. 内容1.目的建立稳定性考察方案,对产品品种、批号、有效期进行考察,为产品制定有效期提供依据。
2.责任人留样观察管理员3.适用范围已经生产的全部产品。
4. 内容1.稳定性考察方法:长期试验长期试验是在接近药品实际贮存条件下进行,其目的是为制订药品的有效期提供依据。
供试品要求3批,市售包装,在温度25℃±4℃,相对湿度60%±15%的条件下放置36个月,分别于第0月、3月、6月、9月、12月、24月、36月,按稳定性考察检查项目进行检查,将结果与0月比较观察其质量否有显著性差异。
2检测时间的规定2.1取样检查时间:6个月允许±15天;12个月后允许±30天。
2.2样品取出先放在常温下,一般要求一周内完成检测;温湿度敏感的药品要及时检测。
3.稳定性试验方案的实施3.1在药品稳定性试验前,留样管理员应检查其储存条件是否合格。
检查合格后将样品存入指定位置。
3.2留样管理员依据稳定性试验方案确定的考察品种、考察月份、检查项目,及时取样、申请检验。
3.3稳定性考察检查项目:考察月份检查项目0 全检3 全检6 全检9 全检12 全检24 全检36 全检其中,性状,主要检查中药材或饮片外观颜色是否符合要求,是否有生虫、发霉迹象。
3.4 QC收到请检样品后,依据稳定性考察检查项目,及时安排检测。
检测结束后,根据检测结果,出具检验报告书给留样观察员。
3.5稳定性试验结果出现异常情况,调查原因,并将情况及时向质量管理负责人汇报。
如果只有一项次要的检测指标有变化(如颜色、水分变化,但仍在标准之内),则继续进行稳定性试验,观察其变化趋势。
若发生显著变化,则应调整试验条件,重新进行试验。
食品加速破坏性试验、稳定性试验方案

食品加速破坏性试验、稳定性试验方案本文给出了基于温度条件的加速破坏性试验和长期稳定性试验的设计要素,供食品生产企业参考。
在确定食品的保质期时,可选择两种方式中的一种,也可以两种方式结合使用。
一、试验原理加速破坏性试验通过将食品样品置于一个或多个温度、湿度、气压和光照等外界因素高于正常水平的环境中,促使样品在短于正常的劣变时间内达到劣变终点,再通过定期检测、收集样品在劣变过程中的各项数据,经分析计算后,推算出食品在预期贮存环境参数下的保质期。
温度是最关键的食品劣变影响因素。
设计加速破坏性试验时,常将温度作为关键因素,甚至作为唯一因素。
1、通常情况下温度每上升10°C则劣变反应速度加倍。
将温差为10°C的两个任意温度下的保质期的比率定义为Q10,见式(1)。
式(1):Q10=θs(T1)/θs(T2),Q10为加速破坏性试验条件下,温差为10°C的两个温度(试验温度T2和T1)下的保质期的比率;θs(T1)为在T1温度下进行加速破坏性试验得到的保质期;θs(T2)为在T2温度下进行加速破坏性试验得到的保质期。
2、实际贮存环境参数下的保质期与加速破坏性试验温度下的保质期呈以下关系,见式(2)。
式(2):θs(T)=θs(T1)xQ10△Ta/10,θs(T)为实际贮存温度T下食品的保质期;θs(T1)为在T1温度下进行加速破坏性试验得到的保质期;△Ta为较高温度(T1)与实际贮存温度(T)的差值(T1-T),单位为摄氏度(°C)。
将试验数据代入式(1)计算出Q10,再通过式(2)可计算出实际贮存温度下的保质期θs(T)。
二、双试验温度法双试验温度法的优点是简便和节约试验时间,缺点是误差较大。
其中T1、T2均应高于实际贮存温度。
1、在任意两个相差10°C的试验温度T1、T2下分别进行加速破坏性试验,根据需要在每个考察时间点对设定的指标进行考察直至劣变终点。
产品稳定性试验方案
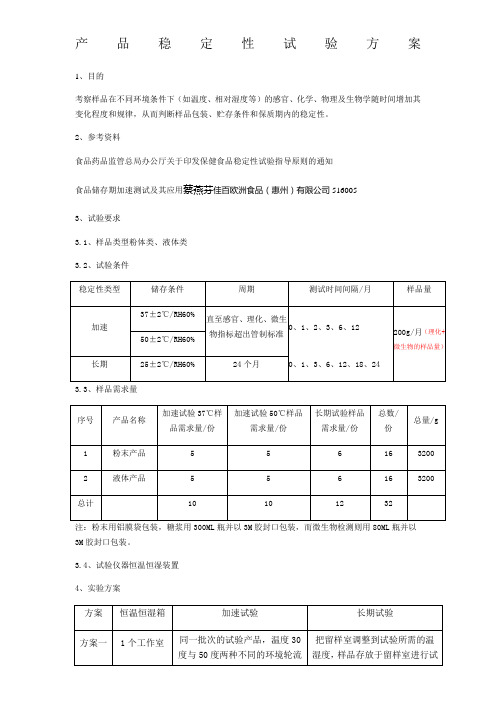
产品稳定性试验方案1、目的
考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。
2、参考资料
食品药品监管总局办公厅关于印发保健食品稳定性试验指导原则的通知
食品储存期加速测试及其应用蔡燕芬佳百欧洲食品(惠州)有限公司516005
3、试验要求
3.1、样品类型粉体类、液体类
3.2、试验条件
3.3、样品需求量
注:粉末用铝膜袋包装,糖浆用300ML瓶并以3M胶封口包装,而微生物检测则用80ML瓶并以3M胶封口包装。
3.4、试验仪器恒温恒湿装置
4、实验方案
注:1、仪器尺寸的选择,由于实验室空间有限,在选购的恒温恒湿箱空间尺寸时有所限制,而我们公司的产品种类较多,试验时只能分批次来进行。
(后附恒温恒湿箱的各种型号及市场价格)
2、仪器工作室的选择,由于试验有加速试验和长期试验,试验的时间较长,建议选购3个工作室的仪器较适合。
5、考察指标与检测方法应按照产品质量标准规定的方法,对样品的卫生学及其与产品质量有关的指标在保质期内的变化情况进行的检测。
6、数据记录、汇总。
产品稳定性试验加速试验方案

文件制修订记录鉴于目前国家尚无出台食品添加剂稳定性试验指导原则,参照《中国药典》2020年版9001原料药物与制剂稳定性试验指导原则,根据公司产品质量稳定性考察计划,结合XXX产品特点和公司总部要求,现拟定XXX稳定性试验加速试验方案。
1、目的:在加速条件下进行加速试验,目的是通过加速产品的化学或物理变化,考察市售包装品在有效期内的质量稳定性,为产品设计、包装、运输、贮存提供必要的资料。
加速试验所用包装应采用模拟小包装,但所用材料与封装条件应与大包装一致。
2、范围:本方案适用于公司生产的市售包装XXX产品。
3、责任:质量部经理负责稳定性考察加速试验方案与报告的起草和批准,QC 人员按照本方案完成实验并报告检验结果。
4、质量标准依据与考察项目:5.1考察批次及样品数:本产品市售包装成品规格为25千克/铝箔袋,选择连续生产的三批模拟市售包装小袋(50g/铝箔袋)产品,每批次10袋,三批次共30袋。
5.2考察方法5.2.1贮存地点:XXX公司稳定性试验室。
5.2.2试验条件:在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。
在试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃、相对湿度65%±5%的情况下(可用Na2Cr04饱和溶液,30℃,相对湿度64.8%)进行加速试验,时间仍为6个月。
样品留样管理人员应在检测日的当天将样品取出交给检验人员,检验人员应在样品接收后立即安排进行测定,并将检验结果报告QC主管。
5.2.4合格标准5.2.4.1按照该稳定性考察方案完成所有测试,测试结果合格;5.2.4.2没有偏差,或者偏差的调查结果和产品质量无关。
6、产品稳定性考察报告6.1试验报告内容的要求应包括产品考察指标与合格标准、考察过程中出现的偏差及处理情况、数据统计、考察结论、附表(实验数据)。
稳定性试验方案

原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察中药在温度、湿度、光线、微生物的影响下随时间变化的规律。
为中药的生产、包装、贮存、运输条件提供科学依据,同时根据试验结果建立药品的有效期。
稳定性试验的基本要求有以下几个方面:(1)稳定性试验包括加速试验与长期试验。
加速试验与长期试验要求用三批供试品进行。
(2)中药制剂的供试品应是放大试验的产品,其处方与工艺应与大生产一致。
每批放大试验的规模,丸剂应在10000g或10000丸左右、片剂10000片左右、胶囊剂10000粒左右,大体积包装的制剂(如静脉输液、口服液等)每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况,灵活掌握。
(3)供试品的质量标准应与各项基础研究及临床验证所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的容器和包装材料及包装方式应与上市产品一致。
(5)研究中药稳定性,要采用专属性强、准确、精密、灵敏的分析方法并对方法进行验证,以保证中药稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比大规模生产的数量要小,故申报者应在获得批准后,从放大试验转入大规模生产时,对最初通过生产验证的三批大规模生产的产品仍需进行加速试验与长期稳定性试验。
1、加速试验此项试验是在超常的条件下进行,其目的是通过加速中药的化学或物理变化,探讨中药的稳定性,为中药审评、工艺改进、包装、运输及贮存提供必要的资料。
供试品要求3批,按市售包装,在温度40℃±2℃,相对湿度75%±5%的条件下放置6个月。
所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。
在试验期间第1个月、2个月、3个月、6个月末各取样一次,按稳定性重点考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即温度30℃±2℃,相对湿度60%±5%的情况下进行加速试验,时间仍为6个月。
压杆稳定性实验

实验五压杆稳定性实验一、试验目的1.测定两端铰支压杆的临界载荷Fcr,验证欧拉公式。
2.观察两端铰支压杆的失稳现象。
二、设备和仪器1.多功能力学实验台2.游标卡尺、钢板尺。
三、试样试样是用弹簧钢60Si2Mn 制成的矩形截面细长杆,名义尺寸为3mm×20mm×300mm,两端制成刀口,以便安装在试验台的V 形支座内。
试样经过热处理:870℃淬油,480℃回火。
四、实验原理两端铰支的细长压杆,临界载荷Fcr 用欧拉公式计算:式中E 是材料弹性模量,I 为压杆横截面的最小惯性矩,L 为杆长。
这公式是在小变形和理想直杆的条件下推导出来的。
当载荷小于Fcr 时,压杆保持直线形状的平衡,即使有横向干扰力使压杆微小弯曲,在撤除干扰力以后仍能回复直线形状,是稳定平衡。
当载荷等于Fcr 时,压杆处于临界状态,可在微弯情况下保持平衡。
把载荷F 为纵坐标,把压杆中点挠度δ为横坐标,按小变形理论绘制的F- δ曲线为图14-1 中的OAB 折线。
但实际的杆总不可能理想地直,载荷作用线也不可能理想地与杆轴重合,材料也不可能理想地均匀。
因此,在载荷远小于Fcr 时就有微小挠度,随着载荷的增大,挠度缓慢地增加,当载荷接近Fcr 时,挠度急速增加。
其F- δ曲线如图中OCD 所示。
工程上的压杆都在小挠度下工作,过大的挠度会产生塑性变形或断裂。
只有比例极限很高的材料制成的细长杆才能承受很大的挠度使载荷稍高于Fcr(如图中虚线DE 所示)。
实验测定Fcr,在杆中点处两侧各粘贴一枚应变片,将它们组成半桥,记录应变仪读数εdu,绘制F-εdu曲线。
作F- εdu曲线的水平渐近线,就得到临界载荷Fcr。
五、试验步骤1.测量试样尺寸用钢板尺测量试样长度L,用游标卡尺测量试样上、中、下三处的宽度b 和厚度t,取其平均值。
用来计算横截面的最小惯性矩I。
2.拟定加载方案,并估算最大容许变形按欧拉公式计算Fcr,在初载荷(200N)到0.8Fcr 间分4—5 级加载,以后应变仪读数εdu每增加20 με读一次载荷值(应变仪测变形时)。
稳定性试验规定,稳定性指导原则,稳定性试验方法

FDA药物稳定性试验指导原那么药品稳定性试验规定每年底制定下年度原料和制剂成品稳定性试验书面方案,内容包括:规格标准、检验方法、检验周期、每批数量、考察工程、考察频次、时间等。
经批准后执行,新开发的制剂品种在开发阶段应制定稳定性方案。
3公司药品生产用原料稳定性试验可采用影响因素试验法:3.1将一批供试品除去包装以后,平放在平皿中,在以下条件下按规定贮存,检测重点考察工程各项质量指标的变化情况。
重点考察工程包括:性状、熔点、含量、有关物质、吸湿性及根据药品性质选定的考察工程。
影响因素试验条件:3.1.1暴露在常温空气中;3.1.2高温试验,温度分别为60℃、40℃两个温度水平;3.1.3高湿试验,湿度分别为90%±5%、75%±5%两个湿度水平;3.1.4强光照射试验,照度为4500LX±500LX4制剂稳定性试验:4.1加速试验:取供试品三批,按市售包装,在温度40℃±2℃,相对温度75%±5%的条件下放置6 个月,在第一个月、第二个月、第三个月、第六个月末取样检测各剂型规定的重点考察工程的质量指标变化情况。
片剂的重点考察工程为:性状、含量、有关物质、崩解时限或溶出度。
硬胶囊剂的重点考察工程为:外观、内容物色泽、含量、有关物质、崩解时限或溶出度、水份。
液体制剂的重点考察工程为:性状、相对密度、含量、pH值、微生物限度检查。
3个月后测试符合要求,有效期暂定为2年,6个月后测试符合要求有效期暂定为3年。
4.2长期试验:取供试品三批,按市售包装,在规定保存条件下贮存,每年检测一次,重点考察工程的质量指标变化情况,观察3年的检验结果,以确定产品的贮存期或有效期。
5严格按照批准的书面稳定性方案,做好试验记录,如发现异常情况,采取措施及时调整。
6试验完毕后,对试验结果进展数理统计后处理,评定并作出结论。
写出稳定性试验报告,所有资料归档保存。
留样观察管理制度留样的环境及要求根据本公司生产的品种的贮存需用,设专用的留样观察室,分为常温区、阴凉区,留样室要求避光、枯燥、通风、防虫鼠。
稳定性试验方案

稳定性试验⽅案Stability Study Protocol for Exhibit Batch of Chloroquine Phosphate Tablets USP, 250mg 规格为250 mg的USP磷酸氯喹⽚长期、中期及加速稳定性研究⽅案Prepared By: Date:起草者:⽇期:Reviewed By QA: Date:审核者:⽇期:Approved By: Date:批准者:⽇期:Starting Date: Completed Date:开始⽇期:结束⽇期:Contents⽬录1. Purpose⽬的 (1)2. Scope范围 (1)3. References参考资料 (1)4. General Information基本信息 (1)4.1 Stability Samples稳定性研究样品 (1)4.2 Product Outline样品概述 (2)4.3 Formulation处⽅ (2)4.4 Container-Closure Systems包装 (3)4.5 Labeling标签 (3)4.6 Samples and Package样品与包装 (4)5. Stability Testing稳定性测试 (4)5.1 Sample Receipt and Storage样品接收与储存 (4)5.2 Storage Conditions and Testing Time Points储存条件与检测时间点 (4)5.3 Sampling取样 (5)5.4 Testing Matrix稳定性测试项⽬表 (6)5.5 Parameters and Acceptance Criteria检测项⽬及质量标准 (6)5.6 Degradation products降解产物 (7)6. Data Presentation数据汇总 (7)7. Reporting报告 (7)7.1 Intermediate Reports中期报告 (7)7.2 Summary Report总结报告 (7)7.3 Stability Documents稳定性⽂件夹 (7)8. Appendix附件 (8)1.Purpose⽬的The purpose of stability testing is to provide evidence of how the Quality, Strength, Degradation Products and Purity of the Chloroquine Phosphate Tablets USP, 250mg will change with time under the influence of environmental room temperature and relative humidity conditions. Data collected from the stability study will enable recommended storage conditions and provide justification for establishing and submitting the data to regulatory authorities for approving the shelf life for marketing purposes.In addition, 3 months of the stability data will be submitted to US FDA as required for submission purposes of the ANDA application.此稳定性研究的⽬的是为了考察磷酸氯喹⽚在环境因素的影响下(例如:温度和湿度)其性质、规格、降解产物和含量等随时间⽽变化的规律,依据稳定性研究的数据确定该产品的储藏条件和有效期。
二化学药品稳定性试验方法

附件二化学药品稳定性试验方法1. 引言化学药品的稳定性试验是药品开发和质量控制中一个至关重要的环节。
稳定性试验可以评估药品在不同条件下的稳定性,包括其化学稳定性、物理稳定性和微生物稳定性。
通过稳定性试验,可以确定药品在储存和使用过程中是否会发生分解、降解、氧化等质量变化,从而确保药品的质量和有效性。
本文档将介绍化学药品稳定性试验的方法和步骤,以便有针对性地进行药品稳定性试验,并保证试验结果的可靠性和准确性。
2. 化学药品稳定性试验方法2.1 试验设计在进行化学药品稳定性试验前,需要制定合适的试验设计。
试验设计应包括以下几个方面:•选择适当的试验条件,如温度、湿度、光照等。
•确定药品的稳定性指标,如药品的主要成分含量、溶解度、pH值等。
•设计试验时间点,通常包括初始时间点和多个时间点的稳定性监测。
2.2 样品准备在进行稳定性试验前,需要准备样品。
样品的选择应符合试验设计的要求,并保证样品的质量和纯度。
样品准备的步骤如下:1.根据试验设计确定所需的样品数量和浓度。
2.准确称取样品,并进行必要的稀释或配制。
3.保证样品的标识清晰,以便于后续的试验操作和结果分析。
2.3 试验条件设置稳定性试验的结果很大程度上取决于试验条件的设置。
以下是一些常用的试验条件设置方法:1.温度设置:根据药品的特性和要求,在试验过程中设置合适的温度,可以包括常温、冷藏温度和高温等。
2.湿度设置:在某些情况下,湿度对药品的稳定性也起到重要的作用。
根据试验设计要求,设置合适的湿度条件。
3.光照设置:某些化学药品对光敏感,因此需要在试验过程中设置光照条件,以模拟实际的储存和使用环境。
2.4 试验方法稳定性试验的具体方法包括以下几个方面:1.药品主要成分含量测定:根据试验设计的要求,采用合适的方法测定药品中主要成分的含量,如高效液相色谱法、气相色谱法等。
2.药品溶解度测定:根据药品的特性和试验设计要求,采用适当的方法测定药品在不同溶剂中的溶解度,如旋光仪法、紫外分光光度法等。
药物稳定性试验方案

***药物稳定性试验方案一、试验目的***药物稳定性试验的目的是考察***药物在温度、湿度、光线的影响下随时间变化的规律,考察其在影响因素试验、加速试验的条件下各项指标是否符合***药物产品质量标准的要求。
二、试验要求***药物稳定性试验的基本要求有以下几个方面:1、稳定性试验项目包括影响因素试验与加速试验。
2、***药物供试品可以从橡胶膏生产车间生产的同一批制剂中抽取,抽样数量符合稳定性试验要求。
3、加速试验与长期试验***药物所用供试品的容器和包装材料及包装方式应与上市产品一致。
4、***药物稳定性试验,要采用专属性强、准确、精密、灵敏的药物分析方法,以保证药物稳定性结果的可靠性。
三、试验方法(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是考察***药物的固有稳定性,了解其在高温、高湿及低温条件下各项质量指标的稳定性及变化情况。
1.高温试验***药物置药物稳定性检查仪中,60℃温度下放置10天,于第5天和第10天取样,按***药物成品质量标准进行全检。
若***药物供试品有明显变化(如含量下降5%),则在40℃条件下同法进行试验。
若60℃无明显变化,不再进行40℃试验。
2.高湿度试验***药物置恒湿密闭容器中,在25℃分别于相对湿度90%±5%条件下放置10天,于第5天和第10天取样,按***药物成品质量标准进行全检,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。
若吸湿增重5%以上,则在相对湿度75%±5%条件下,同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此项试验。
恒湿条件可通过在密闭容器如干燥器下部放置饱和盐溶液实现,根据不同相对湿度的要求,选择NaCl饱和溶液(15.5~60℃,相对湿度75%±1%)或KNO3饱和溶液(25℃,相对湿92.5%)。
3.低温试验***药物置适宜的密封洁净容器中,0℃温度下放置10天,于第5天和第10天取样,按***药物成品质量标准进行全检。
稳定性试验方案

稳定性试验方案稳定性试验是对产品进行持续运行和使用过程中的性能进行评估的一种实验方法。
稳定性试验旨在验证产品在长时间运行下是否能够保持其性能和功能的稳定性,并评估产品在不同环境条件下的耐受能力和可靠性,以进一步指导产品的设计和制造。
下面是一份关于稳定性试验的方案。
一、试验目的:验证产品在连续长时间运行下的性能是否持续稳定,并评估其在不同环境条件下的可靠性。
二、试验对象:待测产品的样机。
三、试验条件:1.运行条件:根据产品的使用场景和要求,设定产品的工作状态和参数。
2.环境条件:将产品置于不同的环境条件下进行试验,包括温度、湿度、震动等。
按照相关标准和用户要求进行设定。
四、试验内容:1.连续运行试验:将产品置于预定的运行条件下进行连续运行,记录运行时间、运行状态和相关参数,观察产品的运行稳定性。
2.环境适应试验:将产品置于不同的环境条件下进行试验,观察产品的性能和功能是否受到环境变化的影响,并记录相关数据。
3.负荷变化试验:在产品连续运行的过程中,逐渐增加或减小产品的负荷,观察产品的运行稳定性和负荷适应能力。
五、试验方法:1.设备准备:使用符合产品要求的测试设备和工具,确保测试的准确性和可靠性。
2.试验设定:根据产品要求和试验目的,设置产品的运行状态、参数和环境条件。
3.试验记录:对产品的运行时间、运行状态和参数进行记录,包括故障记录和异常情况的分析与处理。
4.数据分析:根据试验结果,对产品的性能和功能进行分析,并结合实际使用需求和用户反馈,提出改进和优化的建议。
六、试验报告与分析:1.试验报告:根据试验结果和过程记录,编写试验报告,包括试验目的、方法、过程和结果等内容,详细描述产品的运行稳定性和环境适应性。
2.数据分析与结论:根据试验结果和数据分析,总结产品的稳定性和可靠性,找出存在的问题和改进的方向。
3.改进措施:根据试验结果和分析,提出产品改进的方案和建议,以提高产品的稳定性和可靠性。
七、试验安全与注意事项:1.进行试验前,确保试验设备和环境的安全性和稳定性。
半夏糖浆稳定性试验方案(模板)

2024年半夏糖浆持续稳定性考察方案为了进一步确认销售的半夏糖浆能够在标示的贮存条件下,产品有效期内符合质量标准的各项要求,按照有关规定进行温度25C±2C∖相对湿度60%±5%条件下24个月的长期稳定性考察。
1产品的包装、规格、生产批量、考察批次数:(1)包装:口服液体药用聚酯瓶包装(2)规格:-一(3)生产批量:800万m1(4)考察批次:①包装规格为IOOmI/瓶X1瓶/盒的每年考察一批次。
②包装规格为120m1∕瓶X1瓶/盒的每年考察一批次。
③包装规格为150m1∕瓶X1瓶/盒的每年考察一批次。
④包装规格为180mI∕瓶X1瓶/盒的每年考察一批次。
⑤包装规格为200mI∕瓶X1瓶/盒的每年考察一批次。
2 .产品介绍:半夏糖浆执行标准为部颁标准第八册;批准文号为国药准字ZXXXXXXXXXXXX;包装形式为口服药用聚酯瓶;贮存条件:密封,置阴凉处;有效期为24个月。
3 .相关的物稳定性考察检验方法:包装容器的密封性一目测、感观;性状一目测;相对密度一相对密度测定法。
4 .检验方法依据:(1)部颁标准第八册59页半夏糖浆(2)《中国药典》(2023版)四部“糖浆剂”通则。
5 .合格标准:根据《部颁标准》第八册半夏糖浆项下质量标准进行包装容器的密封性、性状、相对密度的检查,结果符合内控标准规定。
6 .容器密封系统的描述:半夏糖浆所用包装为口服液体药用聚酯瓶和瓶盖,瓶口有热压后的的铝箔封口,包装严密防污染、漏气、漏液,能保证产品质量。
7 .试验间隔时间(测试时间点):每批样品自贮存开始时(0月)检测一次,随后每3个月、6个月、9个月、12个月、18个月、24个月分别检测一次。
8 .贮存条件:密封,在温度25C±2C,相对湿度60%±5%的条件下放置。
(BSCToo型恒温恒湿箱)9 .检查项目:根据《中国药典》2023年版四部9001原料药与药物制剂稳定性试验指导原则项下中稳定性重点考察项目参考表制定该品种检查项目为:包装容器的密封性、性状、相对密度。
稳定性试验加速试验方案

稳定性试验加速试验方案稳定性试验是评估产品在一定的条件下长期稳定性的试验,以确定产品的性能能否在一定时间内维持在一定的稳定水平。
而加速试验是在时间上缩短试验过程,以模拟产品在长期使用时可能遇到的各种严酷环境进行评估。
稳定性试验和加速试验相辅相成,可以提前发现产品的潜在问题,为产品改进提供依据。
1.确定试验目标和要求:根据产品的使用环境和要求,确定试验的目标和要求,例如试验时间、试验条件等。
2.确定试验条件:根据产品的使用环境和要求,确定试验的条件,如温度、湿度、振动等。
3.选择试验样品:从不同批次的产品中选择一定数量的样品进行试验,确保样品的代表性。
4.设计试验方案:根据试验目标和条件,设计试验方案,包括试验设置、试验设备、试验过程等。
5.进行试验:按照试验方案,进行试验,记录试验样品的性能指标和试验条件的变化情况。
6.分析试验数据:对试验数据进行分析,评估样品的稳定性和试验条件对样品性能的影响。
7.判断试验结果:根据试验数据的分析结果,判断样品的稳定性是否符合要求,以及是否需要改进产品设计。
加速试验是在稳定性试验的基础上进行的,通过模拟产品的使用环境、使用寿命和使用条件,以缩短试验时间来评估产品的性能。
加速试验的基本步骤如下:1.确定加速因素:根据产品的使用环境和使用条件,确定加速试验的因素,如温度、湿度、振动等。
2.设置加速条件:根据产品的使用环境和使用条件,确定加速试验的条件,如高温、高湿度、高振动等。
3.设计加速试验方案:根据加速因素和条件,设计加速试验方案,包括试验设置、试验设备、试验过程等。
4.进行加速试验:按照加速试验方案,进行试验,记录试验样品的性能指标和试验条件的变化情况。
5.分析试验数据:对加速试验数据进行分析,评估样品的性能退化情况,预测样品在真实使用环境下的稳定性。
6.判断试验结果:根据加速试验数据的分析结果,判断样品在真实使用环境下的稳定性是否符合要求,以及是否需要改进产品设计。
产品稳定性试验方案

产品稳定性试验方案
1、目的
考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。
2、参考资料
食品药品监管总局办公厅关于印发保健食品稳定性试验指导原则的通知
食品储存期加速测试及其应用蔡燕芬佳百欧洲食品(惠州)有限公司516005
3、试验要求
3.1、样品类型粉体类、液体类
3.2、试验条件
3.3、样品需求量
注:粉末用铝膜袋包装,糖浆用300ML 瓶并以
3M 胶封口包装,而微生物检测则用80ML 瓶并以3M 胶封口包装。
3.4、试验仪器恒温恒湿装置 4、实验方案
注:1、仪器尺寸的选择,由于实验室空间有限,在选购的恒温恒湿箱空间尺寸时有所限制,而我们公司的产品种类较多,试验时只能分批次来进行。
(后附恒温恒湿箱的各种型号及市场价格)
2、仪器工作室的选择,由于试验有加速试验和长期试验,试验的时间较长,建议选购3个工作室的仪器较适合。
5、考察指标与检测方法应按照产品质量标准规定的方法,对样品的卫生学及其与产品质量有关的指标在保质期内的变化情况进行的检测。
6、数据记录、汇总。
稳定性试验方案

稳定性试验方案根据饲料添加剂稳定性试验指南的要求和分类,应进行影响因素试验、加速试验和长期试验。
具体实施方案:一、设备要求:高温烘箱1-2台,恒温恒湿仪一台。
气相、液相、原子吸收光谱仪,紫外分光光度计、化学仪器共用。
二、人员要求:配备一至二名专职或兼职试验人员,设备维护人员要保证设备的正常运行。
三、影响因素试验:1、高温试验方法:随机抽取2-3个样品于高温烘箱中并恒温60℃放置10天。
在放置当天,5天,10天,检测含量、水分、外观及重金属等。
如无变化或变化在规定范围内,则高温试验结束。
如变化超过规定的范围(主要是外观、PH等),则应重新取原批次样品将烘箱温度降至40℃放置10天。
在放置当天,5天,10天,检测含量、水分、外观、PH及重金属等。
如无变化或变化在规定范围内,则高温试验结束。
如指标或外观仍不符合要求,则该产品稳定性较差。
2、高湿试验方法:随机抽取2-3个样品于恒温恒湿仪中并恒温25℃,湿度(RH)90%±5放置10天。
在放置当天,5天,10天,检测含量、水分、外观、PH及重金属等。
如无变化或变化在规定范围内,则高湿试验结束。
如变化超过规定的范围(主要是外观、水分及吸湿增重超5%),则应重新取原批次样品放置恒温恒湿仪将温度降至25℃、湿度(RH)降至75%±5放置10天。
在放置当天,5天,10天,检测含量、水分、外观、PH及重金属等。
如无变化或变化在规定范围内,则高湿试验结束。
如指标或外观仍不符合要求,则该产品稳定性较差。
四、加速试验:1、随机取包装准备销售的三个样品,放置在恒温恒湿仪中,温度设置为40℃±2,湿度设置为75%±5进行6个月试验。
分别在0,1,2,3,6个月末取样检测。
如6个月内样品无变化,指标在规定范围内,加速试验结束。
如发生变化或外观发生变化,应重新取样放置在恒温恒湿仪中并将恒温恒湿仪温度设置为30℃±2,湿度设置为65%±5进行6个月试验。
稳定性试验方案

稳定性试验方案
目录:
1. 稳定性试验方案的重要性
1.1 稳定性试验方案的定义
1.2 稳定性试验方案的目的
1.3 稳定性试验方案的应用领域
2. 实施稳定性试验方案的步骤
2.1 制定试验计划
2.2 确定试验参数
2.3 设计试验方案
2.4 实施试验
2.5 数据分析与结论
3. 稳定性试验方案的优点
3.1 保证产品质量稳定性
3.2 减少生产风险
3.3 提高产品竞争力
4. 稳定性试验方案的注意事项
4.1 确保试验环境稳定
4.2 严格控制试验条件
4.3 定期监测试验数据
5. 结语
---
稳定性试验方案是产品设计和生产过程中至关重要的一环。
通过制定科学合理的试验方案,可以保证产品在不同环境条件下的稳定性和性能表现。
稳定性试验方案的目的在于验证产品在长期使用或储存过程中的稳定性,以便提前发现和解决可能存在的问题,确保产品质量稳定。
实施稳定性试验方案的步骤包括制定试验计划、确定试验参数、
设计试验方案、实施试验以及数据分析与结论。
在整个试验过程中,需要严格按照计划进行,确保试验的可靠性和有效性。
稳定性试验方案的优点包括保证产品质量稳定性、减少生产风险以及提高产品竞争力。
通过建立健全的试验方案,企业可以有效提升产品的市场竞争力,赢得消费者信赖。
在设计稳定性试验方案时,需要注意确保试验环境稳定、严格控制试验条件并定期监测试验数据。
只有这样,才能保证试验结果的准确性和可靠性,为产品质量提供有力保障。
稳定性试验方案的执行对于企业的发展至关重要,需要引起足够重视。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Stability Study Protocol for Exhibit Batch of Chloroquine Phosphate Tablets USP, 250mg 规格为250 mg的USP磷酸氯喹片
长期、中期及加速稳定性研究方案
Prepared By: Date:
起草者:日期:
Reviewed By QA: Date:
审核者:日期:
Approved By: Date:
批准者:日期:
Starting Date: Completed Date:
开始日期:结束日期:
Contents
目录
1. Purpose目的 (1)
2. Scope范围 (1)
3. References参考资料 (1)
4. General Information基本信息 (1)
4.1 Stability Samples稳定性研究样品 (1)
4.2 Product Outline样品概述 (2)
4.3 Formulation处方 (2)
4.4 Container-Closure Systems包装 (3)
4.5 Labeling标签 (3)
4.6 Samples and Package样品与包装 (4)
5. Stability Testing稳定性测试 (4)
5.1 Sample Receipt and Storage样品接收与储存 (4)
5.2 Storage Conditions and Testing Time Points储存条件与检测时间点 (4)
5.3 Sampling取样 (5)
5.4 Testing Matrix稳定性测试项目表 (6)
5.5 Parameters and Acceptance Criteria检测项目及质量标准 (6)
5.6 Degradation products降解产物 (7)
6. Data Presentation数据汇总 (7)
7. Reporting报告 (7)
7.1 Intermediate Reports中期报告 (7)
7.2 Summary Report总结报告 (7)
7.3 Stability Documents稳定性文件夹 (7)
8. Appendix附件 (8)
1.Purpose
目的
The purpose of stability testing is to provide evidence of how the Quality, Strength, Degradation Products and Purity of the Chloroquine Phosphate Tablets USP, 250mg will change with time under the influence of environmental room temperature and relative humidity conditions. Data collected from the stability study will enable recommended storage conditions and provide justification for establishing and submitting the data to regulatory authorities for approving the shelf life for marketing purposes.
In addition, 3 months of the stability data will be submitted to US FDA as required for submission purposes of the ANDA application.
此稳定性研究的目的是为了考察磷酸氯喹片在环境因素的影响下(例如:温度和湿度)其性质、规格、降解产物和含量等随时间而变化的规律,依据稳定性研究的数据确定该产品的储藏条件和有效期。
2.Scope
范围
This procedure is applicable to Finished Product Stability Lab at Hisun Pharmaceutical (Hangzhou) Co.
Ltd. Fuyang, Hangzhou.
适用于浙江台州海正药业成品药稳定性实验室。
3.References
参考资料
3.1 ICH Harmonized Triparties Guideline for Stability Testing of New Drug Substances and Drug
Product06, 2003. [ICH Q1A (R2)]
新原料药和新制剂的稳定性测试指南06, 2003. [ICH Q1A(R2)]
3.2 ASSAY METHOD V ALIDATION REPORT FOR CHLOROQUINE PHOSPHATE, USP, API AND
CHLOROQUINE PHOSPHATE, USP TABLETS, 250 mg AND 500 mg. (ARD-VDR-FPTM025A) 磷酸氯喹原料药、250mg和500mg片的含量测定方法验证报告。
3.3 RELATED SUBSTANCES METHOD V ALIDATION REPORT FOR CHLOROQUINE
PHOSPHATE, USP, API AND CHLOROQUINE PHOSPHATE, USP TABLETS, 250 mg AND 500 mg.(ARD-VDR-FPTM025B)
磷酸氯喹原料药、250mg和500mg片有关物质方法验证报告。
3.4 DISSOLUTION METHOD V ALIDATION REPORT FOR CHLOROQUINE PHOSPHATE, USP
TABLETS, 250 mg AND 500 mg. (ARD-VDR-FPTM025C)
磷酸氯喹250mg和500mg片溶出度方法验证报告。
4.General Information
基本信息
4.1Stability Samples
稳定性样品
4.1.1 One Exhibit Batch for 250mg strength will be included in the stability study.
规格为250mg的磷酸氯喹片各一批。
4.1.2 One batch of 250mg reference product will also be placed on stability study.
规格为250mg和的磷酸氯喹对照制剂各一批。
