融合蛋白的标签
融合蛋白的作用与应用

融合蛋白的作用与应用蛋白质是生命体中重要的组成部分,因此蛋白质的合成和研究一直是生物科学的热门领域。
在这个领域里,融合蛋白技术因其独特的作用和广泛的应用而备受关注。
本文章将重点介绍融合蛋白技术在生物科学研究中的作用和应用。
融合蛋白是一种人工合成的蛋白质,它是由两个或多个不同蛋白质的基因融合而成的。
融合蛋白通常由一个标签和一个目标蛋白组成。
标签可以是荧光蛋白、酶标签、His-标签等。
融合标签可以帮助研究人员追踪蛋白质的存在、位置和运动。
目标蛋白可以是任何感兴趣的蛋白质,例如转录因子、激酶、酶等。
融合蛋白技术的主要作用是实现表达和纯化目标蛋白质。
传统的表达和纯化方法通常需要在目标蛋白质中添加一些化学物质或结构,这样会影响到蛋白质的本来结构和功能。
而融合蛋白技术使得目标蛋白质可以在不添加任何结构和化学物质的情况下得到表达和纯化。
因此,融合蛋白技术可以保证目标蛋白质的结构和功能完整,从而更好的进行生物学研究。
融合蛋白技术还可以用于标记和可视化蛋白质,以便于对其进行追踪和定位。
这项技术可以帮助研究人员研究蛋白质在细胞内的运动和交互,并且提供一种高效、准确的方法来定位和证实蛋白质相互作用的位置和方式。
融合蛋白技术还可以用于对药物与蛋白相互作用进行研究,这样可以更好的理解药物的作用机理并开发更加高效、准确的药物。
例如,研究人员可以制备融合蛋白并将其融入药物。
然后,他们可以研究药物对融合蛋白的影响,从而了解药物如何与蛋白相互作用。
融合蛋白技术还可以用于优化蛋白表达和纯化方案。
蛋白表达和纯化通常是一项复杂的任务,但是融合蛋白技术可以使其更加容易。
通过使用融合蛋白来表达和纯化目标蛋白,可以使表达和纯化此目标蛋白变得更加容易和高效。
总而言之,融合蛋白技术在生物科学研究中具有广泛的应用,可以实现表达和纯化目标蛋白、标记和可视化蛋白、研究药物与蛋白相互作用和优化蛋白表达和纯化方案。
随着蛋白质研究的不断深入,融合蛋白技术将会发挥更多的作用和应用。
His标签融合蛋白纯化步骤

His标签融合蛋白纯化步骤(Ni-NTA琼脂糖凝胶亲和层析纯化法)1. 缓冲液配制◆L ysis Buffer 1 (under native condition)0.5mM Tris.HCl0.5M NaCl5%(w/v) glycerol10mM Imidazol100mg(1mg/ml)lysozyme (Purification of 6xHis-tagged proteinsfrom E.coli)1% Nonidet P40 (NP40 = Igepal CA-630 )0.25% Tween 20 (or Triton 100)0.02% NaN3 (Optional)2 tablets of protease inhibitor cocktail (EDTA free,Recommended)200 µg(2µg/ml) RNase A (Optional)1mg (10µg/ml) DNase1 (Optional)50 mM NaF (Optional)1mM Na3VO4 (Optional)+ ddH2O to 100ml, Adjust pH to 8.0 using NaOH此lysis buffer 适用于从E.coli、哺乳动物细胞和昆虫细胞中纯化带His标签的蛋白质。
仅在用于裂解E.coli细菌时,加入溶菌酶。
Na3VO4是磷酸酶抑制剂,保护磷酸化的蛋白不被磷酸酶还原。
NaF是酯酶抑制剂,保护脂蛋白不被酯酶降解。
注意:当使用镍琼脂糖凝胶纯化带His标签的蛋白时,缓冲液中不能加EDTA,因EDTA能使镍从螯合物上脱离,从而使分离介质失去效果。
◆L ysis Buffer 2(under denature condition)50 mM Tris-Cl8 M Urea (or 6 M Gu-HCl)10mM Imidazole0.05% Tween 20Adjust pH to 8.0 using NaOH◆D ialysis/Tev cleavage Buffer50 mM Tris-Cl,pH8.0100 mM NaCl (depends on solubility of protein)2.5% glycerol0.5mM EDTA0.5mM DTT or TCEP◆缓冲液A:50mM Tris.HCl0.5M NaCl5% glycerol0.05% Tween 20用高浓度HCl调节pH值至8.0。
小肽-fc融合蛋白质粒

小肽-fc融合蛋白质粒
小肽-fc融合蛋白质粒是一种用于表达多肽蛋白质的技术。
这种技
术主要是将FC标签(也称为小肽标签)与你要表达的蛋白质共同结合,以形成一个小肽-fc融合蛋白质粒,以便于向细胞输送蛋白质。
FC标签是一种抗原性多肽,它主要是增加你要表达的蛋白质粒的
活性,以便它可以扩散到细胞的内部,从而实现蛋白质的可控性表达。
FC标签可以将多肽放在一起,这样你就可以有效地表达出你想要的蛋
白质。
通常,在生产过程中,小肽-fc融合蛋白质粒会被通过一种叫做
“重组质粒水解法”的技术来制备。
这种技术主要是将小肽融合蛋白
质粒放在特定pH和温度下,然后通过一种叫做“碱弹”的化学反应将
小肽和目标蛋白质质粒融合在一起,形成一个新的蛋白质粒。
使用小肽-fc融合蛋白质粒的优势是它可以显著改善你要表达的蛋
白质的稳定性,比如它可以抵御环境中的pH和温度变化,防止蛋白质
发生变性。
此外,这种技术可以有效地表达出不易被细胞吞噬,对细
胞有较强致癌性的多肽蛋白质,以及抗生素和疫苗。
此外,小肽-fc融
合蛋白质粒技术还可以大大减少传统重组蛋白质表达系统中的抗原性
蛋白质的表达。
因此,小肽-fc融合蛋白质粒技术具有有效的蛋白质表达、高稳定性、易于操作等优势,因此引起了广泛的关注。
GFP标签融合蛋白亲和凝胶使用说明书

Anti-GFP亲和凝胶Cat#:IP0057(本品仅用于科学研究,不可用于诊断及治疗)1.背景信息GFP,绿色荧光蛋白(Green fluorescent protein),来源于维多利亚多管发光水母,由约238个氨基酸组成,从蓝光到紫外线都能使其激发出绿色萤光。
GFP常用于真核蛋白质重组表达标记。
Anti -GFP亲和凝胶,由高品质的GFP鼠单克隆抗体与Sepharose 4B琼脂糖颗粒共价偶联制成,具有高载量(至少为1.2mg protein/ml凝胶),高特异性,性质稳定,可反复使用的特点,可用于GFP标签融合蛋白的免疫(共)沉淀检测。
2.性能指标应用范围:可用于N端GFP融合蛋白(GFP–Protein)和C端GFP融合蛋白(Protein-GFP)的免疫(共)沉淀。
载量:1ml Sepharose 4B琼脂糖颗粒,共价偶联800μg Anti-GFP 鼠单克隆抗体,可沉淀至少1.2mg GFP融合蛋白。
成分:共价偶联Anti-GFP 鼠单克隆抗体的Sepharose 4B琼脂糖颗粒, 1ml溶于2ml PBS+50%甘油中。
保存方法:在加入了50%甘油和0.2‰叠氮钠的PBS保存液中,-20℃可保存1年。
3.使用方法3.1细胞裂解液制备3.1.1悬浮细胞和半贴壁细胞从细胞培养瓶上吹下来后放入离心管中,1000rpm离心5分钟。
贴壁细胞用细胞刮子轻轻从瓶壁上刮下来,放入离心管中1000rpm离心5分钟。
3.1.2预冷的PBS(pH7.2)重悬细胞,1000rpm离心3min,弃上清。
重复一次。
3.1.3根据细胞的量加入相应体积的细胞裂解液(推荐配方见5.3),反复吹打后冰上放置10-20min,让细胞充分裂解。
3.1.4用超声破碎仪将细胞裂解液超声,直至细胞裂解液透明,不再粘稠。
冰上放置30min之后,12000rpm,4℃离心10min。
取上清,冷冻保存。
3.2装柱及孵育3.2.1根据使用目的选用重力柱或离心管,移入适量亲和凝胶。
几种常用的蛋白标签
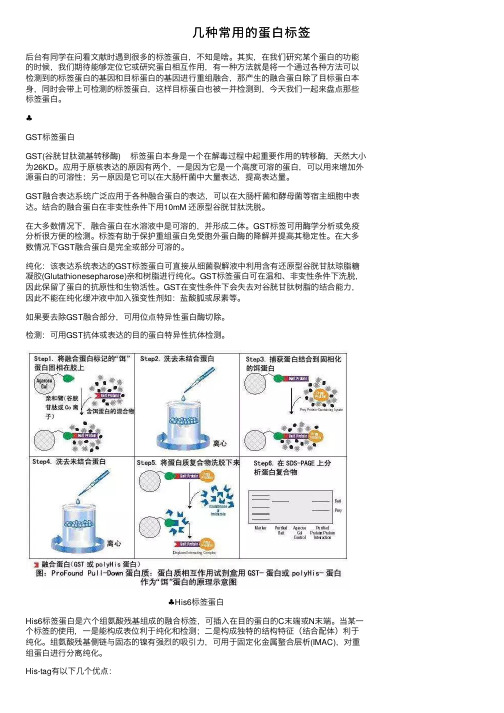
⼏种常⽤的蛋⽩标签后台有同学在问看⽂献时遇到很多的标签蛋⽩,不知是啥。
其实,在我们研究某个蛋⽩的功能的时候,我们期待能够定位它或研究蛋⽩相互作⽤,有⼀种⽅法就是将⼀个通过各种⽅法可以检测到的标签蛋⽩的基因和⽬标蛋⽩的基因进⾏重组融合,那产⽣的融合蛋⽩除了⽬标蛋⽩本⾝,同时会带上可检测的标签蛋⽩,这样⽬标蛋⽩也被⼀并检测到,今天我们⼀起来盘点那些标签蛋⽩。
♣GST标签蛋⽩GST(⾕胱⽢肽巯基转移酶) 标签蛋⽩本⾝是⼀个在解毒过程中起重要作⽤的转移酶,天然⼤⼩为26KD。
应⽤于原核表达的原因有两个,⼀是因为它是⼀个⾼度可溶的蛋⽩,可以⽤来增加外源蛋⽩的可溶性;另⼀原因是它可以在⼤肠杆菌中⼤量表达,提⾼表达量。
GST融合表达系统⼴泛应⽤于各种融合蛋⽩的表达,可以在⼤肠杆菌和酵母菌等宿主细胞中表达。
结合的融合蛋⽩在⾮变性条件下⽤10mM 还原型⾕胱⽢肽洗脱。
在⼤多数情况下,融合蛋⽩在⽔溶液中是可溶的,并形成⼆体。
GST标签可⽤酶学分析或免疫分析很⽅便的检测。
标签有助于保护重组蛋⽩免受胞外蛋⽩酶的降解并提⾼其稳定性。
在⼤多数情况下GST融合蛋⽩是完全或部分可溶的。
纯化:该表达系统表达的GST标签蛋⽩可直接从细菌裂解液中利⽤含有还原型⾕胱⽢肽琼脂糖凝胶(Glutathionesepharose)亲和树脂进⾏纯化。
GST标签蛋⽩可在温和、⾮变性条件下洗脱,因此保留了蛋⽩的抗原性和⽣物活性。
GST在变性条件下会失去对⾕胱⽢肽树脂的结合能⼒,因此不能在纯化缓冲液中加⼊强变性剂如:盐酸胍或尿素等。
如果要去除GST融合部分,可⽤位点特异性蛋⽩酶切除。
检测:可⽤GST抗体或表达的⽬的蛋⽩特异性抗体检测。
♣His6标签蛋⽩His6标签蛋⽩是六个组氨酸残基组成的融合标签,可插⼊在⽬的蛋⽩的C末端或N末端。
当某⼀个标签的使⽤,⼀是能构成表位利于纯化和检测;⼆是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引⼒,可⽤于固定化⾦属螯合层析(IMAC),对重组蛋⽩进⾏分离纯化。
优质原创总结 NusA标签 MBP标签 融合标签蛋白纯化原理及优缺点

融合MBP蛋白的纯化(双标签:MBP-His6)
更多蛋白表达/蛋白纯化相关原理/实验流程及FAQ请访问: /topics/dan-bai-biao-da.html 我们会不断的更新补充最全面、专业的蛋白表达相关知识, 欢迎收藏!
谢谢大家
融合NusA 和 MBP蛋白纯化
融合NusA和MBP蛋白纯化
定义
A
B
原理
方法
C
D
问题
NusA
NusA(antitermination protein
残基数:495
分子量: 54.87KDa
不具有独立的纯化标签功能,所以要与其它标签如His标签联用
关于NusA
NusA的 氨基酸序列
NusA的运用的优点和缺点
NusA标签的去除
NusA标签的去除 (TEV)
双标签融合蛋白NusA与His 6的纯化(试剂)
双标签融合蛋白NusA与His 6的纯化(流程)
双标签融合蛋白NusA与His 的纯化(分析)
6
MBP
麦芽糖结合蛋白(maltose binding protein. MBP)
关于MBP
关于MBP
MBP标签运用的优缺点
融合MBP蛋白的纯化(流程)
融合MBP蛋白的纯化(试剂)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-亲和)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-离子)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-分子筛)
融合MBP蛋白的纯化(双标签:MBP-His6)
蛋白质融合表达的标签及切割研究

1 .1多聚精氨酸-标签(Arg-tag)精氨酸-标签通常由5或6个精氨酸组成.它已被成功用作细菌C末端标签,精氨酸是碱性最强的氨基酸,带5个精氨酸标签的蛋白质可以结合到阳离子交换树脂SP-Sephadex上, 而大部分杂蛋白不结合.结合后,带标签的蛋白质在碱性pH下运行线性NaCl梯度洗脱得到.当C末端为疏水性区域时,多聚精氨酸可能影响蛋白质的三级结构.氨酸残基的C末端序列可用羧肽酶B处理去除.这一酶促处理已被成功用于一些例子,但常常由于低的切割得率或者在期望的蛋白质序列间发生不必要的切割而受到限制.然而精氨酸标签并不常用,与第二标签联用是很有趣的蛋白质纯化工具.1.2 多聚组氨酸-标签(His-tag)已广泛采用的方法是利用固定化金属螯合层析纯化带有由多聚组氨酸残基组成的一个短的亲和标签的重组蛋白质.固定化金属螯合层析的基础是固定在基质上的过渡态金属离子(Co2+, Ni2+, Cu2+, Zn2+)与特定的氨基酸侧链之间的相互作用.组氨酸是与固定化金属离子作用最强的氨基酸,组氨酸的咪唑环作为电子供体容易与固定的金属离子形成配位键.基质材料洗涤之后,可通过调节柱缓冲液的pH或者添加游离咪唑洗脱含多聚氨基酸序列的肽类。
虽然在变性条件下系统对于带6个组氨酸标签的蛋白质纯化有效,带3个组氨酸标签的蛋白质在生理条件下可有效纯化.然而带6个组氨酸标签的蛋白质可以在天然条件下,在低或高浓度盐的缓冲液中结合到Ni2+-NTA 基质上.结合后,目标蛋白可用0.8到250 mM咪唑梯度洗脱.低浓度的咪唑(如0.8 mM)可减少带有组氨酸的宿主蛋白质的非专一吸附.6个组氨酸标签的蛋白质可用20到250mM咪唑浓度范围洗脱. 使用咪唑的缺点是咪唑的存在经常导致蛋白质的聚集.另一种用于纯化多聚组氨酸标签蛋白质的材料是TALON.这由Co2+-羧甲基天冬氨酸(Co2+-CMA)组成,并偶联到固相的树脂上.TALON使得标签蛋白在温和条件下洗脱,已有报导与Ni2+-NTA树脂相比,其非特异性蛋白结合更少,从而达到更高的洗脱产物纯度.一种酶制剂通过SDS-PAGE鉴定的纯度高于95%.1.3 谷胱甘肽S-转移酶-标签1988年首次描述了融合有谷胱甘肽S-转移酶(GST)的多肽的一步纯化.来自日本血吸虫(schisto soma japonicum),26-kDa的 GST被克隆在大肠杆菌表达载体中.融合蛋白可从未经处理的裂解液中用固定化的谷胱甘肽亲和层析加以纯化.结合的融合蛋白在非变性条件下用10mM 还原型谷胱甘肽洗脱..GST标签可用酶学分析或免疫分析很方便的检测.标签有助于保护重组蛋白免受胞外蛋白酶的降解并提高其稳定性.在大多数情况下GST融合蛋白是完全或部分可溶的.推荐采用位点专一的蛋白酶如凝血酶或Xa因子从融合蛋白切除GST标签.蛋白酶解后,GST载体和蛋白酶通过谷胱甘肽琼脂糖亲和层析去除.GST标签可位于N端或C端,可用于细菌,酵母,哺乳细胞, 和杆状病毒感染的昆虫细胞. GST融合蛋白已成为分子生物学家的基本工具.1.4 Strep-标签(Strep-tag)Strep-标签是一氨基酸肽开发来用于在链球菌抗生物素蛋白(streptavidin)柱上亲和纯化相应的融合蛋白.链球菌抗生物素蛋白(streptavidin)在特定位点第44, 45, 和47位的突变体与天然形式相比,对八肽Strep-tag II的亲和力更强,.Strep标签的蛋白质在生理缓冲液条件下结合到生物素结合区域中,并可用生物素衍生物温和洗脱.洗脱时推荐使用2.5 mM脱硫生物素.基质可以用4-羟基-偶氮苯-2-羧酸再生,这种物质在溶液中呈黄色,当结合到基质上则呈红色.结合条件是非常专一的.生物素化的蛋白质如大肠杆菌的羧基载体蛋白可以结合,但生物素或者生物素化的蛋白质则用抗生物素封闭.纯化条件是多种多样的.螯合剂,温和性去污剂,还原型去污剂,和高达1M的盐可以加到缓冲液中. Strep-标签系统适合用于研究蛋白质之间的相互作用以及当那些大的标签或者带电荷的标签无效时的特殊用途.1.5 S-标签S-标签是个融合肽标签可以通过快速灵敏的均匀分析或者在Western blot中用比色法加以检测.该系统的基础是15个氨基酸残基的S-tag与103氨基酸残基的S-蛋白质之间的强烈相互作用,这两个都来自RNaseA.S-蛋白质/S-标签复合物的Kd接近0.1μM,这取决于pH,温度和离子强度.标签由4个带正电荷残基,3个负电荷残基,3个不带电的极性残基和5个非极性残基组成.这使S -标签保持可溶.S-标签的快速分析是基于核酸降解活力的恢复.标签蛋白可以结合到S蛋白质基质上.洗脱条件较苛刻,如pH2.0的缓冲液.然而为了获得有功能的蛋白质推荐用蛋白酶切割标签.该系统可用于纯化的重组蛋白质来源包括细菌,哺乳细胞和杆状病毒感染的昆虫细胞抽提物.该系统经常与第二标签联用.RNase酶A高度灵敏的荧光底物的发现使得该系统可用于与高通量筛选联用的检测.2. 融合蛋白的切割为了对目的蛋白进行生化及功能分析,通常要从目的蛋白上去除fusion tag部分。
融合蛋白标签之欧阳理创编

在蛋白质功能及结构研究过程中,研究的首要任务就是利用多种方法获得纯化的具有完整结构及生物学功能并能够正确折叠的高度纯化蛋白质。
除了蛋白质的研究,具有特定生物活性的高价值蛋白质的生产也需要对蛋白质产品进行纯化。
因此,科研人员和工业生产往往大量采用多种多样的表达系统来获得高表达的蛋白质,对其纯化后进行研究或加工,这些表达系统包括原核表达系统、酵母菌表达系统、昆虫动物细胞表达系统、真核细胞表如何将系统中表达的目标蛋白质与其他蛋白分离,一直是表达纯化中的一个重点。
为了克服从复杂样品中纯化单一蛋白质这种困难,科学家利用生物物质,特别是酶和抗体等蛋白质,具有识别某种特定物质并与该物质分子特异性结合的能力,利用生物分子间的这种特异性结合能力而形成的亲和纯化技术。
亲和标签纯化技术已广泛应用于蛋白质,特别是重组蛋白的分离纯化中。
在重组蛋白的亲和纯化中,利用基因工程技术,将经过改造优化的亲和标签与目标蛋白融合表达,通过一步简单快速的亲和层析,直接获得纯度较高的重组融合蛋白,已成为重组蛋白纯化的一个通用方法,具有结合特异性高、纯化步骤简便、纯化条件温和、适用性广泛等优点,为蛋白质的有效纯化提供了一条解决的途径,广泛应用于蛋白质结构与功能的研究及重组蛋白纯化工艺的开发中。
自从20世纪70年代中期融合标签技术出现以来,亲和标签已成为一种重组蛋白纯化十分有效的工具,具有结合特异性高、纯化条件温和、纯化步骤简便、适用性广泛等显著优势。
通常,亲和标签定义为对特定的生物或化学配基具有高度亲和力的一段氨基酸序列。
到目前为止,已经出现了种类众多、功能各异、用途多样的亲和标签,极大地促进了对重组蛋白的有效纯化。
根据自身分子量大小的不同,亲和标签可以分为两大类:一类是结合固定化配基的短肽标签,如His-tag、FLAG-tag、Strep-tagⅡ等;另一类是识别小分子配基的蛋白标签,如GST、MBP等。
短肽标签:His-tag:His标签是目前高通量蛋白纯化最普遍使用的亲和标签,广泛用于多种重组蛋白在各种表达系统的表达与纯化中。
收藏:几种常用的蛋白标签

收藏:⼏种常⽤的蛋⽩标签后台有同学在问看⽂献时遇到很多的标签蛋⽩,不知是啥。
其实,在我们研究某个蛋⽩的功能的时候,我们期待能够定位它或研究蛋⽩相互作⽤,有⼀种⽅法就是将⼀个通过各种⽅法可以检测到的标签蛋⽩的基因和⽬标蛋⽩的基因进⾏重组融合,那产⽣的融合蛋⽩除了⽬标蛋⽩本⾝,同时会带上可检测的标签蛋⽩,这样⽬标蛋⽩也被⼀并检测到,今天我们⼀起来盘点那些标签蛋⽩。
♣GST标签蛋⽩GST(⾕胱⽢肽巯基转移酶) 标签蛋⽩本⾝是⼀个在解毒过程中起重要作⽤的转移酶,天然⼤⼩为26KD。
应⽤于原核表达的原因有两个,⼀是因为它是⼀个⾼度可溶的蛋⽩,可以⽤来增加外源蛋⽩的可溶性;另⼀原因是它可以在⼤肠杆菌中⼤量表达,提⾼表达量。
GST融合表达系统⼴泛应⽤于各种融合蛋⽩的表达,可以在⼤肠杆菌和酵母菌等宿主细胞中表达。
结合的融合蛋⽩在⾮变性条件下⽤10mM 还原型⾕胱⽢肽洗脱。
在⼤多数情况下,融合蛋⽩在⽔溶液中是可溶的,并形成⼆体。
GST标签可⽤酶学分析或免疫分析很⽅便的检测。
标签有助于保护重组蛋⽩免受胞外蛋⽩酶的降解并提⾼其稳定性。
在⼤多数情况下GST融合蛋⽩是完全或部分可溶的。
纯化:该表达系统表达的GST标签蛋⽩可直接从细菌裂解液中利⽤含有还原型⾕胱⽢肽琼脂糖凝胶(Glutathionesepharose)亲和树脂进⾏纯化。
GST标签蛋⽩可在温和、⾮变性条件下洗脱,因此保留了蛋⽩的抗原性和⽣物活性。
GST在变性条件下会失去对⾕胱⽢肽树脂的结合能⼒,因此不能在纯化缓冲液中加⼊强变性剂如:盐酸胍或尿素等。
如果要去除GST融合部分,可⽤位点特异性蛋⽩酶切除。
检测:可⽤GST抗体或表达的⽬的蛋⽩特异性抗体检测。
♣His6标签蛋⽩His6标签蛋⽩是六个组氨酸残基组成的融合标签,可插⼊在⽬的蛋⽩的C末端或N末端。
当某⼀个标签的使⽤,⼀是能构成表位利于纯化和检测;⼆是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引⼒,可⽤于固定化⾦属螯合层析(IMAC),对重组蛋⽩进⾏分离纯化。
融合蛋白在生物学蛋白质学中的应用研究

融合蛋白在生物学蛋白质学中的应用研究随着科技的发展,生物学领域的研究也在不断地深入,其中研究蛋白质结构与功能的蛋白质学更是成为当前研究的热点。
而在蛋白质学中,融合蛋白作为一种重要的实验工具,在蛋白表达、纯化、结晶等领域起到了不可替代的重要作用。
一、融合蛋白的定义和分类融合蛋白,顾名思义,就是将需要研究的蛋白质和其他的蛋白质融合在一起,形成新的蛋白质。
一般来说,常用的融合蛋白包括标签蛋白、结合蛋白和胰岛素样生长因子等。
其中标签蛋白是融合蛋白中应用最为广泛的一种。
常见的标签蛋白包括His标签、GST标签和SUMO标签等。
而结合蛋白则是将需研究蛋白与可结合的蛋白融合在一起,以便于对目标蛋白进行纯化或者诱导其传递特定的信号。
胰岛素样生长因子则常用于将具有相似功能的蛋白进行融合研究。
二、融合蛋白在蛋白质表达中的应用蛋白质表达是研究蛋白质结构与功能的一个重要环节。
而融合蛋白在蛋白表达中的应用,主要有以下两点:1. 提高表达量:由于一些蛋白质在常规条件下难以表达、可溶性较差或者存在毒性等问题,因此需要寻找合适的表达载体和融合蛋白。
通过将需研究的蛋白与融合蛋白融合在一起,往往能够提高表达量,使得目标蛋白的表达达到可检测水平。
2. 方便纯化:传统的蛋白质纯化方法难以针对某些蛋白进行纯化,而利用融合蛋白能够方便密集地定位到目标蛋白,实现其固定和纯化。
三、融合蛋白在蛋白质结晶中的应用蛋白质结晶是蛋白质学中的另一个重要环节,而融合蛋白在蛋白结晶中的应用也相当重要。
蛋白质的结晶需求它会形成单晶,因此需要控制研究蛋白的溶解度及其稳定性。
而融合蛋白能够通过和研究蛋白相互作用,改变研究蛋白的pH值和离子力度,以便于将研究蛋白从过饱和溶液中提取出来,并促进其结晶。
四、融合蛋白在蛋白质相互作用研究中的应用蛋白质相互作用是生物学研究的核心,而融合蛋白实验的优越性在于其在研究相互作用中的应用。
常见的融合蛋白实验方法包括:酵母双杂交、GST pull-down、荧光共振能量转移(FRET)等。
蛋白标签的主要类型

蛋白标签的主要类型蛋白质标签是一种与蛋白质分子一起携带的辅助性分子或结构域,通常用于便于检测、纯化和定位蛋白质分子。
蛋白标签是现代生物学研究中不可或缺的工具,广泛应用于分子生物学、生物化学和细胞生物学实验中。
根据其来源和使用方式,蛋白质标签可以分为多种类型。
下面将详细介绍几种常见的蛋白标签。
1. 多组份亲和标签:多组份亲和标签使用两个或更多的蛋白质域通过特异性相互作用形成孪生标签或多组亲和纯化系统。
这些系统中的一个域会与感兴趣的蛋白质结合,而另一个域则与亲和基质相互结合。
这种标签使得蛋白质易于纯化和检测,通常可实现高效、高纯度的分离。
常见的多组份亲和标签有双链抗原标签(FLAG标签)、葡萄糖结合蛋白质(GB1标签)等。
2. 金属亲和标签:金属亲和标签利用特定金属离子(如镍、锌、铜、铅等)与蛋白质之间的高亲和力进行结合。
常用于纯化具有氨酰基肽酶(histidine-tag)的蛋白质。
这种标签通过将蛋白质与含有金属离子上的离子交换树脂或亲和树脂结合,实现对蛋白质的高效纯化。
3. 抗体标签:抗体标签通常是通过基因工程方法将表达目的蛋白质的编码序列与抗体的编码序列融合,从而在靶蛋白质上引入抗体的结构域。
抗体标签常用于原位免疫染色、免疫共沉淀、细胞表面标记及免疫检测等实验中。
常见的抗体标签有融合蛋白G(Fusion protein G)标签、融合蛋白A(Fusion protein A)标签等。
4. 绿色荧光蛋白(GFP):GFP是一种来源于发光水母的荧光蛋白质,广泛应用于蛋白质动态、亚细胞定位和蛋白质相互作用研究中。
研究者可以通过高效染色技术将GFP融合到感兴趣蛋白质的C端或N端,使得其可以在细胞中可视化。
GFP不仅可以用于研究单个蛋白质的空间位置和动态过程,还可以用于研究蛋白质的相互作用网络及其在细胞中的功能。
5. 结合蛋白亲和标签:结合蛋白亲和标签通常是指通过蛋白质与其特异结合蛋白的相互作用来实现对目标蛋白质的检测和纯化。
融合蛋白的标签

重组蛋白表达技术现已经广泛应用于生物学各个具体领域, 特别是体内功能研究和蛋白质的大规模生产都需要应用重组蛋白表达载体。
蛋白表达载体按照表达宿主的不同分为3类,分别为表达宿主为大肠杆菌,哺乳动物细胞的,以及慢病毒载体,宿主可以为哺乳动物细胞和原代细胞。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
除了必要的复制和筛选的元件,协助表达和翻译的元件外,本文将6个标签的功能初步介绍如下:(一) His 6His6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:1.标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;2.His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;3.His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;4.His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫制备抗体;5.可应用于多种表达系统,纯化的条件温和;6.可以和其它的亲和标签一起构建双亲和标签。
(二) FlagFlag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
Flag 作为标签蛋白,其融合表达目的蛋白后具有以下优点:1. Flag 作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究。
重组蛋白融合标签及对应的酶切酶

重组蛋白融合标签及对应的酶切酶一、概述重组蛋白是一种人工合成的蛋白质,通常用于生物技术和药物研发领域。
在研究和应用中,为了更好地研究和分析重组蛋白,通常需要在其N端或C端连接不同的标签,以便于对其进行纯化、检测和定位等操作。
而对于大多数重组蛋白而言,酶切酶是一个重要的工具,它可以通过切割特定的肽键来去除标签或实现蛋白质的精确裁剪。
重组蛋白融合标签及对应的酶切酶是重要的研究话题。
二、重组蛋白融合标签1. His标签His标签是一种常用的重组蛋白融合标签,它通常由6个组氨酸构成,其序列为His-His-His-His-His-His。
这种标签能够与金属离子亲和层析柱上的镍离子结合,便于对融合蛋白进行纯化。
常用的His标签融合蛋白包括His-tag、GST-His-tag等。
对应的酶切酶包括Thrombin、Enterokinase等,可以在需要的时候精确切割掉His标签。
2. FLAG标签FLAG标签是另一种常用的重组蛋白融合标签,它是一个八肽序列,其序列为DYKDDDDK。
FLAG标签常用于蛋白质检测和免疫印迹等分析中。
常用的FLAG标签融合蛋白包括pET21a-FLAG、CMV-FLAG等。
对应的酶切酶为Enterokinase等,可实现对FLAG标签的精确切割。
3. GFP标签GFP标签是一种表达在绿色荧光蛋白上的重组蛋白融合标签,其序列与GFP蛋白的序列相同,能够使融合蛋白在荧光显微镜下直接观察到。
常用的GFP标签融合蛋白包括pGFP、pGFP-V-RS等。
对应的酶切酶为Bgl II等。
4. HA标签HA标签是一种可溶酶敏感的蛋白质标签,其序列为YPYDVPDYA。
HA标签常用于蛋白质的免疫检测、纯化等。
对应的酶切酶为Enterokinase等。
5. Myc标签Myc标签是另一种常用的重组蛋白融合标签,其序列为EQKLISEEDL。
Myc标签常用于免疫印迹、免疫沉淀等研究中。
对应的酶切酶为Enterokinase等。
融合标签技术在蛋白质研究中的应用

融合标签技术在蛋白质研究中的应用摘要近年来,越来越多的科学家开始运用一种被称为融合标签的技术来研究蛋白质。
融合标签技术的快速发展给蛋白的快速纯化带来了福音。
本文主要介绍一些常用融合标签的原理、优缺点以及它们在蛋白质研究中的应用,并讨论了融合标签对蛋白研究产生的深远影响。
关键词蛋白质融合标签蛋白纯化前言蛋白质相互作用存在于每个细胞的新陈代谢过程中。
围绕着中心法则,我们可以发现,DNA复制、转录、逆转录、翻译等少不了蛋白质的参与,而且在细胞的信号转导,细胞死亡和凋亡等生命活动中,蛋白质的相互作用也都发挥了核心作用。
对蛋白质的研究,催生了结构生物学的蓬勃发展,而且,蛋白质相互作用的研究也成为了蛋白质研究不可或缺的一部分[1]。
利用蛋白质表达技术,快速、简便地进行有关活性代谢产物的高效表达而研究蛋白质生物学功能和理化性质成为一种很好的研究方法。
其中融合蛋白表达技术由于容易实现高效表达、纯化,兼有步骤简便、产物多以活性形式存在等优点,在蛋白质研究中得到了广泛的应用[2]。
蛋白融合即在蛋白序列上加上蛋白标签。
蛋白标签是指利用DNA重组技术与目的蛋白一起融合表达的一种多肽或蛋白质,以便于目的蛋白的表达、检测以及纯化[3]。
该技术的原理是通过基因操作技术,将目的基因片段与某些特定的蛋白标签串联,插入适当的载体中进行表达。
这些特定的基因因为带有标签,能够与特殊的介质进行亲和层析,使特定的蛋白能够纯化出来。
得到的融合蛋白还可以通过使用化学物质或者酶类的特定反应切除标签,从而得到纯化的目的蛋白,用于结晶或者特定功能研究。
常用的融合蛋白主要包括多聚组氨酸标记、硫氧还原蛋白、谷胱甘肽S-硫转移酶(GST)、融合了八个氨基酸的亲水性多肽、麦芽糖结合蛋白等。
根据其分子量大小,可将之分为两类:小的多肽标签,包括FLAG、His6(六聚组氨酸)、c-myc(人c-myc蛋白表位)、HA(流感病毒血凝素表面抗原决定簇)等;大的蛋白标签,包括SPA(葡萄球菌蛋白A)、GST(谷胱甘肽巯基转移酶)和GFP (绿色荧光蛋白)等。
蛋白融合pdi标签的用途

蛋白融合pdi标签的用途蛋白融合PDI标签的用途蛋白质折叠是生物学中一个重要的过程,它指的是蛋白质从线性氨基酸序列折叠成特定的三维结构的过程。
这个过程对于蛋白质功能的发挥非常重要,因为只有在正确的三维结构下,蛋白质才能发挥其生物学功能。
然而,蛋白质折叠的过程并不总是顺利进行,有时会出现错误的折叠或聚集,导致蛋白质失去功能或形成有害的聚集物。
为了解决这个问题,科学家们开发了一种蛋白质标签——蛋白质融合PDI标签,用于监测和促进蛋白质折叠的正确进行。
蛋白质融合PDI标签是一种蛋白质融合标签,其中PDI代表蛋白质二硫醇异构酶(protein disulfide isomerase)。
PDI是一种在内质网(endoplasmic reticulum,ER)中广泛存在的蛋白质,它在蛋白质折叠的过程中起着重要的作用。
蛋白质融合PDI标签利用了PDI的功能,将其与目标蛋白质融合,以监测和促进目标蛋白质的正确折叠。
蛋白质融合PDI标签的主要用途之一是在蛋白质表达和纯化过程中监测蛋白质折叠的质量。
蛋白质的折叠质量对于蛋白质的功能和稳定性至关重要,因此在表达和纯化过程中对折叠质量进行监测是必要的。
通过将PDI标签与目标蛋白质融合,可以利用PDI的二硫醇异构酶活性来检测目标蛋白质的折叠状态。
如果目标蛋白质折叠正确,PDI标签将保持在目标蛋白质上;而如果目标蛋白质折叠出现错误,PDI标签将与目标蛋白质分离。
通过监测PDI标签的状态,可以及时发现蛋白质折叠的问题,并采取相应的措施进行修复或改进。
除了在蛋白质表达和纯化中的应用,蛋白质融合PDI标签还可以用于研究蛋白质折叠的机制和调控。
蛋白质折叠是一个复杂的过程,涉及到许多分子和细胞机制的相互作用。
通过将PDI标签与不同的蛋白质融合,可以研究PDI在折叠过程中的作用和调控机制。
此外,还可以利用PDI标签来筛选和鉴定与蛋白质折叠有关的分子和药物,以及探索蛋白质折叠与疾病之间的关联。
融合蛋白标签名词解释

融合蛋白标签名词解释篇一融合蛋白标签这东西啊,就像是给蛋白穿上了一件有特殊标记的小衣服。
您想啊,在蛋白这个大家庭里,有各种各样的成员,它们都长得差不多,功能也各有不同。
这时候,要把其中一个特定的蛋白找出来,可不容易呢。
这就好比在一群穿着同样校服的孩子里,要找到你家那一个,是不是有点头疼?这融合蛋白标签啊,就解决了这个大难题。
那这标签是怎么来的呢?其实就是通过基因工程的魔法。
科学家们把编码标签的基因和目标蛋白的基因连接在一起,这样在细胞这个小工厂里生产蛋白的时候,就会产生一个带着标签的融合蛋白。
这个标签啊,可不是随便乱加的,它可有大用处。
比如说,有个叫His - tag的标签,它就像是蛋白身上的小磁铁。
这个小磁铁能干嘛呢?它可以和一种特殊的金属离子紧紧吸附。
在实验室里,科学家们就利用这个特性,把带着His - tag的融合蛋白从一堆蛋白混合物里轻松地拉出来。
就好像你在一堆小铁珠子和塑料珠子里,用一块大磁铁把铁珠子都吸出来一样简单。
这样一来,科学家们就得到了他们想要研究的那个特定的蛋白,干净又纯粹。
还有个叫GST - tag的标签,这个标签像是蛋白的保镖。
为什么这么说呢?因为GST - tag本身是一种酶,它比较稳定。
当它和目标蛋白融合在一起的时候,就像给目标蛋白找了个强壮的保镖。
这个保镖带着目标蛋白在细胞这个复杂的环境里闯荡,能让目标蛋白不容易被细胞里那些调皮捣蛋的酶给分解掉。
这就好比你在一个乱糟糟的集市里,有个强壮的大汉陪着你,那些小混混就不敢轻易来招惹你了。
这些融合蛋白标签啊,还能帮助科学家们研究蛋白的功能呢。
你想啊,如果没有这个标签,蛋白就像一个没有名字的小幽灵,在细胞里飘来飘去,你都不知道它在干嘛。
但是有了标签之后,就像给这个小幽灵挂上了一个小铃铛,它走到哪儿,做了什么,科学家们都能通过检测标签的信号来知道。
比如说,研究蛋白在细胞里的定位的时候,有个荧光蛋白标签,像GFP - tag,这个标签会发出绿色的荧光。
融合蛋白标签

在蛋白质功能及结构研究过程中,研究的首要任务就是利用多种方法获得纯化的具有完整结构及生物学功能并能够正确折叠的高度纯化蛋白质。
除了蛋白质的研究,具有特定生物活性的高价值蛋白质的生产也需要对蛋白质产品进行纯化。
因此,科研人员和工业生产往往大量采用多种多样的表达系统来获得高表达的蛋白质,对其纯化后进行研究或加工,这些表达系统包括原核表达系统、酵母菌表达系统、昆虫动物细胞表达系统、真核细胞表达系统等。
如何将系统中表达的目标蛋白质与其他蛋白分离,一直是表达纯化中的一个重点。
为了克服从复杂样品中纯化单一蛋白质这种困难,科学家利用生物物质,特别是酶和抗体等蛋白质,具有识别某种特定物质并与该物质分子特异性结合的能力,利用生物分子间的这种特异性结合能力而形成的亲和纯化技术。
亲和标签纯化技术已广泛应用于蛋白质,特别是重组蛋白的分离纯化中。
在重组蛋白的亲和纯化中,利用基因工程技术,将经过改造优化的亲和标签与目标蛋白融合表达,通过一步简单快速的亲和层析,直接获得纯度较高的重组融合蛋白,已成为重组蛋白纯化的一个通用方法,具有结合特异性高、纯化步骤简便、纯化条件温和、适用性广泛等优点,为蛋白质的有效纯化提供了一条解决的途径,广泛应用于蛋白质结构与功能的研究及重组蛋白纯化工艺的开发中。
自从20世纪70年代中期融合标签技术出现以来,亲和标签已成为一种重组蛋白纯化十分有效的工具,具有结合特异性高、纯化条件温和、纯化步骤简便、适用性广泛等显著优势。
通常,亲和标签定义为对特定的生物或化学配基具有高度亲和力的一段氨基酸序列。
到目前为止,已经出现了种类众多、功能各异、用途多样的亲和标签,极大地促进了对重组蛋白的有效纯化。
根据自身分子量大小的不同,亲和标签可以分为两大类:一类是结合固定化配基的短肽标签,如His-tag、FLAG-tag、Strep-tagⅡ等;另一类是识别小分子配基的蛋白标签,如GST、MBP等。
短肽标签:His-tag:His标签是目前高通量蛋白纯化最普遍使用的亲和标签,广泛用于多种重组蛋白在各种表达系统的表达与纯化中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重组蛋白表达技术现已经广泛应用于生物学各个具体领域, 特别是体内功能研究和蛋白质的大规模生产都需要应用重组蛋白表达载体。
蛋白表达载体按照表达宿主的不同分为 3 类,分别为表达宿主为大肠杆菌,哺乳动物细胞的,以及慢病毒载体,宿主可以为哺乳动物细胞和原代细胞。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
除了必要的复制和筛选的元件,协助表达和翻译的元件外,本文将6 个标签的功能初步介绍如下:(一) His 6His6 是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的 C 末端或N 末端。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC) ,对重组蛋白进行分离纯化。
使用His-tag 有下面优点:1. 标签的分子量小,只有~0.84KD ,而GST 和蛋白A 分别为~26KD 和~30KD ,一般不影响目标蛋白的功能;2. H is 标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;3. H is 标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA 相互作用研究;4. H is 标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫制备抗体;5. 可应用于多种表达系统,纯化的条件温和;6. 可以和其它的亲和标签一起构建双亲和标签。
(二) FlagFlag 标签蛋白为编码8 个氨基酸的亲水性多肽(DYKDDDDK ),同时载体中构建的Kozak 序列使得带有FLAG 的融合蛋白在真核表达系统中表达效率更高。
Flag 作为标签蛋白,其融合表达目的蛋白后具有以下优点:1. Flag 作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究。
2. 融合Flag 的目的蛋白,可以直接通过Flag 进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高。
3. Flag 作为标签蛋白,其可以被抗Flag 的抗体识别,这样就方便通过Western Blot 、ELISA 等方法对含有Flag 的融合蛋白进行检测、鉴定。
4. 融合在N 端的Flag ,其可以被肠激酶切除(DDDK ),从而得到特异的目的蛋白。
因此现Flag 标签已广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域。
(三) MBPMBP(麦芽糖结合蛋白)标签蛋白大小为40kDa ,由大肠杆菌K12 的malE 基因编码。
MBP 可增加在细菌中过量表达的融合蛋白的溶解性,尤其是真核蛋白。
MBP 标签可通过免疫分析很方便地检测。
有必要用位点专一的蛋白酶切割标签。
如果蛋白在细菌中表达,MBP 可以融合在蛋白的N 端或C 端。
纯化:融合蛋白可通过交联淀粉亲和层析一步纯化。
结合的融合蛋白可用10mM 麦芽糖在生理缓冲液中进行洗脱。
结合亲和力在微摩尔范围。
一些融合蛋白在0.2% Triton X-100 或0.25% Tween 20 存在下不能有效结合,而其他融合蛋白则不受影响。
缓冲条件为pH7.0 到8.5 ,盐浓度可高达1M ,但不能使用变性剂。
如果要去除MBP 融合部分,可用位点特异性蛋白酶切除。
检测:可用MBP 抗体或表达的目的蛋白特异性抗体检测。
(四) GSTGST( 谷胱甘肽巯基转移酶) 标签蛋白本身是一个在解毒过程中起到重要作用的转移酶,它的天然大小为26KD 。
将它应用在原核表达的原因大致有两个,一个是因为它是一个高度可溶的蛋白,希望可以利用它增加外源蛋白的可溶性;另一个是它可以在大肠杆菌中大量表达,起到提高表达量的作用。
GST 融合表达系统广泛应用于各种融合蛋白的表达,可以在大肠杆菌和酵母菌等宿主细胞中表达。
结合的融合蛋白在非变性条件下用10mM 还原型谷胱甘肽洗脱。
在大多数情况下,融合蛋白在水溶液中是可溶的,并形成二体。
GST 标签可用酶学分析或免疫分析很方便的检测。
标签有助于保护重组蛋白免受胞外蛋白酶的降解并提高其稳定性。
在大多数情况下GST 融合蛋白是完全或部分可溶的。
GST 标签蛋白可直接从细菌裂解液中利用含有还原型谷胱甘肽琼脂糖凝胶(Glutathionesepharose) 亲和树脂进行纯化。
GST 标签蛋白可在温和、非变性条件下洗脱,因此保留了蛋白的抗原性和生物活性。
GST 在变性条件下会失去对谷胱甘肽树脂的结合能力,因此不能在纯化缓冲液中加入强变性剂如:盐酸胍或尿素等。
如果要去除GST 融合部分,可用位点特异性蛋白酶切除。
可用GST 抗体或表达的目的蛋白特异性抗体检测。
(五) HAHA 标签蛋白,标签序列YPYDVPDYA ,源于流感病毒的红细胞凝集素表面抗原决定簇,9 个氨基酸,对外源靶蛋白的空间结构影响小, 容易构建成标签蛋白融合到N 端或者 C 端。
易于用Anti-HA 抗体检测和ELISA 检测。
(六) c-MycC-Myc 标签蛋白,是一个含11 个氨基酸的小标签,标签序列QQKLISEEDL, 这11 个氨基酸作为抗原表位表达在不同的蛋白质框架中仍可识别其相应抗体。
C-Myc tag 已成功应用在Western-blot 杂交技术、免疫沉淀和流式细胞计量术中, 可用于检测重组蛋白质在靶细胞中的表达。
(七)荧光蛋白标签eGFP/eCFP/eYFP/mCherr 分别是增强型绿色荧光蛋白/增强型青色荧光蛋白/增强型黄色荧光蛋白/单体红色荧光蛋白,具有不同的激发波长发射波长为,均由野生型荧光蛋白通过氨基酸突变和密码子优化而来。
就eGFP 而言,相对于GFP ,其荧光强度更强、荧光性质更稳定。
同时载体中构建的Kozak 序列使得含有eGFP 的融合蛋白在真核表达系统中表达效率更高。
mCherry 是从DsRed 演化来的性能最好的一个单体红色荧光蛋白,可以和GFP 系列荧光蛋白共用,实现多色标记体内、外实验表明,mCherry 在N 端和C 端融合外源蛋白时,荧光蛋白活性和被融合的目标蛋白功能相互没有明显影响。
这些荧光标签蛋白,其融合表达目的蛋白后具有以下优点:1. 不用破碎组织细胞和不加任何底物,直接通过荧光显微镜就能在活细胞中发出绿色荧光,实时显示目的基因的表达情况,而且荧光性质稳定,被誉为活细胞探针。
2. 其自发荧光,不需用目的基因的抗体或原位杂交技术就可推知目的基因在细胞中的定位等情况。
3. 同时细胞内的其它产物不会干扰标签蛋白检测,从而使其检测更显得快速、简便、灵敏度高而且重现性。
4. 其低消耗、高灵敏度检测,十分适用于高通量的药物筛选。
因此现eGFP 表达标签被广泛地应用于基团表达调控、转基因功能研究、蛋白在细胞中的功能定位、迁移变化及药物筛选等方面。
5. m Cherry 红色荧光蛋白在标记病毒颗粒,研究病毒和宿主细胞之间更有得天独厚的优势。
如用mRFP 或mCherry 标记HIV 病毒颗粒,研究H1V 和宿主细胞问的相互作用以及HIV 侵染宿主细胞的过程.用mRFP 标记慢病毒颗粒,研究慢病毒在小鼠体内的复制过程等。
(八) 荧光素酶来源于生物体内的荧光素,常见的有萤火虫荧光素酶、海肾荧光素酶和Guassia 荧光素酶。
这些荧光素酶作为“报告蛋白”被用于分子生物学研究中,这种技术被称为报告基因检测法或萤光素酶检测法(Luciferase Assay )。
跟普通融合蛋白标签不同,使用荧光素酶构建的报告基因可用作目的基因的定量分析。
因此常用于研究启动子、miRNA 3'UTR 克隆的功能与调控,因为它们对目的基因的调控可以是渐变的,而不是简单的开和关两种状态。
优点:灵敏度高,检测幅度宽;不是哺乳动物细胞内源性基因;重复性好;与HTS 兼容等。
萤火虫和海肾荧光素酶已经被广泛应用于协同报告并进行均一化研究。
由于它们都是快速,容易和高灵敏的监测方法。
而且萤火虫和海肾荧光素酶是理想的双基因报告系统,因为它们来源于不同的生物进化方向,蛋白结构和底物差异都很大,在实验中不会产生相互影响。
(九) Avi TagAviTag 标签蛋白是一个15 个氨基酸的短肽,具有一个单生物素化赖氨酸位点,与已知天然可生物素化序列完全不同,可以加在目标蛋白的N 端和C 端。
融合表达后,可被生物素连接酶生物素化,为了纯化重组蛋白选用低亲和性的单体抗生物素蛋白或抗生物素蛋白衍生物,除了用于蛋白质分离纯化,还用于蛋白质相互作用研究。
(生物素化,biotinylation 是指将生物素共价连接到蛋白质、核酸或其它分子上的过程。
由于生物素的分子量不大(分子量为244.31 ),生物素化反应快速、高效且不易被干扰。
生物素化的分子能通过生物素与链霉亲和素、亲和素互作,且不受高热、pH 、蛋白酶解的影响。
生物素与链霉亲和素、亲和素的结合特异且高效,因此这一互作在生物技术的许多领域有着广泛的应用。
另外,多个生物素化分子可以发生交联来形成个科研人员感兴趣的蛋白,同时允许和多个链霉亲和素、亲和素、中性亲和素蛋白结合,增加了对此蛋白的检测灵敏度。
)Avi Tag 标签系统具有以下几大优点:1. 无论在体外或者体内,几乎所有的蛋白都可以在一个独特的Avi Tag 位点轻易且有效地被生物素化;2. 生物素化是通过酶和底物的反应来实现,反应条件相当温和而且标记的专一性极高;3. 生物素AviTag 只有15 个氨基酸,对蛋白空间结构的影响非常小。
(十) SNAP-TagSNAP-Tag 是新一代的蛋白标签技术,不仅专一性极高而且稳定,最大的优点是适用于多种环境下的蛋白质检测与纯化,如活细胞内、溶液中、或固态相(如SDS-PAGE gels) 等。
SNAP-Tag 是从人的O6- 甲基鸟嘌呤-DNA 甲基转移(O6-alkylguanine-DNA-alkyltransferase )获得。
无论体内还是体外,SNAP-Tag 都能与底物高特异性地共价结合,使蛋白标记上生物素或荧光基团(如荧光素和若丹明)。
SNAP 所带的活性巯基位点接受了苯甲基鸟嘌呤所携带的侧链苯甲基基团,释放出了鸟嘌呤。
这种新的硫醚键共价结合使SNAP 所带的目的蛋白携带上了苯甲基基团所带的标记物。
苯甲基鸟嘌呤在生化条件下稳定,并且没有其他蛋白会和这类物质作用,所以SNAP 标签反应是高特异的。
生物素或各种颜色荧光的底物(如荧光素、若丹明)可渗透进入细胞,方便快捷地进行活细胞内SNAP-Tag 融合蛋白的标记与检测。
它们也可特异性地标记大肠杆菌,酵母和哺乳动物等细胞抽提液或已经纯化的蛋白液中的SNAP-tag 融合蛋白。
