高一化学氮及其化合物思维导图
课件3:5.2.1 氮气和氮氧化物

知识导图
本节内容结束
更多精彩内容请登录:
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
经典例题
【例7】四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒立于盛有水的水槽中,
充分放置后的现象如图所示。其中原试管充满NO2的是( B )
经典例题
【例8】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和 NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A 中余下气体的体积为0.5a mL。 (1)将A倒插入B槽中发生反应的化学方程式为__3_N__O_2_+_H_2_O_=__=_=_2_H_N__O_3_+_N_O___, 该反应中氧化剂与还原剂的质量比为__1_∶__2__,原混合气体中NO2和NO的物质的量之比为__3_∶__1___。 (2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是 _无_色__气__体__变__为__红_棕__色__,__试__管__中__液_面__不__断__上__升__至__全_充__满__。__继__续__通__入_氧__气__后__,__试__管__中_液__面__下。降,最后充满无色气体 (3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为
A.NO2、N2 C.NO2、CO2
B.NO、CO2 D.NO、CO2、N2
经典例题
【例5】某化学学习小组为探究NO2和SO2的反应,特进行如下实验(如下图所示)。
(1)图1两集气瓶中___下_____(填“上”或“下”)瓶颜色深。 (2)图2中反应的现象是__两__气__体__混__合__后__,__颜__色__消__失_________。 (3)图3中“有红棕色气体产生”说明NO2和SO2反应的产物中有_N__O_,NO2在该反应中显__氧__化___性。 (4)由图2和图3中的现象写出NO2和SO2反应的化学方程式:__N_O__2_+__S_O_2_=_=__=_N__O__+_S_O__3_____。
氮的知识点总结
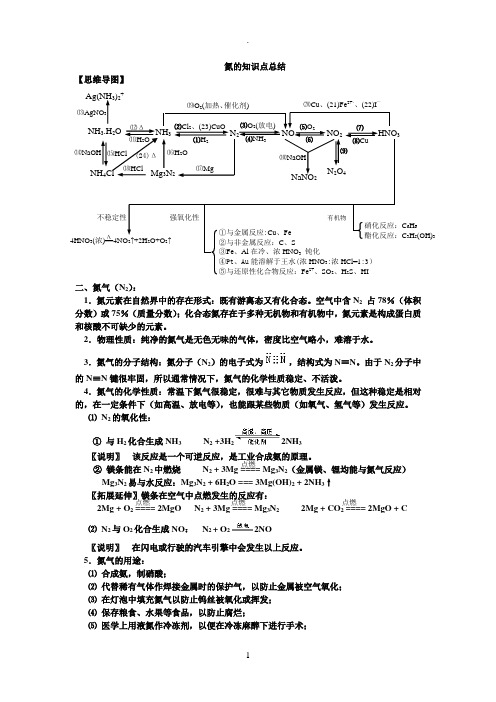
氮的知识点总结【思维导图】二、氮气(N 2):1.氮元素在自然界中的存在形式:既有游离态又有化合态。
空气中含N 2 占78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素。
2.物理性质:纯净的氮气是无色无味的气体,密度比空气略小,难溶于水。
3.氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N 。
由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
4.氮气的化学性质:常温下氮气很稳定,很难与其它物质发生反应,但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
⑴ N 2的氧化性:① 与H 2化合生成NH 3 N 2 +3H 22NH 3〖说明〗 该反应是一个可逆反应,是工业合成氨的原理。
② 镁条能在N 2中燃烧 N 2 + 3Mg ==== Mg 3N 2(金属镁、锂均能与氮气反应)Mg 3N 2易与水反应:Mg 3N 2 + 6H 2O === 3Mg(OH)2 + 2NH 3↑〖拓展延伸〗镁条在空气中点燃发生的反应有: 2Mg + O 2 ==== 2MgO N 2 + 3Mg ==== Mg 3N 2 2Mg + CO 2 ==== 2MgO + C ⑵ N 2与O 2化合生成NO : N 2 + O 22NO〖说明〗 在闪电或行驶的汽车引擎中会发生以上反应。
5.氮气的用途:⑴ 合成氨,制硝酸;⑵ 代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑶ 在灯泡中填充氮气以防止钨丝被氧化或挥发;⑷ 保存粮食、水果等食品,以防止腐烂;⑸ 医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⒆O 2(加热、催化剂) 4HNO 3(浓)==4NO 2↑+2H 2O+O 2↑ 强氧化性 不稳定性 HNO 3 NaNO 2 ⑽NaOH ⒄Mg N 2O 4 ⒃H 2O NH 3.H 2O NH 3 N 2 NO NO 2 Ag(NH 3)2+ NH 4Cl ⒀AgNO 3 ⒁NaOH ⒂HCl ⑿Δ ⑾H 2O Mg 3N 2 ⑵Cl 2、(23)CuO ⑴H 2 ⑶O 2(放电) ⑷NH 3 ⑸O 2 ⑹ ⑺ ⑻Cu ⒅HCl ⒇Cu 、(21)Fe 2+、、(22)I — ①与金属反应:Cu 、Fe ②与非金属反应:C 、S ③Fe 、Al 在冷、浓HNO 3 钝化④Pt 、Au 能溶解于王水(浓HNO 3:浓HCl=1:3) ⑤与还原性化合物反应:Fe 2+、SO 2、H 2S 、HI 有机物 硝化反应:C 6H 6 酯化反应:C 3H 5(OH)3 ⑼ Δ (24)Δ 点燃 点燃 点燃 点燃⑹ 利用液氮制造低温环境,使某些超导材料获得超导性能。
高中化学全套思维导图(高清版)

高中化学全套思维导图(高清版)第一章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第三章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第四章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第五章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第六章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第七章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第八章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第九章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十一章:物质的量与物质的量浓度1. 物质的量物质的量的定义:摩尔物质的量的计算:摩尔质量、物质的量浓度2. 摩尔体积摩尔体积的定义:摩尔体积摩尔体积的计算:气体摩尔体积、液体摩尔体积、固体摩尔体积第十二章:化学反应速率与化学平衡1. 化学反应速率化学反应速率的定义:速率影响化学反应速率的因素:温度、浓度、催化剂、表面积2. 化学平衡化学平衡的定义:平衡状态化学平衡的建立:平衡常数、平衡反应物和物的浓度第十三章:氧化还原反应与电化学1. 氧化还原反应氧化还原反应的定义:氧化剂、还原剂氧化还原反应的类型:单一置换反应、复分解反应、合成反应、分解反应2. 电化学电化学的定义:电流、电极电化学反应:原电池、电解池第十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十九章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二十章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第二十一章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第二十二章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第二十三章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第二十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第二十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第二十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第二十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第二十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用。
高中化学全套思维导图(高清版)

2020-2-269:09:5【老师】俸・KH 高中化経套思“.版).pdf (18.11MB )髙中化学全套思谁导图(高清版),pdf}来目群文件打开打开文骸 转发三1【老师】俸自己没有思维导图的可以借鉴。
1 /43高中化学 第一章 从实验学化学第一节化学实验基础知识取用固体取用液体防火与灭火常见危险与安全措施了解实验安全常识及意外事故处理方法学法指导操作的先后顺序 操作的注意事项 操作的目的 适用范围化学与人类健康 不溶性固体与液体的分萬 实验安全化学与环境保护分离溶于溶液中的固体溶质适用范围1 .蒸发过程不断搅拌I 注意事项蒸发是否易潮解.物质的提纯是将混合物中的少 量杂质除去而得到纯净物质将物质的分 萬与提纯混淆吸取少量液体用滴管 (专用,垂直悬滴,不倒置)实验基本操作物质分离提 纯必须遵循注意防火、防爆炸、防倒吸不増、不减、易分离、易复原2.当大量固体析岀时,停止加热,余热蒸干知识 梳理 化学实解通过动手实验,熟练掌握常用化学 仪器的使用方法和操作注意事项 较多液体用倾倒法 (瓶塞倒放,标签向手心,抓住物质的特性寻找突破口物质检验和实验综合题块状固体用锻子 粉末状用药匙中及故取用药 品的仪器的意的热覗分离 仪器热源,温度可达400 - 500 r酒劈/龜精不超过2/3,不少于1/4,用外 / 5,不对火,不吹灯,先灭后添酒精喷灯温度可达I 000 X ) 水浴漏斗loop 以下 普通漏斗长颈漏斗分液 漏斗主要 用途萃取,分液, 反应加液体用器常仪冷凝管 洗气瓶于燥管注意事项用前先检査是否漏液, 分液时上层液体从上口倒岀,下层液体从下层放出,放液时应打开分液漏斗上玻璃塞或将塞 上的凹槽对准上口小孔。
使漏斗内外大气压相等反应器1 是否易被氧化 是否易燃、易爆 是否易与空W 中某些成分作用 是否易挥发、,1 尹华 是否具有毒性、 腐蚀度便于取用 防止变质 防独、防爆等 细口瓶、产口瓶、 通瓶 塑料瓶、赢r 笑是器等剂质试性则原仪器据依学剂保化试的存密封:水封、 油封、蜡封方式/开放式存放阴凉、避光处(干燥器中存放利用沸点不同,除去难挥发和不挥发的杂质适用范围1.蒸憎烧瓶加热要垫石棉网,温度、 计的水银球与支管口下缘位于同一水平线注意事项2.冷水是下口进,上口出3.要加碎瓷片,防暴沸在互不相溶的溶剂里溶解度差别较大的溶质适用范围1 .溶液总量不超过漏斗容积的3/4 2.把分液漏斗放在铁架台上静置、分层注意事项蒸饌分液3.打开塞子,先从下口放出下层 液体,再从上口倒出上层液体其他基本 操作计量仪器玻璃仪器的洗涤药品的取用药品的保存 装置气密性检验溶液的配勉气体的收集和体积的测量量筒试管、柑垠、隔网可加热或液浴烧杯、烧瓶、 蒸憎烧瓶、锥形瓶 乂_不能加热集气瓶、试剂瓶、滴瓶、 启普发生器主要用途粗略量取液体,精度0.1 mL刻度由下而上增大,无0刻度线, 读数平视。
新人教版高中化学高一化学必修二知识点思维导图

高一化学必修 第二册化工生产中的重要非金属元素硫及其化合物氮及其化合物无机非金属材料硫二氧化硫硫酸不同价态含硫物质的转化硫元素位于元素周期表的第三周期第VIA族硫黄为黄色晶体,难溶于水,微溶于酒精,易溶于二硫化碳具有氧化性、还原性二氧化硫为无色气体,有刺激性气味的有毒气体,密度比空气大易溶于水,其水溶液显酸性二氧化硫具有漂白作用,但生成的化合物不稳定工业上常用二氧化硫来漂白纸浆,毛,丝等,此外,也可用于杀菌消毒,还有一种食品添加剂硫酸是重要的化工原料,可用于生产化肥,农药,炸药,染料和盐类等稀硫酸浓硫酸常见的硫酸盐硫酸根离子检验具有酸的通性溶于水完全电离可与酸碱指示剂作用可以活泼金属碱、碱性氧化物及其盐反应吸水性:能够吸收气体、液体中的水分,故常作干燥剂脱水性:能把有机物中的氢元素和氧元素按水的组成比脱去强氧化性与金属反应与非金属反应(加热)常温下能使铁,铝发生钝化硫酸钙,硫酸钡,硫酸铜硫酸根离子和钡离子反应生成不溶于稀盐酸的白色硫酸钡沉淀通过氧化还原反应可实现不同价态含硫物质的互相转化利用氧化剂,可将硫元素从低价态转化到高价态利用还原剂,可将硫元素从高价态转化到低价态氮气氮的固定一氧化氮二氧化氮氨铵盐硝酸酸雨及防治无色无味,难溶于水的气体化学性质不活泼,通常情况下难以与其他物质发生化学反应具有还原性和氧化性含义:将大气中游离态的氮转化为氮的化合物的过程自然固氮:如豆科植物的根瘤固氮,雷电作用人工固氮:如工业合成氨无色无味有毒性气体,且不溶于水一氧化氮不能和碱反应,是不成盐氧化物,不是酸性氧化物一氧化氮和氧气反应生成二氧化氮是红棕色有刺激性气味的有毒气体,易溶于水和碱反应生成硝酸根离子和亚硝酸根离子,不是酸性氧化物和水反应生成硝酸和一氧化氮无色有刺激性气味的气体,密度比空气小,易液化极易溶于水'且与水的水溶液呈碱性浓盐酸与氨反应生成氯化氨晶体;氨的催化氧化是工业制硝酸的基础氨气和二氧化碳在催化剂加热的条件下生成一氧化氮和水氯化铵和氢氧化钙在加热的条件下生成氨气和氯化钙和水湿润的红色石蕊试纸→变蓝氨盐在碱和加热的条件下生成氨气浓盐酸→白烟硝酸是无色,易挥发,有刺激性气味的液体酸性:在水中能电离不稳定性:浓硝酸见光或受热会分解产生二氧化氮是大气中的氮氧化物与硫氧化物以及他们在大气中发生反应后的生成物溶于雨水形成的直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀防治强氧化性铜与稀硝酸反应生成硝酸铜和一氧化氮和水铜与浓硝酸反应生成硝酸铜和二氧化氮和水浓硝酸与炭在加热的条件下生成二氧化氮和二氧化碳和水调整能源结构,发展清洁能源研究煤的脱硫技术,减少二氧化碳和氮氧化物的排放加强工厂废气的回收处理改进汽车尾气的处理技术,控制尾气排放铵盐是无色或白色的晶体,绝大多数易溶于水;农业上常用做化肥,如硫酸铵,碳酸氢铵,硝酸铵等;氯化铵受热分解生成氨气和氯化氢;氯化氨溶液与氢氧化钠溶液共热生成氨气和水和氯化钠硅酸盐材料新型无机非金属材料硅:高纯硅广泛用于信息技术和新能源技术等领域,以及光伏电站、人造卫星、硅太阳能电池二氧化硅:可用来生产光导纤维新型陶瓷:不再限于传统的硅酸盐体系,在光学,热学,电学,磁学等方面具有很多新的特性和功能碳纳米材料:主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广泛的应用前景第五章 化工生产中的重要非金属元素化学反应与能量化学能与热能在任何的化学反应中总伴有能量的变化当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量主要原因一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小E反应物总能量 > E生成物总能量,为放热反应;E反应物总能量 < E生成物总能量,为吸热反应常见的放热反应和吸热反应常见的放热反应所有的燃烧与缓慢氧化酸碱中和反应金属与酸反应制取氢气大多数化合反应特殊:C+CO₂=加热=2CO是吸热反应常见的吸热反应以C、H₂、CO为还原剂的氧化还原反应C(s)+H₂O(g)=加热=CO(g)+ H₂(g)铵盐和碱的反应Ba(OH)₂·8H₂O+NH₄Cl=BaCl₂+2NH₃↑+10H₂O大多数分解反应KClO₃、KMnO₄、CaCO₃的分解等能源的分类一次能源常规能源可再生资源不可再生资源新能源可再生资源不可再生资源二次能源一次能源经过加工、转化得到的能源称为二次能源电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等化学能与电能化学能转化为电能的方式火力发电化学能→热能→机械能→电能缺点:环境污染、低效原电池将化学能直接转化为电能优点:清洁、高效原电池原理概念把化学能直接转化为电能的装置叫做原电池原电池的工作原理通过氧化还原反应(有电子的转移)把化学能转变为电能构成原电池的条件电极为导体且活泼性不同两个电极接触(导线连接或直接接触)两个相互连接的电极插入电解质溶液构成闭合回路电极名称及发生的反应负极较活泼的金属作负极,负极发生氢化反应电极反应式:较活泼金属-ne⁻=金属阳离子负极现象正极较不活泼的金属或石墨作正极,正极发生还愿反应电极反应式:溶液中阳离子+ne⁻=单质正极的现象:一般有气体放出或正极质量增加原电池正负极的判断方法依据原电池两极的材料较活泼的金属作负极(K,Ca,Na太活泼,不能作电极)较不活泼金属或可导电非金属(石墨)、氧化物(MnO₂)等作正极根据电流方向或电子流向(外电路)的电流由正极流向负极电子则由负极经外电路流向原电池的正极根据内电路离子的迁移方向阳离子流向原电池正极,阴离子流向原电池负极根据原电池中的反应类型负极正极原电池电极反应的书写方法原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应①写出总反应方程式②把总反应根据电子得失情况,分成氧化反应、还原反应③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应原电池的应用原电池的总反应式一般把正极和负极反应式相加而得加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快比较金属活动性强弱设计原电池金属的腐蚀化学电源基本类型干电池活泼金属作负极,被腐蚀或消耗充电电池燃料电池两极都参加反应的原电池,可充电循环使用两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应水能、风能、生物质能煤、石油、天然气等化石能源太阳能、风能、地热能、潮汐能、氢能、沼气核能失电子,发生氧化反应,现象通常是电极本身消耗,质量减小得电子,发生还原反应,现象是常伴随金属的析出或H₂的放出负极溶解,负极质量减少第六章 化学反应与能量化学反应与能量化学反应的速率和限度化学反应的速率概念化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示计算公式v(B)=|Δc(B)|/Δt=|Δn(B)|/V·Δt单位mol/(L·s)或mol/(L·min)B为溶液或气体,若B为固体或纯液体不计算速率以上所表示的是平均速率,而不是瞬时速率重要规律速率比=方程式系数比变化量比=方程式系数比影响化学反应速率的因素内因由参加反应的物质的结构和性质决定的(主要因素)外因温度:升高温度,增大速率催化剂:一般加快反应速率(正催化剂)浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)压强:增大压强,增大速率(适用于有气体参加的反应)其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、 原电池等也会改变化学反应速率化学反应的限度——化学平衡基本情况在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态影响因素可逆反应温度、反应物浓度、压强等催化剂只改变化学反应速率,对化学平衡无影响在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应通常把由反应物向生成物进行的反应叫做正反应;而由生成物向反应物进行的反应叫做逆反应在任何可逆反应中,正方应进行的同时,逆反应也在进行可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0特征逆:化学平衡研究的对象是可逆反应动:动态平衡,达到平衡状态时,正逆反应仍在不断进行等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。
有机化学第四版(董先明)思维导图 含氮化合物

第十章含氮化合物10.1 硝基化合物分类和命名结构硝基的两个氮氧键的长度是一样的,两个氧各提供一个电子,氮提供两个电子,形成四电子三原子的p-π共轭体系性质物理性质相对密度都大于1不溶于水,溶于有机溶剂和浓硫酸多数硝基化合物受热易分解发生爆炸有的多硝基化合物具有芳香气味化学性质还原反应将脂肪族硝基化合物催化加氢或用四氢铝锂、金属(Fe、Sn、Zn)与HCl还原,硝基可被还原为氨基芳香族硝基化合物还原是制备苯胺的重要方法脂肪族硝基化合物的酸性脂肪族一级、二级硝基化合物具有酸性,三级化合物不具有α-H故没有酸性硝基对芳环上邻、对位基团的影响使苯环上的亲电取代反应较难进行使邻、对位存在的取代基反应活性增加,很容易发生水解、氨解等反应。
对酚的酸性的影响苯环上硝基越多,酚的酸性越强10.3 酰胺分类命名结构氮上的孤对电子与碳氧双键形成共轭体系C-N有一定的双键性子,不易自由旋转虽然有氨基,但在水溶液中近于中性性质物理常温下,除甲酰胺是液体其他多为白色晶体酰胺分子能形成分子间氢键,熔沸点比相对分子质量相近的羧酸高低级酰胺易溶于水,芳香族酰胺难溶或微溶于水化学酸碱性由于形成共轭体系,碱性减弱,近乎中性二元羧酸的亚酰胺受到两个羰基的影响,酸性大大增强,可以与强碱形成盐霍夫曼降解反应用溴的碱性溶液与具有伯氨基的酰胺反应,酰胺失去羰基生成少一个碳的伯胺碳酸酰胺碳酸分子中一个羟基被氨基取代的酰胺称为氨基甲酸,两个羟基都被取代为尿素氨基甲酸酯。
很不稳定,一般情况下,立即分解成CO₂和NH₃尿素在酸碱溶液中加热或常温时在脲酶的催化下水解,生成CO₂和NH₃与亚硝酸反应生成CO₃、H₂O、N₂将尿素晶体缓慢加热,两分子尿素脱去一分子氨而缩合成二缩脲二缩脲反应:二缩脲在碱性溶液中与稀硫酸铜溶液产生紫红色反应。
含有两个及以上酰胺键的分子都有这个颜色反应胍。
尿素的羰基上的氧被亚氨基取代生成的分子称为胍。
胍的一个氨基失去一个氢产生的基团为胍基,失去一个氨基为脒基胍的碱性很强,仅次于季铵碱10.2 胺分类命名根据N上所连的烃基的数目伯胺仲胺叔胺季胺简单胺的命名:在“胺”字前加上烃基的名称和数目。
知识点7 氮及其化合物思维导图-备战2021高考化学元素及其化合物知识点思维导图

NH3的还原性
氨气的催化氧化: 用于检验氯气管道是否泄漏8NH3+3Cl2=6NH4Cl+N2 NH3通到灼热的CuO:
电荷守恒:c(Cl—)+c(OH—) = c(H+)+c(NH4+)
NH4Cl溶液中
物料守恒:c(Cl—)=c(NH4+)+c(NH3•H2O) 质子守恒c(H+)=c(OH—)+c(NH3•H2O)
汽车尾气处理中NO被CO还原的化学方程式:
氮化镁水解:Mg3N2+6H2O =3Mg(OH)2↓ +2NH3↑
反应为:HCl+NH3 = NH4Cl、 NH3+HNO3 = NH4NO3
铵盐不稳定(气温高不宜施氮肥)
N2
氮的固定:将游离态的氮 转化为化合态氮的过程
(人工固氮)
氨水与AlCl3反应的离子方程式:Al3++3NH3•H2O = Al(OH)3↓+3NH4+ 银氨溶液的配制:AgNO3+NH3•H2O = AgOH↓+NH4NO3,AgNO3+3NH3•H2O =Ag(NH3)2OH+NH4NO3
豆科植物根瘤菌固氮
标况下,22.4LNO与0.5molO2充分反应,得到NO2分子
NA
NO的制备:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
NO、O2同时通入水中:4NO+3O2+2H2O = 4HNO3
NO、NO2的混合气体通入NaOH溶液:NO+NO2+2NaOH = 2NaNO2+ H2O,工业尾气常用碱液吸收
粒子浓度:c(Cl—)>c(NH4+)> c(H+)>c(NH3•H2O)
NH3的实验室制法:
制备NH3的其他反应: 浓氨水+固体NaOH 浓氨水+固体CaO
共43张丨高中化学全套思维导图,知识点超全归纳,包含90%考点

共43张丨高中化学全套思维导图,知识点超全归纳,包含
90%考点
对于很多理科生来说,理科综合考试成绩的高低基本就代表了综合成绩的高低,因为理综就是“拉分王”。
但偏偏有很多同学的理综水平较差,尤其是物理、化学两科,感觉怎么都记不住、学不会。
其实,化学这一科学习难度并不大,主要困难点在于记忆。
因为化学知识点多且复杂,经常出现背了忘的状况。
思维导图,是一种非常好的学习工具,它能帮助理清知识点之间的关联性,思维导图运用图文并重的技巧,把各级主题的关系用相互隶属与相关的层级图表现出来,把主题关键词与图像、颜色等建立记忆链接。
思维导图充分运用左右脑的机能,利用记忆、阅读、思维的规律,快速掌握知识点。
今天,我们就利用思维导图理清高中化学知识点,今天给大家分享43张高中化学全套思维导图,知识点的超全归纳,包含90%考点,一定要打印背诵哦!
文末有电子版获取方式。
