质量守恒定律题型汇总
质量守恒定律六类题型整理题型

(一)质量守恒定律题型一根据原子种类和个数不变补充化学式。
1-1物质X是一种重要的阻燃剂。
工业上用三氧化二锑(Sb2O3)生产X的化学方程式为:Sb2O3+2H2O2====X+2H2O。
根据质量守恒定律,推断X的化学式为A.SbO2B.Sb2O5 C.HSbO3 D.H3SbO41-2将“神舟七号”飞船送入太空的是“长征二号”F运载火箭,火箭工作中发生的反应为C2H8N2 + 2R == 3N2 + 4H2O + 2CO2;其中R的化学式是A.N2O4B.NO2C.N2O D.CH41-3铁酸钠(Na2FeO4)是一种新型净水剂,具有絮凝和杀菌消毒等作用。
请将下列制取铁酸钠的化学方程式补充完整:2Fe (NO3)3+16NaOH+3Cl2 === 6NaNO3+6NaCl+2Na2FeO4+ 。
1-4若反应②的化学方程式为Y+5O2点燃3CO2+4H2O,Y的化学式为。
1-5工业上可用酸清洗锈蚀的金属。
将生锈的铁片和生锈的铜片[铜锈的成分是Cu2(OH)2CO3]同时放入一定量盐酸中,可能发生的化学反应有:①铜锈溶解:Cu2(OH)2CO3+ 4HCl= 2CuCl2 + 3X + CO2↑,则X的化学式为;1-6.根据质量守恒定律,电解氯化钠的水溶液不可能...得到的物质是A.NaNO3B.H2C.Cl2 D.NaOH题型二“零排放”2 “绿色化学”的特点之一是“零排放”。
一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物。
其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,这种产物是_______(填字母序号,下同)。
A.甲醇(CH4O)B.甲酸(CH2O2)C.乙醇(C2H6O)D.乙酸(C2H4O2)思路:根据二氧化碳中碳原子和氧原子的个数比为1:2题型三质量守恒定律用于一切化学变化3、下列叙述完全符合质量守恒定律的是A.水结成冰前后,质量保持不变B.50mL水和50 mL乙醇混合后总体积小于100 mLC.在100g过氧化氢溶液中,含有30g过氧化氢和70g水D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳题型四、根据情景写化学方程式4-1、化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体。
质量守恒定律之题型归纳

例1: 点石是否真能够成金? 水能否变成油? 例2、 高锰酸钾受热后,剩余物质的质量为什么小? 铁丝燃烧后,为什么生成物的质量会变大?
5、判断反应类型
例:在一定密闭容器内有X、Y、Z、Q四种物质,在 一定条件下充分反应后,测得反应前后各物质的质 量如下
物质 反应前质量 反应后质量 X 2 待测 24 Y 2 Z 84 0 Q 5 14
2、判断化学反应中某物质的组成元素:
例1: 例1:已知光合作用: CO2 + H2O → 淀粉 + O2 试推断淀粉中一定含 元素,可能 含 。
例2、已知A物质在氧气中燃烧后, 生成SO2和H2O, 则A中一定含有的元素是
。
3、推断化学反应中某物质的化学式: 例1: 宇宙飞船的火箭推进器常使用偏二甲肼做燃 料。 已知火箭发射时某化学反应为: N2H4 + 2H2O2 === N2 + 4X 是 则X的化学式 。
4、解释某些化学反应的现象 5、判断反应类型
55 求反应后X的质量____,该反应属于 分解 ______反应.
随堂练习、 下列实验装置不能用来证明:“化学反应前 后各物质质量总和相等”的是( ) C
2、加热铜丝,观察是否保持平衡
题型总结
1、计算化学反应前后,某物质的质量 2、判断化学反应中某物质的组成元素
3、推断化学反应中某物质的化学式
课题1
题型归纳
Chemistry
铭
质量守恒定律的应用
1、计算化学反应前后,某物质的质量:
例1:已知某反应 A + B → C + D, 已知15gA和25gB完全反应生成22gC, 请问同时也生成了 gD
专题十 质量守恒定律

专题十质量守恒定律1.氢气被认为是理想的清洁、高能燃料,其燃烧的化学方程式为2H2+O2点燃__2H2O。
下列有关说法中,不正确的是()A.该反应中分子的种类改变、原子的种类不变B.氢气和氧气在点燃条件下生成水.C.每2个氢分子和1个氧分子在点燃条件下生成2个水分子D.2g氢气和lg氧气在点燃的条件下生成2g水2.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是()A.x的值是7 B.丙可能是该反应的催化剂C.丁一定是化合物D.参加反应的甲和乙的质量比为7:133.已知氯酸钾在二氧化锰做催化剂的条件下,生成氯化钾和氧气。
下图表示一定质量的氯酸钾和二氧化锰固体混合物受热分解过程中,某变量y随时间的变化趋势,纵坐标表示的是()A.固体中氧元素的质量B.生成氧气的质量C.固体中二氧化锰的质量D.固体中钾元素的质量4.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。
下列说法中不正确的是()A.该反应为分解反应B.乙、丁两种物质反应的质量比为7:5C.丙可能为该反应的催化剂D.甲、乙两种物质参加反应的质量比为1:45.小芳做探究性实验:用称量法测定铁在O2燃烧的产物.发现5.6g铁在足量的O2中燃烧得到7.82g固体.小芳排除了其他因素可能产生的误差,则她得到的固体产物可能是()A.Fe3O4和Fe的混合物B.Fe3O4和FeO的混合物C.Fe3O4和Fe2O3的混合物D.Fe3O4、FeO和Fe的混合物6.有4.6g某化合物在足量氧气中充分燃烧,生成8.8g二氧化碳和5.4g水。
下列对该化合物组成的判断中,正确的是()A.一定含有碳、氢两种元泰,可能含有氧元素B.由碳、氢两种元素组成C.由碳、氧两种元素组成D.由碳、氢、氧三种元组成7.下列图像能正确反映对应变化关系的是()A.测定空气中氧气的B.水的电解C.用等质量等浓度的双氧水分别制氧气D.加热高锰酸钾制氧气8.一定质量的某化合物完全燃烧,消耗9.6g氧气,生成8.8g二氧化碳和5.4g水。
化学中的质量守恒定律测试题

化学中的质量守恒定律测试题一、选择题(每题 3 分,共 30 分)1、下列变化中,能用质量守恒定律解释的是()A 5g 水受热变成 5g 水蒸气B 5g 蔗糖溶解在 95g 水中,得到 100g 蔗糖溶液C 木炭燃烧后质量减少D 100mL 水与 100mL 酒精混合后体积小于 200mL2、在化学反应 2A + B = 2C 中,已知 A 的相对分子质量为 24,B 的相对分子质量为 32,C 的相对分子质量为 48,则 A 与 B 的化学计量数之比为()A 1∶1B 2∶1C 1∶2D 3∶23、某物质在空气中完全燃烧生成 88g 二氧化碳和 54g 水,则关于这种物质的组成描述正确的是()A 该物质只含有碳元素和氢元素B 该物质中碳元素与氢元素的质量比为 12∶1C 该物质一定含有碳元素和氢元素,可能含有氧元素D 该物质的分子中碳原子与氢原子的个数比为 1∶34、加热 316g 高锰酸钾,当得到 3g 氧气时,剩余固体的成分是()A KMnO₄、K₂MnO₄、MnO₂B KMnO₄、MnO₂C K₂MnO₄、MnO₂D KMnO₄、K₂MnO₄5、下列实验能够直接用于验证质量守恒定律的是()A 红磷燃烧实验B 铁与硫酸铜溶液反应实验C 碳酸钠与稀盐酸反应实验D 蜡烛燃烧实验6、在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:|物质|甲|乙|丙|丁||||||||反应前质量(g)|8|32|5|8||反应后质量(g)|16|X|5|24|下列说法错误的是()A 该反应是分解反应B X 的值为 12C 丙可能是该反应的催化剂D 参加反应的甲、丁的质量比为 1∶37、现将 10gA 和足量 B 混合加热,A 与 B 发生化学反应,10gA 完全反应后生成 8gC 和 4gD,则参加反应的 A 与 B 的质量比是()A 1∶1B 2∶1C 4∶1D 5∶18、某纯净物 X 在空气中完全燃烧,反应的化学方程式为:X +3O₂= 2CO₂+ 2H₂O,则 X 的化学式为()A C₂H₄B C₂H₅OHC C₂H₂D CH₄9、镁带在耐高温的密闭容器中(内含空气)加热,下列图中能正确表示容器内所盛物质总质量变化的是()A B C D10、有化学反应 A + 2B = C + 2D,已知 49g A 恰好与 29g B 完全反应,生成 60g C,则同时生成 D 的质量为()A 18gB 9gC 30gD 6g二、填空题(每空 2 分,共 30 分)11、质量守恒定律是指参加化学反应的各物质的等于反应后生成的各物质的。
质量守恒定律大题专练(含答案)

质量守恒定律大题专练(含答案)
本文档包含一系列质量守恒定律的大题练,并提供答案。
以下是练及答案的详细内容:
1. 问题:在一个封闭系统中,物质A和物质B发生化学反应生成物质C。
如果物质A的质量为10克,物质B的质量为15克,最终生成的物质C的质量是多少克?
答案:质量守恒定律指出,在封闭系统中,物质的总质量不会发生改变。
因此,物质A和物质B的质量之和等于生成物质C的质量。
在这个例子中,物质C的质量为10克 + 15克 = 25克。
2. 问题:一个木头燃烧产生了灰烬和烟气。
在这个过程中,质量是否守恒?为什么?
答案:质量守恒定律适用于封闭系统,而燃烧过程发生在开放系统中。
当木头燃烧时,一部分木材质量转化为了灰烬,一部分转化为了烟气。
然而,一些部分的质量也以灰烬和烟气的形式逸出系统,因此质量没有完全守恒。
3. 问题:在一个封闭系统中,一个氧气分子和两个氢气分子发生反应生成水分子。
氧气分子的质量为32克,氢气分子的质量为2克。
生成的水分子的质量是多少克?
答案:根据质量守恒定律,反应过程中物质的总质量不会发生改变。
因此,生成的水分子的质量应等于氧气分子和氢气分子质量之和,即32克 + 2克 + 2克 = 36克。
4. 问题:为什么铁锈生成后,金属铁的总质量会增加?
答案:铁锈是由铁与氧气发生化学反应生成的。
当铁与氧气反应时,氧气分子与铁离子结合形成铁锈。
铁离子和氧气的结合增加了铁物质的质量,因此金属铁的总质量会增加。
以上是《质量守恒定律大题专练(含答案)》的内容,希望对您有所帮助。
质量守恒定律题型总结

质量守恒定律题型总结三、特殊方程式A+B=C+D的解法【例1】已知在反应2A+B=C+2D中,A、B、C的质量比为5:2:3,现用15gA与足量B反应,可生成多少克D?若已知C的相对分子质量为M,则D的相对分子质量为多少?【解析】根据质量守恒定律,参加反应的各物质质量之和应该等于反应后生成的各物质质量之和。
相对分子质量乘以化学计量数等于质量。
因此,题目中给出的质量可直接带入方程式,相对质量要乘微粒的个数再带入方程式计算。
由质量守恒定律可知D的质量应为5g+2g-3g=4g2A + B = C + 2D5 2 3 415g XM 2Y5:15g=4:X,X=12g3:M=4:2Y,Y=■M【例2】将含有15gA、10gB、9gC的粉末状混合物充分加热,发生反应后A剩余3g,B增加到25g,C已消耗完,并有气体D放出,则该反应中,A、B、C、D的质量比为多少?【解析】题中没有明确反应物和生成物,一般是物质质量减少的是反应物,物质质量增加的是生成物。
物质减少的质量就是参加反应的反应物的质量,物质增加的质量就是反应生成的生成物质量。
由上可知,A、C是反应物,B、D是生成物,参加反应的A的质量为12g,C的质量为9g,B生成了15g。
A + C =B + D12g 9g 15g 6gA、B、C、D的质量比为4:5:3:2【练一练】1.已知在反应A+3B=2C+2D中,C和D的相对分子质量之比为22∶9,已知2.8gA与一定量B完全反应,生成8.8gC,则在此反应中,B和D的质量比是多少?2.已知3A+2B=2C+D中,反应物A、B的质量比为3∶4,当反应生成C和D的质量共140g时,消耗B的质量为多少克?3.一个密闭容器中有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:■已知物质X、Q的相对分子质量均为n,则下列推理中,正确的是A.反应后物质Z的质量为10gB.反应中,物质Y与Q发生改变的质量之比为1:1C.反应中,生成Y的质量为21gD.该反应的化学方程式中,物质X与Q的化学计量数之比为2:3【答案】1. 8:3 2. 80g 3. A、D四、根据化学方程式的计算1.化学反应前后各元素的质量守恒:【例1】加热铜和氧化铜的混合粉末10g与足量氢气充分反应,得到8.4g铜,原混合物中含铜多少克?【解析】本题有多种解法,最简便的方法就是利用质量守恒定律来解。
拓展1质量守恒定律题型强化

【题型一:质量守恒定律的理解】1、下列现象不能用质量守恒定律解释的是()A.木材燃烧,余下灰烬的质量小于原木材质量B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加C.加热高锰酸钾,剩余固体质量减少D.将一定质量的水冷凝后结成冰,质量不变【答案】D【解析】A、木材燃烧,余下灰烬的质量小于原木材质量,是因为生成的二氧化碳逸散到了空气中,该选项遵循质量守恒定律;B、铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加,是因为铜和空气中的氧气反应生成了氧化铜,该选项遵循质量守恒定律;C、加热高锰酸钾,剩余固体质量减少,是因为反应生成的氧气逸出,该选项遵循质量守恒定律;D、水冷凝后结成冰的过程没有发生化学变化,不能用质量守恒定律解释。
故选:D。
2、化学反应前后,给出下列各项:①原子数目;①分子数目;①元素种类;①物质的总质量;①物质种类;①原子种类;①电子数目。
其中没有变化的是()A.①①①①①B.①①①①①C.①①①①①D.①①①①①【答案】B【解析】化学反应前后,①原子数目、①元素种类、①物质的总质量、①原子种类、①电子数目没有变化;①物质种类一定发生改变;①分子数目可能改变。
故选B。
3、质量守恒定律是帮我们认识化学反应实质的重要理论。
关于反应aA+bB=cC+dD,下列说法正确的是()A.化学计量数a与b之和一定等于c与d之和B.若取xg A和xg B反应,生成C和D的质量总和不一定是2xgC.反应物A和B的质量比一定等于生成物C和D的质量比D.反应中一定有元素化合价的改变【答案】B【解析】A、参加反应的A、B的质量总和一定等于生成的C、D的质量总和,但化学计量数a与b之和不一定等于c与d之和,故A不正确;B、物质参加化学反应按一定的质量比进行,由于参加反应的A、B的质量比不一定是1:1,若取xgA和xgB反应,生成C和D的质量总和不一定是2xg,故B正确;C、参加反应的A、B的质量总和一定等于生成的C、D的质量总和,但反应物A和B的质量比不一定等于生成物C和D的质量比,故C不正确;D、该反应两种物质参与反应,不是分解反应,故D不正确。
质量守恒定律专项练习题

质量守恒定律专项练习题一、选择题1. 质量守恒定律是指:A. 物体在同一物理系统内的质量始终保持不变B. 两个相互作用的物体间的质量始终保持不变C. 物质可以通过化学反应而被转化成其他物质D. 能量守恒定律2. 质量守恒定律适用于以下哪些情况:A. 封闭系统B. 开放系统C. 半封闭系统D. 所有系统3. 下列哪个过程违反了质量守恒定律?A. 燃烧木材产生的灰烬的总质量大于木材的质量B. 非溶解性固体溶解于液体时,溶液的质量大于纯液体的质量C. 盐水中通过电解分解水,生成氧气和氢气D. 弹簧压缩后松开,弹簧的形变能被转化为动能4. 在一个封闭系统中,有两个物体同时发生化学反应,其总质量发生了变化。
这是否违反了质量守恒定律?A. 是,因为化学反应会转化物质B. 不违反,因为封闭系统并不是理想的封闭系统C. 不违反,因为总质量仅在开放系统中始终保持不变D. 无法判断二、填空题1. 质量守恒定律是能量守恒定律之后改变的。
2. 质量守恒定律适用于系统中物质的转化过程。
三、问答题1. 请介绍一下质量守恒定律的基本原理和适用范围。
质量守恒定律是指在封闭系统中,物质不会被创建或毁灭,只能通过物质的转化改变其形态。
即使在物质的转化过程中,总质量始终保持不变。
这个定律适用于封闭系统中物质转化的各种过程,无论是化学反应、物理变化还是核反应。
2. 举一个违反质量守恒定律的例子,并解释为什么它违反了这个定律。
一个违反质量守恒定律的例子是在非封闭系统中发生的核反应。
核反应可以将一个物质转化为另一种物质,同时产生大量的能量。
这个过程中,原有物质的质量会减少,而新产生的物质的质量会增加,从而违反了质量守恒定律。
综上所述,质量守恒定律是自然界中基本的守恒定律之一,它规定了物质在封闭系统中的转化方式,保证了物质的守恒性。
通过理解和应用质量守恒定律,可以帮助我们更好地掌握物质的转化过程,并应用于实际生活和科学研究中。
初中化学真题复习《质量守恒定律》试题汇编(含答案解析)

初中化学真题复习《质量守恒定律》试题汇编(含答案解析)一.选择题(共12小题)1.(2021•鄂州)甲、乙、丙、丁四种物质混合后,在一定条件下充分反应,测得反应前后各物质的质量如表所示。
关于此反应说法正确的是()物质甲乙丙丁反应前质量/g7015 6.258.75反应后质量/g357.548.758.75A.丁一定是该反应的催化剂B.参加反应的甲和乙的质量之和一定等于生成的丙的质量C.甲一定是化合物,乙一定是单质D.该反应可能是分解反应2.(2021•天津)将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。
下列判断正确的是()A.R只含碳、氢元素B.消耗氧气32gC.R含碳、氢、氧三种元素D.R中碳元素的质量分数为70%3.(2021•扬州)FeCl3溶液用于制作印刷电路板,反应为2FeCl3+Cu═CuCl2+2X。
X的化学式是()A.Fe B.FeCl2C.Fe(OH)2D.Fe(OH)3 4.(2021•恩施州)水是生命之源。
下列有关水的说法正确的是()A.水变燃油可以实现B.冰水共存物属于混合物C.电解水的实验中,电源正极产生氢气D.生活中常用煮沸的方法降低水的硬度5.(2021•广安)下列化学方程式书写完全正确的是()A.4Fe+3O22Fe2O3B.2Fe+6HCl═2FeCl3+3H2↑C.Fe2O3+6HCl═2FeCl3+3H2OD.Al+CuSO4═AlSO4+Cu6.(2021•盐城)将CO和铁的氧化物Fe x O y置于密闭容器中,一定条件下充分反应至完全。
反应过程中容器内部分物质的质量变化如图所示。
下列说法正确的是()A.m的值为12.6B.铁的氧化物中x:y=3:4C.参加反应的铁的氧化物的质量为16gD.当CO2质量为4.4g时,容器内CO质量为14g7.(2021•湘潭)取一定质量的Fe(OH)3固体加热至550℃完全分解为Fe2O3和H2O,温度提高到1400℃时,Fe2O3继续分解为复杂的铁的氧化物和O2;将产生的气体先通过浓硫酸,浓硫酸质量增加5.4克,再通过灼热的铜网,铜网质量增加0.8克(产生的气体均被完全吸收)。
质量守恒定律经典练习题40道

质量守恒定律经典练习题40道1、哪个图像能够反映加热高锰酸钾时剩余固体质量与反应时间的关系。
2、碱式碳酸铜受热分解成CuO、CO2和H2O三种物质,它的组成是什么。
3、在方程式CxHyOz + 5O2 = 4CO2 + 4H2O中,x、y、z的值是什么。
4、mg的硫在ng的氧气中燃烧,生成的二氧化硫的质量最合理的答案是什么。
5、镁在空气中燃烧时,生成氧化镁和氮化镁(Mg3N2)。
12g的镁在空气中燃烧后,产生的产物质量是多少。
6、在化学反应aA + bB = cC + dD中,哪个说法是正确的。
7、关于质量守恒定律,哪个叙述是正确的。
8、根据反应3NO2 + H2O = 2HNO3 + X,推断X的化学式是什么。
9、黑火药爆炸的反应主要是2KNO3 + 3C + S = K2S +3CO2↑ + X↑,则X的化学式是什么。
10、哪个现象不能用质量守恒定律解释?11、瑞奥汀河是一条酸河,其中含有硫酸和硫酸亚铁。
研究表明,酸河的形成是由于上游河床含有某种物质R,在水中氧气的作用下发生反应所致。
反应方程式为2R+2H2O+7O2→2FeSO4+2H2SO4.因此,R的化学式为FeS。
12、在实验中,某纯净物X在密闭中稍加加热就分解为NH3、H2O和CO2.根据这一实验事实,无法得出X由四种元素组成、X是化合物、X中有水或X不稳定这些结论。
13、根据化学方程式CxHyOz+5O2→4CO2+4H2O,可以得出x、y、z的值分别为4、8、2.14、在反应2H2O2→2H2O+O2中,肯定发生变化的是各种原子的数目。
15、能够用质量守恒定律解释的说法是:B。
62g磷和80g氧反应生成142g五氧化二磷。
16、某物质在纯氧中燃烧生成氮气和水蒸气,因此该物质一定含有氮元素和氧元素。
17、根据质量守恒定律,铁丝在氧气中完全燃烧后,生成物的质量一定等于铁丝的质量。
18、化学反应前后没有发生改变的是:①原子的数目③元素的种类④物质的总质量⑥原子的种类。
专题6 质量守恒定律全题型总结(学生版)-2020化学《满分中考·重难点题型》精准练(九上)

专题6质量守恒定律全题型总结一、数据分析类计算题此类型题主要考察质量守恒定律宏观概念——反应前后质量不变在反应过程中,质量减少的为反应物,同理可判断生成物甚至反应类型反应前后质量不变的不一定是催化剂(骑马的不一定是唐僧)1.在一个密闭容器内装有四种物质,测得反应前后各物质的质量如下表:物质 a b c d反应前质量/g 16.8 8 2.4 0.5反应后质量/g 0 x 8.4 10.5你认为下列判断中错误的是A.该反应是分解反应B.x的值是8.8C.生成c和d的质量比是3:5 D.b一定是该反应的催化剂2.如图反映了某个化学反应各物质质量与时间的关系.下列描述正确的是A.该反应是化合反应B.甲的相对分子质量大于乙C.丙是反应物,甲和乙是生成物D.t1时,丙的质量一定等于甲、乙的质量之和3.把一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是物质 a b c d反应前的质量(g) 1.4 10 4.0 0.8反应后质量(g) x 3.2 7.2 0.8 A.该反应是分解反应B.X的值为3.0C.a和c是反应物D.d一定是催化剂4.把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法正确的是物质 a b c d反应前的质量/g 7.4 4.2 5.0 3.8反应后的质量/g 6.2 x 5.2 3.8A.物质a是生成物B. x=2.2C. d一定是催化剂D.此反应中a物质和b物质的质量比为6:5 5.在一个密闭容器内有A,B,C,D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是物质 A B C D反应前质量/g 4 6 111 4反应后质量/g 待测 15 0 84A.该密闭容器中发生化学变化属于分解反应B.该密闭容器中发生的化学变化属于化合反应C.该反应中C为化合物,A,B,D三种物质为单质D.反应后密闭容器中A的质量为22g6.在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示.物质X Y Z Q反应前质量/g 8 3 40 5反应后质量/g 待测25 8 23 下列说法不正确的是A.反应后X的质量为0 B.该反应中X、Z的质量比为1:4C.该反应的生成物是Y和Q D.充分反应后,密闭容器中仍有四种物质7.在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示,下列说法错误的是物质 a b c d反应前的质量/g 30 5 10 15反应后的质量/g x y 20 20A. a一定是反应物B. x+y=20C. x的取值范围一定是0≤x≤30D.反应生成c与d的质量比为2:18.一定条件下,一个密闭容器内发生反应,测得反应前后各物质的质量如下表所示。
2024年中考化学专题训练——有关质量守恒定律的计算

2024年中考化学专题训练——有关质量守恒定律的计算一、选择题1.现有8gA 和足量B 在一定条件下充分反应,生成22gC 和18gD,则参加反应的A 和B 的质量比是A.4:11B.1 :2C.1 :4D.11 :9 2.现将20克A和足量B混合加热,A与B发生化学反应,20克A完全反应后生成16克C和8克D,则参加反应的B与生成的C的质量比是A.1∶4B.5∶4C.2∶1D.1:23.一定量的溶液中含有KOH和K2CO3两种溶质,向其中加入l00g溶质质量分数为7.3℅的稀HCl,恰好完全反应且溶液呈中性,将反应后的溶液蒸干,所得固体的质量是A.7.45g B.14.9g C.5. 6g D.13. 8g4.现将10gA和足量B混合加热,A和B发生化学反应,10gA完全反应后生成8gC 和4gD,则参加反应的A和B的质量比是()A.1:1B.2:1C.4:1D.5:15.下列叙述不正确...的是()A.Na2CO3、HNO3、BaCl2、HCl这四种物质的溶液,不用外加....试剂就可以将它们一一鉴别出来B.金属与稀硫酸溶液发生反应后,溶液的质量一定增大C.在电解水的实验中,为增强导电性,可加入少量烧碱或硫酸D.加热氯酸钾和二氧化锰的混合物,一段时间后固体中二氧化锰的质量分数变大6.在化学反应A+B=C+D中,6gA与8gB恰好完全反应,生成9gD.则生成C物质的质量是()A.7g B.5g C.8g D.6g7.化学反应A2+2B===2AB中,A2与B反应的质量关系如图所示,现将12g A2和12g B 充分反应,则生成AB的质量为A.24gB.21gC.18gD.15g8.30g某有机物M在氧气中完全燃烧,生成44gCO2和18gH2O,下列说法不正确的是()A.M含有C、H、O三种元素B.M中氧元素的质量分数约为53.3%C.完全燃烧时,M与消耗O2的质量比为15:16D.3.0gM在2.4gO2氧气中燃烧生成2.4gCO、1.2CO2和1.8gH2O9.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应A.该反应为分解反应B.丙可能为该反应的催化剂C.甲、乙两种物质间参加反应的质量比为1:4D.乙、丁两种物质间反应的质量比为7:510.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下A.W可能是单质B.Y可能是催化剂C.该反应是分解反应D.反应后Z物质的质量为86.4g二、计算题11.碳酸钠俗称纯碱、苏打。
质量守恒定律应用练习题

质量守恒定律应用练习题一、选择题1. 下列哪个现象能用质量守恒定律解释?A. 水结成冰B. 铁钉生锈C. 水沸腾D. 纸张燃烧A. 原子数目B. 分子数目C. 原子质量D. 分子质量A. 参加反应的各物质的质量总和等于物的质量总和B. 参加反应的各物质的质量总和大于物的质量总和C. 参加反应的各物质的质量总和小于物的质量总和D. 参加反应的各物质的质量与物的质量无关二、填空题1. 质量守恒定律是由法国化学家______提出的。
2. 在化学反应中,反应物的总质量与物的总质量______。
3. 在一个封闭系统中进行化学反应,系统内物质的总质量______(增加/减少/不变)。
三、判断题1. 质量守恒定律只适用于物理变化。
()2. 在化学反应中,元素的化合价可以发生改变,但质量守恒定律仍然成立。
()3. 质量守恒定律说明化学反应中,反应物和物的质量可以互相转换。
()四、计算题1. 某化学反应中,反应物A、B的质量分别为10g和15g,物C、D的质量分别为12g和13g。
求反应中是否有物质未参与反应,若有,请计算未参与反应物质的质量。
2. 在一个密闭容器中进行化学反应,反应前容器内物质的总质量为50g,反应后容器内物质的总质量为48g。
求反应过程中是否有物质逸出,若有,请计算逸出物质的质量。
五、实验题1. 设计一个实验,验证质量守恒定律。
要求写出实验步骤、所需材料和实验现象。
2. 在一个密闭容器中进行铁与硫酸铜溶液反应的实验,实验前后容器内物质的质量分别为50g和52g。
分析实验结果,解释可能的原因。
六、简答题1. 请简述质量守恒定律的基本内容。
2. 为什么在化学反应中,即使形态发生改变,物质的总质量仍然保持不变?3. 举例说明在日常生活中如何体现质量守恒定律。
七、作图题1. 请画出铁与硫酸铜溶液反应的示意图,并标注出反应物和物。
2. 设计一个实验装置图,用于验证质量守恒定律,并说明装置的工作原理。
八、综合应用题1. 某化学反应的方程式为:2A + 3B → C + 4D。
质量守恒定律练习题

质量守恒定律练习题质量守恒定律是化学中的一个重要定律,它对于理解化学反应的本质和进行化学计算具有至关重要的意义。
下面为大家带来一系列关于质量守恒定律的练习题,希望能帮助大家更好地掌握这一知识点。
一、选择题1、下列变化中,能用质量守恒定律解释的是()A 5g 水受热变成 5g 水蒸气B 5g 蔗糖溶解在 95g 水中,得到 100g 蔗糖溶液C 木炭燃烧后质量减少D 100mL 水加入 100mL 酒精,得到体积小于 200mL 的溶液答案:C解析:质量守恒定律适用于化学变化,A 选项水受热变成水蒸气是物理变化,B 选项蔗糖溶解是物理变化,D 选项 100mL 水和 100mL 酒精混合体积小于 200mL 是因为分子间有间隔,是物理变化。
C 选项木炭燃烧生成二氧化碳,是化学变化,参加反应的木炭和氧气的质量总和等于生成的二氧化碳的质量,所以燃烧后质量减少,能用质量守恒定律解释。
2、在化学反应 2A + B = 2C 中,已知 A 的相对分子质量为 24,B 的相对分子质量为 32,C 的相对分子质量为 48,则 A、B、C 的化学计量数之比为()A 2:1:2B 3:1:2C 2:3:2D 3:2:1答案:A解析:设 A、B、C 的化学计量数分别为 x、y、z。
根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
则有:\(24x + 32y = 48z\)化简得:\(3x + 4y = 6z\)当 x = 2,y = 1,z = 2 时,等式成立。
所以 A、B、C 的化学计量数之比为 2:1:2,选择 A 选项。
3、加热高锰酸钾制取氧气的化学方程式为\(2KMnO_{4}\stackrel{\triangle}{=\!=\!=}K_{2}MnO_{4} + MnO_{2} +O_{2}\uparrow\),对该反应说法正确的是()A 反应前后锰元素的化合价没有变化B 反应前后氧元素的质量不变C 高锰酸钾是一种混合物D 生成氧气的质量等于高锰酸钾中氧元素的质量答案:B解析:在高锰酸钾\(KMnO_{4}\)中,锰元素的化合价为+7 价,在锰酸钾\(K_{2}MnO_{4}\)中锰元素的化合价为+6 价,在二氧化锰\(MnO_{2}\)中锰元素的化合价为+4 价,A 选项错误;根据质量守恒定律,反应前后元素的种类和质量不变,所以反应前后氧元素的质量不变,B 选项正确;高锰酸钾是由一种物质组成的,属于纯净物,C 选项错误;生成氧气的质量小于高锰酸钾中氧元素的质量,因为还有部分氧元素存在于锰酸钾和二氧化锰中,D 选项错误。
质量守恒定律题型
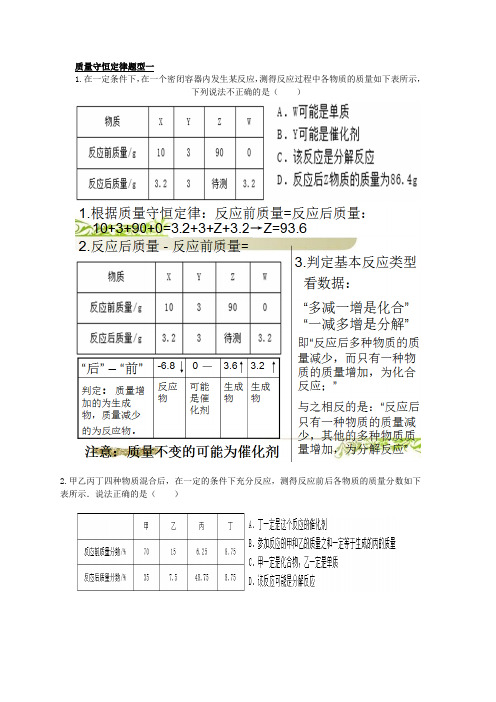
质量守恒定律题型一
1.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,
下列说法不正确的是()
2.甲乙丙丁四种物质混合后,在一定的条件下充分反应,测得反应前后各物质的质量分数如下表所示.说法正确的是()
3. 将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
4.一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表,有关说法正确的是()
5. 在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得部分数据如下表:下列说法中,不正确的是()
6. 在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生反应,一段时间后,测得有关数据如下表,则关于此反应,认识不正确的是()
质量守恒定律题型四
1.某可燃物4.6g 在足量氧气充分燃烧,生成8.8g 二氧化碳和5.4g 水,则该可燃物的组成为(
)
解析:根据质量守恒定律,反应前后元素种类、质量不变,由生成二氧化碳和水的量分别计算出可燃物中C 和H 元素质量.然后比较所求C 、H 元素质量和与可燃物质量是否相等,若相等可燃物就只含C 、H 两种元素,若不等可燃物中还含有氧元素.
水的质量×水中氢的质量分数: 某物质在氧气中完全燃烧生成8.8g 二氧化碳和5.4g 水,则关于这种物质的组成描述正确的是( )
1.
2.
3.某化学反应前后微观模拟如所示,“○”“●”,说法正确是()
4.用“○”和“●”分别代表两种不同元素原子,这两种元素组成物质在一定条件下能发生,
6.。
质量守恒定律题型汇总

质量守恒定律题型汇总质量守恒定律的应⽤题型1 解释及验证类1.下列现象可⽤质量守恒定律解释的是()A.10 g⽔受热变成了10 g⽔蒸汽B.50mL ⽔中加⼊50mL酒精,总体积100mLC.5 g蔗糖溶于95 g⽔中,总质量为100 gD.纸在空⽓中燃烧后化为灰烬,灰烬质量⽐纸的质量⼩2.(2018?滨州)下列实验能够直接⽤于验证质量守恒定律的是()A. B.C.D.3.已知48g镁于32g氧⽓恰好完全反应,⽣成氧化镁80g,则下列说法正确的是()A.5g镁和5g氧⽓⽣成10g氧化镁B.6g镁和4g氧⽓⽣成10g氧化镁C.3g镁和7g氧⽓⽣成10g氧化镁D.4g镁和6g氧⽓⽣成10g氧化镁4 .将氯酸钾和少量⼆氧化锰的混合物加热到没有⽓体放出时,在剩余的固体混合物中⼆氧化锰的质量分数与反应前相⽐()A.没有改变B.增加了C.减少了D.⽆法确定5.(2018?威海)在化学变化中,下列说法正确的是()①原⼦的种类、元素的种类、分⼦的种类均不变②原⼦的数⽬、分⼦的数⽬均不变。
③原⼦的质量、元素的质量、物质的总质量均不变④原⼦核的种类、数量、质量均不变A.①②B.①③C.③④D.②④题型2 确定化学式1.在反应FeS+4HNO3=Fe(NO3)2+2X↑+S↓+2H2O中X的化学式为()A、NH4NO3B、NOC、NO2D、H2S2.根据质量守恒定律判断,在2XY2+Y2=2Z的反应中,Z的化学式应该是()A.X2YB.X2Y3C.XY2D.XY33.我国新⼀代⽓象卫星“风云三号”于今年5⽉27⽇成功发射,运载⽕箭的燃料是偏⼆甲肼(⽤R表⽰),其燃烧的化学⽅程式为:R+2N2O4=3N2+4H2O+2CO2,则偏⼆甲肼的化学式是()A.C2H8N2B.N2H4C.CH4D.C6H7N4.某元素R的氧⽐物中,R元素与氧元素的质量⽐为7:8,R的相对原⼦质量为14,则R氧化物的化学式是()A.RO B.RO2C.R2O D.R2O55、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
质量守恒定律提高综合训练题及解析

质量守恒定律提高综合训练题及解析一、初中化学质量守恒定律选择题1.一定条件下,某装置中发生了化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,正确的是( )物质甲乙丙丁反应前的质量/g60 1.500反应后的质量/g33x243A.x的值等于0.5B.丙和丁的质量变化比为8:1C.乙一定是催化剂D.该反应是化合反应2.已知、、分别表示X、Y、Z三种不同的气体分子,在一定条件下的变化如图所示,由图示获得的下列信息中错误的是( )A.在化学变化中,分子一定发生改变B.分子之间有间隔C.该反应可表示为4X+Y=2ZD.一个Z分子由四个原子构成3.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。
则关于此反应的认识正确的是()物质X Y Z W反应前的质量(g)211616反应后的质量(g)18m611A.该反应为分解反应B.该反应为化合反应C.m=1 D.反应后容器中Z与Y的质量比为1:6 4.某金属单质 X与非金属单质Y可发生反应:2X+Y=X2Y。
某实验探究小组进行了两次实验,测得数据如下表:实验序号X的用量/g Y的用量/g生成X2Y的质量/g17.4 1.68.029.6 3.212.0参加反应的X与Y的质量比为 ( )A.4:1 B.3:1 C.2:1 D.37:85.图反映了某个化学反应各物质质量与时间的关系。
下列描述正确的是A.该反应是化合反应B.甲的相对分子质量大于乙C.丙是反应物,甲和乙是生成物D.t1时,丙的质量一定等于甲、乙的质量之和6.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g410121反应后质量/g01215待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z7.用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的是()A.B.C.D.8.关于分子和原子两种微粒的叙述正确的是A.物质只能由分子构成 B.分子在不断运动,原子静止不动C.相同原子可能构成不同的分子 D.化学变化中分子数目一定发生变化9.如图是某化学反应的微观模型,“”、“”分别表示不同元素的原子,下列各项中对图示模型理解正确的是()A.该反应属于分解反应B.反应中共有两种元素参加C.反应物和生成物中只有一种单质D.参加反应的两种物质分子个数之比为2:310.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如表:物质甲乙丙丁反应前质量/g181232反应后质量/g X26212下列说法中,不正确的是()A.反应后物质甲的质量为13gB.乙是反应物C.反应中乙、丁的质量比为5:4D.物质丙可能是该反应的催化剂11.在一密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质质量如下表,对该反应,下列描述正确的是():物质甲乙丙丁反应前物质质量/g25m188反应后物质质量/g9待测384A.“待测”数值一定为2g B.该反应中甲和丁为反应物C.乙一定是该反应的催化剂D.反应中甲和丙的质量比为9:3812.在一密闭容器内有M、N、Q、R四种物质,在一定条件下充分反应,反应前后各物质质量如表,则下列说法正确的是()物质M N Q R反应前质量(g)2155111反应后质量(g)11待测850A.该反应属于化合反应B.待测物质N的质量为22gC.该反应属于分解反应D.反应中M、N、Q、R四种物质质量比为9:37:80:11113.物质X、Y之间存在如下关系:X+2Na0H2Y+Cu(OH)2↓,则()A.X一定是Cu(N03)2 B.X的式量比Y大C.Y中阴离子的化合价为-2 D.该反应类型为置换反应14.将铜投入浓硝酸中,产生有刺激性气味的气体,该气体可能为()A.二氧化碳B.氢气C.氯化氢D.二氧化氮15.如图所示:3个甲分子与1个乙分子反应生成两个丙分子.根据图示所得信息正确的是()A.物质甲的化学式为H6B.该反应为化合反应C.化学反应中,分子是最小的微粒D.该图示不符合质量守恒定律16.在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示。
质量守恒定律计算题大全

质量守恒定律的适用范围
质量守恒定律适用于所有宏观物质和能量,包括固态、液态和气态物质,以及化学 反应、物理变化和核反应等过程。
在微观领域,由于量子力学的原理,质量守恒定律可能不适用,但在宏观领域仍然 适用。
在宇宙尺度上,由于物质的产生和消失,质量守恒定律可能不成立,但在地球上的 化学反应中仍然适用。
题目6
某物质由碳、氢、氧三种元素组成,其 中碳元素的质量分数为60%,氢元素的 质量分数为13.3%,求该物质的化学式。
物质质量的比较计算题练习
题目7
在相同温度和相同体积的条件下,比较不同物质的质量大小 。
题目8
在相同温度和相同质量的条件下,比较不同物质的体积大小 。
感谢您的观看
THANKS
质量守恒定律是自然界的基本 定律之一,适用于宏观世界的 所有物质和能量。
质量守恒定律的意义
质量守恒定律是化学反应中物质变化 的基础,是化学计量和计算的重要依 据。
通过质量守恒定律,可以推算出反应 物和生成物的分子量、化学计量数等 重要参数。
它揭示了物质之间的转化关系,是化 学反应中物质之间质量相等的客观规 律。
质量守恒定律计算题大全
目录
• 质量守恒定律概述 • 质量守恒定律计算题分类 • 质量守恒定律计算题解析 • 质量守恒定律计算题练习
01
质量守恒定律概述
量守恒定律的定义
质量守恒定律是指在一个孤立 系统中,不论发生何种物理或 化学变化,质量总是保持不变。
在化学反应中,反应前后的质 量是相等的,即反应物的总质 量和生成物的总质量相等。
答案:3g
物质组成的计算题解析
题目:在化学反应A+B=C+D中,已知10gA和20gB恰 好完全反应,生成5gC。若生成5gD时,参加反应的C 的质量是() 答案:0g
有关质量守恒定律和化学方程式的的题型

练一练:Fe + H3PO4 —— Fe3( PO4)2 + H2 KMnO4 —— K2MnO4 + MnO2 + O2
C3H8 + O2 —— CO2 + H2O Cu2(OH)2CO3—— CuO+ CO2+ H2O
CH3OH + O2——CO2 + H2O CH3COOH+ O2—— CO2 + H2O
03
第一招:会看 —— 火眼金睛辨正误 练习1. 下列化学方程式书写正确的是( ) 氧化汞加热分解:HgO Hg + O2↑ 铁在氧气中燃烧:3Fe + 2O2 Fe3O4 Al + O2 = Al2O3 碳在氧气中燃烧:C + O2 = CO2
第一招:会看 —— 火眼金睛辨正误
(二)、化学方程式配平和方法
最小公倍数法
01
配平思路:第一步:入手点——找左右两边各出现1次且原子数在左右两边较大的元素;
02
求该元素原子个数的最小公倍数;
03
推求化学计量数。
04
练一练:P + O2——P2O5 Fe + O2—— Fe3O4 Mg + O2——MgO
奇偶配平法
CXHY+ O2——CO2+ H2O
综 合 练 习:
综 合 练 习:
01
配平下列化学方程式:
02
C2H4 + O2 ——__CO2 + H2O
Al + H2SO4 —— Al 2(SO4)3 + H2
NH3+ O2 ———— NO+ H2O
KClO3—— KCl+ O2
质量守恒定律练习题

质量守恒定律练习题
1、100克水和100克酒精混合质量等于200克,
这是否符合质量守恒定律。
2、16克氧气和2克氢气恰好完全反应生成___克水。
3、16克氧气和16克氢气反应生成___克水。
4、现有一反应A+B——C有10克A和5克B反应结束后还剩余3克A,B无剩余,则生成C的质量____克。
课后习题
1、蜡烛在空气中充分燃烧后,生成水和二氧化碳推出蜡烛的组成__________
2、16克某物质充分燃烧生成44克二氧化碳和36克水,则该物质的组成()
A、只含碳元素
B、只含碳元素和氢元素
C、一定含碳、氢、氧三种元素
D、一定含碳元素、氢元素可能含氧元素
3、a克氯酸钾和b克二氧化锰混合加热一段时间,称的剩余固体质量为c克,生成氧气的质量为_____克,反应后二氧化锰的质量为______ 克。
4、在A+B ——C+D反应中反应物A和B的质量比是5:2,若完全反应生成C 和D共2.1克,则消耗反应物A 的质量为 ____克,B___克。
1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质量守恒定律的应用题型1 解释及验证类1.下列现象可用质量守恒定律解释的是()A.10 g水受热变成了10 g水蒸汽B.50mL 水中加入50mL酒精,总体积100mLC.5 g蔗糖溶于95 g水中,总质量为100 gD.纸在空气中燃烧后化为灰烬,灰烬质量比纸的质量小2.(2018•滨州)下列实验能够直接用于验证质量守恒定律的是()A. B.C.D.3.已知48g镁于32g氧气恰好完全反应,生成氧化镁80g,则下列说法正确的是()A.5g镁和5g氧气生成10g氧化镁B.6g镁和4g氧气生成10g氧化镁C.3g镁和7g氧气生成10g氧化镁D.4g镁和6g氧气生成10g氧化镁4 .将氯酸钾和少量二氧化锰的混合物加热到没有气体放出时,在剩余的固体混合物中二氧化锰的质量分数与反应前相比()A.没有改变B.增加了C.减少了D.无法确定5.(2018•威海)在化学变化中,下列说法正确的是()①原子的种类、元素的种类、分子的种类均不变②原子的数目、分子的数目均不变。
③原子的质量、元素的质量、物质的总质量均不变④原子核的种类、数量、质量均不变A.①②B.①③C.③④D.②④题型2 确定化学式1.在反应FeS+4HNO3=Fe(NO3)2+2X↑+S↓+2H2O中X的化学式为()A、NH4NO3B、NOC、NO2D、H2S2.根据质量守恒定律判断,在2XY2+Y2=2Z的反应中,Z的化学式应该是()A.X2YB.X2Y3C.XY2D.XY33.我国新一代气象卫星“风云三号”于今年5月27日成功发射,运载火箭的燃料是偏二甲肼(用R表示),其燃烧的化学方程式为:R+2N2O4=3N2+4H2O+2CO2,则偏二甲肼的化学式是()A.C2H8N2B.N2H4C.CH4D.C6H7N4.某元素R的氧比物中,R元素与氧元素的质量比为7:8,R的相对原子质量为14,则R氧化物的化学式是()A.RO B.RO2C.R2O D.R2O55、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
6、(2018•苏州)高锰酸钾和浓盐酸发生如下应:2KMnO4+16HCl=2KCl+2MnCl2+5X↑+8H2O,根据质量守恒定律,推测X应是()A.HClO B.ClO2C.O2D.Cl27、4K2Cr2O8==4K2CrO4+2R+3O2求R的化学式为。
题型3 计算相对分子质量1.有化学反应3A+B=C+3D,已知A、B、C的相对分子质量分别为98、160、400,D的相对分子质量为______。
2.在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为____。
题型4 求反应物或生成物化学式前的系数1.2008年奥运会“祥云”火炬中燃料燃烧后不会对环境造成污染,体现了“绿色奥运”的理念。
反应的化学方程式为CxH8+5O2=== 3CO2+4H2O,则x的数值是()A.1 B.2 C.3 D.42、a C3H6+b O2==c CO2+d H2O 找出a、b、c 之间的等量关系。
________________、__________________、________________题型5 确定组成物质的元素种类1.某物质加热分解产生氧化铜和水。
则该物质含有的全部元素是()A.Cu、O B.Cu、O、H C.O、H D.Cu、H2.根据蜡烛燃烧后生成水蒸气和二氧化碳的实验事实,可以推断石蜡(蜡烛的主要成分)的组成里一定含有()A.碳一种元素B.氢一种元素C.碳和氢两种元素D.碳、氢、氧三种元素3.将4.6 g某化合物在空气中完全燃烧,共得到8.8 g 二氧化碳和5.4 g水,则该化合物的组成元素是()A.一定含有碳、氢两种元素 B.一定含有碳、氢元素,可能含有氧元素C.一定含有碳、氢、氧三种元素 D .只含有碳元素4. 某化合物完全燃烧,需要4.8 g氧气,同时只生成4.4 g二氧化碳和2.7 g 水,则该化合物中()A.只含有碳、氢两种元素B.只含有碳、氧两种元素C.含有碳、氢、氧三种元素D.无法确定题型6 求反应中物质之间的质量比1.现有mgKClO3跟2gMnO2混合加热,完全反应后剩余固体物质的质量是ng,则生成氧气的质量是( )A.(m-n)g B.(m+2n)g C.(m+2 -n)g D.(n -2)g 2.根据质量守恒定律,4g碳和4g氧气充分反应后,生成二氧化碳的质量是_________3.4gA物质与5gB物质混合反应,能生成6gC物质,剩余3gB。
若将7gA与3gB混合反应,则生成C物质的质量是( )A.9g B.10g C.8g D.3g4.(2018•恩施州)现将10gA和足量的B混合加热,A和B发生化学反应,10gA 完全反应后生成8gC和4gD,则参加反应的A与B的质量比是()A.1:1 B.2:1 C.5:1 D.4:15.将A、B、C各10g的混合物加热后,A全部参加反应,生成4gD,同时增加了8gC,则反应中A与B的质量比是( )A.1:5B.l:4C.4:l D.5:l 6.甲、乙、丙三种物质在一定条件下可以反应生成丁,在该条件下若取甲、乙、丙各15g,使之充分反应,则只能得到30g丁。
若增加10g丙,则甲和丙可恰好完全反应。
甲和乙反应时的质量比应为()A、1:1B、2:1C、2:3D、3:27、A、B、C三种物质各15 g,它们化合时只能生成30 g新物质D。
若增加10 gA,则反应停止后,原反应物中只余C。
根据上述条件推断下列说法中正确的是( )A.第一次反应停止后,B剩余9 g B.第二次反应后,D的质量为50 gC..反应中A和B.的质量比是3∶2 D.反应中A和C.的质量比是5∶28.已知A、B两种物质反应生成C:A+B→C。
用7gA和2gB或4gA和5gB充分反应都可以得到6gC。
现取A、B固体混合物共充分反应后得到7.5gC。
此混合物中A和B的质量分别是____。
题型7 微观示意图类1、下列示意图形象地表示了A与B反应生成C.其反应前后分子及数目的变化,则该反应的化学方程式中,A、B.、C.的化学计量数之比为A.2∶1∶2B.1∶2∶2C.1∶1∶1D.2∶2∶32. (广州)化学是在原子、分子的水平上研究物质及其变化规律。
请回答下列关于水与过氧化氢(H2O2)的问题:(1)H2O2中氧元素的化合价为__________。
(2)1个过氧化氢分子中含有__________个H,__________个O。
(3)写出下列反应的化学方程式:①水通电后分解:____________________;②过氧化氢分解:___________________。
3. (重庆B卷)学习化学后,我们学会了从微观角度认识物质。
(1)已知碳原子和氧原子的结构示意图分别为:两种原子中相等的是__________(填序号)。
A .质子数B、电子数C、第一层电子数D、第二层电子数(2)保持一氧化碳化学性质的粒子名称是___________。
(3)下图是一氧化碳与氧气反应的微观模型图,请在下图方框中以图示的方式完成该化学反应的微观过程(图中表示氧原子,Ο表示碳原子)。
[3、化学方程式微观模拟图例四种物质A、B、C和D的微观示意图见下表。
物质 A B C D ——氢原子——氧原子——硫原子微观示意图图例说明(1)1个A分子中含有个原子。
(2)这四种物质中,属于单质的有(填表中字母)。
(3)物质D中氢、氧元素的质量比为(结果用最简整数比表示)。
(4)常温下A和B反应生成C和D。
请用化学方程式表示此反应。
练硫元素有-2、+4和+6价。
(1)请写出相应的化学式:硫化氢,+6价硫元素的氧化物。
(2)观察某一反应的微观图示(如下图)并填空。
①从上图可看出,反应前有1个二氧化硫分子和2个硫化氢分子。
那反应后呢?请根据上图,用化学用语准确回答:、。
②请判断:此图示(填“能”或“不能”)反映质量守恒定律。
(3)请用化学方程式表示此反应练习10右图是某个化学反应前、后的微观模拟图。
请根据图示回答:①该化学反应中,参加反应的反应物和生成物的各粒子间的个数比为;②该反应的基本反应类型为;③该反应中的生成物________(填“可能”或“不可能”)属于氧化物。
题型8 密闭容器内的反应1.(2018 • 绥化)在一密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应的认识正确的是()物质X Y Z Q反应前质量/g 20 2 1 37反应后质量/g 15 32 1 未知A.物质Y一定是单质B.反应后物质Q的质量为12gC.反应过程中X、Q的质量比为9:4D.物质Z一定的该反应的催化剂2.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如表:物质甲乙丙丁反应前质量/ g 4 1 42 10反应后质量/ g 待测20 6 31 关于此反应,下列认识正确的是 ( )A.该变化的基本反应类型一定是置换反应B.B.参加反应的甲、丙的质量比为1:9C.乙、丁的相对分子质量比一定为10:9 D.甲反应后的质量为8 g 3.(2018•衡阳)甲、乙、丙、丁种种物质在反应前后的质量关系如图所示,下列有关说法错误的是()A.参加反应的甲和乙质量比为2:7 B.丙可能是该反应的催化剂C.丁一定是化合物 D.x的值是74、在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:物质X Y Z Q反应前质量/ g 8 2 20 5反应后质量/ g 待测10 8 13 下列说法正确的是()A.反应后X的质量为6 g B.该反应的反应物是X、YC.参加反应的X、Z的质量比是1:3D. Y、Q的相对分子质量比一定为1:1 5.(2018•南京)在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。
图中a、b、c、d分别表示相应物质的质量分数。
下列数据正确的是()A.a=56% B.b=6% C.c=17% D.d=8%6.硫粉在耐高温的密闭容器(含空气)中加热,下列图示能正确表示容器中所盛物质质量变化的是( )m m m m0 t 0 t 0 t 0 tA B C D题型8 根据信息书写化学方程式练习:1、发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气和水蒸气组成。
试写出反应的化学方程式。
2、砷化氢AsH3是一种很强的还原剂,在室温下它能在空气中自燃,其氧化产物是砒霜(As2O3),写出该反应的化学方程式:3、将黑色氧化铜粉末装入试管中加热,通入氨气(NH3)则生成红色的铜、水和一种气体单质,该反应的化学方程式:4.饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱。
