联碱法各工段流程图
联合制碱ppt 人教课标版(1)

① >35℃ NH4HCO3会有分解
(1)反应温度控制在30—35℃,是因为若高于35℃,则_____;若低于30℃则_____; 为控制此温度范围,应采取的加热方法是____________。 (2)加料完毕后,继续保温30分钟,目的是_____;只析出NaHCO3 晶体的原因是 _____;用蒸馏水洗涤NaHCO3 晶体的目的是除去_____杂质(以化学式表示) (3)过滤所得母液中含有________(以化学式表示),需加入_____,并做进一步处 理,使NaCI溶液循环使用,同时可回收NH4Cl。
NH 3
NH 3
沉淀 池
煅烧炉
Na 2CO
母液
(提取副产品) (1) 副产品的一种用途为 。 (2)使原料氯化钠的利用率从70%提高到90%以上,主要 是设计了 的循环。
巩固与提高: 1862 年 比 利 时 人 索 尔 维 以 NaCl 、 CO2 、 NH3 和 H2O为主要原料,制得纯净的碳酸钠,叫索尔维制 碱法。其主要操作是:①在氨化饱和食盐水中通 入二氧化碳,制得小苏打;②把小苏打在250℃下 焙烧以制得碳酸钠,二氧化碳循环使用;③析出 小苏打的母液里加入生石灰,使氨循环使用。阅 读上述材料,回答以下问题: 1)饱和食盐水要先氨化,再通入二氧化碳的原因 NH3比CO2溶解度大,先使氨饱和有利用于CO2吸收 是_____________________________________ 在这个生成NaHCO3过程中,两步相关的化学方程 NH3+CO2+H2O → NH4HCO3;NH4HCO3+NaCl → NaHCO3+NH 式是: _______________________________________
5.3化工生产--侯氏制碱法1-lu

纯碱工业的发展史:
纯碱是重要化工原料,广泛应用于玻璃工业、钢 铁工业、化学工业、医药工业、搪瓷、纺织、印 染、造纸、食品等。纯碱工业始于18世纪末,法 国人勒布朗,比利时人索尔维,中国人侯德榜等, 都先后作出了突出的贡献。
饱 过滤 和 通NH3 氨 洗涤 食 盐 盐 水 通CO2 水 石灰石 煅烧
(3) 写出上述流程中X物质的分子式 CO2 。
联合制碱法或侯德榜制碱法
食盐水 CO2 NH3 X 循环II 沉淀池 循环I NH3 母液 (提取副产品) 煅烧炉 Na2CO3
合成氨厂
(4) 使原料氯化钠的利用率从 70%提高到90%以上,主要是设计 I 了 (填上述流程中的编号)的循环。从沉淀池中取出沉 过滤 淀的操作是 。 (5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后, 稀硝酸和硝酸银溶液 再滴加 。 (6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨 a、c。 气的作用有 (a)增大NH4+的浓度,使NH4Cl更多地析出 (b)使NaHCO3更多地析出 (c)使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度
流程图(联合制碱法)
1、合成氨工厂的反应: N2的制取:空气液化 高温 高温 H2、CO2的制取: C+H2O(g)→ H2+CO 、CO+H2O(g) → H2+CO2 NH3的合成: N2+3H2 → 2NH3 2、向已经氨化的饱和食盐水中通入二氧化碳 NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓(析出) 3、 加热碳酸氢钠,得到碳酸钠 2NaHCO3→Na2CO3+H2O+CO2 (循环使用)
侯式制碱法原理与简单流程图

精锐教育学科教师辅导讲义学员编号:年级:高三课时数:3学员:辅导科目:化学学科教师:授课主题侯式制碱法原理和简单流程教学目的侯氏制碱法在高考中占有比较特殊的地位,出现的几率较大;常考的知识点是侯氏制碱法的原理、温度的选择、母液的成分、处理及与氨碱法的优劣比较,学生在温度的控制和母液的处理上出现的错误几率较大。
教学容1.【2013年高考6】与索尔维制碱法相比,侯德榜制碱法最突出的优点是()A.原料利用率高 B.设备少C.循环利用的物质多 D.原料易得2.【2012年高考八】碳酸氢铵是一种重要的铵盐。
实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱。
完成下列填空:41.二氧化碳通入氨水的过程中,先有________晶体(填写化学式)析出,然后晶体溶解,最后析出NH4HCO3晶体。
3.【2010年高考27】工业生产纯碱的工艺流程示意图如下:完成下列填空:1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B2)实验室提纯粗盐的实验操作依次为:取样、、沉淀、、、冷却结晶、、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是。
碳酸化时没有析出碳酸钠晶体,其原因是。
内容回顾4)碳酸化后过滤,滤液D 最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
5)氨碱法流程中氨是循环使用的,为此,滤液D 加入石灰水产生氨。
加石灰水后所发生的反应的离子方程式为: 滤液D 加石灰水前先要加热,原因是。
6)产品纯碱中含有碳酸氢钠。
如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:(注明你的表达式中所用的有关符号的含义)4.【2005年高考五26(A )】我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:(1) 上述生产纯碱的方法称,副产品的一种用途为。
(2) 沉淀池中发生的化学反应方程式是。
(3) 写出上述流程中X 物质的分子式。
联碱生产工艺

侯氏制碱法
(1)NH3+ H2O + CO2==== NH4HCO3 (2) NH4HCO3 + NaCl(饱和) == NH4Cl+
NaHCO3↓(平时这样的反应一般认为不进 行,但是由于在某个温度下,碳酸氢钠的 溶解度较低,会沉淀出来,所以这个反应 能够一定程度上进行)
• 但路布兰法存在产品纯度差,生成成本高 ,人工消耗大,难以连续作业等缺点,遂 有索尔维法问世,并取而代之。
索尔维法制碱
• 1861年比利时人索尔维,在煤气厂从事稀 氨水浓缩时,发现用盐水吸收氨和二氧化 碳可得到碳酸氢钠。当年该法获得专利, 即为索尔维法,后人又称之为氨碱法。并 取代了路布兰法,在欧洲乃至世界逐渐发 展起来并延续至今。
(3)2NaHCO3=Δ== Na2CO3+ H2O+ CO2↑
• 即:
•
①NaCl(饱和) + NH3+ H2O + CO2==== NH4Cl
+ NaHCO3↓
•
②2NaHCO3=Δ== Na2CO3+ H2O + CO2↑
•
氨气与水和二氧化碳反应生成一分子的碳酸
氢铵,这是第一步。第二步是:碳酸氢铵与氯化
主要化学反应为:
清洗塔
碳 化 尾 气
综
中和泵 尾 气回 收 合
联合制碱生产工艺流程
重碱工艺(一过程)
氯化铵来MⅡ
AⅠ去氯化铵
1.工艺流程
该工序主要是利用氨母液
吸收 NH3 AⅡ
澄清桶
AⅠ NH3 吸收
Ⅱ在碳化塔中吸收二氧化碳, 制得碳酸氢钠结晶及适合二过 程要求的氨母液Ⅰ,达到氯化
5.3化工生产――纯碱的制备PPT课件

(5)如何验证D中试管中的产物?
1
23 4 5
6
A
B
C
D
E
3、已知纯碱试样中含有NaCl杂 质。为测定纯碱的质量分数,可 用图中装置进行实验。
主要实验步骤如下: ① 按图组装仪器,并检查装置的气密性 ② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液 ③ 称量盛有碱石灰的U型管的质量,得到 b g ④ 从分液漏斗滴入6 mol / L的硫酸,直到不再产生气体时为止 ⑤ 从导管A处缓缓鼓入一定量的空气 ⑥ 再次称量盛有碱石灰的U型管的质量,得到c g ⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
(4 )→(5 )。 (3)各装置中盛放的试剂是A——C—a—(O——H—)—2——N—H——4C——l —B——H—C—l———C—a—C—O—3
C—饱——和——N—a—H—C——O—3—溶——液——D——冰—水—————————。 (4)D装置试管中应有的现象是—产——生——白——色——沉—淀————;用烧杯中的冰水
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量 试样溶于水后,再滴加
_____稀__硝__酸__和__硝__酸__银__溶__液___。
2、中国化学家侯德榜发明的“侯氏制碱法”大大提高了原料的利用率。化学实
验室利用有关原理制备碳酸氢钠,模拟工业流程。其方法是:把固体氯化钠溶
解在浓氨水里制成饱和溶液,再通入二氧化碳气体,即有碳酸氢钠析出。有关
方程式为:NH3+CO2+NaCl+H2O
NaHCO3+NH4Cl+Q
联碱设备简介

煅烧炉(回转炉)型号及数量: 煅烧工段共有轻灰煅烧炉8台,重质碱煅烧炉1台,凉
NacL
吸氨
冷析
AI
分离(干燥) 氯化铵
根据实际生产情况,事业部现在设有五个工段(车 间),从所包括的工序来讲大致可分为:
压缩工段: CO2压缩、冰机制冷、循环水等工序; 碳化工段:
母液吸氨、淡液及母液蒸馏、氨母液Ⅱ碳酸化、重碱过 滤等工序; 煅烧工段:
重碱煅烧、轻灰凉碱、重灰、小苏打等工序; 结晶工段:
两相混合物的机器。氯化铵晶浆从冷析 结晶器取出到冷析稠厚器稠厚后,供滤 铵机(即离心机)分离。
这种离心机的工作原理是,由电动机带 动三角皮带轮传递给主轴同回转体一起作 回转运动,另一个是在空心轴中中由油压 的作用,由回塞带动推料器作往复运动。 前一个运动完成离心分离作用,后一个运 动是实现卸料作用,后一个运动是实现卸 料作用,两者同时运动构成了过滤、卸料 的自动连续生产过程
冰机的型号: 压缩工段共有冰机16台 LG31.5A螺杆冰机10台 LG25螺杆冰机6台套
碳化工段
一、碳化工段 氨母液Ⅱ碳酸化过程俗称碳化。是将氨
母液Ⅱ在碳化塔内吸收CO2,使其中的 Na2CO3和氨转化成NH4CL,并冷却使 NaHCO3结晶析出,形成NaHCO3悬浮液。
碳化塔
一、碳化塔的作用及简介
碳化塔是纯碱生产中碳酸化过程的主要设 备。其作用是以CO2气和氨盐水为原料, 在塔内进行化学反应,生成NaHCO3悬浮 液,这个反应是个很复杂的过程,总的示 意反应方程式即
联合制碱工业

比较侯德榜制碱法和氨碱法的流程图,分析两者 的异同点?
相同点: 原理相同 不同点:
原料
母液处理方法 循环物质 优缺点
抄课本p112
原料
母液处理方法 循环物质 优缺点
NaCl,CaCO3,NH3
NaCl ,CO2,NH3
Ca(OH)2+2NH4Cl →2NH3+CaCl2+2H2O
CO2 NH3
循 环
NaCl+ NH4HCO3 →
NaHCO3↓+ NH4Cl
△
2NaHCO3 → Na2CO3 + H2O + CO2
高温
母 CaCO3 → CaO + CO2
液 处
CaO + H2O → Ca(OH)2
理
△
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
思考:索尔维也经历过很多失败,当他把食盐水与 碳酸氢铵溶液混合时,有时并没有看到沉淀,为什 么?
联合制碱工业
在中国化学近代工业史上,有一位杰出的科学家, 猜一猜他是谁? 侯德榜
纯碱的用途有哪些?
制玻璃
制肥皂
造纸
乌 鲁 木 齐 郊 区 盐 碱 地
天 津 碱 厂
廉价的原料
N aCl CaCO3
△
NaOH
纯碱:Na2CO3 Na+
CO32-
CaO + CO2 NH3·H2O
你可以通过哪些学过的化学方法制Na2CO3 ?
例2、我国化学侯德榜改革国外的纯碱生产工 艺,生产流程可简要表示如下:
(1)上述生产纯碱的原料是
,纯碱的一种
联碱法
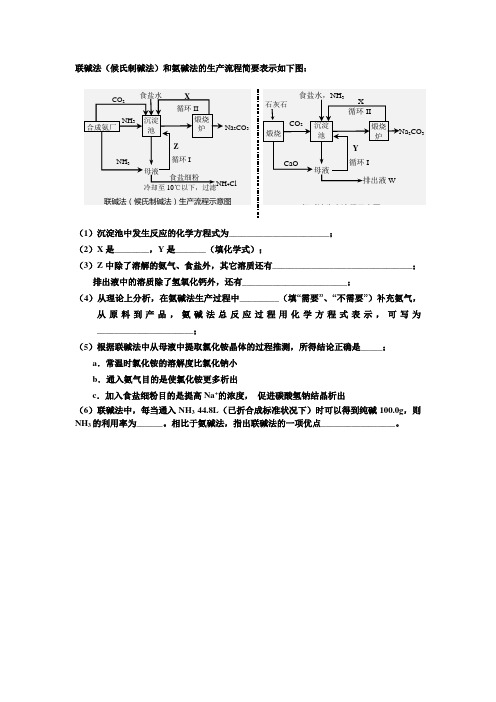
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
(1)沉淀池中发生反应的化学方程式为_______________________;
(2)X是________,Y是_______(填化学式);
(3)Z中除了溶解的氨气、食盐外,其它溶质还有________________________________;
排出液中的溶质除了氢氧化钙外,还有________________________;
(4)从理论上分析,在氨碱法生产过程中_________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为______________________;
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是_____;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为______。
相比于氨碱法,指出联碱法的一项优点_________________。
纯碱生产工艺流程 ppt课件

《生产领域产品质量管理与监督》课程
2
常州工程职业技术学院制药与生物工程技术系
氨碱法生产纯碱反应原理2
所用的氯化钠溶液中或多或少地含有Ca2+、
Mg2+等杂质离子,它们在氨化或碳酸化过程中会
生成CaCO3、Mg(OH)2、MgCO3及其它不溶性复盐, 堵塞设备与管道,影响传热和成品质量。故盐水
在进入吸氨塔前必须除去这些杂质。
《生产领域产品质量管理与监督》课程
纯碱生产工艺流程
常州工程职业技术学院制药与生物工程技术系
氨碱法生产纯碱反应原理1
氨盐水碳酸化生成碳酸氢钠沉淀 NaCl + NH3 + CO2 +H2O → NaHCO3 + NH4Cl 这一过程在碳酸化塔中进行。
由于NaCl水溶液不能吸收CO2,故如上式所 示,NH3与CO2同时通入时CO2的吸收率是很低 的。因此,必须先用NaCl溶液吸收NH3,再吸收 CO2。吸氨是在吸氨塔中完成。
精制方法是加入碱性物质如NaCO3和NaOH等。 使Mg2+生成Mg(OH)2沉淀,使Ca2+生成CaCO3沉淀。
Mg2+ + 2OH → Mg(OH)2↓ Ca2+ + CO32- → CaCO3↓ 生成的沉淀可借沉降法除去。沉淀除去Ca2+、
Mg2+以后的盐水,称为精制盐水。
《生产领域产品质量管理与监督》课程
《生产领域产品质量管理与监督》课程
13
常州工程职业技术学院制药与生物工程技术系
侯氏制碱法2
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
微专题化工生产纯碱工业(侯氏制碱法和索氏制碱法)
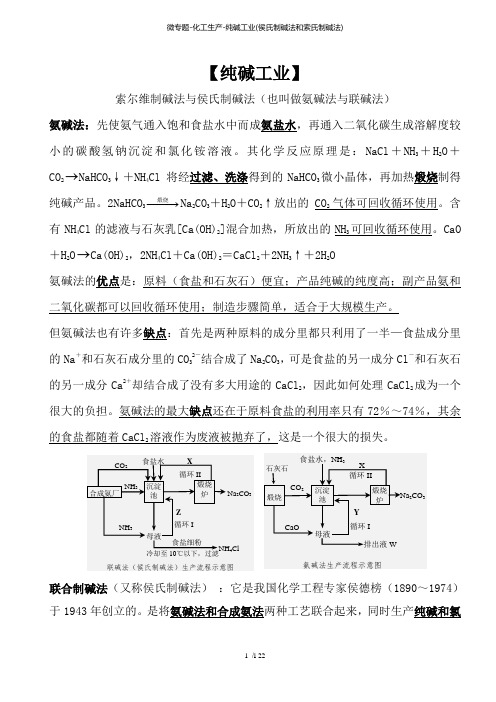
【纯碱工业】索尔维制碱法与侯氏制碱法(也叫做氨碱法与联碱法)氨碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl +NH 3+H 2O +CO 2→NaHCO 3↓+NH 4Cl 将经过滤、洗涤得到的NaHCO 3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO 3−−−→煅烧Na 2CO 3+H 2O +CO 2↑放出的CO 2气体可回收循环使用。
含有NH 4Cl 的滤液与石灰乳[Ca(OH)2]混合加热,所放出的NH 3可回收循环使用。
CaO +H 2O →Ca(OH)2,2NH 4Cl +Ca(OH)2=CaCl 2+2NH 3↑+2H 2O氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的Na +和石灰石成分里的CO 32-结合成了Na 2CO 3,可是食盐的另一成分Cl -和石灰石的另一成分Ca 2+却结合成了没有多大用途的CaCl 2,因此如何处理CaCl 2成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着CaCl 2溶液作为废液被抛弃了,这是一个很大的损失。
联合制碱法(又称侯氏制碱法) :它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳(合成氨厂用水煤气制取氢气时的废气,其化学反应原理是:C+H2O→CO+H2 CO+H2O→CO2+H2)联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
联合制碱

SO4 0.1 %6 B! F# J5 w. I$ `, h8 N& R3 B T
粒度(大于20目) 3 %
4 e4 j0 _! g$ Q A( N6 A, @5 t(2)CO2 是制碱装置的另一主要原料。本装置采用变换气制碱法,直接利用变换气作为碳酸气用以制碱。这样既简化了合成氨的净化流程,又提高了CO2的利用率,使本装置的原料CO2的供应有可靠的保证。合成氨所供应的变换气的规格如下:
因此,若是采用原盐作为原料,在它进入氯化铵工序之前,必须设置原盐精制工序,但是,设置了原盐精制工序,将使整个制碱工艺变得冗长。装置占地将增加,同时盐卤水处理这一环保问题的解决也比较困难,综上所述,本装置选用精制过的洗盐,粒度符合要求的优质洗盐作为联碱装置的原料。本项目选用的优质洗盐的规格如下: ~ f R) n; P, n9 & y, v4 I4 ~
$ u; b( ) B& ~2 Z' z& N& ^1.2我国纯碱行业概况2 M8 j+ S r, S, $ N
我国的纯碱工业始于20世纪200年代。当时我国纯碱工业的先躯、爱国实业家范旭东和化学家侯德榜在天津创办永利碱厂(即现在的天津碱厂),发展民族纯碱工业,这是我国第一个纯碱生产厂。侯氏于40年代开发了联合制碱技术(即侯氏制碱法),为我国发展纯碱工业作出了巨大贡献。但在旧中国,民族工业步履维艰。1 K, u h3 _ F# t% E n
纯碱生产工艺流程 ppt课件

(6)
《生产领域产品质量管理与监督》课程
5
常州工程职业技术学院制药与生物工程技术系
氨碱法生产纯碱反应原理5
氨盐水碳酸化所使用的、蒸馏氯化铵所需要的 石灰乳是由石灰石煅烧而得到的。
(7) 石灰石的煅烧是在石灰窑中进行的。产生的气, 浓度在40%左右,称为窑气,经过除尘、冷却和 压缩后送入碳酸化塔中部用作碳酸化,得到的固 体产品即为石灰。
联碱法生产纯碱反应原理
联碱法以食盐、氨及合成氨工业副产的二氧化
碳为原料,同时生产纯碱及氯化铵,即联合产纯
碱与氯化铵,简称"联合制碱"或称"联碱"主要反
应为:
➢ NaCl+NH3+H2O+CO2= NaHCO3 ↓+NH4Cl NaHCO3 = Na2CO3+CO2↑+H2O↑根据加 入原料的次数及析出氯化铵温度的不同,联合制
联碱工艺流程

联碱工艺流程简介联碱生产按工序可分为碳滤、压缩、煅烧、重灰、重灰包装、结晶、制冷、干铵、干铵包装9个工序。
一:碳滤工序碳滤工序包括碳化、过滤、综合回收几个过程。
碳化过程碳化过程是利用氨母液II在碳化塔中吸收CO2生成NaHCO3结晶同时生成NH4Cl的过程。
碳化塔里的反应可用方程式NaCl+NH3+CO2+H2O NaHCO3 +NH4Cl来表示。
液相流程用方框图表示为:碳化尾气中含有大量的气氨,需经过综合回收后才能排放;其气相流程可用以下方框图表示:碳化过程是一个放热反应过程,反应过程中有大量的反应热需要移走;本工艺选用循环水冷却,下进上出间接换热闭路循环,在此不做介绍。
碳化取出液经取出槽至过滤机,气相里同样含有大量的气氨需经引风机引至净氨塔净氨后放空;过滤机上方以及MI桶放空气体同时净氨后放空。
过滤过程过滤过程是利用真空过滤原理将碳化取出液里的NaHCO3结晶分离出来,同时利用洗水降低NaHCO3里的NaCl含量;滤液去MI桶,NaHCO3结晶去煅烧;过滤尾气经净氨后去压缩工序。
用方框图可表示为:综合回收过程综合回收主要是回收碳化、过滤尾气及煅烧冷凝液里的氨;同时实现用水的回收利用。
煅烧冷凝液回收可用以下方框图表示。
碳化尾气经综合回收后放空、过滤尾气经综合回收后去压缩工序;其回收流程可用以下方框图表示:二、压缩工序压缩工序包括压缩和真空两个环节;压缩是利用压缩机将合成送过来的含98.5%和68.77%的CO2以及回收的煅烧炉气压缩、冷却后分中、下段送入碳化塔。
可用以下方框图表示。
真空环节是利用真空机抽吸过滤尾气放空,起到使过滤机连续稳定运行的作用。
三、煅烧工序煅烧工序使用蒸汽在煅烧炉内加热碳化工序送过来的NaHCO3结晶使之分解生成Na2CO3成品同时对炉气进行回收洗涤的过程。
在煅烧炉内发生以下化学反应: 2 NaHCO3 Na2CO3 + H2O +CO2 其流程可用以下方框图表示:因煅烧炉气中含有大量的CO2气、氨气及碱尘,CO2气和氨气是联碱生产的原料气;碱尘回收及是产品;而这些气体如不加以回收不光对环境造成污染,还增加生产成本。
简述联合制碱法的工艺流程

简述联合制碱法的工艺流程联合制碱法可是个超有趣的化学工艺呢!联合制碱法啊,它有自己独特的一套流程。
它的原料主要是食盐、氨和二氧化碳。
那这些原料怎么开始它们的奇妙之旅呢?咱们先说说氨。
氨在这个过程中可起着很重要的作用呢。
氨先被通入饱和的食盐水里面。
这个时候啊,溶液就发生了很神奇的变化。
会形成一种氨化的饱和食盐水。
这就像是给溶液施了魔法一样,让它具备了特殊的性质。
接下来就轮到二氧化碳出场啦。
二氧化碳被通入到刚才形成的氨化饱和食盐水中。
这一进去呀,就会发生化学反应。
这个反应可不得了,会生成碳酸氢钠沉淀。
你能想象到吗?溶液里突然就出现了小颗粒一样的碳酸氢钠沉淀,就像变魔术似的。
碳酸氢钠沉淀在这个过程里就像是个调皮的小客人,突然冒出来了。
然后呢,要把碳酸氢钠沉淀过滤出来。
这就好比把调皮的小客人从一群小伙伴里挑出来一样。
把碳酸氢钠沉淀过滤出来之后,就可以对它进行加热了。
加热后的碳酸氢钠会分解呢,就像小客人变身了一样,变成了碳酸钠。
碳酸钠可是个很有用的东西哦,我们平常用的很多东西里都有它的身影。
那溶液里剩下的东西也没被浪费哦。
溶液里还含有氯化铵呢。
氯化铵也有它自己的用途。
可以通过一些后续的处理,把氯化铵分离出来。
这样整个联合制碱法的流程就差不多完成啦。
你看,联合制碱法的这个流程就像是一场精心编排的舞台剧。
每个原料都像舞台上的演员,在不同的环节发挥着自己的作用。
氨就像个开场的小引子,把整个故事拉开序幕。
二氧化碳一进来,就和氨以及食盐水共同演绎出碳酸氢钠沉淀这个小高潮。
然后把碳酸氢钠沉淀挑出来加热,这就像是给这个小高潮来了个后续的精彩延续。
最后剩下的氯化铵也能找到自己的归宿。
整个流程充满了化学的奇妙和智慧,是不是很有趣呢?而且啊,联合制碱法还有很多优点呢。
它不像一些老的制碱方法会有很多浪费或者产生很多污染。
它是一种比较环保和高效的制碱方法。
这就像是一个聪明的工匠,用最少的材料做出最好的东西,还不把周围环境弄得乱七八糟的。
