罗匹尼罗中间体2—甲基—3—硝基苯乙腈的合成
盐酸罗匹尼罗合成进展

摘
要: 盐酸 罗 匹尼 罗是 一 种 强 效 的选 择 性 非 麦 角碱 类 多 巴胺 D 一 2受体 激 动 剂 , 独 或 作 为 L d p 单 — o a的 辅 助 药 物 可 用
于 治 疗 帕金 森痛 , 可 用于 治 疗 中度 或 重 度 的 多动 腿 综 合 症 。对 盐酸 罗 匹 尼 罗合 成 方 法进 行 了归 纳 和 比较 , 期 为 其 进 也 以
动 腿综合 征 ( L ) R S 。因其适 应症 广 、 耐受性 好 、 量 小 剂
等 优点 , 酸罗 匹尼罗 越来越 受 到人们 的关 注 。 盐
HO C O BH3 I / - TI F
S oCl ,
) B / HF , H T 1
NH(-r2 nP 1
( COOE )/ oK t2Et
一
步 研 究及 工 业 化 生 产 提 供 参 考 。
关键词 : 盐酸 罗 匹 尼 罗 ; 巴胺 D 一 多 2 受体 激 动 剂 ; 成 合 中图 分 类 号 : 6 R 9 2 TQ 4 7 文献标识码 : A 文 章 编 号 :6 2 4 5 2 0 ) 4 0 1 4 1 7 —5 2 ( 0 8 0 —0 2 —0
盐 酸 罗 匹 尼 罗 ( o ii l h do hoie , 学 R pnr e y r c lr ) 化 o d
迄今 为止 , 文献 报 道 盐 酸罗 匹 尼 罗 主要 是 以 5种
名 为 4E -二丙 胺 基 )乙 基31 3 -氢 吲 哚一一 盐 酸 -2( 一 -,-" 2酮
盐 , 英 国 S t ieB e h m 公 司 开 发 的早 期 帕 系 mi Kl - ec a h n
胺 D一 受体激 动剂 , 直接 激 发纹 状 体 多 巴胺 受 体 , 可 从 而改 善运 动迟缓 、 直和震 颤及 抑郁 情绪 , 高患 者 的 僵 提
罗匹尼罗的合成

3-硝基邻二甲苯的制备在500mL三颈瓶中加入122.0mL(1mol)的邻二甲苯,冷却至-5℃,在搅拌条件下将配好的180.5mL混酸(71.0mL65%硝酸和109.5mL98%浓硫酸)在10~5℃间滴入邻二甲苯中,继续搅拌30min,静置分层,分去下层废酸,依次用水、5%NaOH水溶液、水洗涤,干燥,分馏得馏份75.6g,bp128~130℃(26.66mbar),1.22-甲基-3-硝基苄*二醋酸酯的制备在装有机械搅拌的三颈瓶中加入5.3mL(0.04mol)3-硝基-邻二甲苯和47 mL乙酐、57mL冰醋酸,搅拌至全溶,在冰盐浴中冷却至0℃左右滴加浓硫酸,再将由10.0g(0.1mol)三氧化铬与30mL乙酸酐配成的溶液在5~10℃条件下滴入反应液中,并且在该条件下继续搅拌3h,后处理方法与文献〔3〕相同.得到黄色透明雪花状固体mp84~86℃.1.32-甲基-3-硝基苯甲醛的制备在250mL的圆底烧瓶中依次加入21.05g(0.079mol)2-甲基-3-硝基苄*二醋酸酯(4)、120mL50%乙醇和5mL浓硫酸一同加热回流3h,参照文献〔3〕分出水层处理得产物;1.42-甲基-3-硝基苄基腈的制备取4.15g(0.0251mol)的2-甲基-3-硝基苯甲醛(5)溶于60mL的甲醇中冰水浴冷却至5℃,将0.7g硼氢化钠分批加入冷的溶液中后反应1h,室温放置过夜,将反应液稀释于120mL冰水中,分出油层,用15mL干燥苯,分3次带水,减压蒸出溶剂得油状物〔(6)的粗品〕;向上述油状物3.59g(0.02mol)中加入35mL无水乙醚,分4次滴加三氯化磷共6mL,回流,用TLC检测终点,反应结束后,将冷的反应液倒入50mL冰水中,分出水层,用水洗醚层,醚层用Na2SO4干燥,减压浓缩得氯代物(粗品).在上述(0.0099mol)氯代物中加入1.0g氰化钠和97mL75%乙醇,回流2.5h,反应液倒入150mL水中,放置过夜,得浅黄色结晶,过滤,重结晶,得无色粉末状固体,过滤,真空干燥得产物,mp80~81℃;1.52-甲基-3-硝基苯甲酸的制备(略)1.62-甲基-3-硝基苯甲酰二正丙基乙酰胺的制备22克2-甲基-3-硝基苯甲酸加入25ml氯化亚砜,75C回流1h,反应液真空浓缩,甲苯抽提3~5次(共约100ml),混合抽提液,10C下加入13gNa2CO3(13g+150ml水),与n-二丙胺(150ml甲苯中含10.6g0.12moln-二丙胺)缓慢搅拌,30min后,除去冰浴,继续搅拌1h,加入0.5g固体Na2CO3,15min 后,分离有机层,5%的Na2CO3洗涤,接着用2NHCl洗,最后用水,有机液用Mg2SO4干燥,真空浓缩到无溶剂,得2-甲基-3-硝基苯基-N,N-二正丙基乙酰胺;1.72-甲基-3-硝基苯甲酰二正丙胺的制备2.105nmol2-甲基-3-硝基苯基-N,N-二正丙基乙酰胺溶解在250ml无水四氢呋喃中,加入1mol B2H6试剂160ml,室温放置1h,接着回流2h,冷却,过量试剂用无水甲醇破坏,真空浓缩,残液用40ml6N HCl酸化1h,冷却,再用40%NaOH碱化Ph=8。
盐酸罗匹尼罗的合成

盐酸罗匹尼罗的合成
孙平华;陈卫民;李冰洲;杨兆琪;李茜
【期刊名称】《中国医药工业杂志》
【年(卷),期】2007(38)1
【摘要】2-甲基-3-硝基苯乙酸经氯代、酰胺化、还原得N,N-二丙基-2-甲基-3-硝基苯乙胺,与草酸二乙酯缩合、水解后还原得到2-硝基-6-[2-(二丙胺基)乙基]苯乙酸,最后经还原、缩合闭环及成盐反应制得盐酸罗匹尼罗,总收率约36%。
【总页数】2页(P7-8)
【关键词】罗匹尼罗;多巴胺D2受体激动剂;合成
【作者】孙平华;陈卫民;李冰洲;杨兆琪;李茜
【作者单位】暨南大学药学院
【正文语种】中文
【中图分类】R972
【相关文献】
1.盐酸罗匹尼罗合成工艺的改进 [J], 余长泉;杨健;许惠钢
2.盐酸罗匹尼罗渗透泵型控释片的药代动力学研究 [J], 张婉直;王秀华;惠民权;吉红梅;窦建卫
3.顶空气相色谱法测定盐酸罗匹尼罗原料药的溶剂残留 [J], 张小妮;刘雪峰;王嫦鹤;刘海静
4.盐酸罗匹尼罗合成进展 [J], 黄璐;赵蓉;柯见刚;刘涛;周建明
5.盐酸匹皮尼罗合成路线分析 [J], 张径舟;孔庆新;周在富;姚远;黎庆
因版权原因,仅展示原文概要,查看原文内容请购买。
罗匹尼罗的合成

3-硝基邻二甲苯的制备在500mL三颈瓶中加入122.0mL(1mol)的邻二甲苯,冷却至-5℃,在搅拌条件下将配好的180.5mL混酸(71.0mL65%硝酸和109.5mL98%浓硫酸)在10~5℃间滴入邻二甲苯中,继续搅拌30min,静置分层,分去下层废酸,依次用水、5%NaOH水溶液、水洗涤,干燥,分馏得馏份75.6g,bp128~130℃(26.66mbar),1.22-甲基-3-硝基苄*二醋酸酯的制备在装有机械搅拌的三颈瓶中加入5.3mL(0.04mol)3-硝基-邻二甲苯和47 mL乙酐、57mL冰醋酸,搅拌至全溶,在冰盐浴中冷却至0℃左右滴加浓硫酸,再将由10.0g(0.1mol)三氧化铬与30mL乙酸酐配成的溶液在5~10℃条件下滴入反应液中,并且在该条件下继续搅拌3h,后处理方法与文献〔3〕相同.得到黄色透明雪花状固体mp84~86℃.1.32-甲基-3-硝基苯甲醛的制备在250mL的圆底烧瓶中依次加入21.05g(0.079mol)2-甲基-3-硝基苄*二醋酸酯(4)、120mL50%乙醇和5mL浓硫酸一同加热回流3h,参照文献〔3〕分出水层处理得产物;1.42-甲基-3-硝基苄基腈的制备取4.15g(0.0251mol)的2-甲基-3-硝基苯甲醛(5)溶于60mL的甲醇中冰水浴冷却至5℃,将0.7g硼氢化钠分批加入冷的溶液中后反应1h,室温放置过夜,将反应液稀释于120mL冰水中,分出油层,用15mL干燥苯,分3次带水,减压蒸出溶剂得油状物〔(6)的粗品〕;向上述油状物3.59g(0.02mol)中加入35mL无水乙醚,分4次滴加三氯化磷共6mL,回流,用TLC检测终点,反应结束后,将冷的反应液倒入50mL冰水中,分出水层,用水洗醚层,醚层用Na2SO4干燥,减压浓缩得氯代物(粗品).在上述(0.0099mol)氯代物中加入1.0g氰化钠和97mL75%乙醇,回流2.5h,反应液倒入150mL水中,放置过夜,得浅黄色结晶,过滤,重结晶,得无色粉末状固体,过滤,真空干燥得产物,mp80~81℃;1.52-甲基-3-硝基苯甲酸的制备(略)1.62-甲基-3-硝基苯甲酰二正丙基乙酰胺的制备22克2-甲基-3-硝基苯甲酸加入25ml氯化亚砜,75C回流1h,反应液真空浓缩,甲苯抽提3~5次(共约100ml),混合抽提液,10C下加入13gNa2CO3(13g+150ml水),与n-二丙胺(150ml甲苯中含10.6g0.12moln-二丙胺)缓慢搅拌,30min后,除去冰浴,继续搅拌1h,加入0.5g固体Na2CO3,15min 后,分离有机层,5%的Na2CO3洗涤,接着用2NHCl洗,最后用水,有机液用Mg2SO4干燥,真空浓缩到无溶剂,得2-甲基-3-硝基苯基-N,N-二正丙基乙酰胺;1.72-甲基-3-硝基苯甲酰二正丙胺的制备2.105nmol2-甲基-3-硝基苯基-N,N-二正丙基乙酰胺溶解在250ml无水四氢呋喃中,加入1mol B2H6试剂160ml,室温放置1h,接着回流2h,冷却,过量试剂用无水甲醇破坏,真空浓缩,残液用40ml6N HCl酸化1h,冷却,再用40%NaOH碱化Ph=8。
罗匹尼罗中间体4_2_苯甲酰氧乙基_3_氯_1_3_二氢_2H_吲哚啉_2_酮的[1]
![罗匹尼罗中间体4_2_苯甲酰氧乙基_3_氯_1_3_二氢_2H_吲哚啉_2_酮的[1]](https://img.taocdn.com/s3/m/300d0f6702768e9951e73811.png)
收稿日期:2004-10-19作者简介:王金钢(1979-),男,安徽铜陵人,硕士研究生。
联系人:王松青,电话:022*********,E 2mail :wangsg57@ 。
文章编号:1004-9533(2006)01-0029-04罗匹尼罗中间体42(22苯甲酰氧乙基)232氯21,32二氢22H 2吲哚啉222酮的合成王金钢,王松青,曾 果(天津大学药物与科学技术学院,天津300072)摘要:以苯乙醇为原料,经分子内Friedel 2Crafts 烷基化反应合成了异色满,接着开环、成盐、水解得到苯甲酸222甲酰基苯乙基酯,再和硝基甲烷反应制备22[22(苯甲酰氧基)乙基]2β2硝基苯乙烯,最后通过R oyer 反应环合生成罗匹尼罗中间体42(22苯甲酰氧乙基)232氯21,32二氢22H 2吲哚啉222酮。
产品经由薄层色谱、核磁共振谱、红外光谱分析,确为目的化合物,总收率为31151%。
关键词:罗匹尼罗;帕金森症;多巴胺D 2受体激动剂;合成中图分类号:R972 文献标识码:ASynthesis of 42[22(benzoyloxy)ethyl]232chloro 21,32dihydro 22H 2indolin 222one ,an I ntermidiate of R opiniroleW ANGJin 2gang ,W ANG S ong 2qing ,ZE NG G uo(C ollege of Pharmaceuticals and Biotechnology ,T ianjin University ,T ianjin 300072,China )Abstract :Is ochroman was synthesized from phenyl ethanol by inner m olecular Friedel 2Crafts alkylationreaction.The intermidiate of R opinirole 42[22(benzoyloxy )ethyl ]232chloro 21,32dihydro 22H 2indolin 222one was prepared from is ochroman by ring opening ,salt formation ,hydrolysis ,nitrostyrene formation and R oyer reaction.The target product was confirmed by the analysis of T LC ,1H 2NMR ,IR.The total yield is 31151%.K ey w ords :R opinirole ;Parkins on disease ;dopamine D 2receptor ag onist ;synthesis 罗匹尼罗(R opinirole )化学名42[22(二丙胺基)乙基]21,32二氢吲哚222酮,商品名为Requip ,其作为英国G lans o SmithK line 2beecham (G SK )制药公司开发的帕金森症治疗药物于1996年9月在英国首次上市[1],1998年被美国FDA 批准上市[2],目前已成为治疗帕金森病的一线药物[3]。
2-甲氧基甲基-3-甲氧基丙烯腈的制作工艺

2-甲氧基甲基-3-甲氧基丙烯腈的制作工艺2-甲氧基甲基-3-甲氧基丙烯腈是一种重要的有机合成中间体,在医药、农药、染料和涂料等领域有广泛的应用。
本文将详细介绍2-甲氧基甲基-3-甲氧基丙烯腈的制作工艺。
2-甲氧基甲基-3-甲氧基丙烯腈是一种复杂的有机化合物,其合成工艺需要注意反应条件、操作方法和材料选择等因素。
本文将从材料准备、反应条件、反应步骤、工艺优化等方面进行详细的介绍,以帮助读者更好地了解和掌握该制作工艺。
一、材料准备制备2-甲氧基甲基-3-甲氧基丙烯腈的工艺中所需的原材料主要包括甲基碱、甲醛、氢氰酸和甲氧基甲基溴等。
这些原材料应选择纯度较高的化学试剂,以保证反应的高效性和产物的纯度。
同时,还需要准备适量的有机溶剂如甲醇、氯仿等,用于反应体系的溶解和洗涤。
二、反应条件制备2-甲氧基甲基-3-甲氧基丙烯腈的反应条件十分关键。
首先,将甲醛、氢氰酸和甲氧基甲基溴加入反应瓶中,将反应混合物搅拌均匀,并通过冷却水冷却反应瓶以控制反应温度。
其次,添加适量的甲基碱作为催化剂,并继续搅拌反应体系一段时间以促进反应进行。
最后,控制反应温度在适宜的范围内,并根据反应进行情况进行反应时间的调整。
三、反应步骤制备2-甲氧基甲基-3-甲氧基丙烯腈的反应步骤如下:1. 将甲醛、氢氰酸和甲氧基甲基溴加入反应瓶中,并通过冷却水冷却反应瓶以控制反应温度。
2. 添加适量的甲基碱作为催化剂,并继续搅拌反应体系一段时间以促进反应进行。
3. 控制反应温度在适宜的范围内,并根据反应进行情况进行反应时间的调整。
4. 反应结束后,冷却反应体系并进行适当的洗涤步骤,以去除杂质和废弃物。
5. 通过适当的提纯工艺,得到高纯度的2-甲氧基甲基-3-甲氧基丙烯腈产物。
四、工艺优化制备2-甲氧基甲基-3-甲氧基丙烯腈的工艺可以通过优化反应条件、改变催化剂用量、优化原料比例等手段进行改进。
例如,可以调整甲基碱的加入时间和量,以控制反应速率和产物收率。
2-甲基-3-硝基苯乙酸的合成
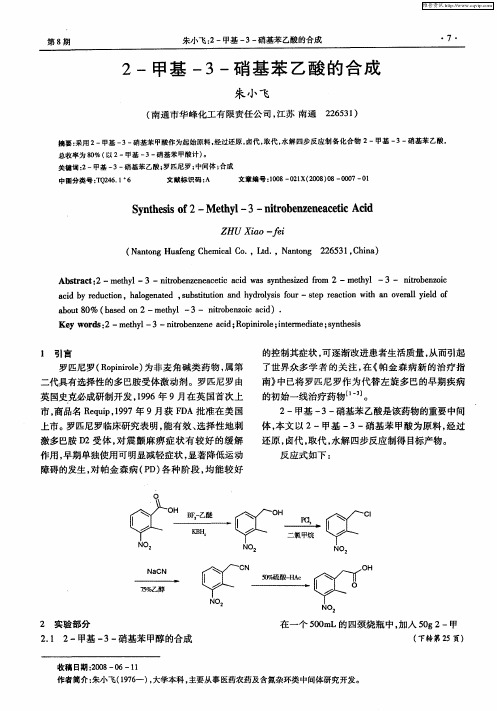
中圈分类号 :Q 4 . 6 T 26 1 文献标识码 : A 文章编 号 :o 8— 2 X( 0 8 O O 0 O 10 0 1 20 )S— O 7一 1
7%乙醇 5
NO2
NO2
2 实验 部分
在 一 个 5 0 L的四颈 烧瓶 中 , 0m 加入 5 g2一甲 0
( 下转第 2 5页)
21 . 2一 甲基 一 一 3 硝基苯 甲醇的合成
收稿 日期 :0 8— 6—1 20 0 1
作者简介 : 飞(96 ) 大学本科 , 朱小 17一 , 主要从事医药农药及含氮杂环类 中间体研究 开发。
有效 。 2 做好 消 防培 训 , ) 熟练 掌握 各 种 消 防器 材 。 3 做好 安 全 防 护 用 品 的 保 管 、 确 使 用 , 防 ) 正 如
加氢装置存在 较高职业 危险因素 , 必须深入研 究安 全 管理 和 预 防事 故 的科 学 方 法 , 制 和 消 除各 控
南》 中已将罗匹尼罗作 为代替左旋多 巴的早期疾病 的初始一线治疗药物¨ 。 J 2一甲基 一 一 3 硝基苯乙酸是该药物的重要 中间 体, 本文 以 2一甲基 一 一硝基苯 甲酸为原料 。 3 经过 还原 , 卤代 , 取代 , 水解四步反应制得 目标产物。
反应 式 如下 :
上市。 罗匹尼罗临床研究表明 , 能有效、 选择性地刺
1 引 言
的控制其症状 , 可逐渐改进患者生活质量 , 从而引起
了世 界众 多 学 者 的关 注 , 《 在 帕金 森 病 新 的 治 疗 指
对硝基苯乙腈的制备

对硝基苯乙腈的制备
佚名
【期刊名称】《精细化工经济与技术信息》
【年(卷),期】2001(000)005
【摘要】对硝基苯乙腈是合成药物的重要中间体。
也用于制备液晶及农用化学品。
它的制备方法有两种:一是苯乙腈直接和混酸(浓HNO3或H2SO4)反应,对
硝基苯乙腈收率为48%,二是对硝基苄基卤和NaCN反应,用DMSO为溶剂,
并在反应混合物中加入一定量的浓H2SO4,产品收率为40%,现介绍用浓
HNO3和多聚磷酸作硝化剂,定向硝化苯乙腈制备对硝基苯乙腈的方法,15g质
量分数为96%的苯乙腈滴加到27.5mL质量分数为68%的HNO3和多聚磷酸混
合物中,在20~25℃下反应2h,反应产物用乙醇水溶液重结晶得对硝基苯乙腈12.9g,产品的收率为64.29%,ω(对硝基苯乙腈)=99.11%。
【总页数】2页(P16-17)
【正文语种】中文
【中图分类】TQ463.4
【相关文献】
1.用于包覆丙烯腈-丁二烯-苯乙烯共聚物的苯乙烯嵌段共聚物热塑性弹性体的制备与性能 [J], 路海冰;娄小安;孟成铭;杨涛
2.相转移催化条件下苯乙腈碱性水解制备苯乙酸 [J], 康跃惠;彭桂存
3.对硝基苯乙腈的制备新技术 [J], 韦长梅;支三军;陈田田;安礼涛;杜祝祝
4.2-甲基-3-硝基苯乙腈合成工艺改进 [J], 李匡元;李娟;张怡;门靖
5.苯乙腈定向硝化制备对硝基苯乙腈 [J], 韦长梅;嵇鸣
因版权原因,仅展示原文概要,查看原文内容请购买。
盐酸匹皮尼罗合成路线分析

关键词:盐酸罗匹尼罗;合成路线;帕金森病
一、 帕金森病
帕金森病( PD) 是人们所熟悉的中枢神经系统疾病,主
要发生在中老年人身上。 它常见的病理特征是黑质致密区
多巴胺( DA) 神经元变性,致使黑质纹状体通路受到破坏及
壳核、尾状核中多巴胺含量受到削减。 临床主要表现为运动
险) ,环合反应时定位不强,可能会导致大量异构体的产生,
后处理困难,而且相关文献并没有报道该路线的收率,从而
限制了该路线的实际应用。
( 三) 以异苯并二氢吡喃为原料
合成路线较短,原料易得,收率适中,副产物少,故该路
线可以用于盐酸罗匹尼罗的合成。
四、 盐酸罗匹尼罗的合成路线确定
综上所述,从合成需兼顾低成本,高收率,低污染,操作
[6] 柯靖.LGR6-AKT / mTOR 信号通路的调节及其在胃
癌发生发展中的作用[ D] .苏州:苏州大学,2019.
[7] 周长青.长效非麦角多巴胺受体激动剂治疗帕金森
病的系统评价[ D] .重庆:重庆医科大学,2014.
[8] 杜芳.新型多巴胺 D3 受体激动剂对多巴胺神经元的
神经营养作用的研究[ D] .西安:第四军医大学,2004.
[9] 李鑫.普拉克索联合左旋多巴治疗帕金森病的临床
疗效及安全性[ J] .智慧健康,2019,5(24) :59-60.
[10] 贺 斌, 邵 福 源. COMT 抑 制 剂 治 疗 帕 金 森 病 展
望[ J] .国外医药( 合成药、生化药、制剂分册) ,2001,22(1) .
[11] 宁翔.恩他卡朋联合复方左旋多①
张径舟 孔庆新 周在富 姚远 黎庆
3-苯氧基苯乙腈的合成

3-苯氧基苯乙腈的合成
3-苯氧基苯乙腈可以通过以下步骤合成:
1. 首先,将苯乙腈和溴化钾反应。
在无水无氧条件下,将苯乙腈溶解在有机溶剂中(如二甲基甲酰胺),然后加入过量的溴化钾。
反应会发生亲电取代反应,其中溴化钾会将溴原子引入苯乙腈分子中,生成苯乙腈的溴代物。
2. 接下来,将生成的苯乙腈的溴代物与苯氧物质反应。
同时加入碱性的溶剂(如乙醇钠溶液)和催化剂(如碘化钯)。
这个反应叫做羰基化合物的斯威特-辛荣反应。
在反应中,苯乙腈的溴代物与苯氧物质发生亲核取代反应,生成3-苯氧基苯乙腈。
3. 最后,通过过滤和洗涤等方法对反应产物进行纯化和分离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A b s t r a c t 2 - Me t h y l 一 3 一 n i t r o b e r t z y l c y a n i d e wa s p r e p a r e d f r o m o - x y l e n e b y n i t r a t i o n , o x i d a t i o n ,h y d r o l y s i s ,
r e d u c t i o n . c h l o r a t i o n a n d c y a n a t i o n . Th e h a l o g a t i o n wa s i mp r o v e d b y u s i n g p h c 6 p h o u s t r i c h l o r i d e t o r e p l a c e p h o s p h o u s t r l b r o mi d e a n d g o o d r e s u l t s we e r o b t a i n e d. Ke y wo r d s P a r k i n s o n s d i s e a s e ; d r u g t h e r a p i e s ; d o p a mi n e ;D 2 r e c e p t o r a g o n i s t ; s y n t h e s i s
依次用水 、 5 %N a O H 水溶液 、 水洗涤, 干燥 , 分馏得
馏份 7 5 . 6 g , b p 1 2 8~1 3 0 " ( 3( 2 6 . 6 6 m b a r ) , 收 率
5 o %.
1 . 2 2 - 甲基0 . 硝基苄叉=醋酸醅 l 4 ) 的制备
1 实验部分
1 . 1 3 - 硝基邻二甲苯( 3 】 的制备
在5 0 0 m L三颈 瓶 中加 入 1 2 2 . 0 mL ( 1 m o D 的邻二 甲苯, 冷 却至 一5 ℃, 在 搅拌 条 件下将配 好
的 1 8 0. 5 mL 混 酸 ( 7 1 . 0 m L 6 5 % 硝 酸 和
硝基. 苯 乙睛 ( 8 ) , 对其中还原 、 氯化和氰代等反应操作进行 了改进, 使用三氯化磷代替三溴化磷. 结
分类号
恫辟 & 似
H H
罗匹尼 罗 (
波动, 可 减少左 旋多 巴 胺总剂 量 2 0 %[ - 2 】 . 国 内尚无 此品种 的研制 报道 . 2 一 甲基. 3 一 硝基苯 乙睛 ( 8 ) 是该 药 的重 要 中 间
7 6 . 9 %.
1 . 4 2 - 甲基. 3 . 硝基苄基腈【 8 J 的制备
取4 . 1 5 g ( 0 . 0 2 5 1 mo 1 ) 的2 . 甲基. 3 . 硝 基 苯 甲醛 ( 5 ) 溶于 6 0 mL的甲醇 中冰水浴 冷却至 5 " C, 将0 . 7 g硼 氢 化钠 分 批 加 入 冷 的 溶 液 中 后反 应 1 h , 室温 放置过夜 , 将 反应液 稀释于 1 2 0 mL冰水 中, 分 出油层 , 用 1 5 mL干燥 苯 , 分 3次 带水 , 减 压蒸 出溶 剂 得 油 状 物 3 . 5 9 g[ ( 6 ) 的粗 品] . 收 率
4 G a U a g h e r GJ P a t d " e i a G , L a v a n c h y J e t a l 4 - 【 2 一 f D i n - p r o p y l a mi n o ) e t h y 1 1 - 2( 3 H) 一 i n d o l ne o . J/ v l e d C h e m.
1 2 0 mL 5 0 %乙醇 和 5 mL浓 硫 酸 一 同加 热 回流
2 结果 与讨 论
第 一步硝 化反 应 中, 去 除 了文 献 中的 水蒸 气 蒸馏操 作, 改 分馏 为减 压蒸馏 , 产 品的收率 和质量 与文献 一致 . 第三 步 水解 反应 , 所得 产 品 2 . 甲基一 3 埔 基苯 甲醛 ( 5 ) 的 熔 点偏 低, 不 易得 到结 晶 固 体. 给纯 化分 离带来困难 作者采用 T L C检测, 控 制 粗品质量 , 将 粗品直接用 于下一步 还原 , 所得产 品收率和质量 与文 献相 符, 使反应操 作大 为简化 , 反 应和后处理 时间大为缩 短 . 在第五步反 应 中, 作 者将文 献 中采用 的三溴 化 磷改 成稳 定 、 易得和 价 廉 的三氯 化磷 , 同样 制得 2 . 甲基. 3 硝基 氯 苄 , 该
Wa n g S o n g q i n g , De n g X i a n g y a n g , Wa n g S h a o j i e , Z h a n g We i g e
D e p a r t m e n t o f P h a r m a c e u t i c s , S h e n y a n g P h a r ma c e u t i c a l U n i v e r s i t y , S h e n y a n g 1 1 0 0 1 5
报
第1 7卷
与3 O mL乙酸 酐配成的溶 液在 5 ~l 0 ℃条 件下滴 入反应液 中, 并且 在该 条件 下继 续搅 拌 3 h , 后处 理方法 与文 献 f 3 相 同. 得 到黄 色 透 明雪 花状 固体
5 . 4 g , 收率 5 0 . 5 %, mp 8 4 ~8 6 ℃.
胺基) 乙基 ] 一 l , 3 一 二氢 吲哚一 2 . 酮, 作 为英 国 S m i t h K L i n e - B e e c h a m 翩药公 司开 发的早期 帕金森症 治
疗药物, 其商品名为 R e q u i p , 于1 9 9 6年 9 月在英
国首 次上市 . 目前 已相继被法 国和瑞士批准 上市 . 罗匹尼罗是一 种强 效 、 选 择性 的非 麦 角碱 类多 巴
7 8 . 4 %.
向上述 油 状物 3 . 5 9 g( 0 . 0 2 m o 1 ) 中加入
3 5 mL 无水 乙醚 . 分 4次 滴 加 三氯 化磷 共 6 mL , 回流 , 用T L C检 测终 点 . 反 应结束后 . 将冷的反应
液倒入 5 0 mL冰 水 中, 分 出水层 , 用水 洗醚 层, 醚
1 5 0 mL水 中, 放 置 过夜 . 得 浅黄 色 结 晶, 过滤 . 重 结 晶. 得 无 色 粉 末状 固体, 过 滤. 真 空 干 燥 得 0 . 7 5 g ,收率 4 7 . 3 %, mp 8 0 ~8 1℃ , 结 构 经 元素
分析、 红外和核 磁确证 .
1 . 3 2 - 甲基. 3 . 硝基苯 甲醛 ( 5 J 的制备 在2 5 0 mL的 圆底 烧 瓶 中依 次 加 入 2 1 . 0 5 g ( O . 0 7 9 o t o 1 )2 - 甲基. 3 . 硝基苄 叉二醋酸酯 ( 4 ) 、
Ma r 2 000 D 1 03
罗匹尼罗中间体 2 . 甲基. 3 . 硝基苯乙腈的合成
…
沈阳药科大学制药系 , 沈阳 摘 要 1 1 0 0 0、 氧 化、 水解、 还原 、 氯 化和氰 代等 6步反 应制 得 2 一 甲基一 3 .
法未 见文 献报道 . 参考 文献
1 De Ma r i n i z RM . Hi e b l e J P. D o p a mi n e r e c e p t o r a g o n  ̄ 。 t s
3 h .参 照文献 ( J 分 出 水层 处 理 得 1 0 . 0 g, 收 率
体, 作者结 合 国内原 料供应 状况, 参 考有 关 文
献 3 - , 以邻二 甲苯为 原 料, 经硝 化 、 氧化 、 水解、 还原 、 氯 化和氰代等 6步反应制 备 2 一 甲基一 3 一 硝基. 苯 乙睛 ( 8 ) , 各 步 中 间体 的理 化 常 数 均 与 文 献相 符, 其中 ( 8 ) 的元 素分 析和 红 外 及 H 核磁 所 测结 果 均与文 献相符 . 有关反应 路线如图 1
d " o n p r o d u c t s 3 - n i t r o - o x r l  ̄
1 9 3 5 ~1 9 3 6
J ( ; h e m S o c , 1 9 6 9 , ( C ) :
在 上述( O . 0 0 9 9 mo 1 ) 氯代物 中加 入 1 0 g氰 化钠和 9 7mL 7 5 % 乙醇, 回流 2 . 5 h , 反应 液倒入
1 9 8 5 .2 8 : 1 5 3 3 ~1 5 3 6
S y n t h e s i s o f 2 一 Me t h y l 一 3 一 n i t r o b e n z y l Cy a n i d e . a n I m— p o r t a n t I n t e r me d i a t e o f Ro pi n i r o l S y nt h e s i s
维普资讯
一
第1 7卷 第 2期
2 0 0 0年 3 月
沈
阳
药
科
大
学
学
报
Vo 1 . 1 7
No. 2
J o u r n a l o f S h e n y a n g P h a r ma c e u t i c M Un i v e r s i t y
N0 2
罾 l
胺D 2 . 受体激动剂, 可直接激发纹状体多 巴胺 受
体, 对年轻患者 的早期疗效与左旋 多 巴胺( n A) 相 似, 耐受性 好, 剂量小. 本 品也适 用于 左旋 多 巴胺
童
Hs P C I
a
5 0 ZC 2 H 0H
3
) 2 ㈣ H z S 0 4
