基于嵌合抗原受体修饰T细胞的肿瘤免疫治疗新策略
CAR-T免疫疗法:肿瘤靶向治疗的新策略

CAR-T免疫疗法:肿瘤靶向治疗的新策略摘要嵌合抗原受体T细胞(CAR-T)细胞是一种全新的治疗恶性肿瘤的策略,它有别于传统的手术、放疗、化疗、抗体药物治疗。
CAR-T细胞疗法在血液肿瘤的治疗中有显著疗效。
本文将综述CAR-T的结构和抗肿瘤的原理、CAR-T细胞在临床上的应用以及CAR-T细胞治疗所面临的挑战及广阔前景。
ABSTRACT Chimeric antigen receptor T-Cell (CAR-T)is a new approach for the treatment of malignant neoplasms and even advanced malignancies. CAR-T cell therapy is different from traditional operation,radiotherapy,chemotherapy and monoclonal antibody drugs. CAR-T cell therapy has showed a significant effect in the treatment of patients with hematologic malignancies. This article reviews the structure of the principles of antitumor of CAR-T and its application,challenges and broad prospects in clinic.KEy WORDS chimeric antigen receptor;immunotherapy;tumor嵌合抗原受体(chimeric antigen receptor,CAR)是由抗体源性靶向区和T 细胞信号区融合而成。
表达CAR后的T细胞可以识别、结合特定的肿瘤细胞表面抗原,分泌细胞因子,杀伤肿瘤细胞。
肿瘤基因治疗的新进展

肿瘤基因治疗的新进展肿瘤基因治疗是一种创新的治疗方法,通过针对肿瘤细胞中的异常基因进行修复或调控,以达到治疗肿瘤的目的。
近年来,肿瘤基因治疗领域取得了许多突破性的进展,为癌症治疗带来了新的希望。
一、CAR-T细胞治疗CAR-T细胞治疗是肿瘤基因治疗中的一种重要方法,它利用工程修饰的T细胞,使其具有更强的对肿瘤细胞的杀伤能力。
该治疗方式的核心是将一种人工合成的CAR(嵌合抗原受体)导入T细胞,让T细胞能够识别并攻击肿瘤细胞。
目前,CAR-T细胞治疗已经在多个癌症领域取得了显著的效果。
例如,针对急性淋巴细胞性白血病(ALL)的CAR-T细胞治疗已经取得了令人瞩目的成功。
通过对一个名为CD19的抗原进行标靶,CAR-T细胞可以识别并消灭白血病细胞,大大提高了ALL患者的生存率。
二、基因编辑技术基因编辑技术是肿瘤基因治疗的另一个创新领域。
该技术利用工具性的核酸酶来精确地修饰人体内的基因,从而改变细胞的生物学行为。
其中,CRISPR-Cas9系统成为最为常用和有效的基因编辑技术。
通过CRISPR-Cas9系统,科学家可以选择性地剪切和修改肿瘤细胞中的致病基因,以抑制肿瘤的生长和扩散。
此外,基因编辑技术还可以用于增强免疫系统的抗肿瘤能力,为肿瘤治疗提供更多选择。
三、肿瘤疫苗肿瘤疫苗是一种通过激活机体免疫系统来抑制肿瘤生长和扩散的治疗方法。
与传统的疫苗不同,肿瘤疫苗并不用于预防疾病,而是用于增强机体对肿瘤的抗击能力。
近年来,肿瘤疫苗的研究取得了一系列突破。
一种被称为个性化肿瘤疫苗的新型疫苗受到了广泛关注。
个性化肿瘤疫苗根据患者肿瘤组织中的突变信息,设计并合成针对特定肿瘤抗原的疫苗,以激活机体对该抗原的免疫反应,从而攻击肿瘤细胞。
四、肿瘤基因治疗的挑战与前景尽管肿瘤基因治疗已经取得了一定的成果,但仍面临着许多挑战。
首先,治疗成本高昂,很多患者难以负担;其次,治疗过程中可能出现严重的副作用,如细胞因子释放综合征等;此外,肿瘤细胞的异质性和免疫逃逸现象也限制了肿瘤基因治疗的应用。
嵌合抗原受体t细胞治疗药物临床应用技术规范

嵌合抗原受体t细胞治疗药物临床应用技术规范一、引言嵌合抗原受体T细胞治疗(CAR-T疗法)是一种精准医学的新技术,其原理是将T细胞介导的特异性免疫疗效引入免疫细胞治疗。
该技术能够激活免疫细胞,从而增强免疫系统的作用,改善患者的治疗效果。
在某些严重的疾病,特别是恶性肿瘤中,CAR-T表现出令人满意的疗效,其中许多患者在治疗后取得很大改善,这也使CAR-T疗法成为肿瘤治疗的创新之一。
二、CAR-T技术的应用CAR-T技术的应用是一项复杂的工程,而为了能够使其在临床上取得理想的疗效,必须遵循一系列有关的规范。
下面便介绍CAR-T技术的应用技术规范:在开展CAR-T技术的临床应用之前,需要对CAR-T技术的安全性进行认真评估,以防止临床使用中出现意外事故。
(二)T细胞选择必须准确筛选合适的T细胞,以保证治疗的准确性和有效性。
(三)材料选择在开展CAR-T技术的临床应用时,必须采用质量可靠的材料,以确保其治疗的安全性和有效性。
(四)个体化治疗对不同病人进行个体化治疗,以保证不同患者获得良好的临床治疗效果。
(五)过程控制在开展CAR-T临床试验时,必须建立严格的过程控制制度,以确保CAR-T技术的有效合理使用。
(六)再造疗效监测给患者注射CAR-T疗法后,必须对患者的再造疗效作出及时、有效的监测,以防止意外发生。
(七)安全性评估三、总结CAR-T技术的发展为治疗重症疾病提供了新的治疗方案,但其临床使用的安全性和有效性仍需要根据有关的技术规范进行深入的研究。
必须准确筛选T细胞和合格的材料,还要建立严格的过程控制制度,以确保CAR-T技术能够在临床安全、有效地使用。
只有按照这些技术规范进行CAR-T技术的临床应用,才能使患者在获得安全和有效的治疗后获得充足的护理以及最佳的疗程结果。
肿瘤的免疫治疗

肿瘤的免疫治疗在与肿瘤的漫长斗争中,医学领域不断探索着新的治疗策略,肿瘤免疫治疗无疑是近年来最具革命性的突破之一。
它为癌症患者带来了新的希望,改变了肿瘤治疗的格局。
肿瘤免疫治疗的核心思想是利用人体自身的免疫系统来对抗肿瘤。
我们的免疫系统就像是一支强大的军队,时刻准备着抵御外来的侵略者和内部的叛乱分子。
肿瘤细胞在某种程度上可以被看作是“叛乱分子”,它们通过各种手段逃避了免疫系统的监视和攻击。
而免疫治疗的目的就是唤醒免疫系统,让它重新识别并消灭肿瘤细胞。
免疫系统中有多种细胞参与了对肿瘤的监视和攻击,其中最为关键的是 T 细胞。
T 细胞表面有一种叫做 T 细胞受体(TCR)的分子,它能够识别肿瘤细胞表面的特定抗原。
然而,肿瘤细胞常常会通过下调这些抗原的表达,或者通过一些免疫抑制分子来抑制 T 细胞的活性,从而逃避免疫系统的攻击。
免疫检查点抑制剂是肿瘤免疫治疗中的一类重要药物。
其中最著名的就是 PD-1/PDL1 抑制剂和 CTLA-4 抑制剂。
PD-1 是 T 细胞表面的一种受体,而 PDL1 则是肿瘤细胞表面的配体。
当 PD-1 与 PDL1 结合时,T 细胞的活性就会受到抑制,从而无法有效地攻击肿瘤细胞。
PD-1/PDL1 抑制剂的作用就是阻断这种结合,让 T 细胞重新恢复活性,从而对肿瘤细胞发起攻击。
CTLA-4 也是一种免疫检查点分子,它主要在T 细胞的激活阶段发挥作用。
CTLA-4 抑制剂可以增强 T 细胞的激活,从而提高免疫系统对肿瘤的攻击能力。
免疫检查点抑制剂在多种肿瘤的治疗中都取得了显著的疗效。
例如,在黑色素瘤、非小细胞肺癌、肾癌等肿瘤中,免疫检查点抑制剂已经成为了重要的治疗手段。
一些患者在接受免疫治疗后,肿瘤明显缩小甚至完全消失,而且这种治疗效果往往能够持续较长时间。
然而,免疫治疗并非对所有患者都有效。
一些患者在治疗后没有明显的反应,这可能与肿瘤的免疫微环境、患者自身的免疫系统状态等多种因素有关。
car-t工作原理

car-t工作原理Car-T(嵌合抗原受体T细胞疗法)是一种新兴的癌症免疫治疗方法,通过改造患者的T细胞,使其能够识别和消灭肿瘤细胞。
它的工作原理可以总结为以下几个步骤:采集T细胞、设计和构建嵌合抗原受体、扩增和激活改造的T细胞、注入到患者体内。
首先,需要采集患者的T细胞。
这通常通过外周血或者肿瘤组织等途径完成。
采集到的T细胞会被送往实验室进行后续处理。
在实验室中,科研人员将设计和构建嵌合抗原受体(CAR)。
CAR 是一种蛋白质分子,由多个部分组装而成,包括外部的抗原结合区域和内部的信号传导区域。
抗原结合区域能够识别特定的肿瘤抗原,而信号传导区域能够激活和增强T细胞的抗肿瘤活性。
当CAR的设计和构建完成后,下一步是将其导入到T细胞内。
为了实现这一点,通常使用病毒载体。
这些病毒载体被改造成可携带CAR 的形式,并且具有足够的感染能力。
当T细胞与携带CAR的病毒载体接触时,病毒会将CAR的遗传信息导入到T细胞内。
这样,T细胞就被改造成拥有特定抗原识别能力的CAR-T细胞。
改造完成后,CAR-T细胞需要经过扩增和激活。
在实验室中,科研人员会提供适当的培养环境和刺激物,使CAR-T细胞能够大量增殖和活化。
这样可以获得大量数量和高度活性的CAR-T细胞。
最后一步是将改造后的CAR-T细胞注入到患者体内。
在注射之前,通常需要对患者进行一些预处理,如化疗或放疗,以减少肿瘤负荷和提高CAR-T细胞的生存率。
一旦注射完成,CAR-T细胞会在体内寻找和识别肿瘤细胞。
通过CAR与肿瘤抗原的结合,CAR-T细胞会释放细胞毒性物质并释放促凋亡信号,从而引发肿瘤细胞的死亡。
除了直接杀伤肿瘤细胞外,CAR-T细胞还具有其他作用。
它可以激活免疫系统中的其他免疫细胞,如自然杀伤细胞和巨噬细胞,以协同作用来清除肿瘤细胞。
此外,CAR-T细胞还具有一定的记忆效应,能够识别和杀伤肿瘤细胞的再现。
总的来说,CAR-T疗法通过改造患者的T细胞,使其能够识别和消灭肿瘤细胞。
细胞免疫治疗在肿瘤治疗中的前景

细胞免疫治疗在肿瘤治疗中的前景细胞免疫疗法是一种新型的治疗方式,目前在肿瘤治疗领域中具有广阔的前景。
本文将介绍这种疗法的定义、特点、治疗原理、具体应用以及可能的发展前景。
一、什么是细胞免疫治疗细胞免疫治疗是一种用免疫细胞来攻击病变细胞的治疗方式。
该方法通过加强免疫系统的功能并引导免疫细胞进入病变区域,杀死以及清除肿瘤细胞。
目前,细胞免疫治疗主要包括:肿瘤免疫检查点抑制剂、基因修饰T细胞疗法、嵌合抗原受体(CAR)T 细胞疗法、癌症疫苗等多种形式的治疗方式。
二、细胞免疫治疗的特点与传统化疗及放疗相比,细胞免疫治疗有以下特点:1. 个性化高:细胞免疫治疗可以基于个体体内的肿瘤细胞特异性来发掘新的治疗途径。
2. 副作用小:与其他治疗方式相比,细胞免疫治疗引起的不良反应很少。
3. 治愈效果好:由于免疫细胞具有极强的肿瘤杀伤能力,因此这种治疗形式可以达到极佳的治愈效果。
三、细胞免疫治疗的治疗原理细胞免疫治疗基于人体的免疫系统来杀死肿瘤细胞。
人体的免疫系统能够识别并杀死几乎所有异常或被感染的细胞,包括肿瘤细胞。
肿瘤细胞在形成时,常常隐藏在人体内的远离免疫清除的位置。
但免疫系统生成的T细胞能够识别它们,并在目标位置随之杀伤或摧毁它们。
因此,细胞免疫治疗最大的作用便是增强人体免疫细胞,使其能够在夺回一种健康状态下攻击和杀伤癌细胞。
四、细胞免疫治疗的具体应用1. 肿瘤免疫检查点抑制剂:这种疗法被设计用来刺激患者身体免疫系统寻找和杀死肿瘤细胞。
常用的检查点抑制剂包括癌症免疫检查点-1抗体(PD-1)和癌症免疫检查点配体-1抗体(PD-L1)。
2. 基因修饰T细胞疗法:通过提取受试者的T细胞并将它们修改为目标性杀伤肿瘤细胞的方式来实现治疗。
通过与肿瘤细胞中的受体结合,这些T细胞可以杀死癌细胞。
3. 嵌合抗原受体(CAR)T细胞疗法:这种疗法基于CAR-T细胞来攻击肿瘤细胞。
CAR-T细胞是一种通过基因修改来增强其功能的T细胞,能够识别和杀死肿瘤细胞。
表达嵌合性受体的T细胞:一种新的肿瘤免疫治疗策略1

表达嵌合性受体的T细胞:一种新的肿瘤免疫治疗策略1王率;殷正丰;吴孟超【期刊名称】《中国免疫学杂志》【年(卷),期】2001(017)011【摘要】@@ 尽管早在20世纪80年代末,过继性免疫疗法就被成功地用于转移性黑色素细胞瘤的治疗,然而获得针对大多数其他类型肿瘤的特异性细胞毒T淋巴细胞(Cytotxic T Lymphocyte,CTL)却很困难.虽然抗体可特异性识别肿瘤抗原,但由于抗体进入组织的能力以及杀伤肿瘤的效应均较差,所以直接注射抗体对肿瘤进行免疫治疗的疗效并不理想.近年来发展了一种新的免疫治疗策略,即根据CTL对靶细胞的识别特异性依赖于T细胞受体(T-Cell Receptor,TCR)的发现,将能特异性识别并结合肿瘤细胞表面抗原或受体的抗体或配体与T细胞受体的细胞内成分融合成嵌合性T细胞受体(Chimeric T Cell Recepter,cTCR),从而产生一种新型的具有高度肿瘤特异性的CTL.cTCR可赋予T细胞持久的预先决定的新配体识别特异性.转染有cTCR 的CTL以主要组织相容性复合物(Major Histocompatibility Complex,MHC)非限制性方式选择性地靶向和杀伤肿瘤细胞或病毒感染的细胞.国际上已有一些实验室对表达cTCR的CTL进行了研究.本文就有关内容作一综述.【总页数】4页(P624-627)【作者】王率;殷正丰;吴孟超【作者单位】第二军医大学东方肝胆外科医院分子肿瘤学研究室;第二军医大学东方肝胆外科医院分子肿瘤学研究室;第二军医大学东方肝胆外科医院分子肿瘤学研究室【正文语种】中文【中图分类】R392.11【相关文献】1.嵌合抗原受体修饰T细胞在肿瘤免疫治疗中的策略 [J], 鲁大鹏;叶园园;王保龙2.嵌合抗原受体T细胞疗法及其在血液肿瘤免疫治疗中的应用 [J], 夏莉;王月英3.嵌合体抗原受体修饰T细胞的肿瘤免疫治疗 [J], 周静;高丽枫4.嵌合抗原受体T细胞在肿瘤免疫治疗中的研究进展 [J], 谭灏;李祥;康永;刘聪;杨伟晗5.纳米技术在嵌合抗原受体T细胞肿瘤免疫治疗中的应用进展 [J], 阳沐;吴莉;王季石因版权原因,仅展示原文概要,查看原文内容请购买。
CAR-T嵌合抗原受体T细胞免疫疗法

Emily Whitehead在五岁时不幸患上
非常难治,存活率很低的一种急性
B淋巴细胞白血病(B-ALL)。
在经过化疗、骨髓移植以后仍然复发,
到了无药可救的阶段。 当时费城医院刚启动CAR-T疗法的临床试验,
总结
但是,由于癌细胞都是从正常细胞癌变产生的, 实际上是很难找到仅仅存在于癌细胞表面、却 不存在于正常细胞表面的信重要。
假如CAR-T攻击了正常的神经细胞、血管 细胞、皮肤细胞等,将会有很大的副作用。 所以CAR-T疗法还未能针对其他细胞—— 这也是CAR-T目前在实体瘤里尚未取得突 破的原因之一。
细胞常用的转录方法
反转录病毒法 转座子法 慢病毒法
电穿孔法
安全性问题
效率太低
表达持久,效率较高;安 全问题,费用较贵
适用性广,更加安全, 效率较低,不够持久
CAR-T 细胞疗法的不良反应
细胞因子释放综合征(CRS)
脱靶效应
严重的神经毒性
转染载体的缺陷 复发
C脱少CA靶为A数RR了效-患T-T高应者细细效产在胞胞转生接的在染的受活体,原化C内目因伴A不R前随是能-T多着持细C采免久A胞用疫R发治-系T、 统 细疗挥的慢胞后抗激病靶会肿活毒出向瘤和或现的作促逆严的用转重炎以抗录的介及原病神质肿并经的毒瘤非毒大,细肿性量胞但瘤、释表细表放面, 从 胞现抗而病所为原对毒特震转多转颤有阴个染、,等器存失其原官在语因在产潜、导人生在嗜致体毒风睡疾的性险及病正作,各的常用基种复组,程发, 有 织度而可因中的且能突也脑研导变病会究致或有表细第不明胞二同再因肿次程子瘤回度释的输的放发表C综生A达合。R,-征T 。 可 所细以胞表效C现A果R为不-T低佳细血胞压在、杀缺伤氧肿、瘤神细经 系 胞统的症同状时、,多对器正官常功组能织障也碍会等有。
嵌合抗原受体T细胞免疫疗法
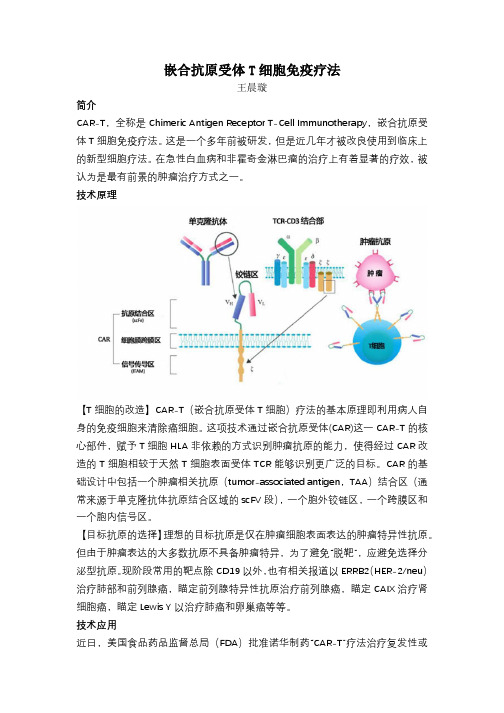
嵌合抗原受体T细胞免疫疗法王晨璇简介CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。
这是一个多年前被研发,但是近几年才被改良使用到临床上的新型细胞疗法。
在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。
技术原理【T细胞的改造】CAR-T(嵌合抗原受体T细胞)疗法的基本原理即利用病人自身的免疫细胞来清除癌细胞。
这项技术通过嵌合抗原受体(CAR)这一CAR-T的核心部件,赋予T细胞HLA非依赖的方式识别肿瘤抗原的能力,使得经过CAR改造的T细胞相较于天然T细胞表面受体TCR能够识别更广泛的目标。
CAR的基础设计中包括一个肿瘤相关抗原(tumor-associated antigen,TAA)结合区(通常来源于单克隆抗体抗原结合区域的scFV段),一个胞外铰链区,一个跨膜区和一个胞内信号区。
【目标抗原的选择】理想的目标抗原是仅在肿瘤细胞表面表达的肿瘤特异性抗原。
但由于肿瘤表达的大多数抗原不具备肿瘤特异,为了避免“脱靶”,应避免选择分泌型抗原。
现阶段常用的靶点除CD19以外,也有相关报道以ERRB2(HER-2/neu)治疗肺部和前列腺癌,瞄定前列腺特异性抗原治疗前列腺癌,瞄定CAIX治疗肾细胞癌,瞄定Lewis Y以治疗肺癌和卵巢癌等等。
技术应用近日,美国食品药品监督总局(FDA)批准诺华制药“CAR-T”疗法治疗复发性或难治性儿童、青少年B-细胞急性淋巴细胞白血病。
同时,CAR-T技术治疗非霍奇金淋巴瘤、慢性淋巴瘤治疗白血病、胰腺间皮瘤、卵巢癌、B细胞癌症、成神经细胞瘤等技术也都在临床试验阶段。
CAR-T的治疗流程大致如下:1、分离:从癌症病人身上分离免疫T细胞。
2、修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,也即制备CAR-T细胞。
3、扩增:体外培养,大量扩增CAR-T细胞。
CART疗法在肿瘤临床治疗中的研究进展

CART疗法的原理:
CART疗法通过基因工程手段,将外源性的抗原结合受体(Antigen-binding receptor)导入到T细胞中,使T细胞能够识别和攻击肿瘤细胞。这种抗原结合受 体通常是由抗体的一部分(恒定区)和T细胞受体(TCR)的α链或β链组成。因 此,CART疗法能够针对特定的肿瘤抗原进行攻击,具有高度特异性和靶向性。
四、结论
CART疗法是一种具有创新性和前景的肿瘤免疫治疗方法。随着科学技术的进 步和研究的深入,我们期待CART疗法在肿瘤免疫治疗中发挥更大的作用,为肿瘤 患者提供更有效的治疗选择。
参考内容三
引言
近年来,肿瘤免疫治疗已成为肿瘤治疗的重要手段之一。其中,CART细胞疗 法作为一种新型的肿瘤免疫治疗方法,备受。CART细胞,全称Chimeric Antigen Receptor T细胞,是一种经过基因改造的T细胞,可以识别并攻击肿瘤 细胞。本次演示将介绍CART细胞在肿瘤治疗中的研究进展、优势与挑战以及未来 展望。
3、实体瘤治疗难度大:相比血液瘤,实体瘤的CART细胞治疗难度更大,主 要是由于实体瘤的异质性较高,且存在肿瘤微环境等问题。目前,CART细胞疗法 主要用于血液瘤的治疗,如淋巴瘤、急性白血病等。
谢谢观看
CART疗法在肿瘤临床治疗中的研究 进展
基本内容
引言:
近年来,细胞工程和免疫疗法的发展为肿瘤的临床治疗带来了新的突破。其 中,CART(Chimeric Antigen Receptor T-Cell)疗法,一种利用患者自身的T 细胞来对抗肿瘤的方法,已经在各类临床试验中显示出强大的潜力。本次演示将 就CART疗法在肿瘤临床治疗中的研究进展进行综述。
背景知识
肿瘤的发病机制复杂,其中涉及到细胞突变、免疫逃逸等多个因素。目前, 肿瘤的主要治疗方法包括手术、放疗和化疗等。然而,这些方法往往无法彻底清 除肿瘤细胞,且可能产生一定的副作用。肿瘤免疫治疗作为一种新型的治疗方法, 旨在调动患者自身的免疫系统来攻击肿瘤,具有特异性强、副作用小等优势。
癌症免疫治疗的新突破

癌症免疫治疗的新突破随着科学技术的进步,人们对于癌症的治疗也在不断创新。
其中,癌症免疫治疗作为一种新颖的方法备受关注。
近年来,科学家们取得了令人振奋的突破,通过激发和增强人体免疫系统来抑制癌细胞生长和扩散。
本文将探讨癌症免疫治疗的新突破,并分析其优势与挑战。
一、 CAR-T细胞治疗——个性化靶向治愈一项引人注目的癌症免疫治疗的新突破是CAR-T细胞治疗。
CAR-T细胞(嵌合型抗原受体T细胞)是通过基因工程技术将患者自身T细胞改造而成具有高度特异性和活性的抗肿瘤效应。
这些CAR-T细胞能够识别并攻击肿瘤相关抗原(TAA)。
目前,针对血液系统恶性肿瘤如急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)的CAR-T细胞疗法已经获得了FDA的批准,并取得了令人惊艳的治疗效果。
CAR-T细胞治疗之所以能够取得如此显著的突破,主要归功于其具有多个优势。
首先,CAR-T细胞能够读取并辨识肿瘤表面的抗原,从而实现个性化的靶向治疗。
其次,CAR-T细胞具有持久的抗肿瘤活性,一次治疗就可在患者体内滞留数年甚至更久。
此外,CAR-T细胞治疗还可以作为一种最后手段被使用,在传统治疗失败或复发后为患者提供新的希望。
然而,尽管CAR-T细胞治疗在某些类型癌症上取得了巨大成功,但它也面临着一些挑战。
首先是耐受性问题,由于反应过于强大使得部分患者出现严重副作用。
其次是高昂的价格和制造复杂性导致这种新兴技术无法普及到更多的患者身上。
因此,科学家们正在不断努力改进CAR-T细胞治疗技术,以提高其安全性、降低治疗成本,并将其应用于更广泛的癌症类别。
二、免疫检查点抑制剂——恢复抗癌免疫力除了CAR-T细胞治疗之外,另一个癌症免疫治疗的新突破是免疫检查点抑制剂。
这些药物通过干扰肿瘤细胞和免疫细胞之间的信号通路,阻断肿瘤对于激活T细胞所需的负向调控信号,从而恢复并激活被压制的抗肿瘤免疫反应。
针对某些类型的癌症,如黑色素癌和非小细胞肺癌(NSCLC),免疫检查点抑制剂已经取得了令人满意的临床效果。
嵌合抗原受体T淋巴细胞免疫疗法在原发性肝癌中的应用

嵌合抗原受体T淋巴细胞免疫疗法在原发性肝癌中的应用李康伟1a,尉 丁1b,张若涵2,李 霄2,陶开山21第四军医大学a.研究生院,b.基础医学院细胞生物学教研室,西安710032;2第四军医大学西京医院肝胆胰脾外科,西安710032摘要:原发性肝癌具有恶性程度高、进展快、易复发转移和病死率高等特点,因此大多数患者就诊时已发生肝内或肝外转移,失去手术治疗机会。
嵌合抗原受体T淋巴细胞(CAR-T)免疫疗法已在B细胞急性淋巴性白血病治疗中取得了较好的效果,其在原发性肝癌、胰腺癌、胃癌以及前列腺癌等实体瘤中的应用也陆续开展了临床试验。
本文综述了CAR-T免疫疗法在原发性肝癌临床试验中的疗效,并讨论了其在临床应用中需攻克的难题,如缺乏适宜的肿瘤靶点、肿瘤微环境对CAR-T的抑制作用以及CAR-T对肿瘤组织的浸润性差等,以期为临床研究提供参考。
关键词:肝肿瘤;免疫疗法;嵌合抗原受体T淋巴细胞基金项目:国家自然科学基金(82170667,81970566)ApplicationofchimericantigenreceptorT-cellimmunotherapyinprimarylivercancerLIKangwei1a,WEIDing1b,ZHANGRuohan2,LIXiao2,TAOKaishan2.(1.a.GraduateSchool,b.DepartmentofCellBiology,SchoolofBasicMedicalSciences,FourthMilitaryMedicalUniversity,Xi’an710032,China;2.DepartmentofHepatobiliarySurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China)Correspondingauthor:TAOKaishan,taokaishan0686@163.com(ORCID:0000-0002-6038-4136)Abstract:Primarylivercancerhasthefeaturesofhighmalignancy,rapidprogression,frequentrecurrence/metastasis,andhighmortality,andtherefore,mostpatientshavedevelopedintrahepaticorextrahepaticmetastasiswhenattendingthehospitalandthuslosttheopportunityforsurgicaltreatment.ChimericantigenreceptorT-cell(CAR-T)immunotherapyhasachievedgoodefficacyinthetreatmentofB-cellacutelymphoblasticleukemia,andclinicaltrialshavebeeninitiatedtoexploreitsapplicationsinsolidtumorssuchasprimarylivercancer,pancreaticcancer,gastriccancer,andprostatecancer.ThisarticlereviewstheefficacyofCAR-Timmunotherapyintheclinicaltrialsforprimarylivercanceranddiscussesthedifficultissuesthatneedtobesolvedinclinicalpractice,suchasthelackofsuitabletumortargets,theinhibitoryeffectoftumormicroenvironmentonCAR-Tcells,andthepoorinfiltrationofCAR-Tcellsintumortissue,soastoprovideareferenceforrelatedclinicalstudies.Keywords:LiverNeoplasms;Immunotherapy;ChimericAntigenReceptorTCellResearchfunding:NationalNaturalScienceFoundationofChina(82170667,81970566)DOI:10.3969/j.issn.1001-5256.2022.10.036收稿日期:2022-03-05;录用日期:2022-04-07通信作者:陶开山,taokaishan0686@163.com 原发性肝癌根据病理分型可划分为肝细胞癌(HCC)、肝内胆管癌以及混合型肝癌。
免疫治疗在癌症治疗中的最新进展

免疫治疗在癌症治疗中的最新进展癌症,这个令人闻之色变的词汇,一直以来都是人类健康的巨大威胁。
多年来,科学家们不断探索各种治疗方法,从传统的手术、放疗和化疗,到如今的靶向治疗,每一次进步都为癌症患者带来了新的希望。
而在众多新兴的癌症治疗手段中,免疫治疗无疑是最引人瞩目的一颗明星。
免疫治疗,顾名思义,就是通过激活或增强人体自身的免疫系统来对抗癌症。
免疫系统是我们身体的“防御部队”,它能够识别和消灭外来的病原体以及体内发生变异的细胞。
然而,癌细胞非常狡猾,它们能够通过各种方式逃避免疫系统的监视和攻击。
免疫治疗的目的就是打破癌细胞的这种“免疫逃逸”机制,让免疫系统重新发挥作用。
免疫检查点抑制剂是免疫治疗中的一类重要药物。
其中最著名的当属 PD-1/PDL1 抑制剂和 CTLA-4 抑制剂。
PD-1 和 PDL1 是免疫系统中的一对“刹车分子”,当它们结合时,免疫系统的活性会受到抑制。
癌细胞正是利用了这一点,通过表达 PDL1 来与 T 细胞表面的 PD-1 结合,从而逃脱免疫系统的攻击。
PD-1/PDL1 抑制剂能够阻断这种结合,让T 细胞重新恢复活性,对癌细胞展开攻击。
CTLA-4 则是另一种免疫检查点分子,CTLA-4 抑制剂能够促进 T 细胞的活化和增殖,增强免疫系统的抗肿瘤能力。
近年来,免疫检查点抑制剂在多种癌症的治疗中都取得了显著的成果。
例如,在黑色素瘤的治疗中,免疫检查点抑制剂已经成为了一线治疗方案,显著延长了患者的生存期。
在肺癌、肾癌、膀胱癌等多种实体瘤的治疗中,免疫检查点抑制剂也展现出了良好的疗效,为许多患者带来了新的希望。
不仅如此,免疫检查点抑制剂还在一些难治性癌症,如肝癌、胰腺癌等的治疗中取得了一定的突破,为这些患者带来了生存的机会。
除了免疫检查点抑制剂,过继性细胞免疫治疗也是免疫治疗领域的一个重要方向。
过继性细胞免疫治疗是指将体外培养扩增的免疫细胞回输到患者体内,以增强患者的抗肿瘤免疫反应。
肿瘤的基因治疗新技术

肿瘤的基因治疗新技术近年来,肿瘤已成为严重威胁人类健康的一种常见疾病。
传统的癌症治疗手段如放化疗虽然在一定程度上有效,但也伴随着一系列副作用和局限性。
为了解决这些问题,科学家们积极探索基因治疗新技术。
这些新技术以通过调节和改变患者体内的基因来达到治愈甚至根治肿瘤的目标,在肿瘤治疗领域吸引着广泛关注。
一、CRISPR-Cas9技术——精准编辑基因组CRISPR-Cas9(集束规律间隔叠加回文序列-{间}-斩-{切}-酶9)是当今最被广泛应用于基因编辑领域的细胞工程技术。
该技术通过将具有修剪能力的核酸芯片RNA导入体外进行不完美匹配DNA,进而切断特定位置的DNA链,并通过DNA 链或插入修复模板实现修复和替换目标区域。
CRISPR-Cas9技术在肿瘤基因治疗中的应用主要涉及两个方面,即抑制肿瘤相关基因和激活抗肿瘤基因。
通过靶向特定肿瘤相关基因,CRISPR-Cas9技术可以巧妙地降低或完全阻断肿瘤细胞的发展进程。
此外,在启动癌变过程中关键性作用的抗癌基因的修复上,该技术也显示出潜力,从而增强机体免疫系统对肿瘤的抵御能力。
二、CAR-T细胞治疗——改造免疫细胞以攻击肿瘤CAR-T(嵌合抗原受体T细胞)是一种使用基因编辑技术来改造患者自身T细胞以攻击癌细胞的新型治疗方法。
该技术首先从患者体内提取T细胞,并利用基因工程技术将一个具有高度特异性的人工受体引入到这些T细胞中。
在CAR-T细胞治疗中,改造后的T细胞同样包含了人类白血球抗原-2(HLA-2)等多种蛋白质表达物。
这些表达物使得CAR-T细胞能够通过与癌细胞表面的特定抗原相互作用,实现对癌细胞的杀伤。
CAR-T细胞治疗在某些肿瘤类型中已取得了显著疗效,并成为肿瘤免疫治疗领域的重要突破。
然而,CRISPR-Cas9和CAR-T技术也存在一些挑战和限制。
其中包括不完全的基因编辑准确性、非特异性靶向、潜在的遗传不稳定性以及治疗后过度免疫反应等副作用。
因此,在进一步开发和优化这些技术时,科学家们需要仔细考虑这些问题,并加强监测系统来确保安全性和有效性。
肿瘤免疫治疗中的T细胞工程技术

肿瘤免疫治疗中的T细胞工程技术在肿瘤治疗领域,免疫治疗是一种新兴而具有潜力的方法。
而T细胞工程技术作为其中重要的一部分,已经在活体和体外实验中取得了一定的成功。
它通过改变患者自身的T细胞,在增强抗肿瘤免疫应答方面发挥着关键作用。
本文将介绍肿瘤免疫治疗中的T细胞工程技术及其应用前景。
1. T细胞基因改造技术T细胞工程技术主要涉及对自体或同种异体来源的T细胞进行基因改造,以提高其功能或增强抗肿瘤能力。
常用的基因改造方法包括转基因、表达受体、引入共刺激信号等。
1.1 转基因转基因是指通过导入外源性DNA序列到目标细胞中,使其表达特定蛋白质或调控相关信号通路。
在肿瘤免疫治疗中,常见的转基因方法是向T细胞中转入抗原受体基因,使其能够识别并攻击肿瘤细胞。
1.2 表达受体表达受体是指通过给予T细胞特定的受体,以增强其对肿瘤细胞的辨识和攻击能力。
常见的表达受体包括嵌合抗原受体(CAR)和TCR转基因技术。
CAR-T细胞治疗已经在临床试验中显示出潜力,并获得了一些成功的案例。
1.3 引入共刺激信号共刺激信号是指促进T细胞活化和增强免疫应答的重要因子。
通过引入共刺激信号相关基因到T细胞中,可以提高肿瘤抗原的诱导效果,并增强对肿瘤细胞的杀伤作用。
2. T细胞工程技术在实际应用中的进展虽然T细胞工程技术在理论上展示了巨大的治疗潜力,但它在实际应用中面临许多挑战和难题。
目前,一些基于T细胞工程技术的抗癌疗法已经进行了早期临床实验,并获得了一定成功。
2.1 CAR-T细胞疗法CAR-T细胞疗法是目前最成熟和广泛应用的T细胞工程技术之一。
它通过改造患者自身的T细胞,使其表达CAR,以增强对肿瘤细胞的识别和攻击能力。
CAR-T细胞治疗已经在治疗多种恶性肿瘤中显示出潜力,特别是在血液系统肿瘤如白血病和淋巴瘤方面。
2.2 TCR转基因技术TCR转基因技术是另一种重要的T细胞工程方法,它通过改变T细胞表面TCR来增强其对肿瘤抗原的诱导效果。
嵌合抗原受体介导的抗肿瘤细胞治疗的发展

嵌合抗原受体介导的抗肿瘤细胞治疗的发展
秦浩越;言欢;张星;黄哲;陈阳倩;张聿达;向思琦;张永昌;杨农;曾亮
【期刊名称】《肿瘤药学》
【年(卷),期】2024(14)2
【摘要】嵌合抗原受体(CAR)技术驱动的T细胞疗法在肿瘤治疗中展示了巨大的创新潜力,尤其在血液肿瘤方面取得了显著成果。
通过精准改造患者或供体细胞,使其能够特异性识别并清除肿瘤细胞,此策略已进入临床实践的新阶段。
尽管如此,CAR-T细胞疗法在实体瘤中的治疗效果尚未达到预期,并且其潜在的不良反应引起了广泛关注。
随着科技的不断进步,基于CAR技术改造的多种细胞类型,如NK细胞、巨噬细胞、NKT细胞及γδT细胞等,正在被纳入肿瘤治疗研究,拓展了治疗前景。
本综述深入探讨了CAR技术的最新进展及其在细胞疗法中的应用,为抗肿瘤治疗提供潜在的新思路和可能性。
【总页数】10页(P156-165)
【作者】秦浩越;言欢;张星;黄哲;陈阳倩;张聿达;向思琦;张永昌;杨农;曾亮
【作者单位】南华大学衡阳医学院湖南省肿瘤医院研究生协作培养基地;湖南省肿瘤医院肺胃肠内科
【正文语种】中文
【中图分类】R730.51;R318
【相关文献】
1.慢病毒介导不同启动子嵌合抗原受体CD19在T细胞中的表达
2.人源化Mesothelin嵌合抗原受体介导的T细胞抗肿瘤效果
3.嵌合抗原受体CAR介导的信号强度会影响T细胞反应
4.长效抑制TIM-3表达增强ROR1嵌合抗原受体修饰的T细胞的抗肿瘤免疫应答
5.靶向人源BCMA的嵌合抗原受体T细胞构建及体外抗肿瘤活性研究
因版权原因,仅展示原文概要,查看原文内容请购买。
肿瘤免疫治疗的新方法CAR-T 细胞治疗
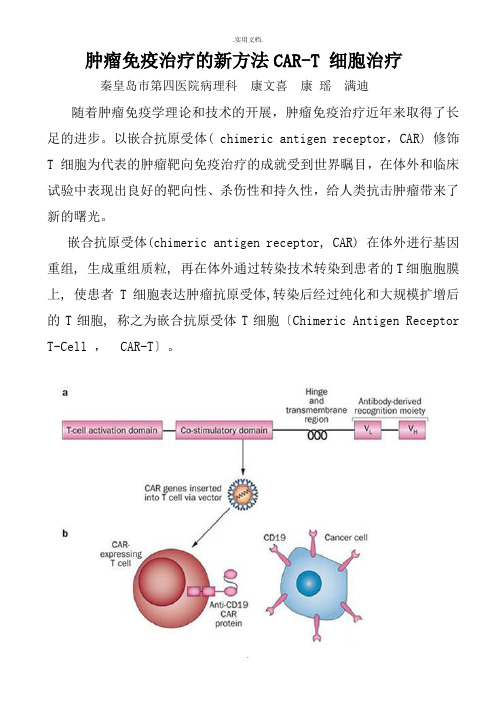
肿瘤免疫治疗的新方法CAR-T 细胞治疗秦皇岛市第四医院病理科康文喜康瑶满迪随着肿瘤免疫学理论和技术的开展,肿瘤免疫治疗近年来取得了长足的进步。
以嵌合抗原受体( chimeric antigen receptor,CAR) 修饰T 细胞为代表的肿瘤靶向免疫治疗的成就受到世界瞩目,在体外和临床试验中表现出良好的靶向性、杀伤性和持久性,给人类抗击肿瘤带来了新的曙光。
嵌合抗原受体(chimeric antigen receptor, CAR) 在体外进行基因重组, 生成重组质粒, 再在体外通过转染技术转染到患者的T细胞胞膜上, 使患者T细胞表达肿瘤抗原受体,转染后经过纯化和大规模扩增后的T细胞, 称之为嵌合抗原受体T细胞〔Chimeric Antigen Receptor T-Cell , CAR-T〕。
1989年Grooss等首次提出CAR-T细胞这一概念,多年来科学家经过不断的深入研究,CAR-T细胞技术已经研制出三代。
第一代CAR 由识别肿瘤外表抗原的单链抗体和免疫受体酪氨酸活化基序〔ITAM〕组成。
然而,ITAM 发出的激活信号只能引起 T 细胞短暂的分裂和较低水平的细胞因子分泌,不能提供长时间的多克隆扩增和持续的体内抗肿瘤效应。
给患者输注第一代 CAR-T细胞2天后, CAR-T细胞在体内可大量繁殖, 但1个月后迅速下降至难以检测的水平, 也没有观察到对肿瘤的免疫应答反响。
虽然对第一代CAR-T细胞的研究较多, 但是大多数试验在细胞扩增、体内存活时间、细胞因子分泌等方面还存在很多问题, 没有到达预期的临床效果。
研究说明, T细胞的完全活化有赖于双信号和细胞因子的作用。
其中第一信号为特异性信号, 由 TCR识别抗原递呈细胞外表的抗原肽-MHC 复合物所启动;第二信号为协同刺激信号, 通过CD28/B7等重要的共刺激分子, 促进IL-2合成, 并使T细胞充分活化及免于凋亡。
对于初始型T细胞(未与抗原接触的T细胞), 如果只有信号1而没有信号2, T 细胞就不能发挥正常作用;即使T细胞与抗原接触, 假设没有协同刺激信号, 细胞也不能发挥正常功能。
肿瘤免疫治疗的新策略与研究进展

肿瘤免疫治疗的新策略与研究进展引言肿瘤免疫治疗是近年来受到广泛关注的一种新型治疗策略。
该策略通过调节患者的免疫系统来抑制肿瘤生长和扩散,并提供了全新的治疗思路和方法。
本文将重点介绍肿瘤免疫治疗的新策略和最新研究进展。
一、肿瘤免疫治疗的传统方法传统的肿瘤治疗方法主要包括手术切除、化疗和放疗。
虽然这些方法在某些情况下能够有效地控制肿瘤的发展,但由于肿瘤细胞常常具有高度变异性和逃避免疫监视的能力,因此传统治疗方法的效果往往有限。
二、免疫检查点抑制剂的应用免疫检查点抑制剂是近年来肿瘤免疫治疗领域取得的重要突破之一。
它们通过抑制免疫检查点上的抑制信号,激活免疫系统来攻击肿瘤细胞。
PD-1抗体和CTLA-4抗体是目前最常用的免疫检查点抑制剂。
临床研究表明,这些药物在多种肿瘤类型中均能显著提高患者的生存率和生活质量。
三、个体化免疫治疗策略尽管免疫检查点抑制剂在肿瘤免疫治疗中取得了重要进展,但并非所有患者对这些药物均有良好的响应。
因此,个体化免疫治疗策略的发展成为当前的研究热点。
个体化治疗的核心是根据患者的基因组信息和免疫特征来选择最佳治疗方案。
例如,根据肿瘤表面抗原的特点,研究人员可以设计特异性T细胞受体(TCR)或嵌合抗原受体(CAR-T)来识别和攻击肿瘤细胞。
此外,疫苗和CpG寡核苷酸也被用于激活患者的免疫系统,增强其对肿瘤的免疫应答。
四、肠道菌群与肿瘤免疫治疗的关系近年来的研究表明,肠道菌群与肿瘤发生和发展密切相关。
肠道菌群的平衡失调可能导致肿瘤的免疫逃逸和治疗抵抗。
因此,调控肠道菌群成为肿瘤免疫治疗的新策略之一。
通过改变患者的饮食结构、使用前生物制剂或通过粪菌移植,可以调节肠道菌群的组成和功能,从而增强免疫治疗的效果。
五、肿瘤免疫治疗的新进展除了上述策略外,还有一些新的肿瘤免疫治疗方法正在不断发展中。
例如,通过利用CRISPR-Cas9技术编辑肿瘤细胞基因组,使其表达免疫抗原,以增强肿瘤细胞的免疫原性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国肿瘤生物治疗杂志http ://www.biother.orgChin J Cancer Biother ,Aug.2013,Vol.20,No.4doi :10.3872/j.issn.1007-385X.2013.04.001·述评·基于嵌合抗原受体修饰T 细胞的肿瘤免疫治疗新策略王艺,赵颖颖,韩双印(郑州大学人民医院中心实验室,河南郑州450003)[基金项目]国家自然科学基金资助项目(No.81172415,No.81241077);河南省重点科技攻关项目资助(No.102102310065)。
Project suppor-ted by the National Natural Science Foundation of China (No.81172415,No.81241077),and the Key Scientific and Technological Project of Henan Province (No.102102310065)[网络出版]http ://www.cnki.net /kcms /detail /31.1725.R.20130722.1347.008.html韩双印,主任医师、教授、博士生导师,郑州大学人民医院中心实验室主任,河南省学术技术带头人,河南省生物治疗学会副主任委员,河南省消化病学会副主任委员。
2001年于日本东北大学医学院获得博士学位,2001-2006年先后在美国斯坦福大学、Kimmel 癌症中心(Kimmel Cancer Center )进行博士后研究。
从事消化系肿瘤的临床和基础研究工作20多年,研究方向为分子肿瘤学和肿瘤免疫治疗,目前主要从事基因修饰T 细胞为基础的肿瘤过继免疫治疗的研究。
在Cancer Res 、Oncogene 、PNAS 、JBC 等国际主流期刊发表学术论文10余篇。
目前作为负责人承担国家自然科学基金、河南省科技攻关项目基金、河南省医学重点科技攻关项目基金等5项课题研究。
Email :shuangyinhan@zzu.edu.cn[摘要]嵌合抗原受体(chimeric antigen receptor ,CAR )修饰T 细胞是近年来迅速发展的肿瘤过继免疫治疗新手段,其独特的作用机制和诱人的应用前景为肿瘤生物治疗开辟了一个崭新的舞台。
CAR 将识别肿瘤相关抗原的单链抗体和T 细胞的活化基序相结合,通过基因转导赋予T 细胞肿瘤靶向性、更强的杀伤活性和持久的生命力。
自1989年Eshhar 等首次提出CAR 以来,CAR 已从第一代发展至含有共刺激分子的第二、三代,CAR 的Ⅰ/Ⅱ期临床试验在白血病、淋巴瘤、黑素瘤等恶性肿瘤中取得了可喜的成果,但是也面临脱靶效应、细胞因子风暴、移植物抗宿主病等潜在的安全性问题,未来研究将集中于设计更安全的第四代CAR 、甄选具备最佳治疗潜质的T 细胞亚群、优化临床治疗方案、完善临床前试验模型等方面。
相信随着免疫学、基因治疗和细胞工程等领域不断取得新突破,CAR 从实验室向临床转化的障碍将会逐一扫除,CAR 有望成为主流的肿瘤治疗方法。
[关键词]嵌合抗原受体;过继免疫治疗;肿瘤靶向治疗[中图分类号]R730.51;R392.11[文献标志码]A[文章编号]1007-385X (2013)04-0383-08New strategy of tumor immunotherapy based on chimeric antigen receptor engineered T cellsWang Yi ,Zhao Yingying ,Han Shuangyin (Central Research Laboratory ,People ’s Hospital Affiliated to Zhengzhou University ,Zhengzhou 450003,Henan ,China )[Abstract ]Chimeric antigen receptor (CAR )-engineered T cell is a newly developed strategy of adoptive immunothera-py.Its unique theoretical superiority and attractive application prospects open up a promising arena for anticancer therapy.CAR combines single chain variable fragment (scFv )antibody recognizing tumor-associated antigen with T cell activation motif ,which endows T cells with tumor-orientated targeting ability ,stronger killing activity ,and prolonged survival by ge-netic modification.Since first proposed by Dr.Eshhar in 1989,CAR has been developed from the first generation to the second and the third generations containing costimulatory molecular.The clinical trials in leukemia ,lymphoma ,and mela-noma have obtained exciting results.However ,the off-target effect ,cytokine strom ,and graft-versus-host disease are po-tential challenges for clinical use.Future research will focus on designing safer CAR of the fourth generation ,selecting good therapeutic T cell subsets ,optimizing clinical scheme of administration ,and improving pre-clinical models.It is be-lieved that the obstacles from bench to clinic will be cleared and that CAR will become one of the main cancer therapies·383·中国肿瘤生物治疗杂志,2013年8月,20(4)with breakthroughs in immunology,gene therapy and cell engineering.[Key words]chimeric antigen receptor;adoptive immunotherapy;tumor target therapy[Chin J Cancer Biother,2013,20(4):383-390]过继免疫治疗(adoptive immunotherapy,AIT)是肿瘤生物治疗的重要方法之一,曾在黑素瘤和肾细胞癌等恶性肿瘤中取得良好的治疗效果。
然而,由于其在多数肿瘤中的表现不尽如人意,AIT始终未能成为一线的治疗方法。
近年,肿瘤“免疫编辑”理论(immuno-editing theory)[1]诠释了免疫治疗多年来的“冰火”之旅。
经历了免疫监视、免疫平衡及免疫逃逸的多数肿瘤患者,体内已经形成以肿瘤为中心的免疫抑制网络,传统的免疫治疗很难达到理想的效果,促使人们重新思考免疫治疗的策略,并在实践中取得了可喜的进步。
首先,以嵌合抗原受体(chimeric antigen receptor,CAR)修饰T细胞为代表的肿瘤靶向免疫治疗能够重塑T细胞的靶向性、增殖性和持久性,有效地提高其特异性杀伤活性[2]。
其次,非清髓性化疗(non-myeloablative chemothera-py,NMC)等宿主预处理方案,为过继性免疫细胞发挥作用提供了适宜的环境,大幅度提升了过继免疫细胞的有效率[3]。
再者,担负治疗使命的免疫细胞从最初的回输CD8+效应记忆T细胞(effector mem-ory T cell,TEM)发展到回输中枢记忆T细胞(centralmemory T cell,TCM)和干细胞样记忆T细胞(stemcell like memory T cell,TSCM),回输此类具有记忆功能的T细胞能够持久地追杀肿瘤细胞,取得长期疗效[4]。
肿瘤过继免疫治疗在经历了20年漫长波折的演变后,原不尽如人意的治疗策略重新焕发出强大的生命力,为肿瘤患者带来了新的希望。
1CAR的发展历程1.1CAR的原理1989年,Eshhar研究小组[5]首次提出将针对肿瘤抗原单克隆抗体的可变区和T细胞受体(T cell receptor,TCR)的亚基融为一体,重定向T细胞(re-directing T cell)的免疫反应。
表达CAR的T细胞以抗原依赖、非MHC限制的方式结合肿瘤抗原,启动并活化下游级联反应,特异性杀伤肿瘤。
第一代CAR由识别肿瘤表面抗原的单链抗体(single chain variable fragment,scFv)和免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM,通常为CD3ζ和FcεRIγ)组成。
早期的实验证明了CAR的可行性,然而第一代CAR只能引起短暂的T细胞增殖和较低的细胞因子分泌,不能提供长时间的T细胞扩增信号和持续的体内抗肿瘤效应。
依照T细胞活化的双信号模型,第二和三代CAR引入了共刺激分子(costimulatory molecule,CM),旨在提高T细胞的细胞毒活性、增殖性与存活时间,促进细胞因子的释放(图1)。
众多的研究以肿瘤抗原识别-细胞因子释放-细胞毒性反应激活的嵌合模式,验证了抗Her2、CEA、PMSA等单链抗体与CD28、CD134(OX40)、CD137(4-1BB)等共刺激分子构成的CAR转染T细胞后的抗肿瘤作用[2,6-7]。
图1嵌合抗原受体结构示意图1.2CAR的结构CAR的结构分为胞外抗原结合区、铰链区、跨膜区和胞内信号区,其抗肿瘤效应依赖于胞外抗原结合区的靶向性、铰链区的灵活性、胞内信号区共刺激分子及T细胞活化基序的协同作用。
