唾液酸测定试剂盒(比色法)产品技术要求北京世纪沃德生物
唾液酸(SA)测定试剂盒(神经氨酸苷酶法)产品技术要求百奥泰康

唾液酸(SA)测定试剂盒(神经氨酸苷酶法)适用范围:该产品用于体外定量测定人血清或血浆中唾液酸的浓度。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:Tris缓冲液 0.1 mol/L PH=7.0神经氨酸苷酶 >0.2U/mL乳酸脱氢酶 >2U/mL试剂2:Tris缓冲液 0.1 mol/L PH=9.0烟酰胺腺嘌呤二核苷酸(NADH) >0.13mmol/LN-乙酰神经氨酸醛缩酶 >2U/mL。
1.2.2 校准品的组成单水平的液体校准品,在水基质中添加唾液酸(60mg/dL),稳定剂<0.1%;定值范围:(50-70)mg/dL。
1.2.3质控品的组成两个水平的液体质控品,在牛血清(30g/L)中添加唾液酸(60mg/dL和150mg/dL),稳定剂<0.1%;定值范围:(50-70)mg/dL、(120-180)mg/dL。
2.1 外观液体双试剂:试剂1:无色至淡黄色液体,试剂2:无色至淡黄色液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在规定参数下,试剂空白吸光度≥0.8。
2.4 分析灵敏度浓度为60mg/dL时,吸光度变化应≥0.005.。
2.5 线性在(0,200]mg/dL线性范围内,线性相关系数r ≥0.996。
在(0,50]mg/dL范围内绝对偏差不超过5mg/dL,在(50,200]mg/dL范围内的相对偏差不超过±10%。
2.6 精密度变异系数CV应≤8%2.7 批间差不同批号之间测定结果的相对极差应≤10%。
2.8准确度回收试验:回收率应在90%-110%范围内。
2.9 质控品赋值有效性测定值在质控靶值范围内。
2.10校准品溯源性要求根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供唾液酸校准品的来源、赋值过程以及测量不确定度等内容。
唾液酸测定试剂盒(NANA-醛缩酶法)产品技术要求北检
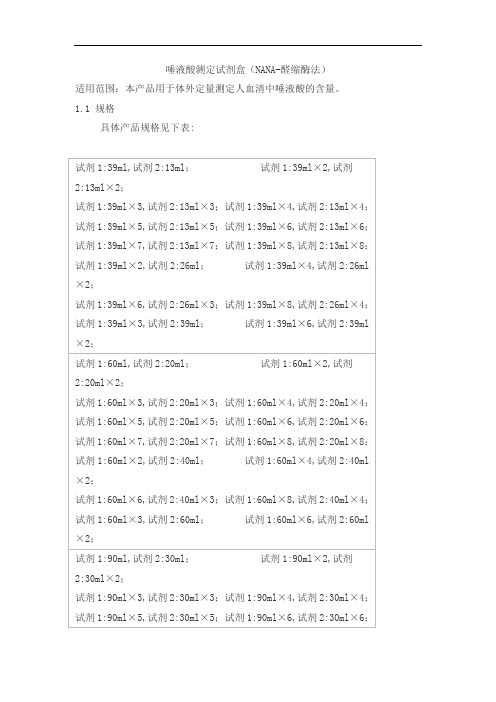
唾液酸测定试剂盒(NANA-醛缩酶法)适用范围:本产品用于体外定量测定人血清中唾液酸的含量。
1.1 规格具体产品规格见下表:1.2 组成成分1.2.1 试剂的组成试剂1:Tris-HCl ≥100mmol/L神经氨酸苷酶≥0.2KU/L 乳酸脱氢酶≥2KU/L 试剂2:Tris-HCl ≥100mmol/LNADH ≥0.13mmol/LN-乙酰神经氨酸醛缩酶≥2KU/L1.2.2 校准品的组成(选配)在水中添加唾液酸唾液酸(30.0~150.0)mg/dl1.2.3 质控品的组成(选配)水平1:唾液酸(20.0~100.0)mg/dl该质控品为血清基质质控品水平2:唾液酸(100.1~200.0)mg/dl该质控品为血清基质质控品校准品、质控品有批特异性,具体靶值见靶值表。
2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色或淡黄色澄清液体;2.1.3 试剂2:无色或淡黄色澄清液体;2.1.4 校准品:无色或淡黄色液体;2.1.5 质控品:无色或淡黄色液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在主波长340nm、副波长405nm、37℃条件下,试剂空白吸光度不小于0.5;2.3.2 试剂空白吸光度变化率在主波长340nm、副波长405nm、37℃条件下,试剂空白吸光度变化率不大于0.02。
2.4 线性2.4.1 线性范围[2.0,200.0]mg/dl,相关系数r>0.990。
2.4.2 线性偏差[40.0,200.0]mg/dl线性范围内,相对偏差不超过±10%;[2.0,40.0)mg/dl线性范围内,绝对偏差不超过±4.0mg/dl。
2.5 分析灵敏度检测浓度为60.0mg/dl的样本时,吸光度变化率不小于0.01。
2.6 重复性2.6.1 试剂重复性测试浓度(30.0±5.0)mg/dl、(60.0±6.0)mg/dl、(95.0±10.0)mg/dl 的样本,重复测试10次,CV≤10%;2.6.2 校准品重复性用试剂测定1瓶校准品,重复测定10次,CV≤10%;2.6.3 质控品重复性用试剂测定1瓶质控品,重复测定10次,CV≤10%。
唾液酸测定试剂盒(比色法)产品技术要求lepu

唾液酸测定试剂盒(比色法)适用范围:用于体外定量测定人血清中唾液酸的浓度。
1.1 规格试剂盒是由试剂1和试剂2组成的液体双试剂,校准品为液体剂型,质控品为冻干粉。
规格及装量见表1。
表1 规格及装量1.2主要组成成分试剂1主要组分:试剂2主要组分:校准品主要组分:质控品主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液;试剂2:无色或黄色透明溶液,校准品:为无色透明液体,质控品:为浅黄色至黄色冻干粉,复溶后为浅黄色至黄色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度在340nm处测定试剂空白吸光度,应≥0.05;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.8。
2.4 分析灵敏度测试50 mg/dL的被测物时,吸光度变化率(ΔA/min)应不低于0.0005。
2.5 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的血清样本,其相关系数r≥0.975。
[10,60)mg/dL区间内绝对偏差不超过±6mg/dL;[60,180]mg/dL区间内相对偏差不超过±10%。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[10,180]mg/dL区间内,线性相关系数r应不低于0.990;2.7.2[10,60)mg/dL区间内绝对偏差不超过±6mg/dL;[60,180]mg/dL区间内相对偏差不超过±10%。
2.8 批间差对同一份样品进行重复测定,相对极差不大于10%。
2.9质控品批内瓶间差变异系数(CV)应≤5%。
2.10溯源性根据GB/T 21415-2008的规定,本试剂盒内校准品溯源至企业工作校准品,与已上市公司试剂盒进行比对赋值。
2.11质控品赋值有效性质控品测值应在靶值范围内。
2.12稳定性2.12.1效期稳定性原包装试剂盒在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7、2.11之规定。
唾液酸测定试剂盒(乳酸脱氢酶法)产品技术要求九强

唾液酸测定试剂盒(乳酸脱氢酶法)适用范围:本试剂盒用于体外定量测定人血清中的唾液酸的含量。
1.1 包装规格见表1。
表1 包装规格1.2 主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品、质控品赋值有差异,具体赋值详见靶值单。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色到淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色到淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A340nm下测定空白吸光度应≥0.7000。
2.4 准确度与已上市产品进行比对试验:在[10.0,200.0] mg/dL区间内,相关系数r ≥0.975,偏差应不超过±10%。
2.5 分析灵敏度样本浓度为60mg/dL时,其吸光度变化率在0.0100~0.1000之间。
2.6 线性区间在[10.0,200.0] mg/dL区间内,线性相关系数r≥0.990,测定的线性偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低两个不同浓度的同一血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.9校准品溯源性按照《GB/T 21415-2008体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用产品校准的来源、赋值过程以及测量不确定度,试剂盒校准品溯源至浙江东瓯诊断产品有限公司的唾液酸测定试剂盒。
5.唾液酸测定试剂盒说明书

唾液酸测定试剂盒(酶法)说明书【产品名称】通用名称:唾液酸测定试剂盒(酶法) 英文名称:SA Determination Kit 【包装规格】试剂1/试剂2: 99ml×6/99ml×2、 99ml×4/66ml×2、 99ml×3/99ml×1、 99ml×2/66ml×1、 99ml×1/33ml×1、 84ml×6/84ml×2、 84ml×4/56ml×2、 84ml×3/84ml×1、 84ml×2/56ml×1、 84ml×1/28ml×1、 60ml×6/20ml×6、 60ml×5/20ml×5、 60ml×4/20ml×4、 60ml×3/20ml×3、 60ml×2/20ml×2、 60ml×1/20ml×1、 48ml×6/16ml×6、 48ml×5/16ml×5、 48ml×4/16ml×4、 48ml×3/16ml×3、 48ml×2/16ml×2、 48ml×1/16ml×1、 45ml×8/20ml×6、 45ml×6/18ml×5、 45ml×4/20ml×3、 45ml×2/15ml×2、 45ml×1/15ml×1、 21ml×5/7ml×5、 21ml×4/ 7ml×4、 21ml×3/7ml×3、 21ml×2/7ml×2、 21ml×1/7ml×1 【预期用途】本试剂用于体外定量测定人血清中唾液酸的含量,临床上可作为一种非特异性炎症指标之一。
唾液酸测定试剂盒(乳酸脱氢酶比色法)产品技术要求zhongshengbeikong

唾液酸测定试剂盒(乳酸脱氢酶比色法)适用范围:本试剂用于体外定量测定人血清中唾液酸的含量。
1.1规格液体双剂型试剂1(R1):60mL×2, 试剂2(R2):20mL×2;试剂1(R1):60mL×1, 试剂2(R2):20mL×1;试剂1(R1):30mL×1, 试剂2(R2):10mL×1;选配校准品:0.5mL×1;选配质控品(2个水平):0.5mL×2。
1.2规格划分说明根据净含量划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体、校准品液体(选配)和质控品液体(选配)组成。
1.3.1 试剂1(R1)液体:三羟甲基氨基甲烷(Tris) 100mmol/L神经氨酸苷酶≥0.2KU/L乳酸脱氢酶≥2KU/L1.3.2 试剂2(R2)液体:三羟甲基氨基甲烷(Tris) 100mmol/LNADH≥0.13mmol/LN-乙酰神经氨酸醛缩酶≥2KU/L 1.3.3 校准品:Tris缓冲液基质唾液酸 40mg/dL~80mg/dL(每批定值)1.3.4 质控品:Tris缓冲液基质唾液酸水平1:35mg/dL~85mg/dL;水平2: 100mg/dL~200mg/dL(每批定值)2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;c) 校准品应为无色或淡黄色透明液体,无混浊、无未溶解物,外包装完整无破损;d) 质控品应为无色或淡黄色透明液体,无混浊、无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和试剂空白吸光度变化率在波长340nm(光径1cm)处,试剂空白吸光度(A)应≥0.800,试剂空白吸光度变化率(△A/min)应≤0.010。
唾液酸含量测定SOP

唾液酸含量测定SOP1.目的为规范唾液酸含量测定的操作,特制定本SOP。
2.范围本SOP适用于唾液酸含量测定的操作。
3.定义无4.职责4.1.QC负责本规程的起草、修订、培训及执行。
4.2.QA、QC组长、质量管理部经理负责本规程的审核。
4.3.质量总监负责批准本规程。
4.4.QA负责本规程执行的监督。
5.引用标准《中华人民共和国药典》2020年版三部。
6.材料6.1.仪器设备:紫外-可见分光光度计:全波长;电子天平;漩涡混合器;电磁炉。
6.2.试剂与配制:0.1mol/L CuSO4溶液:称取0.25g CuSO4·5H2O ,加10ml水溶解。
4%间苯二酚溶液:称取0.4g间苯二酚,加10ml水溶解,临用现配。
HCl·CuSO4溶液:取80ml浓盐酸和0.5ml 0.1mol/L CuSO4溶液,混匀, 临用现配。
反应液:将80.5ml HCl·CuSO4溶液与5.0ml 4%间苯二酚溶液混合,加水定容至100ml,混匀, 临用现配。
有机相:取正丁醇15ml,加乙酸丁酯定容至100ml,12小时内使用。
唾液酸储备液(1mg/ml):精密称取神经氨酸50mg,加注射用水定容至50ml,分装至1.5mlEp管中,1.0ml/支,-20℃保存备用,有效期为一年。
唾液酸标准液(80µg/ml):取唾液酸储备液(1mg/ml)1支,溶解后精密量取800µl 置10ml容量瓶中,加注射用水定容至10ml,临用稀释。
6.3.使用的器具:移液器、容量瓶、烧杯、量筒、试管、刻度吸管等。
7.流程图无8.程序8.1.原理:唾液酸是一类3-脱氧-2-酮糖酸,在适宜的酸浓度及反应温度下,转变为糠醛,糠醛可与芳香族化合物(间苯二酚)及碱性铜离子形成不稳定的红色络合物,在有机酸存在的情况下变成稳定的蓝色物质,其浓度与吸光值成正比。
8.2.标准曲线的测定精确量取唾液酸对照品液(80µg/ml)0、0.1、0.2、0.4、0.8、1.6ml分别加入中试管中,补水至2.0ml,加2ml反应液,混匀,沸水浴15分钟后,冰浴10分钟,再加有机相4ml,混匀30s,吸取上层液,于585nm波长比色测定其OD值。
唾液酸测定法

牛痘疫苗致炎兔皮提取物中N-乙酰神经氨酸含量的测定(方案)前言N-乙酰神经氨酸(又称唾液酸)是一个含9个碳原子并有吡喃糖结构的酸性氨基糖,广泛存在于许多生物体内,是一种天然存在的碳水化合物。
它最初由颌下腺粘蛋白中分离而出,也因此而得名。
唾液酸通常以低聚糖,糖脂或者糖蛋白的形式存在。
人体中,脑的唾液酸含量最高。
脑灰质中的唾液酸含量是肝、肺等内脏器官的15倍。
唾液酸主要的食物来源是母乳,也存在于牛奶、鸡蛋和奶酪中。
已证实唾液酸具有营养大脑及周围神经的作用,近年得到了国际的广泛关注和研究,科学家相继发现了它的许多其它重要生物学功能。
牛痘疫苗致炎兔皮提取物注射液是已上市的镇痛生物制品,主要用于颈、肩、腕综合症;腰痛症病人的疼痛、冷感、麻木等症状的缓解;症状性神经痛。
由于该品种是从动物组织提取的多组份药物,其镇痛机理和活性组份尚都不清楚,这也成了国际和国内科学家长期关注和研究的课题。
鉴于近期有研究表明,该品种在临床中对脑卒中后遗症的治疗有明显改善作用,也了解到到日本制药企业在开展该品种中的唾液酸成份的研究。
故此,我们拟对本产品中唾液酸进行研究及含量测定,为产品新适应症拓展或新的临床治疗提供科学支持。
一、实验目的:测定牛痘疫苗致炎兔皮提取物中的唾液酸(N-乙酰神经氨酸)及其含量。
二、实验方法及步骤:2.1 用N-乙酰神经氨酸标准品验证间苯二酚显色法对唾液酸测定的有效性;比较化学法验证高效液相色谱法对唾液酸测定的有效性。
2.2建立和确认适合牛痘疫苗致炎兔皮提取物中唾液酸的测定方法。
2.3测定牛痘疫苗致炎兔皮提取物中的唾液酸及其含量。
二、实验地点:威世药业(如皋)有限公司理化分析室及精密仪器分析室。
三、主要实验仪器及试剂:方法一(化学法):其他配套器具:移液器、离心管、玻璃试管、玻棒、三角瓶、量杯、量筒、量瓶等器具。
方法二(液相色谱法):其他配套器具:玻璃真空过滤器、样品过滤器、进样器、量杯、量筒等器具。
计量设备及器具均经校验。
人唾液酸(SA)酶联免疫分析试剂盒

人唾液酸(SA)酶联免疫分析试剂盒使用说明书本试剂盒仅供体外研究使用!预期应用ELISA法定量测定人血清、血浆或其它相关生物液体中SA含量。
实验原理用纯化的抗体包被微孔板,制成固相载体,往包被抗SA抗体的微孔中依次加入标本或标准品、生物素化的抗SA抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的SA呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为10ng/ml,做系列倍比稀释(注:不要直接在板中进行倍比稀释)后,分别稀释成10ng/ml,5ng/ml,2.5ng/ml,1.25ng/ml,0.625ng/ml,0.312ng/ml,0.156ng/ml,样品稀释液直接作为标准浓度0ng/ml,临用前15分钟内配制。
如配制5ng/ml标准品:取0.5ml(不要少于0.5ml)10ng/ml 的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml。
4.检测稀释液A:1×10ml。
5.检测稀释液B:1×10ml。
6.检测溶液A:1×120μl(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(100μl/孔),实际配制时应多配制0.1-0.2ml。
如10μl检测溶液A加990μl检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120μl/瓶(1:100)临用前以检测稀释液B1:100稀释。
稀释方法同检测溶液A。
8.底物溶液:1×10ml/瓶。
唾液酸(SA)测定试剂盒(神经氨酸苷酶法)产品技术要求sainuopu

唾液酸(SA)测定试剂盒(神经氨酸苷酶法)适用范围:用于体外定量测定人体血清中唾液酸的含量。
1.1 试剂盒包装规格试剂1:1×15ml,试剂2:1×5ml;试剂1:2×54ml,试剂2:2×18ml;试剂1:3×39ml,试剂2:3×13ml;试剂1:4×54ml,试剂2:4×18ml;试剂1:2×300ml,试剂2:1×200ml;试剂1:2×30ml,试剂2:2×10ml。
校准品(选配):1×1ml;1×3ml。
质控品(选配):1×1ml;1×3ml。
1.2 试剂盒主要组成成分2.1 外观试剂1:无色液体;试剂2:无色液体。
校准品:无色液体。
质控品:无色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、340 nm波长、1cm光径条件下,试剂空白吸光度应不小于0.8。
2.4 分析灵敏度测定浓度为60 mg/dL样本时,吸光度变化值(ΔA)应在(0.005,0.1)范围内。
2.5 线性范围在(5,200)mg/dL线性范围内,线性相关系数r应不小于0.996。
在[50,200)mg/dL范围内的线性相对偏差应不大于±10%;在(5,50)mg/dL范围内的线性绝对偏差应不大于±5mg/dL。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于8%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度回收试验:回收率应在85%~115%之间。
2.9 质控品赋值有效性测定结果在靶值范围内。
2.10 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至企业工作校准品。
DMB 唾液酸标记试剂盒 安全技术说明书

Kit Name: DMB 唾液酸标记试剂盒Kit PN: GKK-407This product is a multi-level kit, composed of the following modules and individual chemical components:Kit ComponentsKit Component Part Number Kit Component NameQtyWS0028 管 A 反应溶液(乙酸和 B-巯基乙醇), 300 µl 2 Vials WS0029 管 B 还原剂(连二亚硫酸钠),1.5 mg 2 Vials WS0030 管 C(DMB 染料), 0.4 mg 2 Vials WS0031 管 D 释放剂, 1.5 ml 2 Vials WS0032 唾液酸参比组合, 1.25 nmol 2 Vials SDSs for each component follow this cover sheet.Transportation Information for the Kit:Proper Shipping Names:DOT IATA/ICAO ChinaUN3316 Chemical Kits UN3316Chemical KitUN3316Chemical Kit页 1/9化学品安全技术说明书根据 GB/T 16483-2008, GB/T 17519-2013发行日期 2020.10.09在 2019.11.12 审核化学品中文(英文)名称, 化学品俗名或商品名:管 A 反应溶液(乙酸和 B-巯基乙醇)(在 1 页继续)· 标签因素· GHS 卷标元素本产品根据化学物质分类及标记全球协调制度(GHS)进行了分类及标记。
· 图示~i GHS07~j GHS08~{GHS09· 名称警告· 标签上辨别危险的成份:2-巯基乙醇 (5.2 %)醋酸 (8 %)· 危险字句吞咽可能有害皮肤接触有害吸入可能有害造成皮肤刺激造成严重眼刺激可能导致皮肤过敏反应怀疑对生育能力或胎儿造成伤害对水生生物有毒对水生生物有毒并具有长期持续影响· 警戒字句如需求医:随手携带产品容器或标签儿童不得接触使用前请读标签· 预防措施避免吸入粉尘/烟/气体/烟雾/蒸气/喷雾戴防护手套/穿防护服/戴防护眼罩/戴防护面具· 事故响应如误吸入:如感觉不适,呼叫急救中心/医生如进入眼睛:用水小心冲洗几分钟。
唾液酸(SA)测定试剂盒(神经氨酸苷酶法)产品技术要求利德曼

唾液酸(SA)测定试剂盒(神经氨酸苷酶法)适用范围:本产品用于体外定量测定人体血清或血浆中唾液酸含量。
1.1 规格试剂1(R1):2×60mL、试剂2(R2):1×60ml;试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):2×45mL、试剂2(R2):2×15mL;试剂1(R1):3×60mL、试剂2(R2):1×60mL;试剂1(R1):2×300mL、试剂2(R2):1×200mL;试剂1(R1):1×400mL、试剂2(R2):2×100mL;试剂1(R1):3×30mL、试剂2(R2):3×10mL;试剂1(R1):1×20mL、试剂2(R2):1×8mL;256T:【试剂1(R1):46.08mL、试剂2(R2):15.36mL】;64T:【试剂1(R1):11.52mL、试剂2(R2):3.84mL】。
校准品(选配):1×1mL。
质控品(选配):低、高值两个水平2×1mL。
1.2 组成试剂盒由试剂、校准品(选配)和质控品(选配)组成:试剂1: Tris-HCL:0.1 mol/L PH=7.0;神经氨酸苷酶:>0.2U/mL;乳酸脱氢酶:>2U/mL。
试剂2: Tris-HCL:0.1 mol/L PH=9.0;NADH:>0.13mmol/L;N-乙酰神经氨酸醛缩酶:>2U/mL。
校准品:单水平的液体校准品,在水基质中添加唾液酸,稳定剂<0.1%;定值范围:(50-70)mg/dL。
质控品:两个水平的液体质控品,在水基质中添加唾液酸,稳定剂<0.1%;定值范围:(50-70)mg/dL和(120-180)mg/dL。
2.1 外观液体双试剂:R1:无色液体, R2:无色液体。
唾液酸酶检测试剂盒(酶反应法)产品技术要求huaye

唾液酸酶检测试剂盒(酶反应法)
适用范围:用于体外定性检测妇女阴道分泌物中唾液酸酶活性。
1.1包装规格:
50人份/盒
1.2主要成分:
每盒含50瓶试剂,每瓶试剂含0.25ml
每瓶试剂的主要成分为:
CL-5001 0.7mg/L
氢氧化钠 20g/L
氯化钾 10g/L
2.1外观
装液瓶外表光滑无破损,液体无色透明,瓶子与盖子衔接处无漏液,标识清晰。
2.2装量
每瓶试剂装量应≥0.25ml。
2.3 临界值
2.3.1本试剂盒的临界值为1.6U/ml
2.3.2阳性符合率
用20人份试剂检测2.0U/ml的唾液酸酶质控品,结果阳性率应≥95%。
2.3.3阴性符合率
用20人份试剂检测1.2U/ml的唾液酸酶质控品,结果阴性率应≥95%。
2.4特异性:
在试剂中分别加入8株108个菌/ml(1.大肠艾希氏菌CMCC 44103、CMCC 44113 ;2.表皮葡萄球菌CMCC 26069;3.金黄色葡萄球菌CMCC 26001;4.淋病奈瑟氏菌CMCC 29106、CMCC 29400;5.白色念珠菌CMCC 10231;6.变形杆菌CMCC 49101。
),结果应不变色,呈阴性反应,对检测无干扰。
2.5批间差
抽取三个批次的试剂,每个批次40人份,检测临界值附近水平(同2.3),各浓度反应结果应一致。
2.6稳定性:
测试在产品有效期后一个月内的试剂盒,结果应符合2.1、2.2、2.3、2.4、2.5的要求。
碘测定试剂盒(比色法)产品技术要求北京世纪沃德生物

碘测定试剂盒(比色法)适用范围:用于体外定量测定人尿液中碘(I)的含量。
1.1 包装规格校准品(选配):水平1:1.0mL×1;1.0mL×2;1.0mL×5。
水平2:1.0mL×1;1.0mL×2;1.0mL×5。
水平3:1.0mL×1;1.0mL×2;1.0mL×5。
水平4:1.0mL×1;1.0mL×2;1.0mL×5。
质控品(选配):水平1:1.0mL×1;1.0mL×2;1.0mL×5。
水平2:1.0mL×1;1.0mL×2;1.0mL×5。
1.2主要组成成分校准品靶值批特异,详见校准品瓶签,质控品质控范围批特异,详见质控品瓶签。
2.1 外观试剂1为无色或微黄色澄清液体,试剂2为无色或微黄色澄清液体。
校准品、质控品为白色至黄色冻干粉,复溶后为无色至黄色液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量试剂液体成分的装量不少于瓶签标示量。
2.3 试剂空白在405nm处测定试剂空白吸光度,应≤2.0。
2.4 分析灵敏度测试200μg/L的被测物时,吸光度变化(△A)≤0.500。
2.5 准确度其回收率应在85%~115%范围内。
2.6 线性2.6.1在[2,1000] μg/L区间内,线性相关系数r≥0.990;2.6.2在[2,400] μg/L区间内,线性绝对偏差不超过±40μg/L;在(400,1000] μg/L区间内,线性相对偏差不超过±10%。
2.7 精密度2.7.1 重复性测试高、低两浓度样本,其结果的变异系数CV应≤5%。
2.7.2 批间差随机抽取三批试剂盒,测试同一份样本,批间相对极差(R)应≤10%。
2.7.3 瓶间均匀性校准品、质控品瓶间变异系数CV≤10%。
2.8 质控品的赋值有效性质控品检测结果应在其质控范围内。
生化多项低值质控品产品技术要求北京世纪沃德生物科技

生化多项低值质控品适用范围:本产品包含项目与本公司生产的试剂盒配套使用,用于50个项目的室内质量控制。
本产品所含项目为:白蛋白、总蛋白、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶、α-淀粉酶、胰淀粉酶、γ-谷氨酰基转移酶、亮氨酸氨基肽酶、乳酸脱氢酶、α-羟丁酸脱氢酶、肌酸激酶、胆碱酯酶、脂肪酶、腺苷脱氨酶、天门冬氨酸氨基转移酶线粒体同工酶、乳酸脱氢酶同工酶1、甘氨酰脯氨酸二肽氨基肽酶、乳酸、总胆汁酸、总胆红素、直接胆红素、胆固醇、甘油三酯、肌酐、尿素、尿酸、葡萄糖、二氧化碳、钙、铁、镁、锌、无机磷、D-3羟丁酸、唾液酸、同型半胱氨酸、磷脂、游离脂肪酸、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肌酸激酶MB同工酶、单胺氧化酶、胰岛素、心脏型脂肪酸结合蛋白、中性粒细胞明胶酶相关脂质运载蛋白、胱抑素C。
1.1包装规格5.0mL×1;5.0mL×6;5.0mL×10;5.0mL×20。
1.2 主要组成成分以人血清为基质的冻干型质控品,约含20mmol/L磷酸盐缓冲液、0.03%防腐剂、5%保护剂、0.15mol/L氯化钠。
具体信息见表1:表1组成及范围质控品质控范围批特异,详见质控品靶值单。
2.1 外观人血清基质质控品,白色至黄色冻干粉,复溶后为无色至黄色澄清液体,目测不得有沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2水分含量水分含量应≤5.0% 。
2.3可接受区间/值检测结果应在各项目质控范围内。
2.4均匀性2.4.1瓶内均匀性)应≤10%。
各项目赋值结果的瓶内变异系数(CV瓶内2.4.2瓶间均匀性各项目赋值结果的瓶间变异系数(CV)应≤10%。
瓶间2.5 稳定性2.5.1效期稳定性原包装质控品在2℃~8℃避光保存,有效期为24个月,稳定期内赋值结果的变化趋势不显著。
2.5.2复溶稳定性游离脂肪酸、单胺氧化酶、中性粒细胞明胶酶相关脂质运载蛋白复溶后质控品在2℃~8℃密封保存24小时,天门冬氨酸氨基转移酶线粒体同工酶、乳酸脱氢酶同工酶1复溶后质控品在2℃~8℃密封保存72小时,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、葡萄糖复溶后质控品在2℃~8℃密封保存5天,α-羟丁酸脱氢酶、腺苷脱氨酶、心脏型脂肪酸结合蛋白复溶后质控品在2℃~8℃密封保存6天,白蛋白、总蛋白、碱性磷酸酶、α-淀粉酶、胰淀粉酶、γ-谷氨酰基转移酶、亮氨酸氨基肽酶、乳酸脱氢酶、肌酸激酶、胆碱酯酶、脂肪酶、甘氨酰脯氨酸二肽氨基肽酶、乳酸、总胆汁酸、总胆红素、直接胆红素、胆固醇、甘油三酯、肌酐、尿素、尿酸、二氧化碳、钙、铁、镁、锌、无机磷、D-3羟丁酸、唾液酸、同型半胱氨酸、磷脂、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、肌酸激酶MB同工酶、胰岛素、胱抑素C复溶后质控品在2℃~8℃密封保存7天,稳定期内赋值结果的变化趋势不显著。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
唾液酸测定试剂盒(比色法)
适用范围:用于体外定量检测人血清中唾液酸(SA)的含量。
1.1产品规格
1.2 主要组成成分
2.1 外观
试剂1应为无色澄清液体,试剂2应为无色澄清液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量
不少于瓶签标示量。
2.3 试剂空白
2.3.1 试剂空白吸光度
在340nm处测定试剂空白吸光度,应≥0.8;
2.3.2 试剂空白吸光度变化率
试剂空白吸光度变化率△A/min≤0.1。
2.4 分析灵敏度
测试100mg/dL的被测物时,吸光度变化率(ΔA/min)应≥0.005。
2.5 线性
2.5.1 在(0,200]mg/dL区间内,线性相关系数r≥0.990。
2.5.2 在(0,50)mg/dL区间内,线性绝对偏差不超过±7.5mg/dL;在[50,200]mg/dL区间内,线性相对偏差不超过±15%。
2.6 精密度
2.6.1 重复性
测定高、中、低不同浓度样本,其结果的变异系数应不超过8%。
2.6.2 批间差
随机抽取三批试剂盒测试同一份样本,试剂盒批间极差不超过10%。
2.7 准确度
待检系统与比对系统测值的相关系数r≥0.975;在(0,50)mg/dL区间内,绝对偏差不超过±7.5mg/dL;在[50,200]mg/dL区间内,相对偏差不超过±15%。
2.8稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
