医用化学复习资料
《药物化学》复习重点资料整理总结

《药物化学》复习重点资料整理总结名词解释:1.稳态血药浓度:以半衰期为给药间隔时间,连续恒量给药后,体内药量逐渐累积,给药4、5次后,血药浓度基本达到稳态水平。
2.药物:是指调节机体生理、生化和病理过程,用以预防、诊断、治疗疾病的物质。
3.药理学:是研究药物与机体之间相互作用及其规律的一门学科,包括药物效应动力学、药物代谢动力学两个方面。
4.首关消除:有些口服药物在经胃肠壁及肝脏时,会被此处的酶代谢失活。
5.肝肠循环:有的药经胆汁排泄再经肠黏膜上皮细胞吸收,由门静脉重新进入全身循环,这种在小肠、肝脏、胆汁间的循环称为肝肠循环。
6.治疗指数:药物的半数致死量LD5a与半数有效量ED50的比值。
7.处方药:必须凭执业医师或执业助理医师处方才可调配。
8.肾上腺素升压作用的翻转:预先给予α受体阻断药能阻断肾上腺素激动α受体的缩血管作用,保留激动β受体的血管舒张作用,使升压作用翻转为降压作用。
9.耐受性:机体对药物的敏感性降低,需增加剂量才能发挥原有药效。
10.反跳现象:长期大剂量使用某药物后突然停药,导致原有病情再现或加重。
11.二重感染:长期使用广谱抗菌药,使得敏感菌被抑制,不敏感菌大量繁殖,引发新的感染。
模块-1、在机体方面,影响药物作用的因素有哪些?(填空题)年龄性别个体差异病理状态心里精神因素遗传因素2、“三致”反应致畸致癌致突变3、药物的二重作用包括什么?P5~防治作用和不良反应4、药物作用的主要类型包括哪些?P4-5兴奋作用和抑制作用局部作用和吸收作用选择性作用和普遍作用直接作用与间接作用预防作用和治疗作用模块二1、药品贮存条件中阴凉处、凉暗处、冷处、常温的条件P28阴凉处:系指不超过20℃阴暗处:系指避光并不超过20℃冷处:系指2℃~10℃常温:系指10℃~30℃2、批准文号的代表字母和数字各自的含义,批号的含义P27字母:化学药品:H 中药:Z 保健:B 生物制品:S体外化学诊断试剂:T 药用辅:F 进口分包装药品:J数字第1、2位为原批准文号的来源代码,第3、4位为换发批准文号之后(公元年号)的后两位数字,第5~8位为顺序号批号的含义:在药品生产过程中,将同一次投料、同一生产工艺所生产的药品定为同一个批号。
药物化学复习资料(化学结构式)
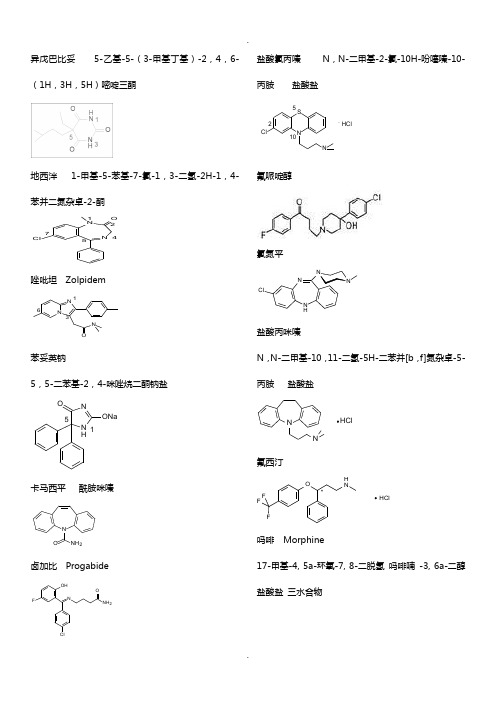
异戊巴比妥 5-乙基-5-(3-甲基丁基)-2,4,6-(1H ,3H ,5H )嘧啶三酮地西泮 1-甲基-5-苯基-7-氯-1,3-二氢-2H-1,4-苯并二氮杂卓-2-酮NNO Cl12457唑吡坦 ZolpidemNN ON 136苯妥英钠5,5-二苯基-2,4-咪唑烷二酮钠盐N H NO ONa15卡马西平 酰胺咪嗪N ONH 2卤加比 ProgabideOHFNClNH 2O盐酸氯丙嗪 N ,N-二甲基-2-氯-10H-吩噻嗪-10-丙胺 盐酸盐.HClNSClN2510氟哌啶醇氯氮平NNNN HCl盐酸丙咪嗪N ,N-二甲基-10,11-二氢-5H-二苯并[b ,f]氮杂卓-5-丙胺 盐酸盐NNHCl氟西汀OH NFFF HCl*吗啡 Morphine17-甲基-4, 5a-环氧-7, 8-二脱氢 吗啡喃 -3, 6a-二醇盐酸盐 三水合物OOHN HO134567891011121314151617. HCl . 3H 2O盐酸哌替啶1-甲基-4-苯基-4-哌啶甲酸乙酯盐酸盐NOO . HCl盐酸美沙酮 NO. HCl喷他佐辛NHOH咖啡因 Caffeine1,3,7-三甲基-3,7-二氢-1H - 嘌呤 -2,6-二酮一水合物N NNNO O. H 2O 137吡拉西坦2-(2-氧代-吡咯烷-1-基)乙酰胺NH 2NOO氯贝胆碱 Bethanechol ChlorideOO H 2NN +(CH 3)3 Cl -CH 3毛果芸香碱NN OH 3CCH 3O溴新斯的明 Neostigmine BromideN +(CH 3)3 Br -ON OH 3CCH 3多奈哌齐硫酸阿托品 Atropine Sulphate. H 2SO 4 . H 2ON OOHOCH 32溴丙胺太林Br -OOO NH 3CCH 3CH 3CH 3CH 3+哌仑西平苯磺阿曲库铵++N H 3CO H 3COOCH 3H 3COO O N OOOCH 3OCH 3OCH 3OCH 3CH 3H 3C SOO O -. 2泮库溴铵1,1¢-[3a ,17b-双-(乙酰氧基)-5a-雄甾烷-2b ,16b-二基]双-[1-甲基哌啶鎓]二溴化物++H NHHHONCH 3CH 3H 3COH 3C H 3C OH 3C O. 2Br -肾上腺素 EpinephrineHO H NOHHOCH 3麻黄碱 EphedrineCH 3H NOHCH 3沙丁胺醇 SalbutamolOHH NCH 3CH 3HOCH 3HO马来酸氯苯那敏N ,N-二甲基-g-(4-氯苯基)-2-吡啶丙胺顺丁烯二酸盐,又名扑尔敏.NClNO OOH OH氯雷他定4-(8-氯-5,6-二氢-11H-苯并[5,6]-环庚烷[1,2-b]吡啶-11-亚基-1-羧酸乙酯NN OOCl盐酸西替利嗪2-[4-[(4-氯苯基)苯基甲基]-1-哌嗪基]乙氧基乙酸二盐酸盐.2HClOOOHClNN咪唑斯汀 Mizolastine2-〔〔1-〔1-〔(4-氟苯基)甲基〕-1H-苯并咪唑-2-基〕哌啶基-4-基〕甲基氨基〕嘧啶-4(3H )-酮盐酸普鲁卡因 Procaine Hydrochloride 4-氨基苯甲酸-2-(二乙氨基)乙酯盐酸盐盐酸利多卡因 Lidocaine HydrochlorideN-(2,6-二甲苯基)-2-(二乙氨基)乙酰胺盐酸盐一水合物盐酸达克罗宁盐酸普萘洛尔Propranolol 1-异丙氨基-3-(1-萘氧基)-2-丙醇盐酸盐硝苯地平Nifedipine盐酸地尔硫卓DiltiazemHydrochlorideHCl硫酸喹尼丁(9S )-6′-甲氧基-脱氧辛可宁-9-醇硫酸盐二水合物2H 2SO 42H 2O1盐酸胺碘酮(2-丁基-3-苯并呋喃基)[4-[2-(二乙氨基)乙氧基]-3,5-二碘苯基]甲酮盐酸盐HClOOOIIN123451,3,2,1,2,卡托普利 1-[(2S )-2-甲基-3-巯基-1-氧代丙基]-L-脯氨酸N OOH1氯沙坦2-丁基-4-氯-1-[[2′-(1H -四唑-5-基)[1,1′-联苯]-4-基]甲基]-1H-咪唑-5-甲醇4'3'2'1'432145154321NHN N NNN OHCl硝酸甘油1,2,3-丙三醇三硝酸酯地高辛洛伐他汀 Lovastatin吉非贝齐Gemfibrozil氯吡格雷Clopidogrel(S )-a-(2-氯苯基)-6,7-二氢噻吩并[3,2-C]吡啶-5(4H )-乙酸甲酯32??????????华法林钠OO NaOO利血平Reserpine 11,17a-二甲氧基-18b-[(3,4,5-三甲氧基苯甲酰)氧]-3b ,20a-育亨烷-16b-甲酸甲酯• 西咪替丁 Cimetidine N ’-甲基-N ”-[2-[[(5-甲基-1H -咪唑- 4-基)-甲基]硫代]-乙基]-N -氰基胍雷尼替丁Ranitidine N ’-甲基-N- [2-[ [ [ 5- (二甲氨甲基)-2-呋喃基] 甲基] 硫代] 乙基] -2-硝基-1,1-乙烯二胺盐酸盐奥美拉唑(R, S )5-甲氧基-2- (4-甲氧基-3,5-二甲基-吡啶-2-基-甲基氧硫基) 苯并咪唑昂丹司琼(消旋)1,2,3,9-四氢-9-甲基-3-[(2-甲基-1H-咪唑-1-基)甲基]-4H -咔唑-4-酮西沙必利 (±)顺式-4-氨基-5-氯-N-[1-[3-(4-氟苯氧基)丙基]-3-甲氧基-4-哌啶基]-2-甲氧基苯甲酰胺西沙必利甲氧氯普胺 MetoclopramideN-[(2-二乙氨基)乙基]-4-氨基-2-甲氧基-5-氯-苯甲酰胺多潘立酮Domperidone 5-氯-1-[1-[3-(2,3-二氢-2-氧代-1H -苯并咪唑-1-基)丙基]-4-哌啶]-2,3-二氢-1H -苯并咪唑-2-酮联苯双酯Bifendate对乙酰氨基酚(Paracetamol ) 扑热息痛N -(4-羟基苯基)乙酰胺CH 3N HOHO阿司匹林 Aspirin 2-(乙酰氧基)苯甲酸; 乙酰水杨酸OO HOC H 3O吲哚美辛 lndomethacin2-甲基-1-(4-氯苯甲酰基)-5-甲氧基-1H -吲哚-3-乙酸NH 3COOHO CH 3OCl双氯芬酸钠 Diclofenac Sodium 2-[( 2,6-二氯苯基 ) 氨基 ] 苯乙酸钠 又名双氯灭痛。
《医用化学》全册课件

分散系的分类 :*
1.按分散相粒子的组成分 均相(单相)分散系
非均相(多相)分散系
判断均相与非均相的方法:
分散相是否以单个分子(或离子)分散 在分散介质中。
是:均相(单相)分散系 否:非均相(多相)分散系
什么是相?
Äà ÍÁ
指在一个体系中,物理和化学性质
完²Ë 全ÓÍ 相同的一部分。
1/3ÊÔ ¹Ü Ë®
• 特征:*
• 1.通透性:能透过滤纸,不能透过半透膜;
.....
渗析(透析)
2.光学性质:丁铎尔效应;
丁铎尔效应:聚光光束通过放在暗处的 溶胶时,从侧面可看到一条明亮的光柱,
这是光散射的结果。*
聚光光束
低分子 溶液
........ .. .. 溶胶
3.动力学性质:布朗运动;
4.电学性质:电泳。
第一节 溶液与分散系的概念
• 溶液:一种或几种物质以分子或离子形式均匀 地分散到另一种液体物质中所得的稳定混合物, 例如 糖水、盐水。
• 溶液中能溶解其它物质的是溶剂(水),被溶 解的物质是溶质(蔗糖、NaCl)。
• 溶液 = 溶质 + 溶剂
Äà ÍÁ
²Ë ÓÍ
1/3ÊÔ ¹Ü Ë®
Õñ µ´ »ì ÔÈ
判断相的依据Õñ:µ´ »ì ÔÈ
¾² ÖÃ
Õá ÌÇ
分散相是否以单个分子(离子)
分散在分散介质中。
ʳ ÑÎ
2. 按分散相粒子的大小分 粗分散系 胶体分散系 分子(离子)分散系
一、粗分散系
• 分散相粒子直径>100 nm,多相,不稳定。 • 例:悬浊液、乳浊液
二、胶体分散系
• 分散相粒子直径1~100 nm,多相,较稳定。
医用化学基础

医用化学基础
医用化学基础是指应用化学原理和方法研究医学相关领域的基础知识。
它涉及医学化学、药物化学、临床化学等多个学科的知识。
医用化学基础主要包括以下几个方面的内容:
1. 化学原理:包括原子结构、化学键、化学反应、化学平衡、溶解度、酸碱平衡等基本化学原理,这些原理对于理解和解释医学中的化学过程和反应非常重要。
2. 药物化学:研究药物的结构、性质、合成方法和作用机理等方面的知识。
药物化学主要包括药物结构与活性的关系、药物合成、药物代谢、药物分析等内容。
3. 分析化学:研究分析化学方法和技术,在医学领域中常用于药物质量控制、临床试验和生物样品分析等。
分析化学的主要内容包括仪器分析、化学分析方法、质量控制等。
4. 临床化学:研究临床诊断和治疗中的化学技术和方法。
临床化学包括临床生化学(研究生物样本中各种生化物质的测定和分析)、临床药学(研究药物的合理使用和药物治疗)等内容。
5. 医学化学:将化学原理和方法应用于医学研究和实践中,包括药物设计、医学影像学、分子生物学等多个领域。
医用化学基础的研究和应用对于药物研发和控制、临床诊断和治疗、生物医学研究等领域都具有重要作用。
它为医学领域提供了有效的化学工具和方法,促进了医学的发展和进步。
药物化学复习提纲-(自动保存的)

一、填空题(5*2分=10分)1、巴比妥酸无催眠作用,当5位碳上的两个氢原子均被取代后,才具有镇静催眠作用。
2、吗啡结构中B/C环呈顺式,C/D环呈反式,C/E环呈顺式,环D为椅型构象,环C 呈半船式构象,镇痛活性与其分子构型密切相关。
3、根据局部麻醉药的特点,可将其化学结构概括为三部分,既包括亲脂性部分、中间部分和_亲水性部分_。
4、药物中的杂质主要来源有合成过程引入和贮存过程引入5、阿托品的水解产物是莨菪醇和莨菪酸。
6、非甾体抗炎药是抑制环氧化酶的活性,减少体内从花生四烯酸合成前列腺素和血栓素前体的一大类具有不同化学结构的药物,这些药物都具有解热、镇痛和抗炎的作用,其抗炎的作用的机制与甾类抗炎药如可的松不同。
7、左旋肾上腺素在pH 4以下的水溶液中能发生消旋化反应而使活性降低。
8、药物从进入人体到产生药效的过程,要经历药剂相、药代动力相、药效相三个重要相。
P5219、解热镇痛药按结构可分为水杨酸类,苯胺类,和吡唑酮类等。
10、去甲肾上腺素为 R构型,具有左旋性,结构上具有儿茶酚胺的结构11、拟胆碱药物的受体有 M1受体,M2受体, M3受体,N受体12、药物分子含有2个苯环,一般空间位阻较小的部位发生氧化代谢;若2个苯环取代基不同,则一般是电子云密度高的芳环易被氧化。
13、普鲁卡因作用时间较短的主要原因是_含有酯基,易水解分解。
14、先导化学物的发现和优化方法有很多,归纳起来可认为是从分子的多样性,分子的互补性和分子的相似性三方面考虑。
二、名词解释(5*4分=20分)1.*组合化学(combinatorial chemistry):是一门将化学合成、组合理论、计算机辅助设计及机械手结合一体,并在短时间内将不同构建模块用巧妙构思,根据组合原理,系统反复连接,从而产生大批的分子多样性群体,形成化合物库,然后,运用组合原理,以巧妙的手段对库成分进行筛选优化,得到可能的有目标性能的化合物结构的科学。
大学医用化学试题及答案

大学医用化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种元素在人体中的含量最高?A. 氧B. 碳C. 氢D. 氮答案:A2. 医用化学中,pH值的计算公式是?A. pH = -log[H+]B. pH = log[H+]C. pH = -log[OH-]D. pH = log[OH-]答案:A3. 以下哪种化合物是人体必需的微量元素?A. 钠B. 铁C. 钙D. 钾答案:B4. 以下哪种物质是人体中的主要储能物质?A. 葡萄糖B. 糖原C. 脂肪D. 蛋白质答案:C5. 以下哪种物质是人体中的主要供能物质?A. 葡萄糖B. 糖原C. 脂肪D. 蛋白质答案:A6. 以下哪种维生素是脂溶性的?A. 维生素CB. 维生素B1C. 维生素AD. 维生素D答案:C7. 以下哪种氨基酸是人体必需氨基酸?A. 甘氨酸B. 丙氨酸C. 赖氨酸D. 丝氨酸答案:C8. 以下哪种物质是人体中的主要缓冲系统?A. 碳酸氢盐缓冲系统B. 磷酸盐缓冲系统C. 血红蛋白缓冲系统D. 蛋白质缓冲系统答案:A9. 以下哪种物质是人体中的主要抗氧化剂?A. 维生素CB. 维生素EC. 辅酶Q10D. 以上都是答案:D10. 以下哪种物质是人体中的主要凝血因子?A. 纤维蛋白原B. 凝血酶C. 血小板D. 以上都是答案:D二、填空题(每题2分,共20分)1. 医用化学中,______是衡量溶液酸碱性的指标。
答案:pH值2. 医用化学中,______是人体中含量最高的无机盐。
答案:钠盐3. 医用化学中,______是人体中含量最高的有机物。
答案:蛋白质4. 医用化学中,______是人体中的主要储能物质。
答案:脂肪5. 医用化学中,______是人体中的主要供能物质。
答案:葡萄糖6. 医用化学中,______是人体中的主要缓冲系统。
答案:碳酸氢盐缓冲系统7. 医用化学中,______是人体中的主要抗氧化剂。
答案:维生素C8. 医用化学中,______是人体中的主要凝血因子。
药物化学复习提纲
药物化学复习提纲考试题型:1、填空题;2、单项选择;3、多项选择;4、合成化学反应;5、论述题;6、名词解释。
注:第一章至第四章,因本人没上课,整理的资料不全面,希望同学们自己看书。
注:化学名和化学结构请同学们参照书本进行整理。
以下是本人整理的资料,内容可能不全面,供同学们参考,请同学结合列出的重点进行复习。
P1 药物化学——是一门发现与发明新药、合成化学药物、阐明药物化学性质、研究药物分子与机体细胞之间相互作用规律的综合性学科。
P8 药物的命名三种类型:1、通用名(国际非专有名)(INN);2、化学名;3、商品名P13 中枢神经系统药物分类:代表药化学名化学式化学反应理化性质临床应用镇静催眠药异戊巴比妥5-乙基-5-(3-甲基丁基)-2,4,6(1H,3H,5H)-嘧啶三酮异戊巴比妥可与吡啶和硫酸铜溶液作用,生成紫蓝色络合物①本品为白色有光泽的结晶性粉末;无臭,味微苦,有引湿性;水溶液呈碱性反应。
地西泮1-甲基-5-苯基-7-氯-1,3-二氢-2H-1,4-苯并二氮杂卓-2-酮(diazepam)本品的酸性水溶液不稳定,水解发生在1,2位或4,5位,亮放映平行进行,最终水解成2-甲氨基-5-氯-二苯甲酮。
4,5位开主要用于失眠、抗焦虑、抗癫痫及其他神经官能症。
本品的二氮卓环上具有内酰胺及亚胺的结构,在酸性或碱性溶液中,受热易水解,生成2-甲氨基-5--氯-二苯甲酮和甘氨酸。
抗癫痫药苯妥英钠5,5-二苯基-2,4-咪唑烷二酮钠盐在水溶液中加入二氯化汞试液,可生成白色沉淀,在氨试液中不溶。
本溶液与咸加热,环状酰脲结构可以开环,分解产生二苯基脲基脲基乙酸,最后生成二苯基氨基乙酸治疗癫痫大发作和局限性发作的主要用药,对小发作无效。
卡马西平5H-二苯并[b,f] 氮杂卓-5-甲酰胺长时间光照,固体表面有白色变橙黄色,部分环化成二聚体和氧化成10,11-环氧化物。
需避光保存。
:①室温、干燥稳定②受潮片剂硬化,药效降低③光照引起聚合和氧化,避光保存(3)代谢10氧代衍生物是奥卡西平属于三环(二苯并氮杂卓类)抗癫痫药。
医用化学溶液知识点总结

医用化学溶液知识点总结一、介绍医用化学溶液是一种溶解了化学药品的液体,是医疗领域中常用的一种处理方式,通过将药物溶解在液体中,可以更方便的进行给药,提高药物的稳定性和可控性,以及减少胃肠道刺激等副作用。
此外,医用化学溶液还可以应用于各种实验室研究和医疗检测等领域。
在医学领域,医用化学溶液的种类繁多、用途广泛,因此对医用化学溶液的认识和掌握十分必要。
二、常用医用化学溶液1. 盐水盐水是医学上最常见的医用化学溶液之一,主要是将氯化钠溶解在水中制备而成。
盐水具有与人体生理盐水浓度接近、成本低廉的特点,常用于静脉注射、输液和清洗伤口等医疗操作中。
2. 葡萄糖溶液葡萄糖溶液是将葡萄糖溶解在水中制备而成,通常用于补充患者体内的能量或滋养物质,适用于各种急性和慢性病患者。
3. 生理盐水生理盐水是一种含有氯化钠、氯化钾、碳酸氢钠和葡萄糖等成分的医用化学溶液,通常用于输液、洗胃、灌肠等治疗过程中。
4. 林格液林格液是一种含有氯化钠、氯化钾、氯化钙等成分的化学溶液,常用于细胞培养、细胞冻存等实验室研究中。
5. 硝酸银溶液硝酸银溶液是将硝酸银溶解在水中而成,通常用于皮肤感染、烧伤、溃疡等治疗中,具有抑菌和杀菌作用。
6. 碘伏碘伏是一种含有碘酒和酒精的化学溶液,常用于外科手术前的皮肤消毒和外伤处理中。
7. 碘化钠溶液碘化钠溶液是一种含有碘酒和氯化钠的溶液,常用于预防和治疗碘缺乏病、甲状腺疾病等。
8. 碳酸氢钠溶液碳酸氢钠溶液是将碳酸氢钠溶解在水中而成,通常用于解毒、中和胃酸、治疗高血钾等疾病。
9. 氨水溶液氨水溶液是一种含有氨气和水的化学溶液,常用于清洁伤口、止血、抗菌等医疗过程中。
10. 硫酸铜溶液硫酸铜溶液是将硫酸铜溶解在水中而成,通常用于眼科治疗、皮肤感染等疾病。
以上列举了一些常见的医用化学溶液,但实际上医用化学溶液种类繁多,适用范围广泛,需要根据具体疾病和治疗目的进行选择和使用。
三、医用化学溶液的制备医用化学溶液的制备依据公式法、稀释法和蒸馏法等多种方法进行,具体步骤如下:1. 公式法公式法是指根据药物的化学成分、药效等参数,按照一定的配方比例制备医用化学溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
文档来源为:从网络收集整理.word版本可编辑.欢迎下载支持. 有机化合物分子中能体现一类化合物性质的原子或基团,通常称为功能基或官能团。 经过均裂生成自由基的反应叫作自由基反应。一般在光、热或过氧化物存在下进行。 共振论的基本内容:一个分子或离子可以用≥2个只是电子位置不同的Lewis结构式表示。在共振理论中, 每一个Lewis结构式称为共振式, 任何一个单一的共振式并不能代表分子或离子的真实结构, 只有共振式的群体或共振杂化体(resonance hybrid)能代表分子或离子的真实结构。 因单键旋转而使分子中原子或基团在空间产生不同的排列形象称为构象。每一种空间排列形象就是一种构象, 因构象不同而产生的异构现象称构象异构。 两个碳环共用两个或更多个碳原子的称为桥环化合物。其中桥碳链的交汇点原子称为桥头碳原子。 电子效应——指分子中电子密度分布的改变对性质产生的影响。它又可分为诱导效应 (Inductive effect, I ) 和 共轭效应 (Conjugative effect, C )两类。立体效应——指分子的空间结构对性质所产生的影响。 诱导效应——由于分子中电负性不同的原子或基团的影响使整个分子中成键的电子云沿碳链(共价键)向一个方向偏移,使分子发生极化的现象。电负性差引起;单向传递、短程作用 如果取代基X的电负性大于H ,X具有吸电子性, 故称为吸电子基或亲电基。由它引起的诱导效应叫做吸电子诱导效应或亲电诱导效应,一般用 -I 表示。如果取代基 Y 的电负性小于 H ,Y 具有供电子性, 称为斥电子基或供电基。由它引起的诱导效应叫做斥电子诱导效应或供电诱导效应,一般用 +I 表示。 根据实验结果, 得出一些取代基的电负性次序如下: -N+R3 > -NO2 > C=O > -F > -Cl > -Br > -I > -OCH3 > -NHCOCH3 > -C≡C > -C6H5 > -CH=CH2 > -H > -CH3 > -C2H5 > -CH(CH3)2 > -C(CH3)3 > -COO- > -O 在 H 前面的为吸电子基, 在 H 后面的为斥电子基。 当不对称烯烃与HBr加成时, 如存在少量过氧化物(R-O-O-R), 将主要得到反马尔可夫尼可夫规则产物。 当共轭体系受到外电场的影响(如试剂进攻等)时, 电子效应可以通过π电子的运动、沿着整个共轭链传递, 这种通过共轭体系传递的电子效应称为共轭效应。电子离域引起;键长平均化,体系能量降低,交替极化,远程作用 苯环本身不易被氧化,但连有侧链的烷基苯,若侧链含有α H,则侧链易被氧化为芳香羧酸。舍掉侧链所有基团,只留羧基。 邻、对位定位基, 又称第一类定位基,“指挥”新取代基主要进入它的邻位和对位,同时活化苯环(卤素除外)。属于第一类基的有(按定位能力由大到小排):
-O-,-NH2,-OH; -OR, -NH-CO-CH3, -OCOR;
-CH3, -C6H5, -CH2CO2H; -F,-Cl,-Br,-I,-CH2Cl 间位定位基,又称第二类定位基,“指挥”新取代基主要进入它的间位,同时钝化苯环。属于第二类基的有(按钝化能力由大到小排):
-NR3, -NO2, -CF3; -CN, -SO3H, -COR(H), -CO2H, -CCl3
-COOR,-CONHCH3, -CONH2,-NH3, etc. 文档来源为:从网络收集整理.word版本可编辑.欢迎下载支持. 3. 二取代苯的定位效应 (1) 两个基定位效应一致时,第三基进入苯环的位置由定位效
应决定。 (2) 两基团定位效应不一致时, 第三基进入位置主要由强定位基决定(定位能力: 致活基> 致钝基)。 稠环芳香烃——由两个或两个以上的苯环共用邻位碳原子相互稠合而成。这类化合物各有其特殊的名称和编号。
萘的化学性质——.亲电取代反应
2. 加成反应 对称面(planes of symmetry)是指能将分子结构剖成互为镜像的两半的面。如通过圆
球心的面;将长方形盒子分成各一半的面都是对称面。 写Fischer投影式的要点: 横前竖后 (1) 水平线和垂直线的交叉点代表手性碳,位于纸平面上。 (2) (2) 连于手性碳的横键代表朝向纸平面前方的键。 (3) (3) 连于手性碳的竖键代表朝向纸平面后方的键。 (4) 2R,3S-2,3,4-三羟基丁醛 Fischer投影式 立体结构式 锯架式 Newman投影式 只在一个平面上振动的光称为平面偏振光,简称偏振光。偏振光的振动平面习惯称为偏振面。化合物能使偏振光的偏振面旋转的性能称为旋光性(optical activity)。手性化合物都具有旋光性。 为了使一个化合物的旋光度成为特征物理常数,通常用1dm长的旋光管,待测物质的浓度为1g/ml,用波长为589nm的钠光(D线)条件下,所测得的旋光度,称为比旋光度。 CHO
CH2OHHOH
D-(+)-甘油醛 CHOCH2OHHHO L-(-)-甘油醛 R/S 构型标记法 将手性碳上的4个原子或基团中优先次序最小的一个置于远离视线的方
向, 然后观察朝向自己的其余3个基团的优先次序。顺时针方向排列为R构型;反时针方向排列为S构型。 一对对映体的等量混合物称为外消旋体(racemic mixture 或 racemate)。通常用(±) 或 dl 表示。外消旋体是混合物。 卤代烷亲核取代反应 反应中, 亲核试剂 :Nu(-) (通常为含孤对电子的试剂如 :NH3,或带负电荷的试剂如OH-、CN-、RO-) 进攻卤烷分子中带部分正电荷的碳原子, 生成取代产物。由亲核试剂对显正电性文档来源为:从网络收集整理.word版本可编辑.欢迎下载支持. 的碳原子进攻而引起的取代反应, 称为亲核取代反应(nucleophilic substitution), 以SN表示。 C—X 键的极性使得 α C 带部分正电荷,并通过诱导效应影响 β H,使其显酸性。正电性的α C 易受亲核试剂进攻, 发生取代反应;而显酸性的 β H 易受碱进攻, 卤代烃失去 β H 而发生消除反应(elimination,E)。仲或叔卤代烃脱 HX 时, 主要产物是双键上烃基最多的烯烃, 即主要是从含 H 较少的 β-C 上脱氢。此称为 Saytzeff 规则。 试剂的碱性越强,浓度越大,越有利于消除,低极性溶剂有利于消除,升高温度有利于消除。 烯丙型/苄型卤烃 孤立型卤烃 乙烯型/苯型卤烃 烯丙基和苄基卤代烃在室温下就能与硝酸银醇溶液发生反应,生成卤化银沉淀。 3类不饱和卤烃进行取代反应的活性次序为: 烯丙型/苄型卤烃 > 孤立型卤烃 > 乙烯型/苯型卤烃 卤代烃能与 Mg、Li、Na、K、Al 等多种金属反应生成含 C—M 键的金属有机化合物。 利用Grignard试剂与醛酮的反应可制备各种醇: Grignard 试剂若遇到含活泼氢的化合物 (如水、醇等),则立即分解生成烷烃。 乙炔钠与醇反应时生成乙炔,说明炔烃的酸性比醇更弱, 不同结构醇钠的碱性强弱次序 是:叔醇钠 > 仲醇钠 >伯醇钠。醇钠在有机合成中可用作引入烷氧基的试剂。 邻二醇类化合物也有酸性,并且由于二个OH处于相邻碳原子上使酸性有所增强。在碱 性溶液中,邻二醇类化合物可与Cu2+反应生成蓝色的铜盐。
CHCH2—CH—CH2
OHOHOH
+Cu(OH)22—CH—CH2
OOOHCu
-2H2O
Cupric glycerinate甘油铜(蓝色) 醇可与含氧无机酸(如硝酸、亚硝酸、硫酸和磷酸等)反应,生成相应的无机酸酯,其 中的 N、P 和 S 都是通过 O 与烷基相连的。 甘油三硝酸酯是一种缓解心绞痛的药物,又是一种烈性炸药。
ROPOOOHPOOOHPOOHOH烷基三磷酸酯
分子内脱水成烯由易到难:叔丁醇 > 异丙醇 > 乙醇 工业上多采用Lewis酸如Al2O3 催化醇的脱水反应。正碳离子稳定性:叔碳 > 仲碳 > 伯碳 醇脱水成烯活性:叔醇 > 仲醇 > 伯醇 硫醇的命名与相应的醇相同,只是在母体名称前加一个硫字。当硫醇结构较复杂时, 把 -SH (巯基) 作为取代基命名。与无机硫化物类似,硫醇可与Pb、 Hg 、Cd、 Ag 、Cu 等重金属盐或氧化物作用生成不溶于水的硫醇盐。 次磺酸 亚磺酸 磺酸
几类物质的酸性比较:有机酸> 碳酸> 苯硫酚> 苯酚> 硫醇> 醇pKa~56.48.310 11 16~18
醚 (ethers) 是两个烃基通过氧原子连接起来的化合物。环氧化合物(epoxides)多指含有三元环的醚及其衍生物。简单的醚常用普通命名法命名:“A基B基醚”。单醚一般省略“二”字。混醚按先小后大,先芳基后脂基排列烃基。结构复杂的醚可用系统命名法:将醚键所连接的2个烃基中碳链较长的烃基作母体,称“某烃氧基某烃”。 O
四氢呋喃 OO1,4-二氧六环 文档来源为:从网络收集整理.word版本可编辑.欢迎下载支持. 冷浓H2SO4
C2H5OC2H
5
n-C5H12
乙醚溶解,呈一相
戊烷不溶解,分层 醚键的断裂——在加热条件下, 醚与氢卤酸反应,醚键断裂,生成醇和卤代烷,生成的醇
可进一步与过量的氢卤酸反应。浓的HI是最有效的分解醚的试剂。 过氧化醚受热易分解爆炸,蒸馏醚时应避免蒸干,过氧化醚的检验:酸性碘化钾-淀粉试纸 ,过氧化醚的除去:还原剂硫酸亚铁或亚硫酸钠。烷基醚在空气中久置,α-碳上的氢可被氧化, 生成醚的过氧化物。 乙醚 过氧化乙醚 冠醚 是分子中含有多个 —OCH2CH2— 结构单元的大环多醚, 因其立体结构像王冠, 故
称冠醚。 环氧化合物的系统命名法通常以“环氧乙烷”为母体, 三元环中氧原子编号为1。
OH2CCCH2CH3
CH3
1
23 2-甲基-2-乙基环氧乙烷
环氧化物分子中存在张力很大的三员氧环,化学性质活泼。与酸、碱或其它强的亲核试剂均能直接进行开环反应(opening of ring reaction) 。 在稀酸条件下,环氧化合物的环被打开,生成相应的加成产物。
OH+, H2OH2CCH2
OHOH乙二醇
HClH2CCH
2
OHCl2-氯乙醇
H+, CH3OHH2CCH
2
OHOCH3
2-甲氧基乙醇
环氧化合物在强碱作用下, 环被打开,生成相应的加成产物。 非对称的环氧化合物在碱性条件或用强亲核试剂进行开环反应时,亲核试剂主要进攻取代基较少的环氧碳原子。
OH2CCHCH3
+ CH3OH
CH3OCH2CHCH3CH3ONa
OH1-甲氧基-2-丙醇
+ NaHSO3
C=OHC
H
SO3Na
OHNaCN
H2O
CHCNOH
氰醇 在干燥HCl存在下,醇与醛的羰基加成生成半缩醛,半缩醛还可以与另一分子醇反应, 失水生成缩醛(acetal)。 Grignard试剂对醛酮的加成是不可逆反应。利用此反应可以制备具有更多碳原子及新碳架的
