初中化学第三单元 课题3:元素
人教版初中化学九年级上册第三单元课题3元素教学设计

五、作业布置
为了巩固本节课的学习内容,确保学生对元素周期表、周期律以及元素符号等知识的掌握,特布置以下作业:
1.完成课本第三单元课题3的课后习题,包括填空题、选择题和简答题,要求学生在完成作业过程中,注意理解题目要求,规范书写,提高解题效率。
4.通过实验探究,学会观察和记录实验现象,培养基本的实验操作技能。
(二)过程与方法
在本课题的学习过程中,教师引导学生:
1.通过观察、思考、讨论等途径,激发学生的学习兴趣,培养学生主动获取知识的能力。
2.通过对元素周期表和周期律的学习,培养学生归纳、总结、推理的逻辑思维能力。
3.通过实验探究,培养学生的观察能力、动手能力和创新能力。
-探究不同元素的化合价规律。
5.进行一次元素周期表的知识竞赛,以小组为单位,内容包括元素符号、元素周期律、实验现象等。要求学生积极参与,提高团队合作能力。
3.详细讲解元素周期律的规律,如原子半径、电负性、金属性等的变化规律,并通过实例分析,让学生掌握周期律的应用。
4.引导学生学会查找元素周期表中的信息,如相对原子质量、元素符号等。
(三)学生小组讨论
在学生小组讨论环节,我将安排以下活动:
1.将学生分成若干小组,每组讨论一个周期或族的特点,归纳总结规律。
-设计互动教学活动,如小组讨论、角色扮演等,让学生在合作交流中深化对周期律的理解。
-创设真实情境,如生活中的元素应用实例,引导学生运用周期律解释现象,增强知识的实际应用能力。
2.针对元素符号的记忆难点,设想以下教学策略:
-采用趣味性记忆法,如编写元素符号顺口溜、制作元素符号卡片等,提高记忆效果。
-定期进行元素符号默写比赛,激发学生的学习兴趣,巩固记忆成果。
初中化学_人教版第三单元课题3元素教学设计学情分析教材分析课后反思

九年级化学学科第三单元课题三元素(第一课时)《同步》开放性作业1、2、3、4、5、6。
参考答案A B D B D B学情分析学生通过前面的学习已初步了解了物质的微观构成以及原子的结构,为本节课奠定了一定的知识基础,但由于本节课从微观到宏观之间的跨度比较大,学生的思维也处于形象思维向抽象思维过度的阶段,化学科学中的逻辑思维能力还有待提高。
效果分析教材分析本课题包括元素、元素符号和元素周期律,这些是初中化学的重要组成部分。
元素概念是初中化学核心的概念之一,对今后的学习起着承上启下的作用。
所谓“承前”,指这节课详细的让学生明白物质的宏观组成是元素,并和物质的微观结构---原子有机的结合起来了使得认识系统化。
所谓“启后”,指学生掌握了元素的概念对学习元素符号、化学式和化学方程式的书写奠定基础。
只有掌握了元素的概念,才能进一步学习化学知识,才能对众多繁杂的物质进行分类,最终实现对分类的物质进行研究。
1、某药品说明书中标明:本品每克含碘150mg、镁65mg、锌1.5mg、锰1mg,这里的碘、镁、锌、锰是指()A.单质B.原子C.元素D.分子2、既能表示一种元素,又能表示一个原子,还能表示一种物质的是()A.N2 B.Cu C.O D.CO23、下列属于金属元素的是()A.Zn B.O C.N D.Cl4、地壳中含量最多的元素是()A.氧 B. 硅C.铝D.铁5元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是( )A.OB.SiC.AlD.Fe6、与元素的化学性质关系最密切的是()A.中子数B.电子数C.最外层电子数D.核外电子课标分析1、知识与技能(1)认识元素的存在,形成元素的概念;(2)初步了解元素在自然界中的分布;(3)知道化学反应前后元素不变。
2、过程与方法(1)通过元素概念的建构,初步学会运用归纳和概括等方法对获取的信息进行加工;(2)通过元素与原子的区别,学会运用对比的方法分析问题,认识事物。
第三单元课题3+元素教学设计-2024-2025学年九年级化学人教版上册

《课题3元素》教学设计课题课题3元素单元第三单元学科化学年级九年级教材分析本节课是初中化学“双基”的重要组成部分,元素的概念是初中化学核心概念。
2022新课标指出,初中化学基础知识和基础技能是构成学生科学素养的基本要素,是为学生的终身学习和将来适应现代社会生活打好基础所必需的。
本课题包括元素、元素符号和元素周期表简介三部分内容。
此前学生已经了解元素是组成物质的基本单位,已学习了原子的结构。
因此本课题就从微观的角度对它下了一个比较确切的定义,从而把对物质的宏观组成与微观认识统一起来。
由于学生没有同位素的知识,因此元素的概念是教学的难点,实际应用中容易将其与原子混淆。
核心素养目标化学观念:通过对有关元素符号知识的自主学习,会正确书写常见元素的名称和符号,理解元素符号的意义,体会元素符号的科学性。
科学思维:能根据元素的原子序数在元素周期表中查元素名称、符号、相对原子质量等信息。
科学探究与实践:通过对元素周期表的分析,知道元素周期表中包含的信息。
科学态度与责任:通过发展善于合作,勤于思考,勇于实践的科学精神,培养关心社会,关心自然的情感和意识。
重点元素符号及其表示的意义。
难点元素符号及其表示的意义。
教学过程教学环节教师活动学生活动设计意图导入新课元素符号和元素中文名称的由来引入新课。
了解元素符号的由来。
使学生认识到学习元素符号的必要性。
讲授新课一、元素符号1.书写规律:(1)一个字母的大写(碳C 氧O)(2)两个字母的前面大写后面小写(钠Na 镁Mg)书写元素符号,熟记33种元素符号通过对有关元素符号知识的自主学习,会正确书写常见元素的名称和符2.元素符号表示的意义:(1)表示一种元素(宏观)(2)表示这种元素的一个原子(微观)(3)部分元素符号有三个意义。
(对于金属、稀有气体、固态非金属单质,元素符号还表示一种单质。
)【注意】元素符号前面有系数,就只表示微粒个数!只表示微观意义,不表示宏观意义。
【练习应用】1.用化学用语填空3个氢原子_________2个锌原子_________ 10个碳原子________n个硫原子__________ 2.写出下列符号的意义2H_________ Zn_______________________ Mg2+__________3Mg2+___________ 号,理解元素符号的意义,体会元素符号的科学性。
初中化学元素课件

这说明是不是还有其它的碳原子呢?
相对原子质量
讨论交流
质子数
中子数
碳原子A
6
6
碳原子B
6
7
碳原子C
6
8
从表格中你发现了什么 规律 ?
碳元素
质子数
中子数
氧原子A
8
8
氧原子B
8
9
氧原子C
8
10
氧元素
你能总结出元素的定义吗??
因此,不同种元素的本质区别是:质子数(核电荷数)不同。即:质子数(核电荷数)决定元素种类
Cu
Zn
Ag
Mn
Ca
一大二小!
元素符号表示的意义
元素符号表示一种元素;还表示这种元素的一
个原子
1
2
3
6
5
4
如:金属元素、稀有气体元素、 固态非金属元素等。
表示这种物质
如:N 既表示氮元素,又表示一个氮原子。 对于由原子直接构成的物质,元素符号还可
铁元素 (宏观) 铁单质(宏观)
一个铁原子(微观)
A
C
8.元素是具有_____ 的一类_____的总称。 9.氧化镁和氧气中都存在着______元素。 10.一种元素与另一种元素的本区别是( ) A.原子量 B.中子数 C.质子数 D.电子数 11.二氧化硫、氧化汞、氧气中都含有( ) A.氧气 B.氧原子 C.氧分子 D.氧元素 12.二氧化硫是由硫____和氧____组成的。
元素的种类 ,物质的种类 。
改变
不变
不变
改变
4.化学反应前后,原子的种类不变,元素种类不变。 问题:某物质隔绝空气加热后,生成氧气和氯化钾,从而推断该化合物含有哪些元素? O2 KCl 含K、Cl、O元素
第三单元课题3+元素说课-2022-2023学年九年级化学人教版上册

说教学目标
1.知识与技能目标:理解元素的概念,能正确书写元素 符号,明白元素符号表达的含义。
2.过程与方法目标:通过引导启发、小组探究学习,让 学生理解元素概念,并运用化学知识去解释生活中的 问题。
3.情感态度与价值观:培养学生合作交流的能力,并在 课堂学习中感知化学之美,增加对化学的学习兴趣。
重点:元素概念,元素符号的书写和表达含义。
难点:培养学生的合作交流能力,激发学习兴趣。。
说学情
九年级学生有一定的自主学习能力和合作探究 能力,对化学充满兴趣。但是对于农村孩子来 说,表达能力相对较弱,因此老师的引导很重 要
说教法学法
好的教学方法可以使教学事半功倍,根据以上 的教学目标,本节课我采用启发引导法为主, 以小组讨论法为辅,这样既能体现新课标中以 学生为主体的要求,又能培养学生的合作交流 表达能力。再通过学生合作探究、交流合作来 突破教学重难点。
在下列化学反应中,分子、原子和元素是否发生变化? 硫 + 氧气 = 二氧化硫 (S) (O2) (SO2)
分子发生改变,原子和元素不变。
展示图片:地壳中元素图,生物细胞中 元素图。 提问:同学从图中得到什么信息?
地壳中元素含量前五:氧、硅、铝、铁、钙 生物细胞中含量最多的元素:氧
由此可以看出元素也是组成物质的。
说教学过程
1.导入:以生活中的物品导入,激发学习兴趣, 为后面教学铺垫。
2.创设情境:通过表格类比,加强学生理解。 3.小组讨论、自主观察、合作探究:培养学生 合作交流能力,察理解能力。突破重难点。 4.巩固提升,课堂活动:增强课堂氛围,同时 又能巩固知识。
说板书设计
1.元素概念 2.化学变化中元素、原子不变,分子改变 3.元素的书写和含义
人教初中化学九上3课题3元素微课一等奖市公开课一等奖课件名师大赛获奖课件

名师归纳
• 元素符号普通表达一种元素,一种原 • 子。由原子构成的物质,元素符号还表 • 示这种物质。
反馈练习
第三单元物质构成的奥秘 课题3 元素
学习目的
• 1.理解元素的概念,初步学会用元素描述物 质的宏观构成。2.通过对单质与化合物和对 元素的分类,进一步体会分类的思想,学 习分类的办法。
• 3.学会常见的元素符号的对的写法,懂得元 素符号的意义,记住某些常见的元素符号。
• 4.初步认识元素周期表的构造(周期和族), 懂得周期表提供的某些信息,如元素符号、 原子序数、相对原子质量等。
内的质子数都是8,化学上把这些 氧原子 统称为氧 元素。
• 元素就是 含有相似核电荷数(即质子数)的一类原子 。
的总称
• 2. 质子数 决定元素的种类。
• 3.地壳里多个元素的含量,,从高到低的前 四位是:氧、硅、铝、铁 ;地壳中含量最多的 非金属元素
• 是 氧 ;地壳中含量最多的金属元素是铝; 生物细
名师归纳
• 分子、原子、元素、物质间的关系:
反馈练习
• 1.地壳中各元素所占质量分数由大到小的次序是 (A )
• A.氧、硅、铝、铁 B.铝、铁、硅、氧 • C.铁、铝、硅、氧 D.硅、氧、铁、铝 • 2.自然界中,某些元素的原子可自动放射含有固
定构成的粒子而变为其它元素。据此判断下列叙 述中,对的的是(A )
• (1)从表中查出硅(Si)元素的相对原子质量为
;
28.09
• (2)6~11号元素中属于金属元素的有 Na(填元素 符号);
初中化学第三单元课题3元素导学案
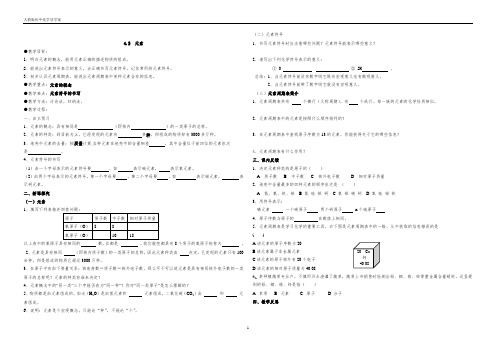
人教版初中化学导学案14.2 元素●教学目标:1、明白元素的概念,能用元素正确的描述物质的组成。
2、能说出元素符号表示的意义,会正确书写元素符号,记住常用的元素符号。
3、初步认识元素周期表,能说出元素周期表中某种元素含有的信息。
●教学重点:元素的概念 ●教学难点:元素符号的书写 ●教学方法:讨论法,归纳法。
●教学过程: 一、自主预习1、元素的概念:具有相同是 (即核内 )的一类原子的总称。
2、元素的种类:到目前为止,已经发现的元素有 多种,但组成的物质却有3000多万种。
3、地壳中元素的含量:按质量计算,各种元素在地壳中的含量相差 ,其中含量位于前四位的元素依次是 。
4、元素符号的书写(1)由一个字母表示的元素符号要 。
如 表示碳元素, 表示氧元素。
(2)由两个字母表示的元素符号,第一个字母要 ,第二个字母要 。
如 表示铝元素, 表示钙元素。
二、新课探究 (一)元素1以上表中的氧原子具有相同的 数,且都是 ,我们就把都具有8个质子的氧原子统称为 。
2、元素是具有相同 (即核内质子数)的一类原子的总称,因此元素种类由 决定。
已发现的元素只有100余种,但是组成的物质已超过3000万种。
3、在原子中有如下等量关系:核电荷数=质子数=核外电子数,那么可不可以说元素是具有相同核外电子数的一类原子的总称呢?元素的种类有谁来决定?4、元素概念中的“同一类”三个字能否改为“同一种”?你对“同一类原子”是怎么理解的?5、物质都是由元素组成的。
如水(H 2O )是由氢元素和 元素组成,二氧化碳(CO 2)由 和 元素组成。
6、说明:元素是个宏观概念,只能论“种”,不能论“个”。
(二)元素符号1、书写元素符号时应注意哪些问题?元素符号能表示哪些意义?2、请写出下列化学符号表示的意义:① O ② 2H 。
总结:1、当元素符号前没有数字则它既有宏观意义也有微观意义。
2、当元素符号前带了数字则它就没有宏观意义。
《第三单元 课题3 元素》作业设计方案-初中化学人教版九年级上册

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
人教版初中九年级化学上册第三单元物质构成的奥秘课题3元素课件

解析 2:00对应的元素为氦元素,氦原子具有相对稳定结构, 12:00对应的元素是镁元素,在化学反应中镁原子易失电子, 两种元素化学性质不相似;5:00对应的元素是硼元素,属于非 金属元素;9:00对应的元素是氟元素,在化学反应中易得到1 个电子形成带一个单位负电荷的氟离子;10:00对应的元素是 氖元素,位于元素周期表第二周期。
图1
图2
(1)写出9号元素的元素符号: F 。
(2)图2中,A图表示某原子的结构示意图,则x= 表示的粒子是 铝离子(或Al3+)。
8 。B图
(3)图2中C图为20号元素的原子结构示意图,若要在图1中为
20号元素排位置,则其位于第 4 圈,与11—18号元素中 Mg (填元素符号)紧挨。
解析 (1)9号元素是氟元素,其元素符号为F。(2)在原子中, 质子数=核外电子数,则x=2+6=8;B粒子的质子数为13,核外 有10个电子,则其是带有3个单位正电荷的铝离子。(3)由图1 可知,元素位于的圈数与其原子核外的电子层数相同,20号元 素原子的核外有4个电子层,因此位于第4圈;层与层间紧挨的 元素的原子最外层电子数相同,因此20号元素与12号元素镁 紧挨。
C.镁(Zn)
D.锰(Mn)
解析 镁的元素符号为Mg。
7.为了书写和学术交流的方便,采用国际统一的符号来表示 各种元素。
(1)用元素符号和数字表示: 氧元素 O ,1个氧原子 O ; 钠元素 Na ,2个钠原子 2Na 。 (2)“H”可以表示 氢元素 、 一个氢原子。
知识点3 元素周期表
8.(情境素材·航空航天)(2023山东青岛中考)“玉兔号”月球
能力提升全练
10.(2023山东潍坊中考,7,★☆☆)科学家利用“基因剪刀” 技术降低了水稻中砷的含量。如图是砷元素在元素周期表 中的信息及原子结构示意图。下列说法错误的是 ( C ) A.砷属于非金属元素 B.砷的原子序数为33 C.砷原子的相对原子质量为74.92 g D.x=5,砷与磷元素化学性质相似
第三单元 课题三 元素 教学设计

第三单元课题3 元素教学目标:知识与技能:1.了解元素的概念,将对物质的宏观组成与微观结构的认识统一起来;2.了解元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号;3.初步认识元素周期表,知道它是学习和研究化学的工具,能根据原子序数,在元素周期表中找到指定的元素和有关该元素的一些其他信息。
过程与方法:1.学习运用对比的方法获取信息;2.学习运用寻找规律性和特殊性的方法处理信息。
情感态度与价值观:1. 进一步建立科学的物质观,增进对物质的宏观组成与微观结构的认;2. 发展善于合作、勤于思考、勇于实践的科学精神。
教材分析:本课题包括元素、元素符号和元素周期表三部分内容,此设计为第一课时,包括元素和元素符号两部分内容。
在学习本课题之前,学生已经认识了分子和原子以及原子的结构,本课从微观结构的角度对元素下了一个比较确切的定义,从而把对物质的宏观组成与微观结构的认识统一起来,在初中化学教学中占有重要的地位。
元素的概念比较抽象,而且容易与原子的概念混淆,教学时应注意两者的区别。
元素符号是国际通用的化学用语,是学习化学的重要工具,要求学生了解元素符号的意义,对于一些常见元素的符号,必须会写、会读、会用。
教学策略分析:本课题的第一课时的教学重点是元素的概念和元素符号,难点是元素的概念。
元素概念的教学应注意从熟悉的例子切入,通过与原子的对比,归纳出元素的定义,并组织好讨论,使学生真正认识到:在化学反应中分子可以发生变化,而元素不发生变化。
元素符号的教学忌一步到位、急于求成,应分散难点,逐步记忆,减轻学生对枯燥乏味的元素符号的记忆负担。
本课题的教学以学生自主探究为主,通过教师设置情景,提出问题,引导学生在学习过程中阅读课文、查阅有关资料的同时进行思考,分组进行讨论,对比,得出结论,从而达成本课的教学目标。
由于本课题理论性较强,是学生学好化学的基础课,所以在教学中要多结合实例,多做练习,使学生在反复实践中去加深理解和巩固,使所学的化学用语、概念得到比较清晰的对比、区分和归类。
《第三单元 课题3 元素》教学设计教学反思-2023-2024学年初中化学人教版九年级上册

《课题3 元素》教学设计方案(第一课时)一、教学目标1. 知识与技能:理解元素的观点,掌握元素与物质组成的干系,能够列举常见元素的名称和符号。
2. 过程与方法:通过观察、思考、讨论,培养学生的观察能力和思考能力。
3. 情感态度与价值观:通过元素的学习,让学生认识到化学在生活中的作用,激发学生对化学学科的兴趣。
二、教学重难点1. 教学重点:理解元素的观点,掌握元素与物质组成的干系。
2. 教学难点:常见元素的名称和符号的记忆。
三、教学准备1. 准备教学用具:黑板、白板、投影仪、元素周期表卡片、常见元素的实物图片(如铁、铜、氢气等)。
2. 准备教学内容:制作PPT,包含元素周期表的相关知识,以及一些生活中的元素应用实例。
3. 准备学生用具:每个学生准备一张元素周期表卡片,便于记忆和练习。
4. 提前安置学生预习元素的相关知识,并收集一些生活中的元素应用实例。
四、教学过程:(一)导入新课1. 复习提问:列举几种常见元素名称。
2. 展示元素周期表,请学生观察并找出规律。
3. 引出课题:元素(二)新课教学1. 介绍元素定义,了解元素种类。
通过实物展示和图片展示,介绍氧、氢、碳、氮、钙等常见元素,让学生观察并思考其存在形式和性质,引导学生总结元素定义。
2. 讲解元素符号的书写与读法。
通过实物或图片展示元素符号,并讲解其书写规则和读法。
可以通过示范和练习的方式,让学生掌握元素符号的书写和读法。
3. 讲解元素周期表的结构和作用。
通过展示元素周期表,介绍周期表的结构和作用,引导学生了解周期表中的周期、族等观点,并诠释周期表对化学学习的重要性。
4. 介绍常见元素的性质和应用。
根据所学知识,介绍氧、氢、碳、氮、钙等常见元素的性质和应用,让学生了解这些元素在生活和生产中的应用。
5. 教室互动:学生分组讨论元素对物质性质的影响。
引导学生分组讨论元素对物质性质的影响,鼓励学生积极思考,通过讨论加深学生对元素性质和物质性质之间干系的理解。
《第三单元课题3元素》作业设计方案-初中化学人教版九年级上册

《元素》作业设计方案(第一课时)一、作业目标本作业设计旨在巩固学生对元素概念的理解,掌握元素周期表的基本结构,并能够初步运用元素知识解决实际问题。
通过作业的完成,提高学生的自主学习能力、分析问题和解决问题的能力。
二、作业内容一、预习复习1. 复习上节课所学内容,掌握基本的化学术语和概念。
2. 预习《元素》课程,了解元素的概念、分类及在自然界中的分布。
二、知识掌握1. 掌握元素周期表的结构,能够指出主族、副族及零族的位置。
2. 理解元素的性质与原子结构的关系,特别是原子序数对元素性质的影响。
3. 通过典型例题,学会运用元素知识解释生活中的化学现象。
三、实践应用1. 完成元素周期表中前XX个元素的记忆与默写,并标注出各元素的原子序数、元素分类及常见化合价。
2. 结合生活实际,找出五个与元素性质相关的化学现象或化学反应,并简要说明其原理。
3. 设计一个简单的实验方案,通过实验观察不同元素在化学反应中的表现。
四、拓展延伸1. 阅读相关科普文章或视频,了解更多关于元素在科技、生活等领域的应用。
2. 小组合作,共同完成一个关于元素知识的PPT或小报,并在班级进行展示。
三、作业要求一、按时完成学生需在规定时间内完成作业,保证作业的时效性。
二、质量保证1. 预习复习部分要求全面复习和预习,理解并掌握元素的基本概念和周期表的结构。
2. 知识掌握部分需通过例题训练,加强对元素性质的理解和应用。
3. 实践应用部分要求结合生活实际,提高分析和解决问题的能力。
4. 拓展延伸部分需学生积极查找资料、阅读科普文章或观看视频等,加深对元素知识的理解。
5. 作业书写要规范,字迹清晰,避免涂改。
四、作业评价教师将根据学生作业的完成情况、正确性、条理性和书写质量进行综合评价。
评价将分为优秀、良好、一般和待提高四个等级,并给予相应的鼓励和建议。
五、作业反馈教师将对学生在作业中出现的错误进行批改,并在课堂上进行讲解和纠正。
同时,教师将根据学生的作业情况,调整教学计划和教学方法,以更好地满足学生的学习需求。
人教版九年级化学第三单元课题3 元素教学设计 第二课时

人教版九年级化学第三单元课题3 元素教学设计第二课时一、教学目标•理解物质的基本组成是由元素组成的•掌握元素、混合物和化合物的概念及其区别•了解元素周期表的基本结构,掌握元素符号、元素名称和元素周期表的使用方法•熟练使用元素周期表查找元素的信息二、教学内容1. 元素、混合物和化合物的概念及其区别•元素:由具有相同原子序数(即核电荷数)的原子所组成的物质,是构成物质的基本单位。
•混合物:由两种或两种以上的纯物质按一定的比例混合而成的物质。
•化合物:由两种或两种以上的不同元素按一定的比例结合而成的物质。
2. 元素周期表的基本结构和使用方法•元素周期表是根据元素的原子序数和元素性质的规律性而设计的一种表格。
•元素周期表由一行一行的小方格组成,每个小方格表示一个元素。
•元素周期表按照原子序数从小到大的顺序排列,同时也按照元素的性质进行分组。
3. 使用元素周期表查找元素的信息•元素周期表上每个元素方格中的信息包括:元素符号、元素名称、原子序数和相对原子质量等。
•元素符号是用来简化元素名称的一种符号表示方法,一般由元素英文名的第一个或前两个字母组成。
三、教学步骤1. 导入(5分钟)首先,教师可以通过问答方式复习上节课的内容,引起学生的兴趣,并将学生的思维导入到本节课的主题。
2. 教学展示(10分钟)在黑板上展示元素周期表的结构,并对元素符号、元素名称、原子序数和相对原子质量等概念进行解释和讲解。
引导学生注意元素周期表的排列顺序和分组的规律性。
3. 学生参与(20分钟)让学生分小组,每个小组分发一份元素周期表。
要求学生查找指定元素的元素符号、元素名称、原子序数和相对原子质量,并在小组内讨论。
4. 学生汇报(10分钟)请学生代表各小组向全班汇报他们所查找到的元素信息,并让其他学生补充和纠正。
教师解答学生提出的问题,并帮助学生正确理解元素周期表的使用方法。
5. 拓展练习(10分钟)在课堂结束前,教师发放练习题让学生独立完成。
《第三单元课题3元素》教学设计教学反思-2023-2024学年初中化学人教版九年级上册

《元素》教学设计方案(第一课时)一、教学目标本课教学目标旨在使学生掌握元素的基本概念、符号表达及其分类方法。
通过教学,期望学生能够理解元素在自然界中的存在形态,认识到元素周期表的基本框架和意义,并能够初步运用元素知识解释一些简单的化学现象。
同时,培养学生科学探究的兴趣和严谨的化学实验态度。
二、教学重难点教学重点在于使学生掌握元素的定义及符号表示法,了解元素的分类及其在周期表中的排列规律。
教学难点则在于帮助学生理解元素周期表的实质性意义,以及如何将元素知识应用于实际问题中。
为突破这一难点,将通过实验演示和案例分析的方式,加深学生对元素知识的理解和应用。
三、教学准备为确保《元素》第一课时的教学顺利进行,需准备以下教学材料:化学元素周期表挂图、元素符号卡片、相关化学实验器材、多媒体教学设备等。
同时,教师需提前熟悉教材内容,准备相应的教学课件和教案,确保课堂上能够灵活应对各种教学情况。
此外,还需布置好化学实验室,准备好必要的实验用品,以备学生进行实验操作。
四、教学过程:一、导入新课在课堂的开始,教师可以通过展示一些日常生活中常见的元素化合物实例,如水、氧气、二氧化碳等,来引出本节课的主题——元素。
让学生感知元素在日常生活中的应用,以及其在物质构成中的重要性。
然后通过简短的讲解,帮助学生回忆上节课的知识点,为学习新内容做好铺垫。
二、知识讲解1. 元素概念及分类在讲解元素的概念时,教师可以通过图表和实例相结合的方式,详细解释元素的定义和分类。
同时,引导学生通过观察实物或图片,理解不同元素的颜色、状态、气味等特性。
通过讨论和交流,激发学生的学习兴趣和好奇心。
2. 元素周期表元素周期表是化学学习的重要工具。
教师可以通过投影仪或电子设备展示元素周期表的结构和特点,让学生了解元素在周期表中的排列顺序和规律。
同时,结合具体的元素实例,讲解元素周期表中的符号、原子序数、电子排布等信息。
三、实验操作为了让学生更好地理解和掌握元素知识,教师可以设计一些简单的实验操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素
周庄中学化学组
1、物质是由什么组成的? 2、氧化汞、过氧化氢、高锰酸钾、氯酸钾 分解均可产生氧气,说明了它们均含有什么? 质子数为8,中子数为8 介绍:几种氧原子 质子数为8,中子数为9 质子数为8,中子数为10
质子数为8的所有氧原子统称为氧元素
一、元素
1.定义: 质子数(即核电荷数)相同的一类 原子的总称.
有A、B、C、D四种元素,已知A元素在地 壳中含量最多,B元素的原子核无中子,C元 素的原子核外有3个电子层,第二层比第一层 + 和第三层的电子总数少1个,D元素的离子D 核 外电子的排布与氖原子相同,则A元素形成的 单质符号为 O2 ,B元素的离子符号 为 H+ ,C元素名称为 氯元素 , 其与D元素形成的化合物是 氯化钠 , + 其构成该物质的粒子符号为 Na 、Cl 。
分析:
蜡烛+ O2
点燃
CO2 + H2O
(2)蔗糖在隔绝空气情况下加强热生成碳 和水,则蔗糖一定含有 C、H、O 元素。
分析:
蔗糖
加热
C + H2O
氧元素: 所有核电荷数为8(质子数为8) 一类氧原子的总称。 碳元素: 所有核电荷数为6(质子数为6) 一类碳原子的总称。 所以,
核电荷数(即质子数)不同 氧元素与碳元素的区别:
在下列化学反应中,反应物与生成物相比较, 分子是否发生了变化?原子是否发生了变化?元 素是否发生了变化?
硫+氧气
(S) (O2)
点燃
二氧化硫
(SO2)
过氧化氢
(H2O2)
MnO2
水+氧气
(H2O) (O2)
物质发生化学反应时,分子 种类改变;原子种类不变;元素 也不会改变。
(1)蜡烛在空气中燃烧生成二氧化碳和水, O C、H 则蜡烛一定含 元素,可能 元素。
空气中含量最多的元素是 氮元素 N
。
一、元素
1.定义: 具有相同核电荷数(即质子数)的一 类原子的总称. 2.元素的种类取决于原子 质子数(核电荷数) [比较] 最外层电子数密切相关。 元素的化学性质与原子 最多金属元素 最多元素 3.元素的分布:
(1)地壳中元素含量由多到少依次为: O Si Al Fe Ca (2)生物细胞中元素含量由多到少依次为: O C H N Ca
2.
、 C 质子数 相同 ,中子数 不同 ,则原子 不同 ,而 是 同种元 素。来自12 6C、 C
13 6
14 6
物质的种类非常多,已知的就有3000多 万,而组成物质的元素只有100多种。
请 思 元 考 素 图 在 地 壳 和 中 的 页 含 资 量 料
4-4 74
一、元素
1.定义: 具有相同核电荷数(即质子数)的一 类原子的总称. 2.元素的种类取决于原子 质子数(核电荷数) [比较] 最外层电子数密切相关。 元素的化学性质与原子 最多金属元素 最多元素 3.元素的分布:
(1)地壳中元素含量由多到少依次为: O Si Al Fe Ca (2)生物细胞中元素含量由多到少依次为: O C H N Ca
最多元素 最多金属元素
地壳中含量最多的元素是 氧元素 O ; 地壳中含量最多的非金属元素是 氧元素 O ; 地壳中含量最多的金属元素是 铝元素 Al ; 人体中含量最多的元素是 氧元素 O ; 人体中含量最多的金属元素是 钙元素 Ca ; 海水中含量最多的元素是 氧元素 O ; 海水中含量最多的金属元素是 钠元素 Na ;
完成P63探究
思考:观察1-18号元素原子结构示意图, 你能归纳出核外电子排布有哪些规律?
4.从原子结构看,元素周期表的规律:
(1)每一周期: 从左往右,电子层数相同 , 最外层电子数 依次增大 . (2)每一族: 从上往下,电子层数 依次增大 ,最外层电子数 相同 .
1.根据下列粒子结构示意图(用序号回答)
A
B
C
D
E
F
(1)表示相对稳定结构的粒子 B.D.F . 其中表示稀有气体的粒子 B . EF (2)表示同种元素的粒子 . (3)在化学反应中,易失去电子的粒子 C 易得到电子的粒子 A.E .
.
2.金属钠中含钠原子(Na),氯化钠中含钠离子(Na+),结 质子数相同 构示意图为 ,它们属于同种元素,因为 , 但化学性质不同,因为 最外层电子数不同 。
×
例:说出下列符号的意义.
氧元素 一个氧原子
O
铁元素 一个铁原子 2个氢原子
Fe
2H
mAu
m个金原子
超市、大卖 场有成千上万 的商品,它们 分类别、有序 的摆放着。构 成物质的100 多种元素也有 内在的规律性, 1869年,门捷 列夫根据元素 原子的结构和 性质,把它们 科学有序的排 列起来,就得 到了元素周期 表。
一、元素
1.定义: 具有相同核电荷数(即质子数)的一 类原子的总称. 2.元素的种类取决于原子 质子数(核电荷数) [比较] 最外层电子数密切相关。 元素的化学性质与原子
1.A原子有8个质子,9个中子;B原 子有9个质子,10个中子;C原子有 8个质子,10个中子。
则A和B 不是 同一种元素,A与C 是 同 一种元素(填“是”与“不是”)
二、元素符号
1.写法: “一大二小”
例:找出下列元素符号书写正确的一项
CA 钙
ag 银
Na 钠
√
mG 镁
二、元素符号
2.意义: 表示 ×元素(宏观) 一个×原子 (微观) 元素符号前有数字,只表示微观意义.
如, “N” 表示氮元素,也可表示一个氮原子.
而 “2N” 只表示2个氮原子,而不能表示2个氮元素.
(1)水是由一个氧元素和两个氢元素组成的。 (2)二氧化硫中有硫和氧两个元素。 种 (3)加热氧化汞生成汞和氧气,说明氧化汞中含 有氧气分子。 元素 原子 原子 (4)二氧化硫分子是由硫元素和氧元素构成的。 (5)水是由氢原子和氧原子构成的。 分子
活动与探究
元素?分子?原子?单质?
为了书写和交流方便,国际上 用统一的符号来表示元素.
最多元素 最多金属元素
钅 钅 金属元素 如,铁、铜、汞… 气 气 石 石 氵 4.元素的分类 非金属元素如,氢、氧、磷、硫、溴… 气 气 气 稀有气体元素如,氦、氖、氩…
一、元素
5.元素与原子的区别:
(1)元素组成物质,是原子总称,可表示种类,不可表示个数。 (2)原子构成分子,也可构成物质,可表示种类也可表示个数。
本课题小结
一、元素 1、元素的定义 2、元素的分布 3、元素的分类 4、元素与原子的区别 二、元素符号 1、写法 2、涵义 三、元素周期表
三、元素周期表
质子数(原子序数)
16 S
1.结构: 32.06 相对原子质量 (1)7个横行,18个纵行 (2)每一横行叫一个周期,每一纵行叫 一个族(8、9、10组成Ⅷ族),所以共有 7个周期,16个族。 2.原子序数 =质子数(即核电荷数) 3.每一周期,
金属元素 非金属元素 稀有气体元素
硫
元素符号 元素名称
物质、 元素、分子、原子、离子关系如何?
分子
构成 分成
构成
原子
得 电 失 子
构成
物质
组成
元素
构成
宏观概念 只讲种类 不讲个数
离子
微观概念 既讲种类 又讲个数
1.水和氢气中都含有相同的
氢分子中含有相同的
D
A
;水分子和
。
C、氢气 D、氢原子
A、氢元素 B、氢分子
2.下列说法有没有错误?将错误的说法加以改正:
