(完整版)x元素周期表及其应用(上课课件)
合集下载
元素周期表及其应用精选教学PPT课件
1988年 ( 选自《 留德十年 》 )
听雨 从一大早就下起雨来。下雨,本来不 是什么 稀罕事 儿,但 这是春 雨,俗 话说: “春雨 贵似油 。”而 且又在 罕见的 大旱之 中,其 珍贵就 可想而 知了。 “润物细无声”,春雨本来是声音极 小极小 的,小 到了“ 无”的 程度。 但是, 我现在 坐在隔 成了一 间小房 子的阳 台上, 顶上有 块大铁 皮。楼 上滴下 来的檐 溜就打 在这铁 皮上, 打出声 音来, 于是就 不“细 无声” 了。按 常理说 ,我坐 在那里 ,同一 种死文 字拼命 ,本来 应该需 要极静 极静的 环境, 极静极 静的心 情,才 能安下 心来, 进入角 色,来 解读这 天书般 的玩意 儿。这 种雨敲 铁皮的 声音应 该是极 为讨厌 的,是 必欲去 之而后 快的。 然而,事实却正相反。我静静地坐在 那里, 听到头 顶上的 雨滴声 ,此时 有声胜 无声, 我心里 感到无 量的喜 悦,仿 佛饮了 仙露, 吸了醍 醐,大 有飘飘 欲仙之 概了。 这声音 时慢时 急,时 高时低 ,时响 时沉, 时断时 续,有 时如金 声玉振 ,有时 如黄钟 大吕, 有时如 大珠小 珠落玉 盘,有 时如红 珊白瑚 沉海里 ,有时 如弹素 琴,有 时如舞 霹雳, 有时如 百鸟争 鸣,有 时如兔 落鹘起 ,我浮 想联翩 ,不能 自已, 心花怒 放,风 生笔底 。死文 字仿佛 活了起 来,我 也仿佛 又溢满 了青春 活力。 我平生 很少有 这样的 精神境 界,更 难为外 人道也 。 在中国,听雨本来是雅人的事。我虽 然自认 还不是 完全的 俗人, 但能否 就算是 雅人, 却还很 难说。 我大概 是介乎 雅俗之 间的一 种动物 吧。中 国古代 诗词中 ,关于 听雨的 作品是 颇有一 些的。 顺便说 上一句 :外国 诗词中 似乎少 见。我 的朋友 章用回 忆表弟 的诗中 有:“ 频梦春 池添秀 句,每 闻夜雨 忆联床 。”是 颇有一 点诗意 的。连 《 红楼梦 》中的林妹妹都喜欢李义山的“留得 残荷听 雨声” 之句。 最有名 的一首 听雨的 词当然 是宋蒋 捷的“ 虞美人 ”,词 不长, 我索性 抄它一 下:
听雨 从一大早就下起雨来。下雨,本来不 是什么 稀罕事 儿,但 这是春 雨,俗 话说: “春雨 贵似油 。”而 且又在 罕见的 大旱之 中,其 珍贵就 可想而 知了。 “润物细无声”,春雨本来是声音极 小极小 的,小 到了“ 无”的 程度。 但是, 我现在 坐在隔 成了一 间小房 子的阳 台上, 顶上有 块大铁 皮。楼 上滴下 来的檐 溜就打 在这铁 皮上, 打出声 音来, 于是就 不“细 无声” 了。按 常理说 ,我坐 在那里 ,同一 种死文 字拼命 ,本来 应该需 要极静 极静的 环境, 极静极 静的心 情,才 能安下 心来, 进入角 色,来 解读这 天书般 的玩意 儿。这 种雨敲 铁皮的 声音应 该是极 为讨厌 的,是 必欲去 之而后 快的。 然而,事实却正相反。我静静地坐在 那里, 听到头 顶上的 雨滴声 ,此时 有声胜 无声, 我心里 感到无 量的喜 悦,仿 佛饮了 仙露, 吸了醍 醐,大 有飘飘 欲仙之 概了。 这声音 时慢时 急,时 高时低 ,时响 时沉, 时断时 续,有 时如金 声玉振 ,有时 如黄钟 大吕, 有时如 大珠小 珠落玉 盘,有 时如红 珊白瑚 沉海里 ,有时 如弹素 琴,有 时如舞 霹雳, 有时如 百鸟争 鸣,有 时如兔 落鹘起 ,我浮 想联翩 ,不能 自已, 心花怒 放,风 生笔底 。死文 字仿佛 活了起 来,我 也仿佛 又溢满 了青春 活力。 我平生 很少有 这样的 精神境 界,更 难为外 人道也 。 在中国,听雨本来是雅人的事。我虽 然自认 还不是 完全的 俗人, 但能否 就算是 雅人, 却还很 难说。 我大概 是介乎 雅俗之 间的一 种动物 吧。中 国古代 诗词中 ,关于 听雨的 作品是 颇有一 些的。 顺便说 上一句 :外国 诗词中 似乎少 见。我 的朋友 章用回 忆表弟 的诗中 有:“ 频梦春 池添秀 句,每 闻夜雨 忆联床 。”是 颇有一 点诗意 的。连 《 红楼梦 》中的林妹妹都喜欢李义山的“留得 残荷听 雨声” 之句。 最有名 的一首 听雨的 词当然 是宋蒋 捷的“ 虞美人 ”,词 不长, 我索性 抄它一 下:
元素周期表及应用课件

VIII族(3个纵行):Fe、Co、
Ni等9种元素
零族元:素周期稀表及应有用 气体元素
元素周期表
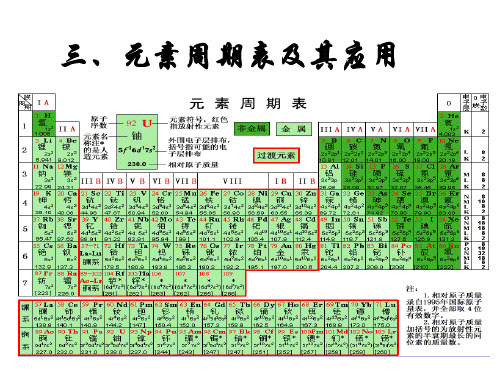
一、元素周期表的结构 1.编排依据:__元__素__周__期__律_____。 2.排列原则 (1)横行_电__子__层__数___相同,每个横行称为_周__期___。 (2)纵行:_最__外__层__电__子__数_____相同,纵行称为_族__。
元素周期表及应用
3.第3周期元素X的气态氢化物化学式是H2X, 下列叙述不正确的是( ) A.该元素的原子最外电子层上只有两个电子 B.该元素最高价氧化物的化学式为XO3 C.该元素是非金属元素 D.该元素最高价氧化物对应水化物的化学式是 H2XO4 答案:A
元素周期表及应用
课堂互动讲练
要点一 由原子序数确定元素位置的方法
1.位、构、性之间的关系
(1)元素的__________决定了元素在周期表中的位
置。 原子结构
(2)元素在周期表中的位置反映了元素的________
和元素的_______特点。
原子结构
性质
元素周期表及应用
2.应用 (1)根据元素在周期表中的位置,推测元素的_原__子_ _结__构___,预测其主要_性__质______。 (2)研究合成新物质 ①在金属和非金属的分界线附近寻找半__导__体____材 料(如_S__i、__G__e、__S__e___等); ②在_过__渡____元素中寻找各种优良的催化剂及耐高 温、耐腐蚀的合金材料。
元素周期表及其应用
元素周期表及应用
一、元素周期表 周期表的编排原则
1、按照原子序数递增的顺序从左到右排列将电子层数相
同的元素排成一个横行
周期
2、把最外层电子数相同的元素(个别例外)按电子层数递
元素周期表及应用ppt课件

13
相对原子质量 密度(g/cm3) 氧化物 氧化物密度
“类硅”性质预测 锗的数据
(1871)
(1886)
72
72.6
5.5
5.32
MO2 4.7
GeO2 4.72
氯化物 氯化物熔点(℃)
MCl4 < 100
GeCl4 84
14
(1886)
类Sc硼==4454 Ti==48 50?
类Ga铝==6698类G 编制一张开普勒-452b星球的元素周期表
距地球1400光年发现与地球相似度高达98%的类地行星:开普勒-452b。假定我 们乘坐光速飞船过去,并采集了一些该星球上的物质分离出10种元素
18
19
X
【思考】X元素最高价氧化物对应水化物的酸碱性?
20
实验 ❖ 如何用下列仪器和试剂判断X元素最高价含氧酸的酸性?
X的最高价含氧酸、X的最高价含氧酸形成的钠盐、HCl、NaOH(均为0.1 mol/L) pH试纸、玻棒、表面皿等
21
宇宙无止境,科学无止境,探索无止境,只要我们手握科学的真理,严谨的科学态 度,更多的元素等待你们去发现,更神奇的宇宙等待你们去探索,未来的“门捷列 夫”将在你们中间诞生!
谢谢各位老师和同学
25
❖ 动手作业:请你再设计一个不同于现代化学元素周期表的形式,但又能反映出元素周 期律变化规律的“你的”元素周期表
26
谢谢各位老师和同学
上海中学 陆晨刚
;.
27
门捷列夫的第一张元素周期表(1869)
BBee 1111..44 ??
Te 128 ?
Au 197 ? Bi 210 ?
12
In 75.6 ?
《元素周期表及其应用》.ppt

碱金属 元素
化学性质相似性
与非金属反应,生成金属化合物。
Li
与H2O反应,生成对应的碱和H2。
Na
与酸反应,生成盐和H2
与盐的水溶液反应
K
化学性质 递变性
Rb 从上到下,反应剧烈程度逐渐__增_强____
Cs
最高价氧化物的水化物的碱性__增_强____
结论:同族元素,有相似性也有递变性
碱金属 化学性质相似性 元素 Li与与水非反金应属反应,生成金属Na化与合水物反。应
周期序数 = 电子层数
元素周期表的结构
主族 ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , (A) ⅥA , ⅦA 共七个主族
副族 ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB ,
族 (B) ⅥB , ⅦB 共七个副族
(纵向) 第VIII 族: 三个纵行,位于Ⅶ B 与 ⅠB中间
零族: 稀有气体元素
短 第1周期:2 种元素
周 第2周期:8 种元素
期 第3周期:8 种元素
周期
(横向)
长 周 期
第4周期:18 种元素 第5周期:18 种元素 第6周期:32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
不完全周期 第7周期:26种元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
主族序数 = 最外层电子数
决定
原子结构
周期表位置
反映
IA H
1
1氢
元素周期表的结构
0
He
IIA IIIA IVA VA VIA VIIA 2氦
Li Be B C N O F Ne
2
3锂 4铍 5硼 6碳 7氮 8氧 9氟 10氖
元素周期表及其应用21页PPT

练习与思考:
❖ 金属性最强的元素(不包括放射性元素) 是 Cs ;
❖ 最活泼的非金属元素是 F ; ❖ 最高价氧化物对应水化物的酸性最强的元
素是 Cl ;
❖ 最高价氧化物对应水化物的碱性最强的元 素(不包括放射性元素)是 Cs 。
元素周期表的应用:
1、预测新元素 2、寻找原料 a、半导体——金属与非金属的分界线附近 b、催化剂 ——过渡元素
解释:
同周期从左到右 原子 半径减小
电子层数相同 原子核对外层电子 的吸引力增强
失电子能力减弱,得电子能力增强
书上P8表1-6
ⅦA族元素气态氢化物的形成和热稳定性
元素
F
Cl
Br
I
气态氢化物
形成的难 H2与F2混 H2与Cl2 H2与Br2 H2与I2混 易程度 合,在冷 混合,光 混合,加 合。加热
2.原子半径的周期性变化规律
3.元素化合价的周期性变化规律
编排原则
1、按原子序数递增的顺序从左到右排列
2、将电子层数相同的元素排成一个横行
3、将最外层电子相同的元素按电子层 的
递增的顺序从上到下排成纵行
随堂练习:
1 、已知某主族元素的原子结构示意图如下, 判断其位于第几周期,第几主族?
X
+19 2 8 8 1
物对应水化物的化学式是:H3XO4、H2YO4、 HZO4,则: (1)X、Y、Z的非金属性强弱顺序为 __Z_>_Y_>__X______。(2)气态氢化物的化学式 分别为___X_H_3、__H_2_Y_、_H__Z___,它们稳定性强弱为
________X_H_3_<_H_2_Y_<__H_Z___________。(3)最 高价氧化物对应水化物的酸性强弱为_______ _____H_3_X_O_4_<_H__2Y_O_4_<__H_Z_O_4____________。
元素周期表及其应用PPT课件

得电子能力
Si < P < S < Cl
原子序数 元素符号 单质和水 (或酸)反 应情况 非金属单质 与氢气反应
11 Na
冷水 剧烈
12 Mg
热水 较快 盐酸 剧烈
13 Al
盐酸 较快
14 Si
15 P
16 S
17 Cl
18 Ar
高 温
磷蒸气 与 H2 能 反应
须 加 热
光照或 点燃爆 炸化合
最高价氧化 NaOH Mg(OH)2 Al(OH)3 H4SiO4 H3PO4 H2SO4 HClO4 物对应水化 强碱 中强碱 两性氢 弱酸 中强 强酸 最强 物的酸碱性 氧化物 酸 酸 得失电子能 力递变
酸 性
得 电 子 能 力
F
2,7
冷暗处 爆炸
HF
强
无
无
强
强
Cl 2,8,7
Br 2,8,18,7 I
点燃或 光照
HCl
HBr HI
弱
Cl2O7 HClO4
Br2O7 HBrO4 I2O7 HIO4
弱 弱
高温
2,8,18,18, 高温,缓 慢, 7
可逆
元素最高价氧化物对应水化物的酸碱性
酸性逐渐增强
H Li K Rb Cs Be Ca Sr Ba B Al Ga In C Si Ge Sn N P As Sb O S Se Te Po F Cl Br I At Na Mg
失电子能力逐渐减弱,得电子能力逐渐增强
稀 有 气 体 元 素
观察 思考:
1。根据钾元素在元素周期表中的位置预测金 属钾的性质,并与金属钠的性质进行比较。 2。观察金属钠和金属钾与水反应的情况,为 你的预测收集证据。
元素周期表及其应用(上课课件)

同 一 周 期
电 子 层 数 相 同
最
外 层
电
子
数
逐
渐
增
多
原 子 半 径 逐 渐 减 小(稀有气体除外) 金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强
第三周期元素的最高价氧化物对应水化物酸性
族 元素
最高价 氧化物 水化物
IA Na
Na2O
IIA Mg
MgO
IIIA Al
Al2O3
IVA Si
元素周期表及其应用
复习:
元素的性质随着元素原子序数的递增而呈周 期性变化的规律叫元素周期律。(实质呢) 1、原子最外层电子排布的周期性变化 2、原子半径周期性变化 3、元素化合价周期性变化 4、元素性质的周期性变化
周期的结构
1
1
2
4 5 6 7 8 9 10
短周期
2 3 4
3
11 12 19 20 21 22 23 37 38 39 40 41 55 56 87 88
热 稳 定 性 逐 渐 减 弱
B
C Si
N P As
O S Se Te
F Cl Br I At
热稳定性逐渐减弱
项目
同周期、同主族元素的递变规律 同周期(左-右) 同主族(上-下)
依次增大 逐渐增多 相同 逐渐减小 周期性变化 按周期元素数增加 相同 依次递增 逐渐增大 基本相同
原 子 结 构
核电荷数 最外层电子数 电子层数 原子半径 化合价 元素的金属性和 非金属性 单质的氧化性还 原性 最高价化合物对 应水化物的酸碱 性
8 2
18 8 2
11 12
B
13 14 15 16 17 18
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
性 单质的氧化性还
质
原性
还原性减弱,氧化性增强 氧化性减弱,还原性增强
最高价化合物对 应水化物的酸碱
性
碱性减弱,酸性增强
酸性减弱,碱性增强
气态氢化物的 稳定性
逐渐增强
逐渐减弱
二 元素的性质和元素周期表的位置关系 1.同周期元素的性质变化规律
Na Mg Al Si
P
S Cl Ar
3
11钠 12镁 13铝 14硅 15磷 16硫 17氯 18氩
同
电 子
一层
周数
期相
同
最 外层 电 子 数 逐 渐 增 多 原 子 半 径 逐 渐 减 小(稀有气体除外) 金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强
112
归纳:
周期序数 = 电子层数 同周期元素电子层数相等 主族序数 = 最外层电子数 同主族元素最外层电子数相等
二、元素原子结构与其在周期表中位置关系
元素 符号
7N
16S 11Na 13Al 10Ne
周期表中 的位置 第二周期
第ⅤA族
第三周期第 ⅥA 族
第三周期第 ⅠA 族
第三周期第 ⅢA 族
周期 1 2 3
元素 种数
2
88
分类
短周期
456
7
排满可以排32种
18 18 32
目前只有26种
长周期 不完全周期
(结构:三短、四长、一不全)
周期的结构
短周期
1
1 234
2
5 6 7 8 9 10
3 11 12
13 14 15 16 17 18
长周期
4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
酸碱性 强碱
碱
两性
弱酸
酸
强酸
最强 酸
酸性逐渐增强,碱性减弱
2、同主族元素性质的变化规律
同一主族(最外层电子数相同)
金
电 子 层 数 依 次 增 多
原 子 半 径 依 次 增 大
单 质 还 原 性 增 强
属
性 ?
增
强
HF 气
电 子 层 数 依 次 增 多
原单
子质
半氧
径
化 性
增减
大弱
态 HCl 氢
化 HBr 物
主族
族的结构
零族
IA
1 1 II A
234
副族
Ⅷ
族
0
2 II IV V VI VII
K
2
IA A A A A
5
6
7
8
9 10
L K
8
3
11 12
II IB
IV B
VB
VI B
VII
B
VIII
IB
II B
13
14
15
16
17
18
M L k
18 8 2
4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
专题1 第一单元 元素周期表及其应用
复习:
元素的性质随着元素原子序数的递增而呈周 期性变化的规律叫元素周期律。(实质呢) 1、原子最外层电子排布的周期性变化 2、原子半径周期性变化 3、元素化合价周期性变化 4、元素性质的周期性变化
一、元素周期表的结构
1、周期(横行)
——具有相同电子层数的元素按照原子序数递增的 顺序排列的一个横行称为一个周期。
第三周期元素的最高价氧化物对应水化物酸性
族 IA IIA
IIIA IVA VA VIA VIIA
元素 Na Mg
Al Si P S Cl
氧化物 Na2O MgO
Al2O3 SiO2 P2O5 SO3 Cl2O7
水化物 NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4
增
强
At
热稳定性逐渐减弱
项目
同周期、同主族元素的递变规律 同周期(左-右) 同主族(上-下)
原
核电荷数
子 最外层电子数
结
电子层数
构
原子半径
依次增大 逐渐增多
相同 逐渐减小
按周期元素数增加 相同
依次递增 逐渐增大
化合价
周期性变化
基本相同
元素的金属性和 非金属性
金属性减弱,非金属性增强 非金属性减弱,金属性增强
第二周期0族
电子 最外层 层数 电子数
25
36 31 33
28
最高正 化合价
+5
+6 +1
+3
—
最低负 化合价
-3 -2
--------
—
小结: 一、周期表的结构
周期(横行)结构: 三短、四长、一不全。
7横行
族(纵行)结构:
七主、七副、零、 Ⅷ族。 18纵行
二、原子结构与元素在周期表中位置的关系
a.周期序数=电子层数 b.主族序数=最外层电子数
稳 定 HI 性 递
非 金 属 性 减 弱
HAt 减
原 子 半 径
氧化 还原
性
单
质
递还
原
性
增
氧
化
增性
递
减
金属性 非金属
性
金 属 性 递 增 非 金 属 性 递 减
高价氧 化对应 水化物 酸碱性
气态 氢化 物稳 定性
碱 性
递
递
增
酸
性
递 减
减
非 金 属 性 递增
金 属 性 递 增
金属最强
非 金 属 性 递 增
渐
增 K Ca Ga Ge As Se Br
强
酸 性 逐 渐 增 强
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
元素气态氢化物的热稳定性
热稳定性逐渐增强
热 稳 定 性 逐 渐 减 弱
BCNO F
热 稳
Si P S Cl
定 性
As Se Br
逐
渐
Te I
112
不完全 周期
2、族(纵行)
族的分类 主族A
包含元素 长、短周期 元素
表示 个数
ⅠA,ⅡA等 7
副族B
零族 Ⅷ族
长周期 稀有气体 8、9、10
元素
元素
纵行
ⅠB,ⅡB等 0
Ⅷ
7
1
1
思考:1、为什么我们将稀有气体元素称为零族元素? ——它们很稳定,它们的化合价通常情况下为0。
结构:(七主、七副、零、八族[三纵行])
金属性递增
非金属性逐渐增强
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2 金
3属 性
4逐 渐
5增 强
6
B
非
金
Al Si
属
性
Ge As
逐
渐
Sb Te
增
强
Po At
7
金属性逐渐增强
元素最高价氧化物对应水化物的酸碱性
酸性逐渐增强
H
碱 Li Be B C N O F
性
逐 Na Mg Al Si P S Cl
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
