生物制品批签发一览表
生物制品批签发合格证书

生物制品批签发合格证书
生物制品批签发合格证书是指经卫生部门或其他相关部门检验合格的生物制品,经过批签发后获得的合格证书。
这是对生物制品生产企业或经销商的一种授权和认可,证明其生产或经营的生物制品符合卫生安全标准,可以销售和使用。
生物制品包括疫苗、血液制品、诊断试剂、生物制剂等。
这些产品对人体健康和生命安全有着重要的影响,因此需要进行严格的监管和质量控制。
生物制品批签发合格证书的发放,是卫生部门对相关企业进行质量监督和管理的一种方式,也是保障公众健康和安全的重要举措。
生物制品批签发合格证书通常需要企业提供相关产品的生产、质控和质量管理资料,包括生产工艺流程、原材料采购和检验记录、生产设备和环境卫生条件等。
卫生部门或相关部门会对这些资料进行审核和检验,以确保产品的质量和安全性符合相关标准和规定。
获得生物制品批签发合格证书后,企业可以在产品上贴上合格标志,证明产品的质量和安全性得到认可。
同时,卫生部门或相关部门会对企业进行定期的监督检查,以确保企业在生产过程中继续保持质量管理和卫生安全的标准。
总之,生物制品批签发合格证书对于保障公众健康和安全起着重要作用,是对生物制品生产企业或经销商的质量管理和卫生安全能力的认可和授权。
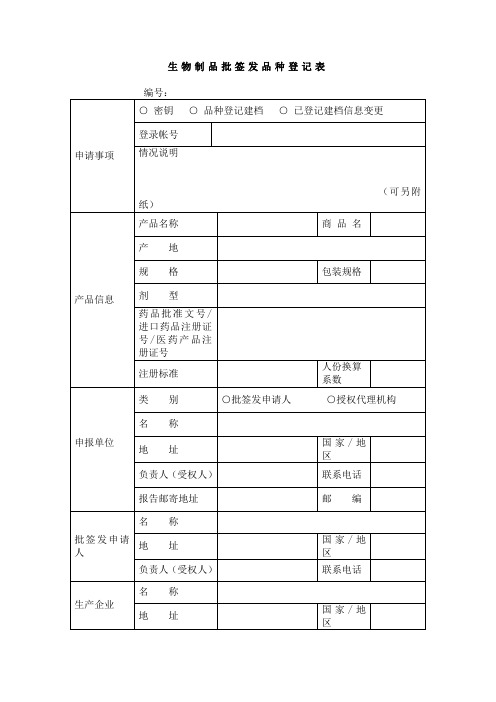
生物制品批签发品种登记表
报告邮寄地址
邮 编
批签发申请人
名 称
地 址
国家/地区
负责人(受权人)
联系电话
生产企业
名 称
地 址
国家/地区
负责人(受权人)
联系电话
所附资料
(说明:未注明原件的,一律为加盖公章的复印件)
药品批准证明
○药品注册批件及附件○补充申请批件及附件○进口药品注册证○医药产品注册证○其他
合法生产证明
○药品生产许可○GMP证书○其他
生物制品批签发品种登记表
编号:
申请事项
○密钥○品种登记建档○已登记建档信息变更
登录帐号
情况说明
(可另附纸)
产品信息
产品名称
商 品 名
产 地
规 格
包装规格
剂 型
药品批准文号/进口药品注册证号/医药产品注册证号
注册标准
人份换算
系数
申报单位
类 别
○批签发申请人○授权代理机构
名 称
地 址
国家/地区
负责人(受权人)
代理机构资质证明
○授权委托书(经公证的原件)○营业执照 ○药品ቤተ መጻሕፍቲ ባይዱ营许可证○介绍信(原件)○其他
○其他
申请单位负责人(签字)
单位公章
申请人(签字)
申请人电话
经手人(签字)
接收日期
备 注
中国食品药品检定研究院填写
主检科室办理
签字: 日期:
业务所意见
签字: 日期:
信息中心办理
签字: 日期:
国家食品药品监督管理局令第11号《生物制品批签发管理办法》【精选】

国家食品药品监督管理局令 第11号 《生物制品批签发管理办法》于2004年6月4日经国家食品药品监督管理局局务会审议通过,现予公布。
本管理办法自公布之日起施行。
二○○四年七月十三日 生物制品批签发管理办法 第一章 总 则 第一条 为加强生物制品质量管理,保证生物制品安全、有效,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)及《中华人民共和国药品管理法实施条例》,制定本办法。
第二条 生物制品批签发(以下简称批签发),是指国家对疫苗类制品、血液制品、用于血源筛查的体外生物诊断试剂以及国家食品药品监督管理局规定的其他生物制品,每批制品出厂上市或者进口时进行强制性检验、审核的制度。
检验不合格或者审核不被批准者,不得上市或者进口。
第三条 国家食品药品监督管理局主管全国生物制品批签发工作;承担生物制品批签发检验或者审核工作的药品检验机构由国家食品药品监督管理局指定。
第四条 生物制品批签发检验或者审核的标准为现行的国家生物制品规程或者国家食品药品监督管理局批准的其他药品标准。
4 11 201628 第二章 申 请 第五条 按批签发管理的生物制品在生产、检验完成后,药品生产企业应当填写《生物制品批签发申请表》,向承担批签发检验或者审核的药品检验机构申请批签发。
第六条 申请批签发的生物制品必须具有下列药品批准证明文件之一: ㈠药品批准文号; ㈡《进口药品注册证》或者《医药产品注册证》; ㈢体外生物诊断试剂批准注册证明。
第七条 申请批签发的技术要求及相关资料的格式,由中国药品生物制品检定所负责组织制定,报国家食品药品监督管理局批准并发布。
第八条 申请批签发时应当提交以下资料及样品: (一)生物制品批签发申请表; (二)药品生产企业质量保证部门负责人签字并加盖本部门印章的批制造及检验记录摘要; (三)检验所需的同批号样品; (四)与制品质量相关的其他资料; (五)进口预防用疫苗类生物制品应当同时提交生产国国家药品管理当局出具的批签发证明文件,并提供中文译本。
2016 年生物制品批签发年报

也可能是进口疫苗量降低的原因之一。详见表 3。.通过分析进口疫苗情况提示:我国脊髓
灰质炎灭活疫苗产能尚需提升,加强对联合疫苗的研发生产是疫苗产业的发展方向之一。
表 3 2016 年涉及进口的疫苗品种签发概况
序号 进口企业名称
疫苗品种
进口疫苗量 签发批 签发量 数(批) (人份)
国疫苗量 签发批 签发量 数(批) (人份)
二是我国疫苗生产企业的研发和生产能力提升,国产疫苗品种基本覆盖发达国家疫苗
上市品种。2016 年,有 6 家进口企业的 8 种疫苗申报批签发。其中,除 1 种五联疫苗(吸
附无细胞百白破、灭活脊髓灰质炎和 b 型流感嗜血杆菌【结合】联合疫苗)外,其他 7 个
品种疫苗均有国产疫苗签发上市,且大多数国产疫苗批次和签发量显著高于进口疫苗。这
总签发量(亿人份)
7.62 7.41 6.64 5.65 6.46
国产疫苗 (亿人份)
7.24 7.09 6.32 5.53 6.31
进口疫苗 (亿人份)
0.38 0.32 0.32 0.12 0.15
进口比率 (%) 4.99 4.32 4.82 2.12 2.32
3
图 2 2012 年至 2016 年国产和进口疫苗签发量
自实施批签发制度以来,批签发体系持续改进、不断完善。生物制品生产企业与国家 监管和检验机构普遍建立了良好共识,不断规范生物制品市场、共同促进产业发展。我国 疫苗生产和研发取得了长足发展,不少疫苗已经走向国际市场。2010 年和 2014 年通过 WHO 疫苗国家监管体系评估。在此基础上,多家疫苗生产企业通过或正在申请 WHO 疫苗预认 证,将国产疫苗纳入联合国等国际机构采购清单,为没有疫苗生产能力的国家提供更多产 品支持。
农业部公告第443号——新生物制品品种及研制单位名单

农业部公告第443号——新生物制品品种及研制单位名单文章属性•【制定机关】农业部(已撤销)•【公布日期】2004.12.24•【文号】农业部公告第443号•【施行日期】2004.12.24•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】种植业正文中华人民共和国农业部公告(第443号)根据《兽药管理条例》和《兽用新生物制品管理办法》的规定,经审查,批准北京海淀中海动物保健科技公司的猪瘟耐热保护剂活疫苗等五种制品(见附件1)为兽用新生物制品,现核发《新兽药证书》,并发布此五种制品的制造及检验试行规程(见附件2)、质量标准(见附件3)、使用说明书(见附件4)。
试行规程和质量标准自发布之日起执行。
其生产、检验、经营等方面的管理工作执行《兽用生物制品管理办法》的规定。
特此公告附件:1.新生物制品品种及研制单位名单2.制造及检验试行规程(略)3.质量标准(略)4.使用说明书(略)二00四年十二月二十四日附件1:新生物制品品种及研制单位名单┏━━━━━━━━━━━━━━━━┯━━━━━━━━━━━━━━┯━━┓┃新生物制品名称│研制单位│类别┃┠────────────────┼──────────────┼──┨┃猪瘟耐热保护剂活疫苗(兔源)│北京海淀中海动物保健科技公司│三类┃┠────────────────┼──────────────┼──┨┃猪瘟耐热保护剂活疫苗(细胞源)│北京海淀中海动物保健科技公司│三类┃┠────────────────┼──────────────┼──┨┃鸡痘耐热保护剂活疫苗│北京海淀中海动物保健科技公司│三类┃┠────────────────┼──────────────┼──┨┃鸡传染性支气管炎耐热保护剂活疫苗│北京海淀中海动物保健科技公司│三类┃┠────────────────┼──────────────┼──┨┃鸡传染性法氏囊病耐热保护剂活疫苗│北京海淀中海动物保健科技公司│三类┃┗━━━━━━━━━━━━━━━━┷━━━━━━━━━━━━━━┷━━┛。
生物制品批签发管理办法(2020年)

生物制品批签发管理办法(2020年)文章属性•【制定机关】国家市场监督管理总局•【公布日期】2020.12.11•【文号】国家市场监督管理总局令第33号•【施行日期】2021.03.01•【效力等级】部门规章•【时效性】现行有效•【主题分类】市场规范管理,药政管理正文国家市场监督管理总局令第33号《生物制品批签发管理办法》已于2020年11月19日经国家市场监督管理总局2020年第11次局务会议审议通过,现予公布,自2021年3月1日起施行。
局长张工2020年12月11日生物制品批签发管理办法(2020年12月11日国家市场监督管理总局令第33号公布)第一章总则第一条为了加强生物制品监督管理,规范生物制品批签发行为,保证生物制品安全、有效,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国疫苗管理法》(以下简称《疫苗管理法》)有关规定,制定本办法。
第二条本办法所称生物制品批签发,是指国家药品监督管理局对获得上市许可的疫苗类制品、血液制品、用于血源筛查的体外诊断试剂以及国家药品监督管理局规定的其他生物制品,在每批产品上市销售前或者进口时,经指定的批签发机构进行审核、检验,对符合要求的发给批签发证明的活动。
未通过批签发的产品,不得上市销售或者进口。
依法经国家药品监督管理局批准免予批签发的产品除外。
第三条批签发申请人应当是持有药品批准证明文件的境内外药品上市许可持有人。
境外药品上市许可持有人应当指定我国境内企业法人办理批签发。
批签发产品应当按照经核准的工艺生产,并应当符合国家药品标准和药品注册标准。
生产全过程应当符合药品生产质量管理规范的要求。
药品上市许可持有人应当建立完整的生产质量管理体系,持续加强偏差管理。
药品上市许可持有人对批签发产品生产、检验等过程中形成的资料、记录和数据的真实性负责。
批签发资料应当经药品上市许可持有人的质量受权人审核并签发。
每批产品上市销售前或者进口时,批签发申请人应当主动提出批签发申请,依法履行批签发活动中的法定义务,保证申请批签发的产品质量可靠以及批签发申请资料和样品的真实性。
生物制品批签发品种目录

已实施国家批签发的生物制品品种目录一、疫苗制品目录细菌类疫苗:1.伤寒Vi多糖疫苗2.口服重组B亚单位/菌体霍乱菌苗(肠溶胶囊)3.钩端螺旋体疫苗4.皮上划痕用鼠疫活疫苗5.皮上划痕人用炭疽活疫苗6.皮上划痕人用布氏菌活疫苗7.皮内注射用卡介苗8.b型流感嗜血杆菌结合疫苗9.吸附百白破联合疫苗10.吸附无细胞百白破联合疫苗11.吸附破伤风疫苗12.吸附白喉疫苗13.吸附白喉疫苗(成人及青少年用)14.吸附白喉破伤风联合疫苗(成人及青少年用)15.吸附白喉破伤风联合疫苗16.A群C群脑膜炎球菌多糖疫苗17.A群脑膜炎球菌多糖疫苗18.23价肺炎球菌多糖疫苗病毒类疫苗:1.森林脑炎灭活疫苗2.黄热减毒活疫苗3.乙型脑炎灭活疫苗4.乙型脑炎减毒活疫苗5.Ⅰ型肾综合征出血热灭活疫苗6.Ⅱ型肾综合征出血热灭活疫苗7.双价肾综合征出血热灭活疫苗8.人用狂犬病疫苗(Vero细胞)9.冻干人用狂犬病疫苗(Vero细胞)10.人用狂犬病疫苗(地鼠肾细胞)11.重组乙型肝炎疫苗(酵母)12.重组乙型肝炎疫苗(CHO细胞)13.冻干甲型肝炎减毒活疫苗14.甲型肝炎减毒活疫苗15.甲型肝炎灭活疫苗16.甲、乙型肝炎联合疫苗17.口服轮状病毒活疫苗18.麻疹减毒活疫苗19.脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞)20.口服脊髓灰质炎减毒活疫苗(猴肾细胞)21.脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)22.风疹减毒活疫苗(人二倍体细胞)23.风疹减毒活疫苗(兔肾细胞)24.腮腺炎减毒活疫苗25.冻干水痘减毒活疫苗26.麻疹腮腺炎联合减毒活疫苗27.麻疹风疹联合减毒活疫苗28.麻疹-腮腺炎-风疹三联减毒活疫苗29.流感全病毒灭活疫苗30.流感病毒裂解疫苗31.流感病毒亚单位疫苗二、血液制品目录1.人血白蛋白2.冻干人血白蛋白3.静注人免疫球蛋白(pH4)4.冻干静注人免疫球蛋白(pH4)三、体外诊断试剂目录1.梅毒快速血浆反应素诊断试剂2.梅毒甲苯胺红不加热血清诊断试剂3.梅毒螺旋体抗体诊断试剂盒(酶联免疫法)4.乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)5.丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)6.人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)7.抗A、抗B血型定型试剂(人血清)8.抗A、抗B血型定型试剂(马血清)9.抗A、抗B血型定型试剂(单克隆抗体)。
中监所新兽药证书兽用生物制品疫苗类
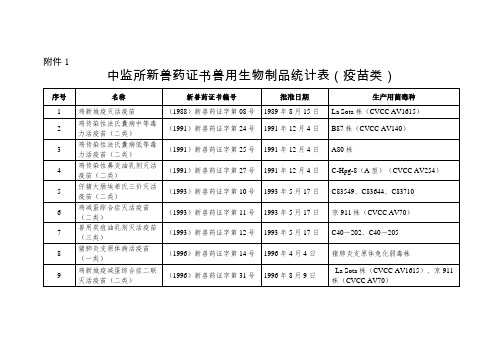
鸡毒支原体油乳剂灭活疫苗(二类)
(2003)新兽药证字38号
2003年9月2日
CR株
17
猪多杀性巴氏杆菌病二价灭活疫苗(三类)
(2003)新兽药证字第41号
2003年9月2日
C44-48、C47-2
18
鸡新城疫活疫苗(CS2株)(三类)
(2003)新兽药证字第59号
2003年9月2日
CS2株
19
NMG株+LY株
40
山羊传染性胸膜肺炎灭活疫苗(山羊支原体山羊肺炎亚种C87001株)(三类)
(2017)新兽药证字03号
2017年1月20日
C87001株
41
禽流感病毒H5亚型灭活疫苗(D7株&#支原体兔化弱毒株
9
鸡新城疫减蛋综合症二联灭活疫苗(二类)
(1996)新兽药证字第31号
1996年8月9日
La Sota株(CVCC AV1615)、京911株(CVCC AV70)
10
羊快疫猝疽(或羔羊痢疫)肠毒血症(复合培养基)三联灭活疫苗(三类)
(1996)新兽药证字第32号
GDr180株
35
高致病性猪繁殖与呼吸综合征、猪瘟二联活疫苗(TJM-F92株+C株)(三类)
(2015)新兽药证字29号
2015年6月24日
TJM-F92株+C株
36
小反刍兽疫活疫苗(clone 9株)(二类)
(2015)新兽药证字59号
2015年11月24日
clone 9株
37
鸭病毒性肝炎二价(1型+3型)灭活疫苗(YB3株+GD株)(三类)
3
鸡传染性法氏囊病低等毒力活疫苗(二类)
韩日澳三国兽用生物制品批签发管理简介

韩日澳三国兽用生物制品批签发管理简介娜琳,李宁,李琰,张存帅(中国兽医药品监 ,北京海淀100081)兽 物制品是指 、 、 禽动物特定传染病或其他有关的疾病的、疫、、类毒素、 制剂和抗血清等制品。
兽用物制品的质 接关系到疫病,从接 到公共卫生和 。
许国家都对兽 物制品施行批管理,但依据不同国情,管 也 同。
在此对韩国、日本和澳大利亚的兽 物制品管理进行概述,同时分国的特点及与我国管的区别,为我国进一步做好兽物制品的批提供参考。
1韩国兽用生物制品批签发的管理情况1.1兽物制品批 管 状韩国的兽用生物制品批系指由韩国农林水 品部 ;的农林检疫本部对兽 物制品是否准市的行批。
韩国对兽 物制品实施批管理开始于1966年1月11 ,批 样、检验等具体 农林 检疫本部 的动物药品管 和动物药品评 负责。
韩国的兽 :物制品批 律依据是《韩国兽药管 规及指导原则》。
2018年韩国的兽 物制品批签发为1 300批,其中进行批 检验的约为300批(1]o1- 2批签发的产品种类所有的兽用疫苗在上市 进行批签发,诊断试剂则不需进行批签发。
1.3兽用生物制品批签发流程 韩国的兽 物制品批 了免检制度,某 品 10批批签发检验 ( 年限要求),则品可以批准免检。
如某一批产品上市.关质量问,则会取消该产品的免检资格,直到10 批品的批 检验,才能批准免检。
企业提出批申请., 是免检的产品,则仅进行资;是 检验的产品,则企业需缴纳的检验检测费用,由动物药品管 到企业进行抽样,并存的样品交给动物药品评进行检验。
的产品,由动物药品管监督企业对该批产品进行销毁,流程1o图1韩国兽用生物制品批签发流程收稿日期:2019 — 11—11作者简介:娜琳(1984 -),女,助理研究员,硕士,从事兽用生物制品批签发等工作,E-m/:n/in668858@ 163. com通讯作者:张存帅,E-mail : zhangcunshuai @ ivdc. cry.com1.4兽用生物制品批签发抽样检验韩国的兽物制品批样由动物药品管负责,检验由动物药品评负责。
2018年10月生物制品批签发月报辽宁成大生物1批狂犬疫苗未签发

2018年10月生物制品批签发月报辽宁成大生物1批狂犬疫苗未签发注:包含了予以签发和不予签发的品种。
2018年10月疫苗签发量较9月下降约73%,占全年签发量的3.7%。
申请签发的疫苗有21个品种,共计121批(约1659万人次),予以签发120。
辽宁成大生物股份有限公司生产的1批冻干人用狂犬病疫苗(Vero细胞)(约计7.7万人次)不符合规定,未予以签发。
︱一类疫苗:10月共签发了9个一类疫苗。
签发量最多的为吸附无细胞百白破联合疫苗,共6批,约计344万人次。
︱二类疫苗: 10月共签发了12个二类疫苗。
签发量最多的为流感病毒裂解疫苗,共14批,约计208万人次。
︱进口疫苗:10月签发了2个进口品种,分别为脊髓灰质炎灭活疫苗(一类)和吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗(二类),进口率均为100%。
详情如下:2018年10月,共签发了10个血液制品,306批,498万份,占2018年签发总量的6.1%,相比9月签发量增长了4.3%。
签发量前两位的依然是人血白蛋白和静注人免疫球蛋白,且人血白蛋白中有52.4%为进口品种。
冻干静注乙型肝炎人免疫球蛋白(pH4)在10月的签发量占2018年总量的100%,为2018年以来首次签发。
详情如下:2018年10月,签发了血源筛查用体外诊断试剂共计9个品种,56批,约73万人份。
其中签发量最多的为抗A血型定型试剂(单克隆抗体)和抗B血型定型试剂(单克隆抗体)。
人类免疫缺陷病毒抗体抗原联合诊断试剂盒(酶联免疫法)全部为进口品种,少量(约1.2%)丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)为进口品种。
详情如下:。
兽用生物制品批签发表格

兽用生物制品批签发申请表监察检验机构保存,第三联由兽用生物制品生产企业保存。
代理机构兽用生物制品批签发申请表监察检验机构保存,第三联由代理机构保存。
编号:兽用生物制品批签发通知单:我所于年月日完成对你单位生产(代理)的首次申报批签发有关材料的审核,同意你单位申报批签发。
申报材料中发生变更事项应及时将变更材料提交我所和所在地省级兽药监察检验机构备案。
特此通知。
中国兽医药品监察所年月日此通知单一式三联,第一联由中国兽医药品监察所保存,第二联由省级兽药监察检验机构保存,第三联由生产企业(代理机构)保存。
批签发产品目录单填报企业(公章):填报日期:20 年月日兽用生物制品生产与检验报告中国兽医药品监察所审核意见VETERINARY BIOLOGICS PRODUCTION AND TEST REPORTDISPOSITION BY CHINA INSTITUTE OF VETERINARY DRUG CONTROL*ANNOTATION:Y-Satisfactory,N-Unsatisfactory,I-Inconclusive,NT-Not Test兽用生物制品批签发样品抽样单检验机构保存,第三联由生产企业(代理机构)保存。
兽用生物制品检验原始记录表(示例)年月日年月日年月日兽用生物制品批签发样品销毁记录表疫苗生产企业经手人:监督单位经手人:此记录表一式二联,第一联由省级兽医行政管理部门保存,第二联由生产企业(代理机构)保存。
可编辑精品文档,欢迎下载编号:兽用生物制品批签发不符合规定通知单:我所于年月日完成对你单位生产(代理)的申报批签发有关材料的审核。
经审核,以下产品不符合生物制品批签发中国兽医药品监察所年月日此通知单一式三联,第一联由中国兽医药品监察所保存,第二联由省级兽药监察检验机构保存,第三联由生产企业(代理机构)保存。
.。
物制品批签发一览

10g/50ml/瓶
10g/50ml/瓶 (20%) 10g/50ml/瓶 (20%) 10g/50ml/瓶
10g/50ml/瓶
10g/50ml/瓶
10g/50ml/瓶 (20%)
31,278瓶 18,782瓶 18,899瓶 33,751瓶 32,905瓶 32,335瓶 18,857瓶
批号 20091144 200911416
批签粤检 2009A13572号
批签粤检 2009A13581号 批签粤检 2009A13805号
批签粤检 2009A13807号
批签粤检 2009A13808号 批签粤检 2009A13809号 批签粤检 2009A13810号 批签粤检 2009A13869号
检品名称 企业名称
规格
数量
人血白蛋白 深圳市卫武光明生物制品有 20% 10g/瓶 限公司
静注人免疫球蛋白 深圳市卫武光明生物制品有 2.5g IgG/瓶
(pH4)
限公司
12342瓶 8411瓶
乙型肝炎人免疫球 广东卫伦生物制药有限公司 100IU/瓶 蛋白
25482瓶
人血白蛋白 广东卫伦生物制药有限公司 20% 50ml 10g/瓶 8496瓶
乙型肝炎人免疫球 广东卫伦生物制药有限公司 200IU/瓶 蛋白
生物制品批签发一览表
统计时间:2010年1月25日至2010年2月1日
证书编号
批签粤检 2009A13403号
批签粤检 2009A13410号
批签粤检 2009A13447号
批签粤检 2009A13449号
批签粤检 2009A13453号
批签粤检 2009A13520号
批签粤检 2009A13571号
已实施国家批签发的生物制品品种目录-推荐下载

附件2: 已实施国家批签发的生物制品品种目录 一、疫苗制品目录 细菌类疫苗: 1.伤寒Vi多糖疫苗 2.口服重组B亚单位/菌体霍乱菌苗(肠溶胶囊) 3.钩端螺旋体疫苗 4.皮上划痕用鼠疫活疫苗 5.皮上划痕人用炭疽活疫苗 6.皮上划痕人用布氏菌活疫苗 7.皮内注射用卡介苗 8.b型流感嗜血杆菌结合疫苗 9.吸附百白破联合疫苗 10.吸附无细胞百白破联合疫苗 11.吸附破伤风疫苗 12.吸附白喉疫苗 13.吸附白喉疫苗(成人及青少年用) 14.吸附白喉破伤风联合疫苗(成人及青少年用) 15.吸附白喉破伤风联合疫苗 16.A群C群脑膜炎球菌多糖疫苗 17.A群脑膜炎球菌多糖疫苗 18.23价肺炎球菌多糖疫苗 病毒类疫苗: 1.森林脑炎灭活疫苗 2.黄热减毒活疫苗 3.乙型脑炎灭活疫苗 4.乙型脑炎减毒活疫苗 5.Ⅰ型肾综合征出血热灭活疫苗 6.Ⅱ型肾综合征出血热灭活疫苗 7.双价肾综合征出血热灭活疫苗 8.人用狂犬病疫苗(Vero细胞) 9.冻干人用狂犬病疫苗(Vero细胞) 10.人用狂犬病疫苗(地鼠肾细胞) 11.重组乙型肝炎疫苗(酵母) 12.重组乙型肝炎疫苗(CHO细胞) 13.冻干甲型肝炎减毒活疫苗 14.甲型肝炎减毒活疫苗 15.甲型肝炎灭活疫苗 16.甲、乙型肝炎联合疫苗 17.口服轮状病毒活疫苗 18.麻疹减毒活疫苗 19.脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞) 20.口服脊髓灰质炎减毒活疫苗(猴肾细胞) 21.脊髓灰质炎减毒活疫苗糖丸(猴肾细胞) 22.风疹减毒活疫苗(人二倍体细胞) 23.风疹减毒活疫苗(兔肾细胞) 24.腮腺炎减毒活疫苗 25.冻干水痘减毒活疫苗 26.麻疹腮腺炎联合减毒活疫苗 27.麻疹风疹联合减毒活疫苗 28.麻疹-腮腺炎-风疹三联减毒活疫苗 29.流感全病毒灭活疫苗 30.流感病毒裂解疫苗 31.流感病毒亚单位疫苗 二、血液制品目录 1.人血白蛋白 2.冻干人血白蛋白 3.静注人免疫球蛋白(pH4) 4.冻干静注人免疫球蛋白(pH4) 三、体外诊断试剂目录 1.梅毒快速血浆反应素诊断试剂 2.梅毒甲苯胺红不加热血清诊断试剂 3.梅毒螺旋体抗体诊断试剂盒(酶联免疫法) 4.乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法) 5.丙型肝炎病毒抗体诊断试剂盒(酶联免疫法) 6.人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法) 7.抗A、抗B血型定型试剂(人血清) 8.抗A、抗B血型定型试剂(马血清) 9.抗A、抗B血型定型试剂(单克隆抗体)。
生物制品批签发名词解释

生物制品批签发名词解释生物制品批签发,这个词听上去是不是有点拗口?就像说“牛头不对马嘴”的时候,脑子里一下子闪过一堆不相关的东西。
其实啊,生物制品批签发就是在说一个产品在出厂之前要经过的一个重要环节。
想象一下,如果你买了一瓶饮料,结果喝了之后发现里面竟然是“神奇的水”,那可就麻烦大了。
所以呢,这个批签发就像是一个把关的人,确保你喝到的每一滴都是安全、有效的。
简单来说,生物制品是指那些用活细胞或生物体制造的产品,像疫苗、抗体、酶等。
就像我们平常吃的饭菜,好的食材、好的做法才能做出美味佳肴。
生物制品也是如此,它们得经过严格的生产过程,才能确保你用上它们的时候,不会出现“翻车”的情况。
想象一下,你在药店看到一瓶疫苗,上面写着“未经批准,请自行承担风险”,那你还敢打吗?大多数人肯定会心里打鼓,毕竟“安全第一”嘛。
批签发的过程就像是一个金字塔,上面是那些专业的监管人员,他们就像是你的护航员。
每一批生物制品在出厂之前,得经过这些专业人士的审查,他们会查看产品的质量、稳定性等等。
想象一下,他们就像是“白衣天使”,在生产线旁边守护着每一瓶生物制品,确保它们在你手上时是绝对安全的。
这过程就像是“千里之行,始于足下”,每一步都得认真对待。
这个批签发不单单是看一眼就结束了,哎呀可不是那么简单的。
每个产品都有自己的“身份证”,包括生产日期、有效期、生产批次等。
这就像你去餐馆吃饭,服务员给你上菜之前,得确认这道菜的制作日期、新鲜程度。
否则,谁敢在这里“闭眼吃饭”?在这方面,生物制品的批签发也是如此,一旦发现问题,立马就会被拦下,绝对不能放行。
说到这里,咱们再来聊聊这批签发的重要性。
我们生活在一个健康意识越来越强的社会,大家对药品的要求可谓是“高到天上去了”。
就算是一点小问题,也可能引发大家的“热议”,甚至是“舆论风波”。
所以,批签发的过程,不光是对产品的把关,也是对公众信心的维护。
毕竟,大家都想要“吃得安心,喝得放心”,对吧?再说,批签发的结果也是相当有趣的。
生物制品(疫苗)批签发实验室各项用房组成

附录B生物制品(疫苗)批签发实验室各项用房组成类别用房实验室名称配置要求实验用房微生物检验实验室无菌检测室★阳性菌检测室★霉菌检测室☆微生物限度检测室★清洗消毒室★准备间★无菌检查培养室★天平室☆高压灭菌间☆培养基贮藏间☆标准菌株贮藏间★样品间☆污染物处理间☆生物安全实验室洁净实验室★支原体实验室☆病毒实验室★细菌实验室★准备间★废弃物处理间★生化免疫实验室试剂准备室☆样品制备室★生化实验室★免疫实验室★数据分析室☆细胞实验室储藏室★准备间★操作室★培养室★分析室★高压灭菌间☆分子生物学实验室试剂准备区★样品制备区★扩增间★产物分析区★动物实验室准备室★实验操作室★ABSL-2实验操作室☆ABSL-2饲育室☆废弃物处理间★清洗消毒室★检疫室★观察室★解剖室★小鼠饲养室★豚鼠饲养室★家兔饲养室★热原实验室★理化实验室普通理化室★样品处理室☆光谱分析室☆辅助仪器室☆天平室★水分测定室★精密仪器分析室★色谱分析室★高温室★实验配套用房实验配套用房业务受理大厅★业务洽谈室☆报告编制室☆资料室★受控文件室☆标准物质暂存间☆中转间及余样间★分样间☆文印室★阴凉库★冷藏库☆冷冻库☆普通耗品库★试剂库★易制毒试剂库☆剧毒试剂库☆易燃易爆试剂库☆设备维修间☆档案查阅室★图书室☆保密室☆学术交流培训用房(宣教用房)★更衣及缓冲间★清洗间★洁物储存室☆饲料库★垫料库★笼具库★物品传递间☆医疗废物暂存间★淋浴间★监控室(动物房用)★管理用房管理用房档案室★研讨与会议室★行政用房★财务室★资料与文印室★值班室☆保障用房保障用房气瓶储存间★不间断电源控制间★废弃物处理间★健康医疗室☆食堂☆风机房★强、弱电室★监控用房★配件耗材储存间☆计算机房★垃圾处理站☆污水处理站☆纯水制备间☆网络信息处理用房★注:1.“★”表示必选。
2.“☆”表示可根据相应地区产品分布、监管需求以及检测业务量选配。
3.各项用房面积具体可根据各省实验室检验任务量进行调整。
生物制品批签发管理办法

生物制品批签发管理办法文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2004.07.13•【文号】国家食品药品监督管理局令第11号•【施行日期】2004.07.13•【效力等级】部门规章•【时效性】失效•【主题分类】卫生监督正文国家食品药品监督管理局令第11号《生物制品批签发管理办法》于2004年6月4日经国家食品药品监督管理局局务会审议通过,现予公布。
本管理办法自公布之日起施行。
局长:郑筱萸二00四年七月十三日生物制品批签发管理办法第一章总则第一条为加强生物制品质量管理,保证生物制品安全、有效,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)及《中华人民共和国药品管理法实施条例》,制定本办法。
第二条生物制品批签发(以下简称批签发),是指国家对疫苗类制品、血液制品、用于血源筛查的体外生物诊断试剂以及国家食品药品监督管理局规定的其他生物制品,每批制品出厂上市或者进口时进行强制性检验、审核的制度。
检验不合格或者审核不被批准者,不得上市或者进口。
第三条国家食品药品监督管理局主管全国生物制品批签发工作;承担生物制品批签发检验或者审核工作的药品检验机构由国家食品药品监督管理局指定。
第四条生物制品批签发检验或者审核的标准为现行的国家生物制品规程或者国家食品药品监督管理局批准的其他药品标准。
第二章申请第五条按批签发管理的生物制品在生产、检验完成后,药品生产企业应当填写《生物制品批签发申请表》,向承担批签发检验或者审核的药品检验机构申请批签发。
第六条申请批签发的生物制品必须具有下列药品批准证明文件之一:(一)药品批准文号;(二)《进口药品注册证》或者《医药产品注册证》;(三)体外生物诊断试剂批准注册证明。
第七条申请批签发的技术要求及相关资料的格式,由中国药品生物制品检定所负责组织制定,报国家食品药品监督管理局批准并发布。
第八条申请批签发时应当提交以下资料及样品:(一)生物制品批签发申请表;(二)药品生产企业质量保证部门负责人签字并加盖本部门印章的批制造及检验记录摘要;(三)检验所需的同批号样品;(四)与制品质量相关的其他资料;(五)进口预防用疫苗类生物制品应当同时提交生产国国家药品管理当局出具的批签发证明文件,并提供中文译本。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生 物 制 品 批 签 发 一 览 表统计时间:2008年7月9日至2008年9月10日 证书编号检品名称 签发结论企业名称规格数量有效期 批号 静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5gIgG/瓶 8168瓶 2010-3-27 批签粤检2008A05052号200803401 静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 8531瓶 2010-5-6 0批签粤检2008A05787号200805403 静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司2.5g IgG/瓶 8145瓶 2010-4-24 批签粤检2008A05788号200804402 冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 2.5g 3289瓶 2011-3-16 批签粤检2008A05836号 20080407冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 2.5g 2444瓶 2011-3-16 批签粤检2008A05837号 20080406 冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 1.0g 3576瓶 2011-3-16批签粤检2008A05838号 20080405冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 1.0g 4873瓶 2011-3-16 批签粤检2008A05839号 20080404 1 冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司1.0g 5049瓶2011-3-16批签粤检2008A05840号 20080403 2 狂犬病人免疫球蛋白 合格 三九集团湛江开发区双林药业有限公司 200IU/瓶103137 瓶 2010-3-31 批签粤检2008A05853号20080403静注人免疫球蛋白(pH4) 合格 三九集团湛江开发区双林药业有限公司5% 50ml 2.5g/瓶 12716 瓶 2011-4-30批签粤检2008A06194号20080506 冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2176 瓶 2011-5-18批签粤检2008A06198号 20080516-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2252瓶 2008-5-14批签粤检2008A06199号 20080515-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2301 瓶 2011-5-11批签粤检2008A06200号 20080514-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2325瓶 2011-5-8 0批签粤检2008A06201号 20080513-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2304瓶2011-5-5 0批签粤检2008A06202号 20080512-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2288 瓶 2011-5-2 0批签粤检2008A06203号 20080511-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2223 瓶 2011-4-21批签粤检2008A06212号 20080409-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2144 瓶 2011-4-18批签粤检2008A06213号 20080408-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2136 瓶 2011-4-15批签粤检2008A06214号 20080407-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2152 瓶2011-4-12批签粤检2008A06215号 20080406-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司2.5g IgG/瓶 2038 瓶 2011-4-9 0批签粤检2008A06223号 20080405-(1人血白蛋白 合格 深圳市卫武光明生物制品有限公司 20% 10g/瓶 11843瓶 2011-4-21 批签粤检2008A06244号20080407 人血白蛋白 合格 深圳市卫武光明生物制品有限公司 20% 10g/瓶13267瓶2011-4-17 批签粤检2008A06245号20080406人血白蛋白 合格三九集团湛江开发区双林药业有限公司20% 50ml 10g/瓶 12548 瓶 2011-4-30批签粤检2008A06344号20080514生 物 制 品 批 签 发 一 览 表统计时间:2008年7月9日至2008年9月10日 证书编号检品名称 签发结论企业名称规格 数量 有效期 批号 人血白蛋白 合格 三九集团湛江开发区双林药业有限公司 20% 50ml 10g/瓶 11229 瓶 2011-4-30 批签粤检2008A06581号20080515 人血白蛋白 合格 深圳市卫武光明生物制品有限公司20 % 10g/瓶 11603瓶 2011-5-20批签粤检2008A06587号20080509冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 2098瓶 2011-5-21批签粤检2008A06588号 20080517-(1冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司 2.5g IgG/瓶 1101瓶 2011-5-24 批签粤检2008A06589号 20080518-1 冻干静注人免疫球蛋白(pH4) 合格 深圳市卫武光明生物制品有限公司2.5g IgG/瓶 942瓶 2011-5-24 批签粤检2008A06590号 20080519-1 人血白蛋白 合格 深圳市卫武光明生物制品有限公司 20% 10g/瓶12235瓶2011-5-3 0批签粤检2008A06591号20080508人血白蛋白 合格 三九集团湛江开发区双林药业有限公司 20% 50ml 10g/瓶 11927 瓶 2011-5-31 批签粤检2008A06841号20080616 人血白蛋白 合格 广东卫伦生物制药有限公司20%,10g/瓶 8717瓶 2013-4-30 批签粤检2008A06968号20080507 冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 2.5g 3350瓶 2011-3-22 批签粤检2008A06971号 20080408冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 2.5g 3864瓶 2011-3-22 批签粤检2008A06975号 20080409冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司 2.5g 3953瓶 2011-4-22 批签粤检2008A06976号 20080511冻干静注人免疫球蛋白(pH4) 合格 广东卫伦生物制药有限公司2.5g3473瓶2011-4-22 批签粤检2008A06977号 20080512人血白蛋白 合格 三九集团湛江开发区双林药业有限公司 20% 50ml 10g/瓶 11149 瓶 2011-5-31 批签粤检2008A06988号20080617 狂犬病人免疫球蛋白 合格 三九集团湛江开发区双林药业有限公司 200IU/瓶 110529瓶 2010-4-28 批签粤检2008A07177号20080504 人血白蛋白 合格 CSL Behring GmbH 10g/50ml/瓶 29,585瓶 2013-2-28 批签粤检2008A07282号61644411B 人血白蛋白 合格 CSL Behring GmbH 10g/50ml/瓶 32,997瓶 2013-2-28 批签粤检2008A07283号62244411B 人血白蛋白 合格 CSL Behring GmbH 10g/50ml/瓶32,212瓶 2013-3-30 批签粤检2008A07284号62844411B人血白蛋白 合格 三九集团湛江开发区双林药业有限公司 20% 50ml 10g/瓶 10809 瓶 2011-5-31 批签粤检2008A07297号20080618 静注人免疫球蛋白(pH4) 合格 三九集团湛江开发区双林药业有限公司 5% 50ml 2.5g/瓶14077 瓶 2011-5-31 批签粤检2008A07299号20080607人血白蛋白 合格 三九集团湛江开发区双林药业有限公司 20% 50ml 10g/瓶 11630 瓶 2011-5-31 批签粤检2008A08107号20080619 人血白蛋白 合格 深圳市卫武光明生物制品有限公司 20% 10g/瓶 12931瓶 2011-6-10 批签粤检2008A08162号20080614 人血白蛋白 合格 深圳市卫武光明生物制品有限公司 20% 10g/瓶13322瓶2011-5-28 批签粤检2008A08163号20080511 人血白蛋白 合格广东卫伦生物制药有限公司20% 50ml 10g/瓶 8495瓶2013-5-31批签粤检2008A08471号20080609。
