蛋白质凝胶机理
简述酪蛋白的酶凝机理。

简述酪蛋白的酶凝机理。
酪蛋白是一种重要的蛋白质,广泛存在于乳制品中。
在乳制品加工过程中,酪蛋白的凝固是非常重要的一步。
酪蛋白的凝固是通过酶的作用实现的,这种凝固过程被称为酶凝。
酶凝是一种特殊的凝固过程,它是通过酶的作用使蛋白质分子聚集在一起形成凝胶的过程。
在酪蛋白的酶凝过程中,主要涉及到两种酶:凝乳酶和胰凝乳蛋白酶。
凝乳酶是一种特殊的酶,它只存在于哺乳动物的乳汁中。
凝乳酶能够将酪蛋白分子中的一些肽键断裂,使其分子结构发生改变,从而使酪蛋白分子聚集在一起形成凝胶。
凝乳酶的作用是非常快速的,只需要几分钟就能使酪蛋白凝固。
胰凝乳蛋白酶是一种消化酶,它能够将酪蛋白分子中的肽键断裂,使其分子结构发生改变,从而使酪蛋白分子聚集在一起形成凝胶。
胰凝乳蛋白酶的作用比凝乳酶慢,需要几个小时才能使酪蛋白凝固。
酪蛋白的酶凝机理是非常复杂的,它涉及到酶的作用、酪蛋白分子的结构和环境因素等多个方面。
在乳制品加工过程中,酪蛋白的酶凝是非常重要的一步,它能够使乳制品获得更好的质量和口感。
sds聚丙烯酰胺凝胶电泳分离蛋白质的原理

sds聚丙烯酰胺凝胶电泳分离蛋白质的原理在蛋白质的分离和分析过程中,SDS-PAGE是最常用的方法之一。
SDS(十二烷基硫酸钠)是一种表面活性剂,它能够使蛋白质带有负电荷,从而使其在电场作用下向阳极移动。
结合凝胶电泳技术,SDS-PAGE可以将混合的蛋白质样品进行分离,得到不同质量的蛋白质。
SDS-PAGE的原理可以分为两个方面:SDS的特性和凝胶电泳的作用。
1. SDS的特性SDS是一种表面活性剂,它的分子结构包含一个烷基链和一个硫酸基团。
在水溶液中,SDS分子会自行形成亲水端和疏水端,亲水端朝外。
当SDS与蛋白质结合时,疏水端会插入蛋白质的氢键、疏水区域和疏水侧链中,形成类似于蛋白质包裹在疏水内部的结构,使其在水中变得均相且带负电荷。
当SDS蛋白质复合物经电场作用发生运动时,SDS发挥了两个作用:1)将蛋白质分子固定在强势的疏水内部。
2)使蛋白质分子带有电荷,使其在电场的作用下向阳极运动。
由于SDS的作用,使得蛋白质分子的移动速度与分子质量相反。
因此,不同分子大小的蛋白质,它们移动到凝胶不同的位置上。
2. 凝胶电泳的作用凝胶电泳是一种基于蛋白质分子大小和电荷的分离方法。
凝胶电泳分为竖直和水平两种方式。
水平的凝胶电泳分离较少,因此此处主要讲述竖直凝胶电泳的原理。
竖式电泳是通过两片石英玻璃板之间的聚丙烯酰胺凝胶进行组装的。
该凝胶可以产生一定的孔隙结构,从而形成了电子通过的通道。
纯化的蛋白质样品与样品缓冲液混合后,加入至凝胶孔道内,随后在一定时间内发生电泳。
通过电场作用,蛋白质复合物沿着凝胶区域内的孔隙向阳极方向运动。
与凝胶孔隙的大小相关的是其分子大小和孔隙结构。
因为蛋白质带有SDS,因此其运动速度与分子量成反比。
所以,大小不同的蛋白质在凝胶区域内分别分离并堆积。
总之,SDS-PAGE是一种通过不同分子质量和电荷分离蛋白质复合物的方法。
在SDS作用下,蛋白质复合物带有负电荷,随电场向阳极运动,在凝胶区域内分离并堆积。
sds聚丙烯酰胺凝胶电泳分离蛋白质的原理

sds聚丙烯酰胺凝胶电泳分离蛋白质的原
理
SDS聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术,其原理是利用SDS(十二烷基硫酸钠)将蛋白质分子的电荷中和,使其在电场作用下按照分子量大小在聚丙烯酰胺凝胶中进行分离。
SDS是一种表面活性剂,具有疏水性和亲水性两种性质。
在SDS存在下,蛋白质分子的疏水性区域被SDS包裹,使其呈现出负电荷,同时SDS的亲水性区域也使蛋白质分子呈现出负电荷。
这样,蛋白质分子的电荷被中和,使其在电场作用下按照分子量大小进行分离。
在SDS聚丙烯酰胺凝胶电泳中,聚丙烯酰胺凝胶是一种具有孔隙结构的凝胶,其孔隙大小与蛋白质分子的分子量有关。
较小的蛋白质分子可以穿过较大的孔隙,而较大的蛋白质分子则不能穿过较小的孔隙。
因此,在电场作用下,蛋白质分子会在聚丙烯酰胺凝胶中进行分离,形成不同的带状图案。
在SDS聚丙烯酰胺凝胶电泳中,还需要加入还原剂β-巯基乙醇,以破坏蛋白质分子之间的二硫键,使其呈现出线性结构,便于在凝胶中进行分离。
SDS聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术,其原理是利用SDS将蛋白质分子的电荷中和,使其在电场作用下按照分子量大小在聚丙烯酰胺凝胶中进行分离。
这种技术在生物学、生物化学
等领域有着广泛的应用。
大豆蛋白凝胶概述

护发产品
大豆蛋白凝胶可以添加到护发产品中,增加头发的弹性和光泽度, 改善发质。
指甲护理
大豆蛋白凝胶可以作为指甲护理产品中的成分,提供指甲所需的 营养,促进指甲健康生长。
05
大豆蛋白凝胶的发展趋势与展望
深入研究大豆蛋白凝胶的制备机理
利用超声波的空化作用,使大豆蛋白 形成凝胶。
高压处理法
利用高压使大豆蛋白发生物理变化, 形成凝胶。
化学法
酸碱处理法
通过添加酸或碱使大豆蛋白发生变性,形成凝胶。
交联法
利用化学交联剂(如戊二醛)使大豆蛋白分子间 形成共价键,形成凝胶。
复合法
结合两种或多种化学方法制备出的大豆蛋白凝胶。
生物法
酶处理法
利用酶(如凝结酵素)催化大豆蛋白 形成凝胶。
微生物发酵法
利用微生物发酵产生的大豆蛋白酶或 其他代谢产物,使大豆蛋白形成凝胶。
03
大豆蛋白凝胶的性质与特点
物理性质
01
02
03
颜色
大豆蛋白凝胶通常呈现为 淡黄色或白色,这取决于 生产过程中的处理方式和 添加的食品添加剂。
外观
大豆蛋白凝胶的外观光滑, 有一定的弹性和韧性,可 以形成各种形状,如球形、 条形等。
深入了解大豆蛋白凝胶的形成过程
研究大豆蛋白分子间的相互作用以及凝胶化过程中的物理和化学变化,有助于优 化制备工艺和提高大豆蛋白凝胶的性能。
探索不同条件下大豆蛋白凝胶的稳定性
研究温度、pH值、离子强度等因素对大豆蛋白凝胶稳定性的影响,有助于开发 适应不同应用场景的大豆蛋白凝胶。
开发新型的大豆蛋白凝胶制备技术
利用大豆蛋白凝胶的优良性质,开发新型的 食品产品,如仿肉制品、乳制品等。
wb实验凝胶电泳的原理

wb实验凝胶电泳的原理
wb实验(Western blot)是一种分子生物学技术,可用于检测蛋白质的存在、定量、大小和性质。
其原理基于凝胶电泳技术,通过将蛋白质样品经过蛋白质电泳分离后,将其转移到固定膜上进行检测。
具体实验步骤如下:
1. 准备蛋白质样品:通常将细胞或组织进行破碎,取其中的蛋白质作为样品。
2. 准备凝胶:将聚丙烯酰胺等材料制成凝胶,制成蛋白质电泳胶。
3. 加载样品:将样品加入凝胶孔中,可以使用样品加载缓冲液来保持稳定。
4. 电泳:将凝胶放入电泳槽中,将电泳缓冲液注入电泳槽内,接通电源,施加电场,蛋白加载入凝胶中,经过分离。
5. 转移:将分离好的蛋白质移至电泳膜上。
常用的转移方法有湿式转移和干式转移两种。
6. 探针反应:使用合适的探针来反应目标蛋白质,通常是特异性抗体。
此时蛋白质与抗体发生反应,生成免疫复合物,可以使用色素等手段进行检测。
总的来说,wb实验的原理就是通过电泳分离蛋白样品,再用探针来检测、定位目标蛋白质。
最新蛋白质凝胶机理

蛋白质凝胶机理蛋白质,凝胶:1 蛋白质凝胶的定义、类型及其凝胶过程中分子构象的变化蛋白质凝胶的形成可以定义为蛋白质分子的聚集现象,在这种聚集过程中,吸引力和排斥力处于平衡,以至于形成能保持大量水分的高度有序的三维网络结构或基体(matrix)。
如果吸引力占主导,则形成凝结物,水分从凝胶基体排除出来。
如果排斥力占主导,便难以形成网络结构。
蛋白质凝胶的类型主要决定于蛋白质分子的形状。
由于凝胶过程是一个动态过程,也受外界环境的 pH、离子强度及加热的温度和时间的影响。
纤维状蛋白质分子,如明胶和肌浆球蛋白凝胶的网络结构由随机的或螺旋结构的多肽链组成。
Ledward报道,明胶的凝胶网络为线性分子通过形成连接区而形成凝胶网络。
Hermanssan和langton观测到肌浆球蛋白凝胶是由线性分子间形成连接点而构建成三维网络。
球蛋白的热凝胶是由仍保持球形结构的蛋白质分子首尾聚集而形成的。
Tombs认为球蛋白形成两种类型的凝胶:高度定向有序的“念珠串状”网络结构和随机聚集的网络结构。
“念珠串状”凝胶外观透明或半透明,Nakamura报道了大豆蛋白具有这种凝胶的网络结构。
这种凝胶是在低离子强度和远离蛋白质等电点pI的条件下形成的。
当环境的离子强度较高及pH接近等电点pI时,则形成随机聚集的凝胶。
然而大多数球蛋白凝胶都具有这两种类型的凝胶网络,这决定于蛋白质的浓度、环境的pH与离子强度及加热的温度和时间。
蛋白质分子构象的变化是蛋白质分子聚集的先决条件,球蛋白更是如此。
在串状网络结构中发现蛋白质分子仍保持球形构象。
经典的球形蛋白质分子展开的“两种状态”理论认为仅存住两种状态的蛋白质:未变性的蛋白质和高度变性的无序蛋白质一现在已经证明,存从无序状态向未变性状态展开的路径中明显存在一动态的中间体。
已经发现相似的中间体状态存在于低pH(或高pH)的平衡条件下、适当浓度变性剂的条件下和高温度的条件下。
这种中间体状态被称为“熔融球蛋白状态”,它被定义为含有与未变性状态相似的二级结构而三级结构展开的紧凑的球形分子。
蛋白质的凝胶机理

蛋白质的凝胶机理蛋白质的凝胶是指蛋白质在适当条件下形成凝胶状态,使液态蛋白质转化为一种具有固态性质的物质。
这种凝胶通常具有高度的弹性和形态稳定性,是生物材料和食品加工等领域中重要的结构与功能材料。
蛋白质的凝胶化机理包括两个方面:一是蛋白质的分子结构和物理化学特性,二是凝胶化条件的影响。
首先,蛋白质的分子结构和物理化学特性是决定其凝胶化特性的重要因素。
蛋白质分子通常由多肽链组成,具有一定的电荷和亲疏水性质。
在特定的温度、pH值和离子强度条件下,蛋白质分子之间会发生相互作用,形成三维网络结构。
这种相互作用形式多种多样,包括静电相互作用、范德华力、氢键等。
其中离子交换和氢键作用是蛋白质凝胶化的重要因素。
离子交换作用通常是在中性或弱酸性下发生,蛋白质分子表面的负电荷与离子的正电荷相互吸引,形成胶态结构。
氢键作用则通常在弱碱性下发生,蛋白质分子之间通过氢键相互连接,形成胶状物质。
其次,凝胶化条件的影响也是影响蛋白质凝胶化的重要因素。
温度、pH值、离子强度、溶液浓度等因素对蛋白质凝胶化都有影响。
通常来说,高温、高PH值、高离子强度和高浓度容易使蛋白质分子自发地聚集形成凝胶结构。
对于某些特定的蛋白质来说,还需要加入特定的辅助剂以促进凝胶化。
例如,明胶在凝胶化前通常需要加入葡萄糖酸盐等酸性物质来降低PH值,从而促进胶态结构的形成。
总的来说,蛋白质的凝胶化机理十分复杂,需要结合蛋白质本身的分子结构和凝胶化条件的影响进行全面的研究。
这对于探究蛋白质的自组装机理,开发高效凝胶材料以及改进食品加工工艺等方面都具有重要的意义。
试述蛋白质形成凝胶的机理。

试述蛋白质形成凝胶的机理。
蛋白质形成凝胶是一种重要的生物现象,凝胶是指蛋白质在水溶液中形成三维网状结构的凝胶态物质。
蛋白质凝胶的形成机理可以归结为以下几个关键因素:
1. 蛋白质结构:蛋白质分子具有复杂的空间结构,包括一级结构(氨基酸序列)、二级结构(α螺旋、β折叠等)和三级结构(立体构型)。
这些结构决定了蛋白质的相互作用和折叠状态,从而影响凝胶的形成。
2. 蛋白质间相互作用:蛋白质分子间的相互作用是凝胶形成的关键。
常见的相互作用包括静电相互作用、氢键、疏水相互作用和范德华力等。
这些相互作用使得蛋白质分子在水溶液中发生聚集,形成互相连接的三维网络结构。
3. 溶剂条件:溶剂条件对蛋白质凝胶形成起着重要作用。
例如,pH值、离子强度和温度等溶液参数可以影响蛋白质的电荷状态和溶解度,进而影响凝胶的形成和稳定性。
适当的溶剂条件有利于蛋白质分子间的相互作用和凝胶结构的稳定。
4. 蛋白质浓度:蛋白质的浓度对凝胶形成也具有重要影响。
当蛋白质浓度超过某个临界值时,蛋白质分子间的相互作用会引发聚集和交联,从而形成凝胶。
这种凝胶形成的浓度临界值被称为凝胶转变浓度。
综上所述,蛋白质形成凝胶的机理是通过蛋白质分子间的相互作用和结构特性,在适当的溶剂条件下,以一定的浓度超过凝胶转变浓度,形成三维网络结构的聚集体。
凝胶的形成使得蛋白质在溶液中呈现出固体的特性,具有高度的稳定性和机械强度。
1/ 1。
双蛋白凝胶的形成机理及其在食品加工中的应用

Food Science And Technology And Economy粮食科技与经济2023 年2月第48卷 第1期Feb.2023Vol.48, No.1近年来,我国重视食物营养健康产业,提出加大双蛋白食物及强化双蛋白工程等重大项目实施力度[1]。
国务院办公厅印发的国民营养计划(2017—2030年)中指出,针对不同人群的健康需求,着力发展保健食品、营养强化食品、双蛋白食物等新型营养健康食品,并且强化双蛋白工程等重大项目实施力度[2]。
以优质动物、植物蛋白为主要营养基料,加大力度创新基础研究与加工技术工艺,开展双蛋白工程重点产品的转化推广[3]。
在食品工业中,许多食品以凝胶的形式存在,或者本质上就是一种凝胶[4]。
近年来,凝胶类相关食品因其高含水量、低热量、诱人的口味和增强饱腹感的特性而在市场上越来越受欢迎[5]。
与单一的蛋白质凝胶相比,双蛋白凝胶在调节凝胶质地方面通常更有效[6]。
大多数食品是含有不同种类蛋白的混合物体系,不同蛋白间的相互作用对食品品质有重要影响,通过不同种蛋白的复配,调控体系的凝胶性,对赋予食品独特的营养价值、形态、风味以及质地等特征更具有重要意义[7-8]。
所以本收稿日期:2022-03-09基金项目:国家青年科学基金项目(32101995);国家粮食领域青年人才支持计划(LQ2018301);江苏省高等学校重点学科建设项目(PAPD);江苏省研究生科研与实践创新计划项目(KYCX21_1530)。
作者简介:徐潼,女,硕士研究生,研究方向为食品加工。
通信作者:方勇,男,博士,教授,研究方向为食品加工。
双蛋白凝胶的形成机理及其在食品加工中的应用徐 潼,丁 俭,李 彭,严 曲,方 勇(南京财经大学 食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023)摘要:双蛋白作为理想的食品成分,在高蛋白食品配方中变得越来越具有吸引力。
与单一的蛋白凝胶相比,双蛋白凝胶具有更好的质地特性、持水性和热稳定性,其凝胶特性的增强机制主要归因于蛋白质之间增加的链缠结、非共价相互作用以及亲水基团和水之间的相互作用。
sds聚丙烯酰胺凝胶电泳分离蛋白质的原理

sds聚丙烯酰胺凝胶电泳分离蛋白质的原理
SDS聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术,其原理如下:
1. 加SDS:将蛋白质样品加入含有十二烷基硫酸钠(SDS)的缓冲液中,SDS会与蛋白质发生作用,使蛋白质分子均匀地被带负电荷,同时SDS也会破坏蛋白质分子的三维结构,使其变成线性结构。
2. 空间分离:将样品加载到聚丙烯酰胺凝胶上,凝胶由于聚合物的交联作用而形成连续的三维通道结构,蛋白质分子在通道中发生空间分离。
3. 电泳:在聚丙烯酰胺凝胶中通入电流,蛋白质分子会受到电场力的作用,向电极移动,越小的蛋白质分子移动的越远,形成一条由大分子向小分子递减的带状图案。
4. 可视化:将凝胶染色或与荧光染料结合,可以在凝胶上清晰地看到分离出的蛋白带,根据分离的结果可以分析蛋白质的分子量和相对含量。
sds-page蛋白凝胶电泳原理

在进行SDS-PAGE蛋白凝胶电泳原理的讨论之前,我们首先需要了解蛋白质和电泳技术的基本概念。
蛋白质是生物体内功能最丰富的大分子化合物,它们参与了生命的方方面面,包括结构、酶活性、信号传导等。
而电泳技术则是一种基于电场作用将带电粒子分离的方法,它在生命科学研究中有着广泛的应用。
SDS-PAGE蛋白凝胶电泳原理是一种常用于分离和鉴定蛋白质的技术,其原理基于蛋白质在电场中的迁移速度与其分子质量成反比的关系。
现在让我们深入探讨SDS-PAGE蛋白凝胶电泳的原理和相关细节。
1. SDS-PAGE蛋白凝胶电泳的基本步骤在进行SDS-PAGE蛋白凝胶电泳实验时,首先需要将待测样品中的蛋白质在含有SDS(十二烷基硫酸钠)的缓冲液中进行变性处理,使得蛋白质呈线性结构并且带有负电荷。
之后,将处理过的蛋白样品加载到聚丙烯酰胺凝胶中,并施加电场使得蛋白质开始迁移。
根据蛋白质的分子质量,它们将在凝胶中以不同的速率迁移,最终实现分离。
2. SDS的作用原理SDS是一种带有负电荷的表面活性剂,它的主要作用是使得蛋白质呈线性构象,并且使得蛋白质的带电量与其分子质量成正比。
这样一来,不同分子质量的蛋白质在电场中受到的阻力相对应也会不同,从而实现蛋白质的分离。
3. 凝胶电泳的原理凝胶电泳是利用凝胶作为分离介质的电泳方法。
凝胶可以是聚丙烯酰胺凝胶、琼脂糖凝胶或者琼脂糖琼脂糖凝胶。
在SDS-PAGE蛋白凝胶电泳中,聚丙烯酰胺凝胶是最常用的分离介质。
它的基本原理是利用凝胶的孔隙大小来实现对蛋白质的分离,分子质量较大的蛋白质会受到较大的阻力从而迁移较慢,分子质量较小的蛋白质则会迁移得更快。
4. 电泳条件的影响在进行SDS-PAGE蛋白凝胶电泳实验时,电泳条件的设定对分离结果有着重要影响。
电场强度的大小、电泳时间的长短、凝胶浓度等都会影响蛋白质的迁移速度和分离效果。
总结而言,SDS-PAGE蛋白凝胶电泳原理基于蛋白质在电场中的迁移速度与其分子质量成反比的关系,通过SDS的作用使得蛋白质呈现线性构象并且带有负电荷,再利用凝胶电泳对不同分子质量的蛋白质进行分离。
蛋白质双向凝胶电泳原理及应用

蛋白质双向凝胶电泳原理及应用一、双向凝胶电泳(2-DE)的原理双向凝胶电泳(two-dimensional electrophoresis,2-DE)的原理是第一向基于蛋白质的等电点不同用等电聚焦分离,蛋白质沿pH梯度分离至各自的等电点;第二向则按分子量的差异用SDS-PAGE聚丙烯酰胺凝胶进行分离,把复杂蛋白混合物中的蛋白质在二维平面上分开。
近年来经过多方面改进已成为研究蛋白质组的最有使用价值的核心方法。
二、关键参数分辨率和可重复性。
目前,双向凝胶电泳的一块胶板(16cm×20cm)可分出3~4千个,甚至1万个可检测的蛋白斑点。
采用固定化pH梯度胶,克服了载体两性电解质阴极漂移等许多缺点而得以建立非常稳定的、可以随意精确设定的pH梯度。
建立很窄的pH范围(如0.05U/cm),对意向区域在pH范围内做第二轮分析,从而大大提高分辨率,威斯腾生物实验中心对这方面的研究比较全面和成熟。
灵敏度。
双向凝胶电泳灵敏度较高的银染色法可检测到4ng蛋白,最灵敏的是用同位素标记,20ppm的标记蛋白可通过其荧光或磷光的强度而测定。
双向凝胶电泳用图像扫描仪、莱赛密度仪、电荷组合装置可把用上述方法得到的蛋白图谱数字化,再经过计算机处理,就可以给出所有蛋白斑点的准确位置和强度,得到布满蛋白斑点的图像,即“参考胶图谱”。
三、蛋白质组研究的主要困难对用双向凝胶电泳分离出来的蛋白,进行定性和定量分析。
双向凝胶电泳最常用的方法是先把胶上的蛋白印迹到PVDF膜上后再进行分析,确定是已知还是未知蛋白。
现在的分级分析法是先做快速的氨基酸组成分析,也可先做4~5个循环的N末端微量测序,再做氨基酸组成分析;结合在电泳胶板上估计的等点电和分子量,查对数据库中已知蛋白的数据,即可作出判断。
四、蛋白质的翻译后修饰和加工指在肽链合成完成后进行的化学反应,如磷酸化、羟基化、糖基化、二硫键形成等,可能有一百种以上。
双向凝胶电泳翻译后修饰和加工对蛋白质的正常生理功能是必需的,它们的变化往往和疾病的发生有关。
蛋白质凝胶与膨润

蛋白质凝胶化由于蛋白质分子中氢键、疏水作用、静电作用、金属离子的交联作用、二硫键等相互作用的结果。
蛋白质凝胶可以看成是水分散在蛋白质中的一种胶体状态,可以含有大量的水(如明胶可含水99%以上),具有一定的形状和弹性,具有半固体的性质。
应用:果冻、豆腐(豆腐是一种高度水合的大豆蛋白质凝胶蛋白质的凝胶化作用是指变性的蛋白质分子聚集并形成有序的蛋白质网络结构过程)、香肠、重组肉制品、乳品、凝结蛋白、明胶凝胶。
不仅形成固态凝结还能增稠,提高乳状液或泡沫的稳定性。
膨润作用:当弹性凝结和溶剂接触时,便自动吸收溶剂而膨胀,体积增大,这个过程叫膨润或溶胀。
有点弹性凝胶膨润到一定程度体积增大就停止了,称为有限膨润。
如:木材在水中。
有的弹性凝胶能无限的吸收溶剂最后形成溶液,叫无限膨润。
如:明胶在水中。
蛋白质的膨润是指蛋白质吸水后不溶解,在保持水分的同时赋予制品以强度和粘度的一种重要功能特性。
烹饪加工中有大量的蛋白质膨润的实例,如以干凝胶形式保存的干明胶、鱿鱼、海参、蹄筋、鱼唇烹调前的发制等。
烹饪加工中有大量的蛋白质膨润的实例,如以干凝胶形式保存的干明胶、鱿鱼、海参、蹄筋、鱼唇烹调前的发制等。
凝胶过滤法分离蛋白质实验报告

凝胶过滤法分离蛋白质一、实验目的了解凝胶层析的基本原理,并学会用凝胶层析分离纯化蛋白质。
二、实验原理凝胶过滤其基本原理是利用被分离的分子大小不同及固定相(凝胶)具有分子筛的特点:本实验使用交联葡聚凝胶,其具有一定孔径的网络结构。
高亲水,在水溶液里吸水可膨胀。
当其填充完成后,加入混合分子大小不同的分离液。
由于大分子物质只能沿着胶粒之间的间隙向下流动,所经路短,最先流出;而涌入胶粒内部的小分子物质,受迷宫效应的影响,要经过层层扩散向下流动,所经路程长,最后流出,通透性居中的分子则后于大分子而先于小分子流出。
从而按大到小的顺序流出实现分离的目的。
三、试剂与仪器0.1mol/L磷酸缓冲液(PH7.0),0.4%K3Fe(CN)6,交联葡聚凝胶,鸡的抗凝全血1.5*20cm的层析柱,试管,量筒,大烧杯,玻璃棒四、实验步骤1.凝胶溶胀2.装柱:从层析柱加入缓冲液,打开出口,将气泡赶走,关闭下端开口,然后加入约6cm的缓冲液,灌注凝胶,打开下端开口。
使其自然沉降高度约17cm,并使其床面覆盖缓冲液,关闭出口盖上小形圆形滤纸。
待凝胶形成后,再用缓冲液洗脱2~3次。
3.样品处理4.上样和过滤:吸取约0.5ml混合液,在距离床面1mm处沿管内壁轻轻加入样品。
打开出口,让样品溶液慢慢浸入凝胶内。
凝胶柱面加上一层磷酸盐缓冲液,并用1~2倍体积的此缓冲洗脱。
5.部分收集:控制速度为0.5ml/min左右,用试管收集洗脱液。
并观察柱上的色带,待黄色的0.4%完全脱下来后,再继续收集两管透明洗脱液作对照,关闭出口。
6.凝胶回收:收集样品后,凝胶柱用3~5倍体积洗脱液继续洗脱,从回收凝胶留给下一组。
五、实验现象结果及其讨论颜色:开始时为无色透明,但时间过去,试管中收集的红褐色开始变深,到最后,试管的颜色为深褐色,接着溶液的颜色开始变浅,红褐色几乎要消失。
接着又开始出现浅黄色,再到黄色,再黄色开始慢慢变浅,最后又变成无色透明。
原因:1.开始时,由于先加进缓冲液,而加入的全血扩散没有那么快,所以白色透明液体为缓冲液。
蛋白质凝固原理

蛋白质凝固原理蛋白质是生命体内最重要的有机物之一,它们在细胞内扮演着重要的角色,如结构支持、运输、调节、免疫等。
蛋白质的结构和功能取决于它们的折叠状态,而蛋白质的折叠状态又取决于它们的氨基酸序列和环境条件。
当蛋白质在一定条件下失去溶解性并形成固体的过程称为凝固。
本文将介绍蛋白质凝固的原理及其在食品加工和医学领域的应用。
一、蛋白质凝固的原理蛋白质凝固是一个复杂的过程,它涉及到多种因素的作用和相互作用。
下面将从分子层面和宏观层面两个方面介绍蛋白质凝固的原理。
1. 分子层面蛋白质分子的折叠状态决定了它们的溶解性和生物活性。
当蛋白质分子处于水溶液中时,它们通常呈现出高度的可溶性和流动性。
但是,在一定条件下,如pH值、温度、离子强度等发生变化时,蛋白质分子可能会发生结构变化,从而失去溶解性并形成固体。
这种结构变化通常包括四种类型:氢键、静电相互作用、疏水作用和范德华力。
氢键是蛋白质分子中最常见的相互作用之一,它是由氢原子和接受氢原子的原子之间的相互作用引起的。
这种相互作用可以稳定蛋白质分子的二级结构,如α螺旋和β折叠片。
静电相互作用是由带电氨基酸残基之间的相互作用引起的,它可以稳定蛋白质分子的三级结构。
疏水作用是由非极性氨基酸残基之间的相互作用引起的,它可以促进蛋白质分子的折叠。
范德华力是由分子之间的瞬时相互作用引起的,它是蛋白质分子在空间结构稳定性方面的一个重要因素。
2. 宏观层面蛋白质凝固的宏观层面通常包括两个步骤:凝胶形成和凝胶收缩。
凝胶形成是指蛋白质分子在一定条件下聚集形成三维网状结构的过程,这种结构可以降低系统的自由能并形成稳定的凝胶。
凝胶收缩是指凝胶中的水分子被排除出凝胶结构,导致凝胶体积缩小的过程。
蛋白质凝固的条件通常包括pH值、温度、离子强度、蛋白质浓度和加工方法等。
不同的蛋白质在不同的条件下可能会形成不同的凝胶结构,例如,鱼肉中的肌原纤维蛋白在中性pH值下可以形成弹性凝胶,而豆腐中的大豆蛋白在酸性pH值下可以形成脆性凝胶。
蛋白质功能化气凝胶

蛋白质功能化气凝胶蛋白质功能化气凝胶是一种具有广泛应用前景的新型材料。
它以天然蛋白质为基础,通过一系列物理或化学方法制备而成,具有良好的生物相容性和生物可降解性,可以在各种领域进行应用。
下面,我们将依次介绍蛋白质功能化气凝胶的应用、制备方法以及其优点。
一、应用领域蛋白质功能化气凝胶具有广泛的应用前景,主要应用于以下几个领域:1. 组织工程学:蛋白质功能化气凝胶具有良好的生物相容性和生物可降解性,可以用于组织工程学中的组织修复和再生。
2. 药物递送:蛋白质功能化气凝胶可以作为药物递送系统,通过调控气凝胶的性质和结构,实现药物的控释和靶向输送。
3. 食品工业:蛋白质功能化气凝胶可以作为食品添加剂,改善食品的质地和口感。
4. 填充材料:蛋白质功能化气凝胶可以作为填充材料应用于各个领域,如建筑、装修等。
二、制备方法蛋白质功能化气凝胶的制备方法多种多样,其中常用的制备方法包括:1. 交联法:通过交联剂将蛋白质交联成气凝胶。
2. 冷冻干燥法:将蛋白质水溶液制成冻干片,然后将冻干片进行微波干燥或真空干燥,形成气凝胶。
3. 电纺法:将蛋白质水溶液放置在电纺机上,通过高压电场将蛋白质纤维化,形成气凝胶。
4. 激光光化学法:利用激光光化学的原理,将蛋白质水溶液输送到激光束处,形成气凝胶。
三、优点蛋白质功能化气凝胶具有以下优点:1. 生物相容性好:蛋白质来源于天然蛋白质,具有良好的生物相容性。
2. 生物可降解性强:蛋白质功能化气凝胶可以被生物体分解吸收,不会给生物体带来不良影响。
3. 可重复性好:蛋白质功能化气凝胶可以通过不同的制备方法进行制备,具有很好的可重复性。
4. 可调控性好:蛋白质功能化气凝胶的物理和化学性质可以通过制备方法进行调控,从而实现对其性质和结构的控制。
总之,蛋白质功能化气凝胶是一种具有极大应用前景的新型材料,它广泛应用于组织工程学、药物递送、食品工业和填充材料等领域,具有生物相容性好、生物可降解性强、可重复性好和可调控性好等优点。
酸-热诱导罗非鱼肌肉蛋白凝胶形成及机理的研究

II
Study on acid-heat-induced gel formation and
2、采用葡萄糖酸内酯(GDL)建立模拟酸化体系,研究 GDL 添加量、蛋白质 浓度和加盐量对酸诱导罗非鱼肌肉蛋白凝胶形成过程的影响。结果表明,在罗非鱼 肌肉蛋白中添加 GDL,4℃放置 24h,GDL 缓慢水解生成葡萄糖酸,使体系 pH 值 在 2h 内迅速下降,12h 后达到稳定;在蛋白浓度 8%和加盐量 3%时,添加 1% GDL 酸化处理的罗非鱼肌肉蛋白凝胶特性最好;酸化过程中蛋白分子中总巯基含量和表 面疏水性均随酸化时间的延长而减小,采用四种变性剂依次对酸诱导体系进行处 理,酸化过程中蛋白质溶解度在 S3 中最大,表明酸诱导凝胶形成过程中起主要作 用的是蛋白分子间疏水相互作用。
酸-热诱导罗非鱼肌肉蛋白凝胶形成及机理的研究
摘要
以罗非鱼为原料加工的鱼糜及鱼糜制品深受广大消费者的欢迎。但工业化加工 鱼糜的方式都以热处理为主,由于加热速度慢、物料温度梯度大和加热时间长,易 引起凝胶劣化而导致鱼糜制品品质下降。针对热诱导凝胶的凝胶特性差,营养损失 大和不易保藏等问题,国内外研究了将高压处理、酶法交联和酸处理等非热处理方 法用于was used, the best gel properties of Tilapia muscle protein was obtained, the total sulphydryl group of the protein molecule and the surface hydrophobicity would reduced with increasing acidification time. Four denaturant were used to dissolute acid-induced gel, the highest protein solubility was obtained in S3, which showed that hydrophobic interactions between protein molecules played a major role in the acid-induced gel process.
蛋白质的SDS凝胶电泳原理
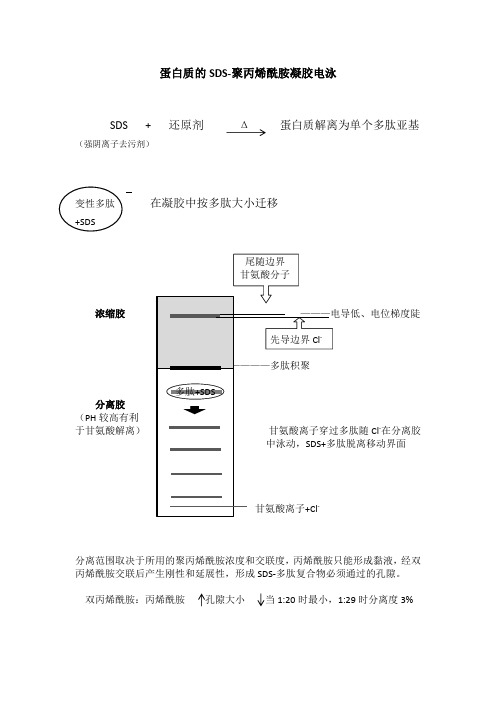
SDS +还原剂Δ 蛋白质解离为单个多肽亚基
(强阴离子去污剂)
变性多肽在凝胶中按多肽大小迁移
+SDS
尾随边界
甘氨酸分子
浓缩胶———电导低、电位梯度陡
先导边界Cl-
————多肽积聚
多肽+SDS
分离胶
(PH较高有利
于甘氨酸解离)甘氨酸离子穿过多肽随Cl-在分离胶中泳动,SDS+多肽脱离移动界面
甘氨酸离子+Cl-
分离范围取决于所用的聚丙烯酰胺度和交联度,丙烯酰胺只能形成黏液,经双
丙烯酰胺交联后产生刚性和延展性,形成SDS-多肽复合物必须通过的孔隙。
双丙烯酰胺:丙烯酰胺孔隙大小当1:20时最小,1:29时分离度3%
最新蛋白质凝胶机理

蛋白质凝胶机理蛋白质,凝胶:1蛋白质凝胶的定义、类型及其凝胶过程中分子构象的变化蛋白质凝胶的形成可以定义为蛋白质分子的聚集现象,在这种聚集过程中,吸引力和排斥力处于平衡,以至于形成能保持大量水分的高度有序的三维网络结构或基体(matrix)o如果吸引力占主导,则形成凝结物,水分从凝胶基体排除出来。
如果排斥力占主导,便难以形成网络结构。
蛋白质凝胶的类型主要决定于蛋白质分子的形状。
由于凝胶过程是一个动态过程,也受外界环境的pH、离子强度及加热的温度和时间的影响。
纤维状蛋白质分子,如明胶和肌浆球蛋白凝胶的网络结构由随机的或螺旋结构的多肽链组成。
Ledward报道,明胶的凝胶网络为线性分子通过形成连接区而形成凝胶网络。
Hermanssan和langton观测到肌浆球蛋白凝胶是由线性分子间形成连接点而构建成三维网络。
球蛋白的热凝胶是由仍保持球形结构的蛋白质分子首尾聚集而形成的。
Tombs认为球蛋白形成两种类型的凝胶:高度定向有序的“念珠串状”网络结构和随机聚集的网络结构。
“念珠串状”凝胶外观透明或半透明,Nakamura报道了大豆蛋白具有这种凝胶的网络结构。
这种凝胶是在低离子强度和远离蛋白质等电点Pl的条件下形成的。
当环境的离子强度较高及pH接近等电点Pl时,则形成随机聚集的凝胶。
然而大多数球蛋白凝胶都具有这两种类型的凝胶网络,这决定于蛋白质的浓度、环境的pH与离子强度及加热的温度和时间。
蛋白质分子构象的变化是蛋白质分子聚集的先决条件,球蛋白更是如此。
在串状网络结构中发现蛋白质分子仍保持球形构象。
经典的球形蛋白质分子展开的“两种状态”理论认为仅存住两种状态的蛋白质:未变性的蛋白质和高度变性的无序蛋白质一现在已经证明,存从无序状态向未变性状态展开的路径中明显存在一动态的中间体。
已经发现相似的中间体状态存在于低pH (或高pH)的平衡条件下、适当浓度变性剂的条件下和高温度的条件下。
这种中间体状态被称为“熔融球蛋白状态”,它被定义为含有与未变性状态相似的二级结构而三级结构展开的紧凑的球形分子。
怎样对蛋白质凝胶分析

百泰派克生物科技
怎样对蛋白质凝胶分析
蛋白质凝胶电泳(SDS-PAGE)是一种用于检测蛋白样品复杂性、蛋白纯度及其分子量大小的重要方法,其可用于蛋白下游检测或分析前分离样品蛋白混合物。
蛋白质凝胶是蛋白凝胶电泳的载体,其包括分离胶和浓缩胶。
SDS-PAGE凝胶分析是将样
品称重后溶解在十二烷基硫酸钠(SDS)中,使蛋白质变性后在电泳电场的作用下,根据蛋白质迁移率与其分子量对数成线性关系的原理实现蛋白质的分离纯化。
SDS-PAGE电泳后得到的蛋白质凝胶采用凝胶成像系统分析,即可获得新检测或缺
失检测蛋白质、蛋白质斑点定量、等电点(pI)和相对分子量(Mr)值等信息。
通过分析上述信息,对蛋白质大小、样品纯度、蛋白种类等进行初步分析与鉴定。
百泰派克生物科技提供基于SDS-PAGE的蛋白分离服务,经过SDS-PAGE电泳将获取蛋白质样品的电泳图谱,结合其它基于质谱的蛋白质鉴定服务对样品进行分析或纯化,用于复杂生物样品的蛋白质谱分析。
您只需将实验目的告知并将样品寄出,我们将负责项目后续所有事宜,包括样品净化(去除DNA和RNA,减少s-s键,蛋白质)、消除样品中高丰度蛋白质以及蛋白质提取、纯化、浓缩和水解消化等处理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质凝胶摘要:凝胶特性是食品蛋白质的重要功能特性,蛋白质的凝胶行为及其流变性质是形成某些食品独特的质构、感官和风味的决定性因素长期以来,人们对蛋白质的凝胶行为进行了广泛深入的研究,但对蛋白质凝胶的机理和凝胶动力学还没有完全了解:本文对当前有关蛋白质凝胶的类型、凝胶过程中蛋白质分子构象的变化、形成蛋白质凝胶的主要作用力和凝胶动力学过程的研究进展作了综述:随着现代分析研究技术的进步,对蛋白质凝胶行为的认识也逐渐深入关键词:蛋白质,凝胶机理1 蛋白质凝胶的定义、类型及其凝胶过程中分子构象的变化蛋白质凝胶的形成可以定义为蛋白质分子的聚集现象,在这种聚集过程中,吸引力和排斥力处于平衡,以至于形成能保持大量水分的高度有序的三维网络结构或基体(matrix)。
如果吸引力占主导,则形成凝结物,水分从凝胶基体排除出来。
如果排斥力占主导,便难以形成网络结构。
蛋白质凝胶的类型主要决定于蛋白质分子的形状。
由于凝胶过程是一个动态过程,也受外界环境的pH、离子强度及加热的温度和时间的影响。
纤维状蛋白质分子,如明胶和肌浆球蛋白凝胶的网络结构由随机的或螺旋结构的多肽链组成。
Ledward报道,明胶的凝胶网络为线性分子通过形成连接区而形成凝胶网络。
Hermanssan和langton观测到肌浆球蛋白凝胶是由线性分子间形成连接点而构建成三维网络。
球蛋白的热凝胶是由仍保持球形结构的蛋白质分子首尾聚集而形成的。
Tombs认为球蛋白形成两种类型的凝胶:高度定向有序的“念珠串状”网络结构和随机聚集的网络结构。
“念珠串状”凝胶外观透明或半透明,Nakamura报道了大豆蛋白具有这种凝胶的网络结构。
这种凝胶是在低离子强度和远离蛋白质等电点pI的条件下形成的。
当环境的离子强度较高及pH接近等电点pI时,则形成随机聚集的凝胶。
然而大多数球蛋白凝胶都具有这两种类型的凝胶网络,这决定于蛋白质的浓度、环境的pH与离子强度及加热的温度和时间。
蛋白质分子构象的变化是蛋白质分子聚集的先决条件,球蛋白更是如此。
在串状网络结构中发现蛋白质分子仍保持球形构象。
经典的球形蛋白质分子展开的“两种状态”理论认为仅存住两种状态的蛋白质:未变性的蛋白质和高度变性的无序蛋白质一现在已经证明,存从无序状态向未变性状态展开的路径中明显存在一动态的中间体。
已经发现相似的中间体状态存在于低pH(或高pH)的平衡条件下、适当浓度变性剂的条件下和高温度的条件下。
这种中间体状态被称为“熔融球蛋白状态”,它被定义为含有与未变性状态相似的二级结构而三级结构展开的紧凑的球形分子。
从受热时的未变性状态到熔融球蛋白的转变及这种部分变性的形式主要与热凝胶的形成有关。
2形成蛋白质热凝胶的作用力蛋白质凝胶是变性的蛋白质分子间排斥和吸引相互作用力相平衡的结果。
一般认为,形成和维持蛋白质凝胶的作用力主要是疏水相互作用、氢键、静电相互作用等物理作用力,但含有巯基的蛋白质分子间SH-SS交换反应也可能对蛋白质的凝胶作用有贡献。
2.1 疏水相互作用蛋白质受热时包埋的非极性多肽暴露出来,从而增强了I临近多肽非极十牛片段的疏水相互作用:因而,平均疏水性(例如蛋白质中疏水氨基酸的比率)应该影响凝胶的形成过程I Shimada和Matsushita等报道,含有高于31.5%克分子分数的非极性氨基酸残基的蛋白质形成凝结型凝胶.而那些含有低于31.5%克分子百分数的非极性氨摹酸残基的蛋白质则形成半透明型凝胶。
这种分类方法清楚地表明疏水相互作用对凝胶形成的重要性和从蛋白质的氨基酸组成预测凝胶特性的可能性。
但是Maria Babajimopoulos等认为疏水相互作用和静电相互作用对于大豆分离蛋白凝胶的形成是可以忽略的.2.2 氢键有关氢键对蛋白质凝胶形成的作用,不同的研究者得到的结论相似。
Catsimpoolas 和Meyer报道.用6mol/L的尿素处理预凝胶,抑制r大豆分离蛋白冷却时形成凝胶,因此认为氢键和疏水相互作用是形成凝胶的主要作用力。
但是高浓度的尿素可能导致蛋白质严重变性,破坏了蛋白质的二级结构,而二级结构x,j-于球蛋白形成凝胶来说是必需的,因为氢键是形成与凝胶有关的B一折叠结构的主要作用力.Maria Babajimopoulos等认为与大豆分离蛋白凝胶过程有关的主要作用力是氢键和范德华力,而疏水相互作用和静电相互作用可以忽略:Shigeru Utsumi等也报道氢键是大豆11S球蛋白、7S球蛋白和大豆分离蛋白凝胶的形成及维持凝胶网络结构的最重要的物理作用力。
2.3 静电相互作用静电相互作用通常在蛋白质聚集过程中表现为相互排斥力,特别是在体系仅含有一种蛋白质或含有相似等电点的不同种蛋白质的情况下。
pI时蛋白质的净电荷为零,当环境的pH接近pI时,蛋白质分子快速随机的聚集,因而很容易形成凝结块在pH条件远离pI时,由于存在较高的净负电荷,静电排斥力占主导,蛋白质分子的聚集不会发生。
当体系的pH 处于pI和极端pH的中间区域时,静电排斥力和相互吸引作用力(主要是疏水相互作用)很好地平衡,从而形成凝胶网络…。
凝胶中静电排斥力的重要性已被在介质中添加盐类所证实.即在pH远离pI的条件下,加入盐类屏蔽了蛋白质分子表面过剩的电荷,并使蛋白质间连接形成纤细的“念珠串”状网络结构。
然而,在介于pI和极端pH中间的pH条件下,加入盐类打破了吸引力和排斥力间的平衡.导致形成聚集体或凝结块。
2.4 二硫键Koseki等证实,即使一些蛋白质的SH—SS间的交换反应被抑制,凝胶的形成也是可能的,因此他们认为分子间的共价二硫键(S—S)不充当起始的凝胶网络的骨架。
Shigeru Utsumi等也认为SH-SS间的交换反应对于大豆11S凝胶的形成是不必要的,但对于形成强的弹性凝胶很重要。
由凝胶的溶解性试验表明,通过形成分子间的二硫键可以获得凝胶网络的物理完整性。
二硫键是否在凝胶网络的连接区形成或它们仅仅有助于增加多肽的有效链长目前还不清楚。
但在后一种情况下,长的多肽链很容易缠绕在一起,因而在凝胶网络内加强了非共价键的形成。
3蛋白质凝胶的应用3.1 蛋白质凝胶在吸水凝胶方面的应用吸水凝胶是一种通过水合作用迅速吸收大量水分而成凝胶状的不溶性亲水高聚物。
它能吸收自身重量数十倍甚至数千倍的液体,同时具有较强的保液能力。
目前国内外研究和应用最多的主要是聚丙烯酸与聚丙烯腈类高吸水凝胶,这类凝胶有很好的持水能力,不足之处是它们不可生物降解,并且自身含有未反应的有毒单体,在应用上受到一定的限制。
近10年来,已有化学改性蛋白质凝胶被用于制备吸水材料,因为蛋白质无污染,是可生物降解的天然物。
Hwang等通过乙二胺四乙酸二酐改性大豆蛋白,经戊二醛交联得到最大吸水量可达自重300多倍的吸水凝胶。
Rathna等进一步研究了用乙醇处理的EDTAD改性大豆蛋白和鱼蛋白凝胶。
所得凝胶的最大吸水量可达自重的400多倍,乙醇还可除去凝胶中的水分,萃取蛋白凝胶中低分子量臭味物质和凝胶中未反应的戊二醛。
刘琼等∞则在制备EDTAD改性明胶蛋白凝胶时重点探讨酰化前蛋白质预处理,通过紫外一可见分光光度法确定了酰化反应的工艺条件蛋白质浓度为l%,pH值为12,酰化反应时间为2~3m。
酰化改性明胶制得的水凝胶,其吸水量最大可达自重的100多倍。
研究还发现此水凝胶体系有pH敏感性,可用作药物控释的载体。
3.2蛋白质凝胶在智能凝胶方面的应用智能型水凝胶是一类对外界刺激能产生敏感响应的水凝胶,外界刺激可以是温度、pH值、溶剂、盐浓度、光、化学物质等。
根据对外界刺激的响应情况,智能型水凝胶分为:温度敏感型水凝胶、pH敏感型水凝胶、光敏感型水凝胶、压力响应型水凝胶、生物分子响应型水凝胶等。
由于敏感型水凝胶的这种智能性,其在药物缓释、蛋白质的分离提纯、人工肌肉等方面有着广阔的应用前景智能凝胶以合成材料为主,近年,以蛋白质或蛋白质经改性后制得对环境产生敏感响应的凝胶开始出现。
WaitercMstin水发现LEA—l蛋白加入水能生成水凝胶。
该水凝胶可作为吸收材料的有效组成、皮肤治疗剂、药物或化妆品赋形剂、改善食物吸湿和保湿作用的添加剂、保持生物分子完整性的防冻剂、增强有机体抗干渗透、耐热性和耐寒性的材料。
丝心蛋白和壳聚糖共混,与戊二醛交联制得半互穿网络结构的智能水凝胶,其可用作非诺洛芬钙缓释制剂的载体嗍。
周英辉等嗍明胶/海藻酸钠聚合物交联互穿网络作为基材,制备了一种pH敏感型微胶囊药物制剂。
该制剂在酸性环境中释放百分率较小,而在碱性环境中为突释型制剂,释放率升高,体现了蛋白质的特性,适用于在酸性环境中需要保护药效、在碱性环境中发挥药效的药物。
3.3蛋白质凝胶在组织工程材料等方面的应用蛋白质凝胶还可应用于组织工程基材、创伤敷料和合金膜等生物材料方面。
高学军等闭以戊二醛为交联剂,利用冻干工艺制得的胶原海绵可用于生物杂化人工皮肤组织工程的研究。
国外有文献报道,将转化生长因子引入到胶原海绵中,可以释放具有生物活性,这种海绵体材料是骨修复的理想材料吲。
马芳制备了一种丝素/明胶共混膜,随着明胶含量的增加,共混膜的溶胀率、透气性、热稳定性都有所提高,改善了原有丝素膜的性能。
邹勇等溯制备的明胶一壳聚糖合金膜是一种优质的皮外覆盖材料。
何兰珍等阿通过冷冻壳聚糖一明胶共混液诱导相分离的方法,制备了多孔性、亲水性、透气性良好的壳聚糖一明胶海绵状伤口敷料。
4结语蛋白质是天然亲水高分子化合物,蛋白质凝胶无毒、可生物降解且生物相容性好。
由于人们对环境问题的日益重视,寻求具环境友好特征的吸水材料和生物材料成为热点问题,而蛋白质凝胶的研究为人们提供了一种新的思路。
作者认为,以下几个问题值得重视。
国内外对于蛋白质凝胶在吸水材料、智能凝胶和人工材料方面研究与应用有一定的报道,但从蛋白分子结构深入研究,并考虑凝胶功能与蛋白质结构和凝胶结构的关系的报道仍不多。
系统的蛋白质凝胶结构与功能关系研究可为蛋白质凝胶应用提供良好的理论基础,对于天然基材料的应用也十分有意义.在这方面仍需要国内外学者的继续努力。
参考文献l 顾雪蓉,朱育平.凝胶化学.北京:化学工业出版社,20052 贾伟,高文远.药物控释新剂型.北京:化学工业出版社,20053顾雪蓉,朱育平.凝胶化学.北京:化学工业出版社,20054 贾伟,高文远.药物控释新剂型.北京:化学工业出版社,20055 胡坤,赵谋明,林伟锋,等.物理作用力对大豆分离蛋白凝胶质构特性的影响.食品科学,20056李云,华欲飞,李向红.大豆蛋白预先热聚集对其凝胶性质的影响.食品科技,20077王飞镝,周智鹏,崔英德,等.DSC研究大豆蛋白凝胶中水的状态叨.功能材料,20068耿信笃,白泉,王超展.蛋白折叠液相色谱法.北京:科学出版社,20069彭湘红,张俐娜.壳聚糖一丝心蛋白包药微球的结构和释放性能研究扁分子学报,200010周英辉,黄明智.明胶/海藻酸钠复合体系用于pH敏感智能药物释放体系的研究.北京化工大学学报,2003。
