晶形沉淀条件
第5章 5.3沉淀的形成与沉淀条件
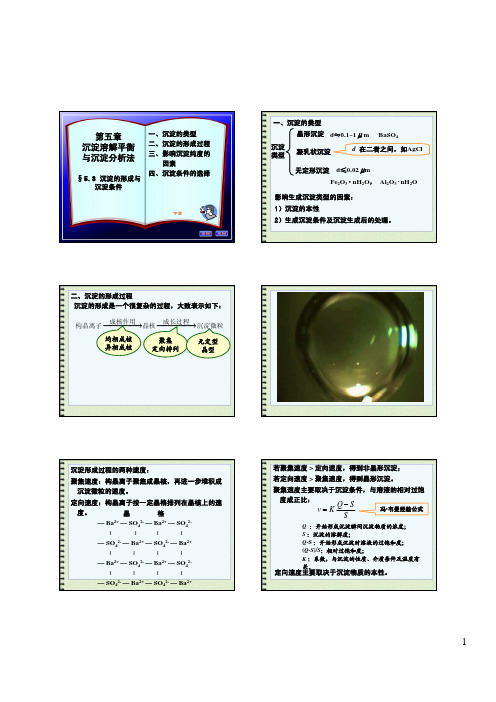
二、沉淀的形成过程 沉淀的形成是一个很复杂的过程,大致表示如下:
成核作用 成长过程 构晶离子 晶核 沉淀微粒
均相成核 异相成核
聚集 定向排列
无定型 晶型
沉淀形成过程的两种速度: 聚集速度:构晶离子聚集成晶核,再进一步堆积成 沉淀微粒的速度。 定向速度:构晶离子按一定晶格排列在晶核上的速 度。 晶 格 — Ba2+ — SO42- — Ba2+ — SO42| | | | — SO42- — Ba2+ — SO42- — Ba2+ | | | | — Ba2+ — SO42- — Ba2+ — SO42| | | | — SO42- — Ba2+ — SO42- — Ba2+
1
三、影响沉淀纯度的因素 1、 共沉淀 在操作条件下,某些物质本身不能单独析出沉 淀,当溶液中产生沉淀时,它便随同生成的沉淀 一起析出。 共沉淀的几种类型: 1)表面吸附 由于在沉淀表面上吸附了杂质而使沉淀玷污的 现象。 原因:处于沉淀表面的离子的电荷作用力未完电 层 — Ba2+ — SO42- — Ba2+ — SO42- …. Ba2+…. Cl| | | | — SO42- — Ba2+ — SO42- — Ba2+ | | | | — Ba2+ — SO42- — Ba2+ — SO42-…. Ba2+…. Cl| | | | — SO42- — Ba2+ — SO42- — Ba2+ 吸附层 扩散层
一、沉淀的类型
第五章 沉淀溶解平衡 与沉淀分析法
§5.3 沉淀的形成与
沉淀条件
一、沉淀的类型 二、沉淀的形成过程 三、影响沉淀纯度的 因素 四、沉淀条件的选择
沉淀条件五字原则

沉淀条件五字原则
沉淀条件五字原则是指在进行沉淀处理时,要考虑五个条件,即温度、浓度、时间、pH值和搅拌。
这五个条件对于沉淀的形成和沉淀物的质量都有重要影响。
1. 温度:温度可以影响物质的溶解度和反应速率,适当的温度可以促进沉淀物的形成和沉淀速度,但过高的温度可能会导致物质的分解或不完全沉淀。
2. 浓度:适当的浓度可以提高沉淀物的产率和纯度,过低的浓度可能导致沉淀物形成困难,过高的浓度可能会造成杂质的混入。
3. 时间:沉淀需要一定的时间来完成,过短的时间可能无法充分沉淀,而过长的时间可能会导致沉淀物的粒径增大或结晶。
4. pH值:pH值可以影响物质的溶解度和沉淀物的形成,适当的pH 值可以促进沉淀物的形成和纯度,但过高或过低的pH值可能导致沉淀物的溶解或不完全沉淀。
5. 搅拌:适当的搅拌可以促进物质的混合和反应,有利于沉淀物的形成和分散,但过强的搅拌可能会导致沉淀物的破碎或杂质的混入。
沉淀条件五字原则是指在进行沉淀处理时,要综合考虑温度、浓度、时间、pH值和搅拌等五个条件,以确保沉淀的形成和沉淀物的质量。
[业务]沉淀的类型及沉淀条件的选择
![[业务]沉淀的类型及沉淀条件的选择](https://img.taocdn.com/s3/m/f86b204776232f60ddccda38376baf1ffc4fe348.png)
沉淀的类型及沉淀条件的选择5.3 沉淀的类型及沉淀条件的选择5.3.1 沉淀的类型按颗粒大小分的不同,可将沉淀粗略分为两大类:一类是晶形沉淀;另一类是无定形沉淀,或称非晶形沉淀或胶状沉淀。
晶形沉淀的颗粒直径约为0.1-1mm,构晶离子排列规则、结构紧密,例如BaSO4。
无定形沉淀颗粒直径小于0.02mm,沉淀颗粒无规则堆积,沉淀疏松含水多,体积大,例如Fe2O3·nH2O。
介于晶形沉淀与无定形沉淀之间的是凝乳状沉淀,它颗粒大小介于以上两者之间,例如AgCl。
沉淀属于何种类型,由沉淀性质决定,但沉淀条件也起很大的作用。
如沉淀的颗粒大小与进行沉淀反应时构晶离子的浓度有关。
5.3.2 沉淀的形成过程沉淀过程中,首先是构晶离子在过饱和溶液中形成晶核,然后进一步成长为按一定晶格排列的晶形沉淀。
1. 晶核的形成晶核的形成有均相成核和异相成核两种情况。
(1)均相成核:是由构晶离子互相缔合而成的晶核。
如硫酸钡沉淀的晶核是Ba2+与SO42-缔合,形成BaSO4、(Ba2SO4)2+和[Ba(SO4)2]2+等等多聚体。
这些是结晶体的胚芽。
形成晶核的基本条件必须是溶液处于过饱和状态,即形成晶核时溶液的浓度Q要大于该物质的溶解度s。
(2) 异相成核:溶液中存在微细的其它颗粒,如尘埃、杂质等微粒,在沉淀过程中,它们起着晶核的作用,诱导沉淀形成。
2. 聚集与定向过程在形成晶核后,溶液的构晶离子不断向晶核表面扩散,并沉积在晶核表面,使晶核逐渐长大成为沉淀的微粒,沉淀微粒又可聚集为更大的聚集体,此过程称为聚集过程。
在聚集过程的同时,构晶离子按一定的晶格排列而形成晶体,此过程称为定向过程。
沉淀类型与聚集过程和定向过程的速度有关。
如果聚集速度大于定向速度,晶体未能定向排列,就堆聚在一起,因而得到的是无定形沉淀。
如果定向速度大于聚集速度,构晶离子得以定向排列,形成晶形沉淀。
聚集速度主要与溶液的相对过饱和度有关,定向速度主要与沉淀物质的性质有关,例如极性较强的盐类,一般具有较大的定向速度。
沉淀的类型及沉淀条件的选择

沉淀的类型及沉淀条件的选择8.4.1沉淀的类型在分量分析法中,为了得到精确的分析结果,要求沉淀尽可能具有易于过滤和洗涤的结构。
按照沉淀的物理性质和结构,可粗略地分为以下三类。
1.晶形沉淀晶形沉淀体积小,颗粒大,其颗粒直径在0.1~1um,内部罗列较规章,结构紧密,比表面积较小,易于过滤和洗涤。
如用普通办法得到的SaSO4沉淀。
2.无定形沉淀无定形沉淀又称为胶状沉淀或非晶形沉淀,是由细小的胶体微粒凝结在一起组成的,体积浩大,颗粒小,胶体微粒直径普通在0.02um以下,无定形沉淀是杂乱疏松的,比表面积比晶形沉淀大得多,简单吸附杂质,难以过滤和洗涤。
X衍射法证实,普通状况下形成的无定形沉淀并不具有晶体的结构。
如Fe2O3·nH2O沉淀。
3.凝乳状沉淀凝乳状沉淀也是由胶体微粒凝结在一起组成的,胶体微粒直径在0.02~0.1um,微粒本身是结构紧密的极小晶体。
所以,从本质上讲,凝乳状沉淀也属晶形沉淀,但与无定形沉淀相像,凝乳状沉淀也是疏松的,比表面积较大,如AgCl沉淀。
生成的沉淀属于哪种类型,首先取决于沉淀的性质,同时也与形成沉淀时的条件以及沉淀的预处理疏远相关。
以上三类沉淀的最大差别是沉淀颗粒的大小不同,分量分析中最好能避开形成无定形沉淀。
由于它的颗粒罗列杂乱,其中还包含了大量的水分子,体积特殊浩大,形成疏松的絮状沉淀,所以在过滤时速度很慢,还会将滤纸的孔隙阻塞。
而且,因为比表面积特殊大,带有大量杂质,很难洗净。
相比之下,凝乳状沉淀在过滤时并不阻塞滤纸,过滤的速度还比较快,洗涤液可以通过孔隙将沉淀内部的表面也洗净。
在沉淀分量分析中,希翼得到的是晶形沉淀,有较大的颗粒,无定形沉淀要紧密,这样便于洗涤和过滤,沉淀的纯度要高。
所以了解沉淀的溶解度、纯度以及沉淀条件的挑选对沉淀分量分析是很重要的。
8.4.2沉淀条件的挑选在分量分析中,为了获得精确的分析结果,要求沉淀彻低、纯净、易于过滤和洗涤,并削减沉淀的溶解损失。
沉淀溶解平衡与沉淀条件的选择

(三) 热溶液中进行沉淀,使沉淀的溶解度略有增 加,可降低溶液的相对过饱和度,为防沉淀热溶 解损失,应在沉淀完成后,冷却后过滤。 ( 四 ) 陈化 沉淀完毕后,让沉淀和溶液一起放置 一段时间。可使沉淀晶形完整、纯净、粗大晶体 长大。加热和搅拌可缩短陈化时间。
二、无定形沉淀的沉淀条件
无定形沉淀一般溶解度很小,溶解损失可忽 略不计。主要考虑减少杂质吸附和防止形成胶体 溶液。 (一 ) 在较浓的溶液进行沉淀,加入沉淀剂的速度 可适当加快。沉淀完毕后,立刻加入大量热水冲 稀并搅拌,使被吸附的部分杂质转入溶液。 (二) 在热溶液中进行沉淀。可防止胶体生成,减少 杂质的吸附作用,并可使生成的沉淀紧密些。 (三)溶液中加入适当的电解质,以防止胶体溶液的 生成。但加入应是可挥发性盐类如铵盐等。 (四)不必陈化。
(二)后沉淀现象
沉淀放置过程中,溶液中杂质离子慢慢沉淀到沉
淀上的现象,称为后沉淀现象。
如在 Cu 2+ 、 Zn 2+ 的酸性溶液通入 H 2 S 最初得到的
CuS↓并不夹杂ZnS。但若↓与溶液长时间接触,由 于CuS↓表面吸附溶液的S2-,使↓表面 [S2-]增加,当 [Zn2+]×[S2-] > Ksp,ZnS时,在CuS↓表面析出ZnS沉 淀。
纯水可不考虑离子强度引起活度系数的减小。
溶解度的大小是选择适宜沉淀剂的重要依据。
对于其它类型MmAn的沉淀:
s m n
K sp m n
m n
适用于构晶离子无任何副反应。
(三)溶度积和条件溶度积
当有副反应发生,构晶离子有多种型体存在, 设其各型体的总浓度分别为[M’]及[A’] :
(二)活度积和溶度积 aM+aA- / aMA(水)= K2Biblioteka 得:aM+×aA- =
第六章重量分析与氧化还原滴定习题10

3. 碘量法分析中所用的标准I2和Na2S2O3。 配制I2液时,为了防止I2的挥发,通常需加 入_____使其生成_____。而配制Na2S2O3时 加入少量Na2CO3,其作用是_______。 4. 在氧化还原滴定中,选择指示剂的基本原则 是______。
5. 用重铬酸钾法测Fe2+时,常以二苯胺磺酸钠 为指示剂,在H2SO4-H3PO4混合酸介质中进行 其中,加入H3PO4的作用有两个,一是_____ ;二是_________。
A. 在稀溶液中进行沉淀
B. 在热溶液中进行沉淀
C. 慢慢加入稀沉淀剂溶液并不断搅拌
D. 不必陈化
9.将沉淀剂稀H2SO4,加到BaCl2溶液中生成 BaSO4沉淀,产生吸附共沉淀的是()
A. BaSO4·SO42- B. BaSO4·2Cl-
C. BaSO4·H+
D. BaSO4·Ba2+
10. 用洗涤方法可除去的沉淀杂质是() A. 混晶共沉淀杂质 B. 包藏共沉淀杂质 C. 吸附共沉淀杂质 D. 后沉淀杂质 11. 以BaSO4作为称量形式测定FeS2时,其 换算因数F的表达式为()
A. Mr FeS2 Mr BaSO4
B. Mr BaSO4 Mr FeS2
C. 2MrFeS2 Mr BaSO4
D. MrFeS2 2Mr BaSO4
11. 为了获得纯净且易于过滤的晶形沉淀, 要求()
A. 沉淀的聚集速率大于定向速率 B. 溶液的过饱和度要大
C. 沉淀的相对过饱和度要小 D. 沉淀的溶解度要小
6. 若两点对的电子转移数均为1,为使反应到 99.9%以上,则一般要求该氧化还原反应的条 件平衡常数lgK′_____,两点对的条件电势差
沉淀的形成

第29讲
第九章 重量分析法
第2讲
•三、沉淀条件对沉淀类型的影响 • 早在20世纪初期,冯·韦曼(Van Weimarn)曾 以BaSO4沉淀为对象,对沉淀颗粒大小与溶液浓度的 关系作过研究。结果发现,沉淀颗粒的大小与形成沉 淀的初速度 (即开始形成沉淀的进度 )有关,而初速度 又与溶液的相对过饱和度成正比。 • 形成沉淀的初速率v=K(Q-S)/S 式中Q为溶液中混合反应物瞬时产生的物质总浓度, S为沉淀的溶解度,Q-S为沉淀开始时的过饱和程度, 此数值越大,生成晶核的数目就越多。K为常数,它 与沉淀的性质、介质、温度等因素有关。
14
第29讲
第九章 重量分析法
第2讲
•2.吸留与包夹 • 在沉淀过程中,当沉淀剂的浓度比较大、 加入比较快时沉淀迅速长大,则先被吸附在 沉淀表面的杂质离子来不及离开沉淀,于是 就陷入沉淀晶体内部,这种现象称为吸留。 如留在沉淀内部的是母液,则称为包夹。这 种现象造成的沉淀不纯是无法洗去的,因此, 在进行沉淀时应尽量避免此种现象的发生。
13
第29讲
第九章 重量分析法
第2讲
• 此外,吸附杂质量的多少,还与下列因素有 关: • (1)沉淀的总表面积愈大,吸附杂质的量愈多。 所以无定形沉淀较晶形沉淀吸附杂质多,细小的 晶形沉淀较粗大的晶形沉淀吸附杂质多。 • (2)杂质离子的浓度愈大,被吸附的量也愈多。 • (3) 溶液的温度也影响着杂质的吸附量,因为 吸附作用是一个放热过程,所以溶液的温度愈高, 吸附的杂质量愈少。
10
第29讲
第九章 重量分析法
第 2讲
图示
BaSO4晶体表面吸附示意图
沉淀表面形成双电层: 吸附层——吸附剩余构晶离子SO42 扩散层——吸附阳离子或抗衡离子Fe3+
沉淀技术

所以选用盐的时候要考虑的不同盐的盐析效果, 常见阴离子的盐析效果:PO43- > SO42- > CH3COO- > Cl- > NO3 - > ClO4 - > I - > SCN – 常见阴离子的盐析效果:NH4+>K+>Na+>Mg+
9
1.盐溶和盐析
• 当向蛋白质溶液中加入电解质时,蛋白质的溶解
度首先将随电解质的增加而增大,这种现象称为 盐溶;
• 当继续加入电解质时,蛋白质的溶解度减小,发
生聚集而沉淀,这种现象称为盐析。
10
盐溶 原理:大多数蛋白类酶都溶于水,而且在低浓度的盐存在 的条件下,酶的溶解度随盐浓度的升高而增加,这称为盐 溶现象。蛋白质分子吸附盐类离子后,带电表层使蛋白质 分子彼此排斥(同性相斥);而蛋白质与水分子的相互作 用却加强,溶解性增大。
lgS =β-ksI
17
3)、盐析分类
lgS =β-ksI
1. ks盐析:固定蛋白质的pH 、T( β ),变动离子 强度I达到沉淀的目的。
2. β盐析:在一定的离子强度下( I ) ,改变溶液 的pH、T ,达到沉淀的目。
3. ks盐析用于蛋白质粗品的分级沉淀。
4. β分段盐析用于蛋白质进一步的精细分离纯化。
lgS =β-ksI
16
2)、β值的特性及对盐析的影响 •表示不外加盐时的理想溶解度S,与盐的种类无关, 但与温度、pH有关; •pH的影响:pI时蛋白质溶解度最低,β在pI时最小( 调节pH可以导致蛋白质净电荷数变化)
•温度的影响:高离子强度溶液中,温度升高一般使β下 降(温度升高利于盐的溶解,夺取更多的水分子,使蛋 白质溶解性更差)
晶形沉淀和无定形沉淀

晶形沉淀和无定形沉淀
哎呀呀,啥是晶形沉淀和无定形沉淀呀?这可把我这个小学生难住啦!
老师在课堂上讲的时候,我就瞪大眼睛使劲听。
晶形沉淀就好像是一群排着整齐队伍的小朋友,一个个站得直直的,有棱有角,特别规整。
比如说像氯化银沉淀,那模样,可漂亮啦,就像一颗颗小小的水晶!
再看看无定形沉淀,哎呀,它们就像是一群调皮捣蛋的小孩子,到处乱跑乱撞,没个固定的形状。
就像氢氧化铁沉淀,乱糟糟的,一点儿也不整齐。
有一次上实验课,我们亲眼看到了晶形沉淀和无定形沉淀的形成过程。
我旁边的小明惊讶地喊:“哇,这差别也太大了吧!”我也忍不住说:“可不是嘛,晶形沉淀咋就那么听话,能长得那么好看呢?”
老师笑着告诉我们:“这可跟它们生成时的条件有关系哟。
”我心里就想:这条件就像是给小朋友们定的规矩,规矩好了,就能长成晶形沉淀那样的乖孩子;要是没规矩,就成了无定形沉淀那样的调皮鬼啦!
后来做作业的时候,我还总是想起那些沉淀的样子。
我就跟同桌说:“你说这晶形沉淀和无定形沉淀,是不是就像我们班的纪律委员和那些总爱捣乱的同学呀?”同桌点点头说:“还真有点像!”
我觉得呀,晶形沉淀和无定形沉淀虽然看起来很不一样,但它们都是化学世界里神奇的存在。
它们就像不同性格的小伙伴,各自有着自己的特点和魅力。
我们得好好了解它们,才能在化学的海洋里畅游呀!。
重量分析法有答案解析

•单项选择1、往AgCI沉淀中加入浓氨水,沉淀消失,这是因为()A、盐效应B、同离子效应C、酸效应D、配位效应2、沉淀掩蔽剂与干扰离子生成的沉淀的()要小,否则掩蔽效果不好。
A、稳定性B、还原性C、浓度D、溶解度3、沉淀重量分析中,依据沉淀性质,由()计算试样的称样量。
A、沉淀的质量B、沉淀的重量C、沉淀灼烧后的质量D、沉淀剂的用量4、称取硅酸盐试样I.OOOOg,在105 C下干燥至恒重,又称其质量为0.9793g ,湿存水分质量分数为()A、97.93 %B、96.07 %C、3.93 %D、2.07 %5、沉淀中若杂质含量太高,则应采用()措施使沉淀纯净。
A、再沉淀B、提高沉淀体系温度C、增加陈化时间D、减小沉淀的比表面积6、只需烘干就可称量的沉淀,选用()过滤。
A、定性滤纸B、定量滤纸C、无灰滤纸上D、玻璃砂芯坩埚或漏斗7、在重量分析中能使沉淀溶解度减小的因素是()A、酸效应B、盐效应C、同离子效应D、生成配合物8、已知BaSO 4 的溶度积Ksp=1.1 X10-16,将O.1mol/L 的BaCl2 溶液和0.01moI/L溶液等体积混合,则溶液()则该硅酸盐中的H2SO4A、无沉淀析岀B、有沉淀析岀C、析岀沉淀后又溶解D、不一定9 、在重量法分析中,为了生成结晶晶粒比较大的晶形沉淀,其操作要领可以归纳为()A、热、稀、搅、慢、陈B、冷、浓、快C、浓、热、快D、稀、冷、慢10 、重量分析对称量形式的要求是()A、颗粒要粗大B、相对分子质量要小C、表面积要大D、组成要与化学式完全符合11、用沉淀称量法测定硫酸根含量时,如果称量式是BaSO 4,换算因数是()A、0.1710 B 、0.4116 C 、0.5220 D 、0.620112、称量分析中以Fe2O3 为称量式测定FeO ,换算因数正确的是()A、B、C、 D 、13、以SO42-沉淀Ba2+时,加入适量过量的SO42-可以使Ba2+离子沉淀更完全。
思考题与习题

思考题与习题第3章思考题与习题一、简答与名解1.重量分析对沉淀的要求是什么?答:要求沉淀要完全、纯净。
对沉淀形式的要求:溶解度要小]纯净、易于过滤和洗涤。
对称量形式的要求:沉淀的组分必须符合一定的化学式、足够的化学稳定性、尽可能大的分子量。
2.解释下列名词:沉淀形式,称量形式,溶解度,同离子效应,盐效应,酸效应,络合效应,聚集速度,定向速度,共沉淀现象,后沉淀现象,再沉淀,陈化,均匀沉淀法,换算因数。
答:沉淀形式:往试液中加入沉淀剂,使被测组分沉淀出来,所得沉淀称为沉淀形式。
称量形式:沉淀经过过滤、洗涤、烘干或灼烧之后所得沉淀。
固有溶解度:难溶化合物在水溶液中以分子状态或离子对状态存在的浓度。
同离子效应:当沉淀反应达到平衡后,加入与沉淀组分相同的离子,以增大构晶离度,使沉淀溶解度减小的效应。
盐效应:由于强电解质盐类的存在,引起沉淀溶解度增加的现象。
酸效应:溶液的酸度对沉淀溶解度的影响。
配位效应:溶液中存在能与沉淀构晶离子形成配位化合物的配位剂时,使沉淀的溶解度增大的现象。
聚集速度:沉淀形式过程中,离子之间互相碰撞聚集成晶核,晶核再逐渐长大成为沉淀的微粒,这些微粒可以聚集为更大的聚集体。
这种聚集过程的快慢,称为聚集速度。
定向速度:构晶离子按一定的晶格排列成晶体的快慢,称为定向速度。
共沉淀现象:在进行沉淀时某些可溶性杂质同时沉淀下来的现象。
后沉淀现象:当沉淀析出后,在放置过程中,溶液中的杂质离子漫漫在沉淀表面上析出的现象。
再沉淀:将沉淀过滤洗涤之后,重新溶解,再假如沉淀剂进行二次沉淀的过程。
陈化:亦称熟化,即当沉淀作用完毕以后,让沉淀和母液在一起放置异端时间,称为陈化。
均匀沉淀法:在一定条件下,使加入沉淀不能立刻与被测离子生成沉淀,然后通过一种化学反应使沉淀从溶液中慢慢地均匀的产生出来,从而使沉淀在整个溶液人中缓慢地、均匀地析出。
这种方法成为均匀沉淀法。
换算因数:被测组分的摩尔质量与沉淀形式摩尔质量之比,他是一个常数。
第9章 重量分析法(课后习题及答案)

第九章 重量分析法思考题与习题1. 沉淀重量法中,对沉淀形式和称量形式的要求?答:①对沉淀形式的要求:溶解度小;易过滤、洗涤;纯度高;易转化为称量形式。
②对称量形式的要求:有确定的化学组成;稳定,不受空气中水分、CO 2和O 2等的影响;称量形式的摩尔质量要大。
2. 简述获得晶形沉淀和无定形沉淀的主要条件。
答:①晶形沉淀的条件:“稀、热、慢、搅、陈”。
②无定形沉淀的条件:“浓、热、快、稀、再’。
3. 为了使沉淀完全,必须加入过量沉淀剂,为什么不能过量太多?答:在沉淀法中,由于沉淀剂通常是强电解质,所以在利用同离子效应保证沉淀完全的同时,还应考虑盐效应的影响,盐效应使沉淀溶解度增大。
有时还应考虑酸效应、配位效应等的影响。
4. 影响沉淀纯度的因素有哪些?简述提高沉淀纯度的措施。
答:影响沉淀纯度的因素主要有两个:共沉淀和后沉淀。
共沉淀包括:表面吸附、混晶、吸留与包藏。
提高沉淀纯度的措施有:选择合理的分析步骤 、降低易被吸附杂质离子的浓度、选择合适的沉淀剂、选择合理的沉淀条件、必要时进行再沉淀等。
5. 计算下列换算因数称量形式 被测组分(1) Al 2O 3 Al(2) BaSO 4 (NH 4)2Fe(SO 4)2·6H 2O(3) Fe 2O 3 Fe 3O 4(4) BaSO 4 K 2SO 4 ·Al 2 (SO 4)3·24H 2O(5) Mg 2P 2O 7 MgO(6) PbCrO 4 Cr 2O 3解:(1) (2) (3) (4) 23AlAl O 2M M ()()444222BaSO NH Fe SO 6H O 2M M 3423Fe O Fe O 2M M ()4242423BaSO K SO Al SO 24H O 4M M(5) (6) 6. 称取0.7089g 不纯的KCl 试样,以过量的AgNO 3处理,得到1.3028gAgCl ,求该试样中KCl 的百分含量。
第六章重量剖析法和沉淀剖析法

v===K(Q-S)/S Q:加入沉淀剂时溶质的瞬间总浓度 S:表示晶核的溶解度 Q-S:过饱和度 K:与沉淀的性质、温度和介质等因素有关的常数 当溶液的相对过饱和度较小时,沉淀生成的初速度很慢,此时异相成核是主要的 成核过程;由于溶液中外来固体颗粒的数目是有限的,构晶离子只能在这有限的晶 核上沉积张大,从而有可能得到较大的沉淀颗粒 当溶液的相对过饱和度较大时,由于沉淀生成的初速度较快,大量构晶离子必然 自 发地生成新的晶核,而使均相成核作用突出起来,溶液中晶核总数也随着相对过饱 和度的增大而急剧增大,致使沉淀的颗粒减小。 3、临界异相过饱和比 Q*/S:过饱和溶液开始发生异相成核作用时溶液的相对过饱 和度的极限值。 临界均相过饱和比 QC/S:过饱和溶液开始发生均相成核作用时溶液的相对过饱 和度的极限值。 由于异相成核可以在较低的过饱和度进行,故其先于均相成核。 临界值的大小是由沉淀物质的本性所决定的。
2、吸留与包夹 ⑴、吸留:在反应中,由于沉淀生成的速度过快,表面所吸附的杂质离子来
不及离开,就被随后生成的沉淀所覆盖而包藏在沉淀内部,称为吸留。 包夹:如留在沉淀内部的是母液,则称为包夹。 ⑵、区别:包夹并无选择性;而吸留实质上是一种吸附,故有一定的选择性。 ⑶、与表面吸附的区别:吸留与包夹都发生在沉淀内部,无法用洗涤的方法
①极性较强的盐类如 BaSO4 等 ,一般具有较大的定性速度,故常生成晶形 沉淀。
②氢氧化物,特别是高价金属离子的氢氧化物,它们的溶解度很小,沉淀 时溶液的相对过饱和度较大;又由于含有大量的水分子而阻碍着离子的定向排列, 因此定向速度较小,一般易生成体积庞大、结构疏松的无定形沉淀。
结论:沉淀的类型不仅取决于沉淀物质的本性,也与进行沉淀的条件密切相关 ,
又有络合效应,所以在进行沉淀时,必须控制沉淀剂的用量,才能达到沉淀完全的 目的。
沉淀的溶解度及其影响因素

沉淀的溶解度及其影响因素在利用沉淀反应进行重量分析时,要求沉淀反应进行完全,一般可根据沉淀溶解度的大小来衡量。
通常,在重量分析中要求被测组分在溶液中的残留量在0.000 1g 以内,即小于分析天平的称量允许误差。
但是,很多沉淀不能满足这个条件。
例如,在1 000 mL水中,BaSO4的溶解度为0.002 3 g, 故沉淀的溶解损失是重量分析法误差的重要来源之一。
因此,在重量分析中,必须了解各种影响沉淀溶解度的因素。
一、沉淀的溶解度当水中存在1: 1型难溶化合物MA时,MA溶解并达到饱和状态后,有下列平衡关系:MA (固)MA (水)M+ + A-式中MA (固) 表示固态的MA,MA (液) 表示溶液中的MA,在一定温度下它的活度积是一常数,即:a (M+)×a (A-) == (7—1)式中a (M+)和a (A-)是M+和A-两种离子的活度,活度与浓度的关系是:a (M+) = (M+) ×ceq(M+);a (A—) = ( A—) ×ceq (A—)(7—2)式中(M+)和( A—)是两种离子的活度系数,它们与溶液中离子强度有关。
将式( 7 - 2 )代入(7 – 1 )得(M+) ceq(M+)·( A-) ceq(A-) = (7—3)故= ceq(M+)·ceq(A—) = (7—4)称为微溶化合物的溶度积常数,简称溶度积。
在纯水中MA的溶解度很小,则ceq(M+) = ceq(A—) = so(7—5)ceq(M+)·ceq(A—) = so2 =(7—6)上二式中的so是在很稀的溶液内,没有其他离子存在时MA的溶解度,由so所得溶度积非常接近于活度积。
一般溶度积表中所列的是在很稀的溶液中没有其他离子存在时的数值。
实际上溶解度是随其他离子存在的情况不同而变化的。
因此溶度积只在一定条件下才是一个常数。
如果溶液中的离子浓度变化不太大,溶度积数值在数量级上一般不发生改变。
华中师范大学等六校合编《分析化学》笔记和课后习题(含考研真题)详解(沉淀重量分析法)【圣才】

c.影响因素 活度积(Kap)仅与温度有关。 ②溶度积 a.使用条件 溶液中电解质的浓度较大,需要考虑离子强度的影响。 b.计算公式
c.影响因素
温度、溶液的离子强度。
③s 与 Kap 或 Ksp 的关系
s M A
Ksp
Kap M A
(3)条件溶度积 MmAn 型沉淀的条件溶度积
2.影响沉淀溶解度的因素 (1)同离子效应
K sp
K
sp
m M
n A
3 / 47
圣才电子书 十万种考研考证电子书、题库视频学习平台
增加某一构晶离子浓度导致沉淀平衡被打破,使沉淀溶解度减小的现象,称为同离子效 应。
(2)盐效应 沉淀的溶解度随着溶液中电解质浓度的增大而增大的现象,称为盐效应。 (3)酸效应 溶液的酸度对于沉淀溶解度的影响称为酸效应。产生酸效应的原因是沉淀的构晶离子与 溶液中的 H+或 OH-发生了副反应。 (4)络合效应 形成沉淀的构晶离子参与络合反应,导致沉淀的溶解度增大的现象,称为络合效应。 (5)其他因素 ①温度 溶解度一般随温度的升高而增大。 ②溶剂 离子型晶体在有机溶剂中的溶解度比在水中小;有机沉淀剂形成的沉淀则相反。 ③沉淀的颗粒大小 同一种沉淀,小颗粒比大颗粒的溶解度大(更大的比表面积;表面的分子有更高能量)。 ④沉淀的结构 亚稳定型的溶解度较大。 ⑤胶溶 已经凝聚的沉淀因为再次形成胶体而重新分散在溶液中。
2.无定形沉淀的沉淀条件 (1)沉淀作用应在比较浓的溶液中进行,加入沉淀剂的速度也可以适当快一些。 (2)沉淀作用应在热溶液中进行。 (3)在溶液中加入适当的易挥发的盐类电解质。 (4)一般杂质较多,需再沉淀。 3.均匀沉淀法 (1)原理 加到溶液中的沉淀剂并不立刻与被测离子发生沉淀,而是通过缓慢的化学反应过程,使 沉淀剂在整个溶液内均匀地产生。 (2)优缺点 ①优点 能得到大颗粒的晶形沉淀,且吸附的杂质量少,较纯净。 ②缺点 a.形成沉淀的反应时间较长。 b.沉淀容易在容器壁上沉积形成一层很薄的膜,增加分离的难度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+ β1H[O
1.6 10 9.346 3.9 10 mol/L
8 -4
②在纯水中 [H ] 10- 7 ,
S 2 KspS O
4
SO4
2
1 1 1.310 4 mol / L
2
s0
aMA水 aMA固
∵a MA(固)= 1
∴a MA(水)= s0
S0为MA(水)的固有溶解度
溶解度S:难溶化合物在水溶液中的浓度,为水中分子浓 度和离子浓度之和 MA(固)溶解度:S = S0 + [M+] = S0 + [A-] 大多数物质的固有溶解度较小因此:S = [M+] = [A-]
离子强度 活度系数
1 I ([ci ]Z i2 ) 2 i lg 0.50 Z ( 0.30 I ) 1 I
2
I
S/S1 1.6 1.4 1.2 1.0 0.001 0.005 c(KNO3)/(mol· L-1) 0.01 AgCl BaSO4 AgCl和BaSO4在不同
分析 :该题中须同时考虑络合效应和同离子效应
络合效应须考虑副反应系数,即Ksp'= Kspα
解: (1) 考虑络合效应
αAg
1 β1[Cl- ] β2[Cl- ]2 β3[Cl- ]3 β4[Cl- ]4 103.4
Ksp' Ksp αAg 10
-6.35
(2)考虑同离子效应 Ksp'= [Ag'+] [Cl-'] =S [Cl-] S = 4.5×10-6mol/L
第十章 重量分析法
定量分析法包括的内容:容量分析和重量分析
1、 重量分析法的特点和要求 2、 沉淀重量法对沉淀的要求 3、 沉淀的溶解度及其影响因素 4、 沉淀的形成 5、 影响沉淀纯度的因素 6、 进行沉淀的条件
7、 有机沉淀剂
8、 重量分析结果的计算
第一节 重量分析法概述
含义:
通过称量被测组分的质量或质量的变化来确定被测组分 含量的分析方法。
m n m n
n m
m n
m n
S
( m n)
K sp mmnn
(三)溶度积和条件溶度积 在实际的沉淀平衡中,还存在着许多副反应 MA M+ + AOHL
HA ┊ 则:溶度积 Ksp=[M+][A-]= [M'][A']/ ( M A) 定义条件溶度积为: Ksp'= [M'][A']= Ksp M A 显然 Ksp'> Ksp
第二节 沉淀的溶解度及其影响因素 沉淀溶解损失的允许最大值:
在利用沉淀进行分析时,要求沉淀进行完全。但绝 对不溶解的物质是不存在的。通常要求沉淀的溶解
损失不超过天平的称量误差即0.1mg,就可认为沉淀
完全。
沉淀溶解损失与溶解度有关,而溶解 度又与溶度积和其他因素有关。
一、沉淀的溶解度与溶度积
(一)溶解度和固有溶解度 MA(固) MA(水) M+ + A- 或 MA(固) M+A-(水) M+ + A固体溶解度以MA(水) 及 M+ + A-两种形式存在。
2 2 4
' 2 K SP [Ca 2 ][C2O'2 ] K S ' 2 4 SP CO
2 4
S ' K SP C O 2
2 4
αC O
2
4
2-
( H)
1 1 1 2 1 1H [H ] 2H[H ]2 =1+Ka [H ] K K [H ] a1 a2 2
沉淀重量法
被测物 被测物 SO42+
溶解、加入沉淀剂
沉淀形式
滤洗、烘(烧)
称量形式 称量形式
沉淀剂 BaCl2
沉淀形式 BaSO4 滤,洗
灼烧,800℃
BaSO4
Mg2+ + (NH4)2HPO4
MgNH4PO4· 6H2O
滤,洗 Mg2P2O7 灼烧 ,1100℃ 滤 洗
Al3+ + 3
OH
Al(
C2O42- + Ca2+
C2O42- + H+
H C2O4 -+ H+
H C2O4 H 2C2O4
2
2 4
2 K 'SP [Ca 2 ][C 2O'4 ] K SP α C O2 S 2
αC O
2
4
2-
( H)
1 1 1 2 1 1H [H ] 2H[H ]2 =1+Ka [H ] K K [H ] a1 a2 2
分类:
•气化法(挥发法)——利用物质的挥发性不同用加热或其 它办法使试样中被测组分气化逸出,然后根据气体逸出前后 的质量差来计算被测组分的含量。 •电解法——利用电解的原理,用电子作沉淀 剂,被测金属 离子在电极上析出。 •沉淀法——利用沉淀反应使被测组分生成溶解度很小的沉 淀,将其过滤、洗涤后,烘干或灼烧成为组分一定的物质, 然后称量,再计算其含量。 优点:Er: 0.1~0.2%,准确,不需标准溶液。 缺点:慢,繁琐,不适合微量成分
2.对沉淀形式的要求:
(1)沉淀的 S 小,溶解损失应<0.1mg。 (该沉淀的定量沉淀) (2)沉淀的纯度高。(不该沉淀的不沉淀,杂质少) (3)便于过滤和洗涤。(晶形好)
3.对称量形式的要求:
(1)组成恒定(定量的基础) (2)稳定(称量准确) (3)摩尔质量大(称量误差小, 对少量组分测定有利) •选择适宜的沉淀剂:对待测组分选择性高、生成的沉淀溶解 度小、易转化为适宜的称量形式、过量的沉淀剂易除去 •选择适宜的沉淀条件
M(OH) ML ┊ ┊
H+
由条件溶度积得到的实际溶解度大于理论计算值
二、影响沉淀溶解度的因素
(一)同离子效应 (二)盐效应
(三)酸效应 (四)络合效应 (五)其它因素 温度、溶剂、沉淀颗粒大小、沉淀结构、形成胶体
(一)同离子效应 当沉淀反应达到平衡后,如果向溶液中加入含有某 一构晶离子的试剂或溶液,则沉淀的溶解度减小的 现象称为同离子效应。 构晶离子:组成沉淀晶体的离子。 加入过量沉淀剂,使沉淀的溶解度降低,溶解损失减小。
pH 2.0 S ' 6.1104 mol / L pH 4.0 S ' 8.25 105 mol / L
例 计算PbSO4在0.10mol/LHNO3溶液中溶解度为 纯水中的多少倍? 解:①在0.1mol/LHNO3溶液中,[H+]= 0.10mol/L,
α
2-=1 SO4
10 8
同离子效应 络合作用
Sx106 mol/L
6 4 2 0 5 4 3
M A
Ksp为溶度积常数(溶度积),与温度和溶液的离子强度有关
S [ M ] [ A ] K sp
K ap γ M γ A
上式即为溶解度与Ksp及Kap间的关系式
一般沉淀类型 MmAn
KSP [M ] [A ] (mS)( nS) m n S
O
Al(
N
O N
)3
N
)3
Al2O3
相关概念
1. 沉淀重量法:利用沉淀反应将待测组分以难溶化合 物形式沉淀下来,经过滤、洗涤、烘干、灼烧后, 转化成具有确定组成的称量形式,称量并计算被测 组分含量的分析方法。 2. 沉淀形式:经反应生成的、具有确定 化学组成的 沉淀。 3. 称量形式: 沉淀经烘干或灼烧后,具有确定化学 组成、供最后称量的物质。
例 计算CaC2O4在pH=5的溶液中的溶解度。 ①不考虑酸效应 ②考虑酸效应
已知K SP(CaC2O4 ) 2 109,K a1 5.9 102,K a 2 6.4 105
解①
9 5 K 2.0 10 4.5 10 mol/L sp S1
② CaC2O4
②计算在0.10mol/L NH3溶液中的溶解度
α Ag+ =1+β1 [NH3]+ β2 [NH3]2=1.7×105
S AgBr
K spα Ag 5.0 10-13 1.7 105 2.9 10-4 mol/L
SAgI
K spα Ag 9.3 10-17 1.7 105 4.0 10-6 mol/L
一些极弱酸难溶盐即使在纯水中也会发生水 解,从而使溶解度增大。
(四)络合效应
由于形成沉淀的构晶离子参与了络合反应而使 沉淀溶解度增大的现象。
MA
M+
L
+
As [ A] [ M '] [ M ] M ( L ) M ( L ) 1 1[ L] 2 [ L]2
ML……MLn
沉淀重量法的分析过程和要求 1 分析过程
过滤
8000C
Ba2+ + SO42-
BaSO4↓
洗涤 灼烧 过滤 洗涤 过滤
BaSO4
烘干 CaO 灼烧
Ca2+ + C2O42-
CaC2O4•2H2O↓
烘干
试样溶液+沉淀剂
待测离子 沉淀剂
沉淀形式↓
沉淀形式
称量形式 洗涤 灼烧 处理过程 称量形式
注:称量形式与沉淀形式可以相同,也可以不同
解: ①不考虑S2-的水解 S1
K sp 6.0 10
