第十一章 分子扩散
分子扩散基本定律课件

探索分子扩散与其他物理过程的相互作用
除了热力学过程外,分子扩散还可能与其他物理过程相互作用。例如,流场、电场、磁 场等都可能对分子扩散产生影响。因此,我们需要进一步探索这些相互作用,并研究如
何利用这些相互作用来调控分子扩散行为。
THANK YOU
在化学反应中的应用
化学反应速率
分子扩散影响化学反应的 速率,因为反应物需要扩 散到彼此接触的区域才能 发生反应。
反应选择性
在某些反应中,分子扩散 可以影响反应的选择性, 导致主要产物和副产物的 生成比例发生变化。
反应机理
分子扩散可以影响化学反 应的机理,例如通过影响 中间体的扩散行为来改变 反应路径。
由于分子热运动而引起的 物质分子的迁移现象。
扩散通量
单位时间内通过单位面积 的扩散物质的质量或物质 的量。
分子的宏观表 现,是物质分子无规则运动的必然结 果。
扩散现象是物质分子之间相互作用的 结果,是物质分子的浓度梯度所引起 的。
扩散现象是物质分子自发的、不消耗 能量的过程,是物质分子自然流动的 结果。
温度控制器
用于控制实验温度,保持恒温 条件。
数据采集和处理系统
用于记录和计算实验数据。
实验结果分析
01
02
03
04
数据处理
对实验数据进行整理、分析和 处理,提取出扩散系数等关键
参数。
结果分析
比较不同实验条件下的扩散系 数,分析影响扩散的因素,如 温度、物质性质、浓度等。
误差分析
对实验结果进行误差分析,评 估实验方法的可靠性和精度。
详细描述
Fick第一定律指出,在稳定状态下,扩散通量与浓度梯度成正比,扩散通量等 于扩散系数乘以浓度梯度。这个定律适用于描述气体、液体和固体的分子扩散 过程。
高考物理一轮复习课件:第十一章 第1讲 分子动理论 内能

(2011·上海高考)在“用单分子油膜估测分子大小” 实验中, (1)某同学操作步骤如下: ①取一定量的无水酒精和油酸,制成一定浓度的油酸酒精 溶液; ②在量筒中滴入一滴该溶液,测出它的体积; ③在蒸发皿内盛一定量的水,再滴入一滴油酸酒精溶液, 待其散开稳定; ④在蒸发皿上覆盖透明玻璃,描出油膜形状,用透明方格 纸测量油膜的面积. 改正其中的错误:___________ (2)若油酸酒精溶液体积浓度为0.10%,一滴溶液的体积为 4.8×10-3 mL,其形成的油膜面积为40 cm2,则估测出油酸 分子的直径为________m.
4.分子的势能 (1)意义:由于分子间存在着引力和斥力,所以分子具有由 它们的相对位置 决定的能. (2)分子势能的决定因素. 微观上——决定于 分子间距离 和分子排列情况; 宏观上——决定于 体积 和状态. 5.物体的内能 (1)等于物体中所有分子的热运动 动能 与分子势能 的总和 ,是状态量. (2)对于给定的物体,其内能大小由物体的 温度和 体积 决 定. (3)物体的内能与物体的位置高低、运动速度大小 无关 .
A
(2)一个汞原子的体积为 - 200.5×10 3 Vmol M -29 3 V0= = = m3 . 3 23 m =2×10 NA ρNA 13.6×10 ×6.0×10 (3)1 cm3 的汞中含汞原子个数 -6 3 23 ρVNA 13.6×10 ×1×10 ×6.0×10 n= = =4×1022 -3 M 200.5×10 M - 【答案】 (1)N (2)2×10 29 m3 (3)4×1022 A
力和分子间距离共同决定的,宏观上取决于气体的体积.
因此选项A正确. 【答案】 A
(2012·大纲全国高考)下列关于布朗运动的说法,正 确的是( ) A.布朗运动是液体分子的无规则运动 B.液体温度越高,悬浮粒子越小,布朗运动越剧烈 C.布朗运动是由于液体各部分的温度不同而引起的 D.布朗运动是由液体分子从各个方向对悬浮粒子撞击作 用的不平衡引起的 【解析】 布朗运动的研究对象是固体小颗粒,而不是液 体分子,故A选项错误;布朗运动的影响因素是温度和颗粒 大小,温度越高、颗粒越小,布朗运动越明显,故B选项正 确;布朗运动是由于固体小颗粒受液体分子的碰撞作用不平 衡而引起的,而不是由液体各部分的温度不同而引起的,故 C选项错误,D选项正确. 【答案】 BD
第十一章_化学动力学基础(二)

第十一章化学动力学基础(二)通过本章学习理解碰撞、过渡态和单分子反应理论,了解一些特殊反应的动力学规律。
(一)基本要求和基本内容:基本要求1.了解化学反应动力学的碰撞、过渡态和单分子反应理论的基本内容,弄清几个能量的不同物理意义及相互关系。
2.了解溶液中反应的特点和溶剂对反应的影响。
3.了解快速反应所常用的测定方法及弛豫时间4.了解光化学反应和催化反应的特点。
重点和难点:过渡态理论中E c、E b、E0、ϑmrH#∆、ϑmrS#∆与Ea之间的关系:基本内容一、碰撞理论1.双分子的互碰频率2.硬球碰撞模型3.微观反应和宏观反应之间的关系4.反应阈能与实际活化能的关系5.概率因子二、过渡态理论1.势能面2.由过渡态理论计算反应速率3.E c、E b、E0、θmrH∆、θmrS∆与Ea和指前因子A之间的关系三、单分子反应理论四、在溶液中进行的反应1.溶剂对反应速率的影响2.原盐效应3.扩散控制反应五、快速反应的测试1.弛豫法2.闪光光解六、光化学反应1.光化学基本定律2.量子产率3.分子的能态4.光化反应动力学5.光化平衡和温度对光化学反应的影响6.感光反应、化学发光七、催化反应动力学1.催化剂与催化作用2.均相酸碱催化3.络合催化(配位催化)4.酶催化反应(二) 基本理论及公式1. 碰撞理论 ⑴ 要点① 反应物分子必须经过碰撞过程才有可能变成产物 ② 只有能量较大的活化分子的碰撞才能发生化学反映⑵ 计算公式① 不同种物质分子间的碰撞次数 [][]B A RTLdB dA Z ABπμπ222⎪⎭⎫ ⎝⎛+=② 同种物质分子间的碰撞次数 []2222A RTLd Z AA AA πμπ=③ 有效碰撞分数)e x p (RTE q C -= E C 为临界能,是基元反应所必需的能量。
④ 不同种分子间碰撞反应的速率常数⎪⎭⎫⎝⎛-=RT E M RTLd k C AB exp 82ππ ⑤ 同种分子间碰撞反应的速率常数⎪⎭⎫⎝⎛-=RT E M RTLd k C AA exp 22ππ ⑶ 解决的问题① 揭示了反应究竟是如何进行的一个简明﹑清晰的物理现象 ② 解释了简单反应速率公式及阿累尼乌斯公式成立的依据③ 解决了反应速率常数的求算问题 ④ 说明了Ea 与T 间的关系RT E E C a 21+=2. 过渡状态理论 ⑴ 要点反应物先形成不稳定的活化络合物,活化络合物与反应物之间迅速达成化学平衡,另一方面活化络合物转化为产物[]C B A C B A C B A +-→⋅⋅⋅⋅⋅⋅⇔-+≠⑵ 计算公式① 用统计热力学方法计算速率常数⎪⎭⎫ ⎝⎛-⋅⋅=∏≠RT E f f hT k k BBB 0'exp② 用热力学方法计算速率常数 (ⅰ) ()()⎪⎪⎭⎫ ⎝⎛∆-⋅⋅=≠-ΘRT G Ch T k k l nB exp 1 或,≠⋅=C B K h Tk k 或,()⎪⎪⎭⎫⎝⎛∆-⋅⎪⎪⎭⎫⎝⎛∆-⋅⋅=Θ≠-ΘRT H R S ChT k k m r mr nB exp exp 1 (ⅱ) ⎪⎪⎭⎫⎝⎛∆-⋅⎪⎭⎫⎝⎛⋅=≠-RTG RT P h T k k PnB exp 1 或 ⎪⎪⎭⎫⎝⎛∆-⋅⎪⎪⎭⎫⎝⎛∆-⋅⎪⎭⎫⎝⎛⋅=Θ≠-RT H RS RT P h T k k P r Pr nB exp exp 1 ③ 几个能量及其关系 (ⅰ) RT E EC a 21+=Ea 活化能,Ec 分子发生有效反应所必须超过的临界能 (ⅱ)mRT E E a +=0E 0 活化络合物的零点能与反应物零点能之差式中m 包括了普适常数项中及配分函数项中所有与T 有关的因子,对一定的反应体系,m 有定值。
[经济学]第11章 对流传质
![[经济学]第11章 对流传质](https://img.taocdn.com/s3/m/c880023e227916888486d784.png)
D y
c A c As 99% c A 0 c As
δD 为流动方向距离 x 的函数。
当流体流过圆管进行传质时,管内浓度边界层的形成与发展过 程亦与管内温度边界层的形成与发展过程类似。 流体最初以均匀浓度和速度 cA0 、u0 进入管内,由于流体中 组 分A 的浓度与管壁浓度不同而发生传质,浓度边界层的厚度由管前 缘处的零值逐渐增厚,经过一个 x 距离后,在管中心处汇合,此后 浓度边界层的厚度即等于管的半径并维持不变,由进口前缘至汇合 点之间的 x 方向的距离称为传质进口段长度。
A
整理得
dy
y 0
y 0
kc Ac As c Ab
DAB dc A kc c Ab c As dy
.......... 11 3
用式(11-3)求解对流传质系数时,关键在于壁面浓度梯度的计算。 • 对于较简单的层流传质问题,求解步骤: (1)求解运动方程和连续性方程,得出速度分布; (2)求解传质微分方程,得出浓度分布; (3)由浓度分布,得出浓度梯度; (4)由壁面处的浓度梯度,求得对流传质系数。
DAB k ....... 11 5 RT z
0 G
②采用物质的量浓度表示
0 cA1 cA2 .......11 6 N A kC
第十一章对流传质源自运动流体与固体表面之间,或不互溶的两运动流体之间发生的 质量传递称为对流传质。对流传质可在单一相中发生,也可以在两 相间发生。 对流传质速率不仅与流体自身的传递性质(如扩散系数)有关, 而且还与流动状态(层流或湍流)和流场的几何特性(平板或圆管)有 关。 流体层流流过界面时的传质称为层流传质,流体湍流流过界面 时的传质称为湍流传质。层流传质全靠分子扩散,湍流传质则主要 靠涡流扩散。 对流传质过程的机理和影响因素与对流传热过程的机理和影响 因素完全相同。故对流传质的许多问题均可采用与对流传热过程类 比的方法处理。
传热-第11章-传质

c N = D x
主讲:魏高升 主讲:
Dept. of Thermal Power Engineering - NCEPU
3. 两种典型的质扩散过程 等摩尔逆向扩散(双向扩散) (1)等摩尔逆向扩散(双向扩散) A 、 B 两种物质以相同的物质 的量通量密度相对扩散( 的量通量密度相对扩散(如气 体分的蒸馏过程, 体分的蒸馏过程,高、低沸点 组分潜热相近时,...) 组分潜热相近时,...) 假设系统总压为常数, 假设系统总压为常数,
DAB dpA , 积分可得 由式 N A = pA1 RT dx cA1 = RT DAB ( pA1 pA2 ) DAB = NA = ( cA1 cA2 ) RT x x
Dept. of Thermal Power Engineering - NCEPU
主讲:魏高升 主讲:
(2)单向扩散 假设: 假设: (1)扩散过程是稳态的; 扩散过程是稳态的; 系统是等温的; (2)系统是等温的; (3)水面上方气体空间的压 为常数; 力p0为常数; (4)混合气体可近似为理想 气体。 气体。 pA , pw的变化如图所示。 的变化如图所示。 根据上述假设, 根据上述假设,
Dept. of Thermal Power Engineering - NCEPU
N A = hm ( cA,w cA,f )
主讲:魏高升 主讲:
以空气平行吹过萘表面的对流传质过程为例, 以空气平行吹过萘表面的对流传质过程为例,
Dept. of Thermal Power Engineering - NCEPU
m n m
n
n
Nu Pr = Sh Sc
n
n
hl D ν D = λ hml a ν
结构化学基础

读书笔记
01 思维导图
03 精彩摘录 05 目录分析
目录
02 内容摘要 04 阅读感受 06 作者简介
思维导图
本书关键字分析思维导图
应用
化合物
结构
化学
基本概念
特征
包括
化学
介绍
结构 一章
材料
基础
配位
性质
高分子化合物
有机化合物
原子
金属
内容摘要
内容摘要
《结构化学基础》是一本全面介绍结构化学的教材,涵盖了结构化学的基本概念、原理和应用。 以下是本书的内容摘要: 这一章主要介绍了原子结构和元素周期表的关系。介绍了原子核的结构和电子的运动状态,然后 介绍了原子能量的量子化和原子光谱的规律性。详细介绍了元素周期表和元素性质的周期性。 这一章主要介绍了分子结构和化学键的基本概念。介绍了分子轨道理论的基本原理和应用,然后 介绍了共价键、离子键和金属键等不同类型的化学键。介绍了分子间相互作用和氢键等概念。 这一章主要介绍了晶体结构和物理性质的关系。介绍了晶体结构的特征和分类,然后介绍了晶体 结构分析和晶体的性质。介绍了晶体的缺陷和非晶体的结构特征。 这一章主要介绍了配位化合物和金属有机化合物的结构和性质。介绍了配位化合物的结构和性质, 包括配位体、配位数和配位反应等。
精彩摘录
《结构化学基础》这本书为我们提供了许多有用的概念和理论,这些概念和 理论不仅有助于我们更好地理解物质的微观结构和性质,还可以帮助我们更好地 理解和应用化学学科中的各种概念和原理。这些精彩摘录只是其中的一部分,但 它们可以帮助我们更好地理解这本书的内容和价值。
阅读感受
阅读感受
在完成《结构化学基础》的阅读之后,我深深地感受到了这本书的深度和价 值。作为一本专门探讨结构化学的著作,它不仅提供了对这一领域的基本理解, 同时也为我们揭示了化学反应的微观机制和物质的基本结构。
第十一章 化学反应动力学 6

多相反应大多数在相的界面进行。 但也有少数多相反应主要发生在不同的相中,如 以硫酸为催化剂,用浓硝酸水溶液对苯进行消化反 应,在两个液相中都能进行反应,酸相中的速率为有 机相的几倍。 多相反应大多数在相的界面进行,反应物向界面扩散是必 不可少的步骤,即使反应发生在不同的相中,反应物也必 须向相的界面扩散,以便进入另一相中发生反应。向相的 界面扩散是多相反应的一个重要特征。 相的界面大小和性质是影响多相反应的一个重要因素。 界面越大,或分散度越大,则越有利于多相反应。
爱因斯坦-斯托克斯方程
L为阿伏加德罗常数,η为粘度,r为球形粒子半径。
若两种半径为rA及rB,扩散系数为DA及DB的球形分子发生 扩散控制的溶液反应。 可以根据扩散定律导出该二级反应的速率常数为
k = 4 πL( DA + DB )rAB f rAB = rA + rB
f为静电因子,量纲为1. 当反应物电荷相反,互相吸引,则反应加速,f > 1 当反应物电荷相同,互相排斥,则反应减慢,f < 1 若无静电影响,则f = 1
若反应分子A和B可用相同半径的球表示,且无静电作用
RT D= 6 Lπηr
k = 4 πL( DA + DB )rAB f
⎛ RT RT ⎞ k = 4 πL⎜ ⎟ ⎜ 6 Lπηr + 6 Lπηr ⎟2r ⎠ ⎝
RT k = 4 πL × × 2r 3Lπηr 该二级反应的速率常数为 k = 8RT 3η
cb为溶液主体浓度,可认为即溶液浓度,故可改写为c,若溶 液体积为V,则c = n(HCl)/V 则
dc DAs − = c = kc dt δV
这就是此溶解过程的速率方程。若搅拌加快,液膜δ变薄,则 溶解速率增大,在搅拌速率恒定,固体表面变化不大的条件 下,此溶解速率符合一级反应的规律。 例11.11.2 某气-固相反应
分析化学(书后习题参考答案)_第十一章_气相色谱分析法

Cu为传质阻力项,包括气体传质阻力和液体传质阻力。该项与填充物的粒度、固定 液的液膜厚度以及载气流速等因素有关。
范·弟姆特方程式指出了影响柱效能的因素,为色谱分离操作条件的选择提供了理 论指导。由于影响柱效能的因素彼此以相反的效果存在着,如流速加大,分子扩散项的 影响减小,传质阻力项的影响增大;温度升高,有利于传质,但又加剧了分子扩散的影 响等等。因此必须全面考虑这些相互矛盾的影响因素,选择适当的色谱分离操作条件, 才能提高柱效能。
8.简单说明两种评价固定液的办法。你认为哪一种评价方法比较合理?试讨论之。 答:气相色谱主要是依据样品在固定相中溶解或吸附能力的不同使之分离的。不同 的样品具有不同的极性,为了使样品很好的分离,一定要根据样品的极性选择具有相同 或相似极性的固定液,固定液的极性通常用以下两种方法表示: (1)相对极性:规定β,β’-氧二丙腈的相对极性为100,角鲨烷的相对极性为零, 以它们作为标准,确定其它各种固定液的相对极性(在0-100之间)。把0-100分成五级, 每20为一级,用“+”号表示,数字越大,极性越强。如:β,β′-氧二丙腈为“+5”, 是强极性固定液;邻苯二甲酸二壬酯为“+2”,是弱极性固定液;阿皮松L为“-”,是 非极性固定液等。 (2)麦氏常数:固定液极性的强弱,代表了物质分子间相互作用力的大小,而物质 分子间的作用力是相当复杂的。已知极性分子间存在着静电力(偶极定向力);极性分子 和非极性分子间存在着诱导力;非极性分子间存在着色散力;此外能形成氢键的分子间 还存在着氢键力。因而仅用相对极性这个单一的数据来评价固定液是不够的。物质分子 间相互作用力可用xˊ、yˊ、zˊ、uˊ、sˊ这五个常数来表示,这些常数称之为麦氏常 数。通常用这五个麦氏常数的总和来表示一种固定液的极性,麦氏常数愈大,表示分子 间的作用力愈大,固定液极性愈强。例如角鲨烷五个常数的总和为零,表示角鲨烷是标 准非极性固定液;邻苯二甲酸二壬酯为801,是弱极性固定液;β,β′—氧二丙腈为4 427, 是强极性固定液。 用五个麦氏常数表示固定液极性的强弱,当然比用单一的相对极性数值表示更为全 面,更为合理。 9.怎样选择固定液? 答:对于固定液的选择,要根据其相对极性或麦氏常数值,根据试样的性质,按照 “相似相溶”的原则来选择,通常固定液的选择大致可分为以下五种情况。 (1)分离非极性组分,一般选用非极性固定液。试样中各组分按沸点大小次序流出色 谱柱,沸点较低的先出峰,沸点较高的后出峰。
第11章扩散

三维方向:
x y z c是溶质单位容/体积浓度,g或mol或质点数/cm3;J为扩散通量,即单位时间单位面积 上溶质扩散的量,g或质点数/cm2· s;D为扩散系数cm2/s ;
J D C D (i
c
j
c
k
c
)
负号表示粒子从浓度高处向浓度低处扩散,即逆浓度梯度的方 向扩散。 稳定扩散:质点浓度分布不随时间变化的扩散(c/t=0); 不稳定扩散:质点浓度分布随时间变化(c/t≠0)。
第十一章
扩
散
扩 散:扩散现象是由于物质中存在浓度梯度、化学位梯度、
温度梯度和其它梯度所引起的物质输运过程。
由于热起伏的存在,晶体中的某些原子或离子由于剧烈的热 振动而脱离格点进入晶格中的间隙位置或晶体表面,同时在晶 体内部留下空位;而且,这些处于间隙位置上的原子或原格点 上留下来的空位可以从热涨落的过程中重新获取能量,从而在 晶体结构中不断地改变位置而出现由一处向另一处的无规则迁 移运动,这就是晶格中原子或离子的扩散。
(11-6)
4
若t时间内,体积元中质点浓度平均增量为c,则根据物质守 恒定律,cdxdydz应等于式(11-6),因此得:
c
J y J X J z x t y z
c
或
c t
J
(D C )
一、扩散的一般推动力(温度?浓度?)
根据广泛适用的热力学理论,可以认为扩散过程与其他物理化学 过程一样,其发生的根本驱动力应该是化学位梯度。一切影响扩散的 外场(电场、磁场、应力场等)都可统一于化学位梯度之中,且仅当 化学位梯度为零,系统扩散方可达到平衡。下面以化学位梯度概念建 立扩散系数的热力学关系(能斯特-爱因斯坦公式) 。
初中分子扩散教案

初中分子扩散教案一、教学目标1. 让学生了解分子扩散的基本概念,理解分子扩散的原理和特点。
2. 培养学生观察、思考和解决问题的能力,提高学生的实验操作技能。
3. 引导学生运用分子扩散知识解释日常生活中的现象,提高学生的科学素养。
二、教学内容1. 分子扩散的基本概念2. 分子扩散的原理和特点3. 分子扩散在日常生活中的应用三、教学重点与难点1. 分子扩散的基本概念2. 分子扩散的原理和特点3. 分子扩散在日常生活中的应用四、教学方法1. 采用问题驱动的教学方法,引导学生主动探究分子扩散的原理和特点。
2. 利用实验和日常生活实例,让学生直观地感受分子扩散现象。
3. 采用小组讨论和汇报的形式,培养学生的团队合作意识和口头表达能力。
五、教学过程1. 导入:通过提问方式引导学生回顾之前学过的知识,为新课的学习做好铺垫。
2. 基本概念:介绍分子扩散的定义,让学生理解分子扩散是物质自发传播的过程。
3. 原理和特点:讲解分子扩散的原理,让学生了解分子扩散是由于分子间的无规则运动导致的。
通过实验演示,让学生观察和记录分子扩散的现象。
4. 日常生活实例:让学生举例说明分子扩散在日常生活中的应用,如气味传播、染料扩散等。
5. 小组讨论:让学生分组讨论分子扩散的原理和特点,以及如何运用分子扩散知识解释日常生活中的现象。
6. 实验操作:指导学生进行实验,观察和记录分子扩散的现象。
要求学生能够正确操作实验设备,并能够分析实验结果。
7. 总结与反馈:对学生的学习情况进行总结,对学生的疑问进行解答。
布置课后作业,巩固所学知识。
六、教学评价1. 学生的课堂参与程度,包括发言、提问、讨论等。
2. 学生的实验操作技能,包括实验设备的正确使用、实验结果的观察和记录等。
3. 学生对分子扩散知识的掌握程度,包括基本概念、原理和特点的理解,以及日常生活实例的应用等。
通过本教案的学习,学生应该能够掌握分子扩散的基本概念,理解分子扩散的原理和特点,并能够运用分子扩散知识解释日常生活中的现象。
第十一章化学动力学基础(二) 本章内容:介绍碰撞理论,过渡状态理论

第十一章化学动力学基础(二)本章内容:介绍碰撞理论,过渡状态理论和单分子反应理论。
了解分子反应动力学的常用实验方法,快速反应所常用的测试方法,说明溶液中反应的特点和溶剂对反应的影响;了解光化学反应的特点及量子产率的计算;介绍催化反应的特点和常见的催化反应的类型。
第一节碰撞理论(simple collision theory)一、碰撞理论基本论点分子碰撞理论是在接受了阿仑尼乌斯活化态、活化能概念的基础上,利用分子运动论于1918 年由路易斯建立起来的。
其基本论点是:1.反应物分子要发生反应必须碰撞,反应物分子间的接触碰撞是发生反应的前提;2.不是任何反应物分子间的碰撞均能发生反应,只有那些能量较高的活化分子、并满足一定的空间配布几何条件的碰撞反应才能发生;3.活化分子的能量较普通能量高,它们碰撞时,松动并部分破坏了反应物分子中的旧键,并可能形成新键,从而发生反应,这样的碰撞称为有效碰撞或非弹性碰撞,活化分子愈多,发生化学反应的可能性就愈大;4.若从Z A,B表示单位时间、单位体积内A,B分子碰撞总数,以q代表有效碰撞在总碰撞数Z A,B中所占的百分数,则反应速率可表示为二、双分子的互碰频率设A、B两种分子都是完全弹性的、无压缩性的刚球,二者半径各为1/2d A, 1/2d B, 单位体积中A的分子数为nN A/V, A分子运动的平均速率为〈U A〉。
假定B分子是静止的,那么一个A 分子与静止B 分子的碰撞次数为,A、B 分子的碰撞直径为d AB = 1/2(d A +d B),碰撞截面为πd2AB,,在时间t内,A分子走过的路程为〈U A〉t,碰撞截面所掠过的体积为〈U A〉tπd2AB, 凡是质心落在这个体积内的静态B分子都可能与A碰撞。
所以移动着的A分子在单位时间内与静止B分子相碰的次数(即碰撞频率)为,由于B分子也在运动,因此要用相对速率u r来代替平均速率(u),A与B的相对速率有几种情况考虑平均情况,则那么,一个运动着的A 分子与运动着的B 分子互相碰撞频率为那么,单位时间、单位体积内所有运动着的A、B 分子碰撞的总次数为对于浓度为[A]的同种分子,则三、硬球碰撞摸型设A.和B为两个没有结构的硬球分子,质量分别为m A和m B,折合质量为μ,运动速度分别为u A、u B,总能量E为'四、微观反应与宏观反应之间的关系反应截面是微观反应动力学基本参数,而速率常数k和实验活化能E a 等是宏观反应动力学参数。
无机材料科学基础第十一章扩散

分别表示流入体积元及从体积元流出的扩散通量, 则在Δt时间内,体积元中扩散物质的积累量为
m ( J x A J x x A ) t
m xA t J
x
J x
x x
C t
C t
x
J x
C x )
(D
图5 扩散流通过微小体积的情况
三、
菲克第二定律
当扩散处于非稳态,即各点的浓度随时 间而改变时,利用式(1)不容易求出浓度 分布C(X,t)。但通常的扩散过程大都是 非稳态扩散,为便于求出C(X,t),还要 从物质的平衡关系着手,建立第二个微分 方程式。
(1) 一维扩散
如图5所示,在扩散方向上取体积元
A x , J x和 J x x
1.恒定源扩散 以一维扩散为例,讨论两种边界条件,扩散动力 学方程的解,如图: 初始条件:t=0, x ≥0,c(x,o)= 0 边界条件:t>0,x=0, c(x,0)= C0 C 用菲克第二定律: C 引入新变量: x u D t 则有: t x C C u C x dc u . . 3 . (1) 2 t u t u 2t du 2t
x
m
dm Adt
C x
At
C x
D(
)
图3 扩散过程中溶质原子的分布
由扩散通量的定义,有
J D C x
(1)
上式即菲克第一定律 式中J称为扩散通量常用单位是g/(cm2.s)或 mol/(cm2.s) ; 负号表示扩散方向与浓度梯度方向相反。 D是同一时刻沿轴的浓度梯度;是比例系 数,称为扩散系数。
图4 溶质原子流动的方向与浓度降低的方向一致
讨论:
对于菲克第一定律,有以下三点值得注意:
第十一章 对流传质

B.C. (1) y 0 ,t ts
(2) y t ,t t0
(3)
y
t
,t y
0
(4)
y
0
, 2t y 2
0
cA a by cy2 dy3
y 0, cA cAs
y D , cA cA0
y D,
cA 0 y
y 0,
2cA y 2
0
二、平板壁面上层流传质的近似解
3
t ts t0 ts
一、平板壁面上层流传质的精确解
平均对流传质系数
kc0m
1 L
L 0
kc0x
dx
0.664
DAB L
ReL1/ 2Sc1/3
Shm
kc0m L DAB
0.664ReL1/ 2 Sc1/ 3
一、平板壁面上层流传质的精确解
(3)Sc≠1,uys≠0 质量传递与动、热传递不完全类似;其求解过程
第十一章 色谱分析法——气相色谱法分离理论
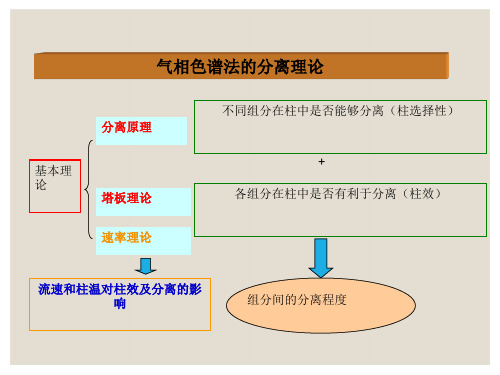
将色谱柱假想成一个精馏塔,塔内有很多塔板,样 品中的组分在每一块塔板上,在流动相和固定相中瞬间 达到一次分配平衡,然后随载气进入下一块塔板,多次 分配平衡后,可使不同的组分得以分离。
(二)理论塔板高度与理论塔板数 1、概念
在塔板理论中,把每一块塔板的高度,即组分在柱内 达成一次分配平衡所需要的柱长称为理论塔板高度,用H 表示。
1、涡流扩散项(A):为了减少涡流扩散,降低H,提高柱效,应尽可能使用直 径小、粒度均匀的固定相,并尽量填充均匀。
2、分子扩散项(B/u) (1)采用相对分子质量较大的载气(如N2),可使B项降低; (2)柱温高,B项增大。
3、传质阻力项(Cu):采用液膜薄的固定液。 要使柱效能提高,必须在分离操作条件上下下功夫。速率理论不仅指出了影
n有效
5.54( tR )2 W1/ 2
16( tR Wb
)2
L H有效 n有效
N和H的计算时需注意的问题:
n有效Leabharlann 5.54( tR )2 W1/ 2
16( tR Wb
)2
H 有效
L n有效
(1)Wb(或W1/2)要与tR单位一致。都用时间(s、min)或都用距离(cm、 mm)。
(2)W b(或W1/2)对应的系数不同。
假设整个色谱柱是直的,则当色谱柱长为L时,所得 理论塔板数n为:
n L H
(三)理论塔板数与色谱参数之间的关系
1、理论塔板数与理论塔板高度
n
5.54
tR W1/
2
2
16
tR Wb
2
HL n
tR越大,峰宽越小,则n越多,该 组分在色谱柱中分离的效果越好。
2、有效塔板数(n有效或neff) 组分在死时间内不参与柱内分配。需引入有效塔板数和有效塔板高度。
聚合物合成工艺学各章重点及要点

聚合物合成工艺学各章重点及要点部分内容不全,大家自己看书第一章绪论1.高分子化合物的生产过程及通常组合形式原料准备与精致,催化剂配置,聚合反应过程,分离过程,聚合物后处理过程,回收过程2.聚合反应釜的排热方式有哪些夹套冷却,夹套附加内冷管冷却,内冷管冷却,反应物料釜外循环冷却,回流冷凝器冷却,反应物料部分闪蒸,反应介质部分预冷。
第二章聚合物单体的原料路线1.生产单体的原料路线有哪些?(教材P24-25)石油化工路线,煤炭路线,其他原料路线(主要以农副产品或木材工业副产品为基本原料)2.石油化工路线可以得到哪些重要的单体和原料?并由乙烯单体可以得到哪些聚合物产品?(教材P24-25、P26、P31)得到单体和原料:乙烯、丙烯、丁烯、丁二烯、苯、甲苯、二甲苯。
得到聚合物:聚乙烯、乙丙橡胶、聚氯乙烯、聚乙酸乙烯酯、聚乙烯醇、维纶树脂、聚苯乙烯、ABS树脂、丁苯橡胶、聚氧化乙烯、涤纶树脂。
3. 合成聚合物及单体工艺路线第三章自由基聚合生产工艺§ 3-1自由基聚合工艺基础1.自由基聚合实施方法及选择本体聚合、乳液聚合、溶液聚合、悬浮聚合。
聚合方法的选择只要取决于根据产品用途所要求的产品形态和产品成本。
2.引发剂及选择方法,调节分子量方法种类:过氧化物类、偶氮化合物,氧化还原体系。
选择方法:(1)根据聚合操作方式和反应温度条件,选择适当分解速度的引发剂。
(2)根据引发剂分解速度随温度的不同而变化,故根据反应温度选择适引发剂。
(3)根据分解速率常数选择引发剂。
(4)根据分解活化能选择引发剂。
(5)根据引发剂的半衰期选择引发剂。
分子量调节方法:控制引发剂用量、控制反应温度、选择适当分子量调节剂。
§ 3-2本体聚合生产工艺1.本体聚合传热方法、排热措施排热措施:采用预聚、后聚分步聚合法;反应达到一定转化率就分离出聚合物;较低温度,较低引发剂浓度下反应;紫外线或辐射引发聚合;强化聚合设备的传热。
分子热运动教学反思

分子热运动教学反思分子热运动教学反思分子热运动教学反思篇1学情分析学生在第十一章“多彩的物质世界”中,已经对物质的组成及分子运动情况有了大致的了解,在化学课中已经知道了扩散现象,对生活中一些常见的扩散现象也有了较深的印象,但对于分子的运动快慢与什么因素有关的问题并不十分清楚。
方法运用在进行“分子运动剧烈程度与温度的关系”的探究中运用类比、推理、论证的方法。
具体做法1.在研究分子运动规律的过程中,通过一系列的推论、实验、现象,引导学生自己的出结论。
2.用到的研究方法:类比法、控制变量法、转换法发挥学生的主动性,根据自己的理解进行小结,培养总结概括能力。
引导学生讨论自行进行探究的过程和方法的小结。
不足之处在于,在提出分子热运动这一观点时应该是让学生多举例子,引导学生自己得出结论,这样学生记忆起来会更深刻,理解的也会更好。
分子热运动教学反思篇21、把学习目标不出示,目的在于学习目标一出示,就把一些问题的答案在没有学习时就告知了学生。
而是在学习小结时以填空的形式出现。
我认为应该是可取的。
但在另一些学科上就不以这样做。
我认为这样是可取的.2、知识学习上分两块,扩散现象和分子间相互作用。
自学完书的内容后就完成学案上的填空。
3、改变了实验探究的做法,而是先接受知识,后用实验来验证。
感觉不是太好.4、教学流程感觉还是完整的,一节课的内容也完成得还好。
存在的问题:1、分组合作学习不到位,与平时要求分小组学习养成习惯不到位有关。
2、缺少点评环节。
与教师平时不常使用这种教学方法有关。
3、教学流程稍显不自然。
与教师准备不充分有关。
4、一个验证实验没有准备好。
这是硬伤。
5、使用导学案和电子白板时,要把电子课件依据导学案做简单一些,在电子白板上展示。
分子热运动教学反思篇3本节课的教学内容是人教版《物理》九年级第十六章的第一节课,教材首先介绍了分子的大小,然后从观察实验,分析宏观扩散现象出发,通过推理去探索微观世界。
依次介绍了分子热运动和分子间的.相互作用力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、简介:
• 分子传质包括分子扩散、热扩散、压力扩 散和强迫扩散
• 分子扩散现象最常见,其它型式扩散存在 的同时必发生分子扩散
• 分子扩散是在静止的系统中由于存在浓度 梯度而发生的质量传递现象
二、分子扩散分类:
CA=f (x,y,z,τ) • (1)一维、二维和三维分子扩散 ;
μB——溶液的动力粘度,cp(厘泊)
Vb——溶质的摩尔体积,示于表(11-4)中
ΦB——溶剂的缔合系数。
溶剂 水 甲醇 乙醇 苯、醚、烷烃及不缔
合性溶剂
Φ 2.6 1.9 1.5
1.0
例题11-2
• 已知10℃水的μB=1.45cP;25℃水的 μB=0.8937cP,试计算醋酸在10℃及 25℃水中扩散系数。
2.液相扩散系数
• 液相扩散不仅与物系的种类、温度有关, 并且随溶质的浓度而变化。
• 只有稀溶液的扩散系数才可视为常数。
斯托克斯-爱因斯坦方程
爱因斯坦假设扩散粒子是半径为rA 的刚球质点,以恒定速度uA在一个粘度 为μB的连续介质中移动。按照斯托克斯 定律层流中一个以稳态速度运动的球,
其所受的力是:
金属中,原子曲曲折折地通过晶体移动;
a——原子间距;
ν——跳跃频率。
某 些 金 属 中 的 互 扩 散 系 数 示 于 图 (11-4) 、 (11-5)、(11-6)中。
• 谢尔比(Sherby)和西姆纳德(Simnad)提出
了一个用来估算纯金属中自扩散系数的关
系式
DAA
D0
exp
(k0
V
) TM T
密排六方晶格是一个正六面柱体,在晶胞的12个 角上各有一个原子,上底面和下底面的中心各 有一个原子,上下底面的中间有三个原子
每个晶胞所包含的原子数为6个。
二、多孔介质中的扩散
• 定义:气体或液体进入固态物质孔隙的 扩散称为多孔介质中的扩散。
• 多孔介质中的三种扩散机理: 斐克扩散、努森扩散、表面扩散
FA=6πrAμBuA
(11-8)
在稀溶液中可导得:
DAB=kTuA/FA
(11-9)
式中:uA/FA ——在单位力作用下,溶质A的分子运动速度
k——
DAB——溶质A在溶剂B
T——
将式(11-8)代入式(11-9)得
DAB=kT/(6πrAμB) 这即是斯托克斯-爱因斯坦方程式。
(11-10)
空穴理论
• 解:查表11-4,醋酸(CH3COOH)的分 子体积为 VA=2×(14.8)+4×(3.7)+12+7.4=63.8 水的ΦB=2.6,MB=18.02,Tk=283K; 298K。
1
DAB
7.4 108
(B MB )2T
BVb0.6
(11 11)
3.固相扩散系数
• 研究气体或液体进入固态物质孔隙的扩散 • 研究借粒子的运动在固体之间进行的扩散
2.压力扩散
• 压力扩散是混合物中存在压力梯度而引起的。
1.将双组分混合物装入两端封闭的圆管,并使 圆管绕垂直于其轴线的轴旋转,则轻组分向 靠近轴的管端(低压区)迁移;重组分向远离 轴的管端(高压区)迁移。
2.在深井中,两组分混合物中的轻组分向顶部 迁移,重组分向底部迁移。
3.混合气体在离心机中的分离操作就是依据压 力扩散原理。
液体结构的最古老的理论乃是空穴理 论。这个理论假定整个液体内存在许多杂 乱分布的空穴和空位,这些空穴或空位为 原子或离子的扩散提供了扩散的途径。液 体内的扩散速率远高于恰处在熔点的固体 内的扩散速率。
威尔克方程(稀溶液) 1
DAB
7.4 108
(B MB )2T
BVb0.6
(11 11)
MB——
y
nB, y
z
nB,z
B
rB
0
(11 29)
• nB
B
rB
0
(11 30)
混合物的连续性方程
•
(nA
nB
)
(
A
B
)
(rA
rB
)
0
(11 31)
n AuA BuB u A B
当无化学反应或A B的化学反应时:
rA rB
• u 0
(11 32)
摩尔单位的连续性方程
代入组分A的连续性方程
•
nA
A
rA
0
A(nA nB ) An Au Au
• (DAB
•A)
•
Au
A
rA
0
(11 37)
•
(cDAB
•
yA)
•
cAuM
cA
RA
0
(11 38)
1、假定ρ和DAB为常数,RA=0:
• (cDAB
•
yA)
• cAuM
cA
RA
0
(11 38)
• 2.努森扩散
孔隙直径与气体分子平均自由行程处于相同数量 级或更小。
努森有效扩散系数计算公式:
DK ,eff
2 3
ruA
uA
8kT
M
1
DK ,eff
97.0r
T MA
2
三、其它型式的扩散
• 分子扩散可以由浓度梯度、温度梯度和 压力梯度或其他外力的作用而产生。
• 1.热扩散 • 2.压力扩散 • 3.强迫扩散
式中
V——金属的正常原子价; TM——绝对熔点; k0——仅与晶体结构有关的系数。
体心立方晶格的形状是一个立方体。在体心立方 晶胞中,原子位于立方体的八个顶角和中心。 体心立方晶胞中的原子数为2。
面心立方晶格的形状是一个立方体。在面心立方 晶胞中,原子位于立方体的八个顶角和六个面 的中心。每个晶胞所包含的原子数为4个。
1
0.841Vc3
2.44
Tc pc
3
A
k
0.77Tc
A
k
1.15Tb
Vb——扩散质(溶质)的摩尔体积,摩尔体积指常压下 沸点时每克摩尔液态物质所占的体积
cm3/gmol。简单分子的摩尔体积示于表11-4中;
Tb—— Tc——
Vc——临界摩尔体积; pc ——临界压力。
3
0.001858T 2 (
1.气相扩散系数(双组分混合气体) 模型:
1.弹性刚球模型 2.麦克斯韦尔模型 3.萨瑟兰模型 4.勒奈特-琼斯模型
(1)弹性刚球模型
uA
8kT
M
1
2d 2 N
Z
1 4
NuA
uA 随机分子的均方根速度;
--分子平均自由行程;
k--玻尔兹曼常数(教材120页)
M--摩尔质量 d--分子直径
N--分子浓度 Z--频率
DAB,T
1 T
dT dy
DAB
d A
dy
K AB,T :热扩散比
K AB,T
DAB ,T
DABc2 M AM B
xA2
xA1
K AB,T
ln
T1 T2
K AB,T :热扩散比
K AB,T 是温度的函数 当K AB,T为常数时,温度与浓度分布 是对数关系
§11-2 传质微分方程
一、传质微分方程
1
1
1
)2
DAB
MA MB
p A2 B D
(1-3)
DAB——扩散系数,cm2/s; T——绝对温度,K; p——压力,atm;
MA,MB——组分A和组分B的分子量,kg/kmol; σAB——平均碰撞直径,埃(勒奈特-琼斯势参数); ΩD—— 基 于 勒 奈 特 - 琼 斯 势 函 数 的 分 子 碰 撞 积 分 [f(kT/εAB)],见表11-2 εAB——分子间作用的能量,erg (勒奈特-琼斯势参数)
1.物理模型
• 2.推导条件:
三维非稳态有化学反应组分A的分子 扩散传质微分方程。
• 3.方程推导:
推导依据:质量守恒定律+斐克定律 组分A净流出控制体质量+组分A在 控制体内质量变化率-经化学反应 生成的组分A的质量=0
组分A净流入控制体质量+经化学反 应生成的组分A的质量=组分A在控制 体内质量变化率
3.强迫扩散
• 强迫扩散:由除重力以外的其他外力作用引 起的扩散。 强迫扩散发生在外力对不同组分作用 不同的条件下。在电场作用下,电解液中的 离子扩散就是一例。
热扩散举例
热扩散引起的扩散通量为:
1 dT jA,T DAB,T T dy
稳态:nA=0
nA jA jA,T 0
jA,T jA
c A
uM
•
cA
DAB 2c A
Dc A
D
DAB 2c A
比较 Dt a2t
• 解:从表11-1中查得在温度为288K和压力为 1×105 N/m2时的Dco-N2=1.945×10-5m2/s。 DAB,2=DAB,1 ×(T2/T1)3/2(p1/p2) 当温度为303K和压力为2×105 N/m2时:
DAB,2=1.945×10-5(303/288)(3/2)(1/2) =1.05 ×10-5m2/s
对于组分A:
• NA
c A
RA
0
对于组分B
:
•
NB
cB
RB
0
(11 33) (11 34)
对于混合物
•
(
N
A
N
B
)
(cA
cB
)
(RA
RB
)
0
(11 35)
• cuM
c
(RA
