化学平衡常数的应用习题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡常数的应用
1、关于化学平衡常数K 的叙述正确的是
A 、K 越大,表示化学反应速率越大
B 、对任一可逆反应,温度升高,则K 值增大。
C 、对任一可逆反应,K 越大;表示反应物的转化率越大
D 、加入催化剂或增大反应物的浓度时,K 值就增大
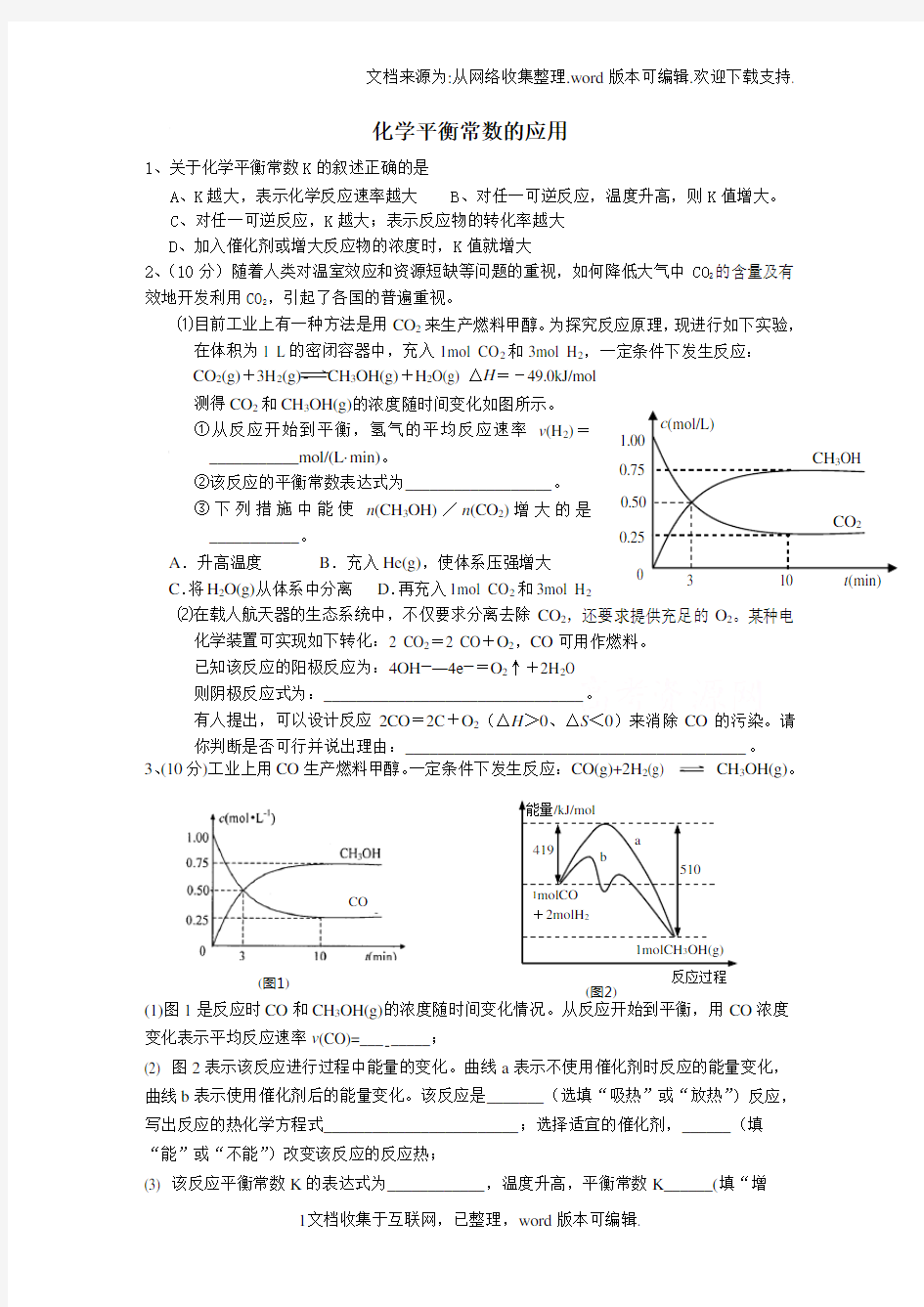
2、(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO 2的含量及有效地开发利用CO 2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO 2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L 的密闭容器中,充入1mol CO 2和3mol H 2,一定条件下发生反应: CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) △H =-49.0kJ/mol
测得CO 2和CH 3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v (H 2)=
___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n (CH 3OH)/n (CO 2)增大的是
___________。
A .升高温度
B .充入He(g),使体系压强增大
C .将H 2O(g)从体系中分离
D .再充入1mol CO 2和3mol H 2 ⑵在载人航天器的生态系统中,不仅要求分离去除CO 2,还要求提供充足的O 2。某种电化学装置可实现如下转化:2 CO 2=2 CO +O 2,CO 可用作燃料。
已知该反应的阳极反应为:4OH ――4e ―=O 2↑+2H 2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO =2C +O 2(△H >0、△S <0)来消除CO 的污染。请你判断是否可行并说出理由:__________________________________________。
3、(10分)工业上用CO 生产燃料甲醇。一定条件下发生反应: CO(g)+2H 2(g) CH 3OH(g)。
(1)图1是反应时CO 和CH 3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO 浓度 变化表示平均反应速率v (CO)=___ _____;
(2) 图2表示该反应进行过程中能量的变化。曲线a 表示不使用催化剂时反应的能量变化, 曲线b 表示使用催化剂后的能量变化。该反应是_______(选填“吸热”或“放热”)反应, 写出反应的热化学方程式________________________;选择适宜的催化剂,______(填 “能”或“不能”)改变该反应的反应热;
(3) 该反应平衡常数K 的表达式为____________,温度升高,平衡常数K______(填“增
c (mol/L) 0.75 1.00 0.50 0.25 0 3 10 t (min) CO 2 CH 3OH 能量/kJ/mol
反应过程
1molCO +2molH 2
1molCH 3OH(g)
419
510 a b (图1) (图2)
CO
大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 n(CH 3OH) n(CO) 增大的有_____ 。 a .升高温度; b .充入He 气
c .再充入1molCO 和2molH 2
d .使用催化剂
4、在一容积为2L 的密闭容器中,加入0.2mol 的N 2和0.6mol 的H 2,在一定条件下发生如下
反应:N 2(g)+3H 2(g) 2NH 3(g);△H <0反应中NH 3的物质的量浓度的变化情况如右图所示,请回答下列问题:
(1)根据右图,计算从反应开始到平衡时,平均反应速率
v(NH 3)为 。
(2)该反应到平衡时H 2的转化率 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH 3的物质的量浓度不可能为 。(填序号)。
a 0.20mol·L -1
b 0.12 mol·L -1
c 0.10 mol·L -1
d 0.08 mol·L -1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数 (填“增大”、“减少”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH 3的
浓度约为0.25 mol·L -1
),请在上图中画出第5分钟末到此平衡时NH 3浓度的变化曲线。
5.(10分)控制、治理氮氧化物对大气的污染是改善大气质量的重要方面。
(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH (烃)、NO 、NO 2、O 3、PAN (CH 3COOONO 2),某地早上至中午这些物质的相对浓度变化如右图所示,则下列叙述合理的是 。(填字母)
a .早上8时交通繁忙期,光化学烟雾的主要成分为RH 、NO
b .14时,光化学烟雾的主要成分为O 3、PAN
c .PAN 、O 3由RH 和NO 直接反应生成
d .PAN 直接由O 3转化生成
(2)火力发电厂的燃煤排烟中含大麓的氮氧化物(NO x ),可利用甲烷
和NO x 在一定条件下反应消除其污染,则CH 4与NO 2反应的化学方程式
为 。
(3)在一密闭容器中发生反应2NO 22NO+O 2,反应过程中NO 2的浓度随时间变化的情况如右下图所示。请回答:
① 依曲线A ,反应在前 3 min 内氧气的平均反应速率
为 。② 若曲线A 、B 分别表示的是该反应在某不同条件下的反应情况,则此条件是 (填“浓度”、“压强”、“温度”或“催化剂”)。
③ 曲线A 、B 分剐对应的反应平衡常数的大小关系是A K B K 。(填“>”、“<”或“=”)
