水分子簇中氢键作用
水分子间氢键

水分子间氢键水是生命的必备条件,也是地球上最常见的化学物质之一。
水分子由一个氧原子和两个氢原子组成,其中氧原子与两个氢原子之间形成了一个角度为104.5度的V形结构。
然而,水分子之间的吸引力远不止于此,它们之间还存在一种极其强力的相互作用——氢键。
氢键是一种分子间的非共价键合,通常存在于氢原子(H)向高电负性原子(如氧、氮或氟)的电子云靠近而形成的相互作用。
在水分子中,氧原子的电负性较高,而氢原子的电负性较低,因此氢键最常见于水分子之间,以及水分子与其他分子之间。
水分子之间的氢键是水的许多独特性质的重要原因之一。
首先,氢键能够影响水分子的凝聚能力。
每个水分子可以与其他最多四个水分子形成氢键,这种相互作用能够使水分子形成紧密的层和团簇,从而增加水的密度和凝聚力。
其次,氢键也决定了水的高沸点和高比热容。
水的沸点非常高,是因为水分子之间的氢键需要克服相当大的相互作用能才能越过水表面并转变为气体。
此外,水的比热容也很高,因为水分子之间的氢键需要吸收更多的热量才能打破分子之间的相互作用,并使水分子具有更高的动能。
除了影响水分子的物理特性外,氢键还可以影响水的生物学特性。
例如,氢键可以促进水和其他分子之间的作用,如蛋白质折叠、RNA-DNA复制和酶催化等过程。
此外,氢键还决定了水的角度、扭曲和柔性,从而影响了水在生物体内的各种生物化学反应。
尽管氢键对水分子和其他生命分子的相互作用起着至关重要的作用,但氢键并不是无限可坚不摧。
在高温或高压下,氢键可以被打破或分离,从而导致水的物理或生物化学性质发生变化。
总之,水分子之间的氢键是决定水物理和生物学性质的关键因素之一。
氢键的强度和灵活性使水成为一种独特而多功能的物质,也为生命的起源和演化提供了宝贵的物理和化学条件。
溶质分子与水分子的氢键

溶质分子与水分子的氢键溶质分子与水分子之间的氢键是溶解过程中一个重要的相互作用方式。
在水溶液中,溶质分子与水分子通过氢键相互吸引,从而实现了溶质的溶解。
本文将介绍溶质分子与水分子的氢键形成机理、氢键的特点以及其在溶解过程中的作用。
氢键是指两个电负性较强的原子之间由氢原子质子形成的相互作用力。
在水分子中,氧原子具有较强的电负性,而氢原子则带有正电荷。
当溶质分子中存在能够与水分子氧原子形成氢键的基团时,溶质分子与水分子之间就会发生氢键的相互作用。
氢键的形成需要满足两个条件:第一,需有一个带有较强电负性的原子,如氧、氮等;第二,需有一个带正电荷的氢原子。
当溶质分子中存在这种具备条件的基团时,氢键就会在溶液中形成。
常见的能够形成氢键的分子有酒精、酮和酚类化合物等。
氢键的特点主要体现在两个方面。
首先,氢键具有较强的结合能力和选择性。
由于氢键的形成依赖于原子之间的电荷分布差异,使得氢键相对其他相互作用力更加强烈。
其次,氢键的方向性使得溶质分子与水分子之间的相互作用具有一定的规律性。
氢键会促使溶质分子中的基团与水分子中的氧原子形成最佳的配位关系,从而增强溶质与水分子之间的吸引力。
在溶解过程中,溶质分子与水分子的氢键起到了重要的作用。
首先,溶质分子与水分子之间的氢键相互作用能够降低溶质分子的能量,促进其向水溶液中扩散。
其次,氢键的存在可以破坏溶质分子之间的分子间相互作用,从而使溶质分子从固态变为液态。
最后,氢键的形成还可以增加水分子周围的有序性,促进氢键网络的形成,使水分子形成液态结构。
综上所述,溶质分子与水分子之间的氢键是溶解过程中一个重要的相互作用方式。
这种相互作用能够通过降低溶质分子的能量促进其溶解,并且使溶质分子从固态转变为液态。
溶质分子与水分子之间的氢键相互作用有助于形成液态结构,从而实现了溶质的溶解。
水分子的结构和氢键作用

水分子的结构和氢键作用水,是地球上最常见的物质之一,也是生命的基础。
我们每天都与水密切接触,但是你是否了解水分子的结构以及其中的氢键作用呢?水分子由两个氢原子和一个氧原子组成,化学式为H2O。
氧原子位于水分子的中心,两个氢原子分别与氧原子形成共价键。
这种共价键使得水分子呈现出一个特殊的结构,氧原子位于中心,两个氢原子呈V字形排列。
这种分子结构使得水分子具有一些特殊的性质。
首先,水分子是极性分子。
由于氧原子的电负性较高,它对电子的吸引力大于氢原子,使得氧原子带有部分负电荷,而氢原子则带有部分正电荷。
因此,水分子呈现出一个正负极性,被称为极性分子。
这种极性使得水分子能够与其他极性分子或离子发生相互作用。
其次,水分子之间存在着一种特殊的相互作用,即氢键。
氢键是一种弱的化学键,它是由极性分子中的氢原子与其他原子的电负性较高的原子之间的相互作用形成的。
在水分子中,氧原子带有部分负电荷,而氢原子带有部分正电荷,因此,水分子之间可以通过氢键相互吸引。
氢键的形成使得水分子能够形成特殊的结构和性质。
首先,氢键使得水分子能够形成固态、液态和气态三种状态。
在低温下,水分子之间的氢键作用较强,使得水分子能够紧密排列,形成固态冰。
在常温下,水分子之间的氢键作用适中,使得水分子能够流动,形成液态水。
在高温下,水分子之间的氢键作用较弱,使得水分子能够蒸发,形成气态水蒸汽。
其次,氢键的存在也使得水分子具有高沸点和高比热容的性质。
由于氢键的强相互作用,需要较高的能量才能将水分子从液态转变为气态,因此,水的沸点相对较高。
同时,氢键的存在也使得水分子能够吸收和释放大量的热量,导致水的比热容较大。
这种高比热容使得水能够稳定地维持温度,起到调节环境温度的作用。
此外,氢键的存在还使得水分子能够与其他分子或离子形成溶液。
由于水分子的极性和氢键的作用,水分子能够与许多其他物质发生相互作用,使它们溶解在水中。
这种溶解作用使得水成为一种优秀的溶剂,能够在生物体内起到运输和反应的作用。
小分子水是什么?

小分子水是什么?水,是生命之源,所有的生物离不开水,人类也不例外。
水的构成方式其实很简单,就是氢氧原子的结合。
可是他们的结合之后的抱团行为,也确定了水的活性大小,小分子水是什么?相信你也非常想了解,下面健宜给大家介绍一下小分水究竟是什么?水分子是由2个氢原子和1个氧原子组成的,分子式是H2O,自然界中的液态或固态水是由大量的水分子靠氢键簇拥到一起而存在的,因此,称为分子簇或分子团。
但是处于分子簇中的水分子是动态结合的,稳定时间非常短,不时有水分子离开,也不时有水分子加入。
在电磁场、热或远红外等作用下,氢键更容易被打破,水分子会变得更加活跃,分子簇中的水分子个数会更少,水分子团会更小。
科学家们应用核磁共振技术观察到水中水分子的结构。
正常水是在140—150赫兹每个水分子团有13—15个水分子组成,称为大分子团水。
世界卫生组织规定,进入100赫兹以内每个水分子团有5—7水分子组成,称为小分子团水。
又称为五角水或六角水。
人们都知道雪片就是六角形的,海水,胎儿的羊水都是小分子团水。
水是以分子团的结构存在的,研究发现水分子团越大活性越小,这种水也越不好喝,不易吸收,而且存在胃肠和肾脏中,产生腹胀和浮肿的现象。
而水分子团越小活性越大,这种水也好喝,喝了软滑、口感好、微微甘甜、具有洁净、含氧量越高,它能去除有机物,去除治病毒素,去除异色异味,去除重金属,保留有机矿物质,活化等特性。
越喝越想喝,喝后不产生饱胀感,促进生命活力,进入体内能很快吸收,渗入细胞内,使水的营养生理功能接近人体细胞内的水,还有缓解代谢疾病和促进生长的作用,这就是小分子团。
氧化意味着腐败或者老化。
当被氧化时,氧化还原电势值(ORP)上升。
当我们变老时,由于所有细胞正在氧化,身体中的氧化还原电势值增加。
不利的数值会引起过度的腐败和过早的老化。
在人体里,氧化是由于失去一个电子的氧分子的自由基所导致。
因为这些自由基设法“偷取”所需要的电子以获得稳定,因此变得非常不稳定和非常容易发生“反应”。
水分子簇中氢键作用

水分子簇中氢键作用张建平 赵 林 王林双(天津大学化工学院天津 300072)摘要概述了近年来为揭示水分子簇存在形态的成因所做的理论和实验研究,指出除范德华力外,氢键和似共价键是水分子间的主要作用力。
总结了水分子簇中氢键的四种作用方式,包括协同效应、氢键的转动、氢键的振动以及氢键变换;分别讨论了这四种作用方式以及似共价键对水分子簇存在状态的影响,最后对该领域的研究前景作了展望。
关键词水分子簇氢键似共价键Hydrogen Bonds in Water ClustersZhang Jianping, Zhao Lin, Wang Linshuang(School of Chemical Engineering,Tianjin University, Tianjin 300072)Abstract Theoretical and experimental studies that reveal the formation of water clusters have been summarized. Besides van der Waals force, hydrogen bonds and quasi-covalent bonds between water molecules are major forces. Four kinds of kinetic motions of hydrogen bonds in water clusters are outlined,including cooperative effect, rotation, vibration and inter conversion, and the effects on the structure of waterclusters caused by quasi-covalent bonds and H-bond kinetic motions are explained in detail. Finally, the perspective in this research field is also discussed.Key words Water clusters, Hydrogen bond, Quasi-covalent bond水是大自然赋予我们的宝贵资源,也是人类赖以生存的必要条件,关于水分子簇结构与功能的研究已成为当今科研前沿的热点之一,其深层研究可望为揭示物理化学、生命科学等领域的本质问题提供有力工具[1~3]。
水分子中间连接的名称

水分子中间连接的名称全文共四篇示例,供读者参考第一篇示例:水分子是由一个氧原子和两个氢原子组成的化学物质。
在水分子中,氧原子与两个氢原子之间的连接被称为氢键。
氢键是一种比共价键弱得多的相互作用力,但是水分子中间的氢键却非常重要,它们决定了水的许多物理和化学性质。
氢键的形成是由于氧原子的电负性比氢原子大,因此氢原子的电子朝向氧原子。
这种极性使氢原子带正电荷,氧原子带负电荷,从而在氢原子和氧原子之间形成了氢键。
氢键的连接方式是氧原子中部的两个孤对电子与两个氢原子之间的质子形成了一个氢键。
这也是为什么水分子的结构呈现H-O-H这样的形式。
氢键的存在使得水分子具有了一些独特的性质。
氢键使得水分子能够形成比较稳定的结构。
由于氢键的存在,水分子在液态状态下能够形成密密麻麻的氢键网络,这使得水分子之间能够形成比较紧密的联系,因此水分子的密度相对较大。
除了使水分子形成紧密的结构,氢键还使得水分子具有了很高的表面张力。
表面张力是指液体表面由分子间相互作用力引起的流体表面的紧密程度。
由于水分子之间的氢键作用,水分子在表面形成了一个相对较薄的弹性膜,这使得水分子具有了非常强的表面张力,因此水滴能够在平滑表面上形成比较规则的形状。
氢键也使得水分子具有了很高的热容量。
热容量是指单位质量的物质升高单位温度所需要的热量。
由于水分子之间的氢键作用力比较强,因此加热水分子需要消耗相对较多的能量,使得水的热容量相对较大。
这也是为什么水是一种很好的热媒介的原因。
水分子中间连接的氢键是水分子物理和化学性质的基础。
氢键决定了水分子的结构和性质,使得水成为了一种非常特殊的化学物质。
在人类日常生活中,水起着非常重要的作用,无论是在饮用、洗涤、农业生产还是工业生产中,水都扮演着不可或缺的角色。
感谢氢键的存在,使得水具有了让人赏心悦目的独特性质。
第二篇示例:水分子中间连接的名称是氢键。
氢键是分子间作用力的一种,是水分子之间相互吸引的力量,使得水分子在液态和固态状态下形成特定的结构和性质。
对水笼团簇(H2O)6氢键的理论分析

硕士学位论文对水笼团簇(H2O)6氢键的理论分析 THEORETICAL ANALYSIS ON THE HYDROGEN BOND OF WATER CAGECLUSTER (H2O)6王阳2009年6月图书分类号:O561.4 学校代码:10213 U.D.C.: 539.19 密级:公开理学硕士学位论文对水笼团簇(H2O)6氢键的理论分析硕士研究生:王阳导师:赵永芳教授申请学位:理学硕士学科:凝聚态物理所在单位:物理系答辩日期:2009年6月授予学位单位:哈尔滨工业大学Classified Index:O561U.D.C.:539.19Dissertation for the Master Degree in ScienceTHEORETICAL ANALYSIS ON THE HYDROGEN BOND OF WATER CAGECLUSTER (H2O)6Candidate: Wang YangSupervisor:Prof. Zhao YongfangAcademic Degree Applied for:Master of ScienceSpeciality:Condensed Matter Physics Affiliation:Department of PhysicsDate of Defence:June, 2009Degree-Conferring-Institution:Harbin Institute of Technology哈尔滨工业大学理学硕士学位论文摘要水包合物(clathrate hydrates)的储氢作用已经引起人们越来越多的重视。
水包合物的主体结构由氢键连接的水分子笼构成,客体分子被包裹在笼子内部。
水笼团簇(H2O)6有着最小的三维笼状结构,对水笼中氢键的理论分析,可以对水笼储氢的原理,氢键的本质、氢键的作用机理等起到进一步认识。
本课题使用分子轨道从头算方法,应用HF、MP2、CCSD(T)等方法以及使用较大的基组,由浅入深的研究了水团簇(H2O)n,n=1-6,重点研究了水笼团簇(H2O)6中氢键的成键机制及其稳定性等。
水分子的氢键

水分子的氢键
水作为良好的溶剂为生命存在提供了基本条件,其独特的氢键结构也一直让科学家难以解释。
北京大学科学家在世界上首次拍到水分子的内部结构,并揭示了单个水分子和四分子水团簇的空间姿态。
这一成果发表在《自然-材料》杂志上。
水结构会发生变化。
氢键的断裂是水结构变化的必要前提。
这种变化
单个的H2O存在。
对水进行充分的良好的磁处理之后,许多氢键被切割开,使水中富含小分子团和更为活泼的单个游离水分子,经紫外
富含小分子团的离子水。
这是一种“松散”的或“分散”的水,具有更大的活性,更容易进入细胞膜,更好地参与生物化学作用。
这种水可简称小分子水。
这种水被航天员们饮用,因为航行时间较长,为了节约空间等因素,小分子水更容易进入细胞膜,更好地参与生物化学作用,而排放量小。
讨论:水结成冰,体积膨胀,能量是从哪来的呢?
日常:热胀冷缩.。
水融合的原理

水融合的原理水融合是指两种或多种不同性质的水分子融合为一体的过程。
要理解水融合的原理,首先需要了解水分子的结构和特性。
水分子(H2O)由一个氧原子和两个氢原子组成。
它们通过共用电子对形成了两个O-H共价键。
氧原子比氢原子更电负,因此氧原子部分带负电荷,氢原子则带正电荷,形成极性分子。
这种分子极性使得水分子能够形成氢键。
氢键是一种特殊的化学键,它是极性分子之间的相互作用力。
水分子中的氢键是由氧原子的负电荷与相邻氢原子的正电荷之间的静电吸引力形成的。
由于氢键的存在,水分子之间的结合力相对较强。
当两个水分子接近到足够近的距离时,它们之间的氢键作用会导致分子之间发生相互吸引,从而形成水融合。
在水融合过程中,水分子的氢键重新排列,原本与周围水分子相连的氢键被断裂,而新的氢键则形成,使得分子重新组合。
水融合的过程涉及到许多因素,包括温度、压力、溶质的种类和浓度等。
通常情况下,水融合发生在高温和高压的条件下,例如在水蒸汽和高温高压水中。
此时,水分子之间的氢键会断裂,水分子会更加自由地运动和重新组合。
水融合的原理与水分子的特性密切相关。
由于水分子的极性和氢键的存在,水分子之间会产生较强的吸引力,这也是水具有高沸点、高比热容和高表面张力的原因。
在水融合中,这种吸引力进一步加强,导致水分子更加紧密地结合在一起。
水融合具有一些独特的性质和效应。
例如,水融合可以改变水的物理性质,使其具有更大的稳定性和活性。
水融合还可以增强水的溶解能力,使其能够溶解更多的溶质。
此外,水融合还可以改变溶质的化学反应速率和选择性。
水融合对于生命起着重要的作用。
生物体内的许多化学反应都发生在水中,水融合可以促进这些反应的进行。
水融合还可以影响生物分子的结构和功能,对细胞的生理功能起到调节和保护作用。
总之,水融合是水分子之间通过氢键相互吸引而形成的一种新的结合形式。
水融合的原理与水分子的极性和氢键的存在密切相关,它对水的物理性质、溶解能力以及生物体的生命活动起着重要的影响。
水升温形成氢键

水升温形成氢键
水是生命之源,它也是组成物质的基本组成成分之一,以至于没有水,生命就不能存在。
一种特殊的水分子形式,称为氢键,在生物体细胞中发挥着重要作用。
氢键的形成受到温度的影响,当温度上升时,水分子的结构发生变化,使氢键形成。
首先,我们需要了解水分子的结构。
水分子是由两个氢原子和一个氧原子组成的,当这三个原子电荷不平衡时,会吸引其他离子,形成氢键。
氢键由一个氢原子与另一个氧原子之间的微弱共价键形成。
在一般情况下,水分子不是现存氢键的形式,而只当温度上升时,水分子才会形成氢键。
当温度上升时,水分子由于热能的作用而受到负面穿透,改变了空间结构,使水分子的电荷不再是均衡的,而是有统一偏向的,这样,水分子之间就会相互吸引,形成氢键。
此外,温度的上升也会对水分子的极性产生影响,使得一个水分子的空间位置被另一个水分子吸引,从而增强氢键之间的交互作用,使水分子形成氢键。
另一方面,当水分子形成氢键时,水分子之间会形成一个网状结构,这种结构具有很高的热稳定性,使水分子在高温下保持稳定,可以抵抗热能的影响,从而在高温环境中使水的结构稳定。
在生物体细胞中,氢键的形成可以帮助细胞有效地吸收和储存营养,并保护细胞免受外界物质的侵袭,为细胞生存提供了保护作用。
此外,水分子形成氢键时,也可以激活一些生物反应,如蛋白质的合成和细胞复制等,这些都可以帮助生物体更好地健康成长。
总而言之,水分子形成氢键是一个复杂的过程,这也是水分子能够在高温环境下稳定存在的关键。
水分子在形成氢键的过程中受温度的影响,当温度上升时,水分子的结构发生变化,使氢键形成,进而可以帮助生物实现良好的健康成长。
水的结构 性质

水的介电常数
Water 80.4 Methanol (甲醇) 33.6 电常数大,在25℃ Ethanol (乙醇) 24.3 为78.54; Ammonia (氨水) 17.3 水的介电常数高是 Acetic acid(醋酸) 6.15 Chloroform(氯仿) 4.81 由分子极性强造成 Ethyl ether(乙醚) 4.43 的,这个性质使水 Benzene (苯) 2.28 成为一种优良溶剂。 Carbon tetrachloride 2.24
近30年来水分子簇结构与功能的探索已引起科学界 的广泛关注....
水分子团簇变小, 水的溶解力、 渗透力、 代谢 力、 扩散力、 乳化力均有所增强, 从而具有一定的 “活化” 作用, 在一定程度上可以增强生物体的新陈 代谢、 血脂代谢、 酶活性以及免疫功能, 因此, 这 , , 样的水也被称为活化水
水的结构和性质
高亮 09051107
分子式为:H2O。 分子式为: 。
氢键
由于氧的电负性很大, 共用电子对强烈偏向氧原子, 几乎裸露的氢 质子和附近另一个带负电荷的氧原子相互靠近, 从而产生静电吸 引作用, 这个静电吸引作用力就是所谓的氢键。
氢键有方向性和饱和 性 水中氢键是弱键, 水中氢键是弱键,比 水分子中O-H键能 键能1/20 水分子中 键能 还小 水中氢键约90%具有 具有 水中氢键约 静电性质( 静电性质 HOδ--Hδ+····Oδ-H2), , 10%具有共价性质 HO具有共价性质( 具有共价性质 H····OH2)
• 冰融化为水时 , 冰中的氢键只有15%受到破坏 • 冰熔化时,大部分氢键没有断,只是弯曲, 许 多环是五分子构成的
水的表面张力
水的表面张力大,界面水分子与体相水相互作用强烈。 水的表面张力大,界面水分子与体相水相互作用强烈。 界面水分子间氢键强度大于体相,界面水分子行为特别。 界面水分子间氢键强度大于体相,界面水分子行为特别。 界面上H 能集结于界面上, 更具有优势, 界面上 3O+、OH-能集结于界面上,但OH-更具有优势, 界面是带有负电荷的。 界面是带有负电荷的。 气水界面还具有手性的选择性和识别能力
氢键相互作用
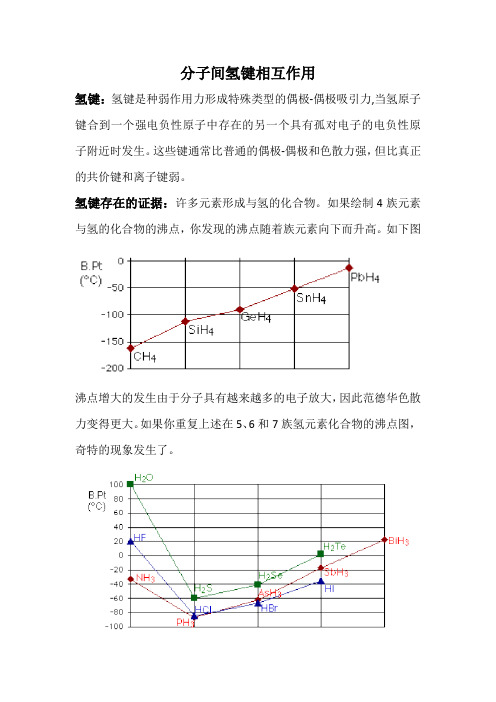
分子间氢键相互作用氢键:氢键是种弱作用力形成特殊类型的偶极-偶极吸引力,当氢原子键合到一个强电负性原子中存在的另一个具有孤对电子的电负性原子附近时发生。
这些键通常比普通的偶极-偶极和色散力强,但比真正的共价键和离子键弱。
氢键存在的证据:许多元素形成与氢的化合物。
如果绘制4族元素与氢的化合物的沸点,你发现的沸点随着族元素向下而升高。
如下图沸点增大的发生由于分子具有越来越多的电子放大,因此范德华色散力变得更大。
如果你重复上述在5、6和7族氢元素化合物的沸点图,奇特的现象发生了。
虽然大多数情况下的趋势与4族中的一样,氢与各族中的第一个元素的化合物的沸点异常高。
在NH 3,H 2 O和HF的情况下,必存在一些额外吸引的分子间作用力,需要更多的热能来破坏。
这些相对强大的分子间力被描述为氢键。
形成氢键的起源:分子具有这种额外的键的是:(注:实线表示在屏幕或纸张平面内的键。
虚线键表示远离你的屏幕或纸张的背面,楔形键是指向你的)在每一个这些分子中注意:1.氢原子直接结合到最负电元素之一,导致氢原子获得显著量的正电荷。
2.每个连接氢原子的元素不仅显著的负电性,而且还具有至少一个“有效的”孤对。
2-级的孤对有电子被包含在一个相对小的体积的空间,因此具有高密度的负电荷。
考虑两个的水分子的接近结合:δ+氢原子强烈吸引着孤对以致它几乎像形成配位共价键一样。
它不会走那么远,但吸引力显著比普通的偶极-偶极相互作用强。
氢键有大约平均共价键强度的十分之一,并正在液态水中不断被打破和重新形成。
如果你把氧原子和氢原子间的共价键比喻成稳定的婚姻,氢键具有“只是好朋友”的状态。
水是氢键的一个“完美”例子。
注意每个水分子有可能与周围的水分子形成四个氢键。
这也确是δ+氢原子和孤对的数目,所以他们中每一个都参与氢键。
这就是为什么水的沸点比氨或氟化氢更高。
在氨的情况下,形成氢键的数目由每个氮上只有一个孤对的事实所限制。
在氨分子的基团中,没有足够孤对满足周围所有氢原子。
水中所有的氢键

水中所有的氢键
氢键是生物体中最重要的化学键,它是水分子由两个氢原子和一个氧原子组成的化学键,
是水分子最重要的结构和功能的秘密武器之一。
水分子的结构通过氢键来保持,这种键类
似可以伸缩的绳索,水分子被氢键连在一起,这样就可以形成密集的三维网格,其中包含
着大量能量和整个生命系统维持的物质。
水是生物体的主要组成部分,因此氢键在生物体的结构和功能中起着至关重要的作用。
它
起到了调节温度、细胞功能、促进化学反应和运输等重要作用。
同时,氢键也可以为物质
运输和代谢提供便利,是生物体能够维持细胞分子结构的重要物质。
氢键也是众多物质前
往其他部位的通道,同时将细胞中的微分子聚集在一起,形成各种复杂的形状来维护细胞
的功能。
氢键对细胞的性能也有重要作用,它可以促进脂质膜的稳定性和抗微生物攻击,并有助于
维持细胞的形状特征,从而维持脂质膜的弹性和稳定性。
此外,氢键还可以改变脂质膜的
性质,从而促进细胞内部的新陈代谢。
而活性蛋白质、脂质及糖蛋白等中的疏水团也受氢
键的引力和亲水性的影响,在其结构活性、水环境能量以及细胞环境协调方面起着重要的
作用。
总的来说,氢键是水分子的核心组成部分,它不仅在形式上和功能上起着重要的作用,而
且在水维护细胞分子结构的过程中起着关键性的作用,是维持生物体稳定运作的重要物质。
氢键意义总结

氢键意义总结概述氢键是一种特殊的化学键,它在分子间的相互作用中起着重要的作用。
氢键的形成和破裂对于分子结构、物理性质和化学反应都具有重要意义。
在本文档中,我们将对氢键的意义进行总结。
分子间相互作用分子之间的相互作用对于物质的性质和行为至关重要。
氢键是一种分子间的相互作用,它主要存在于含有氢原子的分子中。
它的强度介于共价键和离子键之间,经常用于解释分子之间的非共价相互作用。
三种类型的氢键根据氢键的形成位置和性质,可以将其分为三种类型:分子-分子氢键、分子-离子氢键和分子内氢键。
分子-分子氢键分子-分子氢键发生在两个不同分子之间的氢键相互作用中。
例如,水分子(H2O)之间的氢键是其中的一种形式。
它可以使水分子更加结合,并影响水的物理性质,如沸点和冰的密度。
分子-离子氢键分子-离子氢键发生在分子和离子之间。
典型的例子是在一些盐的晶体中,阳离子和水分子之间形成的氢键。
氢键可以影响晶体的结构和稳定性。
分子内氢键分子内氢键发生在一个分子内部的氢键相互作用中。
分子内氢键可以使分子产生一些特殊的构象和稳定性。
例如,酮和醇中的分子内氢键可以改变它们的化学性质和反应活性。
氢键的重要意义氢键在化学和生物学中具有广泛的应用和重要性。
下面列举氢键的几个重要意义:维持分子结构氢键可以通过使分子组成更紧密,从而维持分子结构的稳定性。
在一些官能团和功能群中,氢键可以使它们与其他分子相互作用,从而影响分子的形状和结构。
决定物理性质氢键对物质的物理性质有重要影响。
例如,在液体中,氢键可以使分子间的相互吸引力增强,从而提高沸点和熔点。
氢键也可以影响溶解度、表面张力和黏性等物理性质。
调控化学反应氢键在化学反应中扮演着关键角色。
它可以影响分子的构象和空间排列,从而调控反应的速率和选择性。
例如,在酶催化的生物化学反应中,氢键的形成和破裂是决定反应速率和特异性的关键因素。
生物活性氢键在生物分子中起着关键作用。
例如,在DNA和蛋白质的结构中,氢键是稳定其三维结构的重要因素。
水分子呈现氢键结构

水分子呈现氢键结构水分子是地球上最常见的化学物质之一,也是生命存在的基础。
它的特殊性质不仅体现在其普遍存在于生物体内外,还体现在其分子结构中的氢键。
在水分子(H2O)中,氢键是通过水分子中的氢原子与相邻水分子中的氧原子之间的电荷相互作用形成的。
这种氢键结构赋予了水分子许多独特的性质。
首先,氢键赋予了水分子的高凝聚力。
由于氢键的存在,水分子表现出较高的凝聚能力,使得水分子之间的吸引力比其他分子之间的吸引力更强。
这种高凝聚力解释了水的表面张力和高沸点等特征。
同时,这也使得水分子在液态时形成了比较密集的结构,导致水的密度最大值出现在0℃,而不是它的固态。
其次,氢键使水分子有较大的极性。
水分子中氢原子的部分正电荷与氧原子的部分负电荷之间的相互作用使得水分子中产生了极性分子。
这种极性赋予了水分子良好的溶剂性,使得水成为了生物体内许多物质的有效载体。
水分子的极性也是导致水的特异性和温和性的重要原因。
此外,氢键也对水的热性质产生了影响。
水的热容量很大,意味着它能够在吸收或释放大量的热量时保持相对稳定的温度。
而这种特性是由于氢键的存在,使得水分子在吸收或释放热量时,需要克服氢键的束缚力。
在生物体内,氢键结构在许多生物分子的结构和功能中起着关键的作用。
例如,DNA双螺旋结构中的氢键使得DNA的稳定性得以保持,同时也方便了DNA分子的复制和读取。
蛋白质分子的折叠和稳定性也依赖于氢键的形成。
这些生物分子中的氢键结构对于生命的存在和功能发挥至关重要。
总而言之,水分子呈现氢键结构是水的独特性质之一。
这种氢键结构赋予了水分子高凝聚力、较大的极性以及特殊的热性质,对生命的存在和许多生物体内的反应过程起着重要的作用。
了解水分子中的氢键结构对于理解水的特性和生命的基本原理具有重要意义。
水分子聚在一起不散开的原因

水分子聚在一起不散开的原因【摘要】水分子聚在一起不散开的原因是由于水分子具有极性,使其互相吸引并形成氢键。
表面张力的作用也使水分子倾向于聚集在一起。
温度的影响可以改变水分子的运动轨迹,影响其聚集程度。
溶质的存在可以干扰水分子之间的相互作用,影响水分子的聚集状态。
离子的作用能够通过离子间的静电吸引力增加水分子间的聚集。
最终,水分子聚集形成团簇,各种因素共同作用导致水分子之间的相互作用,使其不散开。
水分子聚在一起的原因是多种多样的,这种聚集现象在自然界中随处可见。
【关键词】水分子、聚集、不散开、互相吸引、氢键、极性、表面张力、温度、溶质、离子、团簇、相互作用、原因、多样1. 引言1.1 水分子互相吸引的作用水分子之间互相吸引的作用是由于水分子的极性所造成的。
水分子是由一个氧原子和两个氢原子组成的,氧原子比氢原子的电负性更高,因此在共价键形成的过程中,氧原子会吸引更多的电子,使得整个水分子呈现出极性。
这种极性导致水分子之间产生静电力的作用,使得它们互相吸引并聚集在一起。
除了极性的作用外,水分子之间还可以通过氢键的形式相互吸引。
氢键是一种比较弱的相互作用力,但在水分子中起着至关重要的作用。
当水分子中的氧原子与氢原子形成氢键时,会导致水分子之间更加紧密地联系在一起,从而增强了它们的聚集效果。
水分子之间互相吸引的作用是由于其极性和氢键的存在所导致的。
这种吸引力使得水分子可以紧密地聚集在一起,形成团簇或者更大的结构,从而保持水的液态状态并表现出一些特殊的性质,如表面张力等。
1.2 氢键的形成水分子聚在一起不散开的原因主要是由于水分子之间存在着互相吸引的作用。
这种吸引力主要是通过氢键形成的。
氢键是一种特殊的化学键,它是由一个带部分正电荷的氢原子与一个带部分负电荷的非金属原子之间的相互作用所形成的。
在水分子中,氧原子带有部分负电荷,而氢原子带有部分正电荷,因此它们之间会形成氢键。
氢键的形成是由于氢原子的电子云被氧原子吸引,从而使氢原子与氧原子之间出现了一种弱的吸引力。
与水分子形成氢键的物质

与水分子形成氢键的物质水分子是地球上最普遍的分子之一,由一个氧原子和两个氢原子组成。
它是地球上维持生命活动的必需品,但同时也是化学实验中经常涉及的物质。
许多化学反应都在水中或者与水有关的溶液中进行,因此,了解如何与水分子形成氢键的物质对于探索这些反应以及其他许多领域都至关重要。
下面将逐步介绍几种能够与水分子形成氢键的物质:1. 氨基酸氨基酸是生命活动中必不可少的分子。
与水分子相遇时,它们能够形成氢键。
这些氢键可以通过一种特殊的方式相互作用,即亲水作用。
亲水作用是指一种分子的极性区域和水分子之间相互作用的过程。
在这种作用中,氨基酸通过氢键连接到水分子上,使其在水中溶解。
2. 聚乙烯醇聚乙烯醇是一种重要的胶粘剂,也是化妆品、纺织品和药物的原料之一。
它可以与水分子形成氢键,因此常常被用于保湿剂。
在这种情况下,聚乙烯醇的分子链通过氢键与水分子连接,形成水合物,使肌肤更加柔软,减少水分流失。
3. 葡萄糖葡萄糖是一种简单的糖分子,被广泛应用于许多工业、医学和食品应用中。
葡萄糖能够与水分子形成氢键。
在葡萄糖水中,葡萄糖分子通过氢键与水分子结合形成水合物,使葡萄糖分子能够在水中更好地溶解。
4. 醋酸醋酸是一种常用的化学试剂,也用于制备多种材料和药物。
它可以与水分子形成氢键,尤其是在水中高浓度的情况下。
当醋酸与水分子形成氢键时,产生的复杂分子结构能够影响很多与水有关的物理性质,例如密度和折射率等。
总之,与水分子形成氢键的物质在化学实验和生活中都有重要的用途。
不同的物质和水分子结合形成的氢键也会对物质的性质和用途产生各种不同的影响。
因此,了解这些氢键的性质和应用有助于我们更好地理解我们周围的世界。
水分子结构及其应用研究综述

水分子结构及其应用研究综述水分子是地球上最常见的分子之一,也是生命的重要基础。
它由两个氢原子和一个氧原子组成,化学式为H2O。
水分子的结构和性质对生命和地球的许多方面都具有重要影响。
本文将综述水分子的结构特点及其在科学研究和应用中的重要作用。
一、水分子的结构水分子由一个氧原子和两个氢原子组成,氧原子与氢原子之间分别以共价键相连。
氧原子比氢原子电负性更强,因此在水分子中,氧原子对电子的吸引力更大,使得氧原子带负电荷,氢原子则带正电荷。
由于氧原子的电负性,使得水分子呈现极性,即分子内部存在部分正电荷和部分负电荷。
这种极性使得水分子具有许多特殊性质。
水分子能够形成氢键。
由于氧原子带有负电荷,氢原子带有正电荷,因此水分子之间的氧和氢可以形成氢键。
氢键是一种比共价键和离子键弱很多的相互作用力,但是由于水分子中氧原子的电负性,使得水分子之间的氢键占据了重要地位。
氢键使得水分子可以在凝聚态下形成液态和固态,同时也使得水分子在生命体系中扮演者重要的功能。
水分子的极性也为它的良好溶剂性提供了基础。
水分子中的极性使得它能够溶解许多带电荷的分子和极性分子,比如盐类和糖类。
这种溶解能力使得水成为了地球上生命活动的基础,同时也为许多化学反应和生物过程提供了必要的环境。
水分子的极性也使得它表现出较高的表面张力和黏度。
水分子之间的相互作用力比较强,因此在表面上会形成一个较为坚固的膜,这使得水能够扮演者一种重要的环境因素。
水的表面张力也使得一些昆虫得以在水面上漂浮。
而水的黏度也使得水能够在植物的导管中上升。
二、水分子在科学研究中的应用由于水分子的特殊结构和性质,使得它在科学研究中发挥着重要作用。
在地球科学中,水的循环是一个重要课题。
水蒸气通过蒸发、凝结和降水形成了水的循环,在地球上影响着气候和生物圈。
对水分子结构和性质的研究有助于我们理解水的循环规律和地球上水资源的分布。
在生物科学中,水分子是生命的基础。
生命起源于水,水是维持生命的重要物质。
原创2:2.3.2 较强的分子间作用力——氢键

化学 · 选修 3
2.3.2 较强的分子间作用力——氢键
较强的分子间作用力——氢键
科普新知
看图 昆虫为什么能在水上行走? 思考 美丽雾凇如何形成的?
水分子间有一种特殊作用力——氢键
水中的氢键很脆弱,破坏的快,形成的 也快,总之水分子总是以不稳定的氢 键连在一片。这一特性使水有了较强 的内聚力和表面能力.由于具有较高的 表面能力,所以昆虫能在水面上行走。 当然也和昆虫本身的结构有关系。
分子内氢键
分子间氢键
熔沸点低
熔沸点高
较强的分子间作用力——氢键
课时小结
范德华力
分子间 作用力
氢键
静电作用
类 分子内氢键 型 分子间氢键
饱和性 方向性
总结感悟
较强的分子间作用力——氢键
当堂巩固
1.水分子间因存在氢键的作用而彼此结合形成(H2O)n。在冰中每个水 分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大 的分子晶体。 每个水分子形成的氢键数为4÷2=2 (1)1 mol冰中有____2____mol氢键。 (2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为 自__身__电__离_____H_2_O__+__H_2_O_冰__:___H__3O_升_+_+华__O热__H_=-__氢__键_。×2+范德华力 (3)已知在相同条件下双氧(5水1 k的J•沸m点ol-明1-显1高1 于kJ水•m的ol沸-1点) ÷,2=其2原0因kJ可•m能ol是-1 ___双__氧__水__分__子__之__间__存__在__更__强__烈__的__氢__键________________________。 (4)在冰结构中,每个水分子与相邻4个水分子以氢键相连接。在冰中除 氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热51 kJ·mol-1, 则冰中氢键的能量是___2_0__kJ·mol-1。
液态水中氢键键能

液态水中氢键键能1.引言1.1 概述液态水是生命存在的基础,也是地球上最常见的物质之一。
水分子由一个氧原子和两个氢原子组成,这种特殊的结构使得水具有一些独特的性质。
其中最重要的一个性质就是它能够形成氢键。
氢键是指非共价键中的一种特殊键型,它主要存在于分子间或分子内部。
在液态水中,由于氢键的存在,水分子会通过氢键产生一定的吸引力和相互作用。
这种相互作用不仅影响了水分子的结构和动力学过程,也对水的性质产生了巨大的影响。
在液态水中,氢键键能起着至关重要的作用。
首先,氢键键能决定液态水的物理性质,如密度、表面张力、熔点和沸点等。
其次,氢键键能还决定了水分子在液态中的运动方式和动力学行为,比如水的扩散、自由度和分子间交互等。
此外,氢键键能也在水的溶解性、化学反应和生物活性中起到了重要的调控作用。
然而,液态水中氢键键能也会受到一些因素的影响。
首先,温度是影响液态水中氢键键能的重要因素之一,随着温度的升高,液态水中的氢键键能会减弱。
此外,溶质的存在、外界压力和电场等外部条件也可以对液态水中的氢键键能产生显著影响。
综上所述,液态水中的氢键键能在水的性质和行为中起到了重要的作用。
深入理解液态水中氢键键能的特点和影响因素,对于我们进一步探索水的奥秘、理解生命的起源和改进相关应用具有重要的意义。
文章结构是指文章所包含的各个部分和章节,以及它们之间的逻辑关系和次序。
在本文中,文章结构分为引言、正文和结论三个主要部分。
引言部分用于引入文章的主题和背景,并对文章的结构做出概述。
在引言的1.2部分,将介绍以下内容:1.2 文章结构本文的文章结构可以分为三个主要部分:引言、正文和结论。
在正文部分,将详细讨论液态水中氢键键能的相关知识。
首先,在2.1部分将介绍液态水的性质,包括其物理性质和化学性质。
液态水是生活中最常见的状况,了解其性质对于理解液态水中氢键键能的重要性至关重要。
接下来,在2.2部分将定义和详细讨论氢键的特点。
氢键是液态水中相互作用较强的键,对于液态水的许多性质和现象具有重要影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水分子簇中氢键作用张建平 赵 林 王林双(天津大学化工学院天津 300072)摘要概述了近年来为揭示水分子簇存在形态的成因所做的理论和实验研究,指出除范德华力外,氢键和似共价键是水分子间的主要作用力。
总结了水分子簇中氢键的四种作用方式,包括协同效应、氢键的转动、氢键的振动以及氢键变换;分别讨论了这四种作用方式以及似共价键对水分子簇存在状态的影响,最后对该领域的研究前景作了展望。
关键词水分子簇氢键似共价键Hydrogen Bonds in Water ClustersZhang Jianping, Zhao Lin, Wang Linshuang(School of Chemical Engineering,Tianjin University, Tianjin 300072)Abstract Theoretical and experimental studies that reveal the formation of water clusters have been summarized. Besides van der Waals force, hydrogen bonds and quasi-covalent bonds between water molecules are major forces. Four kinds of kinetic motions of hydrogen bonds in water clusters are outlined,including cooperative effect, rotation, vibration and inter conversion, and the effects on the structure of waterclusters caused by quasi-covalent bonds and H-bond kinetic motions are explained in detail. Finally, the perspective in this research field is also discussed.Key words Water clusters, Hydrogen bond, Quasi-covalent bond水是大自然赋予我们的宝贵资源,也是人类赖以生存的必要条件,关于水分子簇结构与功能的研究已成为当今科研前沿的热点之一,其深层研究可望为揭示物理化学、生命科学等领域的本质问题提供有力工具[1~3]。
近年来,随着光谱科学和微观测试技术的发展以及分子轨道理论的介入,水分子簇的研究进入了量子时期,从而为揭示水分子簇存在形态的成因提供了实验和理论依据。
基于蒙特卡罗模拟的极化-解离多体经验势能函数(PD-PEF)[4]在计算(H2O)n(n=2~8)的水分子簇的结构特征和分子尺度过程中,将氢原子视为单一的裸露质子,由于其充分考虑到分子间氢键及分子内部作用力的影响,适于计算水分子簇的结构特征参数。
在六元水分子簇稳定性的研究中[5,6],应用从头计算法的独立分子模型,通过平动矢量和欧拉角将簇中每个分子的位置和取向逐一标定,总结出六水分子簇的五种结构形式,并通过计算氢键强度及自由能的大小,得出环状六水分子簇具有最稳定结构的结论。
进入上世纪90年代以来,美国加州大学Berkeley实验室设计的远红外振转隧道光谱仪能够清晰观测到分子间的振转谱线,为深层次研究氢键作用下水分子簇的微观结构开辟了一条崭新的途径[7]。
张建平 男,28岁,博士生,现从事废弃物处理和水的功能化研究。
E-mail: jianpingzhang@国家自然科学基金资助项目(20376054)2005-03-04收稿,2005-08-30接受研究表明[4,8],水主要依靠分子间氢键作用以动态分子簇的形式存在,其稳定存在时间只有10-12s左右。
在这个过程中,既不断有水分子加入某个水分子簇,同时也有水分子脱离该团簇,而簇的大小只是个平均数,且随时因环境状态的变化而改变。
而对于形成水分子簇的作用力而言,除范德华力外,可归结为分子间的氢键和似共价键。
1氢键水分子簇的形态以及各种特殊的物理化学性质,归根结底都取决于其氢键的特性。
氢键中质子的核磁共振氢谱若显示质子向高频移动,则表明氢键中的质子受到其它分子集团较强作用力的影响。
理论上每个水分子既可以作为氢键受体(即提供孤对电子),又能提供氢原子形成氢键(即氢键给体),在液态水中可形成动态的氢键网络,进而形成水分子簇。
当单体氢原子受到两个原子相当强束缚作用时,表明它们之间形成了氢键[9],如带有部分正电荷的氢原子与带有部分负电荷的氧原子、氮原子之间的氢键作用。
氢键的强度主要取决于H…O的键长和键角。
当键角在20º范围内氢键的强度基本呈线性变化,而氢键的键长是影响其强度最为重要的因素,随着氢键(H…O)键长增加,氢键强度呈指数衰减。
X射线研究表明[10],在0℃时,氢键键长为0.277nm;4℃时,键长为0.284nm;200℃时,键长为0.294nm。
随着温度的升高,氢键具有明显变弱的趋势,氢键数量减少,簇中氢键的断裂及部分水分子的脱离使得水分子簇变小[11,12],如图1所示。
图1不同温度下水分子簇中分子个数分布[12]Fig.1Distribution of moleculars in water clusters at different temperatures[12]在水分子簇中,共价键和氢键之间可以形成一种动态平衡[13],即H…O键越强,O―H键越弱,O…O间距越短。
其中O―H共价键的弱化将引起氢键键长变短,当氢键充分弯曲后,其强度变弱,这将导致两个水分子的分离。
其它因素,例如极化作用,将减小氢键长度,增加氢原子的共价性,但在增加的共价性的量化指标上仍存在分歧。
二元水的氢键是非常强的,即使在气相中仍保持很高的浓度,如在40℃、100%湿度情况下大约有1016/cm3量级的二元水存在[14],这在太阳能的吸收和大气反应动力学中起着至关重要的作用。
1.1氢键的协同效应一般认为,水中的氢键形态呈随机性,被选择的水分子也呈随机性,由于氧原子周围四个价电子中的两个可以与其它水分子形成氢键,故此形成氢键受体的水分子的成键几率均为50%。
当单体水分子形成四氢键时(两个氢键为给体,两个氢键为受体),无论是从统计学分析还是从能量角度推演,都必然使水分子趋向多分子的团簇结构,它们的氢键链即O―H…O―H…O呈现协同效应,断裂第一个氢键最难,下一个次之,依此类推,所以在氢键定位的大分子化合物中,容易发生解链(如核酸的解链)。
氢键的协同效应是液态水的基本特性,此种情况下的氢键强度约为二元水单体氢键强度的2.5倍。
氢键协同作用的本质就是其作为受体的行为强化了其作为给体的行为,换言之,由于水分子接受其它分子的氢原子的空轨道形成氢键,这种行为有利于此水分子的两个具有空轨道的氢原子与其它水分子形成新的氢键。
当然这种行为过程也存在阻抗效应,即单体水分子的两个孤对电子中的其一作为受体形成氢键,这必然弱化另外一个形成氢键的能力。
但从分子整体稳定性角度看,既有作为给体的氢键又有作为受体的双氢键水分子比具有给体氢键或受体氢键的单体水分子更加稳定,故此推测最开始形成的两氢键(一个给体氢键,一个受体氢键)形成分子的最强氢键。
考虑分子间氢键的平均强度,断开一个氢键弱化了其周围的氢键作用,形成一个氢键则增强了其周围氢键的协同作用,因此目前普遍认同的一种观点为:由于氢键的协同作用可使水分子以大的团簇结构存在,据估算,0℃下氢键化的水分子簇内分子个数为400左右[15]。
实际上水中不仅存在强氢键的协同作用,还存在大量的弱氢键,这种弱氢键势能面限制了相邻氢键的势能,并且可以持续几个分子层[16],与之相比,强氢键的协同作用影响距离则要长得多。
在高温下(>100℃)弱氢键可以被观察到,能量在17~23kJ/mol,此时大部分氢键被破坏,弱氢键则显示出很强的弱化协同作用能力。
高温下氢键的断裂不仅因为高能条件下的布朗运动所导致,而且随着温度的升高氢键给体能力也呈现明显的下降趋势,大约每100℃降低10%[17]。
1.2氢键的转动在早期针对水分子的研究中,人们用结构散射解释液态水中质子的行为特征,接着提出了热跃迁、质子隧道效应和溶剂化影响等多种概念,最近又建立了水化质子-分子簇动态缺陷模型[18]。
计算表明,水化质子被第一溶剂层的两个水分子所共享,动态结构缺陷由第二溶剂层中热诱导的氢键断裂速率控制,而由于隧道效应导致的质子传递可以忽略,动态氢键互变模型可由二维函数P(δ,R O-O)确定,其中δ是设定质子与瞬时氢键中心的距离,R O-O为相应两水分子内氧原子之间的距离。
无疑,问题的解决必须依靠氢键网络重排动力学的进一步探索。
对于n不大于5的水分子簇(H2O)n而言,簇中存在n个非氢键原子,而笼状六元水中只存在2个非氢键原子,依靠氢键弱作用形成的水分子簇结构中的非氢键原子可以沿对称面(或对称轴)翻转,产生隧道分裂效应从而发生给体隧道变换,形成不同的对映结构,即氢键网络重排,此翻转过程并不破坏原有的化学键。
以三环水为例[19],(H2O)3为环状结构(图2),簇中3个氧原子形成一个平面,3个非氢键原子中,一个在氧原子平面上方,另外两个在平面下方,在一定条件下,非氢键氢原子可以自由翻转。
图2三元水中氢原子翻转示意图Fig.2Overturn of hydrogen in water trimer通过对高分辨率谱图的群论分析[20],二元水存在三种低能翻转路径,量子隧道能量值分别为2.47、3.64和7.86kJ/mol。
三元水有96种翻转结构,其中两个低能路径已基本认定,阈值分别为1.09和8.36kJ/mol,第三条路径在远红外光区,已由Wales等[21]测定。
如果断裂的氢键没有键合成原来的状态,在其它氢键存在状态不变情况下,此氢原子会绕着同一分子的氢键发生转动,很少发生转移。
总之,氢键的转动行为从根本上影响着水分子簇的最小能量结构和可能的氢键网络重排路径,是深入探索水分子种种特殊性质的一把必不可少的钥匙。
1.3氢键的振动分子间氢键的振动频率在远红外区(10~500cm-1),也有人认为350cm-1以下为液态水分子转动的频率区,其实两者往往是交织在一起的,而水分子间的氢键又远非一般意义上的分子间作用力,其振动光谱区红移,Liu等[19,22~24]对几个水分子的团簇结构进行的研究,其转动和振动光谱观测区主要在几十个波数区。
水分子以多种方式振动,如图3所示,仅在气相中,就存在对称伸缩振动(ν1=3657cm-1)、非对称振动(ν3=3756cm-1)和弯曲振动(ν2=1595cm-1)[25]。
