北京工商大学2017年硕士理学院《物理化学》考试大纲
2017年理学院各专业考试大纲

2017年理学院各专业考试大纲统计学专业课初试考试大纲科目一:《分析与代数》一、课程的性质《数学分析》和《高等代数》是理工科对数学知识要求较高的主干课程,是非常重要的基础理论课,对学生将来从事专业科学研究起着极重要的作用.二、考试的总体要求要求考生系统地理解数学分析的基本概念、基本理论,掌握《数学分析》和《高等代数》的基本理论和基本方法, 对所列考试内容的知识点要熟练掌握并灵活运用,既要理解相关理论又要会应用。
三、考试内容《数学分析》:1、实数集与函数,数列极限、函数极限及函数连续性;2、一元函数微积分(一元函数的导数、微分、不定积分、定积分、微分中值定理)及其应用;3、多元函数的极限、微分(多元函数的极限、偏导数及可微性、隐函数定理及其应用);4、重积分(二重积分、三重积分)及应用;5、线面积分(第一、二型曲线、曲面积分)及应用;6、级数(数项级数及函数项级数)及其应用。
《高等代数》:1、一元多项式理论:最大公因式与因式分解,有理系数多项式;2、行列式:行列式的计算及性质,Laplace展开定理;3、线性方程组理论:Cramer法则,Gauss消元法,n维向量的线性相关性,矩阵的秩,线性4、方程组有解的判别,线性方程组解的结构;5、矩阵:矩阵的运算,方阵的行列式,矩阵的逆,分块矩阵,初等矩阵,广义逆矩阵;6、二次型:二次型的化简,标准形与唯一性,正定二次型与正定矩阵,实二次型的分类;7、线性空间:线性空间的基底、维数、坐标、基变换与坐标变换,线性子空间及它们的交与和,线性空间的同构;8、线性变换:线性变换的矩阵与线性变换的运算,线性变换的特征值与特征向量,矩阵的特征值与特征向量,矩阵的对角化,线性变换的值域与核,不变子空间,Jordan标准形; 9、欧氏空间:向量的内积,标准正交基,度量矩阵,实对称矩阵的对角化,正交矩阵,正交变换。
科目二:《概率论与数理统计》一、课程的性质《概率论与数理统计》是数学专业最重要专业基础之一。
2017年硕士研究生入学考试大纲

2017年硕士研究生入学考试大纲考试科目名称:教育管理与教学论考试科目代码:807 一、考试要求教育管理与教学论考试大纲适用于北京工业大学高等教育研究所(0451)教育(专业学位)的硕士研究生入学考试。
考试内容包含教育管理学、发展心理学、课程与教学论三个部分。
这三门课程是教育(专业学位)学科教育管理、心理健康教育方向的重要基础理论课。
教育管理学的考试内容主要包括现代教育管理、教育领导的基本概念、基本理论与管理实务知识,对教育管理改革取向的理解与综合分析能力等。
发展心理学的考试内容主要包括发展心理学的理论、认知发展、情绪与依恋的发展、自我与社会认知的发展、道德的发展、发展的生态系统等方面的基础知识,以及运用这些知识分析与解决实际问题的能力。
课程与教学论的考试内容主要包括掌握课程与教学的基本概念及必要的基础知识, 较为熟练地掌握课程编制的基本原理与技术,以及教学过程的基本规律,具有一定的分析、综合能力。
二、考试内容教育管理学部分:(一)现代教育管理的基本概念、理论基础及其流派(1)管理、教育管理、教育管理现代化等基本概念的内涵,管理与行政概念的区别与联系。
(2)管理理论的主要流派及其对教育管理的影响。
(二)中西方历史上的教育管理实践与思想(1)我国历史上的主要教育管理实践与思想。
(2)西方国家历史上的主要教育管理实践与思想。
(三)教育管理的层次、相关管理理论与管理实务知识(1)宏观教育行政管理体制的基本类型、国内外改革历程和趋势。
(2)教育政策与法律、教育计划、教育督导、教育财政的基本概念、主要议题、相关理论与改革趋势。
(3)学校管理过程、学校效能、学校组织管理、学校质量管理及实务管理的基本概念、相关理论观点、实施与评价。
(4)领导的概念、教育领导理论、领导者管理制度及其取向。
发展心理学部分:(一)发展心理学的进展与理论(1)发展心理学的界说、变迁与进展。
(2)精神分析、行为主义、维果茨基、皮亚杰、朱智贤的心理发展观。
研究生入学物理化学复习提纲

研究生入学考试物理化学复习提纲第二章热力学第一定律与热化学一、重要概念系统与环境,隔离系统,封闭系统,(敞开系统),广延性质(加和性:V,U,H,S,A,G),强度性质(摩尔量,T,p),功,热,内能,焓,热容,状态与状态函数,平衡态,过程函数(Q,W),可逆过程,节流过程,真空膨胀过程,标准态,标准反应焓,标准生成焓,标准燃烧焓二、重要公式与定义式1. 体积功: W= -p外dV2. 热力学第一定律:∆U = Q+W,d U = Q + W3.焓的定义:H=U + pV4.热容:定容摩尔热容C V,m = Q V /dT = (∂U m/∂T)V定压摩尔热容C p,m = Q p /dT = (∂H m/∂T)P理性气体:C p,m- C V,m=R ;凝聚态:C p,m- C V,m≈0理想单原子气体C V,m =3R/2,C p,m= C V,m+R=5R/25. 标准摩尔反应焓:由标准生成焓∆f H Bθ(T)或标准燃烧焓∆c H Bθ(T)计算∆r H mθ = ∑v B∆f H Bθ(T)= -∑v B∆c H Bθ(T)6. 基希霍夫公式(适用于相变和化学反应过程)∆r H mθ(T2)= ∆r H mθ(T1)+⎰21TT∆r C p,m d T7. 恒压摩尔反应热与恒容摩尔反应热的关系式Q p-Q V = ∆r H m(T)-∆r U m(T)=∑v B(g)RT8. 理想气体的可逆绝热过程方程:p1V1♑= p2V2♑ ,p1V1/T1 = p2V2/T2,♑=C p,m/C V,m三、各种过程Q、W、∆U、∆H的计算1.解题时可能要用到的内容(1)对于气体,题目没有特别声明,一般可认为是理想气体,如N2,O2,H2等。
恒温过程dT=0,∆U=∆H=0,Q=W;非恒温过程,∆U = n C V,m ∆T,∆H = n C p,m ∆T,单原子气体C V,m =3R/2,C p,m = C V,m+R = 5R/2(2)对于凝聚相,状态函数通常近似认为与温度有关,而与压力或体积无关,即∆U≈∆H= n C p,m ∆T2.恒压过程:p外=p=常数,无其他功W'=0(1)W= -p外(V2-V1),∆H = Q p =⎰21TT n C p,m d T,∆U =∆H-∆(pV),Q=∆U-W(2)真空膨胀过程p外=0,W=0,Q=∆U理想气体结果:d T=0,W=0,Q=∆U=0,∆H=0(3) 恒外压过程:例如(p124习题2-7): 1mol 理想气体于27℃ 、101325Pa 状态下受某恒定外压恒温压缩到平衡,再由该状态恒容升温到97 ℃ ,则压力升到1013.25kPa 。
物理化学大纲

物理化学大纲北京化工大学硕士研究生入学考试《物理化学》考试大纲(Physical Chemistry)一、课程名称、对象名称:物理化学(包括实验)对象:化学、化工、材料类等专业硕士研究生入学考试用二、理论部分第一章气体1.理想气体分压定律、分体积定律。
2.真实气体真实气体与理想气体的偏差、范德华方程.真实气体的液化(C02的p-V图)、临界现象、临界参数。
3.对应状态原理及压缩因子图对比参数、对应状态原理。
用压缩因子图进行普遍化计算。
第二章热力学第一定律1、基本概念及术语系统、环境、性质、状态、状态函数、平衡态、过程、途径。
2.热力学第一定律功、热、热力学能(内能),热力学第一定律。
恒容热、恒压热、熔。
3.热容平均热容、真热容。
定压摩尔热容、定容摩尔热容。
Cp,m与Cv,m的关系。
4.相变焓*5.溶解熔与稀释焓6.标准摩尔反应焓反应进度,标准态,标准摩尔反应焓,标准摩尔生成焓及标准摩尔燃烧焓.标准摩尔反应焓与温度的关系。
7.可逆过程体积功的计算可逆过程.恒温可逆过程与绝热可逆过程功的计算。
8.热力学第一定律对实际气体的应用实际气体的热性能与焓焦耳--汤姆生效应、节流系数。
第三章热力学第二定律1.热力学第二定律自发过程的共同特征,热力学第二定律的文字表述。
卡诺循环及卡诺定理,热力学第二定律的数学表达式,熵增原理及'熵判据。
2.熵变计算简单p.V.T变化过程的熵变,热源的熵变。
可逆相变与不可逆相变,相变过程的熵变。
3.热力学第三定律热力学第三定律,规定熵。
化学反应熵变的计算。
4.亥姆霍兹函数与吉布斯函数的定义,恒温恒容过程与恒温恒压过程方向的判据,亥姆霍兹函数与吉布斯函数变化的计算。
5.热力学基本方程和麦克斯韦关系式热力学基本方程,麦克斯韦关系式。
证明热力学等式的一般方法。
6.热力学第二定律应用举例--克拉佩龙方程和克劳修斯-克拉佩龙方程。
第四章多组分系统热力学1.拉乌尔定律与享利定律2.偏摩尔量与化学势偏摩尔体积及其它偏摩尔量.吉布斯--杜亥姆方程。
物理化学考试大纲

物理化学考试大纲 Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】《物理化学》课程考试大纲适用专业:学制年限:总学时:学分:制定者:审核人:一、课程的性质与考试目的本课程为专业基础课。
本课程是学习物理化学的基本原理,掌握化学反应平衡规律和速率规律。
通过本课程的学习,学生应该掌握必需的物理化学基本原理,并能用以分析和解决与化学有关的实际问题,为学习药学专业课程打下基础。
通过本课程的学习,为后续课程做好理论准备,增强学习化学的兴趣,培养尊重事物的科学态度,进一步深化学习化学的学习方法,使学生初步具有探索事物本质的勇气和精神。
二、考试的内容与要求第一章热力学第一定律考试内容:系统与环境、系统的性质、热力学平衡态, 掌握状态函数法和状态方程、过程和途径、热和功等基本概念、热力学第一定律, 最大体积功等一些重要概念的理解和应用;热力学第一定律, 盖斯定律、生成焓,燃烧焓,了解键焓估算的反应热、离子摩尔生成焓、溶解热和稀释热,掌握基希霍夫公式考试要求;1. 理解系统与环境、系统的性质、热力学平衡态, 掌握状态函数法和状态方程、过程和途径、热和功;2. 掌握热力学第一定律、热力学能、热力学第一定律的数学表达式;掌握热力学第一定律在理想气体中的应用, 了解热力学第一定律在实际气体中的应用;3. 理解盖斯定律、生成焓,燃烧焓,了解键焓估算的反应热、离子摩尔生成焓、溶解热和稀释热,掌握基希霍夫公式;第二章热力学第二定律考试内容:热力学第二定律;熵、熵变的计算;亥姆霍兹能、吉布斯能考试要求:1、理解热力学第二定律。
2、掌握环境和系统的熵变的计算。
3、掌握热力学第一定律和第二定律的联合公式; 掌握亥姆霍兹能、吉布斯能能;理解自发过程的方向和限度4、掌握理想气体的简单状态,相变化和化学变化的ΔG的计算。
第三章多组分系统热力学考试内容:偏摩尔量、化学势;稀溶液中的两个经验定律、气体组分中各组分的化学势、液态混合物,稀溶液,真实溶液中组分的化学势考试要求:1. 识记偏摩尔量的物理, 了解偏摩尔量的集合公式和吉布斯-杜亥姆方程2. 理解化学式;3. 了解拉乌尔定律和亨利定律的微观解释,掌握拉乌尔定律和亨利定律;4. 气体组分中各组分的化学势;5、了解液态混合物,稀溶液,真实溶液中组分的化学势;第四章化学平衡考试内容:化学反应等温式和平衡常数;平衡常数的测定和反应限度的计算、标准反应吉布斯能的变化及化合物的标准生成吉布斯能;温度对平衡常数的影响考试要求:1. 掌握化学反应等温式和平衡常数;2. 掌握平衡常数的测定和反应限度的计算;3. 掌握标准反应吉布斯能的变化及化合物的标准生成吉布斯能;4. 了解反应吉布斯能随温度的变化和范特霍夫方程;第五章相平衡考试内容:相律;单组分系统;单组分系统考试要求;1. 了解相律的推导,理解相、自由度、组分数、物种数、相平衡的概念,掌握相律及其应用;2. 掌握单组分的相图和克劳修斯-克拉伯龙方程;3. 掌握理想的完全互溶双液系, 掌握杠杆规则, 理解非理想的完全互溶双液系;了解蒸馏和精馏第六章电化学考试内容:电化学的基本概念、电解质溶液电导的测定及应用、电池电动势与电极电势;电池中各物质活度对电池电动势的影响;可逆电池的电动势测定及其应用。
物理化学研究生硕士招生考试大纲

《物理化学》课硕士研究生考试大纲一、考试内容及基本要求第一章. 气体的PVT 关系考试要求1.掌握理想气体状态方程和分压定律的应用;2.理解并掌握饱和蒸气压概念;3.了解真实气体与理想气体的偏差;考试内容1. 理想气体状态方程;2.理想气体混合物;第二章. 热力学第一定律考试要求1.掌握热力学基本概念,着重理解状态函数的特性;2.了解几种热效应形式,掌握化学反应热的概念,明确内能与焓是状态函数,热与功是途径函数;3.掌握热力学第一定律的表达式,能根据状态函数的特性,计算ΔU 和ΔH ,能对理想气体在恒温、恒压、恒容或绝热过程中的ΔU 、ΔH 、Q 及W 进行计算;4.掌握相变焓的相关计算;5.掌握用标准摩尔生成焓和标准摩尔燃烧焓数据计算化学反应热的方法,会用基希霍夫定律计算不同温度下的热效应;6.掌握可逆过程的特点和理想气体可逆体积功的计算;7.了解焦尔——汤姆生效应的特征。
考试内容1.热力学基本概念;2.热力学第一定律;3.恒容热、恒压热,焓;4.热容,恒容变温过程、恒压变温过程;5.焦耳实验,理想气体的热力学能、焓;6.气体可逆膨胀压缩过程,理想气体绝热可逆过程方程式;7.相变化过程;8.化学计量数、反应进度和标准摩尔反应焓;9.由θm f H ∆和θm c H ∆计算θm r H ∆第三章. 热力学第二定律考试要求1.了解自发过程的共同特征,明确热力学第二定律各种表达方法;2.了解熵的引出过程,准确掌握熵的定义,克劳修斯不等式及隔离系统的熵判据;3.掌握系统进行PVT 变化及各类相变化时ΔS 的计算方法;4.了解热力学第三定律及规定熵、标准熵的定义,掌握由25℃各物质的标准熵求取化学反应标准反应熵的方法;5.掌握亥姆霍斯函数、吉布斯函数的定义,以及亥姆霍斯函数判据、吉布斯函数判据的本质及应用条件;6.了解热力学基本方程的导出及适用条件,掌握ΔA、ΔG的一般计算方法。
考试内容1.卡诺循环;2.热力学第二定律;3.熵、熵增原理;4.单纯PVT变化熵变的计算;5.相变化过程熵变的计算;6.热力学第三定律和化学变化过程熵变的计算;7.亥姆霍兹函数和及布斯函数;8.热力学基本方程;9.克拉佩龙方程;10.吉布斯-亥姆霍兹方程和麦克斯韦关系式。
北京工商大学2017年硕士研究生入学复试参考书目
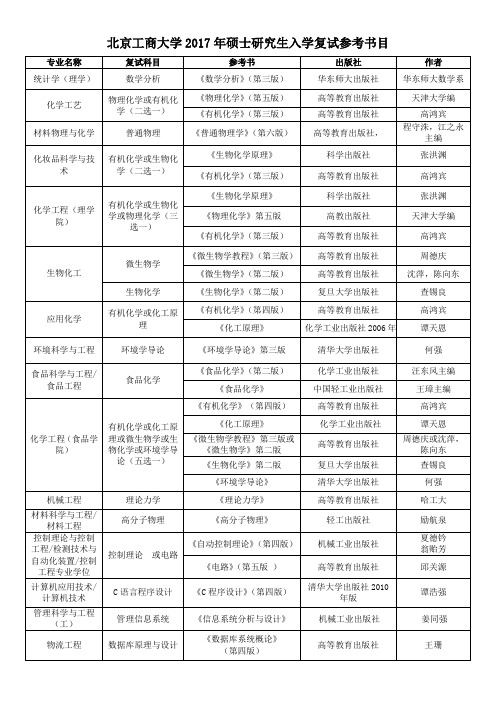
国际商务
国际商务综合
保险硕士 资产评估 管理科学与工程 (管理学) 会计学
保险学 微观经济学 运筹学
会计学综合 《审计学》 (第四版)
专业名称
复试科目
参考书 教指委大纲 《中级财务会计》 (第四版)
出版社
作者 杨有红 欧阳爱平 王斌 潘爱香 赵保卿 兰苓 劳埃德.拜厄尔 著,李业昆译 杨有红,欧阳爱 平 袁琳 (美)蔡斯 (Chase,R.B.) 等著,任建标 等译 田里 徐学鹿 范建 吕 来明 杨紫煊 江伟、肖建国 陈光中 魏振瀛 李仁玉,陈敦 高铭暄 张文显 魏振瀛 李仁玉,陈敦 高铭暄 本书编写组 本书编写组 杨保军 罗子明等
作者 陈孟熙 郭庆旺 李友元、姜竹 黄达 王俊豪 洪涛 海闻 黎孝先 李朝鲜等 邱东 李宝仁 浙江大学 盛骤 等编 王绪瑾 陈雨露
财政学
财政理论与实务 《财政学》 (第二版)
金融学
金融学综合
《金融学》 《产业经济学》 《流通产业经济学》 (第二版) 《国际贸易》 《国际贸易实务》 《社会经济统计学》 《国民经济统计学》 (第二版) 《计量经济学》
化学工程(理学 院)
有机化学或生物化 学或物理化学(三 选一)
微生物学 生物化工
环境科学与工程 食品科学与工程/ 食品工程
化学工程 (食品学 院)
专业名》 (第三 版) 《财政学》
出版社 中国人民大学出版社 2012 年版 中国人民大学出版社 机械工业出版社 中国人民大学出版社 2012 高等教育出版社 经济管理出版社 上海人民出版社 2003 年版(2007 年印刷) 对外经济贸易大学出 版社 2011 年版 经济科学出版社 2006 东北财经大学出版社 2011 机械工业出版社 2015 年1月 高等教育出版社, 2009 年版 高等教育出版社 2011 年 8 月版 中国人民大学出版社 2012 中国金融出版社, 2010 年 经济科学出版社 2006 高等教育出版社, 2009 年版 中国人民大学出版社, 2014 中国人民大学出版社 对外经济贸易大学出 版社 2010 年 中国人民大学出版 社,2002 年 高等教育出版社 2011 年 8 月版 机械工业出版社, 2013 年版 清华大学出版社 北京大学出版社 经济科学出版社
北京工商大学2017年硕士研究生初试参考书目

北京工商大学 2017 年硕士研究生入学初试参考书目
科目代码 211 334 357 考试科目 翻译硕士英语 新闻与传播专业综 合能力 英语翻译基础 参考书 出版社 不指定书目 《媒体写作与语言艺术》 (上、 中国广播电视出版社 2011 年版 下) 《实用汉英翻译教程》 《英汉翻译简明教程》 《金融学》 431 金融学综合 《公司理财》 《社会经济统计学》 《计量经济学》 (第四版) 《概率论与数理统计教程》 《税收学》 433 税务专业基础 《中国税制》 (第六版) 434 435 国际商务基础 保险专业基础 《国际商务》(原书第七版) 《保险学》(第五版) 《经济学导论》 436 资产评估专业基础 《资产评估教程》 《财务管理学》(第六版) 440 448 711 新闻与传播专业基 础 汉语写作与百科知 识 新闻与传播综合 法学综合(一) (民 法学、民事诉讼法 学) “毛特体” 《传播学教程》 (第二版) 《汉语写作与百科知识》 《传播学教程》 (第二版) 《民法》 (第五版) 《民法学》 (第二版) 《民事诉讼法》 (第七版) 《毛泽东思想、中国特色社会 主义理论体系概论》 《数学分析》 (第三版) 714 分析与代数 《高等代数》 715 716 专业英语(翻译与 写作) 量子力学 水平考试 不指定参考书 《量子力学教程》 (第一版) 高等教育出版社 周世勋 编 高等教育出版社 外语教学与研究出版社 外语教学与研究出版社 中国人民大学出版社 2012 年版 机械工业出版社 2009 年版 经济科学出版社 2006 机械工业出版社 2008 高等教育出版社 2009 年版 中国人民大学出版社 2014 年版 中国人民大学出版社 机械工业出版社,2011 年 高等教育出版社,2011 年月版 财经科学出版社,2010 年版 中国财政经济出版社 2010 年版 中国人民大学出版社 2012 年 6 月版 中国人民大学出版社 2012 年版 武汉大学出版社出版,2012 中国人民大学出版社 2011 年版 北大和高教联合出版 北大出版社 中国人民大学出版社 高等教育出版社 2015 年修订版 华东师大出版社 作者 刘洪妹孟伟 曾诚 庄绎传 黄达 斯蒂芬.罗斯等 著,吴世农译 李朝鲜 李宝仁 浙江大学 盛骤 等编 黄桦等编著 马海涛 等编 著 【美】迈克尔• 钦科陶等 王绪瑾 徐丹丹、徐秋慧 编著 刘玉平主编 靳新,王化成, 刘俊彦 编 郭庆光 刘军平 郭庆光 魏振瀛 李仁玉 陈敦 姜伟 肖建国 本书编写组 华东师大数学系 编 北京大学数学系
物理化学考试大纲

物理化学考试大纲课程名称:物理化学科目代码:862适用专业:化工所有专业参考书目:《物理化学》(上、下册)(第五版)高等教育出版社,2009,天津大学;(物理化学实验教材可由下列教材中任选一种)《物理化学实验》石油大学出版社吴肇亮等;《基础化学实验》(上、下册)石油工业出版社,2003,吴肇亮等硕士研究生物理化学课程考试大纲一、概述物理化学课程主要包括热力学原理和应用、化学动力学基础、相平衡基础、表面胶化和统计力学基础部分。
其中前三部分为主要内容。
考生应比较牢固地掌握物理化学基本概念及计算方法,同时还应掌握物理化学一般方法,并具备结合具体条件应用理论解决实际问题的能力。
在物理化学实验的相关内容中,要求掌握常用的物理化学实验方法和测试技术。
在有关的物理量计算和表述中,应注意采用国家标准单位制(SI制)及遵循有效数运算规则。
在涉及数值的计算中应注意物理量单位的运算及传递。
二、课程考试的基本要求理论部分:下面按化学热力学、统计热力学初步、化学动力学、电化学、界面现象和胶体化学六个部分列出基本要求。
基本要求按深入程度分“了解”、“理解”(或“明了”)和“掌握”(或“会用”)三个层次。
(1)化学热力学1.热力学基础理解下列热力学基本概念:平衡状态,状态函数,可逆过程,热力学标准态。
理解热力学第一、第二、第三定律的叙述及数学表达式。
明了热力学能、焓、熵、Helmholtz函数和Gibbs函数等热力学函数以及标准燃烧焓、标准生成焓、标准摩尔熵、标准生成Gibbs函数等概念。
掌握在物质的P、V、T变化、相变化和化学变化过程中计算热、功和各种状态函数变化值的原理和方法。
在将热力学一般关系式应用于特定系统的时候,会应用状态方程(主要是理想气体状态方程,其次是Van der Waals方程)和物性数据(热容、相变热、蒸汽压等)。
掌握熵增原理和各种平衡判据。
明了热力学公式的适用条件。
理解热力学基本方程和Maxwell关系式。
物理2017年考纲

物理Ⅰ.考核目标与要求根据普通高等学校对新生文化素质的要求,依据中华人民共和国教育部 2003 年颁布的《普通高中课程方案(实验)》和《普通高中物理课程标准(实验)》,确定高考理工类物理科考试内容。
高考物理试题着重考查考生的知识、能力和科学素养,注重理论联系实际,注意物理与科学技术、社会和经济发展的联系,注意物理知识在生产、生活等方面的广泛应用,以有利于高校选拔新生,有利于激发考生学习科学的兴趣,培养实事求是的态度,形成正确的价值观,促进“知识与技能”“过程与方法”“情感态度与价值观”三维课程培养目标的实现。
高考物理在考查知识的同时注重考查能力,并把对能力的考查放在首要位置;通过考查知识及其运用来鉴别考生能力的高低,但不把某些知识与某种能力简单地对应起来。
目前,高考物理科要考查的能力主要包括以下几个方面:1.理解能力理解物理概念、物理规律的确切含义,理解物理规律的适用条件以及它们在简单情况下的应用;能够清楚地认识概念和规律的表达形式(包括文字表述和数学表达);能够鉴别关于概念和规律的似是而非的说法;理解相关知识的区别和联系。
2.推理能力能够根据已知的知识和物理事实、条件,对物理问题进行逻辑推理和论证,得出正确的结论或做出正确的判断,并能把推理过程正确地表达出来。
3.分析综合能力能够独立地对所遇到的问题进行具体分析、研究,弄清其中的物理状态、物理过程和物理情境,找出起重要作用的因素及有关条件;能够把一个复杂问题分解为若干较简单的问题,找出它们之间的联系;能够提出解决问题的方法,运用物理知识综合解决所遇到的问题。
4.应用数学处理物理问题的能力能够根据具体问题列出物理量之间的关系式,进行推导和求解,并根据结果得出物理结论;能运用几何图形、函数图像进行表达、分析。
5.实验能力能独立地完成表2、表3中所列的实验,能明确实验目的,能理解实验原理和方法,能控制实验条件,会使用仪器,会观察、分析实验现象,会记录、处理实验数据,并得出结论,1对结论进行分析和评价;能发现问题、提出问题,并制订解决方案;能运用已学过的物理理论、实验方法和实验仪器去处理问题,包括简单的设计性实验。
2017年全国统一考试大纲考试说明及样题(化学)

2017年全国统一考试大纲考试说明及样题化学根据教育部考试中心《2017年普通高等学校招生全国统一考试大纲(理科)》(以下简称《大纲》),结合基础教育的实际情况,制定《2017年普通高等学校招生全国统一考试大纲的说明(理科)》(以下简称《说明》)的化学科部分。
制定《说明》既要有利于化学课程的改革,又要发挥化学作为基础学科的作用;既要重视考查考生对中学化学知识的掌握程度,又要注意考查考生进入高等学校继续学习的潜能;既要符合《普通高中化学课程标准(实验)》和《普通高中课程方案(实验)》的要求,符合教育部考试中心《大纲》的要求,符合普通高中课程改革实验的实际情况,又要利用高考命题的导向功能,推动化学课程的课堂教学改革。
一、考核目标与要求化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
化学科命题注重测试考生自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
(一)对化学学习能力的要求1.接受、吸收、整合化学信息的能力(1)对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。
例1短周期元素W、X、Y、Z的原子序数依次增加。
m、p、r是由这些元素组成的二元化合物。
n是元素Z的单质,通常为黄绿色气体;q的水溶液具有漂白性,0.01 mol·L-1 r溶液的pH为2;s通常是难溶于水的混合物。
上述物质的转化关系如图所示。
下列说法正确的是A.原子半径的大小W<X<YB.元素的非金属性Z>X>YC.Y的氢化物常温常压下为液态D.X的最高价氧化物的水化物为强酸【说明】本题主要考查考生对原子结构和元素性质周期性变化规律的理解。
考生需要熟练掌握短周期主族元素,并将原子结构、元素单质性质、化合物性质与相关化学反应等内容进行综合运用,正确得出相关元素的名称及其化合物,并进而对元素的原子半径大、非金属性强弱的比较、氢化物的熔点和沸点、氧化物的水化物的酸碱性强弱等做出正确判断。
物理化学(一)考试大纲

⑥ 能根据标准热力学函数的表值计算平衡常数; ⑦ 了解同时平衡、反应耦合、近似计算等。
第七章 考试内容 统计热力学的基本概念,配分函数及其与热力学函数的关系。 考试要求 统计热力学基础
① 了解什么是最概然分布; ② 理解为什么可以用最概然分布的微观状态数来代替整个体系的微观状态
数;
③ 理解配分函数的定义及意义; ④ 了解定位体系与非定位体系的热力学函数的差别; ⑤ 了解平动、转动、振动配分函数对热力学函数的贡献,了解公式的推导过
程;
⑥ 了解什么是玻色-爱因斯坦统计和费米-狄拉克统计。
第八章 电解质溶液 考试内容 电化学的基本概念,电导理论及强电解质溶液理论 考试要求
① 了解迁移数的意义及常用的测定方法;
1. 明确电导率、摩尔电导率的意义及其与浓度的关系; 2. 熟悉离子独立移动定律及电导测定的应用;明确电导率、摩尔电导率 的意义及其与浓度的关系; 3. 熟悉离子独立移动定律及电导测定的应用;
① 了解热力学的一些基本概念,如体系、环境、状态、功、热量、变化过程
等;
② 明确热力学第一定律和内能的概念。明确热和功只在体系与环境有能量交
换时才有意义。熟知功与热正负号的取号惯例;
③ 明确准静态过程与可逆过程的意义; ④ 明确 U 及 H 都是状态函数,以及状态函数的特性; ⑤ 较熟练地应用热力学第一定律计算理想气体在等温、等压、绝热等过程中
4
考试内容 化学动力学的基本理论,催化反应、光化学反应的基本知识 考试要求 1. 了解碰撞理论、过渡状态理论、单分子反应理论的基本内容并弄清 几个能量的不同意义及相互关系; 2. 了解溶液中反应的特点及离子强度对反应的影响; 3. 了解光化学反应的特点量子产率; 4. 了解催化反应的特点和常见的催化反应类型; 第十三章 考试内容 表面化学的基本知识,附加压力,液液、液固界面的铺展与润湿,气-固 表面的吸附。 考试要求 1. 明确表面吉布斯自由能、表面张力的概念,了解表面张力与温度的 关系; 2. 明确弯曲表面的附加压力产生的原因及与曲率半径的关系,学会使 用 Young-Laplace 公式; 3. 了解弯曲表面与平面上的蒸气压的差别,学会使用 Kelvin 公式,会 用这个基本原理来解释常见的表面现象; 4. 理解吉布斯吸附等温式中各项的物理意义并能应用其进行简单的计 算; 5. 理解表面活性剂的概念及其基本特性,了解其分类及几种重要作用; 6. 了解液-液、液-固界面的铺展与润湿情况,理解气-固表面的吸 附本质,了解吸附理论的基本内容。 第十四章 考试内容 分散体系的分类,胶体基本特性及一般性质。 考试要求 1. 了解胶体分散体系的基本特性; 2. 了解胶体分散体系的动力性质、光学性质、电学性质及其应用; 3. 了解溶胶的稳定性及电解质对其的影响,会判断电解质聚沉能力的 大小; 4. 了解大分子溶液与溶胶的异同点。 二、考试的方法和考试时间 本课程考试采用相关专业统一闭卷考试,考试时间为 180 分钟。 三、考试评价标准 评卷采用一百五分制。 胶体化学 界面现象
化学工程与技术《物理化学简明教程》考试大纲

化学工程与技术《物理化学简明教程》考试大纲一.指导思想及大纲依据1.指导思想为了正确、客观、真实的给出化学工程与技术硕士生入学物理化学学科的成绩,提高物理教学质量,促进物理化学教学的全面改革,采用标准化考试对考生进行物理化学知识水平测试。
2.大纲依据①参照1980年部颁发高等师范院校物理化学教学大纲(试用)。
②上海师范大学等五校合编《物理化学》(高等教育出版社1991年第三版)。
③参考傅献彩、沈文霞、姚天扬编《物理化学》(高等教育出版社1990年第四版)。
④参考印永嘉、奚正楷、李大珍编《物理化学简明教程》(高等教育出版社1992年第三版)。
⑤中华人民共和国国家标准GB3102·8物理化学和分子物理学的量和单位。
二.考试对象化学工程与技术硕士生入学考试学生。
三.考试目标1.本考试是化学工程与技术硕士生入学考试学生物理化学学科的成绩考试。
2.考试目标分为:A、认识与记忆B、理解与判断C、掌握与应用D、分析与综合A、认识与记忆①对物理化学中基本概念、定义、名词的重现与复述;②对物理化学中基本定律、定理、理论及重要公式的重现与复述;③对物理化学中各种量的法定计量单位与符号及重要常数的了解与熟记;④对物理化学中重要定律,理论的实验基础及物理化学发展的重要史实的了解。
B、理解与判断①准确理解物理化学的概念、基本定律、重要公式和理论;②能区分物理化学中易混淆的概念;③理解物理化学中重要图示所代表的物理意义;④理解物理化学计算的基本原理和方法。
C、掌握与应用①掌握物理化学基本概念、基本原理,并能解决和论证给定条件下的物理化学问题;②熟练运用物理化学重要公式进行有关计算;③能从物理化学的基本公式、假定出发,推导出所要求的关系式;④掌握物理化学中有关图象的绘制方法,并能进行解释和应用。
D、分析与综合①从物理化学基本原理出发,运用演绎、归纳等方法分析、论证具体问题。
②掌握物理化学各部分知识之间的内在联系,并能用于解决某些问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京工商大学2017年硕士理学院《物理化学》考试大纲(一)化学热力学
1.掌握理想气体和范德华气体状态方程。
理解热力学第一、二、三定律的叙述及数学表达式,明确U、
H、S、A、G函数和ΔcHmθ,ΔfHmθ,ΔfGmθ和Smθ函数等概念。
掌握在物系的p、V、T变化、相变化和化学变化过程中计算热、功和各种状态函数变化值的原理和方法。
掌握熵增原理的各种平衡判据。
掌握热力学公式的适用条件,掌握热力学基本方程和Maxwell关系式。
2.理解偏摩尔量和化学势的概念。
能用Clapeyron和Clapeyron-Clausius方程进行有关相平衡的计算。
掌握拉乌尔定律和亨利定律以及它们的应用,掌握理想溶液和稀溶液中化学势的表达式,理解逸度和活度的概念和逸度和活度的的标准态和对组分活度及活度系数的计算方法。
掌握单组分和二组分系统典型相图的特点和应用。
能用杠杆规则进行计算,熟练掌握相图的分析。
3.掌握用热力学数据计算Kθ。
掌握用等温方程和等压方程进行有关的计算和应用,理解温度、浓度、压力对化学平衡的影响。
(二)电化学
1.理解和掌握电解质离子迁移数、独立离子运动定律、活度、离子平均活度系数的概念和计算。
了解离子氛的概念和Debye-Hiieckel极限公式。
2.掌握各类电极的特征和电动势测定的应用,掌握Nernst方程计算和应用。
理解产生电极极化的原因和超电势的概念。
(三)胶体与界面现象
1.理解和掌握附加压力、Laplace公式、Kelvin公式、Young方程及其应用。
2.掌握固体表面Langmuir吸附和溶液表面Gibbs吸附模型和吸附等温式。
3.掌握溶胶的电学特性及电解质对溶胶的聚沉影响
(四)化学动力学
1.理解化学反应速率、反应速率常数及反应级数的概念,掌握零、一、二级反应的速率方程及其应用;掌握由反应机理建立速率方程的近似方法(稳定态近似法、平衡态近似法);了解多相反应的步骤;理解经典过渡态理论的基本思想、基本公式及有关概念。
2.掌握阿仑尼乌斯方程及应用,明确活化能及影响反应速率的因素对反应速率的影响
文章来源:文彦考研。
