气体摩尔体积课堂教学
《气体摩尔体积》第一课时教学设计

《气体摩尔体积》第一课时教学设计教学目标1.知识目标在了解气体体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
2.能力目标通过气体摩尔体积的概念的教学,培养学生分析、推理、归纳、总结的能力。
3.情感目标通过设问,引导学生科学的思维方法;培养学生的主动参与意识,激发学习兴趣,教学重点:气体摩尔体积的概念教学难点:相同温度和压强下,相同物质的量的任何气体所占的体积大约相同的原因。
教学方法:设疑、导思、归纳、应用教学过程:[复习提问] 1.1mol物质含有的粒子数约是多少?2.什么叫摩尔质量?[学生回答] 1 mol任何物质的粒子个数约为6.02×1023个。
摩尔质量:单位物质的量(1 mol)任何物质的质量。
[引入新课]既然1 mol任何物质的粒子个数约为6.02×1023个,1 mol任何物质的质量(摩尔质量)都是以克为单位,在数值上等于构成该物质的粒子的式量。
那么,1 mol 任何物质的体积(即摩尔体积)又该如何确定呢?[板书] 一、气体摩尔体积1.1mol固、液态物质的体积[提问] 已知物质的质量和密度,怎样求体积?[学生回答]V=[投影] 计算1mol几种固、液态物质的体积,填表一;物质粒子数1mol 物质质量(g)20℃密度(g/cm3)体积(cm3)Fe 6.02×102356 7.8Al 6.02×102327 2.7Pb 6.02×1023207 11.3H2O 6.02×102318 1(4℃)H2SO4 6.02×102398 1.83学生分组计算出1molFe、Al、Pb、H2O、H2SO4的体积分别为:7.2、10、18.3、18、53.6cm32.计算标准状况下,1mol H2、O2、CO2气体的体积,并填表二:气体粒子数1mol物质质量(g) 密度(g/L)体积(L)H2 6.02×1023 2.016 0.0899O2 6.02×102332.00 1.429CO2 6.02×102344.01 1.977学生分组计算出标准状况下,1mol H2、O2、CO2的体积分别为:22.4L、22.4L、22.3L [板书] 标准状况:0℃,101kPa[投影问题]1. 1 L=________cm3。
化学教案-气体摩尔体积

化学教案-气体摩尔体积一、教学目标1.了解气体摩尔体积的定义和单位。
2.掌握气体摩尔体积与摩尔质量、密度等物理量的关系。
3.学会运用气体摩尔体积进行相关计算。
二、教学重难点1.教学重点:气体摩尔体积的概念及计算。
2.教学难点:气体摩尔体积与摩尔质量、密度等物理量的关系。
三、教学过程1.导入新课通过提问方式引导学生回顾摩尔质量、摩尔浓度的概念。
提问:同学们,我们之前学习了摩尔质量和摩尔浓度,那么气体摩尔体积是什么意思呢?它与我们之前学过的物理量有什么关系呢?2.讲解气体摩尔体积的概念通过PPT展示气体摩尔体积的定义:在标准状况下,1摩尔气体所占的体积为22.4L。
强调气体摩尔体积的单位:L/mol。
举例说明:在标准状况下,1摩尔氧气(O2)的体积为22.4L。
3.探讨气体摩尔体积与摩尔质量、密度的关系提问:同学们,我们之前学习了摩尔质量和密度,那么气体摩尔体积与这两个物理量有什么关系呢?通过PPT展示气体摩尔体积与摩尔质量、密度的关系公式:V=nVM=m/M=ρVM。
举例讲解:在标准状况下,氧气(O2)的摩尔质量为32g/mol,密度为1.429g/L,计算其摩尔体积。
4.气体摩尔体积的计算通过PPT展示气体摩尔体积的计算公式:V=nVM。
讲解计算步骤:确定气体的摩尔数n,然后乘以气体摩尔体积VM,得到气体的体积V。
举例计算:计算标准状况下,2摩尔氧气(O2)的体积。
5.气体摩尔体积的应用通过PPT展示气体摩尔体积在实际生活中的应用:如气体压缩、气体分离等。
举例讲解:在气体压缩过程中,如何根据气体摩尔体积计算压缩后的气体体积。
6.课堂小结强调气体摩尔体积与摩尔质量、密度的关系。
7.课后作业(课后自主完成)1.解释气体摩尔体积的概念。
2.写出气体摩尔体积的计算公式。
3.计算标准状况下,1摩尔氢气(H2)的体积。
4.分析气体摩尔体积与摩尔质量、密度的关系。
四、教学反思本节课通过讲解气体摩尔体积的概念、计算公式及应用,使学生对气体摩尔体积有了更深入的了解。
气体摩尔体积-公开课市公开课获奖课件省名师示范课获奖课件
1mol
50
受温度和压强影响
1mol H2O(l)
二、影响物质体积大小旳原因
影响1mol不同气体体积旳原因主要是:粒子间距
受温度和压强影响 1、温度:当其他条件不变,温度升高,气体体积增大 2、压强:当其他条件不变,压强升高,气体体积减小
假如温度和压强一定,则粒子间旳距离一定, 体积也就一定。
三、阿伏伽德罗定律
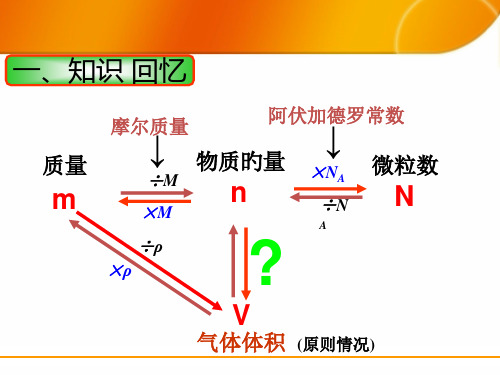
一、知识 回忆
质量
m
↓ ↓ 摩尔质量
阿伏加德罗常数
物质旳量
÷M
n
×M
×NA ÷N
微粒数
N
A
÷ρ ×ρ
?
V
气体体积 (原则情况)
第三课时 气体摩尔体积
教师:林海霞 学生:高一(4)班 日期:2023年9月23日
第三课时 气体摩尔体积
内容
一、知识回忆 二、影响物质体积大小旳原因 三、阿伏伽德罗定律 四、气体摩尔体积
• (4)原则情况下,1mol任何物质旳体积都约是22.4L。
•
错误。“物质”应是气体。
• (5)只有在原则情况下,气体摩尔体积才可能约为22.4L/mol。
•
错误。不一定。
• (6)22.4L气体所含分子数一定不小于11.2L气体所含旳分子数。
•
错误。未指明气体体积是否在相同条件下测定。
第三课时 气体摩尔体积
体积由大到小旳顺序是: ①③④②
Thank you!
A.质量为12 g
B.物质旳量为6 mol
C.体积为22.4 L
D.分子数为6.02×1023
6.(1)CO2旳摩尔质量为 44 g.mol-1 ;88g CO2旳物质旳量为
,所含2二m氧ol化碳分子数为
气体摩尔体积的教案设计

气体摩尔体积的教案设计气体摩尔体积的教案设计(通用6篇)作为一名人民教师,通常需要准备好一份教案,借助教案可以恰当地选择和运用教学方法,调动学生学习的积极性。
教案要怎么写呢?下面是店铺帮大家整理的气体摩尔体积的教案设计(通用6篇),仅供参考,希望能够帮助到大家。
气体摩尔体积的教案设计篇1教学目标知识目标使学生在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
使学生在理解气体摩尔体积,特别是标准状况下,气体摩尔体积的基础上,掌握有关气体摩尔体积的计算。
能力目标通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
通过有关气体摩尔体积计算的教学,培养学生的计算能力,并了解学科间相关知识的联系。
情感目标通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程中的设问,引导学生科学的思维方法。
教学建议教材分析本节教材在学习了物质的量和摩尔质量概念的基础上,学习气体摩尔体积的概念及有关计算,这样的编排,有利于加深理解、巩固和运用有关概念,特别是深化了对物质的量及其单位的理解。
本节是今后学习有关气态反应物和生成物的化学方程式的计算,以及学习化学反应速率和化学平衡的重要基础。
本节教材首先注意了学科间的联系和学生已有的知识,通过计算得出1mol几种物质的体积,设问:1mol 气态物质的体积是不是也不相同呢?然后介绍气态物质的体积与外界温度、压强的关系,计算出标准状况下1mol气体的体积,引出气体摩尔体积的概念,最后是关于气体摩尔体积概念的计算。
教学建议教法建议1.认真钻研新教材,正确理解气体摩尔体积的概念。
原必修本39页在标准状况下,1mol任何气体所占的体积都约是22.4L,这个体积叫做气体摩尔体积。
认为22.4L/mol就是气体摩尔体积。
新教材52页气体摩尔体积的定义为单位物质的量气体所占的体积叫做气体摩尔体积。
即 Vm=V/n 。
由此可以看出,气体摩尔体积是任意温度和压强下,气体的体积与气体的物质的量之比,而22.4L/mol 是在特定条件(如:0℃,101KPa)下的气体摩尔体积。
1.2.2 气体摩尔体积(同步课件)-高一化学同步精品课堂(沪科版2020必修第一册)

A 没有指明标准状况
×
B
气体摩尔体积既适用于单一气体,也可以是混合气体,只要 符合物质的量为1 mol,且为标准状况下,体积就约为22.4 L
√
C 标准状况下,1 mol任何气体的体积必定是22.4 L
×
D
18 g H2O是1 mol H2O,但22.4 L CO2不一定是1 mol,因为其 条件不确定
V 22.4
mol
③气体的分子数N=n·NA=
V 22.4
·NA
质量
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1
④气体的质量m=n·M=
V 22.4
·M g
二、知识梳理
【问题1】请同学们认真思考并判断正误:
(1)1 mol任何气体的体积都为22.4 L (2)1 mol任何物质在标准状况下所占的体积都为22.4 L (3)标准状况下,1 mol水所占的体积是22.4 L
二、知识梳理
1mol下列气体在00C 1.01×105Pa下的体积
名称 H2 O2 CO2 N2
状态 气体 气体 气体 气体
密 度(g/L) 0.0899 1.429 1.965 1.251
质量(g) 2.016 32.00 44.01 28.02
体积(L)
22.425 22.393 22.397 22.398
特别提示
阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体; 同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”。
0℃、 101k Pa 理解要点: 对象:任何气体包括混合气体
物质的量:1mol
结论 体积约为22.4L
二、知识梳理
气体摩尔体积
气体摩尔体积第二课时教案实用

气体摩尔体积第二课时教案实用一、教学目标1.理解气体摩尔体积的概念。
2.掌握气体摩尔体积的计算方法和应用。
3.能够运用气体摩尔体积的概念解决实际问题。
二、教学重点与难点1.教学重点:气体摩尔体积的概念、计算方法和应用。
2.教学难点:气体摩尔体积的计算方法和应用。
三、教学准备1.教材:《化学》选修4第三章第二节。
2.教学工具:PPT、黑板、粉笔。
四、教学过程1.导入新课通过提问方式引导学生回顾上节课所学的气体摩尔体积的概念,为新课的学习做好铺垫。
2.讲解气体摩尔体积的概念(1)介绍气体摩尔体积的定义:单位物质的量的气体所占的体积。
(2)讲解气体摩尔体积的单位:L/mol。
3.讲解气体摩尔体积的计算方法(1)根据理想气体状态方程PV=nRT,推导出气体摩尔体积的计算公式:V=nRT/P。
(2)讲解气体摩尔体积的计算公式中各物理量的含义及单位。
4.讲解气体摩尔体积的应用(1)计算气体的物质的量。
(2)计算气体的质量。
(3)计算气体的体积。
5.例题讲解(1)讲解例题1:已知某气体的压强为 1.01×10^5Pa,温度为273K,求该气体的摩尔体积。
解:根据气体摩尔体积的计算公式V=nRT/P,代入已知数据,计算得到V=22.4L/mol。
(2)讲解例题2:已知某气体的摩尔体积为22.4L/mol,压强为1.01×10^5Pa,求该气体的温度。
解:根据气体摩尔体积的计算公式V=nRT/P,代入已知数据,计算得到T=273K。
6.练习与讨论(1)让学生独立完成课后练习题,巩固所学知识。
(2)组织学生进行小组讨论,分享解题思路和经验。
(2)引导学生思考如何运用气体摩尔体积的概念解决实际问题。
五、课后作业1.完成课后练习题。
2.收集有关气体摩尔体积的实际应用案例,下节课分享。
六、教学反思1.本节课通过讲解气体摩尔体积的概念、计算方法和应用,使学生掌握了相关知识。
2.通过例题讲解和练习,提高了学生的解题能力。
第一章-第二节-第二课时-《气体摩尔体积》市公开课获奖课件省名师示范课获奖课件

P1 n1 P2 n2
物质旳量之比
(T、V相同)
5. 同温同压下,相同质量旳任何气体旳体
积与其式量 成反比
m VM
PV RT 1
2 (T、P、m相同 )
M VM
2
1
1.同温同压下,相同体积(或分子数或物质旳量)旳下列
气体中,质量最大旳是(C )
(A)氦气 (B)氢气 (C)氧气 (D)氮气
结论
v对象:任何气体
v物质旳量:1mol
体积约占 22.4L
22.4L
(原则情况)
原则情况下旳气体摩尔体积示意图
原则情况下,1mol 任何气体旳体积都约是22.4L 。 原则情况下旳气体摩尔体积Vm≈22.4 L·mol-1 1mol任何气体,能够是单一纯净旳气体,也能够是混合气体。
因为不考虑实际气体旳分子大小,所以全部气体没有差别, 都可看作是相同旳分子。
试计算:原则情况下,0.8molH2和0.4molO2旳混合气旳 体积约为___2_6_._8_8_L____。
(0.8mol+0.4mol)×22.4L·mol-1=26.88L
例一: 在原则情况下, 2 . 2 g CO2 旳体积是多少?
解: n(CO2) =
m [CO2] M[CO2]
2.2g = 44 g ·mol -1 = 0 . 05mol
在相同条件(00C、1.01×105Pa)下,1mol气体旳体积几乎 完全相同,都约为22.4L。
为何相同条件下,1mol不同固体和液体旳体积不同,而1mol不 同气体旳体积几乎相同?物质旳体积与什么原因有关?
经过该视频(影响物质体积旳原因)旳立体展示可让学生更生动形象地了 解影响物质体积旳三个要素,还能让学生深刻地体会到温度和压强对分 子间旳距离旳影响,从而突破这节课旳难点。
高一化学教案气体摩尔体积[第一课时](精选3篇)
](https://img.taocdn.com/s3/m/0e3b8e793868011ca300a6c30c2259010202f307.png)
高一化学教案气体摩尔体积[第一课时](精选3篇)第一篇:气体摩尔体积的概念和计算方法教学目标:1. 了解气体的摩尔体积的概念;2. 掌握气体摩尔体积的计算方法;3. 能够解决与气体摩尔体积相关的计算题目。
教学重点:1. 掌握气体摩尔体积的概念;2. 掌握气体摩尔体积的计算方法。
教学难点:1. 计算气体摩尔体积的相关问题。
教学过程:一、导入与导入教师可以通过展示一个被充满气体的气球引起学生的兴趣,然后提问“为什么气球上的字体可以充满气球呢?”,引导学生思考气体的特点。
二、概念讲解1. 气体摩尔体积的定义:在摩尔数相同的条件下,不同气体的体积相同。
也就是说,1mol气体的体积是一定的,无论是什么气体。
2. 计算方法:气体摩尔体积可以通过将气体的体积除以摩尔数来计算。
三、实例演练1. 例题一:30L的甲烷气体中含有2mol的甲烷,求甲烷气体的摩尔体积。
答案:30L/2mol = 15L/mol2. 例题二:一个容器内有5mol的氨气,体积为50L,求氨气的摩尔体积。
答案:50L/5mol = 10L/mol四、拓展应用1. 通过计算气体摩尔体积,可以进一步计算气体的密度;2. 探究不同气体的摩尔体积是否相同。
五、小结与展望教师对本节课的重点内容进行小结,并展望下节课的教学内容。
第二篇:气体摩尔体积的实验测定方法教学目标:1. 了解气体摩尔体积的实验测定方法;2. 掌握气体摩尔体积的实验计算方法;3. 能够通过实验结果计算气体摩尔体积。
教学重点:1. 掌握气体摩尔体积的实验计算方法;2. 能够通过实验结果计算气体摩尔体积。
教学难点:1. 进行气体摩尔体积实验的操作;2. 分析实验数据并计算气体摩尔体积。
教学过程:一、导入与导入教师可以通过展示实验装置的图示,引起学生的兴趣,然后提问“你们有没有想过如何实验测定气体的摩尔体积呢?”,引导学生思考如何进行实验。
二、概念讲解1. 遵循玻意耳定律:相同条件下,等压下,气体的摩尔体积是恒定的;2. 实验操作:用实验装置装满气体,记录气体的体积和摩尔数,然后计算气体的摩尔体积。
气体摩尔体积教案

气体摩尔体积教案一、教学目标1.了解气体摩尔体积的概念和计算方法;2.掌握气体摩尔体积的实验测量方法;3.培养学生的实验操作能力和数据处理能力。
二、教学内容1. 气体摩尔体积的概念气体摩尔体积是指在标准状态下,1摩尔气体所占的体积。
标准状态是指温度为273.15K(0℃),压强为101.325kPa(1 atm)的状态。
2. 气体摩尔体积的计算方法气体摩尔体积的计算方法为:V m=V n其中,V m为气体摩尔体积,V为气体体积,n为气体的物质量(单位为摩尔)。
3. 气体摩尔体积的实验测量方法实验器材1.烧杯2.水槽3.水银压力计4.气压计5.气球6.气管7.水平尺8.温度计实验步骤1.将气球充满气体,用气管将气体导入烧杯中;2.将烧杯放入水槽中,使其完全浸没在水中;3.用水银压力计测量水面下方的压强;4.用气压计测量气球内气体的压强;5.用水平尺测量水面到烧杯口的距离;6.用温度计测量水温;7.计算气体摩尔体积。
实验数据处理1.计算气体摩尔体积的值;2.计算实验误差。
三、教学重点和难点1. 教学重点1.气体摩尔体积的概念和计算方法;2.气体摩尔体积的实验测量方法。
2. 教学难点1.实验器材的使用方法;2.实验数据的处理方法。
四、教学方法1.讲授法:通过讲解气体摩尔体积的概念和计算方法,让学生了解气体摩尔体积的基本知识;2.实验法:通过实验测量气体摩尔体积,让学生掌握气体摩尔体积的实验测量方法;3.讨论法:通过讨论实验数据的处理方法,让学生掌握数据处理的技巧。
五、教学评价1.实验报告:要求学生撰写实验报告,包括实验目的、实验器材、实验步骤、实验数据、数据处理和结论等内容;2.实验成绩:根据学生的实验操作能力和数据处理能力,给予相应的实验成绩;3.学生反馈:听取学生对教学内容和教学方法的反馈,及时调整教学策略,提高教学效果。
六、教学建议1.教师要注重实验操作的指导,确保实验数据的准确性;2.学生要认真听讲,积极参与实验操作和数据处理,提高实验操作能力和数据处理能力;3.教师要及时反馈学生的实验成绩和学习情况,及时调整教学策略,提高教学效果。
高中化学_【课堂实录】气体摩尔体积教学设计学情分析教材分析课后反思

《气体摩尔体积》教学设计一、教学目标化学课程标准要求:认识摩尔是物质的量的基本单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用。
同时基于以上对教材和学情的分析,设计符合自己学生的三维目标如下:1、知识与技能:①、能说出气体摩尔体积的概念。
②、借助图片演示,能从宏观和微观两个方面理解各因素如何影响气体体积。
③、能进行气体摩尔体积的简单判断和计算。
2、过程与方法:①、通过已有知识的迁移理解气体摩尔体积。
②、当堂巩固练习使学生能学以致用。
③、让学生体验发现问题、分析问题、解决问题的探究性学习的过程。
3、情感、态度与价值观:①激发和培养学生积极投入,循序渐进寻求真理的探究意识。
②培养分析推理能力,渗透透过现象看本质、从特殊到一般认识事物规律等哲学思想。
二、教学重点和难点1.教学重点:气体摩尔体积概念的建立;学生合作探究能力的初步培养。
2.教学难点:影响气体体积的因素在宏观和微观之间的思维转化;学生合作探究能力的初步培养。
三、教学方法和手段1、方法:以问题推进的小组内合作探究式教学2、手段:动画、多媒体等四、教学过程设计请小组合作完成学习探究案中<探究二>,中心发言人准备展示、评价交流成果教师综合评价学生表现板书决定1mol 物质体积的主要微观因素固体 液体 气体 粒子数目 1mol 1mol 1mol粒子大小粒子间距倾听、理解、记笔记动画演示等物质的量的气体体积的决定因素欣赏、体会微观形象化 观察思考1mol 不同气体物质的体积物质状态0 ℃ 101kPa20 ℃ 101kPa0 ℃ 202kPaH 2 气体 22.39L 24.0 L 11.2 LO 2 气体 22.4L 24.0 L 11.2 LCO 2 气体 22.4L 23.9L 11.2L宏观上影响气体体积的因素是什么? 思考并回答。
利用已学的知识解决实际问题,培养学生学习化学的兴趣。
布置任务 请小组合作完成学习探究案中<探究三>,中心发言人准备展示、评价交流成果 交流、讨论、展示、评价。
气体摩尔体积公开课教学课件

1mol硫酸
4
注意啦!有条 件,为什么?
1mol气体物质
1mol下列气体在0 oC、101KPa 下的体积
名称 状态 密 度(g/L) 质量(g) 体积(L)
H 2 气体 0.0899 O2 气体 1.429 CO 2 气体 1.965
2.016 32 44
22.4 22.39 22.39
N 2 气体 1.25 28 22.4 5
(2)标准状况下, 33.6LH 2 的物质的量是
H2
气体
0.0893g/L
22.4L
O2
气体 1.429g/L 22.39L
CO 2
气体 1.965g/L 22.39L
N2
气体
1.25g/L
22.4L 6
结论:
?1. 在相同条件下,1mol气 体所占的体积相同。
?2.在相同条件下,1mol固体 或液体的体积不相同。
7
为什么? ?在相同状况下,为什么
气体摩尔体积(L/mol )
即:n =
V Vm
标准状况下:
n= V
22.4L/mol
24
N,n,m,V之间的相互转化
÷NA
×M
N
n
m
×NA
÷M
×Vm ÷Vm
V
(气体)
25
【例题】在标准状况下, 2.2g CO 2的体积约为多少?
【解】CO2的摩尔质量为 44g/mol 。 2.2gCO2的物质的量为 :
注意解题格式,要标 明粒子的类型,有 必要的文字说明并 带入单位进行计算!
0.05molCO 2在标准状况下的体积为: V(CO2)=n(CO2)·Vm
=0.05mol ×22.4L/mol
气体摩尔体积人教版高二年级化学课堂PPT教辅

例 3.CO 和 CO2 的混合气体 18 g,完全燃烧后测得 CO2 的体积 为 11.2 L(标准状况)。
(1)混合气体中 CO 的质量是
g。
(2)在标准状况下,混合气体中 CO2 的体积是
L。
(3)在标准状况下,混合气体的密度是
g·L-1。
(4)混合气体的平均摩尔质量是
g·mol-1。
[解析] CO 燃烧发生反应:2CO+O2=点==燃==2CO2,CO 的体积
与生成 CO2 的体积相等,燃烧后 CO2 的总体积为 11.2 L,故 18 g CO
和 CO2 的混合气体的总体积为 11.2 L,在标准状况下,18 g CO 和
CO2 的混合气体的物质的量为 0.5 mol,设 CO 的物质的量为 x mol,
【思考】 在相同条件下,微粒数相同的不同固态物质或液态 物质的体积是否相同?
[提示] 不相同。因为固态物质、液态物质体积主要受微粒的数 目和微粒本身的大小不同影响,而不同的固态物质、液态物质的微 粒大小各不相同。
三、 阿伏加德罗定律 1.内容:同温同压下相同体积的任何气体都含有相同数目的微 粒。 2.适用范围:阿伏加德罗定律及其推论仅仅适用于气体,可以 是单一气体,也可以是混合气体,对固体和液体不适用。 3.“三同定一同”规律:同温、同压、同体积、同分子数中只 要有“三同”则必有第“四同”。
(3)2 个数据:“1 mol”“约 22.4 L”。
2.气体摩尔体积的计算
①气体的物质的量 n=VVm。 ②气体的密度 ρ=mV=n·mVm=VMm。 ③气体的微粒数 N=n·NA=VVm·NA。 ④气体的质量 m=n·M=VVm·M。
3.求解气体摩尔质量“五”方法 (1)根据物质的质量(m)和物质的量(n):M=mn 。 (2)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数 (NA):M=NAN·m。
气体摩尔体积的教案

气体摩尔体积的教案气体摩尔体积的教案作为一名专为他人授业解惑的人民教师,时常会需要准备好教案,借助教案可以提高教学质量,收到预期的教学效果。
教案要怎么写呢?以下是小编收集整理的气体摩尔体积的教案,仅供参考,欢迎大家阅读。
第一课时教学目标知识技能:正确理解和掌握气体摩尔体积的概念;初步掌握阿伏加德罗定律的要点,并学会运用该定律进行有关简单推理。
能力培养:培养科学归纳的思维能力,空间想像能力,运用事物规律分析解决问题的逻辑思维能力。
科学思想:引导学生逐步树立“透过现象,抓住本质”的辩证唯物主义认识观点。
科学品质:激发学生严谨务实,循序渐进,探索真理的科学态度。
科学方法:由数据归纳客观规律;由理想模型出发进行逻辑推理。
重点、难点气体摩尔体积概念的逻辑推理过程;阿伏加德罗定律的直观理解。
教学过程教师活动学生活动设计意图【引言】物质都是由原子、分子、离子这些基本微粒构成的。
衡量物质所含微粒数多少用哪个物理量?该物理量的单位是什么?1mol物质含有多少构成它的基本微粒?1mol不同物质所含有的微粒数都相同,它们的体积是否也相同呢?这是本堂课要解决的问题。
【板书】第二节气体摩尔体积回顾上堂课内容,回答:物质的量,摩尔,阿伏加德罗常数个,约为6.02×1023个。
引导学生由旧知识再现进入新的认知过程。
【投影】1mol铁、铝、铅、水、硫酸的质量、密度、体积。
引导学生分析投影数据。
【展示】引导学生看课本42页、43页图2-1和图2-2,并出示1mol铁、铝、铅、水、硫酸实物,引导观察。
分析投影数据,归纳并猜想:1mol不同的固态或液态物质,体积是不相同的。
看课本插图,并观察分析实物,进一步证实上面的猜想。
引导学生从感性、理性两方面认识事物客观规律,培养他们进行科学归纳的能力。
【设问】对于1mol不同的固态和液态物质来说,为什么其体积各不相同?【讲述】物质都是由原子、分子、离子这些微观粒子构成的,在讨论物质所思考,但难以给出合理解释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体体积与分子间的距离
决定物质体积的因素
结论:
1.当粒子数目一定时,固体、液体的体积主
要由粒子本身的大小决定。 2. 相同条件下,当粒子数目一定时,气体物 质的体积主要由微粒间的平均距离决定。
1ቤተ መጻሕፍቲ ባይዱol气体在任何情况下,体积都相等吗
由于压强的增大使得分子间距离减小, 而使气体体积缩小
温度升高,分子间距离增大,而 使气体体积膨胀
1摩尔不同液体物质的体积是否相同?
18.0cm 3 54.1cm 3
6.02× 1023 个原子 18克
6.02× 1023 个原子 98克
1mol H2O
1mol H2SO4
1摩尔不同气体的体积呢?
物质 H2 O2 摩尔质量 (g/mol) 2.016 32.00 密度(g/L) 1摩尔物 0℃,101KPa 质的体积 22.4L 0.0899 1.429
为什么在标准状况下1mol任何气 体所占的体积都相同呢?
标准状况:温度(0℃或273K) 压强(101 325 Pa或1.01×105Pa) 一定量气体的体积取决于气体分子间的平均 距离 同一条件下,气体分子间平均距离几乎相等
一、气体摩尔体积
概念:单位物质的量的气体所占的体积 符号:Vm
思考
同温同压下,体积相同的气体 的物质的量是否相同?所含的 分子个数是否相同?说明理由。
阿伏加德罗定律
在相同的温度和压强下,相同体积的任 何气体都含有相同数目的分子。
同温同压下: V 1
n1 N1 V2 n 2 N 2
注 意
阿伏加德罗定律
适用对象:任何气体 适用条件:同温、同压、同体积 结论:分子数目相同,即气体物质的 量相同。 即:三同、两同
气体摩尔体积
质量
物质的量
÷M
×M ÷ρ
粒子数目
×NA
÷NA
m
×ρ
n
N
V
体积
1 摩尔不同固体的体积是否相同?
18.3cm 3
7.2cm 3
6.02× 10 个原子 56克
23
10cm 3
6.02× 1023 个原子 6.02× 1023 个原子 27克 207克
1mol Fe
1mol Al
1mol Pd
结论 体积约为22.4L
练习:判断正误并说明理由
标况下,1摩尔任何物质的体积都约是22.4L。
1摩尔气体的体积约为22.4L。
标况下,1molO2和N2混合气的体积约为22.4L
22.4L气体所含分子数一定大于11.2L气体所含 分子数。 任何条件下,气体的摩尔体积都是22.4L/mol 只有在标况下,气体的摩尔体积才能是 22.4L/mol
下列说法中,错误的是( B ) A.同温同压下,含有相同分子数的两种气体, 占有相同的体积 B.同温同压下,相同质量的两种任何气体,占 有相同的分子数 C.同温同压下,相同物质的量的两种气体,占 有相同的体积
D.同温同压下,2L O2 和N2的混合气体与2L CO2和CO的混合气体,含有相同的分子数。
V 公式: Vm n
单位: L / mol或m3/mol
在标准状况下,1摩尔任何气体的体积
都约是22.4L,22.4 L / mol是特定条件下 的气体摩尔体积
标准状况下的气体摩尔体积理解要点:
注
意
条件:标准状况(S .T.P) 0℃、 1.01×105 Pa 对象:任何气体 物质的量:1mol
22.4L 22.3L
CO2
44.01
1.977
我们可以得到这样的结论:
1摩尔液体或固体的体积: 不同
相同条件下,1摩尔不同气体的体积:相同
决定物质体积的因素
1.粒子个数
决定物质体积的因素
2.粒子的大小
3.粒子间的距离
固体体积与粒子数
气体体积与粒子数目的关系
固体体积与粒子的大小
气体体积与粒子的大小关系
