化学工业出版社物理化学答案第5章 化学平衡
第5章 化学平衡

5.16在25℃时,若两个反应的平衡常数之比为10,则两个反应的ΔrGm 相差(5.7)kJ·mol-15.17在20℃时,甲醇的蒸汽压为11.83kPa,则甲醇汽化过程的ΔrGm为(5.23)kJ·mol-1。
甲醇在正常沸点时的ΔrGm为(0)kJ·mol-1 5.18在100℃时,反应AB(g)===A(g)+B(g)的平衡常数Kc=0.21mol·dm-3,则标准平衡常数K的值为(6.43)5.19已知环戊烷的汽化过程ΔrHm=28.7kJ·mol-1,ΔrSm=88J·mol-1·K-1.环戊烷的正常沸点为(53.1)℃,在25℃时的饱和蒸汽压为(37.3)kPa5.20对于反应:SO3(g)===SO2(g)+1/2O2(g) ΔrHm=98.7kJ·mol-1 将反应速率常数、反应速率、标准平衡常数K及平衡移动方向等随条件的变化填入下表k正k逆r正r逆K平衡移动方向增加总压不变不变增大增大不变逆向移动升高温度增大增大增大增大增大正向移动加催化剂增大增大增大增大不变不移动5.21已知反应NiSO4·6H2O(s)===NiSO4(s)+6H2O(g)的ΔrGm=77.7kJ·mol-1 ,则平衡时NiSO4·6H2O固体表面上水的蒸气压p(H2O)为(537)Pa5.22反应I2(g)===2I(g)达平衡时:(1)升高温度,平衡常数(增大);原因是(I2解离是吸热反应ΔrHm>0)(2)压缩气体时,I2(g)解离度(减少);原因是(总体积减小,压强增大,平衡向气体粒子数减少的方向移动)(3)恒容时充入N2气体,I2(g)的解离度(不变)原因是(I2(g)和I(g)的分压都不变)(4)恒压时充入N2气体,I2(g)的解离度(增大)原因是(体积变大时,则I2(g)和I(g)的分压同时减小,平衡向粒子数多的方向移动)5.23合成氨反应:N2(g)+3H2(g)===2NH3(g),在673K时,K=5.7*10^-4;在473K时,K=0.61.则873时,K=(1.3*10^-5)。
物理化学核心教程(第二版)思考题习题答案—第5章 化学平衡

第五章 化学平衡一.基本要求1.掌握化学反应等温式的各种形式,并会用来判断反应的方向和限度。
2.了解标准平衡常数的定义,掌握标准平衡常数的各种表示形式和计算方法。
3.掌握标准平衡常数K 与r m G ∆在数值上的联系,熟练用热力学方法计算r m G ∆,从而获得标准平衡常数的数值。
4.了解标准摩尔生成Gibbs 自由能f m G ∆的定义和它的应用。
5.掌握温度对化学平衡的影响,记住van ’t Hoff 公式及其应用。
6.了解压力和惰性气体对化学平衡的影响。
二.把握学习要点的建议把本章放在多组分系统之后的目的,就是要利用多组分系统中介绍的化学势的概念和各种表示方式,来导出化学反应等温式,从而用来判断化学反应的方向与限度。
本章又用到了反应进度的概念,不过其值处在0 1 mol -的区间之内。
因为在利用化学势的表示式来计算反应的Gibbs 自由能的变化值时,是将化学势看作为一个定值,也就是在有限的反应系统中,化学进度为d ξ,如果在一个很大的系统中, 1 mol ξ=。
严格讲,标准平衡常数应该用绝对活度来定义,由于本教材没有介绍绝对活度的概念,所以利用标准态化学势来对标准平衡常数下定义,其含义是一样的。
从标准平衡常数的定义式可知,标准平衡常数与标准化学势一样,都仅是温度的函数,因为压力已指定为标准压力。
对于液相反应系统,标准平衡常数有其相应的形式。
对于复相化学反应,因为纯的凝聚态物质本身就作为标准态,它的化学势就是标准态化学势,已经归入r m G ∆中,所以在计算标准平衡常数时,只与气体物质的压力有关。
学习化学平衡的主要目的是如何判断反应的方向和限度,知道如何计算平衡常数,了解温度、压力和惰性气体对平衡的影响,能找到一个经济合理的反应条件,为科研和工业生产服务。
而不要过多地去考虑各种浓度表示式和各种平衡常数表示式之间的换算,否则会把自己搞糊涂了,反而没抓住主要内容。
由于标准平衡常数与r m G ∆在数值上有联系,r m ln p G RT K ∆=-,所以有了r m G ∆的值,就可以计算p K 的值。
物理化学 第五章 化学平衡

压力商Jp: 前式中的后一项的加和Σ υ BRTln(pB/pθ )可以用 乘积的形式表示: Σ υ BRTln(pB/pθ )=RTΣ υ Bln(pB/pθ ) B B =RTlnП (pB/pθ )υ B B 式中,П (pB/pθ )υ B为各反应物及反应产物的 B (pB/pθ )υ B的连乘积,称为压力商,用Jp表示。
←Δ rGm=(əG/əξ )T,p
0
1
图5.1.1 恒温、恒压下G随ξ 的变化
由图中曲线可以看出,在反应开始即ξ =0时,G 值最大;随着反应的进行,反应系统的G值逐渐 降低。曲线上任一点处的斜率(əG/əξ )T,p代表 在 T、p一定且反应进度为ξ 处的反应Δ rGm: Δ rGm=(əG/əξ )T,p 随着反应的进行,ξ 渐渐增大,曲线斜率的绝对 值渐渐变小。反应达平衡时,Δ rGm=0,即反应系 统的G达到极小。所以,恒温恒压不作非体积功 条件下,化学反应的平衡条件为: Δ rGm=(əG/əξ )T,p=0
代入摩尔反应吉布斯函数的关系式中,可得: Δ rGm=(əG/əξ )T,p=Σ υ Bμ θ B+Σ υ BRTln(pB/pθ ) B B 标准摩尔反应吉布斯函数Δ rGθ m: 上式中Σ υ Bμ θ B为各反应组分均处于标准态 B (pθ =100kPa的纯理想气体)时每摩尔反应进度吉 布斯函数变,以Δ rGθ m表示,称为标准摩尔反应 吉布斯函数,即: Δ rGθ m=Σ υ Bμ θ B
调节Jp改变反应方向和反应产率的局限性: Jp的可调性提供了控制、甚至改变反应方向的可 能性。但是对于Δ rGθ m«0的反应,Kθ »1,反应达 到平衡时反应物的分压几乎为0,因此可以认为 反应能进行到底;而Δ rGθ m»0的反应,Kθ «1,反 应达到平衡时反应产物的分压几乎为0,可以认 为反应不能发生;只有Δ rGθ m接近于0的反应, Kθ 与1相差不太大时,才有可能通过调节Jp来改 变化学反应的方向和影响反应的产率。
物理化学 第五章 相平衡

一、基本概念和公式 (一)几个基本概念 1. 相和相数 (1)相 (phase) 系统内部物理和化学性质完全均匀的部分称为相。 特点 相与相之间在指定条件下有明显的界面, 在界面上宏观性质的改变是飞跃式的。 (2)相数 (number of phase) 系统中相的总数称为相数,用 表示。 气体:
(三)二组分系统的相图及应用
(3) 同时具有最高、最低会溶温度 (4) 不具有会溶温度
(三)二组分系统的相图及应用
4. 不互溶双液系 (1) 特点 如果A,B 两种液体彼此互溶程度极小,以致可忽略 不计。则A与B共存时,各组分的蒸气压与单独存在时一 样,液面上的总蒸气压等于两纯组分饱和蒸气压之和。 * * 即: p pA pB 当两种液体共存时,不管其相对数量如何,其 总蒸气压恒大于任一组分的蒸气压,而沸点则恒低 于任一组分的沸点。 (2) 水蒸气蒸馏
CaF2 ( A)
0 .6
0 .8
1 .0 CaCl2 ( B)
(三)二组分系统的相图及应用
(3) 相合熔点 A和B形成的化合物有确定的熔点,完全熔化时不 分解,在熔点时液相和固相的组成相同,所以稳定化 合物的熔点称为相合熔点。 (4) 不相合熔点 因为C没有自己的熔点,将C加热,到O点温 度时分解成 CaF2 (s) 和组成为B的熔液,所以将O点 的温度称为转熔温度(peritectic temperature)也 叫异成分熔点或不相合熔点。
(四)三组分系统的相图及其应用
(d) 如果代表两个三个组分 系统的D点和E点,混合成新 系统的物系点O必定落在DE 连线上。哪个物系含量多, O点就靠近哪个物系点。 O点的位置可用 杠杆规则求算。
mD OD mE OE
物理化学第5章相平衡

(2) 保持压力不变,得 T-x 图 常用
这三个变量通常是T,p 和组成 x。所以要表示二组分系统状态图,需用三个坐标的立体图表示。
一. 合金体系 1、相图绘制—— 热分析法 §5.7 具有简单低共熔混合物的固液二组分系统 Cd-Bi二元相图
①对拉乌尔定律有较大正偏差:
在T-x图上就有最低点,这最低点称为最低恒沸点
最低恒沸混合物是混合物而不是化合物,它的组成在定压下有定值。
在标准压力下, 的最低恒沸点温度为351.28 K,含乙醇 95.57 。
改变压力,最低恒沸点的温度也改变,它的组成也随之改变。
属于此类的系统有:
5.8 有化合物生成的固液二组分系统
5.4 完全互溶的双液系统
5.2 单组分系统的克-克方程
5.9 三组分系统
5.7 具有简单低共熔混合物的固液二组分系统
5.1 相律
5.3 水的相图
第五章 相平衡
相平衡是热力学在化学领域中的重要应用之一 研究多相系统的平衡在化学、化工的科研和生产中有重要的意义,例如:溶解、蒸馏、重结晶、萃取、提纯及金相分析等方面都要用到相平衡的知识 相律(phase rule);相图(phase diagram)
2、分析相图
区:图上有4个相区 ( 1) AEH线之上, 熔液(l)单相区 (2) ABE之内, Bi(s)+ l 两相区 (3) HEM之内, Cd(s)+ l 两相区 (4)BEM线以下, Bi(s)+Cd(s)两相区
线:有三条多相平衡曲线
(1)ACE线,Bi(s)+熔液 共存时的熔液组成线。
组成为F的气体冷到E
有组成为x1的液体出现
第五章 化学平衡

物理化学电子教案
大部分化学反应可以几乎同时朝正、反两个方 向进行, 在一定条件 (温度, 压力, 浓度)下, 当正反两 个方向的反应速度相等时, 体系就达到了平衡状态, 平衡状态就是反应的限度.
◆平衡后, 体系中各物质的数量按一定的比例关系不再 改变. 一旦外界条件改变, 平衡状态就要发生变化. ◆ 平衡状态从宏观上看是静态,实际上是一种动态平衡. ◆ 实际生产中需要知道: ①如何控制反应条件, 使反应 按人们所需要的方向进行; ②在给定条件下, 反应进行的最 高限度是什么?
θ rGm (T ) RT ln kfθ
rGm RT ln kfθ RT ln Qf
对理想气体反应:
则有:
Qf Qp
θ p
θ kfθ kp
rGm RT ln k RT ln Qp
第五章 化学平衡
物理化学电子教案
用化学反应等温式判断反应方向
化学反应等温式也可表示为:
物理化学电子教案
fG θ ) h ( H RT ln θ p fD θ θ [d ( D RT ln θ ) e( E RT ln p
fH ) ] θ p fE ) ] θ p
θ θ θ θ [( gG hH ) (d D eE )]
只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故。
第五章 化学平衡
物理化学电子教案
如反应 D E 2F 为例,在反应过程中Gibbs自 由能随反应过程的变化如图所示。 R点,D和E未混合时Gibbs 自由能之和;
P点,D和E混合后Gibbs自 由能之和;
1 0
物理化学 第5章 相平衡

2、三条两相平衡线, φ=2 , f =1 ,压力与温度只能 改变一个,指定了压力,则温度随之而定。 OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点 T 647 K , p 2.2107 Pa ,这时气-液界面消失。 高于临界温度,不能用加压的方法 使气体液化。 OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。 OC 是液-固两相平衡线,当C点延长至压力大于 2 108 Pa 时,相图变得复杂,有不同结构的冰生成。
OD 是AO的延长线,是过冷水和水蒸气的介稳平衡 线。因为在相同温度下,过冷水的蒸气压大于冰的蒸 气压,所以OD线在OB线之上。过冷水处于不稳定状 态,一旦有凝聚中心出现,就立即全部变成冰。 3、一个三相点 (triple point), O点 是气-液-固三 相共存点, φ=3,f=0 三相 点的温度和压力皆由系统自 定。
dp S m dT Vm
由于 因此:
H m S m T dp H m dT T Vm
克拉佩龙方程
适用于纯物质的任意两相平衡
(1)对气-液两相平衡
dp H m dT T Vm
RT Vm Vg Vl Vg p
d ln p vap H m 2 dT RT
T T TF
(2)压力平衡条件:达到平衡时各相的压力相等
p p pF
(3) 相平衡条件: 任一物质B在各相中的化学 势相等,相变达到平衡
物理化学04-第五章化学平衡

仅是T的函数
( pG / p ) ( pH / p ) 常数 K a b ( p A / p ) ( pB / p )
Kө标准平衡常数
无量纲
令
gG hH a A bB r Gm
g h
( pG / p ) ( pH / p ) 1 ln ( g h a b G H A B) a b ( p A / p ) ( pB / p ) RT
3. 化学反应的平衡常数和等温方程P347
理气化学反应: aA(g)+bB(g)=gG(g)+hH(g) 平衡时
(产物) (反应物)
i i i i
gG+hH=aA+bB 理气混合物中某一组分的化学势:
B B RT ln(PB / P )
g[ G RT ln( pG / p )] h[ H RT ln( pH / p )] a[ A RT ln( p A / p )] b[ B RT ln( pB / p )]
纯物质:GB=μ*B
G nA A nB (*:纯态) * * (1 ) A B
* * * B
A ( A )
* * B *
但是实际上A、B是混合在一起的,因此还要考虑混合 过程对系统吉布斯自由能的影响
mixG RT (nA ln xA nB ln xB )
平衡常数还有其他的表示形式,反应达平衡时,用反 应物和生成物的实际压力、摩尔分数或浓度代入计算, 得到的平衡常数称为经验平衡常数。 一. 气相反应(理想气体) aA+bB=gG+hH
物理化学课程讲义-第五章1

(b)
热力学基本方程
这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 µ B保持不变。
公式(a)表示有限体系中发生微小的变化; 公式(b)表示在大量的体系中发生了反应进度等于1 mol的变化。这时各物质的浓度基本不变,化学势也 保持不变。
化学反应的方向与限度
物理化学课程讲义
—— 第五章 化学平衡
化学反应体系
化学反应体系:封闭的单相体系,不作非膨胀功, 发生了一个化学反应,设为:
dD + eE + ⋅ ⋅ ⋅ → fF + gG + ⋅ ⋅ ⋅
各物质的变化量必须满足:
0 = ∑ν B B
B
根据反应进度的定义,可以得到:
dξ =
dn B
νB
dnB = ν Bdξ
$ m $ f
下标 m 表示反应进度为 1 mol 时的标准Gibbs自 由能的变化值。显然,化学反应方程中计量系数呈 ∆ $ 倍数关系, r Gm (T ) 的值也呈倍数关系,而 K $ 值则 f 呈指数的关系。 例如: (1) H 2 (g) + I 2 (g) = HI(g) ∆ r G
1 2 1 2
$ $ 对吸热反应, ∆ r H m > 0 ,升高温度, K p 增加, 对正反应有利。
$ ∆r H m < 0 对放热反应,
K $ 降低, ,升高温度, p
对正反应不利。
温度对化学平衡的影响
$ ∆ r H m 可视为常数,得定积分式为: 若温度区间不大,
∆r H 1 1 ln $ = ( − ) R T1 T2 K p (T1 ) K $ (T2 ) p
物理化学05章_相平衡5-6

CuCl2 KCl
FeCl3 H2 O 的4种水合物
Mn(NO3 )2 H2O 的2种水合物
0.6
0.8
wCd
1 Cd
纯Bi的步冷曲线
T /K 546
a
A
f * 1 2. 冷至A点,固体Bi开始析出 * f 0 * f * 1
1. 加热到a点,Bi全部熔化 Φ 1 f * C 1 Φ 1 温度可以下降
Φ 2 f C 1 Φ 0 温度不能改变,为Bi熔点 Φ 1
453
单相
E点:水在苯胺中 的饱和溶解度 温度升高,互溶程 度增加
T/K
D点:苯胺在水中 的饱和溶解度
TB
B
等压
373
A'
An
A"
T1
两相
C 313 D 0.2 0.4 0.6 0 质量分数 H2 O
1.0 0.8 C6 H5 NH2
E
B点水与苯胺完全互溶
H2 O-C6 H5 NH2的溶解度图
TB 是最高会溶温度
帽形区内两相共存
DB线是苯胺在水 中的溶解度曲线
453
单相
T/K
EB线是水在苯胺中 的溶解度曲线
在
TB
B
等压
373
A'
T1 温度作水平线
两相
An
A"
T1
交点 A' A " 称为 共轭配对点
C 313 D 0.2 0.4 0.6 0 质量分数 H2 O
1.0 0.8 C6 H5 NH2
E
A n 是共轭层组成的平均值
具有会溶温度。
不互溶的双液系——蒸气蒸馏
第5章化学平衡
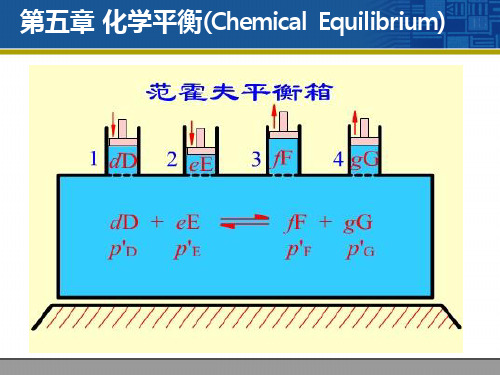
1
第五章 化学平衡(Chemical Equilibrium)
热力学在物理化学中两个重要的应用:相平衡、 化学平衡。
所有的化学反应可同时向正反两个方向进行。在 一定条件下,当正反两个方向的反应速率相等时, 就达到了平衡状态(有些反应逆向程度很小,可忽 略,称为单向反应) 。
• ΔrGm0 f (T ) • ΔrG与m Δ均rG与m0 化学反应写法有关
②等温方程应用于平衡态: ΔrGm 0
③等温方程应用于标准态:ΔrG=m ΔrGm0
15
2.理气反应的标准平衡常数(Standard Equilibrium Constant)
恒温恒压理想气体反应的等温方程:
ΔrGm ΔrGm0 RT ln J P
9
2.化学反应的方向与平衡条件
1)判据
r Gm
用(
G
)
T
判断:相当于
,p
A
G
T
,P
G ~ 图 上曲线的斜率。
G
(
)T , p
0
反应自发向右进 行,趋向平衡;
(
G
)T
,
p
0
反应自发向左进 行,趋向平衡。
G
( )T , p
0
反应达到平衡;
10
2.化学反应的方向与平衡条件
2)化学反应的限度(平衡条件) 化学反应的平衡条件是?
解决方法:将上式转变为用T , p等, y宏观
可测量表示的公式,达到便于使用的目的。
12
1.理想气体反应的等温方程(Isothermal Equation)
•对于理想气体反应 0 B B( g)
物理化学《化学平衡》习题及答案

物理化学《化学平衡》习题及答案选择题1.下面的叙述中违背平衡移动原理的是(A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动(C) 加入惰性气体平衡向总压力减少的方向移动 (D) 降低压力平衡向增加分子数的方向移动答案:C 。
加入惰性气体平衡向总压力增大的方向移动2.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是(A) 温度和内能都不变 (B) 内能和体积都不变 (C) 孤立系统 (D) 内能, 压力与体积的乘积都不变答案:D 。
因ΔH =ΔU +Δ(pV )3.在等温等压下,当反应的∆r G m ∃ = 5kJ ·mol -1时,该反应能否进行?(A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行答案:C 。
应该用∆r G m 判断而不是∆r G m ∃ 。
4.已知反应 2NH 3 = N 2 + 3H 2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为: (A) 4 (B) 0.5 (C) 2 (D) 1 答案:C 。
5.反应 2C(s) + O 2(g) ←→ 2CO(g),其∆r G m ∃ /(J ·mol -1) = -232600 - 167.7T /K ,若温度升高,则:(A) ∆r G m ∃ 变负,反应更完全 (B) K p ∃ 变大,反应更完全 (C) K p ∃ 变小,反应更不完全 (D )无法判断 答案:C6.对于气相反应,当体系总压力p 变化时(A) 对K f ∃ 无影响 (B) 对K r 无影响 (C) 对K p ∃ 无影响 (D) 对K f ∃ 、K r 、K p ∃ 均无影响答案:A 。
理想气体的K p ∃ 不受压力的影响而真实气体的K p ∃ 将随压力而变。
7.理想气体反应CO(g)+2H 2(g) = CH 3OH(g)的∆r G m ∃与温度T 的关系为:∆r G m ∃ = -21660+52.92T ,若要使反应的平衡常数K p ∃ >1,则应控制的反应温度: (A) 必须低于409.3℃ (B) 必须高于409.3K (C) 必须低于409.3K (D) 必须等于409.3K 答案:C8.某化学反应在298K 时的标准吉布斯自由能变化为负值,则该温度时反应的K p ∃将是: (A)K p ∃= 0 (B) K p ∃ < 0 (C) K p Θ > 1 (D) 0 < K p ∃ < 1 答案:C 。
第五章 物理化学 化学平衡-1

dG = BBd 在恒T、p下两边同时除以d,有:
G
ξ T,p
B
νB μB ΔrGm
G
ξ
T, p
——一定温度、压力和组成的条件下,反应进行了
d 的微量进度折合成每摩尔进度时所引起系统吉布
斯函数的变化;
B
pB p
RT ln
B
pB p
νB
RT ln
B
pB p
νB
其中的
B
pB p
νB
是反应物及产物的
pB p
νB
的连乘积。
因为反应物计量系数 vB 为负,产物计量系数vB 为正,所以它
的形式是
将此式代入 ΔrGm νB μB 得到:
B
ΔrGm
B
νB μB RT
B
νBln
pB p
5.2.1
7
式中第一项 νB μB 为该化学反应在温度 T 下的标准摩尔吉
B
布斯函数: ΔrGm νB μB 5.2.1 它仅是温度的函数。
B
而第二项为:RT νBln
1. 摩尔反应吉布斯函数
恒T、p且W′= 0时,一化学反应的进度为d 时,有:
a A + b B == yY + z Z
化学势:
A
B
Y
Z
微小反应: - dnA - dnB
dnY
dnZ
dG = YdnY + ZdnZ - AdnA - BdnB = Yyd + Zzd - Aad - Bbd = ( yY + zZ - aA - bB )d
物理化学-第五章-化学平衡
( g )
3. 增加反应物的量对平衡移动的影响
aA bB yY zZ 恒温恒容条件下增加反应物量对反应平衡的影响:
在已达到平衡的系统中,加入反应物A,瞬间A的分压增加,其他组分分压不变,结果Jp减小, 温度一定,Kϴ不变,反应右移。 恒温恒压条件下增加反应物量并不总是使平衡右移: 当起始反应物配比1:1时,平衡后加入反应物,会使平衡左移。
Kθ的实验测定和平衡组成的计算
Kθ的计算 1. Kθ可由热力学计算得到,由△rGθm=-RTlnKθ计算 2. Kθ 可由实验测定得到,由平衡时Kθ= ∏(PB/Pθ)vB( 理想气 体)可得
平衡组成的特点
1. 反应条件不变,平衡组成不变 2. 一定温度下,正向与逆向反应平衡组成算出的Kθ应一致 3. 温度不变,改变原料配比所得的Kθ应相同
注意:溶剂A和溶质B的标准态不同。
A
B
B
(r b
B
B B
/ b )B
习题
五氯化磷分解反应 在200℃时的Kθ =0.312,计算: (1)200℃、200kPa下PCl5的离解度; ( 2 )组成 1 ∶ 5 的 PCl5 与 Cl2 的混合物,在 200 ℃ 、 101.325kPa下PCl5的离解度。
上式中△rHθ m=∑vB△fHθ m,B=-∑vB△cHθ m,B,△rSθ m=∑vBSθ m,B (2)通过△fGθ m来计算△rGθ m
△rGθ m=∑vB△fGθ m
(3)由相关线性反应计算,如果一个反应可由其他反应线 性组合得到,那么该反应的△rGm也可由相应反应的△rGm线
性组合得到
如 (3)=(1)+ 2*(2),那么 △rGθ m,3=△rGθ m,1+2△rGθ m,2
物理化学第五章化学平衡小结 (2)

第四章 化学平衡核心内容: 恒T 、p 、W ˊ=0下,化学反应自发0,,><=∆∑='B B W p T G μν平衡 反向自发主要内容:化学反应△G、K的计算及过程方向的判断。
一、内容提要1、化学反应自发进行与达到平衡的条件自发0,,><=∆∑='B B W p T G μν 平衡反向自发其中,B ν为B 的化学计量数,对于产物B ν取正值,对于反应物B ν取负值。
2、理想气体化学反应的等温方程(分压的影响)与反应方向的具体判据P m r m r Q RT G G ln +∆=∆θθp Q RT K RT ln ln +-=θθK Q RT pln= <0 自发 (Q p<θK )=0 平衡 (Q p=θK ) >0 反向自发(Qp>θK )式中:θθμνB B m r G ∑=∆为标准摩尔反应吉布斯函数变化,θK 为标准平衡常数,)ex p(RT G K mr θθ∆-==B p p eqB Bνθ)(∏=f(T)3、理想气体化学反应平衡常数的其她表示法及其相互关系除了标准平衡常数外,实际应用中常用经验平衡常数KP 、K C 、K n 、K y(1)K P :θK =∑∏=∏-BB B p p p p eq B BeqB B νθννθ)()()(θK =∑-B p K P νθ)( θK 仅就是温度的函数,K P 也只与温度有关。
(2)KC :理想气体PB V=n B RT pB=RT c RT Vn B B= θK =∑∏=∏=∏BB B B pRT c p RT c p p B B B B eqB B νθννθνθ)()()( ∑=BpRT K K C νθθ)( KC 也只与温度有关(3)K y:p B=py B=θK∑∏=∏=∏B BB B pp y p y p p p B B B B eqB B νθννθνθ)()()( ∑=Bpp K K y νθθ)(总K y 与温度与总压有关(4)K n :∑=BB BB n n pp =θK BB BB BeqB Bn npp pp ννθυθ)()()(∑∏=∏=∑∑B npp K n νθ)(K n 与温度、总压与惰性气体有关。
化学平衡习题解答

第5章化学平衡习题解答1.有理想气体反应2SO 2(g )+O 2(g )⇌2SO 3(g ),在1000K 时 K =3.45。
试计算SO 2(g )、O 2(g )和SO 3(g )的分压分别为2.03×104Pa 、1.01×104Pa ,和1.01×105Pa 的混合气中,发生上述反应的m r G ∆,并判断反应进行的方向。
若SO 2(g )和O 2(g )的分压仍分别为 2.03×104Pa 及1.01×104Pa ,未使反应正向进行,SO 3的分压最大不得超过多少?解:pp m r m r J RT K RT J RT G G ln ln ln +-=+∆=∆ 45.2121.41.101001.103.210101.1)101/1001.1()101/1003.2()101/1001.1(]/[]/[]/[425254254255)(O 2)(SO 2)(SO 223==⨯⨯⨯⨯=⨯⨯⨯⨯⨯⨯=⋅=p p p p p p J g g g p kJ 85.245.345.2ln1000314.8ln -=⨯==∆K J RT G p m r 45.3)101/1001.1()101/1003.2()101/(]/[]/[]/[5425425(g)SO )(O 2)(SO 2)(SO 3223=⨯⨯⨯⨯⨯=⋅=p p p p p p p K g g g8242(g)SO 10436.1101.0)1003.2(45.3)(3⨯=⨯⨯⨯=p Pa10198.110436.148(g)SO 3⨯=⨯=p [答:3.56×104J·mol -1;1.19×104Pa]2.合成氨反应为3H 2(g )+N 2(g )⇌2NH 3(g ),所用反应物氢气和氮气的摩尔比为3:1,在673K 和1000kPa 压力下达成平衡,平衡产物中氨的摩尔分数为0.0385。
物理化学第五章 化学平衡

K
J
eq p
p / p eq B(g)
vB( g )
B
举例: 碳酸钙的分解反应
CaCO3 (s) CaO(s) CO2 (g) K p(CO2 ) / p
p(CO2): CO2的平衡压力,亦称碳酸钙的分解压力 分解压力越小,稳定性越高
分解温度 pgeq pamb
如果产生的气体不止一种,则所有气体压力的总和
4. Ag可能受到H2S(理想气体)的腐蚀而发生如下反应: H2S(g) +2Ag(s)==Ag2S(s) +H2(g)
今在298K、100kPa下,将Ag放在等体积的H2和H2S组 成的混合气体中。 试问⑴Ag是否可能发生腐蚀而生成Ag2S?
⑵在混合气体中,H2S的百分数低于多少才不致发 生腐蚀?
§5.1 化学反应的方向及平衡条件
化学反应通常发生在多相多组分系统中
化学反应 0 vB B
B
dG SdT Vdp B ()dnB () B
恒T、恒p,W’=0
dG B ()dnB () B[ dnB ( )] BdnB
B
B
B
相平衡 B () B ( ) ... B
反应进度
rGm <0,故在该条件下,Ag能被腐蚀而生成Ag2S
比较KΘ和Jp的大小判断: rGΘm = –RTln KΘ = fGΘ(Ag2S,s) - fGΘ(H2S,g)
则 ln KΘ =(– 40.25+32.93)×10-3/( – 8.315×298.2)
= 2.953 KΘ = 19.15 而 Jp=1 ∴ Jp <KΘ , rGm<0,正向反应自发,即Ag能被腐 蚀而生成Ag2S。
vB
物理化学第五章相平衡练习题及答案

第五章相平衡练习题一、判断题:1.在一个给定的系统中,物种数可以因分析问题的角度的不同而不同,但独立组分数是一个确定的数。
2.单组分系统的物种数一定等于1。
3.自由度就是可以独立变化的变量。
4.相图中的点都是代表系统状态的点。
5.恒定压力下,根据相律得出某一系统的f = l,则该系统的温度就有一个唯一确定的值。
6.单组分系统的相图中两相平衡线都可以用克拉贝龙方程定量描述。
7.根据二元液系的p~x图可以准确地判断该系统的液相是否是理想液体混合物。
8.在相图中总可以利用杠杆规则计算两相平畅时两相的相对的量。
9.杠杆规则只适用于T~x图的两相平衡区。
10.对于二元互溶液系,通过精馏方法总可以得到两个纯组分。
11.二元液系中,若A组分对拉乌尔定律产生正偏差,那么B组分必定对拉乌尔定律产生负偏差。
12.恒沸物的组成不变。
13.若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A的摩尔分数成正比。
14.在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
15.三组分系统最多同时存在5个相。
二、单选题:1.H2O、K+、Na+、Cl- 、I- 体系的组分数是:(A) K = 3 ;(B) K = 5 ;(C) K = 4 ;(D) K = 2 。
2.克劳修斯-克拉伯龙方程导出中,忽略了液态体积。
此方程使用时,对体系所处的温度要求:(A) 大于临界温度;(B) 在三相点与沸点之间;(C) 在三相点与临界温度之间;(D) 小于沸点温度。
3.单组分固-液两相平衡的p~T曲线如图所示,则:(A) V m(l) = V m(s) ;(B) V m(l)>V m(s) ;(C) V m(l)<V m(s) ;(D) 无法确定。
4.蒸汽冷凝为液体时所放出的潜热,可用来:(A) 可使体系对环境做有用功;(B) 可使环境对体系做有用功;(C) 不能做有用功;(D) 不能判定。
5.压力升高时,单组分体系的熔点将如何变化:(A) 升高;(B) 降低;(C) 不变;(D) 不一定。
(物理化学)第五章-化学平衡概念题

第五章 化学平衡基本概念题 一、填空题。
在题中“____”处填上答案。
1、723 ℃时反应 Fe(s) + CO 2(g) == FeO(s) +CO(g) 的K =1.82,若气相y (CO 2)=0.65,y (CO)=0.35,则反应将⎽⎽⎽⎽。
(选填向左进行、向右进行、达到平衡)2、反应 2C(石墨)+O 2(g) == 2CO(g) 在温度为T 时的标准平衡常数为 K ,则同温度下CO(g)的标准摩尔生成吉布斯函数∆r G = 。
3、写出反应的摩尔吉布斯函数的定义式: ;写出化学反应等温方程式: 。
4、已知25 ℃时反应 CO(g) + H 2O(g) == CO 2(g) + H 2(g)的∆r G =-28.49 kJ ·mol -1,则反应的K = 。
5、反应C (s) + H 2O (g) == CO (g) + H 2(g),在400 ℃时达到平衡,∆r H = 133.5 kJ ·mol -1,为使平衡向右移动,可采取的措施有(1)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽;(2) ⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽;(3)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽;(4)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽;(5)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
6、在25 ℃时,气相反应A + B = 2C + D,当达到平衡时,p K θC K θ(填<,= 或 > )。
二、是非题。
在题后括号内,正确的打“√”,错误的打“×”。
1、当一个化学反应处于平衡状态时,反应的标准摩尔吉布斯函数∆r G =0。
是不是?( )2、由∆r G =-RT ln K ,因为K 是平衡常数,所以∆r G 是化学反应达到平衡时的摩尔吉布斯函数变化值。
是不是?( )3、化学反应:nA = A n 和1/2nA = 1/2A n 的平衡常数分别为p K θ(1)和p K θ(2),它们之间的关系为p K θ(1)=1/2p K θ(2)是不是?( )4、压力商的表达式为'B B B B J p p ννθθ∑=∏⋅,是不是?( ) 三、选择题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第5章 化学平衡5.1. 反应)()()()(222g CO g H g O H g CO +=+的标准平衡常数与温度关系为216.2/2150lg −=T K K P θ,当CO(g),H 2O(g),H 2(g),CO 2(g)的起初组成的质量分数分别为0.30,0.30,0.20和0.20时,总压为100.00kPa 时,问在什么温度以下(或以上)反应才能向生产产物的方向进行?解:要使反应向生成物的方向进行,必须使0<∆m r G ,即0ln ln <+−=∆P Op m r Q RT K RT G Op P K Q ln ln <已知CO(g),H 2O(g),H 2(g),CO 2(g)的起初组成的质量分数分别为0.30,0.30,0.20和0.20 则相应的摩尔分数分别为0.25,0.40,0.24和0.11,所以216.22150)40.025.011.024.0lg(−<××TK解得T<1313K5.2. 373K 时,)()()()(222323g O H g CO s CO Na s NaHCO ++=反应的231.0=θP K(1)在0.01m 3的抽空容器中,放入0.1molNa 2CO 3(s),并通入0.2mol )(2g O H ,问最少需通入物质的量为多少的)(2g CO ,才能使Na 2CO 3(s)全部转为)(3s NaHCO ?(2)在373K ,总压为101.325kPa,要在)()(22g O H g CO 和的混合气体中干燥潮湿的)(3s NaHCO ,问混合气体中)(2g O H 的分压应为多少才不致)(3s NaHCO 分解?解:(1)欲使Na 2CO 3(s)全部转变为)(3s NaHCO ,应满足Op P K Q >即2)100000(231.0(2Pa P VnRTO H ×>×,式中O H P 2为剩余0.1mol )(2g O H 的分压,n 为使)(3s NaHCO 不分解需通入)(2g CO 的物质的量。
解得mol n 24.0>故最少需通入)(2g CO 的物质的量为mol mol 34.024.01.0=)(+(2)设混合气体中)(2g O H 的分压为O H P 2时才不致使)(3s NaHCO 分解,当生成的)(3s NaHCO 与)()(22g O H g CO 和处于平衡时,有Op P K Q =即2)100000(231.0)101325(2222Pa P Pa P P P O H O H CO O H ×=−×=×解得 KPa P O H 6.342=5.3. 反应)()(2)(42g CH g H s C =+的129.19)1000(−⋅=∆mol KJ K G m r θ,若参加反应的气体的摩尔分数分别为1.0)(,8.0)(,1.0)(224===N x H x CH x ,试问在1000K 和100kPa 压力下,能否有)(4g CH 生成?解:P Om r m r Q RT G G ln +∆=∆1563.0)(64.0)(1.022224==O O H CH P P P P P Q =4.38591563.0ln 1000314.8192901111>⋅=××⋅⋅+⋅=∆−−−−mol J K K mol J mol J G m r所以不可能有)(4g CH 生成5.4.在723K 时,将0.10molH 2(g)和0.20mol )(2g CO 通入抽空的瓶中,发生如下反应:)()()()(222g CO g O H g CO g H +=+ (1)平衡后瓶中总压力为50.66 kPa,经分析知其中水蒸气的摩尔分数为0.10,今在容器中加入过量的)()(s Co s CoO 和,在容器中又增加了如下两个平衡:)()()()(22g O H s Co g H s CoO +=+ (2) )()()()(2g CO s Co g CO s CoO +=+ (3)经分析知容器中水蒸气的摩尔分数为0.30,计算这三个反应用摩尔分数表示的平衡常数。
解: )()()()(222g CO g O H g CO g H +=+ 平衡 α-1.0 α-2.0 α αα为平衡时CO 的物质的量,n 总=0.30molmol mol x n O H 03.01.030.02=×=×总=α22110563.730.020.030.010.0)30.0(−×=−×−=αααK在反应(1)和反应(2)中,若用去一份H 2(g)就生成一份H 2O(g),在反应(1)和反应(3)中,一份 CO 2对应一份CO ,系统中总的物质的量不变,n 总=0.30molmol mol O H 09.03.030.02=×=αmol mol mol H 01.009.01.02=−=α901.009.022222====HO H H O H P P K αα因为(3)=(2)-(1) 所以11907563.09123===K K K5.5. 在870K 和100kPa ,下列反应达到平衡:)()()()(222g CO g H g CO g O H +=+。
若将压力从100kPa 提高到50000kPa ,问:(1)各气体仍作为理想气体处理,其标准平衡常数有无变化?(2)若各气体的逸度因子分别为77.0,23.1,10.1,09.1222====O H CO H CO γγγγ,则平衡应向何方移动?解:(1)对理想气体有0ln (=∂∂T O PP K , 0)ln (=∂∂T OC PKPP K B BT P∑−=∂∂υ)ln (因为该反应的∑=0B υ,故0)ln (=∂∂T PPK ,即增加或减小压力对平衡无影响。
(2) OH CO HCO OPOP Of K K K K 222γγγγγ== 因为O H CO H CO 222γγγγ> 所以1>γK又因为Of K 只是温度的函数,在一定温度下有定值,而1>γK ,当压力从P O 增加到500P O时,O P K 必然减小,因为x O x OPK PP K K BB =∑=ν(,所以x K 下降,平衡向左移动。
5.6. 25℃,金刚石和石墨的标准生成焓,标准熵和密度如下:1./−∆mol kJ H m f θ11../−−K mol J S m θ3./−cm g ρ金刚石 1.90 2.439 3.513 石墨0 5.694 2.260求在 25℃时,金刚石和石墨的平衡压力。
解:190.1−⋅−=∆mol KJ H m r θ,11255.3−−⋅⋅=∆K mol J S m r θ,187.2−⋅−=∆mol KJ G m r θ,13610894.1−−⋅×=∆mol m V m m T m r V PG ∆=∂∆∂)(平衡时:0=∆m r G ,即O m Om r m r P V G G P −∆∆−∆=]/)[( KPa P 61052.1×=5.7.已知下列氧化物的θm f G ∆与温度的关系为12)/48.74103849()(−⋅+×−=∆mol J K T MnO G m f θ12)/89.83101163()(−⋅−×−=∆mol J K T CO G m f θ122103954)(−⋅×−=∆mol J CO G m f θ(1)计算说明在0.133Pa 的真空条件下,用碳粉还原固态MnO 生成纯Mn 及)(g CO 的最低还原温度是多少?(2)在(1)的条件下,用计算说明还原反应能否按下列方程式进行:)()(2)()(22g CO s Mn s C s MnO +=+解:(1) 还原反应为MnO(S) + C(S) = Mn(S) + CO(g)12)/37.158102686(),(),(−⋅−×=∆−∆=∆mol J K T s MnO G g CO G G m f m f m r θθθ12)/86.270102686()ln(ln −⋅−×=+∆=+∆=∆mol J K T PP RT G Q RT G G O COm r P m r m r θθ在最低还原温度时,0=∆m r G ,由此可得T=992K(2)122)/96.148103744(),(2),(−⋅−×=∆−∆=∆mol J K T s MnO G g CO G G m f m f m r θθθ01004.115ln(132>⋅×=+∆=∆−mol J PP RT G G OCO m r m r θ故在该条件下,还原反应不可能按照(2) 式进行。
5.8.已知)(2g Br 的191.30−⋅=∆mol KJ H m f θ,111.3−⋅=∆mol KJ G m f θ。
设θm r H ∆不随温度而改变,计算(1) )(2l Br 在298K 时的饱和蒸汽压; (2) )(2l Br 在323K 时的饱和蒸汽压; (3) )(2l Br 在100KPa 时的沸点;解:)()(22g Br l Br ⇔(1) ln()298(ln )298(2OBr OP m PP RT K K RT K G −=−=∆θ2553.1)298,,()298()ln(22−=∆−=∆−=RT K g Br G RT K G PP Om f Om O Br285.02=OBr PP , KPa P Br 5.282=(2)9656.0)32312981(314.830910)32312981()298()323(ln 111=−⋅⋅⋅=−∆=−−−K K K mol J mol J K K R H K K K K Om r O P O P626.2)298()323(=K K K K O P OP 7485.0)323(=K K OP KPa P Br 85.742=(3)沸腾时,OBr P P =2,即1)(=T K OP ,则)29811()()298(lnKT R H T K K K b Om r OP OP −∆=)29811(314.830910285.0ln 111KT K mol J mol J b −⋅⋅⋅=−−− K T b 3.331=5.9.设在某一温度下,有一定量的)(5g PCl 在100kPa 压力下的体积为1dm 3,在该条件下)(5g PCl 的解离度5.0=α。
