物理化学_周亚平_天津大学第四版_课后答桉
物理化学天津大学第四版答案

物理化学天津大学第四版答案【篇一:5.天津大学《物理化学》第四版_习题及解答】ass=txt>目录第一章气体的pvt性质 ....................................................................................................... (2)第二章热力学第一定律 ....................................................................................................... . (6)第三章热力学第二定律 ....................................................................................................... .. (24)第四章多组分系统热力学 ....................................................................................................... . (51)第五章化学平衡 ....................................................................................................... .. (66)第六章相平衡 ....................................................................................................... (76)第七章电化学 ....................................................................................................... (85)第八章量子力学基础 ....................................................................................................... . (107)第九章统计热力学初步 ....................................................................................................... ...... 111 第十一章化学动力学 ....................................................................................................... . (117)第一章气体的pvt性质1.1 物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
物理化学(天津大学第四版)课后答案 第六章 相平衡

0 1.08 1.79 2.65 2.89 2.91 3.09 3.13 3.17 (1) 画出完整的压力-组成图(包括蒸气分压及总压,液相线及气相线);
(2) 组成为
的系统在平衡压力
下,气-液两相平衡,求
课 后 答 案 网
平衡时气相组成 及液相组成 。
(3) 上述系统 5 mol,在
课 后 答 案 网
(3) 某组成为 (含 CCl4 的摩尔分数)的 H2O-CCl4 气体混合物在 101.325 kPa 下恒压冷却到 80 °C 时,开始凝结出液体水,求此混合气体的组成; (4) 上述气体混合物继续冷却至 70 °C 时,气相组成如何; (5) 上述气体混合物冷却到多少度时,CCl4 也凝结成液体,此时气相组成如
(5) 上述气体混合物继续冷却至 66.53 °C 时,CCl4 也凝结成液 体(共沸),此时 H2O 和 CCl4 的分压分别为 26.818 kPa 和 74.507 kPa,因此
课 后 答 案 网
6.12 A–B二组分液态部分互溶系统的液-固平衡相图如附图,试指出各个相区
(2) 当温度由共沸点刚有上升趋势时,系统处于相平衡时存在哪 些相?其质量各为多少?
解:相图见图(6.7.2)。(1)温度刚要达到共沸点时系 统中尚无气相存在,
课 后 答 案 网
只存在两个共轭液相。系统代表点为
。
根据杠
杆原理
(2)当温度由共沸点刚有上升趋势时,L2 消失,气相和 L1 共存,因此
何? (2)外压 101.325 kPa 下的共沸点为 66.53 °C。 (3)开始凝结出液体水时,气相中 H2O 的分压为 43.37 °C,因此
(4) 上述气体混合物继续冷却至 70 °C 时,水的饱和蒸气压,即水在气相中 的分压,为 31.16 kPa,CCl4 的分压为 101.325 – 31.36 = 70.165 kPa,没有达 到 CCl4 的饱和蒸气压,CCl4 没有冷凝,故
《物理化学》习题答案(天大第四版)

3.6 不同的热机中作于 的高温热源及 热源之间。求下列三种情况下,当热机从高温热源吸热 时,两热源的总熵变 。
的低温
(1) 可逆热机效率 。 (2) 不可逆热机效率 。 (3) 不可逆热机效率 。 解:设热机向低温热源放热 ,根据热机效率的定义
因此,上面三种过程的总熵变分别为 。 3.7 已知水的比定压热容 。今有1 kg,10 °C的水 经下列三种不同过程加热成100 °C的水,求过程的 。 (1) 系统与100 °C的热源接触。 (2) 系统先与55 °C的热源接触至热平衡,再与100 °C的热源接触。 (3) 系统先与40 °C,70 °C的热源接触至热平衡,再与100 °C 的热源接触。 解:熵为状态函数,在三种情况下系统的熵变相同
g的
系统冰和水的质量分别为
2.30 蒸汽锅炉中连续不断地注入 20 °C的水,将其加热并蒸发成 180 °C,饱和蒸汽压为 1.003 MPa 的水蒸气。求生产 1 kg 水蒸气所需要 的热量。 已知:水 在 100 °C的摩尔蒸发焓 , 水的平均摩尔定压热容 ,水蒸气 的摩 尔定压热容与温度的函数关系见附录。 解:将过程看作是恒压过程( ),系统的初态和末态分 别为 和 。插入平衡相变点 ,并将蒸汽看作理想气体,则过程的焓变为 注:压力对凝聚相焓变的影响可忽略,而理想气体的焓变与压力无关 查表知 因此,
将
代替上面各式中的
,即可求得所需各量
3.9 始态为 ,的某双原子理想气体1 mol, 经下列不同途径变化到 的末态。求各步骤及 途径的 。 (1) 恒温可逆膨胀; (2) 先恒容冷却至使压力降至100 kPa,再恒压加热至 ; (3) 先绝热可逆膨胀到使压力降至100 kPa,再恒压加热至 。 解:(1)对理想气体恒温可逆膨胀,DU = 0,因此
物理化学第四版上册课后答案天津大学第一章气体PVT关系

第一章习题解答1.1物质的体膨胀系数αV与等温压缩率κT的定义如下:试导出理想气体的、与压力、温度的关系解:对于理想气体:PV=nRT , V= nRT/P求偏导:1.2 气柜储存有121.6kPa,27℃的氯乙烯(C2H3Cl)气体300m3,若以每小时90kg的流量输往使用车间,试问储存的气体能用多少小时?解:将氯乙烯(M w=62.5g/mol)看成理想气体:PV=nRT , n= PV/RT n=121600300/8.314300.13 (mol)=14618.6molm=14618.662.5/1000(kg)=913.66 kgt=972.138/90(hr)=10.15hr1.3 0℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度?解:将甲烷(M w=16g/mol)看成理想气体:PV=nRT , PV =mRT/ M w 甲烷在标准状况下的密度为=m/V= PM w/RT=101.32516/8.314273.15(kg/m3)=0.714 kg/m31.4 一抽成真空的球形容器,质量为25.0000g。
充以4℃水之后,总质量为125.0000g。
若改充以25℃,13.33kPa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
水的密度按1 g.cm-3计算。
解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M wM w= mRT/ PV=(25.0163-25.0000)8.314300.15/(13330100 10-6)M w =30.51(g/mol)1.5 两个容器均为V的玻璃球之间用细管连接,泡内密封着标准状况下的空气。
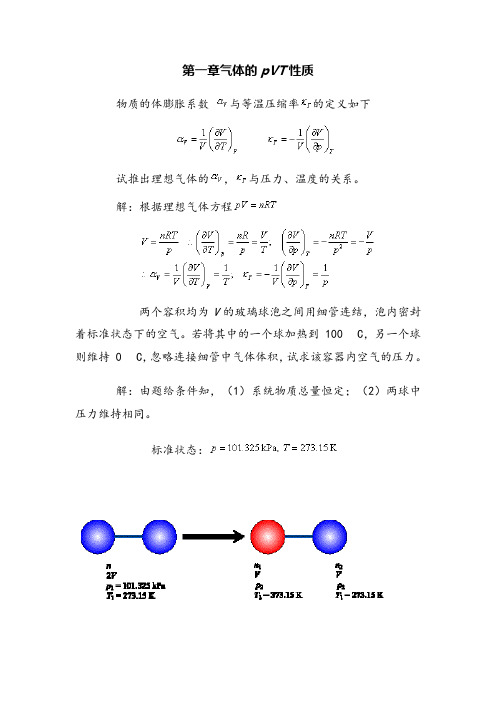
若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接细管中的气体体积,试求该容器内空气的压力。
解:因加热前后气体的摩尔数不变:加热前:n=2 P1V/RT1加热后:n=P1V/RT1PV/RT2列方程:2 P1V/RT1=P1V/RT1PV/RT2P=2 T2P1/( T1T2)=2373.15100.325/(373.15 273.15)kPa=115.47kPa1.6 0℃时氯甲烷(CH3Cl)气体的密度ρ随压力的变化如下。
物理化学第四版课后答案
第一章气体的pVT性质物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到 100 C,另一个球则维持 0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义(3)根据分体积的定义对于分压室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
今有0 C, kPa的N2气体,分别用理想气体状态方程及van der Waals方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
大学所有课程课后答案

我为大家收集了大学所有课程的课后答案,这里只列出了一部分,要想找到更多的答案,请到查找。
资料打开方法:按住 Ctrl键,在你需要的资料上用鼠标左键单击资料搜索方法:Ctrl+F 输入关键词查找你要的资料【数学】∙01-08数值分析清华大学出版社第四版课后答案∙01-08微分几何第三版梅向明黄敬之主编课后答案∙01-07高等代数与解析几何陈志杰主编第二版课后答案∙01-07高等代数第三版北京大学数学系主编高等教育出版社出版课后答案∙01-07数学分析陈纪修主编第二版课后答案∙01-07数学分析华东师大第三版课后答案∙12-27高等数学同济大学出版社第五版课后答案∙12-08积分变换(第四版)东南大学数学系张元林编高等教育出版社课后答案∙11-30微积分复旦大学出版社曹定华主编课后答案∙11-21人大-吴赣昌-高等数学/微积分(经管类)课后答案∙11-09概率统计简明教程同济版课后答案∙11-09复变函数钟玉泉课后答案∙11-09微积分范培华章学诚刘西垣中国商业出版社课后答案∙11-09线性代数同济大学第四版课后答案∙11-08概率论与数理统计浙大版盛骤谢式千课后答案∙11-08复变函数西安交通大学第四版高等教育出版社课后答案∙11-07离散数学教程肖新攀编著课后习题答案∙11-07离散数学(第三版)清华大学出版社(耿素云,屈婉玲,张立昂)课后习题答案∙11-04高等数学同济大学出版社第六版课后答案∙10-27高等数学北大版课后答案∙【通信/电子/电气/自动化】∙01-08信号与线性系统分析吴大正第4版课后答案∙01-08信号与系统刘泉主编课后答案∙01-08信号与系统奥本海姆英文版课后答案∙01-08数字信号处理吴镇扬高等教育出版社课后答案∙01-08通信原理樊昌信第六版国防大学出版社课后答案∙01-08通信原理北京邮电大学课后答案∙12-10数字逻辑第四版(毛法尧著) 高等教育出版社∙12-10数字逻辑第二版(毛法尧著) 高等教育出版社课后答案∙12-08电路第五版邱关源罗先觉高等教育出版社课后答案∙12-03数字信号处理教程(程佩青第二版) 清华大学出版社课后答案∙12-02数字信号处理教程程佩青(第三版)清华大学出版社课后答案∙11-09模拟电子技术基础童诗白第三版习题答案∙11-09数字电子技术基础阎石第五版课后答案∙11-06信号与系统郑君里主编第二版课后答案∙11-06信号与系统哈工大课后答案∙10-31模拟电子技术基础(第四版童诗白、华成英主编)习题答案∙10-29模拟电路康华光【计算机/网络/信息】∙01-08数据结构(C语言版) 李春葆主编课后答案∙12-05计算机网络教程第五版谢希仁电子工业出版社课后答案∙11-09c程序设计谭浩强主编清华大学出版社习题答案及上机指导∙10-26C语言程序设计教程习题参考答案∙10-26MATLAB程序设计与应用(第二版)刘卫国主编实验答案【经济/金融/营销/管理/电子商务】∙01-06现代西方经济学(宏观)尹伯平主编课后答案∙01-06现代西方经济学(微观经济学) 宋承先主编第3版笔记和课后习题详解∙01-06微观经济学:现代观点范里安主编第5版课后答案∙01-05微观经济学平狄克主编第4和5版笔记和课后习题详解∙01-05宏观经济学曼昆主编第五版课后答案∙01-05宏观经济学多恩布什主编课后习题答案∙01-05企业会计学赵惠芳主编课后答案∙12-05市场调研与预测习题与实例陈启杰上海财经大学出版社课后答案∙11-28西方经济学高鸿业第四版(微观宏观)课后答案∙11-10中级财务会计刘兵初宜红山东人民出版社课后答案∙11-09经济法概论课后答案∙11-08中级财务会计(第二版)刘永泽东北财经大学课后答案【物理/光学/声学/热学/力学】∙01-19机电传动控制华中科技大学出版社邓星钟主编课后答案∙01-05量子力学张永德主编课后答案∙01-04量子力学导论曾谨言著第二版课后答案∙01-04量子力学曾谨言著高等教育出版社第三版第一卷课后答案∙01-04量子力学教程周世勋著高等教育出版社课后答案∙01-04量子力学教程曾谨言著课后答案∙01-04电动力学郭硕鸿主编第三版课后答案∙01-04理论力学卢圣治著课后答案∙01-03理论力学周衍柏著第二版课后答案∙11-09普通物理学程守洙江之咏第五版习题分析与解答∙11-09物理学马文蔚(第五版) 习题分析与解答∙11-09大学基础物理学.2版.清华.张三慧习题答案∙11-06大学物理学赵近芳主编第二版课后答案【土建/机械/车辆/制造/材料】∙01-08机械设计基础(第五版) 高等教育出版社课后答案∙01-07材料力学单辉祖主编课后答案∙01-06材料力学刘鸿文主编哈工大第四版课后答案∙11-11机械原理第六版课后答案【化学/环境/生物/医学/制药】∙01-03高分子化学潘祖仁著第四版课后答案∙01-03物理化学辅导与习题详解第五版傅献彩著∙01-02物理化学南开大学第五版课后答案∙01-02物理化学周亚平天津大学第四版课后答案∙01-02分析化学武汉大学第四版思考题答案∙01-02分析化学武汉大学第四版课后答案∙01-02基础有机化学邢其毅著课后答案∙01-01有机化学莫里森著课后答案∙12-31有机化学(第四版)高鸿宾著课后答案∙12-31有机化学(汪小兰著) 课后答案∙12-31无机化学第三版武汉大学吉林大学编高等教育出版社课后答案∙12-31中级无机化学(朱文祥著) 高等教育出版社课后答案∙12-31无机化学第三版(宋天佑著) 高等教育出版社课后答案∙12-30生物化学解题指导与测验张楚富高等教育出版社课后答案∙12-30生物化学简明教程第四版(张丽萍著) 高等教育出版社课后答案∙12-30生物化学原理(张洪渊著) 科学出版社课后答案∙12-30生物化学第三版(沈同王镜岩著) 高等教育出版社课后答案∙10-31有机化学第三版(胡宏纹著) 高等教育出版社课后答案∙10-29有机化学第四版答案曾昭琼主编高等教育出版社【法学/哲学/心理学/政治学】∙12-29实验心理学杨治良版练习题及答案07年心理学考研∙12-29《心理学》考试题库及答案程素萍浙江大学出版社∙12-29教育心理学第三版(皮连生著) 上海教育出版社课后答案∙12-04毛邓三(2007 华中科技大学版)(毛邓三编写组著) 高等教育出版社课后答案∙11-07毛邓三课后简答题答案∙10-29逻辑学参考答案∙10-26思想道德修养与法律基础罗国杰主编高教版课后答案∙10-26毛泽东思想和中国特色社会主义理论体系概论(吴树青等著) 高等教育出版社课后答案∙10-25马克思主义基本原理概论左伟清华南理工大学出版社课后答案∙10-25毛邓三思考题课后答案【英语/文学/史学/外语/教育】∙01-30step_by_step 2000 第四册听力答案课后答案∙01-30step_by_step 2000 第三册听力答案课后答案∙01-30step_by_step 2000 第二册听力答案课后答案∙01-30step_by_step 2000 第一册听力答案课后答案∙01-09大学体验英语综合教程第四册课后答案及课文翻译∙01-09大学体验英语综合教程第三册课后答案及课文翻译∙01-09大学体验英语综合教程第二册课后答案及课文翻译∙01-09大学体验英语综合教程第一册课后答案及课文翻译∙01-09新视野大学英语第五册课后答案∙01-09新视野大学英语第四册课后答案及课文翻译∙01-09新视野大学英语第三册课后答案及课文翻译∙01-09新视野大学英语第二册课后答案及课文翻译∙01-09新视野大学英语第一册课后答案及课文翻译∙01-05文学理论童庆炳主编修订二版课后答案∙01-05语言学教程胡壮麟主编课后答案[适合背诵]∙11-08中国近代史纲要沙健孙高等教育出版社课后答案∙11-07全新版大学英语综合教程第四册课后答案及课文翻译∙11-07全新版大学英语综合教程第三册课后答案及课文翻译∙11-06全新版大学英语综合教程第二册课后答案及课文翻译∙11-06全新版大学英语综合教程第一册课后答案及课文翻译∙11-06新世纪大学英语综合教程3 课后答案∙11-06新世纪大学英语综合教程2 课后答案∙11-06新世纪大学英语综合教程1 课后答案∙10-25新编大学英语(第一册)习题答案第二版∙10-25新编大学英语(第二册)习题答案∙10-25新编大学英语(第三册)习题答案10-25新编大学英语(第四册)课文翻译及课后习题答案。
物理化学第四版课后答案

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
物理化学第四版课后答案

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 ︒C,另一个球则维持0 ︒C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 ︒C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算气(附录七)用van der Waals计算,查表得知,对于N2,用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 ︒C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 ︒C,使部分水蒸气凝结为水。
物理化学第四版课后习题答案

物理化学第四版课后习题答案【篇一:物理化学第四版上册课后答案天津大学第三章】>3.1卡诺热机在(1)热机效率;的高温热源和的低温热源间工作。
求(2)当向环境作功源放出的热。
时,系统从高温热源吸收的热及向低温热解:卡诺热机的效率为根据定义3.5高温热源温度,低温热源。
今有120 kj的热直接从高温热源传给低温热源,龟此过程的解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6 不同的热机中作于的高温热源及的低温热源之时,两热源的总熵变间。
求下列三种情况下,当热机从高温热源吸热。
(1)可逆热机效率(2)不可逆热机效率(3)不可逆热机效率。
解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为。
3.7 已知水的比定压热容下列三种不同过程加热成100 ?c的水,求过程的(1)系统与100 ?c的热源接触。
今有1 kg,10 ?c的水经。
(2)系统先与55 ?c的热源接触至热平衡,再与100 ?c的热源接触。
(3)系统先与40 ?c,70 ?c的热源接触至热平衡,再与100 ?c的热源接触。
解:熵为状态函数,在三种情况下系统的熵变相同在过程中系统所得到的热为热源所放出的热,因此3.8 已知氮(n2, g)的摩尔定压热容与温度的函数关系为将始态为300 k,100 kpa下1 mol的n2(g)置于1000 k的热源中,求下列过程(1)经恒压过程;(2)经恒容过程达到平衡态时的解:在恒压的情况下。
在恒容情况下,将氮(n2, g)看作理想气体将代替上面各式中的,即可求得所需各量3.9始态为同途径变化到,,的某双原子理想气体1 mol,经下列不的末态。
求各步骤及途径的。
(1)恒温可逆膨胀;(2)先恒容冷却至使压力降至100 kpa,再恒压加热至;(3)先绝热可逆膨胀到使压力降至100 kpa,再恒压加热至。
解:(1)对理想气体恒温可逆膨胀,?u = 0,因此(2)先计算恒容冷却至使压力降至100 kpa,系统的温度t:(3)同理,先绝热可逆膨胀到使压力降至100 kpa时系统的温度t:根据理想气体绝热过程状态方程,各热力学量计算如下【篇二:物理化学第四章课后答案傅献彩第五版】lass=txt>第七章电化学7.1 用铂电极电解能析出多少质量的解:电极反应为溶液。
《物理化学》习题答案(天大第四版)

因此,由标准摩尔生成焓
由标准摩尔燃烧焓
2.37 已知25 °C甲酸甲脂(HCOOCH3, l)的标准摩尔燃烧焓 为 ,甲酸(HCOOH, l)、甲醇(CH3OH, l)、水 (H2O, l)及二氧化碳(CO2, g)的标准摩尔生成焓 分别 为 、 、 及 应用这些数据求25 °C时下列反应的标准摩尔反应焓。 解:显然要求出甲酸甲脂(HCOOCH3, l)的标准摩尔生成焓
第二章 热力学第一定律
2.5 始态为25°C,200kPa的5mol某理想气体,经途径a,b两不同 途径到达相同的末态。途经a先经绝热膨胀到 -28.47°C,100 kPa,步骤的功Wa=-5.57KJ,再恒容加热到压力200 kPa的末态,步 骤的热Qa=25.42KJ。途径b为恒压加热过程。求途径b的Wb及Qb。 解:先确定系统的始、末态
由于P1V1=P3V3,则T3=T1,对有理想气体∆H和∆U只是温度的函数 ∆H=∆U=0 该途径只涉及恒容和恒压过程,因此计算功是方便的
根据热力学第一定律: Q= ∆U-W=0-5.00=-5.00KJ
2.13 已知20°C液态乙醇(C2H5OH,l)的体膨胀系数 等温压缩率 ,密度 ,摩尔定压热 容 。求20 °C,液态乙醇的 。 解:由热力学第二定律可以证明,定压摩尔热容和定容摩尔热容 有以下关系
由于加热缓慢,B可看作经历了一个绝热可逆过程,因此
功用热力学第一定律求解
气体A的末态温度可用理想气体状态方程直接求解,
将A与B的看作整体,W = 0,因此
2.25 在带活塞的绝热容器中有4.25 mol的某固态物质A及5 mol某单原 子理想气体B,物质A的 。始态温度 , 压力 。今以气体B为系统,求经可逆膨胀到 时, 系统的 及过程 的。
物理化学(天津大学第四版)课后答案 第三章 热力学第二定律

第三章热力学第二定律3.1卡诺热机在的高温热源和的低温热源间工作。
求(1)热机效率;(2)当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热。
解:卡诺热机的效率为根据定义3.5高温热源温度,低温热源。
今有120kJ 的热直接从高温热源传给低温热源,龟此过程的。
解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6不同的热机中作于的高温热源及的低温热源之间。
求下列三种情况下,当热机从高温热源吸热时,两热源的总熵变。
(1)可逆热机效率。
w w w .k h d a w .c o m 课后答案网(2)不可逆热机效率。
(3)不可逆热机效率。
解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为。
3.7已知水的比定压热容。
今有1kg ,10°C 的水经下列三种不同过程加热成100°C 的水,求过程的。
(1)系统与100°C 的热源接触。
(2)系统先与55°C 的热源接触至热平衡,再与100°C 的热源接触。
(3)系统先与40°C ,70°C 的热源接触至热平衡,再与100°C 的热源接触。
解:熵为状态函数,在三种情况下系统的熵变相同在过程中系统所得到的热为热源所放出的热,因此w w w .k h d a w .c o m 课后答案网3.8已知氮(N 2,g )的摩尔定压热容与温度的函数关系为将始态为300K ,100kPa 下1mol 的N 2(g)置于1000K 的热源中,求下列过程(1)经恒压过程;(2)经恒容过程达到平衡态时的。
解:在恒压的情况下w w w .k h d a w .c o m 课后答案网在恒容情况下,将氮(N 2,g )看作理想气体将代替上面各式中的,即可求得所需各量3.9始态为,的某双原子理想气体1mol ,经下列不同途径变化到,的末态。
求各步骤及途径的。
(1)恒温可逆膨胀;(2)先恒容冷却至使压力降至100kPa ,再恒压加热至;(3)先绝热可逆膨胀到使压力降至100kPa ,再恒压加热至。
5.天津大学物理化学第四版_习题及解答

天津大学《物理化学》第四版习题及解答目录第一章气体的pVT性质 (2)第二章热力学第一定律 (6)第三章热力学第二定律 (24)第四章多组分系统热力学 (51)第五章化学平衡 (66)第六章相平衡 (76)第七章电化学 (85)第八章量子力学基础 (107)第九章统计热力学初步 (111)第十一章化学动力学 (117)第一章气体的pVT性质1.1 物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5 两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 °C,另一个球则维持0 °C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n 次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 °C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals方程计算其摩尔体积。
物理化学 天津大学第四版 课后答案 第十一章 化学动力学

-0.1052 -0.2159 -0.3235 -0.4648 -0.6283
利用 Powell-plot method 判断该反应为一级反应,
课 后 答 案 网
拟合公式
蔗糖转化 95%需时
5. N -氯代乙酰苯胺
异构化为乙酰对氯苯胺
为一级反应。反应进程由加 KI 溶液,并用标准硫代硫酸 钠溶液滴定游离碘来测定。KI 只与 A 反应。数据如下:
略
20,21 略
22. NO 与 进行如下反应:
在一定温度下,某密闭容器中等摩尔比的 NO 与 混合物在不同初压下的半 衰期如下:
50.0 45.4 38.4 32.4 26.9
95
102
140
176
224
课 后 答 案 网
求反应的总级数。
解:在题设条件下,
,速率方程可写作
课 后 答 案 网
解:同上题,
,处理数据如下
120
180
240
330
530
600
32.95 51.75 48.8 58.05 69.0 70.35
拟合求得
。
15. 某气相反应 求。
为二级反应,在恒温恒容下的总压 p 数据如下。
0 41.330
100 34.397
200 31.197
和 B 的饱和蒸气压分别为 10 kPa 和 2 kPa,问 25 ºC 时 0.5 mol A 转化为产物 需多长时间?
解:在(1)的情况下,
,速率方程化为
在(2)的情况下,假设 A 和 B 的固体足够多,则在反应过程中气相中 A 和 B 的 浓度不变,既反应速率不变,因此
29. 反应 率常数为
在开始阶段约为 级反应。910 K 时速 ,若乙烷促使压力为(1)13.332 kPa,( 2)39.996
物理化学(天津大学第四版)课后答案 第七章 电化学

为
。在同一电导池中装入
的
溶液,测得电阻为
。利用表 7.3.2 中的数据计算
的解离度 及解离常熟 。
解:查表知
无限稀释摩尔电导率为
课 后 答 案 网
因此,
7.12 已知 25 ØC 时水的离子积
,
、和 的
分别等于
,
和
。求 25 ØC 时纯水的电导率。
解:水的无限稀释摩尔电导率为
第七章 电化学
7.1 用铂电极电解
溶液。通过的电流为 20 A,经过 15 min 后 ,问:(1)
在阴极上能析出多少质量的 ?(2) 在的 27 ØC,100 kPa 下的
?
解:电极反应为
课 后 答 案 网
电极反应的反应进度为 因此:
7.2 在电路中串联着两个电量计,一为氢电量计,另一为银电量计。当电路中
通电 1 h 后,在氢电量计中收集到 19 ØC、99.19 kPa 的
;在银电
量计中沉积
。用两个电量计的数据计算电路中通过的电流为多少。
解:两个电量计的阴极反应分别为
电量计中电极反应的反应进度为
对银电量计
对氢电量计
课 后 答 案 网
7.3 用银电极电解
溶液。通电一定时间后,测知在阴极上析出
(2)
7.25 写出下列各电池的电池反应,应用表 7.7.1 的数据计算 25 ØC 时各电池 的电动势及各电池反应的摩尔 Gibbs 函数变,并指明各电池反应能否自发进行。
解:(1)
课 后 答 案 网
(2)
,反应可自发进行。
,反应可自发进行。
(2)设平衡时 Fe2+的浓度为 x,则
因此,
物理化学_周亚平_天津大学第四版_课后答案

气体混合达到平衡态。求末态的温度 T 及过程的
。
解:过程图示如下
合,则
假定将绝热隔板换为导热隔板,达热平衡后,再移去隔板使其混
由于外压恒定,求功是方便的
由于汽缸为绝热,因此
2.20 在一带活塞的绝热容器中有一固定的绝热隔板。隔板靠活塞一侧为 2 mol,
0 °C 的单原子理想气体 A,压力与恒定的环境压力相等;隔板的另一侧为 6 mol, 100 °C 的双原子理想气体 B,其体积恒定。今将绝热隔板的绝热层去掉使之变成
解:该过程图示如下
设系统为理想气体混合物,则
1.17 一密闭刚性容器中充满了空气,并有少量的水。但容器于 300 K 条件下大 平衡时,容器内压力为 101.325 kPa。若把该容器移至 373.15 K 的沸水中,试 求容器中到达新的平衡时应有的压力。设容器中始终有水存在,且可忽略水的任 何体积变化。300 K 时水的饱和蒸气压为 3.567 kPa。
假设气体可看作理想气体,
,则
2.16 水煤气发生炉出口的水煤气的温度是 1100 °C,其中 CO(g)和 H2(g)的摩尔
分数均为 0.5。若每小时有 300 kg 的水煤气由 1100 °C 冷却到 100 °C,并用所
收回的热来加热水,是水温由 25 °C 升高到 75 °C。求每小时生产热水的质量。
冰的摩尔定压热容分别为
和
焓。
。求在常压及-10 °C 下过冷水结冰的摩尔凝固
解:过程图示如下
平衡相变点
,因此
2.33 25 °C 下,密闭恒容的容器中有 10 g 固体奈 C10H8(s)在过量的 O2(g)中完全 燃烧成 CO2(g)和 H2O(l)。过程放热 401.727 kJ。求
物理化学第四版课后答案

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
物理化学第四版课后答案

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
收回的热来加热水,是水温由 25 °C 升高到 75 °C。求每小时生产热水的质量。
CO(g)和 H2(g)的摩尔定压热容 与温度的函数关系查本书附录,水
的比定压热容 。
解:300 kg 的水煤气中 CO(g)和 H2(g)的物质量分别为
解:用理想气体状态方程计算
用 van der Waals 计算,查表得知,对于 N2 气(附录七)
,用 MatLab fzero 函数求得该方程的解为
也可以用直接迭代法, ,取初值
,迭代十次结果
1.16 25 °C 时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同
温度下水的饱和蒸气压)总压力为 138.7 kPa,于恒定总压下冷却到 10 °C,使
对于分压
1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度
的纯氮进行置换,步骤如下:向釜内通氮气直到 4 倍于空气的压力,尔后将釜内
混合气体排出直至恢复常压。重复三次。求釜内最后排气至恢复常压时其中气体
含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压 p,混合气体的摩尔分数不变。
100 kPa。活塞外的压力维持在 100 kPa 不变。今将容器内的隔板撤去,使两种
气体混合达到平衡态。求末态的温度 T及过程的 。
解:过程图示如下
假定将绝热隔板换为导热隔板,达热平衡后,再移去隔板使其混
合,则
由于外压恒定,求功是方便的
由于汽缸为绝热,因此
2.20 在一带活塞的绝热容器中有一固定的绝热隔板。隔板靠活塞一侧为 2 mol,
解:将过程看作是恒压过程( ),系统的初态和末态分
通电缓慢加热左侧气体 A,使推动活塞压缩右侧气体 B 到最终压力增至 200 kPa。
求:
(1)气体 B 的末态温度 。
(2)气体 B 得到的功 。
(3)气体 A 的末态温度 。
(4)气体 A 从电热丝得到的热 。
解:过程图示如下
由于加热缓慢,B 可看作经历了一个绝热可逆过程,因此
因此
由于理想气体的 U和 H只是温度的函数,
整个过程由于第二步为绝热,计算热是方便的。而第一步为恒温
可逆
2.24 求证在理想气体 p- V 图上任一点处,绝热可逆线的斜率的绝对值大于恒温
可逆线的绝对值。
证明:根据理想气体绝热方程,
得 ,因此
。因此绝热线在 处的斜
率为
气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:
因此,
1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均
可视为理想气体。
(1) 保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试
平衡时,容器内压力为 101.325 kPa。若把该容器移至 373.15 K 的沸水中,试
求容器中到达新的平衡时应有的压力。设容器中始终有水存在,且可忽略水的任
何体积变化。300 K 时水的饱和蒸气压为 3.567 kPa。
解:将气相看作理想气体,在 300 K 时空气的分压为
由于体积不变(忽略水的任何体积变化),373.15 K 时空气的分压为
及过程的 。
解:过程图示如下
将 A 和 B 共同看作系统,则该过程为绝热可逆过程。作以下假设
(1)固体 B 的体积不随温度变化;(2)对固体 B ,则
从而
对于气体 B
2.26 已知水(H2O, l)在 100 °C 的饱和蒸气压 ,在此温度、压
力下水的摩尔蒸发焓 。求在在 100 °C,101.325 kPa 下
同样,由于汽缸绝热,根据热力学第一定律
2.23 5 mol 双原子气体从始态 300 K,200 kPa,先恒温可逆膨胀到压力为 50
kPa,在绝热可逆压缩到末态压力 200 kPa。求末态温度 T及整个过程的
及 。
解:过程图示如下
要确定 ,只需对第二步应用绝热状态方程
,对双原子气体
使压力体积增大到 150 dm3,再恒压冷却使体积缩小至 25 dm3。求整个过程的
。
解:过程图示如下
由于 ,则 ,对有理想气体 和 只是温度
的函数
该途径只涉及恒容和恒压过程,因此计算功是方便的
根据热力学第一定律
2.13 已知 20 °C 液态乙醇(C2 H5OH,l)的体膨胀系数 ,等温压
由于容器中始终有水存在,在 373.15 K 时,水的饱和蒸气压为 101.325
kPa,系统中水蒸气的分压为 101.325 kPa,所以系统的总压
第二章 热力学第一定律
2.5 始态为 25 °C,200 kPa 的 5 mol 某理想气体,经途径 a,b 两不同途径到达
相同的末态。途经 a 先经绝热膨胀到 -28.47 °C,100 kPa,步骤的功
使 1 kg 水蒸气全部凝结成液体水时的 。设水蒸气适用理想气体状
态方程式。
解:该过程为可逆相变
2.28 已知 100 kPa 下冰的熔点为 0 °C,此时冰的比熔化焓热
J·g-1. 水的平均定压热容 。求在绝热容器内
向 1 kg 50 °C 的水中投入 0.1 kg 0 °C 的冰后,系统末态的温度。计算时
缩率 ,密度 ,摩尔定压热容
。求 20 °C,液态乙醇的 。
解:由热力学第二定律可以证明,定压摩尔热容和定容摩尔热容有以下
关系
2.14 容积为 27 m3 的绝热容器中有一小加热器件,器壁上有一小孔与 100 kPa
的大气相通,以维持容器内空气的压力恒定。今利用加热器件使器内的空气由 0
恒温线在 处的斜率为
。由于 ,因此绝热
可逆线的斜率的绝对值大于恒温可逆线的绝对值。
2.25 一水平放置的绝热恒容的圆筒中装有无摩擦的绝热理想活塞,活塞左、右
两侧分别为 50 dm3 的单原子理想气体 A 和 50 dm3 的双原子理想气体 B。两气体
均为 0 °C,100 kPa。A 气体内部有一体积和热容均可忽略的电热丝。现在经过
300 kg 的水煤气由 1100 °C 冷却到 100 °C 所放热量
设生产热水的质量为 m,则
2.18 单原子理想气体 A 于双原子理想气体 B 的混合物共 5 mol,摩尔分数
,始态温度 ,压力 。今该混合气体绝热反抗恒外
压 膨胀到平衡态。求末态温度 及过程的 。
解:过程图示如下
功用热力学第一定律求解
气体 A 的末态温度可用理想气体状态方程直接求解,
将 A 与 B 的看作整体, W = 0,因此
2.25 在带活塞的绝热容器中有 4.25 mol 的某固态物质 A 及 5 mol 某单原子理想
气体 B,物质 A 的 。始态温度 ,压力
。今以气体 B 为系统,求经可逆膨胀到 时,系统的
求两种气体混合后的压力。
(2) 隔板抽取前后,H2 及 N2 的摩尔体积是否相同?
(3) 隔板抽取后,混合气体中 H2 及 N2 的分压立之比以及它们的分体积各为若
干?
解:(1)等温混合后
即在上述条件下混合,系统的压力认为 。
(2)混合气体中某组分的摩尔体积怎样定义?
(3)根据分体积的定义
2.30 蒸汽锅炉中连续不断地注入 20 °C 的水,将其加热并蒸发成 180 °C,
饱和蒸汽压为 1.003 MPa 的水蒸气。求生产 1 kg 水蒸气所需要的热量。
已知:水 在 100 °C 的摩尔蒸发焓 ,
水的平均摩尔定压热容 ,水蒸气 的摩尔定压
热容与温度的函数关系见附录。
;再恒容加热到压力 200 kPa 的末态,步骤的热 。途
径 b 为恒压加热过程。求途径 b 的 及 。
解:先确定系统的始、末态
对于途径 b,其功为
根据热力学第一定律
2.6 4 mol 的某理想气体,温度升高 20 °C,求 的值。
解:根据焓的定义
2.10 2 mol 某理想气体, 。由始态 100 kPa,50 dm3,先恒容加热
0 °C 的单原子理想气体 A,压力与恒定的环境压力相等;隔板的另一侧为 6 mol,
100 °C 的双原子理想气体 B,其体积恒定。今将绝热隔板的绝热层去掉使之变成
导热板,求系统达平衡时的 T及过程的 。
解:过程图示如下
显然,在过程中 A 为恒压,而 B 为恒容,因此
同上题,先求功
分析:因为是绝热过程,过程热力学能的变化等于系统与环境间
以功的形势所交换的能量。因此,
单原子分子 ,双原子分子
由于对理想气体 U和 H均只是温度的函数,所以
2.19 在一带活塞的绝热容器中有一绝热隔板,隔板的两侧分别为 2 mol,0 °C
的单原子理想气体 A 及 5 mol,100 °C 的双原子理想气体 B,两气体的压力均为
不考虑容器的热容。
解:经粗略估算可知,系统的末态温度 T 应该高于 0 °C, 因此
2.29 已知 100 kPa 下冰的熔点为 0 °C,此时冰的比熔化焓热
J·g-1. 水和冰的平均定压热容 分别为 及
。今在绝热容器内向 1 kg 50 °C 的水中投入 0.8 kg 温度 -20
设第一次充氮气前,系统中氧的摩尔分数为 ,充氮气后,系统中氧的
